第 12 章 生命有机化学
有机化学第12章 羧酸

四、α-H的卤代反应
羧酸的α-H可在光、碘、红磷、硫等催化剂存在下被溴 或氯取代生成卤代酸。
RCH2COOH
Br2 PΔ
RCHCOOH Br2
Br
PΔ
Br R-C-COOH
Br
控制条件,反应可停留在一取代阶段。
CH3CH2CH2CH2COOH + Br2
P Br2 70 ℃
实质上并非两者的简单组合
醛酮中 C O 键长 0.122nm
醇中
C OH 键长 0.143nm
O HC
OH
(甲酸)
0.1245nm 0.1312nm 电子衍射实验证明
O RC
O-H
P-π 共轭体系
RC sp2 杂化
O OH
O RC
OH O HC OH
O RC
O
O 0.127nm HC
O 0.127nm
O RC
O
O HC
O
羧酸的化学性质
H
脱羧反应
O
RCC
羟基断裂呈酸性
H
OH
α H 的反应
羟基被取代的反应
一、酸性
羧酸具有弱酸性,在水溶液中存在着如下平衡:
RCOOH
RCOO + H+
乙酸的离解常数Ka为1.75×10-5 , pKa =4.76 甲酸的Ka=2.1×10-4 , pKa =3.75 其他一元酸的Ka在1.1~1.8×10-5之间, pKa在4.7~5之间。 可见羧酸的酸性小于无机酸而大于碳酸(H2CO3 pKa1=6.73)。
oocoh形式上看羧基是由一个和一个组成coh实质上并非两者的简单组合醛酮中coo01245nm键长0122nmhc01312nmoh醇中coh甲酸电子衍射实验证明键长0143nmoorcohrc2ohp共轭体系sp杂化ooorcrcrcohoooo0127nmohchchcohoo0127nm羧酸的化学性质h脱羧反应orcc羟基断裂呈酸性ohhh的反应羟基被取代的反应一酸性?羧酸具有弱酸性在水溶液中存在着如下平衡
华中科技大学有机化学第十二章 羧酸及其衍生物

Kochi反应便宜,对一级,二级,三级卤化烷的产率均好。
10.3 羧酸的合成反应
1. 烯或炔烃的氧化。
2. 醇或醛的氧化。 3. 烷基苯的侧链氧化。 4. 甲基酮的氧化(卤仿反应)。 5. 腈化合物的水解。 6. 格氏试剂与二氧化碳反应。 7. 苯酚钠盐与二氧化碳反应。
9.4 羧酸衍生物的结构与命名 1.羧酸衍生物的结构 羧酸衍生物的结构通式为RCOL (L= OR , NH2, NHR , NR2, X, OCOR等).这些化合物都具有酰基(RCO),因此又称酰基化合物.它们的 结构与羧酸相似,都具有羰基的键。并与L的一对未共用电子共扼.其电 子共轭与共振式如下:
丁二酸和戊二酸在单独加热或与乙酐共热时脱水生成环酐己二酸和庚二酸受热时同时发生脱水和脱羧生成较为稳定的失羧卤化将羧酸与ago反应得羧酸的银盐然后加等摩尔的溴或碘在无水四氯化碳中回流即可失羧得到溴代或碘代烷hunsdiecker反应
第十二章 羧酸及其衍生物
分子中含有羧基(-COOH,carboxyI group)的化合物叫做羧酸 (carboxyIic acid)。羧基是羧酸的官能团,除甲酸(HCOOH)外,羧酸 可看作是烃分子中的氢原子被羧基取代的产物。
生成酸酐的反应机理是一分子羧酸对另一分子羧酸的亲核加成-消去反应
3.生成酯 羧酸和醇或在强酸(硫酸,对甲苯磺酸等)催化下分子间脱水生成酯, 这个反应叫做酯化反应(esterification)。 酯化反应是可逆反应。为了提高产率,一般采用的方法是增加某 一种反应物的用量,或不断从体系中移去某一种产物。 实验证明,羧酸酯化时生成的水分子中的氧原子一般是来自羧酸 的羟基。例如,用同位素标记的醇与羧酸反应,其结果是同位素标记 的氧原子留在酯分子中。
六、二元羧酸受热的反应 二元羧酸受热易脱水、脱羧,生成产物的结构取决于两个 羧基的相对位置。无水草酸在加热时脱羧生成甲酸。
有机化学第12章 杂环化合物

生物碱
存在于植物体内的一类碱性含氮有机化合物称为生物碱。
HO O
CH3 N H O-C-CH 952年确定结构。)
H O-C H
C H3O
颠茄碱(阿托品)
CH=C H2
N N CH3
N 金鸡纳碱(奎宁)
烟碱(尼古丁)
有芳香性
有芳香性
12.3 五元杂环化合物
12.3.1 呋喃
存在于松木焦油中,为无色液体,难溶于水,易溶于有机溶剂。其蒸汽遇 有被盐酸浸过的松木时,即呈绿色(叫松木反应,鉴别呋喃的存在)。
工业上用糠醛(-呋喃甲醛)制备:
(1)呋喃的制备
• 实验室采用糠酸加热脱羧制得:
(2)化学性质
呋喃具有芳香性,较苯活泼,容易发生取代反应;还有一定程度的不饱和 化合物的性质(发生加成反应)。
芳香性强弱的次序
苯 > 噻吩 呋喃 112 离域能:152
取代反应活性的次序
>
吡咯
>
88
62 KJ/mol
位电子 云密度 -0.10
• 吡咯 > 呋喃 > 噻吩 > 苯 -0.03 -0.06 0 (不一致)
(2)六元杂环化合物——吡啶
氮原子与碳原子处在同一平面。 吡啶的结构与苯相似,符合休克尔规则,具有芳香性。
第12章 杂环化合物
一般把除碳以外的成环原子叫杂原子,常见的杂原子有氧、硫和氮:
• 环系中可含一个、两个或多个相同或不同的杂原子。
•环可以有三元环、四元环、五元环、六元环或更大,可以 是稠合的环。
• 杂环化合物种类繁多,约占全部已知有机化合物的 三分之一。
• 已经学过的杂环化合物:
• 本章介绍的是具有不同芳香性的杂环化合物(简称芳杂 化合物)。
2022年高考化学大一轮复习练习:第12章 有机化学基础(选修5)-第3讲 Word版含答案

课时规范训练[单独成册]1.下列关于有机物的叙述正确的是()A.乙醇可以被氧化为乙酸,二者均能发生酯化反应B.人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外C.我国居民传统膳食以糖类为主,淀粉、脂肪都是糖类物质D.由CH2===CH—COOCH3合成的聚合物为CH2CHCOOCH 3答案:A2.某有机物的结构如图,该有机物不行能具有的性质是()①可以燃烧氧化②能使酸性KMnO4溶液褪色③能跟NaOH溶液反应④能发生一个分子内或n个分子间酯化反应⑤能发生加聚反应⑥它有手性碳原子⑦能被催化氧化成醛⑧该有机物的碳原子存在sp2、sp3杂化A.①④B.④⑥C.⑤⑦D.只有⑥答案:D3.某同学用2 mL 1 mol/L的CuSO4溶液与4 mL 0.5 mol/L的NaOH溶液混合,然后加入0.5 mL 4%的HCHO溶液,加热至沸腾,未见红色沉淀,试验失败的主要缘由()A.甲醛量太少B.硫酸铜量少C.NaOH量少D.加热时间短解析:选C。
醛基和新制的氢氧化铜悬浊液反应必需在碱性条件下才能进行的,所以依据题意可知,氢氧化钠不足,试验不能成功,答案选C。
4.人们已进入网络时代。
常观看显示屏,会使人感到眼睛疲惫,甚至会对眼睛产生肯定的损害。
人眼中的视色素里含有视黄醛(见图a),作为辅基的蛋白质,而与视黄醛相像结构的维生素A(见图b)常作为保健药物。
从结构上看,维生素A与视黄醛的关系是()A.同分异构体B.同系物C.维生素A是视黄醛的还原产物D.维生素A是视黄醛的氧化产物解析:选C。
从结构上看,a催化加氢得到b,即维生素A是视黄醛的还原产物。
5.有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在肯定条件下可转化为B(如图所示),下列说法正确的是()A.分子A中全部碳原子均位于同一平面B .用FeCl 3溶液可检验物质B 中是否混有AC .物质B 既能发生银镜反应,又能发生水解反应D .1 mol B 最多可与5 mol H 2发生加成反应解析:选B 。
生物化学第12章知识点总结

1.能量的生成:当有机物被氧化成CO2和H2O时,释放的能量转化成ATP。
2.生物氧化的特点(异同点):①酶的催化②氧化进行过程中,必然伴随生物还原反应的发生。
③水是许多生物氧化反应的氧供体。
通过加水脱氢作用直接参予了氧化反应。
④氧化过程中脱下来的氢质子和电子,通常由各种载体,如NADH等传递到氧并生成水。
⑤生物氧化是一个分步进行的过程,能量通过逐步氧化释放,不会引起体温的突然升高,而且可使放出的能量得到最有效的利用。
⑥生物氧化释放的能量一般都贮存于一些特殊的化合物中,主要是ATP.【生物氧化和有机物在体外氧化(燃烧)的实质相同,都是脱氢、失电子或与氧结合,消耗氧气,都生成CO2和H2O,所释放的能量也相同。
但二者进行的方式和历程却不同:生物氧化体外燃烧细胞内温和条件(常温、常压、中性pH、水溶液)高温或高压、干燥条件一系列酶促反应,逐步氧化放能,能量利用率高无机催化剂能量爆发释放释放的能量转化成ATP被利用转换为光和热,散失3.高能化合物的概念:在标准条件下发生水解时,可释放出大量自由能的化合物,称为高能化合物。
4.高能化合物的类型:磷氧键型(乙酰磷酸);氮氧键型(磷酸肌酸);甲硫键型(S-腺苷甲硫氨酸);硫酯键型(酰基辅酶A)5.ATP的特殊作用:①ATP在一切生物生命活动中都起着重要作用,在细胞的细胞核、细胞质和线粒体中都有ATP存在。
②ATP在磷酸化合物中所处的位置具有重要的意义,它在细胞的酶促磷酸基团转移中是一个“共同中间体”③ATP是生物体通用的能量货币。
④ATP是能量的携带者和转运者,但并不能量的贮存者。
起贮存能量作用的物质称为磷酸原,在脊推动物中是磷酸肌酸。
6.电子传递链的概念:在生物氧化过程中,代谢物上脱下的氢经过一系列的按一定顺序排列的氢传递体和电子传递体的传递,最后传递给分子氧并生成水,这种氢和电子的传递体系称为电子传递链。
又称呼吸链。
7.电子传递链的组成:FMN、辅酶Q、细胞色素b、c1、c、a、a3以及一些铁硫蛋白8.细胞色素c:唯一能溶于水的细胞色素;Q循环:通过辅Q的电子传递方式称为Q循环9.电子传递链的电子传递顺序(必考):NADH:NADH→复合体Ⅰ→Q→复合体Ⅲ→细胞色素→复合体Ⅳ→O2FADH2:FADH2→复合体Ⅱ→Q→复合体Ⅲ→细胞色素→复合体Ⅳ→O210.电子传递抑制剂的概念:能够阻断呼吸链中某部位电子传递的物质称为电子传递抑制剂。
有机化学:第十二章 醛和酮

分子量
58
58
58
60
沸点
-0.5
48.8
56.1
97.2
共四十八页
第三节 醛酮的化学性质(huàxuéxìngzhì)
δ δO CC
H
R (H )
酸和亲电试剂进攻富电子的氧 碱和亲核试剂进攻缺电子的碳
涉及醛的反应(氧化反应 ) α H 的反应 羟醛缩合反应
卤代反应
醛酮中的羰基由于π键的极化,使得氧原子上带部分负电荷,碳原子上带部分正电荷。
机理(jī lǐ):
共四十八页
氨的衍生物能与醛、酮起加成反应,用于鉴别羰基的存在,称为羰基 试剂。
常用试剂:2,4-二硝基苯肼
R C
R'
O + H2NNH
NO 2
NO 2
R
-H2O
C
NNH
R'
NO 2
NO 2
黄色(huángsè)结 晶
反应产物用稀酸水解(shuǐjiě),可生成原来的醛、酮。用与分离和提纯醛或酮。
羰基是醛、酮的官能团。
O
R1
R
CO
CO
R2
H
O
羰基化合物广泛存在于自然界,它们既是参与生物代谢过程的重要物质(wùzhì),如甘油
醛
(HOCH2CHOHCHO)和丙酮酸 (HOOCCOCH3)是细胞代谢作用的基本成分,
又是有机合成的重要原料和中间体。
共四十八页
第一节 醛和酮的分类(fēn lèi)和命名
共四十八页
一 、亲核加成反应(jiā chénɡ fǎn yīnɡ)
亲核加成反应是羰基(tānɡ jī)的特征反应,亲核试剂NuA与羰基C=O反应。
有机化学 第十二章 羧酸

王鹏
山东科技大学 化学与环境工程学院
12.3 羧酸的物理和波谱性质
二、1H-NMR:
-COOH: δ范围 10~14 邻近羧基的碳上的氢移向低场区, δ约2~2.6 O CH2 C O H
δ: 2~3
10~13
如p282 图13-2异丁酸的核磁图 羧酸核磁的另一特点是活性氢交换后低场区信号 减弱或消失
王鹏
12.4 羧酸的化学性质
酯化反应的亲核取代机理:
O R C OH + H
+
快
+OH
慢
OH R
快
R
快
C
OH
.. R'O H ..
C
+.. O R'
OH H O R C OR'
OH
快
+ OH OR'
H2O 快 慢
R
C
R
C
OR'
H
+
+ OH2
快
叔醇更倾向于酸碱中和机理,即酸失去H+,叔醇 失去OH-,剩余部分结合成酯
溶解性:
低级脂肪酸是极性分子,易溶于水(因为易与水成分子间 氢键)。随着碳原子数增加,水溶性逐渐降低
熔沸点:
羧酸的熔沸点比分子量相近的其他化合物高许多
王鹏
山东科技大学 化学与环境工程学院
12.3 羧酸的物理和波谱性质
一、IR:
O-H:3560~3500(单体)3000~2500(二聚) C=O:1720,C-O:1250 羧酸的红外特征是强而宽的羧基峰和羰基峰
王鹏
山东科技大学 化学与环境工程学院
12.2 羧酸的分类和命名
有机化学第五版第十二章答案

第十二章 羧酸1. 命名下列化合物或写出结构式。
H CCH 2COOHCH 3H 3C(1)ClCHCH 2COOHCH 3(2)COOHCOOH (3)(4) CH3(CH 2)4CH=CHCH 2CH=CH(CH 2)7COOH (5) 4-methylhexanoic acid (6) 2-hydroxybutanedioic acid (7) 2-chloro-4-methylbenzoic acid (8) 3,3,5-trimethyloctanoic acid1. 1. 解:解:(1)3-甲基丁酸 (2)3-对氯苯基丁酸 (3)间苯二甲酸 ( 4)9,12-十八二烯酸十八二烯酸CHCH CHCOOH COOHCl CHCH CCH CHCHOH HCOOH + PClCOOH + PClΔ碱石灰NaCO3Tollens试剂(+)银镜 NaCO3I2 + NaOH(+)△(-)KMnO 4/H (△(丁二酸 二酸己二酸(△() 正丙醇 HBr1) Mg , Et 2O2) CO ; 3) H +O CH HBrNaCNCNH 3OOH H2SO4△H HBr(CHMg Et O1) CO22) H OCl2POH COOH SOCl2COCl CH3CH2COONa THF1) CO222) H+OEtOHH+甲为CH3CH 2COOH , 乙为HCOOC 2H 5 , 丙为CH 3COOCH 3 . 7. 指出下列反应中的酸和碱. (1) 二甲醚和无水三氯化铝二甲醚和无水三氯化铝; (2) (2) 氨和三氟化硼; (3) 乙炔钠和水乙炔钠和水 7.解:按Lewis 酸碱理论:凡可接受电子对的分子、离子或基团称为酸,凡可给予电子对的分子、离子或基团成为碱。
Lewis 碱: 二甲醚二甲醚,, , 氨氨, , 乙炔钠乙炔钠乙炔钠. . Lewis 酸: 三氯化铝三氯化铝 , , , 三氟化硼三氟化硼三氟化硼 , , 水.8. (1) 按照酸性降低的次序排列下列化合物:①乙炔、氨、水; ②乙醇、乙酸、环戊二烯、乙炔(2) 按照碱性降低的次序排列下列离子:①C H3- , CH3O-, HC≡C- ; ②C H3O- , (CH3)3CO-, (CH3)2CHO-8.解:(1)酸性: ①水>乙炔>氨;②乙酸>环戊二烯>乙醇>乙炔(2)碱性:①CH3->HC≡C- >CH3O-; ②(CH3)3CO->(CH3)2CHO->依分OHCOOHCOOHC CHCH3綜上所述,马尿酸的结构为:C NHCHO。
高考化学总复习 第12章 有机化学基础 第2讲 烃和卤代烃配练习5高三5化学试题

目夺市安危阳光实验学校第2讲 烃和卤代烃【2019·备考】最新考纲:1.掌握烷烃、烯烃、炔烃和芳香烃的结构与性质。
2.掌握卤代烃的结构与性质,以及与其他有机物的相互转化。
3.了解烃类及衍生物的重要应用以及烃的衍生物合成方法。
考点一 烷烃、烯烃、炔烃的结构与性质 (频数:★☆☆ 难度:★★☆)1.烷烃、烯烃、炔烃的组成、结构特点和通式 2.脂肪烃的物理性质性质变化规律状态常温下含有1~4个碳原子的烃都是气态,随着碳原子数的增多,逐渐过渡到液态、固态沸点随着碳原子数的增多,沸点逐渐升高;同分异构体之间,支链越多,沸点越低相对密度 随着碳原子数的增多,相对密度逐渐增大,但密度均比水小 水溶性均难溶于水3.脂肪烃的化学性质 (1)烷烃的化学性质 ①取代反应如乙烷和氯气生成一氯乙烷:CH 3CH 3+Cl 2――→光照CH 3CH 2Cl +HCl 。
②分解反应:CH 4―——―→高温隔绝空气C +2H 2③燃烧反应燃烧通式为C n H 2n +2+3n +12O 2――→点燃n CO 2+(n +1)H 2O 。
(2)烯烃的化学性质①与酸性KMnO 4溶液的反应能使酸性KMnO 4溶液褪色,发生氧化反应。
②燃烧反应燃烧通式为C n H 2n +3n 2O 2――→点燃n CO 2+n H 2O 。
③加成反应CH 2==CH —CH 3+Br 2―→。
CH 2==CH —CH 3+H 2O ――→催化剂△。
CH 2==CH —CH==CH 2+2Br 2―→。
CH 2==CH —CH==CH 2+Br 2―→(1,4-加成)。
④加聚反应如n CH 2===CH —CH 3――→催化剂。
(3)炔烃的化学性质①与酸性KMnO 4溶液的反应能使酸性KMnO 4溶液褪色,发生氧化反应。
如: CH≡CH――→KMnO 4H 2SO 4CO 2(主要产物)。
②燃烧反应燃烧通式为C n H 2n -2+3n -12O 2――→点燃n CO 2+(n -1)H 2O 。
有机化学 第十二章 含氮化合物
胺的化学性质(P374)
结 构 分 析
2014-12-28
18
1、 胺的碱性和成盐反应
1) 胺的碱性
胺的水溶液和氨一样发生解离反应而呈碱性:
Kb值愈大或pKb值愈小则碱性愈强;反之愈弱。
2014-12-28 19
一些胺的pKb值
2014-12-28
20
①
脂肪胺的碱性大于芳香胺
脂肪胺 氨
芳香胺
2014-12-28
6
12. 2. 1 胺的分类、命名和结构(P370)
1 、 胺的分类:
① RNH2:伯胺; R2NH:仲胺; R3N:叔胺 ② RNH2--脂肪胺; ArNH2 --芳香胺 ③ RNH2:一元胺; H2NRNH2:二元胺;多元胺
*注意: 伯、仲、叔胺与伯、仲、叔醇的不同涵义 叔碳
Hofmann 消除的取向
2014-12-28
33
比较:卤代烷的消除取向—Saytzeff 取向 (决定于产物的稳定性)
H H3C CH2 CH ' CH X
H CH2 NaOC2H5 H3C CH2 CH CH
H CH2
主要
主要产物为双键上取代基最多的烯烃。
2014-12-28 34
Hofmann消除取向的解释 (决定于反应物的结构) 从β-氢的位阻和酸性的差别分析
1 含氮化合物的还原 2 酰胺的降解制备 3 氨或胺的烃基化
2014-12-28
50
1、 含氮化合物的还原
(1)硝基化合物的还原
还原剂:H2-Ni(orPt)、Fe(orSn)+HCl、(NH4)2S……
NO2 + 3H 2 NO2
Fe+HCl Ni 常温常压
第十二章 生物氧化

FMN → Q (Fe-S) CytC → Cytaa3 → O2 →
琥珀酸 → FAD → Q
NADH
→
Cytb
→
CytC1
→
(2)琥珀酸氧化呼吸链(FADH2氧化呼链):
→ Cytb → CytC1 → (Fe-S) CytC → Cytaa3 →
O2
43
CO
氰化物
NADH氧化呼吸链中氢和电子的传递
48
高能化合物
高能键: 水解时释放的能量> 21KJ/mol 的化学 键。用“~”符号表示。 如ATP(三磷酸腺苷)分子含2个高能键。
磷酸 腺苷
P ~ P~ P - A
30.55KJ/mol 14.2KJ/mol
49
ADP(二磷酸腺苷)分子含1个高能键。
T:3 D:2 M: 1
磷酸
腺苷
P~ P - A
琥珀酸 琥珀酸脱氢酶
COOH CH CH COOH
延胡索酸
+
2H+ + 2e-
15
OH CH3CHCOOH
乳酸
乳酸脱氢酶
NAD
+
O CH3CCOOH
丙酮酸
NADH
16
加水脱氢
酶催化醛氧化成酸的反应即属于这一类。
H 2O H R C OH OH ø O R C O H + 2H + + 2e -
45
琥珀酸氧化呼吸链中氢和电子的传递
琥珀酸、-磷酸甘油、脂酰CoA等代谢物通过 FADH2氧化呼吸链氧化。
46
47
第三节 氧化磷酸化
有机化学课后习题答案第12章
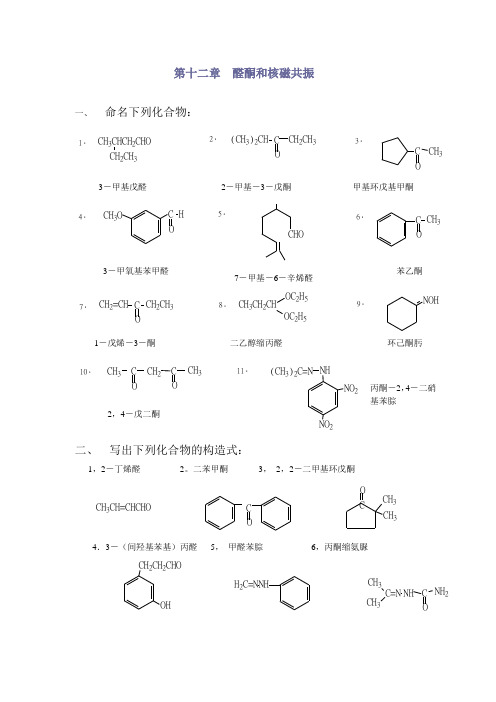
第十二章 醛酮和核磁共振一、命名下列化合物:1.CH 3CHCH 2CHO CH 2CH 32.(CH 3)2CH CCH 2CH 33.C CH 34.CH 3OC OH 5.CHO6.C OCH 3710.CH 3CH 2CH3C C11.(CH 3)2C=NNO 2NHNO 2二、 写出下列化合物的构造式:1,2-丁烯醛 2。
二苯甲酮 3, 2,2-二甲基环戊酮COCH 3CH 3CH 3CH=CHCHOC4.3-(间羟基苯基)丙醛 5, 甲醛苯腙 6,丙酮缩氨脲CH 2CH 2CHOOHH 2C=N NHCH 3CH 3C=N NH C O NH 27,苄基丙酮 8,α-溴代丙醛CH 2CH 2CH 2CH 3C CH 3CH CHOBr9,三聚甲醛 10,邻羟基苯甲醛CH 2OCH 2OCH 2OCHO OH三、 写出分子式为C 5H 10O 的醛酮的同分异构体,并命名之。
CH 3CH 2CH 2CH 2CHOCH 3CH 3CHCH 2CHOCH 3CH 2CHCHOCH 3(CH 3)CCHOCH 3CH 2CH 2CH 3CH 3CH 2CH 2CH 3CH 3CH(CH 3)2C C C酮: 2-戊酮 3-戊酮 3-甲基-2-丁酮四、 写出丙醛与下列各试剂反应所生成的主要产物:1,NaBH 4在氢氧化钠水溶液中。
2,C 6H 5MgBr 然后加H 3O + CH 3CH 2CH 2OHCH 3CH 2CHC 6H 5OH3.LiAlH 4 ,然后加水 4,NaHSO 3 5, NaHSO 3然后加NaCNCH 3CH 2CH 2OHOHCH 3CH 2CHSO 3NaCH 3CH 2CHCNOH6,稀碱 7,稀碱,然后加热 8,催化加氢 9,乙二醇,酸OHCH 3CH 2CHCHCHOCH 3CH 3CH 2CH=CCHOCH 3CH 3CH 2CH 2OHCH 3CH 2CHO O CH 2CH 210,溴在乙酸中 11,硝酸银氨溶液 12,NH 2OH 13,苯肼Br CH 3CHCHOCH 3CH 2COONH4CH 3CH 2CH=NOH CH 3CH 2CH=NNH五、 对甲基苯甲醛在下列反应中得到什么产物?六、苯乙酮在下列反应中得到什么产物?1.COCOCOCOCH3CH3CH3CH3+HNO3H2SO4COCONO2CH3O-+HCCl3+NaBH4CHCH3OH+MgBrCOMgBrCH3C6H5CH3CC6H5OHH3O+2.3.4.七、下列化合物中那些能发生碘仿反应?那些能和饱和亚硫酸氢钠水溶液加成?写出反应式。
化学高考一轮复习课件第12章第3讲醇酚

(4)在有机合成中,利用醇或卤代烃的消去反应可以在碳 链上引入双键、三键等不饱和键。
4.有机化学中的氧化反应和还原反应 (1)有机化学中,通常将有机物分子中加入氧原子或脱去 氢原子的反应称为氧化反应,而将有机物分子中加入氢原子 或脱去氧原子的反应称为还原反应。 (2)在氧化反应中,常用的氧化剂有O2、酸性KMnO4溶 液、O3、银氨溶液和新制的Cu(OH)2悬浊液等;在还原反应 中,常用的还原剂有H2、LiAlH4和NaBH4等。
例1 有下列几种醇 ①CH3CH2CH2OH
(1)其中能被催化氧化生成醛的是____(填编号,下同),其中能 被催化氧化,但不是生成醛的是________,其中不能被催化氧化的 是__________。
(2)与浓 H2SO4 共热发生消去反应 只生成一种烯烃的是_____,能生成三种烯烃的是________, 不能发生消去反应的是______________________。
(2)各自消耗的H2的最大用量是①______、②______、 ③______、④______。
答案 (1)5 mol 2 mol 6 mol 6 mol (2)5 mol 4 mol 7 mol 10 mol
考点三 有机反应类型 1.取代反应(特点:有上有下) (1)取代反应指的是有机物分子中的某些原子或原子团被 其他原子或原子团所代替的反应。 (2)烃的卤代、芳香烃的硝化或磺化、卤代烃的水解、醇 分子间的脱水反应、醇与氢卤酸的反应、酚的卤代、酯化反 应、酯的水解和醇解以及蛋白质的水解等都属于取代反应。 (3)在有机合成中,利用卤代烷的取代反应,将卤原子转 化为羟基、氨基等官能团,从而制得用途广泛的醇、胺等有机 物。
红热铜丝插入醇中有刺激性
气味(生成醛或酮)
有机化学第12章胺

12.3胺的化学性质
12.3.1胺的碱性
(1)产生碱性的原因: N上的孤对电子
(2)判别碱性的方法: pKb的值;或其共轭酸的pKa的值;
以及形成的铵正离子的稳定性
胺类碱性在强弱取决于N上电子云密度的高低和与质子结合能 力的大小以及铵正离子的稳定性。
影响碱性强弱的因素: 诱导效应:胺的氮原子上所连的烷基增多,推电子能力增强,氮 原子上电子密度升高,碱性增强。 空间效应 烷基数目的增加,占据了氮原子外围更多的空间,使 质子难于与氮原子接近。使胺的碱性降低。 共轭效应:芳香胺中氨基氮原子上的未共用电子对与苯环的电子 形成共轭体系,使氮原子上的电子部分地移向苯环,降低了氮原 子上的电子云密度,与质子的结合能力降低,碱性减弱。 溶剂效应:N上取代基多,与H2O形成氢键少,与H+结合形成铵离 子后,溶剂化稳定作用弱,碱性减弱。
12.3.6.1卤化
12.3.6.2硝化
12.3.6.3磺化
12.4季铵盐和氢氧化四烃基铵
12.4.1季铵盐的性质
叔胺与卤代烷或活泼芳卤作用,则得到季铵盐;
季铵盐具有无机铵盐的一般性质:如溶于水,不溶于非极性
有机溶剂,不稳定,加热易分解成原来的叔胺和卤代烃。
具有长碳链的季铵盐是一类阳离子表面活性剂,具有良好的去 污、乳化、杀菌、消毒作用
1010主要内容主要内容胺的结构分类命名胺的结构分类命名胺的物理性质胺的物理性质胺的化学性质烃化酰化亚硝化胺的化学性质烃化酰化亚硝化氧化芳胺环上的亲电取代反应氧化芳胺环上的亲电取代反应胺的制法胺的制法根据胺分子中所含氨基的数目可以有一元二元或多元胺
第10章
胺
主要内容 胺的结构、分类、命名 胺的物理性质 胺的化学性质(烃化、酰化、亚硝化、 氧化、芳胺环上的亲电取代反应) 胺的制法 季铵盐与季铵碱
有机化学——第12章糖类化合物

葡萄糖单元是通过α-1,4-苷键相连。与直链不同的是,每隔20-25
个葡萄糖单元,就有一个以α-1,6-苷键相连的支链。
α-1,6-苷键
α-1,4-苷键
32
性质:
(1) 水溶性: 热水
直链淀粉:溶解 支链淀粉:糊化
(2) 水解性:大分子 淀粉 蓝糊精
小分子 无色糊精 麦芽糖 D-葡萄糖
红糊精
(3) 显色反应:
-苷键
甲基 - -D-吡喃葡萄糖苷 20
6、酯化反应
应用制备酯的通用方法可以在糖中的每一个有羟基的位点发生成 酯反应。
快 Ac2O NaAc 0oC 无水 ZnCl2 Ac2O 0oC 慢 100oC 相对较快 -D-吡喃葡萄糖 -D-吡喃葡萄糖 快 Ac2O NaAc 0oC Ac2O, NaOAc 100oC相对较慢
鼠李糖 (C6H12O5)
戊糖 根据碳原子数不同: 己糖 单糖 (monosaccharides) 分类: 根据羰基的不同: 醛糖 酮糖
低聚糖 (Oligosaccharides) 2-10个单糖
多聚糖 (Polysaccharides) > 10 个单糖
2
第一节 单糖
单糖是多羟基醛或多羟基酮。
除丙酮糖外,所有单糖都有旋光性。多数单糖有变旋现象。
14
五、单糖的化学性质: 1、碱催化的异构化反应
15
2、氧化反应
还原糖和非还原糖的概念:
凡是对斐林试剂、托伦试剂、本尼迪试剂呈正反应的糖称为还 原糖,呈负反应的糖称为非还原糖。 醛糖具有醛基(或半缩醛羟基),可以被弱氧化剂氧化;酮糖在碱 性条件下发生互变异构形成醛糖,也可被氧化。
黄原酸纤维素:
35
纤维素酯
大学有机化学第十二章胺和生物碱

因为:pH<5
—N+—CH3 X CH3 OH
-
2、重氮盐与苯酚进行偶联反应
OH 弱碱性 PH< 9 CH3 —OH OH弱碱 —O—N=N— CH3 —N2+Cl- +
黄色、5-甲基-2-羟基偶氮苯
+ H2O
在强碱性溶液pH>9,偶联反应不能进行。 因为重氮正离子存在如下平衡
—N2+ + OH—N=N—O- + H+
..
..
O —C — O —
..
..
..
—NO2
(三)磺化反应
H —SO2Cl + H2NR —S—NR
+ HCl
NaOH - + —SO2NR Na + H2O —SO2Cl + H NR 2 —SO2NR2 有一定的m.p NaOH —SO2Cl + HCl ×
+ NR3
×
(四)与亚硝酸的作用
—N=N—OH
重 氮 酸 pH9~11
重氮酸盐 pH11~13
重氮酸和重氮盐都不能进行偶联反应
应反联偶 pH5~7 pH< 9 偶联反应
(CH3 )3 N OH +
—N2+Cl-
第三节
生物碱及生源胺
一、生物碱的概念及临床应用
生物碱——是一类含氮的具有显著生理活性的有 机碱性化合物。
目前应用于临床的生物碱有一百种以上。
(CH3)2NH
CH3NHCH2CH3 CH2—NH2
乙胺
二甲胺
甲乙胺
CH2—NH2
乙二胺
(CH3CH2)2NH —NH2 —CH2NH2
《化学与人生哲理》课件第12章 有机化学与人生哲理

H
H H
45
HH 3 H
H H
H
6
1
HH
2
H
1
H H
6 5
CCHH22 4
2
3
H H
HH H H
在椅型构象中,C-H 键分为两类:
6个C-H 键处于直立键(a键) 6个C-H 键处于平伏键(e键)
5a 6e
e e
aa
a1 e
4a
e3
e 2a
a a
a
a e
ae
a
e
ee e
环己烷可以由一种椅型构象翻转成另一 种椅型构象,原来的a键变为e键,原来的e键 变为a键:
纽曼(Newman)投影式:
能量 / (kJ mol-1) ·
HH
H H
H H
H
H
H
H
H
H
12.6
H
H
H
H
H
H
交叉式与0°
120° 旋转角度
2.4.2 丁烷的构象
图 2.13 正丁烷构象的模型
由C2-C3 σ键旋转产生的极限构象:
CH3
H
H
H
H
CH3
HCH3
1824年,28 岁
氰 水解
草酸
1828年
氰酸铵 无意中 加热
尿素
NH4OCN
氰酸铵
O H2N C NH2
尿素
随着有机化合物相继由碳、氢等元素合成, “生命力”学说才逐渐被人们抛弃。 1840年,德国化学家柯尔柏合成了醋酸; 1950年,法国化学家柏赛罗合成了油脂。
从此,人们深信:不但可以从简单物质合成与天然有 机物完全相同的物质,还可以合成有机体不能合成的比 天然有机物更好的物质。这样有机化学就进入了合成的 时代。有机化学作为一门科学就真正形成了。
化学解题思路-第十二章有机化学基础

第十二章有机化学基础有机化学是比较新鲜陌生的知识块面,但是高中有机化学的难度并不高,只要迈入门槛就很容易掌握。
关于有机化学的小题大都直接考察有机化学的基础知识,包括有机分子的结构(简)式的书写、基本的化学键、碳原子的杂化方式、基本有机物的物理化学性质、空间结构、化学反应等。
只需要将题目中的信息与课程知识进行比对,选用对应的知识进行分析即可。
有机分子的种类很多,结构可以非常复杂,但是再复杂的结构也都是由最基本的碳氢氧等原子、单键双键三键等化学键、基本的官能团构成。
在面对没见过的有机分子时,通常从官能团入手,通过官能团来分析分子的性质。
对于有多个官能团的分子,可以分别单独考虑每个官能团,有需要时再将各官能团的性质联系起来。
如果遇到完全陌生的有机分子或有机反应,可以按照“拼插小球”的模型进行简洁且有效地理解和分析,特别是要弄清楚反应前后发生变化的原子参与成键的具体变化情况,同时尽量向已经学习过的知识进行类比靠拢。
1.(2021全国甲)下列叙述正确的是()A. 甲醇既可发生取代反应也可发生加成反应B. 用饱和碳酸钠溶液可以鉴别乙酸和乙醇C. 烷烃的沸点高低仅取决于碳原子数的多少D. 戊二烯与环戊烷互为同分异构体解析:本题需判断各叙述的正误,直接分析判断各选项:选项A,甲醇CH OH的官能团是羟基,可发生取代反应,不能发3生加成反应。
错误,排除。
选项B,乙酸与碳酸钠反应可以生成二氧化碳气体,乙醇与碳酸钠反应不能产生二氧化碳气体,因此可以进行鉴别。
正确,备选。
选项C,烷烃的沸点高低不仅取决于碳原子数的多少,还取决于支链的数目。
错误,排除。
选项D,戊二烯有5个碳原子和2个双键,不饱和度为2,可求得其分子式为C H。
环戊烷也有5个碳原子,不饱和度为1,可求得其分58子式为C H。
二者的分子式不同,不是同分异构体。
错误,排除。
510本题选B。
2.(2019全国Ⅲ)下列化合物的分子中,所有原子可能共平面的是()A. 甲苯B. 乙烷C. 丙炔D. 1,3-丁二烯解析:本题需判断化合物中的所有原子是否可能共平面。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
六. 多糖
( 一) . 同聚 多糖 ( 一种 单糖 组 成) 1:淀粉 :分子式 (C6H10O5)n : 分 类 :直 链、 支 链淀 粉 直链淀粉:实际结构为螺旋状,加碘成蓝色,螺旋环中刚好能容纳 实 一个碘分子,两者电子作用产生蓝色, 以α -1,4-苷键相连 , 苷 支链淀粉:占大部分,遇碘呈紫色,支链交接点:1、6相连,主链 、 相 也为 1、4相连。 、 相 水溶 性: 纯直 链 淀粉 :不 溶 , 纯 支 链淀 粉 :可 溶 [早期观点:直链淀粉可溶,支链不溶。 因一般得到的淀粉, 早 包 有一 层膜 , 在热 水 里溶 胀, 直 链淀 粉 能透 过膜 , 形成 悬浮 液 (非 溶解 ) ,而 支 链淀 粉不 能 透过 , 似乎 不溶 ]
CH2OH
CH2OH
(三):成脎反应 三: CHO OH + 3 NH2-NHCH2OH 过 量苯 肼 CH2OH D-葡萄糖脎 葡 果 糖、 甘露 糖 、葡 H+ NH2 + NH3 + H2O
(四):烷基化、 酰基化
CH2OH
CH2OH
2: 溴水氧化 : CHO Br2水 pH4~6 CH2OH CH2OH COOH
3: HNO3 氧化 : CHO HNO3 COOH 糖二酸
CH2OH
COOH
(二) :还原反应 二 CHO NaBH4 CH2OH 糖醇 CH2OH CHO NaBH4 CH2OH L-古牙糖 古 相同(转180° ,不变) CH2OH
HOH2C
麦芽糖: 麦芽糖:
O
HOH2C O O OH
两分子D-葡萄糖通过 - , 糖苷键形成。 两分子 -葡萄糖通过α-1,4 -糖苷键形成。 即由一分子D-葡萄糖半缩醛羟基同另一分子 - 即由一分子 -葡萄糖半缩醛羟基同另一分子D-葡萄糖 4号碳上羟基脱水形成。 号碳上羟基脱水形成。 号碳上羟基脱水形成
CHO
CH2OH
D–(+)– 葡萄糖 ( )
CH2OH
D–(–)– 古罗糖 ( )
CHO
CHO
CHO
CH2OH
D–(+)– 甘露糖 ( )
CH2OH
CH2OH
D–(+)– 半乳糖 ( )
CH2OH
D–(–)– 艾杜糖 ( ) 8
D–(+)– 塔洛糖 ( )
单糖的一些实验现象用单糖的开链结构无法说明: 单糖的一些实验现象用单糖的开链结构无法说明: ①. 变旋光现象 D–葡萄糖在 ℃以下从水溶液中结晶得 型葡萄糖, 葡萄糖在50 以下从水溶液中结晶得α–型葡萄糖 型葡萄糖, 葡萄糖在 熔点为146 ℃;在98℃以上从水溶液中结晶得 β–型葡萄 熔点为 ℃ 型葡萄 糖,熔点为150 ℃; 熔点为 α–型葡萄糖配成的溶液: 初比旋光度 型葡萄糖配成的溶液: 型葡萄糖配成的溶液 +113° ° β–型葡萄糖配成的溶液: 初比旋光度 型葡萄糖配成的溶液: 型葡萄糖配成的溶液 +17.5° ° 终比旋光度 +52.7° ° 终比旋光度 +52.7° °
糖 的 分类 : 1. 单糖——不能再水解为更简单的糖。 (甜味) 不 例: 葡萄 糖 ,果 糖 , 阿拉 伯 糖 2. 低 聚糖——水解后能产生 2~10个单糖 (甜味) 水 个 例: 双糖 (二糖)---水解产生两分子单糖。 例:麦芽糖,蔗糖。 水 三糖---水解成三分子单糖。 水 3. 多糖——水解后生成 10个分子以上单糖,常为 100~300单元。 水 个 单 例 : 淀 粉 ,纤 维 素 。 ( 大都 无 甜味 )
D D D
= +112
( 常用 )
:[α] = +19, [α] = + 52
测定:平衡时: α 型:36% , β 型:64% , 开链:0.02%
Hawarth式(哈沃斯提出的环状的透视结构式 ) 式
1
CHO OH H OH OH
H HO H H
2 3 4 5 6
H H OH H
90°转向右侧 HOH2C °
直链淀粉: -葡萄糖通过α- , 糖苷键形成。 直链淀粉: D-葡萄糖通过 -1,4 -糖苷键形成。
HOH2C O HOH2C O HOH2C O O O O HOH2C O
支链淀粉: -葡萄糖通过α- , 糖苷键和α- , 支链淀粉: D-葡萄糖通过 -1,4 -糖苷键和 -1,6 -糖苷键形成。 糖苷键形成。
1
β - D -( + ) - 吡 喃 型 葡 萄 糖
α 、β 的 区 别 在 C , 非 手 性 碳变 为 手 性 碳 , 其它 手 性 碳 不 变 -- - 差 向 异 构 体 ( 头 向 异 构 A n om e r s ) , 一 对 非 对 映 体 中 只 有 一 个 C 不 同 。 葡 萄糖 在 甲 醇 中 结 晶, 得 α 型 : [ α] β型 平 衡时
( 自学, 一般了 解)
醛糖的递升和递降 递升: 递升: CHO
HCN
CN
CN
+
CH2OH
CH2OH
1. Ba(OH)2 2. H3O+
CH2OH
COOH
CH2OH HO H O O
COOH
CH2OH HO H O O
CH2OH
CH2OH
CHO
CHO
Na Hg H2O
CH2OH
+
CH2OH
1 Ca2+ 2
CHO H OH CH2OH
CHO HO H CH2OH
D–(+)–甘油醛 甘油醛
L–(–)–甘油醛 甘油醛
7
己醛糖16种异构体: 个 型 己醛糖 种异构体:8个D–型,8个L–型 种异构体 个 型
CHO
CHO
CHO
CHO
CH2OH
D–(+)– 阿洛糖 ( )
CH2OH
D–(+)– 阿卓糖 ( )
6
5
4
3
2
1
CHO
OH OH H OH
CH2OH
6
H
4
OH OH H H
H
5
CH2OH
1 2 3
6
CH2OH
5
H CHO
6
旋转C 旋转 4—C5σ键120° 键 °
H
4
OH
1
H OH H
3
OH
H
2
CHO
OH
OH
CH2OH 5 O H H H 4 1 OH H OH OH 3 2 H OH
α – D–(+)– 吡喃葡萄糖 ( ) 吡喃葡萄糖
4
CH2OH
葡萄糖构型: 葡萄糖构型:用Fischer投影式表示 投影式表示
CHO H HO H H OH H OH OH CH2OH
HO OH OH CH2OH CHO OH
CHO
CH2OH
糖的习惯命名:根据最高编号手性碳,若羟基在右为 糖的习惯命名:根据最高编号手性碳,若羟基在右为D– 型,若羟基在左为L–型。 若羟基在左为 型
单 糖的化学性质 (部分补充,较教材详细) 部 (一): 氧化反应 一: 1: Tollen 试剂、 Fehling 试剂 : CHO 环式 开链 Ag(NH3)2 + Ag COOH
CH2OH 用于鉴别醛及 α -羟基酮 (一般酮不反应) 羟 酮糖能反应,可转化 CH2OH C=O [ CH OH C OH 烯酮式 ] CHO CHOH
葡萄糖具有醛基可被吐伦试剂和菲林试剂氧化, ③. D–葡萄糖具有醛基可被吐伦试剂和菲林试剂氧化, 葡萄糖具有醛基可被吐伦试剂和菲林试剂氧化 但却不与饱和NaHSO3加成。 加成。 但却不与饱和 中没有ν ④. 单糖在 IR中没有 c=o吸收,在1HNMR中也无醛基质 中没有 吸收, 中也无醛基质 子的吸收。 子的吸收。
第十二章 生命有机化学
包括碳水化合物、氨基酸、 包括碳水化合物、氨基酸、蛋白质
§1 2 - 1
糖(碳水化合物)
一 . 碳水化 合物 定 义、 分 类 主 要有 : 淀粉 ,纤 维 素, 葡 萄糖 等 共同点: Cn(H2O)m,故称碳水化合物。 故 注: a :不符合糖的结构特点 不 b:有些糖类并非 Cn(H2O)m。例: 鼠李糖 ( C6H12O5) 有 c: 符合的也不全是糖 , 例: 醋酸 (C2H4O2), 乳酸 (C3H6O3) 定义: 糖——多羟基醛酮或水解后能变成多羟基醛酮的化合物。 多 这些 多 羟基 醛酮 一 般以 半 缩醛 、 半缩 酮形 式 存在 。
二. 单糖的开链结构(简讲) 单糖分:二碳、三碳 以官能团分:醛糖、酮糖 例 CH0 CHOH CHOH CHOH CHOH CH2OH CH2OH 己醛糖 (葡萄糖) C=O CHOH CHOH CHOH CH2OH 己酮糖 (果糖 )
......
写法:官能团在上,编号从 靠近醛、酮开始。
单糖 结 构 葡萄 糖 构造 式 确 定: (1):元素分析:分子量测定,得分子式 C6H12O6 : (2): 反应: Ag(NH3)2 , HCN , 苯肼 ,羟胺 ——有醛基 有 (3): 乙酰化 :水解成五分子 CH3-COOH ——五个羟基 : 五 (4): Na-Hg 还原成己六醇——直链 : 直 (5):氧化得六碳酸 — : O 在 头上 , 若 O -CR-C-C
6
CH2OH 5 O H OH 4 H 1 H OHOH 2 H 3 H OH
β – D–(+)– 吡喃葡萄糖 ( ) 吡喃葡萄糖
13
实际上:α 、β 型因氧桥过长,不符合实际构型。 Howorth (哈沃斯式)结构更合理 哈 O α 型 β 型
OH OH OH OH CH2OH CH2OH
三 葡萄糖环式结构的解释
