3种不同皮色萝卜种质染色体核型分析
不同颜色肉质萝卜核型分析研究

( a gn r m . %0 2 . % ) n h r xse in f a tdfe e c si h e ime tc n r n i g fo 3 4 ~ 8 8 o ,a d t e ee it d sg i c n i r n e n t e r d pg n o i f
用于萝卜红色素分析的材料为25份红色肉质萝卜材料编号125用于核型分析的材料为4份红皮红心萝卜编号为21份绿皮红心萝卜编号为25萝卜材料来源及主要特征性状材料编号材料来源主要特征性状肉质根皮色肉质根肉色重庆涪陵自交系深绿红色红色红色红色红色红色红色红色红色红色红色红色红色红色红色红色红色红色10重庆涪陵自交系红色红色11重庆涪陵自交系深绿红色红色12重庆涪陵自交系红色红色13重庆涪陵自交系淡绿红色红色14重庆涪陵自交系深绿红色红色15重庆涪陵杂交种红色红色16中国农科院蔬菜花卉研究所红色红色17重庆涪陵自交系红色红色18重庆涪陵自交系红色红色19重庆涪陵自交系红色红色20重庆涪陵杂交种红色红色21重庆涪陵常规种红色红色22重庆涪陵杂交种红色红色23重庆涪陵杂交种红色红色24重庆涪陵常规种淡绿红色红色25北京地方品种深绿绿色红色26四川绵阳市正兴种业经营部红色白色27四川成都市新农业武候种苗研究所红色白色28四川蜀信种业有限公司淡绿红色白色29四川成都合手区园艺种业经营部白色白色30四川绵阳市正兴种业深绿白色白色31四川绵阳市正兴种业淡绿白色白色32河南省民权县民权种业有限公司深绿白色白色江等
萝 卜 型公 式为 2 一2 一1 属 于 1 型 ; 核 n x 8 m, A 白皮 白心萝 1核 型公 式 为 2 一2 一1 、 n x 6 m+2 m, 属 s 于 1 型 。从核 型进 化看 , 色 肉质 萝 卜比 白色 肉质 萝 卜 A 红 进化 程度 高 , 色 肉质 萝 卜可能 是 由 白 色 红 肉质 萝 卜 演化 而来 , 此推测 , 色肉质 萝 卜可能是 白色 肉质 萝 卜的 变种 。 据 红
染色体核型分析报告

染色体核型分析报告:核型染色体分析报告染色体核型分析弱精染色体核型分析46 xn 染色体核型分析46 xy篇一:染色体核型分析细胞遗传学(染色体核型)分析克隆性染色体异常是诊断恶性血液病的重要依据。
许多特异性染色体畸变和特定的恶性血液病亚型相联系,因而成为恶性血液病诊断分型的重要指标;诊断时的染色体核型对恶性血液病具有独立的预后价值,对于治疗方案的选择具有指导意义;同时染色体畸变可作为监测白血病缓解、复发及突变的重要参考指标,也为分子学研究提供了重要线索。
比如t(9;22)异常的急性淋巴细胞白血病、复杂染色体异常的白血病预后很不好,应尽早进行异基因造血干细胞移植等。
WHO制定的恶性血液病分型系统中,将染色体核型作为最重要的分型及诊断指标,发现重现性异常的染色体可提前作出AML的诊断。
很多染色体异常导致特异性的白血病融合基因。
染色体分析除用于各类恶性血液病患者,如急、慢性白血病、MDS、MPNs、淋巴瘤、多发性骨髓瘤(MM)患者外,还可用于儿童遗传性疾病、先天性畸形的染色体检测,以及习惯性流产、不孕不育等疾病的诊断。
但是染色体分裂相的制备和分析具有一定的难度,需要时间长,因此导致临床染色体的诊断缺乏及时性,往往发报告时间需要一个月甚至更长的时间;染色体核型分析需要细胞分裂才能完成,因此需要细胞具有良好的分裂活性,部分患者的细胞不分裂就不能观察到可供分析的中期分裂相(正常染色体分裂相,核型排列后如图3和图4),在一定程度上影响了患者的确诊和治疗。
此外染色体一般只能分析20-30个分裂相细胞,敏感性只有百分之一,当异常细胞比例较低时,也难以发现异常的染色体。
异常染色体核型的判断需要经验丰富的技术人员,尤其对一些复杂染色体异常,或异常较小的染色体,往往难以正确判断。
采用染色体全自动扫描暨自动核型分析系统可以加快染色体检测和发报告速度。
通过加用一些促细胞分裂的试剂可增加可供分析的核型。
图3 正常男性的染色体核型图4:正常女性核型 46,XX不同血液恶性肿瘤常见的染色体异常见表2,具体介绍如下。
萝卜的品质鉴别(最全)word资料

萝卜的品质鉴别一、萝卜简介萝卜:(luóbo)(Raphanus sativus L.)十字花科、萝卜属。
一、二年生草本。
根肉质,长圆形、球形或圆锥形,根皮红色、绿色、白色、粉红色或紫色。
茎直立,粗壮,圆柱形,中空,自基部分枝。
基生叶及茎下部叶有长柄,通常大头羽状分裂,被粗毛,侧裂片1~3对,边缘有锯齿或缺刻;茎中、上部叶长圆形至披针形,向上渐变小,不裂或稍分裂,不抱茎。
总状花序,顶生及腋生。
花淡粉红色或白色。
长角果,不开裂,近圆锥形,直或稍弯,种子间缢缩成串珠状,先端具长喙,喙长2.5~5厘米,果壁海绵质。
种子1~6粒,红褐色,圆形,有细网纹。
原产我国,各地均有栽培,品种极多,常见有红萝卜、青萝卜、白萝卜、水萝卜和心里美等。
根供食用,为我国主要蔬菜之一,种子含油42%,可用于制肥皂或作润滑油。
种子、鲜根、叶均可入药,功能下气消积。
生萝卜含淀粉酶,能助消化。
二、萝卜的生物学特性萝卜直根系,主根深60厘米--180厘米,主要根群分布在20厘米--45厘米的土层中。
萝卜的肉质根是同化产物的贮藏器官,皮色有白、粉红、紫红、青绿等色,前苏联和法国还有黑皮萝卜。
肉色有白、青绿、紫红等色。
萝卜营养生长期叶丛生于短缩茎上。
叶形上板叶(枇杷叶)与花叶(大类羽状全裂叶)之分。
叶色有淡绿、浓绿、亮绿、黑绿之分。
叶丛有直立、半直立和平展等方式。
萝卜植株通过阶段发育后,由顶芽抽生的花茎为主茎,各白萝p卜花多为白色或淡紫红色,青萝卜的花多为紫色,而红萝卜的花多为白色。
萝卜果实为角果,成熟后不开裂,每果有种子3--10粒,脱粒较费工。
一般种皮有红褐和黄褐色两种,深浅依品种而异,很多地方方有红籽白萝卜、黄籽红萝卜的规律。
种子千粒重7.0克--13.8克。
我国栽培的萝卜在植物学上统称为中国萝卜,自古就盛行,明代时已遍及全国。
多年以来形成了许多优良品种,其中东北绿星大红萝卜、天津青萝卜就是地方优良品种之一。
三、萝卜的分类萝卜的种类可依据根形、根色、用途、生长期长短及栽培等情况分类。
不同肉质颜色萝卜ANS 基因表达差异分析

河南农业科学,2019,48(12):98-102Journal of Henan Agricultural Sciencesdoi :10.15933/ki.1004-3268.2019.12.014收稿日期:2019-08-10基金项目:重庆市科委基础与前沿研究项目(cstc2016jcyjA0136);重庆市科委社会民生项目(cstc2017shms -xdny80074)作者简介:刘红芳(1978-),女,甘肃武威人,讲师,硕士,主要从事萝卜病虫害防治研究㊂E -mail:lhongfang@ 通信作者:陈发波(1981-),男,四川冕宁人,教授,博士,主要从事萝卜遗传育种研究㊂E -mail:chenfabo963@不同肉质颜色萝卜ANS 基因表达差异分析刘红芳,陈发波,李文博,方㊀平(长江师范学院现代农业与生物工程学院,重庆涪陵408100)摘要:为了解不同肉质颜色萝卜ANS 基因的表达量与萝卜色素含量的关系,以16份不同肉质颜色萝卜为材料,采用荧光定量PCR 法检测cDNA 样本中的ANS 基因表达量,同时测定萝卜肉质根的色素含量,分析萝卜色素含量与ANS 基因表达量的相关关系㊂结果表明,16份不同肉质颜色萝卜间色素含量存在极显著差异(F =114.2940,P =0.0001)㊂其中,红皮红心萝卜肉质根色素含量(23.80ɢ)显著高于白皮白心萝卜色素含量(0.10ɢ);16份不同肉质颜色萝卜ANS 基因表达量也存在极显著差异(F =95.9840,P =0.0001),其中,红皮红心萝卜ANS 基因表达量最高(6.4390),白皮白心萝卜ANS 基因表达量最低(0.1268)㊂相关分析结果表明,萝卜ANS 基因表达量与萝卜色素含量的相关系数为0.83,且达到极显著水平㊂ANS 基因可能是萝卜色素合成的关键结构基因㊂关键词:萝卜;色素含量;ANS 基因;相关性中图分类号:S631.1㊀㊀文献标志码:A㊀㊀文章编号:1004-3268(2019)12-0098-05Differential Expression Pattern of ANS Genes in DifferentColor Radish(Raphanus sativus L.)LIU Hongfang,CHEN Fabo,LI Wenbo,FANG Ping(Modern Agriculture and Bioengineering School,Yangtze Normal University,Fuling 408100,China)Abstract :To explore the relationship between expression level of ANS gene and pigment content indifferent color radish,sixteen radish varieties with different color fleshy roots were collected as materials and their expression levels of ANS gene were detected from cDNA samples using real-time PCRtechnology,as well as their pigments content were determined.Subsequently,the relationship between expression level of ANS gene and the content of pigment was explored.The results showed that,the content of pigment(F =114.2940,P =0.0001)and expression level of ANS gene(F =95.9840,P =0.0001)were both significantly changed in different color radish respectively.Especially it was found that the content of pigment and expression level of ANS gene were both significantly higher in red radish(23.80ɢ,6.4390)than those in white radish (0.10ɢ,0.1268);In addition,the correlation analysis betweenexpression level of ANS gene and content of pigment in different color radish was conducted,and it was found that their correlation reached extremely significant level and correlation coefficient was 0.83.it was inferred that ANS gene might be one of key regulators in pigment synthesis of radish.Key words :Radish(Raphanus sativus L.);Pigment content;ANS gene;Correlation ㊀㊀萝卜(Raphanus sativus L.)属于十字花科(Bras-sicaceae)萝卜属(Raphanus )萝卜种,是我国第二大蔬菜类作物㊂除作为蔬菜食用外,有的萝卜品种还是提取天然色素的理想原料,如胭脂萝卜㊂胭脂萝卜又名红心萝卜,主产于重庆市涪陵区及邻近区县,是涪陵的第二大特产[1]㊂从胭脂萝卜中提取的萝㊀第12期刘红芳等:不同肉质颜色萝卜ANS基因表达差异分析卜红色素不仅可以作为食品添加剂,还具有抗氧化㊁抗痛风等药用功效,其应用前景广阔㊂从分子水平解析胭脂萝卜红色素合成的机制,可以为通过基因工程手段提高胭脂萝卜色素含量提供理论,对开发和利用胭脂萝卜具有重要意义㊂我国学者先后对胭脂萝卜的品种选育㊁相关性状遗传和萝卜红色素的提取等方面开展了研究㊂陶红英等[1]对胭脂萝卜根部性状进行了研究,结果表明,胭脂萝卜色素含量与其肉质根皮厚度呈正相关㊂王丽霞等[2]研究了胭脂萝卜肉质根生长中的过氧化物同工酶含量的变化规律,结果表明,过氧化物同工酶有提高萝卜产量的作用,且与萝卜花青素的形成有着密切联系㊂刘海军等[3]提出了以乙酸溶液浸提辅以超声波法来提取优质萝卜红色素的方法,进一步优化了生产中萝卜红色素的提取方法㊂花青素(Anthocyanin)是植物次级代谢的重要产物,属于天然色素中的一种,其存在形式为花色苷,在27科72属的开花植物(被子植物)中广泛存在[4]㊂花青素有许多功能,比如预防紫外线损伤㊁预防病原体和吸引昆虫传播花粉等[5]㊂花青素合成酶(Anthocyanid in synthase, ANS)最初是在玉米的A2突变体中克隆得到的,催化无色的原花色素氧化产生有色的花色素,大多数ANS基因由2个外显子和1个内含子组成,且剪切位点都一致[6]㊂SHI等[7]分析了不同颜色武当木兰花瓣中ANS基因的表达量,表明红色花瓣中其表达量是白色花瓣的26倍㊂赵志常等[8]通过对芒果ANS基因的克隆及其序列分析发现,芒果花色素苷合成代谢途径中至关重要的基因包括ANS基因,其对芒果果皮红色的形成具有重要作用㊂目前,对胭脂萝卜的研究主要集中在新品种选育㊁相关性状遗传和萝卜红色素的提取等方面,而有关萝卜颜色控制基因的研究相对较少,ANS基因是花青素生物合成途径后期非常重要的基因㊂鉴于此,分析不同肉质颜色萝卜ANS基因表达量与色素含量的相关关系,可为通过基因工程选育高色素含量萝卜品种提供依据㊂1㊀材料和方法1.1㊀供试材料供试材料为16份不同肉质颜色萝卜品种,由长江师范学院提供,材料编号及相关表型性状见表1㊂1.2㊀萝卜肉质根色素含量的测定按照陶红英等[1]的方法测定萝卜肉质根的色素含量,将新鲜的萝卜肉质根对分成2份,1份用于含水量的测定,另外1份用于色素含量的测定㊂提取胭脂萝卜肉质根汁液,在520nm下测定吸收值,制作标准曲线㊂1000g萝卜肉质根的色素含量C(ɢ)=Vˑy㊂其中,汁液容积V(mL)=1000ˑ肉质根含水量(%),汁液质量浓度y(g/mL)由标准曲线的回归方程计算㊂表1㊀16份不同肉质颜色萝卜性状Tab.1㊀The characteristics of16materials used in this study编号No.叶形Leaf shape叶色Leaf colour皮色Skin colour肉质颜色Fleshy colour 1板叶绿色白色白色2花叶(深)绿色白色白色3花叶(深)绿色白色白色4花叶(浅)绿色白色白色5板叶浅红色红色白色6花叶(深)浅红色红色白色7花叶(深)花红色红色白色8花叶(深)绿色绿色花心9花叶(深)花红色红色花心10板叶红色红色花心11花叶(深)花红色红色花心12花叶红色红色红心13花叶(深)浅红色红色花心14花叶深红色红色红心15板叶花红色红色花心16花叶(深)花红色红色花心1.3㊀萝卜ANS基因表达量的测定1.3.1㊀萝卜肉质根总RNA的提取㊀采用柱式植物总RNA抽提纯化试剂盒SK8661提取萝卜肉质根总RNA,试剂盒由上海生工生物工程有限公司提供㊂1.3.2㊀反转录cDNA㊀使用第1链cDNA合成试剂盒,反转录合成ANS基因第1链cDNA㊂在0.2mL PCR管中加入总RNA5L㊁随机引物p(dN)6 (0.2g/L)1L和无RNA酶ddH2O5L,放入70ħ温度下水浴5min后,转入到0ħ下冰浴10s㊂然后加入反应缓冲液4.0L㊁10mmol/L脱氧核糖核苷三磷酸混合液2.0L㊁20U/L核糖核酸酶抑制剂1.0L和10U/L逆转录酶2.0L㊂于37ħ温度下水浴5min,再在42ħ下水浴60min,最后70ħ水浴10min终止反应㊂1.3.3㊀荧光定量PCR检测㊀管家基因引物序: actin-F:5ᶄ-TATGAGCAAAGAGATCACAGCACT-3ᶄ; actin-R:5ᶄ-TGAGGGAAGCAAGAATGGAA-3ᶄ,目的基因引物序列:ANS-F:5ᶄ-TACATTGAAGCGACGAG-TGAGT-3ᶄ;ANS-R:5ᶄ-AGGGC-ATTTCGGGTAATA-GTT-3ᶄ,引物由上海生工生物有限公司合成㊂将已合成的cDNA样品作8倍稀释处理后作为模板上机检测㊂反应混合液见表2,在ABI Stepone plus型荧光定量PCR仪中进行反应,反应程序:95ħ预变性99河南农业科学第48卷表2㊀荧光定量PCR反应混合液Tab.2㊀Reaction mixture of fluorescence quantitative PCR 成分Reaction component浓度Concentration体积/μLVolume Master Mix2ˑ10引物F Primer F10μmol/L1引物R Primer R10μmol/L1 ddH2O7 cDNA1合计Total20 120s,95ħ变性10s,60ħ退火40s,40个循环㊂1.4㊀数据处理采用2-ΔΔCt法对萝卜ANS基因含量进行相对定量分析,采用DPS软件和Excel2010软件进行相关图表的制作㊁方差分析和相关性分析㊂2㊀结果与分析2.1㊀不同萝卜品种色素含量分析对16份不同肉质颜色萝卜色素含量进行方差分析(表3),结果表明,16份萝卜色素含量存在极显著差异(F=114.2940,P=0.0001)㊂图1显示, 14号萝卜色素含量最高,为25.43ɢ,15号和16号萝卜次之,色素含量分别为23.48ɢ和22.58ɢ,而2号㊁3号和4号萝卜几乎不含色素㊂表3㊀16份萝卜色素含量方差分析Tab.3㊀Variance analysis of pigment content in16types of radish变异来源Source of variation SS df MS F P 区组间Block㊀㊀ 5.80992 2.9050 1.41000.2598处理间Treatment3531.657615235.4438114.2940∗∗0.0001误差Error61.799630 2.06总变异Total3599.267247㊀注:∗∗表示在0.01水平差异显著,下同㊂㊀Note:∗∗indicate significance at the0.01level,the same below.不同字母表示在0.05水平差异显著,下同Different letters indicate significance at the0.05level,the same below图1㊀16份不同类型萝卜色素含量Fig.1㊀Pigment content in16different types of radish㊀㊀根据表1中肉质根皮色及肉质颜色,将16份不同肉质颜色萝卜分为5种类型,即白皮白心㊁红皮白心㊁绿皮花心㊁红皮花心和红皮红心㊂对5种类型萝卜色素含量进行方差分析(表4),结果表明,5种类型萝卜色素含量存在极显著差异(F=255.9250,P=0.0001)㊂图2显示,红皮红心萝卜色素含量最高,为23.80ɢ,红皮花心萝卜次之,色素含量为7.00ɢ,白皮白心萝卜色素含量最低,仅为0.10ɢ㊂红皮红心萝卜色素含量显著高于其他类型萝卜㊂表4㊀5种类型萝卜色素含量方差分析Tab.4㊀Variance analysis of pigment content in five types of radish变异来源Source of variation SS df MS F P 区组间Block㊀㊀ 4.45672 2.2283 2.11100.1836处理间Treatment1080.84794270.2120255.9250∗∗0.0001误差Error8.44668 1.0558总变异Total1093.751114001㊀第12期刘红芳等:不同肉质颜色萝卜ANS基因表达差异分析A:白皮白心;B:红皮白心;C:绿皮花心;D:红皮花心;E:红皮红心,图4同A:Radish with white skin and fleshy root;B:Radish with red skin and white fleshy root;C:Radish with green skin and pinky fleshy root;D:Radish with red skin and pinky fleshy root; E:Radish with red skin and fleshy root.The same as Fig.4图2㊀不同肉质颜色萝卜色素含量Fig.2㊀Pigment content of radish withdifferent fleshy colour 2.2㊀不同萝卜品种ANS基因表达量分析对16份不同肉质颜色萝卜ANS基因表达量进行方差分析(表5),结果表明,16份不同肉质颜色萝卜间ANS基因表达量存在极显著差异(F= 95.9840,P=0.0001)㊂图3显示,14号萝卜ANS 基因表达量最高,为9.1730,其次为16号萝卜(7.1439),2号㊁3号和4号萝卜ANS基因表达量最低,分别为0.1429㊁0.1093和0.0909㊂对5种类型萝卜ANS基因表达量进行方差分析(表6),结果表明,5种类型萝卜间的ANS基因表达量存在极显著差异(F=137.9950,P=0.001)㊂图4显示,红皮红心萝卜的ANS基因表达量最高(6.4390),其次为红皮花心萝卜(1.3030)㊁绿皮花心萝卜(1.2390)㊁红皮白心萝卜(0.7090)和白皮白心萝卜(0.1268),红皮红心萝卜的ANS基因表达量显著高于其他类型萝卜㊂表5㊀16份萝卜ANS基因表达量方差分析Tab.5㊀Variance analysis of ANS gene expression level in16types of radish变异来源Source of variation SS df MS F P 区组间Block0.141220.07060.32800.7229处理间Treatment309.91201520.660895.9840∗∗0.0001误差Error 6.4576300.2153总变异Total316.510847图3㊀16份不同类型萝卜ANS基因表达量Fig.3㊀The expression level of ANS gene in16different types of radish表6㊀5种类型萝卜ANS基因表达量方差分析Tab.6㊀Variance analysis of ANS gene expression level in five types of radish变异来源Source of variation SS df MS F P 区组间Block 2.53232 1.2661 1.66400.2487处理间Treatment419.97454104.9936137.9950∗∗0.0001误差Error 6.086880.7609总变异Total428.593614101河南农业科学第48卷图4㊀5种类型肉质根中ANS基因表达量Fig.4㊀The expression level of ANS gene of five radishieswith different fleshy roots2.3㊀ANS基因表达量与萝卜色素含量的相关性分析利用DPS软件对萝卜ANS基因表达量与萝卜色素含量进行相关性分析,结果表明,萝卜ANS基因表达量与萝卜色素含量相关系数为0.83,且达到极显著水平,说明萝卜ANS基因与萝卜色素含量密切相关㊂3㊀结论与讨论天然色素与人工合成色素相比有许多突出优点,比如安全性高㊁低毒副作用㊁毒理学评价不高等[7]㊂花青素是重要的天然色素,其应用广泛㊂而ANS基因在花青素生物合成途径的后期起着重要作用,它能够依赖2-酮戊二酸离子和二价铁离子将无色的花青素催化成显色的花青素[8-11],这使ANS基因与花青素生物合成关系方面的研究成为近年来科学研究的热点㊂冯文亭[12]对红早酥梨花色素苷合成相关基因进行克隆及功能研究,结果表明,ANS基因是花色素苷生物合成重要的结构基因㊂王雪等[13]通过对苹果梨果皮花色素苷合成相关基因PyANS的克隆与表达进行分析,认为PyANS基因对果实花色素苷积累有一定的促进作用㊂孙梓健[14]研究发现,不同叶色根用芥菜中ANS基因的表达量与花青素的积累有密切关系,ANS基因在红叶芥叶片中的表达量要比绿叶芥叶片中的高㊂胭脂萝卜是提取天然色素的理想材料,但对其色素合成的分子机制研究报道相对较少㊂本研究结果表明,16份不同类型萝卜间肉质根ANS基因的表达量和色素含量均存在极显著差异,且红皮红心萝卜的ANS基因表达量和色素含量均显著高于其他类型萝卜㊂相关性分析,不同类型萝卜ANS基因表达量与色素含量呈极显著正相关,且相关系数较大(0.83),表明ANS基因可在萝卜色素生物合成中扮演重要角色,在接下来的研究中可以重点克隆胭脂萝卜ANS基因,并开展其分子作用机制研究,进而通过转基因手段提高萝卜色素的产量㊂参考文献:[1]㊀陶红英,吕发生,谭革新,等.红心萝卜肉质根性状间的关系[J].西南农业学报,2012,25(2):605-608. [2]㊀王丽霞,王林松,孙向东,等.心里美萝卜营养生长期肉质根过氧化物酶同工酶谱及组化分析[J].中国生物化学与分子生物学报,2009,25(1):65-71. [3]㊀刘海军,孙井坤.萝卜红色素的提取工艺研究[J].黑龙江八一农垦大学学报,2014,26(1):55-58. [4]㊀LIM S H,SONG J H,KIM D H,et al.Activation of antho-cyanin biosynthesis by expression of the radish r2r3-mybtranscription factor gene rsmyb1[J].Plant Cell Reports,2016,35(3):641-653.[5]㊀WANG Z,WEI P,HE C,et al.Blueberry anthocyanin-enriched extracts attenuate fine particulate matter(pm2.5)-induced cardiovascular dysfunction[J].Journal of Agricul-tural&Food Chemistry,2017,65(1):87-94.[6]㊀YE J B,XU F,WANG G Y,et al.Molecular cloning andcharacterization of an anthocyanidin synthase gene inPrunus persica(L.)[J].Notulae Botanicae Horti Agrobo-tanici Cluj-Napoca,2017,45(1):1842-4309. [7]㊀SHI Q Q,ZHOU L,LI K,et al.Transcriptional regulationinvolved in anthocyanin biosynthesis in plants[J].ForestResearch,2015,35(8):42-50.[8]㊀赵志常,陈亚渊,高爱平,等.芒果ANS基因的克隆及其序列分析[J].华北农学报,2014,29(S):6-9. [9]㊀ZHANG J,HAN Z Y,TIAN J,et al.The expression levelof anthocyanidin synthase determines the anthocyanin con-tent of crabapple(Malus sp.)petals[J].Acta Physiologi-ae Plantarum,2015,37(6):109.[10]㊀LI P,CHEN B,ZHANG G,et al.Regulation of anthocya-nin and proanthocyanidin biosynthesis by Medicago trun-catula bHLH transcription factor MtTT8[J].New Phy-tologist,2016,210(3):905-921.[11]㊀李珍,刘金兵,习卫平,等.辣椒花青素生物合成相关基因的表达分析研究[J].华北农学报,2014,29(4):87-92.[12]㊀冯文亭.红早酥梨花色素苷合成相关基因克隆及功能分析[D].杨凌:西北农林科技大学,2014. [13]㊀王雪,曲柏宏,鹿艳新,等.苹果梨果皮花色素苷合成相关基因PyANS的克隆与表达分析[J].北方园艺,2016(5):108-112.[14]㊀孙梓健.红叶芥花青素合成途径结构基因的克隆及表达分析[D].重庆:西南大学,2014:3-6.201。
3种不同皮色萝卜种质染色体核型分析

基因组学与应用生物学,2009年,第28卷,第6期,第1141-1145页Genomics and Applied Biology,2009,Vol.28,No.6,1141-1145研究报告Research Report3种不同皮色萝卜种质染色体核型分析沙玉辉1刘莉2王康1龚义勤1Le Cong Thanh 1张翠萍1柳李旺1*1南京农业大学作物遗传与种质创新国家重点实验室,农业部南方蔬菜遗传改良重点开放实验室,南京,210095;2中国种子集团公司,北京,100045*通讯作者,nauliulw@;nauliulw@摘要本研究采用根尖压片法,对3种不同肉质根皮色的萝卜种质进行染色体数目和核型分析,以获得准确的细胞遗传学信息。
研究结果表明,Nau-dqp08,Nau-txbyw07和Nau-chhong108这3种不同皮色萝卜的染色体数目均为18,核型公式分别为2n =2×=18=14m +4sm ,2n =2×=18=18m 和2n =2×=18=16m +2sm ,且核型都属于1A 型;核不对称系数分别为59.48%、55.39%与58.08%;核型不对称性大小为Nau-dqp08>Nau-chhong108>Nau-txbyw07,其中Nau-txbyw07核型较为原始。
本研究结果可为萝卜种质鉴定、遗传变异和亲缘关系分析提供细胞学依据。
关键词萝卜,染色体,核型分析Karyotype Analysis of Three Types of Radish Germplasms with Different Tap-root Skin ColorsSha Yuhui 1LiuLi 2WangKang 1GongYiqin 1Le CongThanh 1ZhangCuiping 1LiuLiwang 1*1National Key Laboratory of Crop Genetics and Germplasm Enhancement,Nanjing Agricultural University,Key Laboratory of Southern Vegetable Crop Genetic Improvement,Ministry of Agriculture,Nanjing,210095;2China National Seed Group Corp.,Beijing,100045*Corresponding author,nauliulw@;nauliulw@ DOI:10.3969/gab.028.001141Abstract In this research,we have analyzed the karyotype and chromosome number of three types of different tap-root skin color radish germplasms by using root-tip squashing method in order to obtain precise cyto-genetic data of radish.The results showed that chromosome number of Nau-dqp08,Nau-txbyw07and Nau-chhong108were all 18,and their karyotype formulas were 2n =2×=18=14m +4sm,2n =2×=18=18m and 2n =2×=18=16m +2sm,respectively,all of which belonging to “1A ”according to Stebbins classification of karyotypic asymmetry,and karyotype asym-metry index of which were 59.48%,55.39%and 58.09%,respectively.Karyotype asymmetries ranked in the increas-ing order was Nau-dqp08>Nau-chhong108>Nau-txbyw07,and the karyotype of Nau-txbyw07was more primitive a-mong the total.The results of these experiments should be provided cytological information for radish germplasm i-dentification,genetic variation and analysis of genetic relationship in radish.Keywords Radish (Raphanus sativus L.),Chromosome,Karyotype /doi/10.3969/gab.028.001141基金项目:本研究由国家科技支撑计划课题(2008BADB1B03)、863计划(2008AA10Z150)和江苏省农业种质资源基因库项目[sx (2008)g09]共同资助萝卜(Raphanus sativus L.)是一种十字花科(Bras-sicaceae)萝卜属(Raphanus )中重要的一、二年生蔬菜作物,广泛种植于我国以及东南亚地区,深受消费者喜爱。
染色体核型分析讲课ppt课件

样品要求:对数期生长, 状态良好,紧密度高,折 光性好,细胞量≥T25 / 60 mm平皿 差速贴壁法去除MEF ( KSR培养体系除外) 终止培养前1~2小时,加入秋水仙素(100ug/ml), 最终浓度为0.1~0.2ug/ml。
作用:破坏纺锤体 防护:有剧毒、无挥发性 染色体核型因分析素讲:课 时间、浓度
玻片标本质量评价
分裂相形态
√
过密
适中
过散
解决方案
过密:适当提高固定液中冰醋酸比例,增加滴片高度; 过散:适当降低固定液中冰醋酸比例,减小滴片高度。
染色体核型分析讲课
三、染色体核型分析
玻片标本质量评价
分裂相形态
重叠
解决方案 尽量将细胞吹打成单细胞悬液; 滴片时勿重复滴加同一区域。
染色体核型分析讲课
三、染色体核型分析
染色体核型分析
染色体标本制备及核型分析 质量保障部 Faye
染色体核型分析讲课
一、名词解释
二、染色体标本制备
实验耗材 前期处理 实验步骤
三、染色体核型分析
玻片标本质量评价 计数标准、合格指标 染色体核型排列 核型检测的可重复性
染色体核型分析讲课
一、名词解释
核型
一个体细胞中的全部染色体,按其大小、形态特征 顺序排列所构成的图像。
实验步骤
细胞收获
低渗处理
预固定
固定
制片
(1)加入3ml固定液,静置30min,离心弃上清; (2)再次加入3ml固定液,吹打均匀并静置30min
染色体核型分析讲课
二、染色体标本制备
实验步骤
细胞收获
低渗处理
预固定
固定
制片
离心弃上清液,根据细胞数量情况,加入1~2 mL固定 液,吹打细胞制成悬液,悬液呈微白色时为最佳。
不同肉质颜色萝卜DFR基因表达差异分析

不同肉质颜色萝卜DFR基因表达差异分析作者:陈发波高健姚启伦来源:《江苏农业科学》2019年第12期摘要:为了探明DFR基因的表达量与萝卜红色素含量之间的关系,以16个色素含量不同的萝卜品种为研究材料,测定肉质根色素含量和DFR基因的表达量,并进行方差分析。
结果表明,不同类型萝卜品种间色素含量存在真实的差异,16个萝卜品种间色素含量变幅在0.01‰~25.43‰,平均值为7.40‰。
采用RT-PCR法定量分析DFR基因相对表达量,结果表明,DFR基因在16个品种萝卜中的表达差异达到了极显著水平,DFR基因表达量在0.077 9~6.639 3 之间,平均值为1.574 1。
对16个萝卜品种的DFR基因表达量与色素含量进行相关分析,结果表明,DFR基因相对表达量与色素含量之间的相关系数为0.89,达到了极显著水平,说明DFR基因的表达量越高,萝卜红色素的含量越高。
推测DFR基因可能是萝卜红色素合成的关键基因,可将其作为萝卜或其他作物色素生产基因工程的候选基因。
關键词:红心萝卜;红色素;RT-PCR;DFR基因;表达量;方差分析中图分类号: S631.101; 文献标志码: A; 文章编号:1002-1302(2019)12-0182-04红心萝卜别称胭脂萝卜,是十字花科萝卜属萝卜种中的一个地方品种,在1979年蔬菜品种调查中确认为重庆涪陵特产[1]。
红心萝卜具有心皮全红、色泽鲜美的特点,用以制作泡菜、萝卜干等,口感清脆。
此外在红心萝卜中提取的红色素不仅可以作为食品添加剂,还具有抗氧化、抗痛风等功效,其应用前景广阔。
涪陵红心萝卜在涪陵及周边区县均有栽种,是非常具有地方特色的蔬菜品种。
但由于人们长期以来的自繁自种及红心萝卜与其他萝卜品种容易相互授粉,红心萝卜的一些优良性状已逐步退化,如红心性状普遍退化,亟待人们对其色素合成相关基因展开研究,以保护和利用这一特色农业资源。
目前人们对于涪陵红心萝卜的研究主要集中在新品种选育[1-3]、相关性状关系[4-6]与萝卜红色素的提取工艺[7-8]等方面,而关于基因表达量与色素含量之间的关联性分析报告较少。
萝卜主要性状遗传规律的研究进展

究发 现椭 圆形 × 圆形 , 现椭 圆形 ;椭 圆形× 椭 F表 长 圆柱 形 。 F 表现偏 长 圆柱形 , 正反 交结 果相 同 。 且 所 以认 为 萝 卜肉质根 长 、 根粗 2个 性状 均 为不 完 全显
粉 红 或淡 紫 皮 , F 出现 分 离 ; 绿皮 与 红皮 正 反 交 , , F
李鸿渐等翻 3 个 杂 对 4
基 因对 控 制 , 为 2对连 锁 基 因控 制 时 , 受 到 细 若 还 胞质 基 因组 可能 主要 是 质体基 因组 的互作 , 表现 出 明显 的偏 母 遗传 现象 : 红皮似 由 3对 独立 遗 传 的基
因控制 , 3对 基 因还 有 相 互作 用 , 中 1 可 能 这 其 对
性 , 型介 于 双亲 之 问 。李鸿 渐等 [ F株 2 1 , 叶数 认为 在
和 叶 片 大 小相 似 的情 况 下 , 直立 型适 于密 植 ; 从 但 生态 型来 说 , 平展 型具 有 较强 的耐 寒性 。
料 ,采用 植 物数 量 性状 主基 因+ 基 因混 合遗 传 模 多 型多 世 代 联 合 分析 方法 ,分 析 了萝 卜干 物质 量 和
色 、 色、 色 、 粉 绿 黄绿 色 、 黄色 、 白色 、 黑色 等 , 有些 品 种 出土 部分 的皮色 与入 土部 分不 同。何 启伟 等闻 以 不 同皮 色萝 卜 试材 , 行杂 交 , 为 进 并对 F 、 色表 , 皮 F 现 进行 观察 ,发 现 白皮 与绿 皮 正反 交 , F 都表 现淡 绿 皮 ,: F 出现分 离 ; 白皮与 红皮 正反 交 , , F 都表 现 为
长 根形 × 根 形 , 肉质 根 产 量 的超 亲优 势 最 为 粗 F代
明显 。
① 肉质根形状
植物染色体的核型分析
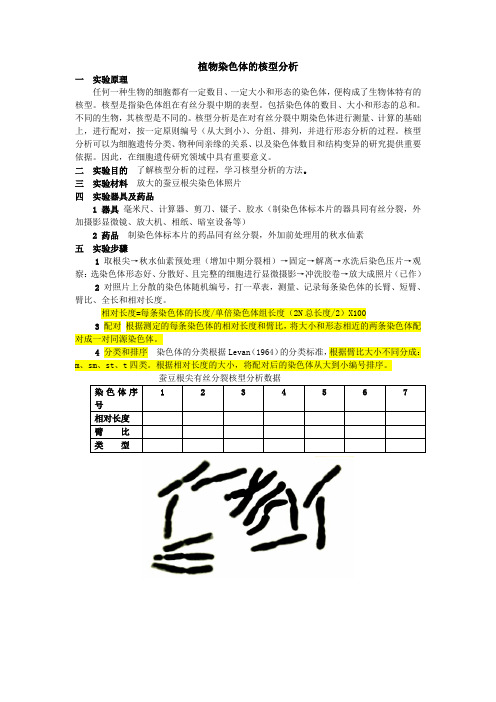
植物染色体的核型分析一实验原理任何一种生物的细胞都有一定数目、一定大小和形态的染色体,便构成了生物体特有的核型。
核型是指染色体组在有丝分裂中期的表型。
包括染色体的数目、大小和形态的总和。
不同的生物,其核型是不同的。
核型分析是在对有丝分裂中期染色体进行测量、计算的基础上,进行配对,按一定原则编号(从大到小)、分组、排列,并进行形态分析的过程。
核型分析可以为细胞遗传分类、物种间亲缘的关系、以及染色体数目和结构变异的研究提供重要依据。
因此,在细胞遗传研究领域中具有重要意义。
二实验目的了解核型分析的过程,学习核型分析的方法。
三实验材料放大的蚕豆根尖染色体照片四实验器具及药品1 器具毫米尺、计算器、剪刀、镊子、胶水(制染色体标本片的器具同有丝分裂,外加摄影显微镜、放大机、相纸、暗室设备等)2 药品制染色体标本片的药品同有丝分裂,外加前处理用的秋水仙素五实验步骤1 取根尖→秋水仙素预处理(增加中期分裂相)→固定→解离→水洗后染色压片→观察:选染色体形态好、分散好、且完整的细胞进行显微摄影→冲洗胶卷→放大成照片(已作)2对照片上分散的染色体随机编号,打一草表,测量、记录每条染色体的长臂、短臂、臂比、全长和相对长度。
相对长度=每条染色体的长度/单倍染色体组长度(2N总长度/2)X1003配对根据测定的每条染色体的相对长度和臂比,将大小和形态相近的两条染色体配对成一对同源染色体。
4分类和排序染色体的分类根据Levan(1964)的分类标准,根据臂比大小不同分成:m、sm、st、t四类。
根据相对长度的大小,将配对后的染色体从大到小编号排序。
1 2 3 4 5 6 7大麦根尖有丝分裂核型。
萝卜主要性状遗传规律的研究进展

萝卜主要性状遗传规律的研究进展作者:罗智敏王超楠闻凤英刘晓晖赵冰黄志银来源:《长江蔬菜·学术版》2011年第02期摘要:综述了萝卜主要性状遗传规律的研究概况,包括肉质根的形状、根质量、大小、皮色、肉色;叶片的形状和颜色;抗病性和雄性不育性等。
以期通过对遗传规律的总结为萝卜育种中的亲本选配提供理论参考。
关键词:萝卜;主要性状;遗传规律萝卜(Raphanus sativus L.)是我国栽培的主要蔬菜作物之一。
近年来,我国萝卜育种水平有了较大提高,相关育种技术研究取得了显著进展,开展优势育种,选育和利用优良的杂种一代来提高产量和品质,日益受到广大育种者和生产者的重视[1]。
深入揭示萝卜各方面性状的遗传规律,对开展育种研究有着十分重要的意义。
1 主要植物学性状的遗传规律1.1 肉质根①肉质根形状萝卜肉质根形状有圆形、椭圆形、扁圆形、长圆柱形、短圆柱形、卵圆形、圆锥形、纺锤形、炮弹形等。
李鸿渐等[2]报道萝卜杂种一代的肉质根形状趋向于双亲的中间类型,即长形根与短形根,粗肉质根与细肉质根之间有互补作用。
长圆柱形×圆锥形,F1为长筒形;圆形×圆锥形,F1为纺锤形或卵圆形;圆形×扁圆形,F1多为扁圆形。
张丽[3]研究发现椭圆形×椭圆形,F1表现椭圆形;椭圆形×长圆柱形,F1表现偏长圆柱形,且正反交结果相同。
所以认为萝卜肉质根长、根粗2个性状均为不完全显性,属细胞核遗传,不受细胞质的影响。
②肉质根质量及大小李鸿渐等[2]对34个杂种一代与亲本的鲜质量产量进行了研究,结果表明,有53%杂交组合的鲜质量产量呈超亲遗传,27%表现高于双亲平均值,9%低于双亲平均值。
林欣立等[4]对获得的12个杂种一代及其亲本的根长、根粗和根质量进行研究结果表明,75%组合的单株根质量表现为超亲显性,说明利用杂种优势取得萝卜根质量增长的可能性很大;根长在12个组合中有4个表现为正向显性,8个表现为负向显性;根粗在12个组合里有11个表现为正向超亲显性。
实验四染色体核型分析

核型模式图
二、实验原理
不同物种的染色体都有各自特定的形态结构 (包括染色体的长度、着丝点位置、臂比、随 体大小等)特征,而且这种形态特征是相对稳 定的。因此,染色体核型分析是生物种质资源 遗传性研究的重要内容。
染色体核型分析主要包括染色体长度、染色体 臂比、着丝点位置、次缢痕等。
三、实验材料及用品
臂比(长/ 短)
Arm ratio(L/
S)
类型 Type
1 3.25+0.99=4.24
7.05
2 2.49+0.92=3.41
5.61
3 2.06+1.02=3.08
5.06
4 1.71+1.03=2.74
4.51
5 1.46+0.96=2.42
3.99
6 1.21+0.92=2.13
3.52
L
3.27
st
L
2.70
sm
L
2.03
sm
M2
1.66
m
M2
1.51
m
M1
1.32
m
五、实验方法与步骤
1.用Photoshop图像处理软件,对染色体照片进行适 当的编辑(包括去色、调节反差和对比度)、并对 染色体进行初编号。
2.用Image j 或 ImageБайду номын сангаасtool软件,测量每一条染色体 的短臂、长臂的长度,计算其相对长度、臂比值。
实验四染色体核型分析
核型(karyotype) 是指染色体组在有丝分裂中期的表型,
包括染色体数目、大小、形态特征的总和。 核型模式图(idiogram)
将一个染色体组的全部染色体逐个按 其特征绘制下来, 再按长短、形态等特征排 列起来的图象称为核型模式图,它代表一个 物种的核型模式。
紫色洋葱和白色洋葱的核型比较分析

e lt g,i wa u d ta h ay tp ft td e i n o eo e otelwl v l t n l A y e,a d i ay tpefr l s2n uai n t sf n h t ek roy eo su idwht u in b lng dt h o y e oui a tp o t he e o 2 n t k r oy omuawa s
分生组织 的大小 , 一般 每个 根尖可制 片 3~ 4片 。 1 2 5 压 片 。染 色后 , .. 加盖 玻 片 , 吸水 纸 放在 盖 玻 片 上 用 面, 左手 按住 载玻 片 , 右手 拇指在 吸水 纸上 对准 根尖部 位 用
见报 道 。核型 分 析是 染 色 体研 究 的 重要 基 础 , 在 起 源 分 其
4 0卷 2期
陈 蕾等 紫色洋葱和 白色洋葱的核型比较分析 表 2 紫色洋葱核型分析相关参数
施加 压力 , 铅笔 的橡 皮头 轻敲 盖玻 片 即可 , 料均 匀 或用 使材 分散 , 细胞分离压平 , 压力要适 当 , 注意不要 移动盖 片 。
12 6 核型分 析。镜检找 出染 色体分 散较好 的 中期 分 裂相 .. 细胞 , 照并测 量各 参数 , 据公式 计算 出每 条染 色体 的 总 拍 根
色体 基数 的鉴定 或减数分裂观 察 , 染色体 核型分 析 的资料 但
不多, 尤其 是不同种 间的染 色体核型 比较研究 在 国 内外 尚未
将根 冠和伸 长 区 以上 的部 位切 去 , 留分 生组 织 , 将其 切 保 并 成细碎组织 , 1 滴 滴醋 酸 洋红 染 液 , 染色 l 1 i。根 据 0~ 5mn
n r lwae to oma frmeh d.P oo c o rp y wa d pe o po u et ih q ai ho sme s e i n F n ly,k roy ea ay i sc n h tmirg a h sa o td t r d c hehg — u ly c rmo o p cme . i al t ay tp n lsswa o —
看染色体核型分析报告模板通用版

看染色体核型分析报告模板通用版See the general version of the report template of chromosome karyotype analysis汇报人:JinTai College看染色体核型分析报告模板通用版前言:报告是按照上级部署或工作计划,每完成一项任务,一般都要向上级写报告,反映工作中的基本情况、工作中取得的经验教训、存在的问题以及今后工作设想等,以取得上级领导部门的指导。
本文档根据申请报告内容要求展开说明,具有实践指导意义,便于学习和使用,本文档下载后内容可按需编辑修改及打印。
我们的染色体核型报告附有完整的核型图像和描述。
对我们来说,最重要的是看懂“染色体核型”一栏中的结果。
对一张染色体报告来说,最重要的是染色体核型结论。
为了方便理解,我们将染色体核型结果大致分成三种类型。
1、正常染色体核型正常男性染色体核型为:46, XY正常女性染色体核型为:46, XX如果你的染色体报告显示的是以上两种核型,且你的性别与染色体核型相符,那么你的染色体就是完全正常的。
2、染色体变异(染色体多态性)染色体变异(variation)也经常被称为染色体多态性。
各种染色体变异在人群中发生的总频率大约在10%-15%左右。
染色体变异虽然看起来是和正常核型不一样,但是它们并没有实际的临床意义。
因此,染色体变异可以被看成是正常的染色体,它们对个人健康无害,也不会影响生育后代。
染色体变异可以被分成很多种,常见的有异染色质长度和位置变异,以及随体与随体柄区域的'变异。
你可能看到的报告形式往往好似以下形式:46、XY, 9qh+46、XX, 21pstk+46、XY, inv(9)(p11q12)46、XY, Yqh+以上只是一些示例,事实上染色体变异的形式是很多的。
要知道自己的染色体是否属于变异染色体,最简单的方法是在我们报告的结果说明上看一看是否有“染色体多态性”这个判断。
染色体核型分析

要求: 掌握动物细胞染色体标本的一般过程 观察染色体的数目和形态特征
主要仪器: 主要仪器: (1)离心机 (2) 电热恒温干燥箱 (3) 水浴锅 (4) 天平 (5) 显微镜
材料
新建MB16C传代细胞系,核型范围22新建MB16C传代细胞系,核型范围22-84.
实验步骤
收获前5小时加 秋水仙素(终浓度0 收获前5小时加入秋水仙素(终浓度0.2-3ug/ml); ug/ml) 1. 混匀后继续培养5小时; 混匀后继续培养5小时; 2. 胰酶消化细胞; 胰酶消化细胞; 3. 转入15ml离心管中,以1000转/分钟离心6-8分钟, 转入15ml离心管中, 1000转 分钟离心6 分钟, 15ml离心管中 去上清液 去上清液 4. 加入5ml低渗液(0.075M/l KCL),将细胞沉淀吹打均 加入5ml低渗液(0.075M/l KCL), 5ml低渗液 (!),室温20 30min。 20匀 (!),室温20-30min。 5. 加入3 ml新配制的固定液,轻轻混匀后以与前面相 加入3 ml新配制的固定液 新配制的固定液, 同的转速和时间离心, 同的转速和时间离心,吸去上清液
思考题: 思考题:
结合所有同学的染色体计数结果,分析 MB16C的染色体众数,MB16C染色体的 MB16C的染色体众数,MB16C染色体的 变化原因。 染色体制备的关键步骤
6. 加入5mL固定液并充分将细胞混匀,室温固定20-30 加入5mL固定液并充分将细胞混匀,室温固定20 5mL固定液并充分将细胞混匀 20min,重复离心后, min,重复离心后,去掉上清液 7. 经离心和去上清液后的细胞沉淀中加入约0.5ml-2ml 经离心和去上清液后的细胞沉淀中加入约0.5ml 0.5ml新鲜固定液吹打混匀 8. 细胞悬液滴于预冷的载玻片上(以每张玻片3滴细胞 细胞悬液滴于预冷的载玻片上(以每张玻片3 悬液为宜) 悬液为宜) 9. 酒精灯烘烤滴片,或室温晾干 酒精灯烘烤滴片, 10. 滴加10% Giemsa染液若干,染色10-20min 滴加10% Giemsa染液若干,染色10 染液若干 1011. 自来水冲洗,镜检-,拍照,计数。 自来水冲洗,镜检- 拍照,计数。
核型分析口诀范文

核型分析口诀范文核型分析是一种常见的染色体分析技术,通过观察染色体在显微镜下的形态结构和数量,可以确定个体的染色体组成。
下面是一个简单的核型分析口诀,帮助记忆和理解核型分析的步骤和要点。
核型分析,七步法,用显微镜,找出病因。
第一步,细胞培养,收集样本,让细胞分裂。
细胞生长,分裂期,受精卵,选择细胞。
第二步,细胞准备,用荧光染料,标记染色体。
靶标精确,染色鲜艳,准确显示。
第三步,细胞损伤,制作干片,使染色体扩展。
热凝胶法,金属性染剂,断裂染色。
第四步,显微观察,放大细胞,观察染色体形态。
20个倍数,不同形态,记录细节。
第五步,分析计数,分类染色体,统计数量。
编号染色体,统计态型,建立染色图。
第六步,异常识别,找出没变异,染色体缺失。
三倍体染色体,易位缺失,发现异常。
第七步,病因解析,疾病原因,找出解决方法。
核型分析,口诀告诉,百分之九十分析无误。
细心观察,准确记录,确保结果。
核型分析,重要手段,研究遗传,解决问题。
遗传病理,胚胎畸形,核型分析。
核型分析,提供线索,疾病治疗,指导方案。
核型分析,技术更新,高分辨率,解决更多问题。
全基因组,测序技术,核型分析。
核型分析,七步法,提供真实,有效信息。
遗传变异,疾病诊断,核型分析。
总结核型分析,步骤七,从采样到结果真实。
细胞培养,细胞准备,细胞损伤,显微观察。
分析计数,异常识别,病因解析。
核型分析,有用工具,提供线索,做决策。
遗传变异,疾病治疗,核型分析。
以上是一个简单的核型分析口诀,通过记忆这个口诀,可以帮助我们理解和记忆核型分析的步骤和要点。
当然,核型分析是一项复杂的技术,建议在实践中结合更具体的教材和指导进行学习和了解。
紫色洋葱和白色洋葱的核型比较分析

紫色洋葱和白色洋葱的核型比较分析陈蕾;王军【摘要】[Objective] This study aimed to compare the similarities and dissimilarities in karyotypes of purple and white onions, so as to lay foundation for further studying its genetic improvement and breeding more onion varieties. [ Method] Sections of root-tip cells were prepared by normal wafer method. Photomicrography was adopted to produce the high-quality chromosome specimen. Finally, karyotype analysis was conducted using Adobe Photoshop [ Result ] Chromosome karyotype analysis on the root-tip showed that the chromosome number of both purple and white onions was 2n = 2x = 16. Among the 16 chromosomes of both the onions, no satellite chromosome was found. By measuring and calculating, it was found that the karyotype of the studied white union belonged to the lowly evolutional 2A type, and its karyotype formula was 2n = 2x = 16 = 14 m + 2St, with the karyotype asymmetry coefficient of 58. 67% . No obvious centromere was observed in the sections of purple onion. [ Conclusion] The karyotypes of white and purple unions are similar and we can infer from this fact that the reason of different characters between both the onions is not due to the chromosome aberration. This karyotype formula and asymmetrical karyotype coefficient had spme reference values on the identification of onion variety resources.%[目的]分析紫色洋葱和白色洋葱的核型并比较他们的异同点,为进一步研究洋葱遗传改良奠定基础,为培育洋葱新品种提供理论依据.[方法]运用传统的压片技术制备洋葱根尖细胞染色体标本后进行核型分析.[结果]通过对紫色洋葱和白色洋葱根尖细胞的核型分析,发现2种洋葱的染色体数均为2n=2x=16,其中均未发现具有随体的染色体.通过对白色洋葱的染色体进行测量和计算发现其核型均属进化程度较低的2A型,核型公式为2n =2x=16=14m +2St(SAT),核型不对称系数58.67%;而紫色洋葱的染色体制片由于无明显着丝粒,故有待于进一步的研究.[结论]2种洋葱的核型相似,说明两者的性状差异不是由染色体变异造成的,需要做进一步的研究;该试验得到的核型公式及核型不对称系数对我国洋葱品种资源的系统分类和遗传育种研究具有一定的参考价值.【期刊名称】《安徽农业科学》【年(卷),期】2012(040)002【总页数】3页(P796-797,816)【关键词】紫色洋葱;白色洋葱;染色体;核型分析【作者】陈蕾;王军【作者单位】曲阜师范大学,山东曲阜273165;曲阜师范大学,山东曲阜273165【正文语种】中文【中图分类】S633.2洋葱(Attlum lepa L.)是一种重要的葱属植物,栽培历史悠久,品种类型丰富。
实验二植物染色体核型分析

二.实验原理
1. 一般有四种方法。 常规的形态分析。选用分裂旺盛细胞的有丝分裂中期的染色体制 成染色体组型图,以测定各染色体的长度(微米)或相对长度 (%),着丝粒位置及染色体两臂长的比例(臂比),鉴别随体 及副缢痕的有无作为分析的依据。
带型分析。显带技术是通过特殊的染色方法使染色体 的不同区域着色,使染色体在光镜下呈现出明暗相间 的带纹。每个染色体都有特定的带纹,甚至每个染色 体的长臂和短臂都有特异性。根据染色体的不同带型, 可以更细致而可靠地识别染色体的个性。
编号
1 2 3 4 5 6 ……
绝对 长度 (μm)
相对 长度
短臂 (μm)
长臂 臂 着丝粒 随体 染色体 (μm) 率 指数 有无 类型
染色体类型由臂比值确定。 Total length: μm P217
臂比(长臂/短臂)
1-1.7 1.71-3.0 3.01-7.0
>7.01
形态特征
m 中着丝粒染色体 sm 近中着丝粒染色体 st 近端着丝粒染色体
t 端着丝粒染色体
染色体类型由臂比值确定。 Total length: μm P217
核型分析之染色体自动核型分析系统
核型分析之染色体自动核型分析系统
核型分析之染色体自动核型分析系统
核型分析之染色体自动核型分析系统
核型分析之染色体自动核型分析系统
核型分析之染色体自动核型分析系统
核型分析之教师用图片
理20小时;b、幼根用0.05%秋水仙溶液处理7小时; • 固定:新配的材料用卡诺氏固定液固定24小时后,放
入70%乙醇中置于冰箱中备用。 • 解离:蒸馏水清洗后,放于1N盐酸中,60℃恒温水浴
10分钟。 • 染色和压片: 1. 镜检:
核型与带型分析

括号内为结构异常的染色体
重排中用于分开染色体 嵌合体中用于分开不同的细胞系 易位 末端 从....到
4.2 核型描述方法 4.2.1 染色体数目异常的核型描述
首先是书写染色体总数,加一个逗号,接 着写出性染色体的组成,然后写出染色体的异 常。“+”和“-”号当其放在相应的符号之 前,表示增加或丢失了整条染色体;当其放在 相应符号之后,则表示染色体长度的增加或减 少。 例如:47,XX,+21为一个女性先天愚型 的核型,有一条额外的21号染色体; 46,XY,5p-表示一个5号染色体短臂长度 减少的男性核型。
人染色体组型模式图
是鉴别染色体进行配对分类的基木技术,是 在对染色体进行测量计算的基础上, 进行分组、 排队、配对, 并进行形态分析的过程。
2 染色体核型分析的意义: ◆不同物种的染色体都有各自特定的形态结构 (包括染色体的长度、着丝点位置、臂比、随体
大小等)特征,而且这种形态特征是相对稳定的。
因此,染色体核型分析是生物种质资源遗传性研 究的重要内容,在动植物分类和生物进化研究中 也得到广泛的应用;
带(subband)的水平。使我们能够确认那些更为
微小的染色体结构改变了。
i)SCE(sister chromatid exchange)显示方法:
5-BrdU→T
5-BrdU
优缺点:染色体显带技术能够识别不同 的染色体,从染色体水平上了解许多疾病的 遗传变异,但是受到分辨率(超过3Mb的DNA 才会识别)的影响,检测出像染色体微缺失 的综合症的微小染色体变异可能性较小;只 能分析中期分裂相细胞;而且,由于许多肿 瘤是实体,染色体重组非常复杂,无法通过 显带技术得到全部的核型。
1996 年 Schroch等首次描述了SKY技术。应用5 种荧光素同时标记24条人染色体,制成染色体涂染探 针,应用Fourier光谱仪,CC成像和荧光显微镜进行检 测分析,经计算成像处理,46条染色体形成具有不同 颜色的核型影像,可用以分析各种染色体异常。
生物染色体组型(核型)分析

5.分类:按臂比分类 M:1.0 m: 1~1.7 sm: 1.71~3.0 st: 3.01~7.0 t: >7.01
6.综合描述:根据实验结果写出蚕豆的核型公式并分类。 蚕豆标准核型公式为:2n=12=2m(SAT)+10t 对称核型:由M和m染色体组成 基本对称核型:大多数由M和m染色体组成 基本不对称核型:大多数由sm、st和t染色体组成 不对称核型:由st和t染色体组成
实验三 生物染色体组型(核特征,学习生物染色体组型(核型)分析的方法。 • 实验材料:蚕豆根尖细胞有丝分裂前期末染色体放大照片。 • 实验器材:计算器,剪刀,毫米尺,胶水
实验原理: 每种生物细胞内染色体的形态结构和数目都是相对恒 定的。各生物细胞内特定的染色体组成叫做该生物的染色 体组型或核型。 染色体组型或核型分析,就是研究一个物种细胞内染 色体的数目及形态特征,即通过对染色体的长度、着丝粒 位置、臂比和随体有无等观测,从而描述和阐明该物种的
臂比:长臂长度/短臂长度
绝对长度(μ m):测量获得的各染色体的长臂+短臂/放大倍数 相对长度(%):单个染色体的长度占单套染色体组总长度的百 分数。
2.配对:根据各染色体的长度、臂 比、随体有无等信息,将同源 染色体配对。 3.排列:将各对同源染色体按大小 (长度)进行排列并编号。
4.剪贴:各染色体着丝点在同一水
作 业
1.测量、计算并填表(P33) 2.根据配对、排列结果,按要求剪贴染色体 3.写出核型公式并分类
染色体组成,为细胞遗传学、分类学及进化遗传学等研究
提供依据。 植物根尖等分生组织细胞的有丝分裂前期末或中期, 染色体短粗且分散,数目和形态特征清晰可辩,是核型分 析的最佳时期。
实验步骤
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
基因组学与应用生物学,2009年,第28卷,第6期,第1141-1145页Genomics and Applied Biology,2009,Vol.28,No.6,1141-1145研究报告Research Report3种不同皮色萝卜种质染色体核型分析沙玉辉1刘莉2王康1龚义勤1Le Cong Thanh 1张翠萍1柳李旺1*1南京农业大学作物遗传与种质创新国家重点实验室,农业部南方蔬菜遗传改良重点开放实验室,南京,210095;2中国种子集团公司,北京,100045*通讯作者,nauliulw@;nauliulw@摘要本研究采用根尖压片法,对3种不同肉质根皮色的萝卜种质进行染色体数目和核型分析,以获得准确的细胞遗传学信息。
研究结果表明,Nau-dqp08,Nau-txbyw07和Nau-chhong108这3种不同皮色萝卜的染色体数目均为18,核型公式分别为2n =2×=18=14m +4sm ,2n =2×=18=18m 和2n =2×=18=16m +2sm ,且核型都属于1A 型;核不对称系数分别为59.48%、55.39%与58.08%;核型不对称性大小为Nau-dqp08>Nau-chhong108>Nau-txbyw07,其中Nau-txbyw07核型较为原始。
本研究结果可为萝卜种质鉴定、遗传变异和亲缘关系分析提供细胞学依据。
关键词萝卜,染色体,核型分析Karyotype Analysis of Three Types of Radish Germplasms with Different Tap-root Skin ColorsSha Yuhui 1LiuLi 2WangKang 1GongYiqin 1Le CongThanh 1ZhangCuiping 1LiuLiwang 1*1National Key Laboratory of Crop Genetics and Germplasm Enhancement,Nanjing Agricultural University,Key Laboratory of Southern Vegetable Crop Genetic Improvement,Ministry of Agriculture,Nanjing,210095;2China National Seed Group Corp.,Beijing,100045*Corresponding author,nauliulw@;nauliulw@ DOI:10.3969/gab.028.001141Abstract In this research,we have analyzed the karyotype and chromosome number of three types of different tap-root skin color radish germplasms by using root-tip squashing method in order to obtain precise cyto-genetic data of radish.The results showed that chromosome number of Nau-dqp08,Nau-txbyw07and Nau-chhong108were all 18,and their karyotype formulas were 2n =2×=18=14m +4sm,2n =2×=18=18m and 2n =2×=18=16m +2sm,respectively,all of which belonging to “1A ”according to Stebbins classification of karyotypic asymmetry,and karyotype asym-metry index of which were 59.48%,55.39%and 58.09%,respectively.Karyotype asymmetries ranked in the increas-ing order was Nau-dqp08>Nau-chhong108>Nau-txbyw07,and the karyotype of Nau-txbyw07was more primitive a-mong the total.The results of these experiments should be provided cytological information for radish germplasm i-dentification,genetic variation and analysis of genetic relationship in radish.Keywords Radish (Raphanus sativus L.),Chromosome,Karyotype /doi/10.3969/gab.028.001141基金项目:本研究由国家科技支撑计划课题(2008BADB1B03)、863计划(2008AA10Z150)和江苏省农业种质资源基因库项目[sx (2008)g09]共同资助萝卜(Raphanus sativus L.)是一种十字花科(Bras-sicaceae)萝卜属(Raphanus )中重要的一、二年生蔬菜作物,广泛种植于我国以及东南亚地区,深受消费者喜爱。
萝卜属于多态型种,我国为主要起源地之一,有着丰富的种质资源(汪隆植和何启伟,2005)。
随着生物技术和分子生物学的发展,不同的分子标记技术、同工酶技术等不断地应用于萝卜的种质鉴定和系统亲缘关系的研究(陈惠明和周长久,1999;Yamgishi et al.,1998;Huh and Ohnishi,2002)。
而关于萝卜细胞遗传学信息较少,核型分析方面的研究尚未见系统报道。
一个物种的核型反映了其染色体水平上的整体特征,研究和比较物种的核型有助于判基因组学与应用生物学Genomics and Applied Biology DOI:10.3969/gab.028.001141断和分析物种间的遗传距离和亲缘关系,初步揭示遗传进化的过程和机制。
萝卜种质分类与根皮色有一定的相关性(孔秋生等,2005),但目前尚未见关于不同肉质根皮色萝卜种质的核型研究的报道。
本文主要对不同肉质根皮色的萝卜种质进行核型分析,研究其染色体数目及形态特征,并分析不同皮色萝卜染色体之间的差异,以期为萝卜种质鉴定、品种间遗传变异和种间亲缘关系研究提供细胞学证据。
1材料和方法1.1材料本实验所采用的3份萝卜种质为本实验室所保存的高代自交系,其中Nau-dqp08的根皮色为绿色,Nau-txbyw07为白色,Nau-chhong108为红色。
1.2制片和镜检采用根尖压片法制片镜检。
将萝卜饱满的种子置于铺有滤纸的培养皿中催芽。
当根尖长至0.5~1.2cm 时,将其用冰水混合物预处理20~24h,后用卡诺固定液(V无水乙醇:V冰醋酸=3:1)固定10~24h,固定材料也可转入70%乙醇中,于4℃冰箱中保存备用。
制片时,根尖用蒸馏水洗净,用1mol/L盐酸于60℃下解离6~8min,用蒸馏水洗净,卡宝品红染液染色,压片,用Nikon H550S显微镜进行镜检并拍照。
1.3核型分析统计30个以上供试细胞,以其中85%以上细胞具有恒定一致的染色体数作为该种的染色体数(李懋学和陈瑞阳,1985)。
分别选用5个分散良好的中期分裂相细胞进行染色体核型分析。
用Ikaros染色体图像分析软件进行分析,测出染色体的长短臂之比,并对染色体进行配对,根据染色体全长顺序编号排序并绘出核型图。
以染色体臂比来确定着丝点位置(Levan et al.,1964),以染色体相对长度系数IRL(index of relative length)将染色体分成4组的染色体分类标准(Kuo et al.,1972)。
根据染色体长、短臂的相对长度绘制核型模式图。
按照Stebbins(1971)的方法确定核型类型,核型中最长染色体与最短染色体之比小于2:1,且臂比大于2的染色体所占比例为0、0.01~0.50、0.51~0.99和1.00时分别为1A、2A、3A和4A核型。
根据文献中提出的核型不对称系数(asymmetry index)确定染色体核型不对称程度(李懋学和陈瑞阳,1985)。
2结果与分析2.1Nau-dqp08萝卜核型分析对多个Nau-dqp08萝卜的细胞进行染色体计数,统计结果发现其染色体有18条(图1A);核型模式图及核型图如图1B和图1C所示。
图1Nau-dqp08的染色体中期分裂相(A)、核型图(B)及核型模式图(C)Figure1The metaphase chromosome(A),karyogram(B)and id-iogram(C)of Nau-dqp08经Ikaros染色体图像分析软件分析中期细胞染色体得到染色体核型分析以及染色体配对的参数数据(表1)可知,Nau-dqp08萝卜第2、第6对染色体为近中部着丝点染色体(sm),其它7对染色体为中部着丝点染色体(m),核型公式为2n=2×=18=14m+4sm。
染色体相对长度由染色体长度与染色体组总长度的比值乘以100%求得,相对长度变化范围为8.40~14.19;用长臂/短臂求得臂比值,臂比值变化于1.28~1.72,平均臂比值为1.50(表1);没有臂比值大于2的染色体,最长染色体与最短染色体的比值为1.96。
按照Stebbins(1971)提出的标准,Nau-dqp08核型属1A型,核不对称系数为59.48%。
2.2Nau-txbyw07萝卜核型分析Nau-txbyw07萝卜染色体条数及形态见图2A。
所有的染色体都为中部着丝点染色体(m),核型公式为2n=2×=18=18m。
图2B和图2C分别为Nau-txbyw07萝卜的核型模式图及核型图。
染色体相对长度为8.43~13.77,臂11423种不同皮色萝卜种质染色体核型分析Karyotype Analysis of Three types of Radish Germplasms with Different Tap-root Skin Colors表1三种供试萝卜种质染色体参数比较Table1Comparison of chromosome parameters in three different radish germplasms种质GermplasmNau-dqp08 Nau-txbyw07 Nau-chhong108染色体序号Chromosomecode No.123456789123456789123456789长臂Long arm8.127.917.206.566.296.585.965.815.047.877.587.586.467.026.185.065.345.067.347.056.957.146.756.196.525.194.96短臂Short arm6.074.664.714.984.933.984.083.843.365.905.904.215.344.214.784.493.653.376.095.665.384.574.664.473.574.193.43总长度Total length14.1912.5711.9111.5411.2210.5610.049.658.4013.7713.4811.7911.8011.2310.969.558.998.4313.4312.7112.3211.7011.4110.6610.099.388.39臂比(长臂/短臂)Arm ratio(L/S)1.351.711.591.331.281.721.471.551.511.281.221.211.331.241.261.171.471.321.211.251.291.571.461.401.831.241.45平均臂比Averagearm ratio(L/S)1.501.281.41类型Typemsmmmmsmmmmmmmmmmmmmmmmmmmsmmm相对长度(%)Relative length(%)注:sm:近中部着丝点染色体;m:中部着丝点染色体Note:sm:Submetacentric chromosome;m:Metacentric chromosome比值位于1.17~1.47,平均臂比值为1.28(表1)。
