《原电池化学电源》练习题
2022-2023高一化学下学期暑假训练6 原电池和化学电源(含解析)

原电池和化学电源1.分析如图所示的四个原电池装置,其中结论正确的是()A.①②中Mg作负极,③④中Fe作负极B.②中Mg作正极,电极反应式为6H2O+6e−=6OH−+3H2↑C.③中Fe作负极,电极反应式为Fe-3e−=Fe3+D.④中Cu作正极,电极反应式为2H++2e−=H2↑2.如图是铜锌原电池示意图。
当该原电池工作时,电解质溶液为稀硫酸。
下列描述不正确的是()A.溶液逐渐变蓝B.锌片逐渐溶解C.铜片上有气泡产生D.电流计指针发生偏转1.下列烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是()A. B.C. D.2.把金属X放入盐Y(NO3)2的溶液中,发生如下反应:X+Y2+=X2++Y,以下叙述正确的是()A.常温下金属X一定能与水反应,Y一定不能与水反应B.X与Y用导线连接后放入CCl4中,一定形成原电池C.X、Y用导线连接后放入Y(NO3)2的溶液中,一定有电流产生D.由X与Y做电极形成的原电池中,X一定是负极,Y一定是正极3.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s),下列说法错误的是()A.电池工作时,锌失去电子,发生还原反应B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e−=Mn2O3(s)+2OH−(aq)C.电池工作时,氢氧化钾电解质溶液中OH−移向负极D.外电路中每通过0.4mol电子,锌的质量理论上减小13g4.氢氧燃料电池用于航天飞船,电极反应产生的水经冷凝后可作为航天员的饮用水,其电极反应为:负极:2H2+4OH−-4e−=4H2O;正极:O2+2H2O+4e−=4OH−。
当得到3.6L饮用水时,电池内转移的电子的物质的量约为()A.3.6molB.400molC.200molD.800mol5.为将反应2Al+6H+=2Al3++3H2↑的化学能转化为电能,下列装置能达到目的的是(铝条均已除去了氧化膜)()A.B.C.D.6.人造地球卫星上使用的一种高能电池(银锌蓄电池),其电池的电极反应式为:Zn+2OH−-2e−=ZnO+H2O,Ag2O+H2O+2e−=2Ag+2OH−。
高三化学一轮复习【原电池 化学电源 】练习题

高三化学一轮复习原电池 化学电源一、选择题(每题2分)1.下列能量转化过程与氧化还原反应无关的是( ) A .硅太阳能电池工作时,光能转化成电能 B .锂离子电池放电时,化学能转化成电能 C .电解质溶液导电时,电能转化成化学能D .葡萄糖为人类生命活动提供能量时,化学能转化成热能2.一种熔融碳酸盐燃料电池原理示意如图。
下列有关该电池的说法正确的是( )A .反应CH 4+H 2O =====催化剂△3H 2+CO ,每消耗1 mol CH 4转移12 mol 电子 B .电极A 上H 2参与的电极反应为H 2+2OH --2e -===2H 2OC .电池工作时,CO 2-3向电极B 移动D .电极B 上发生的电极反应为O 2+2CO 2+4e -===2CO 2-3K]3.在固态金属氧化物电解池中,高温共电解H 2O-CO 2混合气体制备H 2和CO 是一种新的能源利用方式,基本原理如图所示。
下列说法不正确的是( )A .X 是电源的负极B .阴极的电极反应式是H 2O +2e -===H 2+O 2-、CO 2+2e -===CO +O 2-C .总反应可表示为H 2O +CO 2=====通电H 2+CO +O 2 D .阴、阳两极生成的气体的物质的量之比是1∶14.全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a 常用掺有石墨烯的S 8材料,电池反应为:16Li+xS 8=8Li 2S x (2≤x≤8)。
下列说法错误的是( )A .电池工作时,正极可发生反应:2Li 2S 6+2Li ++2e -=3Li 2S 4B .电池工作时,外电路中流过0.02 mol 电子,负极材料减重0.14 gC .石墨烯的作用主要是提高电极a 的导电性D .电池充电时间越长,电池中Li 2S 2的量越多5.X 、Y 、Z 、M 、N 代表五种金属,有以下反应:①Y 与M 用导线连接放入稀硫酸中,M 上冒气泡;②M 、N 为电极,与N 的盐溶液组成原电池,电子从M 极流出,经过外电路,流入N 极; ③Z +2H 2O(冷水)===Z(OH)2+H 2↑;④水溶液中,X +Y 2+===X 2++Y 。
2020年高考人教版化学:原电池 化学电源 练习题(含答案)

2020年高考人教版化学:原电池化学电源练习题一、选择题1、可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH 溶液为电解质溶液,铝合金为负极,空气电极为正极。
下列说法正确的是( )A.以NaCl溶液或NaOH溶液为电解质溶液时,正极反应都为O2+2H2O+4e-===4OH-B.以NaOH溶液为电解质溶液时,负极反应为Al+3OH--3e-===Al(OH)3↓C.以NaOH溶液为电解质溶液时,电池在工作过程中电解质溶液的pH保持不变D.电池工作时,电子通过外电路从正极流向负极解析:选A 正极O2得电子,溶液显碱性或中性时,正极反应都为O2+2H2O+4e-===4OH-,A项正确;铝作负极,在碱性溶液(NaOH)中的负极反应为Al+4OH--3e-===AlO-2+2H2O,B项错误;在碱性电解质溶液中总的电池反应式为4Al+3O2+4OH-===4AlO-2+2H2O,溶液pH降低,C项错误;电池工作时,电子从负极流向正极,D项错误。
2.原电池中,B极逐渐变粗,A极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )A.A是Zn,B是Cu,C为稀硫酸B.A是Cu,B是Zn,C为稀硫酸C.A是Fe,B是Ag,C为稀AgNO3溶液D.A是Ag,B是Fe,C为稀AgNO3溶液解析:选C 在原电池中,一般活泼金属作负极,失去电子发生氧化反应(金属被氧化)而逐渐溶解(或质量减轻);不活泼金属(或导电的非金属)作正极,发生还原反应有金属析出(质量增加)或有气体放出;依据题意可知A为负极、B为正极,即活泼性A大于B,且A 能从电解质溶液中置换出金属单质。
所以,只有C选项符合题意。
3.将反应2Fe3++2I-=2Fe2++I2设计成如图所示的原电池。
下列说法不正确的是( )A.盐桥中的K+移向FeCl3溶液B.反应开始时,乙中石墨电极上发生氧化反应C.电流计读数为零时,反应达到化学平衡状态D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极解析:选D A项,甲池中石墨电极为正极,乙池中石墨电极为负极,盐桥中阳离子向正极移动,所以向FeCl3溶液迁移,正确;B项,反应开始时,乙中I-失去电子,发生氧化反应,正确;C项,当电流计为零时,说明没有电子发生转移,反应达到平衡,正确;D项,当加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,作为负极,而乙中石墨成为正极,错误。
《原电池+化学电源》练习题
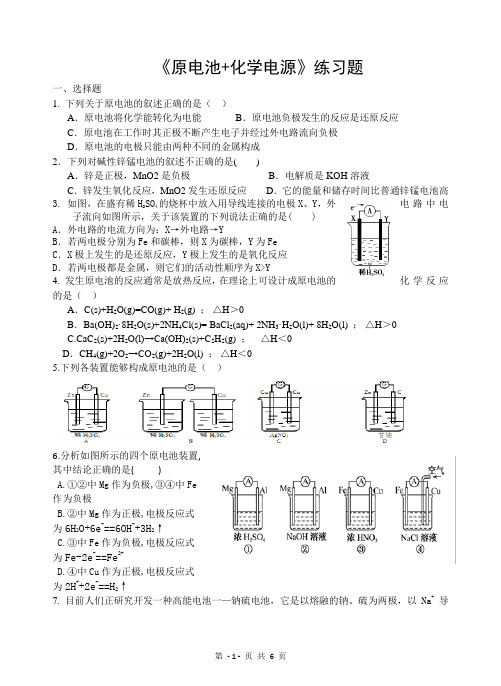
《原电池+化学电源》练习题一、选择题1. 下列关于原电池的叙述正确的是()A.原电池将化学能转化为电能B.原电池负极发生的反应是还原反应C.原电池在工作时其正极不断产生电子并经过外电路流向负极D.原电池的电极只能由两种不同的金属构成2.下列对碱性锌锰电池的叙述不正确的是()A.锌是正极,MnO2是负极B.电解质是KOH溶液C.锌发生氧化反应,MnO2发生还原反应D.它的能量和储存时间比普通锌锰电池高3. 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )A.外电路的电流方向为:X→外电路→YB.若两电极分别为Fe和碳棒,则X为碳棒,Y为FeC.X极上发生的是还原反应,Y极上发生的是氧化反应D.若两电极都是金属,则它们的活动性顺序为X>Y4. 发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应的是()A.C(s)+H2O(g)=CO(g)+ H2(g) ;△H>0B.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(aq)+ 2NH3·H2O(l)+ 8H2O(l) ;△H>0C.CaC2(s)+2H2O(l)→Ca(OH)2(s)+C2H2(g) ;△H<0D.CH4(g)+2O2→CO2(g)+2H2O(l) ;△H<05.下列各装置能够构成原电池的是()6.分析如图所示的四个原电池装置,其中结论正确的是( )A.①②中Mg作为负极,③④中Fe作为负极B.②中Mg作为正极,电极反应式为6H2O+6e-==6OH-+3H2↑C.③中Fe作为负极,电极反应式为Fe-2e-==Fe2+D.④中Cu作为正极,电极反应式为2H++2e-==H2↑7. 目前人们正研究开发一种高能电池一—钠硫电池,它是以熔融的钠、硫为两极,以Na+导电的β,,——Al2O3陶瓷作固体电解质,反应如下:2Na+x S Na2S x,以下说法,正确的是( )A.放电时,钠作正极,硫作负极B.放电时,钠极发生还原反应C.充电时,钠极与外电源正极相连,硫极与外电源的负极相连D.充电时,阳极发生的反应是S x2--2e-= x S8. X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为电池的负极。
人教高中化学考点规范练17 原电池 化学电源(含答案)

考点规范练17原电池化学电源一、选择题1.在如图所示的装置中,a是金属活动性顺序中氢前的金属(K、Ca、Na除外),b为石墨棒,关于此装置的各种叙述不正确的是()。
A.石墨棒上有气体放出,溶液的pH变大B.a是正极,b是负极C.导线中有电子流动,电子从a极经导线流向b极D.a极上发生了氧化反应2.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,其中NH3被氧化为常见无毒物质。
下列说法错误的是()。
A.溶液中OH-向电极a移动B.电极b上发生还原反应C.负极的电极反应式为2NH3+6OH--6e-N2+6H2OD.理论上反应消耗的NH3与O2的物质的量之比为3∶43.如图为利用电化学方法处理有机废水的原理示意图。
下列说法正确的是()。
A.a、b极不能使用同种电极材料B.工作时,a极的电势低于b极的电势C.工作一段时间之后,a极区溶液的pH增大D.b极的电极反应式为CH3COO-+4H2O-8e-2HC O3-+9H+4.一种太阳能电池的工作原理如图所示,电解质为铁氰化钾和亚铁氰化钾的混合溶液,下列说法不正确的是()。
A.K+移向催化剂bB.催化剂a表面发生的化学反应:[Fe(CN)6]4--e-[Fe(CN)6]3-C.[Fe(CN)6]3-在催化剂b表面被氧化D.电解质溶液中的[Fe(CN)6]4-和[Fe(CN)6]3-的浓度基本保持不变5.如图是一种锂钒氧化物热电池装置,电池总反应为x Li+LiV3O8Li1+x V3O8。
工作时,需先引发铁与氯酸钾反应使共晶盐熔化,下列说法不正确的是()。
A.组装该电池应当在无水、无氧的条件下进行B.整个过程的能量转化涉及化学能转化为热能和电能C.放电时LiV3O8电极反应为x Li++LiV3O8-x e-Li1+x V3O8D.充电时Cl-移向LiV3O8电极6.科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。
原电池(化学电源)训练带答案.doc

负极: _________________总反应方程式(离子方程原电池(化学电源)训练班级 ______________ 姓名 _____________________1、分析下图所示的四个原电池装置,其中结论正确的是()A. ①②中Mg 作负极,③④中Fe 作负极B.②中Mg 作正极,电极反应式为6比0+6e 「=60IT+3H 昇 C.③中Fe 作负极,电极反应式为Fe — 2e 「=Fe 2+ D. ④中Cu 作正极,电极反应式为2H++2e 「=l {昇2、如图所示为某原电池的结构示意图,下列说法不正确的是(盐桥中装满用饱和KC1溶 液和琼胶做成的冻胶)() A. 该原电池的总反应式为2Fe 3++Cu^2Fe 2++Cu 2+B. 该电池工作时,Cu”在电极上得到电子,发生还原反应C. 若用此电池电解饱和氯化钠溶液制取C1”当铜电极的质量减少6.4 g 时,产生氯气的体积为2. 24 L (折算为标准状况)D. 电池工作过程中,电子由铜电极经过电流表流向石墨电极3、甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由 甲醇、空气(氧气)、KOH (电解质溶液)构成。
电池的总反应式为2CH 3OH+3O 2+4OH"=2CO3"+6H 20=则下列说法正确的是()A. 电池放电时通入空气的电极为负极B. 电池放电时负极的电极反应式为CH3OH-6e _+H 2O=CO 2 t +6H +C. 由于CO 訂水解显碱性,电池放电时,电解质溶液的pH 逐渐增大D. 电池放电时每消耗1 mol CHsOH 转移6 mol 电子4、伏打电池:(负极 --- Zn 、正极 ---- C u 、电解液 --- H2SO4)______ 正极: _______________________________ Zn + 2H + =H 2 t + Zn 2+ 5、 碱性锌猛干电池:(负极一一Zn 、正极——C 、电解液KOH 、MnO?的糊状物) 负极: ______________________________ 正极: _________________________________ 化学方程式 Zn +MnO 2 +H 20 =ZnO + Mn (0H )26、 银锌电池:(负极 -- Zn 、正极 ---- A gzO 、电解液NaOH )负极: _______________________________ 正极: _________________________________ 化学方程式 Zn + Ag 2O + H 20 = Zn (0H )2 + 2Ag7、 铅蓄电池:(负极 -- Pb 正极------ P b02电解液 ----- 浓硫酸)总化学方程式 Pb+Pb02 + 2H 2S04=ff^2PbS04+2H 20^B H 2SO 4 ① ZaOH 溶液 ② 浓 HZ 。
作业二十一原电池化学电源

原电池化学电源(建议用时40分钟)1.下图为一原电池装置,下列叙述中正确的是( )①铜离子在铜片表面被还原②盐桥中的K+移向ZnSO4溶液③电流从锌片经导线流向铜片④铜是正极,铜片上有气泡产生⑤正极反应为Cu2++2e-===Cu⑥实验过程中取出盐桥,原电池仍继续工作⑦将锌片浸入CuSO4溶液中发生的化学反应与该原电池反应相同A.①⑤⑦B.①③④C.②⑤⑦D.④⑥⑦【解析】选A。
该原电池中,较活泼的金属锌作负极,发生氧化反应,较不活泼的铜作正极,发生还原反应,电子由负极锌流出,经导线流向铜电极(电流的方向与之相反),负极、正极的反应分别为负极:Zn-2e-===Zn2+,正极:Cu2++2e-===Cu;盐桥中的阳离子向正极区硫酸铜溶液中迁移,故①、⑤正确,②、③、④错误;取出盐桥后不能构成闭合回路,原电池不能继续工作,⑥错误;无论是否为原电池,反应实质相同,均为氧化还原反应,⑦正确。
2.如图所示是几种常见的化学电源示意图,有关说法正确的是( )A.上述电池分别属于一次电池、二次电池和燃料电池B.干电池工作时,H+向锌筒移动C.铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207 gD.氢氧燃料电池的正极反应一定是O2+4e-+2H2O===4OH-【解析】选A。
干电池工作时,石墨为正极,锌筒为负极,电子从锌筒沿导线流向石墨,H+在NH4Cl溶液中由锌筒一端流向石墨一端,B错误;铅蓄电池工作过程中,硫酸铅在负极上析出,该极质量应该增加而非减小,C错误;若电解质溶液为酸性溶液,则氢氧燃料电池的正极反应是O2+4e-+4H+===2H2O,D错误。
3.由我国科学家研发成功的铝锰电池是一种比能量很高的新型干电池,以氯化钠和稀氨水混合溶液为电解质,铝和二氧化锰石墨为两极,其电池反应为Al+3MnO2+3H2O===3MnO(OH)+Al(OH)3。
下列有关该电池放电时的说法不正确的是( )A.二氧化锰石墨为电池正极B.负极反应式为Al-3e-+3NH3·H2O===Al(OH)3+3NH+4C.OH-不断由正极向负极移动D.每生成1 mol MnO(OH)转移2 mol电子【解析】选D。
高考化学一轮复习6.2原电池化学电源练习(含解析)

原电池化学电源1.依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如图所示。
下列有关说法中错误的是( )A.电解质溶液Y是CuSO4溶液B.电极X的材料是CuC.银电极为电池的正极,其电极反应为Ag++e-===AgD.外电路中的电子是从X电极流向Ag电极【答案】A【解析】由电极反应可知,电解质溶液应为AgNO3溶液而不是CuSO4溶液。
2.一定条件下,碳钢腐蚀与溶液pH的关系如下:下列说法不正确的是( )A.在pH<4溶液中,碳钢主要发生析氢腐蚀B.在pH>6溶液中,碳钢主要发生吸氧腐蚀C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-===2H2OD.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓【答案】C【解析】 A项,酸性较强条件下,碳钢主要发生析氢腐蚀,正确;B项,在pH>6的溶液中,酸性较弱,主要发生吸氧腐蚀,正确;C项,碳钢腐蚀的正极反应为O2+2H2O+4e-===4OH-,错误;D项,除O2后,腐蚀速率减缓,正确。
3.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。
①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。
据此判断这四种金属活动性由强到弱的顺序是( )A.①③②④B.①③④②C.③④②① D.③①②④【答案】B【解析】①②相连时,外电路电流从②流向①,说明①为负极;①③相连时,①为负极;②④相连时,②上有气泡,说明④为负极;③④相连时,③的质量减少,说明③为负极。
综上所述可知,这四种金属活动性由强到弱的顺序为①③④②,【答案】项B正确。
4.铅蓄电池的示意图如图所示。
下列说法正确的是( )A.放电时,N为负极,其电极反应式为:PbO2+SO2-4+4H++2e-===PbSO4+2H2OB.放电时,c(H2SO4)不变,两极的质量增加C.充电时,阳极反应式为:PbSO4+2e-===Pb+SO2-4D.充电时,若N连电源正极,则该极生成PbO2【答案】D【解析】放电时,是原电池,M作负极,电极反应式为Pb+SO2-4-2e-===PbSO4,A不正确;放电时,正负极均消耗硫酸,c(H2SO4)减小,B不正确;充电时阳极发生氧化反应,电极反应式为PbSO4-2e-+2H2O===PbO2+SO2-4+4H+,C不正确;充电时,若N连电源正极,则该极为阳极,电极反应产物为PbO2,D正确。
高考化学二轮专题提分训练:原电池——化学电源(含详解)

原电池化学电源一、选择题 ( 此题包含10 小题 , 每题 6 分, 共 60 分)1. 依照氧化复原反响:2Ag +(aq)+Cu(s)====Cu 2+(aq)+2Ag(s),设计的原电池以下图。
以下相关说法中错误的选项是()A. 电解质溶液Y 是 CuSO4溶液B. 电极 X 的资料是CuC. 银电极为电池的正极, 其电极反响为Ag++e- ====AgD. 外电路中的电子是从X 电极流向Ag 电极2.(2014 ·银川模拟 ) 对于以下图①、②两个装置的表达评论正确的选项是()选项叙述评论A装置名称 : ①是电解池 , ②是原电池错误B硫酸浓度变化 : ①增大 , ②减小正确电极反响式 :C①中阳极 :4OH- -4e - ====2HO+O2↑正确②中正极 :Zn-2e - ====Zn2++离子挪动方向 : ①中 H 向阴极方向挪动D错误②中 H+向正极方向挪动3.(2014 ·厦门模拟 ) 控制合适的条件 , 将反响Fe3++Ag Fe2+ +Ag+设计成以下图的原电池(盐桥装有琼脂—硝酸钾溶液; 敏捷电流计的0 刻度居中 , 左右均有刻度) 。
已知接通后察看到电流计指针向右偏转。
以下判断正确的选项是()A. 在外电路中 , 电子从石墨电极流向银电极B. 盐桥中的K+移向乙烧杯C. 一段时间后 , 电流计指针反向偏转, 超出 0 刻度 , 向左侧偏转D. 电流计指针居中后, 往甲烧杯中加入必定量的铁粉, 电流计指针将向左偏转4.(2013 ·兰州模拟 ) 新式 LiFePO4可充电锂离子动力电池以其独到的优势成为绿色能源的新宠。
已知该电池放电时的电极反响为正极:FePO4+Li ++e- ====LiFePO4, 负极 :Li-e- ====Li+。
以下说法中正确的是()A. 充电时动力电池上标明“+”的电极应与外接电源的正极相连B. 放电时电池反响为FePO4+Li ++e- ====LiFePO4C. 放电时电池内部Li +向负极挪动D. 放电时 , 在正极上Li +得电子被复原5.(2014 ·唐山模拟 ) 工业上常将铬镀在其余金属表面, 同铁、镍构成各样性质的不锈钢, 在以下图装置中 , 察看到图 1 装置铜电极上产生大批的无色气泡, 而图 2 装置中铜电极上无气体产生, 铬电极上产生大批有色气体, 则以下表达正确的选项是()A. 图 1 为原电池装置,Cu 电极上产生的是O2B. 图 2 装置中 Cu电极上发生的电极反响式为Cu-2e - ====Cu2+C. 由实验现象可知: 金属活动性Cu>CrD. 两个装置中 , 电子均由Cr 电极流向Cu 电极6. 以下图装置可用来监测空气中NO的含量 , 以下说法错误的选项是()A. 外电路中电流由Pt 电极流向 NiO 电极B.Pt 电极上发生的是复原反响2--====NO2C.NiO 电极的电极反响式为 NO+O-2eD. 每流经 1 m3空气 ( 假定 NO被完整汲取 ), 转移电子的物质的量为2× 10-7 mol, 则该空气中 NO的含量约为 3× 10-2-3 mg· m7.(2014 ·长春模拟 ) 获取“ 863”计划和中科院“百人计划”支持的环境友善型铝碘电池已研制成功 , 电解液为 AlI3溶液 , 已知电池总反响为2Al+3I ====2AlI。
原电池 化学电源练习题

原电池、化学电源练习题1.下列说法正确的是( )A .原电池是把电能转化为化学能的装置B .原电池中电子流出的一极是正极发生氧化反应C .原电池的两极发生的反应均为氧化还原反应D .形成原电池后,原电池中的阳离子向正极移动2.下列关于实验现象的描述不正确的是( )A .把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡B .用铜板和锌板紧靠在一起浸入硫酸铜溶液,负极铜板质量增加C .把铜片插入三氯化铁溶液中,在铜片表面出现一层铁D .把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快。
3. 下列有关化学电池的说法不正确的是 ( )A. 化学电池是将化学能变成电能的装置B. 一次电池的活性物质消耗到一定程度就不能使用了C. 二次电池又称充电电池或蓄电池,放电后可以再充电,故可多次重复使用D. 燃料电池是将燃料燃烧所放出的能量转化为化学能装置4.白铁皮(镀锌铁皮)发生析氢腐蚀,若有0.2摩电子转移,下列说法不正确的是( )A.有6.5克锌被腐蚀B.2.8克铁被腐蚀C.正极上H +被还原D.在标准状况下有2.24升气体放出5.把A 、B 、C 、D 四块金属泡在稀H 2SO 4中,用导线两两相连可以组成各种原电池。
若A 、B 相连时,A 为负极;C 、D 相连,D 上有气泡逸出;A 、C 相连时A 极减轻;B 、D 相连,B 为正极。
则四种金属的活泼性顺序由大到小排列为( )A. A >B >C >DB. A >C >B >DC. A >C >D >BD. B >D >C >A6.将等质量的两份锌粉a 和b ,分别加入两个盛过量的稀硫酸的烧杯中,并向加入a 的烧杯中再加入少量CuO 粉末。
下列各图表示氢气体积V (H 2)与反应时间t 的关系,其中正确的是 ( )7.X 、Y 两根金属棒插入Z 溶液中构成如下图的装置,实验中电流表指针发生偏转,同时X 棒变粗,Y 棒变细,则X 、Y 、Z 可能是下列中的 ( ) 8.科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机酸转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。
原电池化学电源

原电池化学电源第二节原电池化学电源一、选择题(每小题6分,共60分)1.金属M和N可构成如图所示的装置。
下列分析正确的是(A)A.金属活泼性:N>MB.M逐渐溶解C.负极反应为2H++2e-H2↑D.S错误!未找到引用源。
向M极定向移动【解析】在原电池中电流方向和电子流动方向恰好相反,所以此电池中电子从N极流出,即N极为负极,金属活泼性:N>M,N极逐渐溶解,S 错误!未找到引用源。
向N极定向移动。
综上,A项正确。
2.下列关于化学电源的说法不正确的是(B)A.可以根据硫酸密度的大小来判断铅蓄电池是否需要充电B.燃料电池是利用燃料和氧化剂之间的氧化还原反应,将化学能转化为热能,然后再转化为电能的化学电源C.普通锌锰干电池中,发生氧化还原反应的物质大部分被消耗后,就不能再使用了D.由Ag2O和Zn形成的碱性银锌纽扣电池,发生电化学反应时,Zn 作为负极【解析】A项,铅蓄电池的反应式为Pb+PbO2+4H++2S错误!未找到引用源。
2PbSO4+2H2O,放电时硫酸参与反应生成水,正确;B项,原电池是将化学能转化为电能的装置,错误;C项,普通锌锰干电池为一次性电池,正确;D项,原电池中,易失电子的金属作负极,该原电池中,Zn易失电子而作负极,正确。
3.如图,石墨Ⅰ电极生成的Y是氧化物,下列有关说法错误的是(A)A.负载中电子流向为石墨Ⅱ极流向石墨Ⅰ极B.石墨Ⅰ极的电极反应式为NO2+N错误!未找到引用源。
-e-N2O5C.电池中N错误!未找到引用源。
向石墨Ⅰ极移动D.该装置工作时化学能转化为电能【解析】A项,由题意知石墨Ⅰ极是负极,电子由石墨Ⅰ极流向石墨Ⅱ极,错误;B项,Ⅰ电极是负极,发生氧化反应,NO2中N元素化合价升高,正确;C项,原电池中阴离子向负极移动,即N错误!未找到引用源。
向石墨Ⅰ极移动,正确;D项,原电池中化学能转化为电能,正确。
4.根据如图,下列判断中正确的是(D)A.向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成B.烧杯a中发生反应O2+4H++4e-2H2O,溶液pH降低C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极D.烧杯b中发生反应Zn-2e-Zn2+【解析】该电池中,Zn失去电子生成Zn2+,电子流向铁表面,通入的O2得电子生成OH-。
高中化学原电池、化学电源练习题

高中化学原电池、化学电源练习题1.某兴趣小组设计的简易原电池装置如图所示。
该电池工作时,下列说法正确的是( )A.锌片作正极B.铜片上有气泡产生C.将电能转化为化学能D.电子由铜片经导线流向锌片解析:选B 根据原电池的工作原理,活泼金属作负极,锌比铜活泼,锌片作负极,A 错误;铜片作正极,电极反应式为2H++2e-===H2↑,铜片上有气泡冒出,B正确;该装置为原电池装置,是将化学能转化成电能的装置,C错误;根据原电池的工作原理,电子从负极经导线流向正极,即电子从锌片经导线流向铜片,D错误。
2.(2016·上海高考)图1是铜锌原电池示意图。
图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )A.铜棒的质量B.c(Zn2+)C.c(H+) D.c(SO2-4)解析:选C 该装置构成原电池,Zn是负极,Cu是正极。
A项,在正极Cu上溶液中的H+获得电子变为氢气,Cu棒的质量不变,错误;B项,由于Zn是负极,不断发生反应Zn-2e-===Zn2+,所以溶液中c(Zn2+)增大,错误;C项,由于反应不断消耗H+,所以溶液的c(H +)逐渐降低,正确;D项,SO2-4不参加反应,其浓度不变,错误。
3.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。
下列说法中正确的是( )A.①②中Mg作负极,③④中Fe作负极B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+D.④中Cu作正极,电极反应式为2H++2e-===H2↑解析:选B ①中Mg作负极;②中Al作负极;③中铜作负极;④是铁的吸氧腐蚀,Cu 作正极,电极反应式为O2+2H2O+4e-===4OH-。
4.如图所示为锌铜原电池。
下列叙述中,正确的是( )A.盐桥的作用是传导离子B.外电路电子由铜片流向锌片C.锌片上的电极反应式为Zn2++2e-===ZnD.外电路中有0.2 mol电子通过时,铜片表面质量增加约3.2 g解析:选A “双液”原电池中,盐桥连接左、右两个烧杯中的溶液,传导离子,起到导电作用,A正确;锌的活泼性强于铜,则锌片作负极,铜片作正极;在外电路中,电子由负极流向正极,则电子由锌片流向铜片,B错误;锌片是负极,发生失去电子的氧化反应,电极反应式为Zn-2e-===Zn2+,C错误;铜片是正极,电极反应式为Cu2++2e-===Cu,外电路中通过0.2 mol电子时,铜片上析出0.1 mol Cu,其质量为0.1 mol×64 g·mol-1=6.4 g,D错误。
原电池 化学电源 电化学 经典习题及解析

原电池化学电源题组一原电池工作原理的考查1.下列装置中能构成原电池产生电流的是()答案 B解析A项,电极相同不能构成原电池;C项,酒精不是电解质溶液,不能构成原电池;D项,锌与电解质溶液不反应,无电流产生。
2.有关电化学知识的描述正确的是() A.CaO+H2O===Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液C.原电池的两极一定是由活动性不同的两种金属组成D.理论上说,任何能自发进行的氧化还原反应都可设计成原电池答案 D解析CaO+H2O===Ca(OH)2不是氧化还原反应,KCl和AgNO3反应生成AgCl沉淀易阻止原电池反应的发生;作电极的不一定是金属,如石墨棒也可作电极。
题组二原电池正、负极的判断3.下列有关原电池的说法中正确的是() A.在内电路中,电子由正极流向负极B.在原电池中,相对较活泼的金属作负极,不活泼的金属作正极C.原电池工作时,正极表面一定有气泡产生D.原电池工作时,可能会伴随着热能变化答案 D解析A项,内电路中不存在电子的移动;B项,若是由铝、镁、氢氧化钠溶液构成的原电池,则负极是铝;C项,若是由锌、铜、硫酸铜溶液构成的原电池,则正极表面析出铜,没有气泡产生。
4.分析下图所示的四个原电池装置,其中结论正确的是()A.①②中Mg作负极,③④中Fe作负极B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑C.③中Fe作负极,电极反应式为Fe-2e-===Fe2+D.④中Cu作正极,电极反应式为2H++2e-===H2↑答案 B解析②中Mg不与NaOH溶液反应,而Al能和NaOH溶液反应失去电子,故Al是负极;③中Fe在浓硝酸中易钝化,Cu和浓HNO3反应失去电子作负极,A错,C错。
②中电池总反应为2Al +2NaOH+2H2O===2NaAlO2+3H2↑,负极电极反应式为2Al+8OH--6e-===2AlO-2+4H2O,二者相减得到正极电极反应式为6H2O+6e-===6OH-+3H2↑,B正确。
原电池 化学电源(高一)练习及答案

原电池化学电源一、选择题1、(2015·成都模拟)金属M和N可构成如图所示的装置。
下列分析正确的是()A、金属活泼性:N>MB、M逐渐溶解C、负极反应为2H++2e-=== H2↑D、SO-24向M极定向移动2、下列关于化学电源的说法不正确的是()A、可以根据硫酸密度的大小来判断铅蓄电池是否需要充电B、燃料电池是利用燃料和氧化剂之间的氧化还原反应,将化学能转化为热能,然后再转化为电能的化学电源C、普通锌锰干电池中,发生氧化还原反应的物质大部分被消耗后,就不能再使用了D、由Ag2O和Zn形成的碱性银锌纽扣电池,发生电化学反应时,Zn作为负极3、(2015·江苏泰州三中月考)如图,石墨Ⅰ电极生成的Y是氧化物,下列有关说法错误的是()A、负载中电子流向为石墨Ⅱ极流向石墨Ⅰ极B、石墨Ⅰ极的电极反应式为NO2+NO-3-e-=== N2O5C、电池中NO-3向石墨Ⅰ极移动D、该装置工作时化学能转化为电能4、(2015·河北衡水中学调研)根据如图,下列判断中正确的是()A、向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成B、烧杯a中发生反应O2+4H++4e-=== 2H2O,溶液pH降低C、电子从Zn极流出,流入Fe极,经盐桥回到Zn极D、烧杯b中发生反应为Zn-2e-=== Zn2+5、(2015·南昌调研)普通水泥在固化过程中自由水分子减少,并产生Ca(OH)2,溶液呈碱性。
根据这一特点,科学家发明了电动势(E)法测水泥初凝时间,此法原理如图所示。
反应总方程式为2Cu+Ag2O Cu2O+2Ag。
下列有关说法不正确的是()A、工业上制备水泥的原料有黏土、石灰石、石膏B、测量原理装置图中Ag2O/Ag极发生还原反应C、负极的电极反应式为2Cu+H2O-2e-=== Cu2O+2H+D、在水泥固化过程中,由于自由水分子的减少,溶液中各离子浓度的变化导致电动势变化6、美国圣路易斯大学研制新型的乙醇燃料电池,用质子(H+)溶剂,在200 ℃左右供电。
原电池 化学电源(练习题)

原电池 化学电源(练习题)1.有A 、B 、C 、D 四种金属,当A 、B 组成原电池时,电子流动方向A →B ;当A 、D 组成原电池时,A 为正极;B 与E 构成原电池时,电极反应式为:E 2-+2e -=E ,B-2e -=B 2+则A 、B 、D 、E 金属性由强到弱的顺序为( )A .A ﹥B ﹥E ﹥D B .A ﹥B ﹥D ﹥EC .D ﹥E ﹥A ﹥B D .D ﹥A ﹥B ﹥E2.下列事实能说明Al 的金属活动性比Cu 强的是 ( )A . 常温下将铝和铜用导线连接组成原电池放入到氢氧化钠溶液中B . 常温下将铝和铜用导线连接组成原电池放入到稀盐酸溶液中C . 与氯气反应时,铝失去3个电子,而铜失去2个电子D . 常温下,铝在浓硝酸中钝化而铜不发生钝化3.锌银电池广泛用作各种电子仪器的电源,它的充放电过程可以表示为:2Ag +Zn(OH)2 Ag 2O +Zn +H 2O此电池放电时,被氧化的物质是 ( )A. AgB. Zn(OH)2C. Ag 2OD. Zn4.某原电池总反应的离子方程式为:Fe+2Fe 3+=3Fe 2+,不能实现该反应的原电池为( )A .正极为Cu ,负极为Fe ,电解质溶液为FeCl 3B .正极为C ,负极为Fe ,电解质溶液为Fe(N03)3C .正极为Fe ,负极为Zn ,电解质溶液为Fe 2(SO 4)3D .正极为Ag ,负极为Fe ,电解质溶液为CuSO 45.设想通过原电池反应以H 2和Cl 2为原料生产盐酸。
关于这种原电池的设想正确的是( )A .正极反应为H 2-2e -=2H +B .在电池工作时,H +移向负极C .电池正极发生氧化反应D .以盐酸作为电解质,并不断补充蒸馏水,以维持溶液一定的pH6.燃料电池是一种新型电池,它主要是利用燃料在燃烧过程中把化学能直接转化为电能。
氢氧燃料电池的基本反应是:X 极:21O 2(g)+H 2O(l)+2e -=== 2OH - Y 极:H 2(g)+2OH -=== 2H 2O(l)+2e -下列判断正确的是 ( )A .X 是正极B .Y 是正极C .Y 极发生还原反应D .Y 极发生氧化反应7.日常所用的干电池的电极分别为碳棒和锌皮,以糊状NH 4Cl 和ZnCl 2作电解质(其中加 充电 放电入MnO2氧化吸收H2), 电极反应可简化为:Zn-2e-==Zn2+;2NH4++2e-=NH3+H2,根据上述叙述判断下列说法正确的是()A. 干电池中锌为正极,碳为负极B. 干电池工作时,电子由锌极经外电路流向碳极C. 干电池长时间连续工作时,内装糊状物可能流出腐蚀用电器D. 干电池可实现化学能向电能的转化和电能向化学能的转化8.汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据此反应判断下列叙述正确的是()A.PbO2为电池的负极B.负极的电极反应式为:Pb+SO42——2e—= PbSO4 C.PbO2得电子,被氧化D.电池放电时,溶液酸性增强9.以Mg片和Al片为电极,并用导线连接,同时插入NaOH溶液中,下列说法正确的是A.Mg片作负极,电极反应:Mg-2e-=Mg2+B.Al片作负极,电极反应:Al+4OH--3e-=AlO2-+2H2OC.电子从Mg电极沿导线流向Al电极D.Mg片上有气泡产生10.锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时,LiCoO2中Li被氧化,Li+迁移并以原子嵌入电池负极材料碳(C6)中,以LiC6表示。
原电池 化学电源

第二节 化学反应与能量的变化一、选择题(每小题4分,共48分)1.下列有关电池的说法不正确的是 ( )A .手机上用的锂离子电池属于二次电池B .铜锌原电池工作时,电子沿外电路从铜电极流向锌电极C.甲醇燃料电池可把化学能转化为电能D .锌锰干电池中,锌电极是负极解析:锂离子电池可以充电后再次使用,属于二次电池,A 项正确;铜锌原电池中铜为 正极,故外电路中电流为铜流向锌,而电子是由锌流向铜,B 项错;电池的实质即是化 学能转化成电能,C 项正确;Zn 失去电子生成Zn 2+,故作为负极,D 项正确。
答案:B2.(2011·聊城模拟)在如图所示的8个装置中,属于原电池的是 ( )A .①④B .③④⑤C .④⑧D .②④⑥⑦解析:根据原电池的构成条件可知:①中一个电极,③中两电极材料相同,⑤中酒精不 是电解质,⑧中两电极材料相同且无闭合回路,故①③⑤⑧均不能构成原电池。
答案:D3.(2011·济南调研)将纯锌片和纯铜片按如图所示方式插入同浓度的稀硫酸中一段时间,以 下叙述正确的是( )A .两烧杯中铜片表面均无气泡产生B .甲中铜片是正极,乙中铜片是负极C .两烧杯中溶液的pH 均增大D .产生气泡的速率甲比乙慢解析:因乙杯中锌片和铜片没有接触,故不能构成原电池,A 、B 皆错;因甲烧杯中Zn 、 Cu 用导线连接后构成原电池,加快了Zn 的溶解,故D 错;又因两杯中的Zn 都能与稀H2SO4反应产生H2而消耗H+,故C正确。
答案:C4.(2011·南京模拟)关于铅蓄电池的说法正确的是() A.在放电时,正极发生的反应是Pb(s)+SO2-4(aq)-2e-―→PbSO4(s)B.在放电时,该电池的负极材料是铅板C.在充电时,电池中硫酸的浓度不断变小D.在充电时,阳极发生的反应是PbSO4(s)+2e-―→Pb(s)+SO2-4(aq)解析:A项中电池放电时正极应发生还原反应,电极反应为:PbO2+4H++SO2-4+2e-―→PbSO4+2H2O;C项中电池充电时硫酸的浓度应不断增大;D项中电池充电时阳极应发生PbSO4+2H2O-2e-―→PbO2+4H++SO2-4。
原电池 化学电源试题

原电池 化学电源1.课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。
下列结论错误的是( ) A .原电池是将化学能转化成电能的装置 B .原电池由电极、电解质溶液和导线等组成C .图中a 极为铝条、b 极为锌片时,导线中会产生电流D .图中a 极为锌片、b 极为铜片时,电子由铜片通过导线流向锌片 2.根据下图判断,下列说法正确的是()A .装置Ⅰ和装置Ⅱ中负极反应均是Fe -2e -===Fe 2+B .装置Ⅰ和装置Ⅱ中正极反应均是O 2+2H 2O +4e -===4OH -C .装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动D .放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH 均增大 3.如图所示是一位同学在测试水果电池,下列有关说法错误的是( )A .若金属片A 是正极,则该金属片上会产生H 2B .水果电池的化学能转化为电能C .当A 、B 分别为Zn 、Fe 金属片时,Zn 作正极D .金属片A 、B 可以一个是铜片,另一个是铁片4.有A 、B 、C 、D 、E 五块金属片,进行如下实验:①A 、B 用导线相连后,同时浸入稀H 2SO 4溶液中,A 极为负极;②C 、D 用导线相连后,同时浸入稀H 2SO 4溶液中,电流由D →导线→C ;③A 、C 相连后,同时浸入稀H 2SO 4溶液中,C 极产生大量气泡;④B 、D 相连后,同时浸入稀H 2SO 4溶液中,D 极发生氧化反应;⑤用惰性电极电解含B 离子和E 离子的溶液,E 先析出。
据此,判断五种金属的活动性顺序是 ( ) A .A>B>C>D>E B .A>C>D>B>E C .C>A>B>D>ED .B>D>C>A>E5.一种光化学电池的结构如图所示,电池总反应式为AgCl(s)+Cu +(aq)===Ag(s)+Cu 2+(aq)+Cl -(aq),下列关于该电池在工作时的说法中正确的是( )A .生成108 g 银,转移电子个数为2 molB .Cu +在负极发生氧化反应C .Ag 电极活泼,Ag 失电子发生氧化反应D .Cl -由负极迁移到正极6.甲醇(CH 3OH)是一种有毒物质,检测甲醇含量的测试仪工作原理如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《原电池+化学电源》练习题一、选择题1. 下列关于原电池的叙述正确的是()A.原电池将化学能转化为电能B.原电池负极发生的反应是还原反应C.原电池在工作时其正极不断产生电子并经过外电路流向负极D.原电池的电极只能由两种不同的金属构成2.下列对碱性锌锰电池的叙述不正确的是()A.锌是正极,MnO2是负极B.电解质是KOH溶液C.锌发生氧化反应,MnO2发生还原反应D.它的能量和储存时间比普通锌锰电池高3. 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )A.外电路的电流方向为:X→外电路→YB.若两电极分别为Fe和碳棒,则X为碳棒,Y为FeC.X极上发生的是还原反应,Y极上发生的是氧化反应D.若两电极都是金属,则它们的活动性顺序为X>Y4. 发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应的是()A.C(s)+H2O(g)=CO(g)+ H2(g) ;△H>0B.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(aq)+ 2NH3·H2O(l)+ 8H2O(l) ;△H>0(s)+2H2O(l)→Ca(OH)2(s)+C2H2(g) ;△H<0D.CH4(g)+2O2→CO2(g)+2H2O(l) ;△H<05.下列各装置能够构成原电池的是()6.分析如图所示的四个原电池装置,其中结论正确的是( )A.①②中Mg作为负极,③④中Fe作为负极B.②中Mg作为正极,电极反应式为6H2O+6e-==6OH-+3H2↑C.③中Fe作为负极,电极反应式为Fe-2e-==Fe2+D.④中Cu作为正极,电极反应式为2H++2e-==H2↑7. 目前人们正研究开发一种高能电池一—钠硫电池,它是以熔融的钠、硫为两极,以Na+导电的β,,——Al2O3陶瓷作固体电解质,反应如下:2Na+x S Na2S x,以下说法,正确的是( )A.放电时,钠作正极,硫作负极B.放电时,钠极发生还原反应C.充电时,钠极与外电源正极相连,硫极与外电源的负极相连D.充电时,阳极发生的反应是S x2--2e-= x S8. X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为电池的负极。
X、Y、Z三种金属的活动性顺序为()>Y>Z >Z>Y >X>Z >Z>X9.微型锂碘电池可用植入某些心脏病人体内的心脏起搏器所用的电源。
这种电池中的电解质是固体电解质LiI,其中的导电离子是I-。
下列有关说法正确的是()A.正极反应:2Li-2e-=2Li+B.负极反应:I2+2e-=2I-C.总反应是:2Li+I2=2LiID.金属锂作正极10.如图所示,各烧杯中均盛有海水,铁在其中被腐蚀由快到慢的顺序为()A.②①③④B.④③①②C.④②①③D.③②④①11.锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池。
某种锂电池的总反应式是Li+MnO2=LiMnO2。
下列说法正确的是()A. Li是负极,电极反应为Li-e-=Li+B. Li是正极,电极反应为Li+e-=Li-C. MnO2是负极,电极反应为MnO2+e-=MnO2-D. 锂电池是一种环保型电池12.某种氢氧燃料电池的电解液为KOH溶液.下列有关该电池的叙述不正确的是() A.正极反应式为:O2+2H2O+4e-===4OH-B.工作一段时间后,电解液中KOH的物质的量不变C.该燃料电池的总反应方程式为:2H2+O2===2H2OD.用该电池电解CuCl2溶液,产生 L Cl2(标准状况)时,有 mol 电子转移13.一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-.下列对该项燃料电池说法正确的是( ) A.在熔融电解质中,O2-移向正极B.电池总反应式是:2C4H10+13O2―→8CO2+10H2OC.通入空气的一极是正极,电极反应为:O2+4e-===2O2-D.通入丁烷的一极是正极,电极反应为:C4H10+26e-+13O2-===4CO2+5H2O14.生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是2PbSO4+2H2O 充电放电PbO2+Pb+2H2SO4下列对铅蓄电池的说法错误的是( )A.需要定期补充硫酸B.工作时铅是负极,PbO2是正极C.工作时负极上发生的反应是Pb-2e-+SO2-4===PbSO4D.工作时电解质的密度减小15.氢氧燃料电池用于航天飞机,电极反应产生的水,经冷凝后可作为航天员的饮用水,其电极反应如下:负极:2H2+4OH--4e-===4H2O正极:O2+2H2O+4e-===4OH-当得到 L饮用水时,电池内转移的电子数约为( )A. mol B. molC.100 mol D.200 mol16.最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰.电池总反应为:Zn+2MnO2+H2O===ZnO+2MnOOH.下列说法不正确的是( )A.该电池Zn为负极,MnO2为正极B.该电池的正极反应为:MnO2+e-+H2O===MnOOH+OH-C.导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向ZnD.电池工作时水分子和OH-都能通过薄层纸17.以Mg片和Al片为电极,并用导线连接,同时插入NaOH溶液中,下列说法正确的是()A、Mg片作负极,电极反应:Mg-2e-=Mg2+B、Al片作负极,电极反应:Al+4OH--3e-=AlO2-+2H2OC、电子从Mg电极沿导线流向Al电极D、Mg片上有气泡产生18.碱性电池具有容量大、放电电流大的特点,因此得到广泛应用。
锌锰电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2 MnO2(s)+H2O(l)=Zn(OH)2+Mn2O3 (s)。
下列说法错误的是( )A.电池工作时,锌失去电子B.电池负极的电极反应式为Zn-2e-+2 OH-=Zn(OH)2C.电池工作时,电子由正极通过外电路流向负极D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g19.设想通过原电池反应以H2和Cl2为原料生产盐酸。
关于这种原电池的设想正确的是()A.正极反应为H2-2e-=2H+ B.在电池工作时,H+移向负极C.电池正极发生氧化反应D.以盐酸作为电解质,并不断补充蒸馏水,以维持溶液一定的pH 20.右图是2004年批量生产的笔记本电脑所用甲醇燃料电池的结构示意图。
甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH30H+302→2C02+4H20。
下列说法正确的是A.左电极为电池的负极,a处通入的物质是甲醇B.右电极为电池的负极,b处通入的物质是空气C.负极反应式为:CH30H+H20-6e-→CO2+6H+D. 正极反应式为:02+2H20+4e-→40H—21.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压高铁电池的总反应为:Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是( )A.放电时负极反应为:Zn-2e-+2OH-==Zn(OH)2B.充电时阳极反应为:Fe(OH)3-3e -+5OH -==FeO 2-4+4H 2OC.放电时每转移3 mol 电子,正极有1 mol K 2FeO 4被氧化D.放电时正极附近溶液的碱性增强22.镍镉(Ni -Cd)可充电电池在现代生活中有广泛应用。
已知某镍镉电池的电解质溶液为KOH 溶液,其充、放电按下式进行: Cd(OH)2+2Ni(OH)2 Cd +2NiOOH +2H 2O 。
有关该电池的说法中,不正确的是A .放电时,电解质溶液中的OH -向负极移动 B .充电过程是电能转化为化学能的过程C .放电时,负极附近溶液的碱性不变D .充电时阴极反应为:Cd(OH)2+2e -===Cd +2OH -23.Harbermann 等设计出利用Desulfovibrio desulfurcan 菌种生成的硫化物作为介体的微生物燃料电池,电池内部有质子通过,该系统不经任何维护可连续运行5年。
该电池的负极反应式为:S 2-+4H 2O -8e -===SO 2-4+8H +。
有关该电池的下列说法中正确的是A .若有1.12 L 氧气参与反应,则有 mol 电子发生转移B. 质子由正极移向负极C .该电池的总反应为S 2-+2O 2===SO 2-4D .正极的电极反应式为2O 2+8e -+4H 2O===8OH -24.以氨作为燃料的固体氧化物(含有O 2-)燃料电池,具有全固态结构、能量效率高的特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体。
其工作原理如图所示,下列关于直接氨固体氧化物燃料电池的说法正确的是 ( )A .该电池工作时的总反应为4NH 3+5O 2===4NO +6H 2OB .固体氧化物作为电池工作的电解质,其作用是让电子在电池内移动C .电池工作时,在接触面上发生的电极反应为 2NH 3+3O 2--6e -===N 2+3H 2OD .外电路的电流方向为从电极a 流向电极b25.查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO 2,但实际上乙醇被氧化为X ,其中一个电极的反应式为CH 3CH 2OH -2e-===X +2H +。
下列说法中正确的是( )A .电池内部H +由正极向负极移动B .另一极的电极反应式为O 2+4e -+2H 2O===4OH -C .乙醇在正极发生反应,电子经过外电路流向负极D .电池总反应式为2CH 3CH 2OH +O 2===2CH 3CHO +2H 2O二、填空题 26、近年我国首创以Al ──空气──海水为能源的新型电池,以海水为电解液.靠空气中的氧使铝不断氧化而产生电流.其工作时电极总反应式为:4Al + 3O 2 + 6H 2O = 4Al(OH)3;请判断:(1)原电池的负极是_____;(2)工作时原电池的两极反应:A .负极_____ _ ;B .正极____ _;(3)工作时原电池正极附近pH______(增大,减小,不变).25、(I )将Zn 棒和Cu 棒用导线连接后,放入某电解质溶液中,构成如图所示装置。
