人教版高中化学必修二第二次月考试卷.docx
人教版高中化学必修二下学期高一第二次月考化学试卷.docx

高中化学学习材料鼎尚图文收集整理霞浦一中2016-2017学年度下学期高一第二次月考化学试卷考试时间:90分钟满分100分可能用到的原子量H:1 C:12N:14 O:16Al:27 Si:28 Fe: 56第I卷(选择题)(每空3分,总分60分)1.元素性质呈周期性变化的原因是()A. 相对原子质量逐渐增大B. 核电荷数逐渐增大C. 核外电子排布呈周期性变化D. 元素的化合价呈周期性变化2.下列化学用语的使用正确的是( )A. N2的电子式: B.质子数为53、中子数为78的碘原子:C. 氯化氢的电子式D. F的原子结构示意图:3.下列物质中含有Cl-的是()A. 液态氯化氢B. 次氯酸钠溶液C. 固体氯化钠D. 四氯化碳4.钚是一种具有放射性的超铀元素,几位美国科学家在1940年首次发现这一元素,它目前被应用于核武器和核反应堆。
下列说法正确的是()A. 23894uP、23994uP、24094uP是钚的三种同素异形体 B. 23894uP中有94个中子C. 23994uP的中子数与质子数之差为51 D. 一个24094uP的质量为240 g5.下列各对物质中属于同分异构体的是()A. 147N和157N B. 白磷和红磷C. 和D. 和6.下面有关硅的叙述中,不正确的是()A. 硅的化学性质不活泼,在自然界中主要以游离态存在B.二氧化硅可用于制造光导纤维C.多数合金的熔点低于组成它的成分的金属的熔点D.制普通玻璃的原料是纯碱、石灰石、石英7.下列表述正确的是:( )①人造刚玉的熔点很高,可用作高级耐火材料,主要成分是二氧化硅②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料④水晶项琏和餐桌上的瓷盘都是硅酸盐制品⑤大阳能电池可采用硅材料制作,其应用有利于环保、节能A. ①②③B. ②④C. ③④⑤D. ③⑤8.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是()A. 氢氧化钠B. 氯化铜C. 稀盐酸D. 稀硫酸9.2005年1月14日“惠更斯”号探测器成功登陆了土卫六,根据发回的照片和数据分析,土卫六“酷似地球经常下雨”,不过“雨”的成份是以液态甲烷为主的一些碳氢化合物.下列说法中,错误的是()A. 碳氢化合物的通式为C n H2n+2B. 甲烷是一种比较洁净的能源C. 甲烷不能使酸性高锰酸钾褪色D. 甲烷的二氯代物无同分异构体10.下表物质与其所含化学键类型、所属化合物类型不正确的一组是()选项 A B C D物质Na2O2H2O HCl NaCl化学键类型离子键、共价键共价键离子键离子键化合物类型离子化合物共价化合物离子化合物离子化合物11.下列属于氧化还原反应,且为吸热反应的是()A.C+H2O高温CO+H2 B.2NaOH+H2SO4═Na2SO4+2H2OC.Zn+2H+=Zn2++H2↑D.Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O12.关于化学反应中能量变化的说法错误的是()A.右图所示的反应为吸热反应B.化学反应中有物质变化也有能量变化C.需要加热的才发生的反应一定是吸热反应D.化学键断裂吸收能量,化学键生成放出能量13.下图是周期表中短周期的一部分,若a原子最外层的电子数比次外层少了3个,则下列说法不正确的是()A. d的氢化物比b的氢化物稳定B. d与c不能形成化合物C. 原子半径的大小顺序是a>b>c>dD. a、b、c的最高价氧化物对应水化物的酸性强弱的关系是c>b>a14.下列叙述中正确的是()A. 除零族元素外,短周期元素的最高化合价在数值上等于该元素所属的族序数B. ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数C. 除短周期外,其他周期均有18种元素D. X2+的核外电子数目为18,则X在第三周期第ⅡA族15.下列对一些实验事实和理论解释正确的是( )选项实验事实理论解释A HCl气体溶于水,能电离出H+、Cl-HCl为离子化合物B HBr的酸性强于HCl的酸性Br的非金属性比Cl强C HF的沸点高于HCl F的非金属性比Cl强D K3C60在熔融状态下能够导电K3C60中含有离子键16.对于反应2SO2+O22SO3,下列判断正确的是()A. 2 mol SO2和5 mol O2充分反应可生成2 mol SO3B. 2 mol SO2和1mol O2达到化学平衡时SO2、O2、SO3的分子数之比一定为2∶1∶2C. 达到化学平衡时SO2的消耗速率必定等于O2的生成速率的2倍D. 三种物质的浓度相等时,说明反应达到了化学平衡。
人教版高一化学第二学期第二次月考测试卷含解析

人教版高一化学第二学期第二次月考测试卷含解析一、选择题1.aL CO 2气体通过足量Na 2O 2所得的气体与bL NO 相混和时,可得到cL 气体(相同状况),以下表达式中错误的是 A .若a <b ,则c >0.5(a+b) B .若a >b ,则c =0.5(a+b) C .若a =b ,则c =0.5(a+b) D .若a <b ,则c <0.5(a+b)【答案】D 【解析】 【详解】首先发生反应:2Na 2O 2+2CO 2=2Na 2CO 3+O 2,可知生成氧气体积为0.5a L ,与bL NO 混合又发生反应:O 2+2NO =2NO 2,二者恰好反应时0.5a :b =1:2,解得a =b ,则 A 、若a <b ,则NO 有剩余,由O 2+2NO =2NO 2可知气体体积减少0.5a L ,故得到气体体积等于NO 的体积,则c =b ,即c >0.5(a +b ),A 正确;B 、若a >b ,则O 2有剩余,由O 2+2NO =2NO 2可知气体体积减少为参加反应氧气的体积,即气体体积减少为0.5b L ,故得到气体体积为c =(0.5a L +b L -0.5b L )=0.5(a +b ),B 正确;C 、若a =b ,则此时生成NO 2体积c =2×0.5a =b =0.5(a +b ),C 正确;D 、根据以上分析可知D 错误。
答案选D 。
2.下列离子方程式书写正确的是A .向明矾溶液中逐滴加入足量Ba(OH)2溶液时,反应为:Al 3++ 2SO 2-4+ 2Ba 2++ 4OH -= 2BaSO 4↓+ AlO -2+ 2H 2OB .硫化亚铁与浓硫酸混合:2H ++FeS=H 2S↑+Fe 2+C .向次氯酸钙溶液中通入SO 2:Ca 2++2ClO -+SO 2+H 2O=CaSO 3↓+2HClOD .磁性氧化铁溶于稀硝酸:3Fe 2++4H ++NO -3=3Fe 3++NO↑+3H 2O 【答案】A 【详解】A .Ba(OH)2足量,故明矾KAl(SO 4)2·12H 2O 完全反应,其中Al 3+与OH -反应生成-2AlO ,即①3+--22Al +4OH = AlO +2H O ,2-4SO 与Ba 2+反应,②2-2+44SO +Ba = BaSO ↓,由于Al 3+、2-4SO 都来源于明矾,故应满足原比例1:2,则总反应为①+②×2,即3+2-2+--4422Al +2SO +2Ba +4OH = 2BaSO +AlO +2H O ↓,A 正确; B .浓硫酸具有强氧化性,可以将FeS 中亚铁氧化为Fe 3+,-2价硫氧化为S 单质,自身被还原为SO 2,B 错误;C .次氯酸根有强氧化性,能将SO 2氧化为2-4SO ,自身被还原为Cl -,C 错误; D .磁性氧化铁为Fe 3O 4,书写离子方程式时,Fe 3O 4不能拆,D 错误;故答案选A。
人教版高中化学必修二下学期月考试题.docx

高中化学学习材料(灿若寒星**整理制作)下学期月考试题高 一 化 学考试说明:1、考试用时90分钟,满分100分。
2、可能用到的相对原子质量C---12 Zn---65 O---16 Cl--- 35.5S--- 32 N--- 14 Na---23 Ca---40第Ⅰ卷 选择题(每小题3分,共60 分)每题只有一个正确选项1、下列关于Bi 20983和Bi 21083的说法正确的是 A .Bi 20983和Bi 21083都含有83个电子 B .Bi 20983和Bi 21083互为同素异形体 C .Bi 20983和Bi 21083的核外电子数不同 D .Bi 20983和Bi 21083分别含有126和127个质子2、下列说法正确的是( )A .SiH 4比CH 4稳定B .Na 和Cs 属于第ⅠA 族元素,Cs 失电子能力比Na 的强C .O 2―半径比F ―的小D .P 和As 属于第ⅤA 族元素,H 3PO 4酸性比H 3AsO 4的弱3、铝与过量的稀盐酸反应,为了加快反应速率,但是又不影响生成的氢气总量,可以采取的措施是A 、升高温度B 、加入适量水C 、加入少量Cu SO 4溶液D 、加入食盐固体4、人造地球卫星用到的一种高能电池――银锌蓄电池,其电池的电极反应式为Zn +2OH --2e - = ZnO + H 2↑, Ag 2O+ H 2O +2e -=2 Ag + 2OH - ,根据此反应判断氧化银是A 、负极,并被氧化B 、正极,并被还原C 、负极,并被还原D 、正极,并被氧化5、一定温度下,可逆反应3X (g )+Y (g )=2Z (g ),达到限度的标志是A 、单位时间内生成3n molX ,同时消耗n molYB、X的生成速率与Z的生成速率相等C、X、Y、Z的浓度相等D、X、Y、Z的分子个数比是3:2:16、下列四种X浓液,均能跟盐酸反应,其中反应最快的是A、10℃20mL 3mol·L-1的X溶液B、20℃30mL 2mol·L-1的X溶液C、20℃10mL 4mol·L-1的X溶液D、10℃10mL 2mol·L-1的X溶液7、下列电子式表示中错误的是()A. Na+B.C.D.8、X,Y,Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X、Y与稀盐酸组成原电池时,Y为负极。
人教版高中化学必修二高一年级第二次月考化学试题.docx

高中化学学习材料鼎尚图文收集整理高一年级第二次月考化学试题可能用到的相对原子质量:H 1 C 12 N 14 O 16一.选择题( 本题有26个小题,每小题有1选项符合题意,每小题3分,共52分。
) 1.衡量一个国家石油化工发展水平的标志是A.石油产量B.乙烯产量C.天然气产量D.汽油产量2.下列有关甲烷性质的叙述,正确的是A.甲烷是一种无色,有臭味的气体 B.甲烷易溶于水C.甲烷与氯气发生的化学反应类型属于取代反应 D.甲烷是一种混合物3.下列实验能获得成功的是A.苯和浓溴水用铁做催化剂制溴苯B.乙烯与溴的四氯化碳溶液得到1,2—二溴乙烷C.甲烷与氯气光照制得纯净的一氯甲烷D.将苯与浓硝酸混合共热制硝基苯4.若用乙烯和氯气在适当的条件下反应制取四氯乙烷,这一过程中所要经历的反应及耗用氯气的量是(设乙烯为1mol ,反应产物中的有机物只是四氯乙烷)A.取代4 mol Cl2 B.加成2 mol Cl2 C.加成、取代3 mol Cl2 D.加成、取代2 mol Cl2 5.下列反应属于取代反应是A .C3H8 + 5O23CO2 +4H2O B. CH4+C12CH3C1+HClC. D. +3H26.下列各物质能使酸性高锰酸钾溶液退色的是A.乙酸B.丁烯 C.苯 D.乙酸乙酯7.下列有机物在空气中燃烧,产生明亮火焰并带有浓烟的物质是A.CH4 B.CH2=CH2 C. D.CH3CH2OH8.下列变化不是由加成反应引起的是A.苯中加溴水振荡,溴水层褪色B.石油裂解后的气体通入溴水,溴水褪色C.乙烯通入溴水,溴水褪色D.苯转化为环已烷9.可以用分液漏斗进行分离的混合物是A、酒精和碘水B、苯和水C、乙醇和水D、乙酸和水10.除去乙烷中乙烯的办法是A.点燃 B.通过浓硫酸 C.通过溴水 D.通过石灰水11.下列各组有机化合物中,肯定属于同系物的一组是A.C3H6与C5H10 B.C4H6与C5H8C.C2H2与C6H6 D.C3H8与C5H1212.下列气体在氧气中完全燃烧后,其产物既可使无水硫酸铜变蓝,又可使澄清石灰水变浑浊的是A.H2S B.CH4C.H2D.CO13.某有机物的结构简式为CH2=CH—CH2OH。
人教版高一第二学期 第二次月考化学试卷含答案

人教版高一第二学期第二次月考化学试卷含答案一、选择题1.将43.8g Al、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。
另取等质量的该合金溶于过量的稀硝酸中,生成13.44LNO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为A.39.2g B.44.8g C.58.8g D.66.4g【答案】C【详解】合金溶于足量的NaOH溶液中,金属铝和氢氧化钠反应产生气体氢气6.72L,物质的量为0.3mol,根据电子转移守恒可以知道n(Al)=0.3×23=0.2mol,故金属铝的质量为0.2×27=5.4g ,金属铝提供电子的量是0.6 mol,将合金溶于过量稀硝酸中,分别生成Al3+ 、Cu2+离子,根据电子守恒,金属共提供电子的物质的量为13.44×322.4=1.8 mol 故Cu共提供的电子物质的量为1.8-0.6=1.2 mol,向反应后的溶液中加入过量的NaOH溶液,铝离子全部转化为偏铝酸根离子,不会出现沉淀,所得沉淀为氢氧化铜,由电荷守恒可以知道,反应中金属铜提供的电子的物质的量等于生成碱的氢氧根离子的物质的量即n(OH-)=1.2 mol,所以反应后沉淀的质量等于43.8-5.4+1.2×17=58.8 g ;C正确;故答案选C。
2.图是利用二氧化硅制备硅及其化合物的流程,下列说法正确的是( )A.由反应②③说明SiO2属于两性氧化物B.由反应④说明酸性,H2SiO3>H2CO3C.硅胶吸水后,经干燥可以重复再生D.图中所示转化反应都是氧化还原反应【答案】C【详解】A.二氧化硅是酸性氧化物能和强碱反应,反应方程式为SiO2+2NaOH=Na2SiO3+H2O;但也能和特殊的酸氢氟酸反应,反应方程式为:SiO2+4HF=SiF4↑+2H2O,二氧化硅只是能和特殊酸反应,和其它酸不反应,和酸的反应没有普遍性,所以不能说明其具有两性,A错误;B.高温下SiO2能与Na2CO3固体反应生成Na2SiO3和CO2,不是在常温下进行,且不是在水溶液中进行,不能说明硅酸的酸性强于碳酸,B错误;C.硅胶吸附水后,可通过热脱附方式将水份除去重复使用,C正确;D.图中二氧化硅与氢氟酸、氢氧化钠、碳酸钠的反应,硅酸钠与盐酸的反应、硅酸的分解、硅酸的生成,元素的化合价都没有发生变化,是非氧化还原反应,D错误;答案选C。
人教版高中化学必修二第二学期高一年级第二次月考考试题.docx

高中化学学习材料鼎尚图文收集整理2016-2017学年第二学期高一年级第二次月考考试题化学(普通班)时长:90分钟分值:100一.选择题(本题包括20小题,每小题只有一个选项符合题意,每小题3分,共60分)1.下列关于化学键的叙述正确的是()A.两个原子之间的相互作用叫化学键B.化学键既存在于相邻原子之间,又存在与相邻分子之间C.化学键通常指的是相邻的两个或多个原子之间的强相互作用D.阴阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距相当小2.下列物质的电子式书写正确的是()A.B.C.D.3.下列物质中不存在化学键的是A.水B.食盐C.氯气D.氦气4.下列各分子中化学键类型不同的是A.H2O、CO2B.MgF2、H2O2C.NaOH、Ba(OH)2D.NaCl、KCl5.下列物质中属于共价化合物的是A Na2O2B NaHSO4C HNO3D I26.下列不是离子化合物的是( )A.H2 OB.CaI2C. KOHD.NaNO37.下列过程中,共价键被破坏的是( )A.碘升华B.溴蒸气被木炭吸附C.酒精溶于水D.HCl气体溶于水8.下列用电子式表示化合物的形成过程,正确的是()A.B.C.D.9.下列事实中,能够证明HCl是共价化合物的是()A.HCl易溶于水B.液态的HCl不导电C.HCl不易分解D.HCl溶于水能电离,呈酸性10.有下列电子层结构的各原子中最难形成离子的是( )11.下列过程属于放热反应的是()A.在生石灰中加水B.硝酸铵溶于水C.浓硫酸加水稀释D.用石灰石煅烧石灰12.下列说法不正确的是()A.化学反应可分为吸热反应和放热反应B.化学反应的实质是旧键的断裂与新键的生成C.化学反应中的能量变化都是以热能的形式表现出来D.放热反应发生时可能需加热13.反应热是()A.燃烧热的集中表现B.中和热的集中表现C.溶解热的集中表现D.键能变化的集中表现14.已知H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ•mol-1,其中aq代表稀溶液,以下四个反应方程式中,反应热△H=-57.3kJ•mol-1的是( )A.H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1)B.1/2H2SO4(aq)+ 1/2Ba(OH)2(aq)=1/2BaSO4(s)+H2O(1)C.HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(1)D.HCl(aq)+NH3•H2O (aq)=NH4Cl (aq)+H2O(1)15.已知在101KPa,298K条件下,2 mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是()A.H 2 O(g)= H 2(g)+ 1/2O 2;△H(298K)= -242kJ·mol-1B.H 2(g)+ 1/2O 2(g)= H 2 O(l);△H(298K)= +484kJ·mol-1C.H 2(g)+ 1/2O 2(g)= H 2 O(g);△H(298K)= -242kJ·mol-1D.H 2(g)+ 1/2O 2(g)= H 2 O(g);△H(298K)= -484kJ16.下列分子间不能形成氢键的是( )A.H 2 O B.HFC.NH3D.CO217.下列反应既属于氧化还原反应,又属于吸热反应的是()A.铝片和稀盐酸反应B.Ba(OH)2·8H2O与NH4Cl的反应C.甲烷在氧气中的燃烧D.灼热的碳与二氧化碳的反应18.下列关于燃烧热的说法中正确的是( )A.1 mol物质燃烧所放出的热量B.常温下,可燃物燃烧放出的热量C.在25℃、1.01×105 Pa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量D.燃烧热随化学方程式前的化学计量数的改变而改变19.以下几个热化学方程式,能表示有关物质燃烧时的燃烧热的热化学方程式是( )A.C(s)+ 1/2O2(g)===CO(g) ΔH =+110.5 kJ·mol-1B.C(s)+O2(g)===CO2(g) ΔH =-393.5 kJ·mol-1C.2H 2(g)+O2(g)===2H2O(l) ΔH =-571.6 kJ·mol-1D.H2(g)+ 1/2O2(g)===H2O(g) ΔH =-241.8 kJ·mol-120.关于能源,以下说法中不正确的是( )A.煤、石油、天然气等燃料的最初来源都可追溯到太阳能B.柴草燃烧时释放的能量是生物能C.核能和地热能来自地球自身D.潮汐能来源于月球引力做功第II卷(非选择题,40分)21.(18分)写出下列物质或原子的电子式(1)H2O ______ CO2 ______ NaCl ______Na2O2 ______ OH-NH4+(2)HCl H2N2N C l C22.(8分)中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。
人教版高一化学第二学期第二次月考测试卷及答案
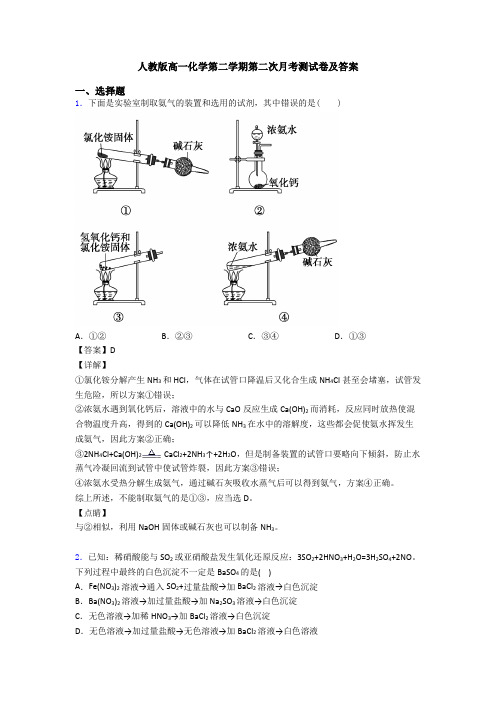
人教版高一化学第二学期第二次月考测试卷及答案一、选择题1.下面是实验室制取氨气的装置和选用的试剂,其中错误的是( )A.①②B.②③C.③④D.①③【答案】D【详解】①氯化铵分解产生NH3和HCl,气体在试管口降温后又化合生成NH4Cl甚至会堵塞,试管发生危险,所以方案①错误;②浓氨水遇到氧化钙后,溶液中的水与CaO反应生成Ca(OH)2而消耗,反应同时放热使混合物温度升高,得到的Ca(OH)2可以降低NH3在水中的溶解度,这些都会促使氨水挥发生成氨气,因此方案②正确;③2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O,但是制备装置的试管口要略向下倾斜,防止水蒸气冷凝回流到试管中使试管炸裂,因此方案③错误;④浓氨水受热分解生成氨气,通过碱石灰吸收水蒸气后可以得到氨气,方案④正确。
综上所述,不能制取氨气的是①③,应当选D。
【点睛】与②相似,利用NaOH固体或碱石灰也可以制备NH3。
2.已知:稀硝酸能与SO2或亚硝酸盐发生氧化还原反应:3SO2+2HNO3+H2O=3H2SO4+2NO。
下列过程中最终的白色沉淀不一定是BaSO4的是( )A.Fe(NO3)2溶液→通入SO2+过量盐酸→加BaCl2溶液→白色沉淀B.Ba(NO3)2溶液→加过量盐酸→加Na2SO3溶液→白色沉淀C.无色溶液→加稀HNO3→加BaCl2溶液→白色沉淀D.无色溶液→加过量盐酸→无色溶液→加BaCl2溶液→白色溶液【答案】C【详解】A.硝酸亚铁中有硝酸根离子存在,加入过量的稀盐酸,就相当于硝酸存在,通入二氧化硫气体,二氧化硫与水生成亚硫酸,被硝酸氧化成硫酸根离子,加氯化钡最终生成BaSO4沉淀,A不符合题意;B.硝酸钡溶液中有硝酸根离子存在,加入过量的稀盐酸,就相当于硝酸存在,加入亚硫酸钠,亚硫酸根离子被硝酸氧化成硫酸根离子,所以一定是硫酸钡白色沉淀,B不符合题意;C.无色溶液加入稀硝酸,加入氯化钡,Ag+可能干扰,最终生成的白色沉淀可能是AgCl或BaSO4,C符合题意;D.无色溶液,加盐酸无沉淀,就排除了亚硫酸钡和氯化银,因为亚硫酸钡会和盐酸生成二氧化硫和水,再加氯化钡有生成沉淀,所以一定是硫酸钡白色沉淀,D不符合题意;答案选C。
人教版高中化学必修二第二次月考答案.docx
高中化学学习材料
2009-2010下期第二次月考
高一化学答案2010.5
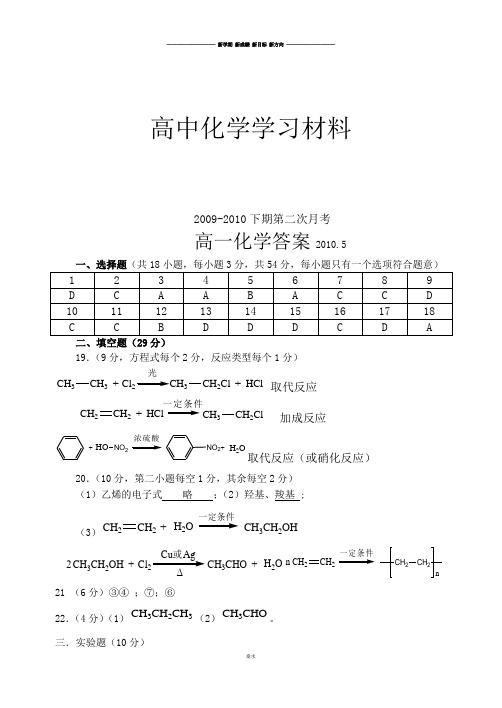
19.(9分,方程式每个2分,反应类型每个1分)
CH 3CH 3+Cl 3
CH 2Cl +HCl 光
取代反应 CH 2
CH 2+HCl
CH 3
CH 2Cl 加成反应
+
HO NO 2
+NO 2H 2O
浓硫酸
取代反应(或硝化反应)
20.(10分,第二小题每空1分,其余每空2分) (1)乙烯的电子式 略 ;(2)羟基、羧基 ;
(3)
CH 2CH 2+H 2O
CH 3CH 2OH
H 2O CH 3CH 2OH +Cl Cu 或Ag CH 3CHO +2CH 2
CH 2
n CH 2
CH 2
n
21 (6分)③④ ;⑦;⑥
22.(4分)(1)CH 3CH 2CH 3(2)CH 3CHO 。
三.实验题(10分)
23.(1)(2分,每空1分)催化剂、脱水剂(或吸水剂)
(2)(6分,每空1分);饱和碳酸钠溶液;中和乙酸、溶解乙醇、降低乙酸乙酯的溶解度。
防止倒吸;防止暴沸。
(3)(2分)CH 3COOH+CH 3CH 2OH CH 3COOC 2H 5 + H 2O
四、计算题(7分) (1)(3分)乙醇的物质的量是0.2mol (2)(4分)二氧化碳在标准状况下的体积为:7.84L
浓硫酸
加热。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3CH3
CH2C CH3
C2H5
3
高中化学学习材料
2009-2010下期第二次月考
高一化学2010.5
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5 Fe-56一、选择题(共18小题,每小题3分,共54分,每小题只有一个选项符合题意)
1.2008年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷,下列有关丙烷的叙述中不正确的是()
A 分子中碳原子不在同一直线上
B 光照下能够发生取代反应
C 比丁烷沸点低
D 燃烧时火焰明亮并伴有大量黑烟
2.制取较纯净的一氯乙烷最好采用的方法是()
A.乙烷和氯气反应 B.乙烯和氯气反应
C.乙烯和氯化氢反应 D.乙烯和氢气、氯气的混合气体在常温下反应
3.烷烃是烯烃R与氢气发生加成反应后的产物,则R的结构简式有()
A.三种 B.四种 C.五种 D.六种
4.将下列各种液体分别与溴水混合并振荡,静置后混合液分成两层,下层几乎呈无色的是()
A.苯 B.酒精
C.CCl4 D.溴苯
5.已知二氯丙烷有四种同分异构体,则六氯丙烷有多少种同分异构体?()
A 三种
B 四种
C 五种
D 六种
6.已知乙烯能被酸性高锰酸钾溶液氧化成CO2。
既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的乙烯的方法是()
A.通入足量溴水中 B.通入足量的溴的四氯化碳溶液中
C .通入酸性高锰酸钾溶液中
D .通入氢气与乙烯反应
7.1mol 乙烯与氯气完全加成后再与氯气取代,整个过程最多需氯气( )
A .1mol
B .4mol
C .5mol
D .6mol
8.两种气态烃组成的混合气体0.2 mol ,完全燃烧得0.36 mol CO 2和7.2 g H 2O ,
下列关于该混合气体的说法正确的是( )
A .一定有乙烯
B .一定没有乙烯
C .一定有甲烷
D .可能有乙烷
9、A 、B 、C 三种醇分别与足量的金属钠反应产生相同体积的氢气,消耗这三种醇的
物质的量之比是3:6:2,则A 、B 、C 这三种醇分子种羟基的个数比是:( )
A .3:2:1
B .2:6:3
C .3:6:2
D .2:1:3 10、mmol C 2H 2跟nmol H 2在密闭容器中反应,生成pmol C 2H 4。
将反应后的混合气体
完全燃烧,生成CO 2和H 2O ,所需氧气的物质的量是:( )
A . 3pmol
B .p)32n 2m 5(-+mol
C .)2
n 2m 5(+mol D .)p 2n m 3(++mol 11、在CH 3
CH CH 2分子中,处于同一平面上的原子数最多可能是:( ) A .15个 B .16个 C .17个 D .18个
12、下列各组液体混合物,能用分液漏斗分离的是:( )
A .溴苯和溴
B .正己烷和水
C .苯和硝基苯
D .乙醇和水
13、由乙烯推测丙烯(CH 2=CH —CH 3)与溴水反应产物结构简式正确的是( )
A .CH 2Br —CH 2—CH 2Br
B .CH 3—CBr 2—CH 3
C .CH 3—CH 2—CHBr 2
D .CH 3—CHBr —CH 2Br
14. 1866年凯库勒提出了苯的单、双键交替的平面六边形结构,解释了苯的部分性
质,但还有一些问题尚未解决,它不能解释下列事实有( )
A .苯的间位二取代物只有一种
B .苯能与H 2发生加成反应
C .溴苯没有同分异构体
D .邻二溴苯只有一种
15.能通过化学反应使溴水褪色,又能使酸性高锰酸钾溶液褪色的是( )
A.苯
B.甲苯
C.乙烷
D.乙烯
16. 既能使溴水褪色又能跟金属钠反应,还可以和碳酸钠溶液反应的物质是
( )
CH 3CHO +2O 2 CH 3COOH
17.某有机物的结构简式为CH 2=CHCH 2OH 。
下列关于该有机物的叙述不正确的是
A .能与金属钠发生反应并放出氢气
B .能在催化剂作用下与H 2发生加成反应
C .在浓H 2SO 4催化下能与乙酸发生酯化反应
D .可以与碳酸氢钠反应产生二氧化碳气体
18.一定质量的某有机物和足量的金属钠反应,可得到气体V 1L ,等质量的该有机物
与足量的纯碱反应,可得到气体V 2L 。
若同温同压下V 1>V 2(V 2不为零),则该有机物可能
是( )
A . HOCH 2CH 2COOH
B .HOOC-COOH
C .HOCH 2CH 2OH
D .CH 3COOH
二、填空题(29分)
19.(9分)写出反应方程式,并指明反应类型。
在一定条件下,乙烷和乙烯都能制备氯乙烷(C 2H 5Cl )。
⑴用乙烷制备氯乙烷的化学方程式是 ,该
反应的类型是 ;
⑵用乙烯制备氯乙烷的化学方程式是 ,该
反应的类型是 ;
(3)由苯制取硝基苯的化学方程式是 ,该反应
的类型是 ;
20.(10分) 已知:① A 是石油裂解气的主要成分,A 的产量通常衡量一个国家的
石油化工水平;
② 现以A 为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1)写出A 的电子式 ;
(2)B 、D 所含官能团的名称分别是 、 ;
A
B C D
① H 2O O 2 ② ③ O 2 乙酸乙酯 ④
聚乙烯 ⑤
(3)写出下列反应方程式: ① ; ② ; ⑤ 。
21.下列几组物质中,互为同系物的有 ,互为同分异构体的有 ;属于同种物质的有 。
① O 2和O 3;② 35Cl 和37Cl ;③ CH 3CH 3和CH 3CH 2CH 3;
④ CH 3CH 2CH 2CH 3和CH 3CH 2CH(CH 3)2;⑤ 乙醇、乙烷;
⑥ ⑦CH 3CH 2CH 2CH 3和CH 3CH(CH 3)2
22.(4分)现测得某有机物的相对分子质量为44,根据下列条件回答:
(1)若有机物中仅仅含有碳和氢两种元素,则该有机物的结构简式
为 ;
(2)若该有机物中仅含有一个氧原子,且分子中含有—CH 3,则该有机物的结构
简式为 。
三.实验题(10分)
23.实验室用图示装置制取乙酸乙酯。
(1)浓H 2SO 4的作用是:①_____ _ __,②_____________。
(2)右边试管内装有 ,该溶液的作用是 ________、______________、_____________________。
导气管不能插入液面以下,原因是 。
加热前,大试管中加入几粒碎瓷片的作用是______________。
(3)制取乙酸乙酯的反应方程式是__________________________________。
四、计算题(7分)
24.一定量的乙醇在氧气不足的情况下燃烧,得到一氧化碳、二氧化碳和水的总质
量是27.6 g ,其中水的质量是10.8 g ,则:
(1) 乙醇的物质的量是多少?
(2) 产生的二氧化碳在标准状况下为多少升?
C Cl
H Cl
H C Cl
H Cl
和
2009-2010下期第二次月考
高一化学答题卷2010.5
二、填空题(29分)
19.(9分)
(1)化学方程式是,该反应的类型是;
(2)化学方程式是,该反应的类型是;
(3)化学方程式是 ,该反应的类型是。
20.(10分)
(1)写出A的电子式;
(2)B、D所含官能团的名称分别是、;
(3)写出下列反应方程式:
①;
②;
⑤。
21.互为同系物的有,互为同分异构体的有;属于同种物质的有。
22.(4分)
(1)结构简式为;(2)结构简式为。
三.实验题(10分)
23.(1)浓H2SO4的作用是:①_____ _ __,②_____________。
(2)右边收集试管内装有,该溶液的作用是
________、______________、___________________________。
原因是作用是________________。
(3)反应方程式是______________________________________。
四、计算题(7分)
24.。
