第9章 光学异构体的拆分和不对称合成
不对称合成简介

班级:11化31 演讲:刘聪聪 小组成员:刘聪聪 董坤
目录
1.手性化合物的重要性及其合成方法 2.不对称合成方法的简介 3.发展
1.手性化合物的重要性及其合成方法
自然界中存在许多光学对映体,这些物质就像人的左右手, 立体结构对称,左右相反,决不能重合。对于手性化合物而 言,制备单一的对映体是非常重要的,因为对映体的生理作 用往往有很大差别。 例如: 反应停:R-异构体具有减轻孕妇早期妊娠反应的作用,S异构体致畸; 天冬酰胺:(R)-天冬酰胺是甜的,(S)-天冬酰胺是苦 的;
[5]梁丽华.不对称合成的研究与发展.2003
[6]何煦昌.不对称有机合成和反应的分类.合成化学.2002
Thank you!
为了完成立体选择性反应,在非手性底物上连接手性定 向基团(手性“辅基”)以诱导反应的立体选择性,该手 性辅助基团在完成不对称合成反应后可以从产物中脱去, 有时还可以回收并重复使用。该方法与第一代方法相似。
S + A* R P-A* -A* P*
从反应过渡态考虑选择适当的手性辅助基团,使在反 应中心形成刚性的不对称环境,可获得很高的立体选择性。
不对称合成的方法:
按照手性基团的影响方式及不对称合成的发展历史可大 致划分为四大类:
①底物控制反应,属于第一代不对称合成;
②辅基控制反应,属于第二代不对称合成; ③试剂控制反应,属于第三代不对称合成; ④催化剂控制反应,属于第四代不对称合成。
2.不对称合成方法的简介
2.1底物控制反应
2.2辅基控制反应 2.3试剂控制反应 2.4催化剂控制反应
手性化合物的获得途径:
①从天然产物中提取手性药物; —早期,有限。 ②拆分法分离手性药物;(外消旋体拆分)
光学异构体的气相色谱拆分法

塔板数要求保持为 15那么Δ( G ) 0, 必须大于 4.7( 18J相当于 在 38 9 K时等于 10 .1。若使用填 充 柱, G) 值至少要求 15J =15,9 26( . 38
K。 ) 许多研究工作都致力于找到最低的理论塔板数 要求 , 以达到可以实际应用的 目的。 而这其中的重点 实际放在如何改造固定相结构使其具有高立体选择 性上。
物须有足够大的色谱行为差异;. 5 形成的非对映体
衍生物须具有化学和立体化学的稳定性 。
有关合适衍生化试剂的选择, 已作了大量的研
究工作。这些工作普遍地针对如何增加手性化合物
分子态的色谱 值。 与经典法比较, 这种G -D CC R法
具有快速、 高的化学和光学纯度等优点 。 的一些 常用 手性衍生化试剂及其应用列于表 1 。
气相色谱拆分法是手性色谱学(h acrmtga Cil aor- r ho py的重要分支, h) 一般可分为直接和间接拆分法。 这
两 种方法的共同点 , 都是以气相色谱 ( C 为基础 。 G ) 引入新的不对称中心, 使对映体 的性质产生差 异, 进 而被拆分。
3 直接拆分法
对映异构体的 G C直接拆分法是通过使 用一个 具有光学活性的环境 , 称之为手性 固定相 的, 供 来提
试 剂 衍 生化
不能有化学或立体化学的降解反应; 衍生化试剂必
须是光学纯的 , 或者试 剂中对映体 杂质的量可以精 确确定 , 以便定量分析时能加以校正 。
表 2 C常用 C P及其应用 G S
Ky d gs m t r h,e oo e,ha ewr a c o a g pysr imr cr o s h r oa t es il
较C P法经济。 S 总之, 与其它常规测定光学纯度的方法相比较,
不对称合成及拆分

R O
(R)-BINAL-H R'
HO
R H
(S)
R’是不饱和基团 (R)
(2) 过渡金属络合物催化的 羰基化合物的氢化
酮的不对称氢化是制备手性醇的一个有效方法, BINAP-Ru (II)催化剂对于官能化酮的不对称氢 化是极为有效的:
O R NHBoc O
OH
O OC 2H +
B. 配位竞争拆分法: 使含旋光性氨基酸残基的非对称 2+ Cu 离子交换树脂(固定的配位体)与 2+ Ni 或 离子配位,即生成所谓的“配位 体交换树脂”。这种配位体交换树脂的 固定配位体可以部分地和有倾向地与D或L-α氨基酸(活动的配位体)发生配位 体交换作用,于是可以用来拆分DL-α-氨 基酸。
——生成相应的1,3-二醇:
OH
CH2OH
LiCu(CH ) 32 3 HC CH 2OH
O
第二部分:外消旋体的拆分
外消旋体可以分为三类: ——按照分子间的亲和力差异 1. 外消旋化合物:相反的对映体之间 >同种类 分子之间,相反的对映体即将在晶体的晶胞中配对, 从而形成外消旋化合物。 2. 外消旋混合物:当同类分子之间在晶体中有 较大的亲和力时,它们可分别结晶成-(+)-或 -(-)-对映体的晶体。 3. 外消旋固体溶液: 当一个外消旋体的相同构 型分子和相反构型分子之间的亲和力差别不大时, 其分子排列是混乱的。
不对称合成及拆分
内容简介:
*第一部分:不对称合成 Morrison和Mosher提出了一个广义的定义, 将不对称合成定义为“一个反应,其中底物 分子整体中的非手性单元由反应剂以不等量 地生成立体异构产物的途径转化为手性单元。 也就是说,不对称合成是这样一个过程,它 将潜手性单元转化为手性单元,使得产生不 等量的立体异构产物”。 *第二部分:外消旋体的拆分 外消旋体的“拆分”是指将一个外消旋体的 两个对映体分开,使之成为纯净的状态。
立体化学-光学异构
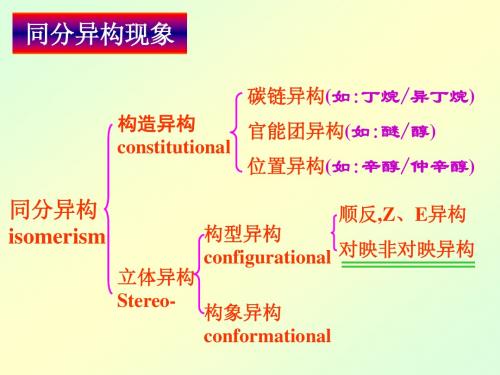
快速判断Fischer投影式构型的方法:
1°当最小基团位于横线时,若其余三个基团由大→中→小为顺 时针方向,则此投影式的构型为S,反之为R。
2°当最小基团位于竖线时,若其余三个基团由大→中→小为n 时针方向,则此投影式的构型为R,反之为S。 含两个以上C*化合物的构型或投影式,也用同样方法对每一个 C*进行R、S标记,然后注明各标记的是哪一个手性碳原子。
(2)Fischer投影式
为了便于书写和进行比较,对映体的构型常用费歇尔投影式表示:
COOH COOH H H OH CH3 乳酸对映体的费歇尔投影式 CH3 OH HO CH3 H COOH
构型的表示法
费歇尔投影式
乳酸的分子模型和投影式
•费歇尔投影式:两个竖立的键—向纸面背后伸去的键;
两个横在两边的键—向纸面前方伸出的键. •在纸面上旋转180º —不变;旋转90º 或270º 或翻身—镜象
含有一个手性碳原子的化合物的对映异构
•手性碳原子的概念— 在有机化合物中,手性分子大
都含有与四个互不相同的基团相连的碳原子。 • 这种碳原子没有任何对称因素,故叫不对称碳原子,或 叫手性碳原子,在结构式中通常用*标出手性碳原子。
W C X Z Y
镜面
W Y Z C X
• 含有一个手性碳原子的分子一定是手性分子;
乳酸的分子模型图
两个乳酸模型不能叠合
• 乳酸的两个模型的关系象左手和右手一样,它们
不能相互叠合,但却互为镜象.
分子对称因素
物质分子能否与其镜象完全重叠(是否有手性),可从分子中 有无对称因素来判断,最常见的分子对称因素有对称面和对称中 心。 (1)对称面 假设分子中有一平面能把分子切成互为镜象的两半,该平面就 是分子的对称面,例如:
有机合成-不对称合成

三、不对称反应的原理和基本方法 一个不对称合成反应中必须至少有一种的不对称因素 存在,这种不对称因素可来自于底物、试剂、催化剂 (化学的或生物的)、溶剂或物理))(光、电磁场)等。根 据不对称因素的来源, 可将不对称反应分为: (1)手性底物控制; (2)手性辅助基团控制; (3)手性试剂控制 (4)手性催化剂控制的四个主要反应类型。
Ph 2P PPh 2
F F O N Me
N COOBu' BiI 3 ( 碘化铋)
F F O NH S Me
Me N
O F N O Me COOH
N
(1) (2) (3) 环状烯胺(1)以(2S,4S)-BPPM与碘化铋(III)催化氢 化以96%产率得到(2)。 从(2)很容易经六步反应制 备到(3)左氟砂星。
其中S为含潜手性基团的底物,A*为光学纯的手性辅助试剂, S—A*为连上辅助基团的底物,P*—A*为连着辅助基团的产物, 而P*则为去除辅助基团后的最终产物。其中手性辅助试剂A* 一般可回收再使用。
以(S)—1—氨基—2—甲氧甲基吡咯烷(SAMP,8)为手性辅助基团合 成高光学纯度的食叶蚁警戒 信息素9就是这类不对称反应的一个典型例子
由光学纯1,1‘-联萘-2,2’-二酚
是手性氢负离子还原剂。
(2) 过渡金属络合物催化的 羰基化合物的氢化
Noyori等发现手性联二萘膦(BINAP)与过渡金属 形成配合物还可以还原羰基得到醇。
酮的不对称氢化是制备手性醇的一个有 效方法,BINAP-Ru (II)催化剂对于官能 化酮的不对称氢化是极为有效的:
一个好的不对称合成反应首先应具有好的立体选择性, 即高的对映或非对映过量。此外,温和的反应条件、高 的收率、两种立体异构体合成的通用性、原料经济性等 亦是衡量其优劣的指标。
光学异构体的分离

浙江大学化学实验报告课程名称:化学专业实验Ⅱ实验名称:光学异构体得分离指导教师:专业班级:姓名:学号:同组学生:实验日期:实验地点:一、实验目得1、通过苯甘氨酸得拆分实验,理解对映异构体得各种拆分方法; 2、理解有机物溶解、结晶得原理及意义,并将其用于分离提纯; 3、掌握拆分、结晶得基本操作。
二、实验原理与仪器1、实验原理对映异构体(也称光学异构体、对映体)就是指分子为互相不可重合得镜像得立体异构体,其主要得拆分方法有机械拆分法,微生物化学拆分法,选择吸附拆分法,诱导结晶拆分法,化学拆分法。
诱导结晶拆分法就是指在外消旋体(两种对映体得等量混合物)得过饱与溶液中,加入一定量得一种旋光体得纯晶体作为晶种,形成溶液中该种旋光体过量,且在晶种得诱导下优先结晶析出。
将这种结晶滤出后,则另外一种旋光体在滤液中相对较多。
再加入外消旋体制成过饱与溶液,于就是另外一种旋光体优先结晶析出,如此反复进行结晶,就可以把一对对映体分开。
化学拆分法就是指利用手性试剂作为拆分剂加入外消旋体混合物中,使它与外消旋体发生反应,生成两个非对映异构体复盐(非对映异构体指具有二个或多个非对称中心,并且其分子互相不为镜像得立体异构体),再利用它们物理性质(例如溶解度、蒸汽压、吸收系统等)得不同,用常规得方法将其拆分,最后再把这两个非对映异构体分别复原为原来得对映体。
化学拆分法最适用于酸或碱得外消旋体得拆分。
对于苯甘氨酸,诱导结晶拆分法得到得产物光学纯度较低,难以找到合适得溶剂使得两种对映体在其中得溶解度有较大差异,且循环量较大,因此本实验采用化学拆分法,利用手性拆分剂与外消旋体形成得复盐溶解度得差异进行结晶拆分。
本实验中,D,L-苯甘氨酸(简写D ,L-PG 分子式如Ⅰ),手性拆分剂为d -樟脑磺酸(简写d-CS ,分子式如Ⅱ),二者形成得复盐在水中溶解度有很大差异(如表1),可用结晶方法分离。
D,L-苯甘氨酸与d-脑磺酸溶于热溶剂中,形成非对映异构体复盐得饱与溶液,降低温度则复盐溶解度降低,溶液变成过饱与溶液,在饱与溶液中结晶与溶解存在动态平衡,可以通过降温与/或加晶种破坏其平衡使一种结晶优先析出。
有机化合物的光学异构

当偏振光通过样品后,偏振光的方向 向左转。
右旋
当偏振光通过样品后,偏振光的方向 向右转。
旋光性的测定
测量仪器
旋光仪,用于测量样品的旋光度、 比旋光度和旋光方向。
测量方法
将样品放入旋光仪的样品管中,调 整偏振片的角度,使入射光变为平 面偏振光,然后观察出射光的方向 变化。
注意事项
测量时需要使用标准样品进行校正, 以保证测量结果的准确性。
利用不同光学异构体在流动相和固定相之间的分配系数差异进行分离。高效液相色谱法具有分离效率 高、分析速度快等优点,但需要选择合适的固定相和流动相。
06
有机化合物光学异构体的应用
在药物研发中的应用
药物研发
光学异构体在药物研发中具有重要作用 ,因为不同的异构体可能具有不同的药 理作用和生物活性。通过研究光学异构 体,可以发现更有效、副作用更小的药 物。
光学异构体的旋光性是由分子中原子 排列的几何形状和电子自旋状态共同 决定的。
光学异构体的分类
根据旋光性的不同,光学异构体可以分为左旋和右旋两种类 型。
根据分子中是否含有手性碳原子,光学异构体可以分为手性 化合物和非手性化合物。
光学异构体的研究意义
1
光学异构体在自然界中广泛存在,研究它们有助 于深入了解生物体内的代谢过程和物质转化机制。
共结晶法
利用不同光学异构体与同一溶剂或配体形成不同稳定性的络合物进行分离。共结晶法通常需要深入研究络合物的 形成条件和稳定性差异。
色谱分离法
薄层色谱法
利用不同光学异构体在固定相上的吸附和洗脱速度的差异进行分离。薄层色谱法具有操作简便、分离 效果好等优点,但需要选择合适的固定相和洗脱剂。
高效液相色谱法
有机化合物的光学异构
不对称合成反应

O
Et O
NH O
NH
5-乙 基 -5-( 1,3-二 甲 基 丁 基 ) 巴比妥酸盐
2021/4/9
18
3、其中一种有毒或引起严重副反应
• 反应停是一种缓解妇女怀孕初期反应的镇 痛剂,它的副作用曾经使欧洲2万多孕妇产 生灾难性后果——胎儿发生畸变
O
N OO
O NH
(R )-异 构 体 为 镇 静 剂 (S)-异 构 体 有 致 畸 性
2021/4/9
6
• 不对称合成研究是手性物质创造的关键
方法和手段,是化学研究最为活跃的领域 之一。它在关乎人类健康的手性医药、农 药、香料、香精、食品添加剂以及多种功 能材料等相关领域具有重要的理论意义和 应用前景。
2021/4/9
7
内容
一、有关不对称合成中常用术语 二、手性的重要性 三、手性的发展历史 四、手性化合物的来源 五、催化剂 六、不对称合成方法 七、不对称合成反应
2021/4/9
12
对映体和非对映体
• 对映体,异构体互为不能重叠的镜影系。 • 非对映体,有两个以上的不对称中心,但
异构体不为镜影关系。
2021/4/9
13
(e.e.)和(d.e.)
• 对映体过量(enantiomer excess, ee.) • 非对映体过量(diastereomer excess, de.)
不对称合成反应
2021/4/9
1
手性:
指一个物体与其镜 像不重合
2021/4/9
2
2021/4/9
3
2021/4/9
4
2021/4/9
5
手性是自然界的基本属性
• 宇宙是非对称的,如果把构成太 阳系的全部物体置于一面跟随着 它们的镜子面前,镜子中的影像 不能和实体重合。……生命由非 对称作用所主宰。我能预见,所 有生物物种在其结构上、在其外 部形态上,究其本源都是宇宙非 对称性的产物。 ———Louis Pasteur
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
9.2.1 不对称合成在测定对映体绝对构型中的应用及对映体 纯度的测定
(1)对映体绝对构型的测定 对于对映体绝对构型的测定,最常用的、也是最直接的方 法是X射线结晶学的方法。然而这样一个直接测定的方法也
有它的局限性,例如它只限于适宜的晶体或含有适当其他原
子的晶体,同时还需要通过繁琐的计算才可以得知(现在常 用计算机来计算)。
(2)包结拆分
该方法是80年代由日本化学家Toda教授发明的。其 基本原理是在外消旋化合物的溶液中加入某种手性化合物, 该手性化合物作为主体能够通过弱的分子间作用力(如氢 键或分子间的π-π作用力)选择性地与外消旋化合物中的 某一个对映异构体(客体)形成稳定的超分子配合物(即
包结复合物)析出,从而达到使对映异构体分离的目的。
9.1.2 化学拆分法 化学拆分法是广泛使用的一种方法。根据手性试剂与外 消旋体反应所得生成物不同可分为以下三种: (1)生成非对映异构体的拆分法 该方法称为经典成盐拆分法,是一种经典的应用最广 的拆分方法。它是利用手性试剂与外消旋体进行反应可以 生成两个非对映异构体,再利用生成的两个非对映异构体 的某种性质(主要是溶解度)方面存在的差异而将两者分 开,最后再把拆分开的两个非对映异构体分别复原为原来 的对映异构体。
晶、非线性光学材料、导电高分子方面也显示出诱人的前景。
9.1 光学异构体的拆分 9.1.1 直接结晶拆分法 (1)自发结晶拆分法 自发结晶拆分法又称晶体机械分离拆分法,是指当外 消旋体在结晶过程中,对映异构体分别能够自发的形成足 够大的、肉眼可以识别的晶体,从而可以在放大镜的帮助 下,用镊子将他们分别拣出来,从而达到拆分的目的。
Pr,镱Yb)和不同的手性β-二酮配合,就可制成一系列 的CSR。由于手性位移试剂CSR可以使范围广泛的各种不
同类型的有机物对映体信号化学位移产生明显的不等价,
因此已经被成功用于数百种不同手性化合物的对映体纯度 的测定,成为测定对映体纯度的有力手段。
有供测定用的很完备的仪器。
化学上主要是化学转变或降解,不过要充分注意的是在进 行这些反应时不要影响手性原子或中心,避免异构化或消旋化 的产生。应用不对称合成测定构型是化学方法的一种。
(2)对映体纯度的测定 对映体过量百分数(ee,enantiomeric excess),如在反应产物中有R型和S型两种对映体,当
目前常用“构型联系”这样一个间接的方法来测定对映体
的绝对构型。它是首先通过X射线结晶学的方法测定一个化合
物的构型,然后将待测构型的化合物与已测定其绝对构型的化 合物联系起来,从而获得待测化合物的绝对构型。
构型联系的方法有化学方法和物理方法。物理上最经常应
用同时也比较可靠的是施光色散(optically rotatory dispersion)和圆二色散(circular dieroism),他们都
第9章
光学异构体的拆分和不对称合成
手性是自然界中普遍存在的现象,构成生物体的基本物
质如氨基酸、糖类等都是手性分子。含有手性因素的药物,不 同光学异构体之间在活性、代谢过程及毒性等方面往往存在着 差异。随着人们对手性分子认识的不断深入,手性分子的重要 性不仅表现在与生物相关的领域,而且在功能材料领域,如液
R型为主要产物时,则
① 比旋光度测定法
描述对映体组成的最常用术语是光学纯度(op, optical purity)。它指的是所测样品的比旋光度与所测
化合物两对映体之一的最大比旋光度之比。即:
② 核磁共振法
通常情况下,互为对映体的两种化合物的NMR信号完
全重合。当我们给对映体加一个不对称的环境,使它们处 于非对映异构关系下,这时它们就有可能产生化学位移不
(2)晶结晶
法和接种结晶法三种。
诱导结晶法也称优先结晶法,是在饱和或过饱和的外消旋
体溶液中加入其中一个光学异构体的晶种,使该对映异构体 稍稍过量而造成不对称环境,结晶就会按非平衡的过程进行。 得到晶体后,反复的重结晶可进一步提高产物的光学纯度。
等价,从而使相应基团的信号分开。
实际应用时,主要通过两种途径来实现:一是用一种光学 纯试剂将对映体变成非对映体,然后测定其内部非对映异构 基团的相对峰强度;二是在测定的样品中加入手性试剂或手 性位移试剂,提供一个外部非对映异构环境。
手性位移试剂(CSR) 镧系金属离子对NMR信号有
抗磁位移作用。将不同的镧系金属离子(主要有铕Eu,镨
溶液中加入其中一种纯对映体的晶种,然后冷却,则同种对映
体将附在晶种上析出。
(3)手性溶剂结晶法 利用外消旋体的两个对映体与手性溶剂的溶剂化作用力 的差异来进行对映异构体结晶的拆分方法就叫做手性溶剂
结晶拆分法。然而这种方法需要寻找特殊的手性溶剂,且
适用于拆分的外消旋体混合物的范围相当狭窄,故实际工 业生产的意义不大。
逆向结晶法,是通过加可溶性的某一种构型的异构体到外
消旋体的饱和溶液中,添加的这种构型的异构体就会吸附到外
消旋体溶液中同种构型异构体结晶的表面,从而抑制该外消旋 体饱和溶液中跟这种构型相同的异构体晶体的继续生长,而外
消旋体溶液中跟所添加的异构体相反构型的异构体结晶速率就
会加快,从而形成结晶析出。 接种结晶拆分法,是综合了优先结晶法和逆向结晶法的特点 而发展起来的一种方法。它是指向一个外消旋混合物的热饱和
9.2 不对称合成 不对称合成,也称手性合成、立体选择性合成、对映选择 性合成,是研究向反应物引入一个或多个具有手性元素的有机 合成的分支。不对称合成的第一个实例是被称为“糖化学之父” 的Fischer完成的。1890年,Fischer用L-阿拉伯糖与氢氰
酸反应,再经酸性水解,成功地分离出3:1量的L-甘露糖酸和
