化学-安徽省宿州市芦岭矿中学、朱仙庄矿中学2017-2018学年高二上学期期末联考试题
语文---安徽省宿州市芦岭矿、朱仙庄矿中学2017-2018学年高二上学期期末联考试题(解析版)

安徽省宿州市芦岭矿、朱仙庄矿中学2017-2018学年高二上学期期末联考语文试题第Ⅰ卷(阅读题共71分)一、现代文阅读(35分)(一)论述类文本阅读(9分,每小题3分)阅读下面文字,完成1~3题。
美国著名媒体文化研究者和批评家尼尔·波兹曼,曾大声疾呼要对电视保持警惕,倘若他看到今天的媒体变迁状况,或许会将矛头调转,指向比电视更小的屏幕——以智能手机为代表的移动终端。
而他所担忧的过分依赖技术来追求最高效率对文化积淀的侵蚀,用于阐释眼下人们的文化生活方式会更恰如其分。
科学技术的发展使智能手机成为了人们获取信息和消费文化的主要载体,我们的文化生活方式也随之发生了改变。
微博,在生活节奏极快的现代社会,已成为人们在无数个碎片化的闲暇时间里获取信息和表达自我最便捷的方式。
正是在微博热的“点化”下,一系列以“微”著称的文化消费形式应运而生——字数不超过140字的微小说、对话不超过140字的微访谈、时间不超过300秒的微电影……在拥有无限空间和容量的数字化世界里,它们如无数个碎片向我们袭来,充塞着所有时间。
“微博了一年,没怎么看电视,把放那儿的时间变成了刷屏,觉得时间被浪费,其实是换了个地方挥霍而已。
”电影导演何平在自己微博上抒发的这番感慨,或许正好说出了我们面对“微”文化时隐约的焦虑。
1971年,经济学家赫伯特·西蒙对现代人的注意力匮乏症做出了最好的诊断:信息消耗的是接收者的注意力,信息的聚敛必然意味着注意力匮乏。
在海量的“微”文化产品面前,人们的种种欲罢不能,恰好印证了这个观点——在适应了140个字的阅读之后,许多人很难再捡起一部几百页的书本;在习惯了不超过几百秒的电影之后,要在影院里看一场两三个小时的电影会变得如坐针毡。
当我们的时间和注意力被多如牛毛的“微”文化产品肢解时,读一本书、看一部电影、欣赏一场演出,甚至直面内心的冥想与沉思,都变成了奢侈的事。
“微”文化产品的另一个副作用是逻辑思维的“被碎片化”导致的思维能力弱化。
安徽省宿州市芦岭矿中学、朱仙庄矿中学2017-2018学年高二上学期期末联考物理试卷
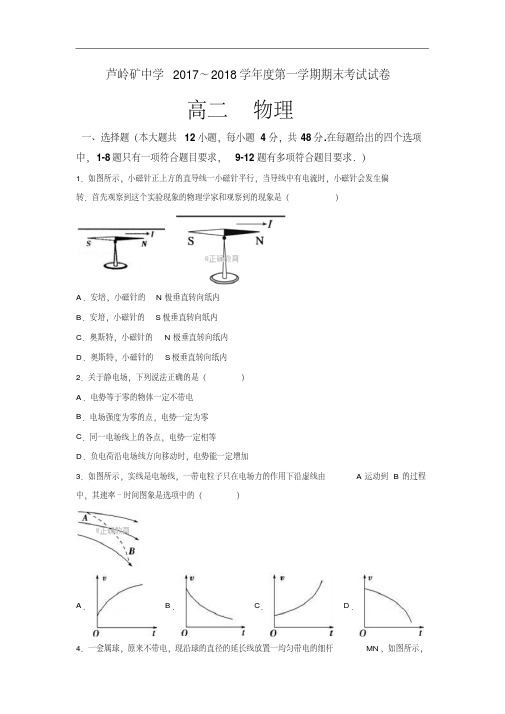
芦岭矿中学2017~2018学年度第一学期期末考试试卷高二物理一、选择题(本大题共12小题,每小题4分,共48分.在每题给出的四个选项中,1-8题只有一项符合题目要求,9-12题有多项符合题目要求.)1.如图所示,小磁针正上方的直导线一小磁针平行,当导线中有电流时,小磁针会发生偏转.首先观察到这个实验现象的物理学家和观察到的现象是()A.安培,小磁针的N极垂直转向纸内B.安培,小磁针的S极垂直转向纸内C.奥斯特,小磁针的N极垂直转向纸内D.奥斯特,小磁针的S极垂直转向纸内2.关于静电场,下列说法正确的是()A.电势等于零的物体一定不带电B.电场强度为零的点,电势一定为零C.同一电场线上的各点,电势一定相等D.负电荷沿电场线方向移动时,电势能一定增加3.如图所示,实线是电场线,一带电粒子只在电场力的作用下沿虚线由A运动到B的过程中,其速率﹣时间图象是选项中的()A.B.C.D.4.一金属球,原来不带电,现沿球的直径的延长线放置一均匀带电的细杆MN,如图所示,金属球上感应电荷产生的电场在球内直径上a、b、c三点的场强大小分别为E a、E b、E c,三者相比()A.E a最大B.E b最大C.E c最大D.E a=E b=E c5.有一个长方体金属电阻,材料分布均匀,边长分别为a、b、c,且a>b>c.电流沿以下方向流过该金属电阻,其中电阻阻值最小的是()A.B.C D.6.一电压表由电流表G与电阻R串联而成,如图所示,若在使用中发现此电压表的读数总比准确值稍小一些,采用下列哪种措施可能加以改进()A.在R上串联一比R小得多的电阻B.在R上串联一比R大得多的电阻C.在R上并联一比R小得多的电阻D.在R上并联一比R大得多的电阻7.显像管原理的示意图如图所示,当没有磁场时,电子束将打在荧光屏正中的O点,安装在管径上的偏转线圈可以产生磁场,使电子束发生偏转.设垂直纸面向里的磁场方向为正方向,若使高速电子流打在荧光屏上的位置由a点逐渐移动到b点,下列变化的磁场能够使电子发生上述偏转的是()A.B.C.D.。
2017-2018学年安徽省宿州市芦岭矿中学、朱仙庄矿中学高二上学期期末联考地理试题 解析版

芦岭矿中学2017~2018学年度第一学期期末考试试卷高二年级地理第Ⅰ卷(选择题共60分)一、选择题:(每题2分,共60分。
下面各题四个选项中,只有一项是符合题意的,请把正确的选项填在后面的答题表中。
)1. 关于区域的叙述,错误的是()A. 区域具有一定的区位特征B. 区域都有一定的面积和形状C. 区域都有一定明确的界线D. 区域地理环境对区域发展有深刻的影响【答案】C【解析】试题分析:区域都具有一定的区位特征,A正确。
区域都有一定的面积和形状,B正确。
区域都有一定的界线,行政区的界线一般是明确的,自然区一般没有明确界线,C错。
区域地理环境对区域发展有深刻的影响,D正确。
【考点定位】区域的特征。
【名师点睛】了解区域的主要特征,区域有一定的面积和形状,有一定界线。
要注意界线分自然界线和人为界线,人为界线一般是明确的,自然界线一般是模糊的。
区域地理环境对区域发展有深刻的影响。
2. 关于区域环境的叙述正确的是( )A. 区域环境是指区域内的自然环境B. 受人类生产和生活的影响,区域环境是不断发展变化的C. 区域环境是指区域内的人文环境D. 区域环境对人类活动的影响随人类生产力的进步而增大【答案】B【解析】区域环境是指区域内的自然环境和社会环境的综合;受人类生产和生活的影响,区域环境是不断发展变化的;区域环境是指区域内的自然环境和人文环境;区域环境对人类活动的影响随人类生产力的进步而增大或减小。
故选B。
3. GIS的全称是()A. 地理信息系统B. 遥感技术C. 全球定位系统D. 数字地球【答案】A【解析】GIS的全称是地理信息系统,选A。
据报载,我国江西省中南部山区出现大片“红色荒漠”,即在亚热带湿润的岩溶地区,土壤遭受严重侵蚀,基岩裸露,地表出现出类似荒漠化景观的土地退化现象。
据此,回答下面小题。
4. “红色荒漠”形成的自然原因主要是()A. 风化作用B. 风力侵蚀作用C. 流水侵蚀作用D. 沉积作用5. “红色荒漠”形成的人为原因主要是()A. 滥伐森林B. 过度放牧C. 开山取石D. 环境污染6. 根据江西丘陵山区自然条件的特点,对“红色荒漠”进行治理工作应当先做好的工作是()A. 大力开荒种田,保持植物覆盖率B. 农业生产加强综合开发C. 发展以畜牧业为主的农业生产D. 彻底退耕还林【答案】4. C 5. A 6. B【解析】本题考查南方丘陵地区红漠化成因及治理。
安徽省宿州市埇桥区朱仙庄矿中学高中化学必修一:4.4硝酸 教学设计

《硝酸的性质》教学设计【教材分析】硝酸这一节内容是在讲述了氮气、氨气、铵盐后,对于氮的化合物有了一些了解,硝酸的物理性质和酸性在初中也已有所了解,本节是建立在这两个基础上再来学习硝酸特殊的性质。
其中硝酸的氧化性是本节的重点内容,也是本节的教学难点。
通过观察铜与浓硝酸和稀硝酸反应时的不同现象。
加深学生对硝酸氧化性的认识及对反应产物的记忆,同时也解开了学生在初中时学习实验室制氢气时不能选用硝酸的疑惑。
同时教材还介绍了硝酸的不稳定性,拓宽了学生的视野。
【设计理念】通过探究式学习,让学生自主的获取知识和技能,体验和了解科学探究的过程和方法,形成创新意识,树立科学的价值观。
所以,在本节的重点内容—硝酸的强氧化性的教学处理上,特别注重这点,让学生成为主体,活跃于课堂,最大程度地调动了学生学习的积极性。
在实验中以实验探究引导思考,让学生在探究知识,掌握技能的同时得到科学方法训练,体验实验探究的快乐,形成和发展探究能力,倡导“教贵善诱,学贵善思,以诱达思,启智悟道”的启发式教学。
【教学目标】知识与技能1. 了解硝酸的物理性质2. 掌握硝酸的化学性质3. 了解硝酸的用途和环境污染过程与方法通过对实验现象的观察、分析和推理,培养学生的实验能力、观察能力、思维能力和创新能力,提高学生的化学素养.情感态度与价值观在实验探究中体验质疑、求真,同时培养学生主动参与、积极探究、勤于动手的态度,树立环保意识。
【教学重点、难点】重点:硝酸的特性;难点:硝酸的强氧化性.【教学方法】“教贵善诱,学贵善思,以诱达思,启智悟道”的启发式教学。
【课时安排】1课时【教学流程】引课]人们常说“雷雨发庄稼”,结合前面学习的有关氮及其化合物知识解释该现象。
在其过程中生成的HNO3是常见的三大强酸之一,也是重要的化工原料,它有哪些性质和用途呢?这也就是我们本节课将要探究的内容。
展示]一瓶浓硝酸,组织学生观察颜色和状态并让一位同学演示闻气味的方法,通过实验观察硝酸的挥发性.归纳出硝酸的物理性质。
【数学】安徽省宿州市芦岭矿中学、朱仙庄矿中学2017-2018学年高二上学期期末联考(理)

安徽省宿州市芦岭矿中学、朱仙庄矿中学2017-2018学年高二上学期期末联考(理)一、选择题(本大题共12小题,每题5分,共60分。
每题只有一个正确答案) 1、设命题p :∃n ∈N ,n 2>2n ,则“非p ”为( )A .∀n ∈N ,n 2>2nB .∃n ∈N ,n 2≤2nC .∀n ∈N ,n 2≤2nD .∃n ∈N ,n 2=2n2、抛物线y 2=6x 的准线方程是( )A .x=3B .x=﹣3C .x=D .x=﹣3、若圆(x-3)2+(y+5)2=r 2上的点到直线4x-3y-2=0的最近距离等于1,则半径r 值是( )A. 4B. 5C. 6D. 94、过点A(1,2)且与原点距离最大的直线方程是( )A. x+2y-5=0B. 2x+y-4=0C. x+3y-7=0D. x+3y-5=05、某几何体的三视图如图所示(单位:cm),则该几何体的体积是( )A .8 cm 3B .12 cm 3 C.323 cm 3 D.403cm 36、若平面α的法向量为1(3,2,1)n =,平面β的法向量为)1,0,2(-=n ,则平面α与β夹角的余弦是( )B.C. D.7、点M 在z 轴上,它与经过坐标原点且方向向量为s =(1,-1,1)的直线l 的距离为6,则点M 的坐标是( )A .(0,0,±2)B .(0,0,±3)C .(0,0,±3)D .(0,0,±1)8、已知直线l 过点P(1,0,-1),平行于向量(2,1,1)a =,平面α过直线l 与点M(1,2,3),则平面α的法向量不可能是( ) A. (1,-4,2) B.11(,1,)42- C. 11(,1,)42-- D. (0,-1,1)9、已知双曲线22221x y C a b -=:(0a >,0b >)的一条渐近线方程为y =,且与椭圆221123x y +=有公共焦点.则C 的方程为( ) A .221810x y -=B .22145x y -=C .22154x y -=D .22143x y -=10、在长方体ABCD -A 1B 1C 1D 1中,AB =BC =2,AA 1=1,则BC 1与平面BB 1D 1D 所成角的正弦值为( )A.63B .255C.155D .10511、若点O 和点F 分别为椭圆x 24+y 23=1的中心和左焦点,点P 为椭圆上的任意一点,则OP →·FP→的最大值为( )A .6B .3C .2D .8 12、若P 是以F 1,F 2为焦点的椭圆=1(a >b >0)上的一点,且PF 1⊥PF 2, tan ∠PF 1F 2=,则此椭圆的离心率为( )A .B .C .D .二、填空题(本大题共4小题,每题5分,共20分)13.已知向量(,12,1),(4,5,1),(,10,1)OA k OB OC k ===-,且A 、B 、C 三点共线, 则k =14.已知抛物线22(0)y px p =>的过焦点的弦为AB ,且9AB =,6A B x x +=, 则p= 的圆心为C , ()1,0A 是圆内一定点, Q 为圆周上任一15、设圆点,线段AQ 的垂直平分线与CQ 的连线交于点M ,则M 的轨迹方程为 16、已知椭圆22416x y +=,直线AB 与椭圆交于A 、B 两点,若点 P (2,-1)是线段AB 的中点,则直线AB 的方程是.()22125x y ++=三、解答题(本大题6小题,共70分。
安徽省宿州市十三所重点中学高二化学上学期期中试题(含解析)

2018—2019学年度第一学期期中质量检测高二化学试题(理科)说明:1、本试卷分第I卷和第II卷两部分;满分100分,考试时间100分钟。
2、请将第I卷和第II卷两部分的答案用黑笔或蓝色笔写在试卷答题卷上。
可能用到的相对原子质量:H:1 C:12 N:14 O: 16 P: 31 Cu: 64第I卷(选择题共48分)一、选择题(本题共计16小题,每小题只有一个正确答案,每小题3分,共计48分)1。
下列说法正确的是A。
能自发进行的反应都是放热反应B。
硝酸铵溶于水是熵增加的过程C. 工业合成氨的反应是熵增加反应D。
碳酸钙受热分解在任何温度下均不能自发进行【答案】B【解析】【分析】结合ΔG=ΔH—TΔS,若ΔG<0,则为自发反应,反之,非自发;【详解】A.由ΔG=ΔH-TΔS可知,能自发进行的反应不一定都是放热反应,熵增的吸热反应在一定条件下也能自发进行,A项错误;B。
硝酸铵溶于水混乱程度增大,是熵增加的过程,B项正确;C。
工业合成氨的反应是熵减反应,C项错误;D.碳酸钙受热分解反应为吸热反应,是熵增的反应,结合ΔG=ΔH—TΔS,在高温下能自发进行,D项错误;答案选B。
【点睛】反应能否自发由ΔG=ΔH-TΔS决定,若ΔG〈0,则为自发反应,若ΔG〉0,则为非自发反应;2.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,不正确的是A. 用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-===Cl2↑B. 钢铁发生电化学腐蚀时负极反应式为Fe-2e-===Fe2+C. 粗铜精炼时,与电源负极相连的是纯铜,阴极反应式为Cu2++2e-=== CuD。
氢氧燃料电池的负极反应式为O2+2H2O+4e-===4OH-【答案】D【解析】【分析】A。
电解饱和食盐水时,阳极上氯离子放电,生成Cl2;B.钢铁发生电化学腐蚀时,负极反应式为Fe-2e-=Fe2+;C.精炼粗铜时,粗铜作阳极、纯铜作阴极;D.氢氧燃料电池中,负极上失电子、正极上得电子。
安徽省宿州市芦岭矿中学、朱仙庄矿中学2017-2018学年

芦岭矿中学2017-2018学年度第一学期期末考试高二数学(文科)试卷 第Ⅰ卷(共60分)一、选择题(每题5分,满分60分,将答案填在答题纸上): 1、“点P 在直线m 上,m 在平面α内”可表示为( )A .P ∈m ,m ⊆αB .P ∈m ,m ∈αC .P ⊆m ,m ∈αD .P ⊆m ,m ⊆α2、已知双曲线22184x y -=的的渐近线方程为( ) A .x y 21±= B .x y 2±= (C )x y 22±= (D )x y 2±= 3、“m n >”是“22m n >”的( )A. 既不充分也不必要条件 B .充分不必要条件 C.充分必要条件D. 必要不充分条件4、已知函数32()f x x ax x c =+-+,且'(1)a f =.则a =( )A .1B .2C .-1D .-2 5、221x y =在点11,2⎛⎫ ⎪⎝⎭处的切线方程为( ) A. 2210x y ++= B. 2210x y +-=C. 2210x y --=D. 2230x y --= 6、若一个三棱柱的三视图如图所示,其俯视图为正三角形, 则这个三棱柱的高和底面边长分别为( )A .2,2 3B .2,4C .4,2D .22,27、设a R ∈,若直线1l :280ax y +-=与直线2l :(1)40x a y +++=平行,则a 的值为( )A.1-B. 1C.2-或1-D. 1或2-8、有下列四个命题:①“若1xy =,则,x y 互为倒数”的逆命题;②“相似三角形的周长相等”的否命题;③“若1b ≤-,则方程2220x bx b b -++=有实根”的逆否命题;④“若A B B = ,则A B ⊇”的逆否命题. 其中真命题是( )A . ① ③B ② ③C ① ②D ③ ④ 9、经过点M (2,1)作圆x 2+y 2=5的切线,则切线方程为( )+y -5=0 B. 2x +y -5=+y +5=0 D. 2x +y +5=010、若椭圆181622=+y x 的弦被点)1,2(平分,则此弦所在的直线方程( ) A .014132=-+y x B .042=-+y x C .03=-+y x D .082=-+y x 11、球面上四点P 、A 、B 、C ,,已知PA 、PB 、PC 两两垂直,且PA =PB =PC =a ,则球的表面积为( )A . 22a π B .26a π C .24a π D .23a π12、已知直线)2(+=x k y )0(>k 与抛物线x y 82=相交于B A ,两点,F 为抛物线的焦点,若FB FA 2=,则k 的值为( )A.322 B. 32C. 31D. 32第Ⅱ卷(共90分)二、填空题(每题5分,满分20分,将答案填在答题纸上) 13、抛物线x y 42=的焦点到准线的距离是________. 14、命题“2,1x N x ∀∈>”的否定为 .”15、如图,已知二面角α-l -β为600,点A∈α,AC⊥l,垂足为C ,点B∈β,BD⊥l,垂足为D ,且AC=2,CD=3,DB=2,则AB=16、已知圆C 的圆心是直线01=+-y x 与y 轴的交点,且圆C 与直线03=++y x 相切,则圆的标准方程为 .三、解答题 (本大题共6小题,共70分.解答应写出文字说明、证明过程或演算步骤.) 17、已知双曲线方程为14491622=-x y . (1)求该双曲线的实轴长、虚轴长、离心率;(2)若抛物线C 的顶点是该双曲线的中心,而焦点是其下顶点,求抛物线C 的方程.α l A CBDβ18、已知p :函数2()lg(3)f x x x a =-+的定义域为R ,q :函数()(25)g x a x =-在R 上单调递增.若p q ∨ 为真,而p q ∧为假,求实数a 的取值范围.19、(1)求函数y =e x+1e x -1的导数;(2) 设函数f (x )=ax 3+bx +c (a ≠0)为奇函数,其图象在点(1,f (1))处的切线与直线x -6y -7=0垂直,导函数f ′(x )的最小值为-12,求a ,b ,c 的值;20、已知以点()1,2A -为圆心的圆与直线1:220l x y ++=相切,过点()2,0B -的直线l 与圆A 相交于,M N 两点,Q 是MN 的中点,4MN =. (1)求圆A 的标准方程; (2)求直线l 的方程.21、如图,四棱锥错误!未找到引用源。
安徽省宿州市高二上学期理综-化学期中考试试卷

安徽省宿州市高二上学期理综-化学期中考试试卷姓名:________ 班级:________ 成绩:________一、选择题(每题2分,共18分。
) (共18题;共45分)1. (2分)新能源的开发利用是人类社会可持续发展重要课题。
下列物质属于新能源的是A . 氢气B . 煤炭C . 天然气D . 石油2. (2分) (2016高三上·滕州期中) 一定条件下,向密闭容器中加入 X物质,发生反应3X(g)═Y(g)+Z(g)△H<0,反应一定时间后改变某一个外界条件,反应中各时刻X物质的浓度如下表所示,下列说法中不正确的是()反应时间(min)05151720X的浓度(mol/L) 1.00.40.40.70.7A . 0~5 min时,该反应的速率为v(X)=0.12 mol/(L•min)B . 5 min时反应达到第一次平衡,该温度下的平衡常数数值为0.625C . 15 min时改变的条件不可能是升高温度D . 从初始到18 min时,X的转化率为30%3. (2分)(2020·嘉兴模拟) 600℃时,在 2 L 的恒容密闭容器中充入一定量的 CO 和 H2O,发生反应: CO(g)+H2O (g) CO2(g)+H2 (g)。
反应过程中的部分数据如下表所示:()下列说法正确的是A . 0~5 min 用 CO 表示的平均反应速率为0.08mol·L−1·min−1B . 该反应在 10 min 后才达到平衡C . 温度升高至800℃时,反应平衡常数为 0.64,则正反应为吸热反应D . 保持其他条件不变,起始时向容器中充入 0.60 molCO 和 1.20 molH2O,达到平衡时 n(CO2)=0.4mol4. (2分) (2016高一下·沙市月考) 下列关于ⅦA族元素的叙述正确的是()A . ⅦA族元素是同周期中原子半径最大的元素(惰性气体元素除外)B . ⅦA族元素是同周期中非金属性最弱的元素C . ⅦA族元素的最高正价都是+7价D . ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数5. (2分)沼气是一种能源,它的主要成分是CH4 , 0.5molCH4完全燃烧生成CO2和液态水时放出445kJ 的热量,则下列热化学方程式中正确的是()A . 2CH4(g)+4O2(g)=2CO2(g)+4H2O(g)△H=+890kJ•mo l﹣1B . CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890kJ•mol﹣1C . 1/2 CH4(g)+O2(g)=CO2(g)+H2O(l)△H=﹣890kJ•mol﹣1D . CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890kJ•mol﹣16. (2分) (2019高一上·扶余月考) 配制一定物质的量浓度的MgSO4溶液时,下列情况可能导致实际浓度偏高的是()A . 称量时部分MgSO4吸收了水蒸气B . 定容时俯视容量瓶上的刻度线C . 洗涤后的容量瓶中有少量水珠D . 溶解过程中有少量的溶液溅出烧杯外7. (2分)(2020·承德模拟) 实验室模拟从海带提取碘单质的流程如下:下列有关说法正确的是()A . 实验室在蒸发皿中灼烧干海带B . 操作1为过滤,操作3为蒸馏 H2SO4(aq)C . 含I-的滤液中加入稀硫酸和 H2O2后,碘元素发生还原反应D . 含I-和IO3-的混合溶液中加入稀硫酸发生反应的离子方程式为: 5I-+IO3-+6H+=3I2+3H2O8. (2分) (2018高二上·武清期中) 下列有关“电离平衡”的叙述正确的是()A . 电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等B . 电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是静态平衡C . 电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动D . 电解质达到电离平衡后,各种离子的浓度相等9. (2分) (2016高一下·怀仁期中) 下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是()A . 2Na2O2+2H2O═4NaOH+O2↑B . Mg3Cl2+2NaOH═Mg(OH)2↓+2NaClC . 2NaOH+Cl2═NaOCl+H2OD . NH4Cl+NaO═NaCl+NH3↑+H2O10. (3分) NA代表阿伏加德罗常数的值。
安徽省宿州市芦岭矿中学、朱仙庄矿中学2017-2018学年高二上学期期末联考英语试题

2017-2018学年度第一学期期末考试试卷高二年级英语本试卷分第I卷(选择题)和第II卷(非选择题)两部分。
满分150分,考试时120分钟。
注意事项:答案应写在答题卡上,不能写在试题卷上。
第I卷选择题(共三部分满分100分)第一部分听力(共两节,满分30分)做题时,先将答案标在试卷上。
录音内容结束后,你将有两分钟的时间将试卷上答案转涂到答题卡上。
第一节(共5小题;每小题1.5分,满分7.5分)听下面5段对话。
每段对话后有一个小题,从题中所给的A、B、C三个选项中选出最佳选项,并标在试卷的相应位置。
听完每段对话后,你都有10秒钟的时间来回答有关小题和阅读下一小题。
每段对话仅读一遍。
1. What might prevent the woman buying the table?A. Its quality.B. Its price.C. Its design.2. Who planted the trees?A. The woman.B. Henry.C. Someone else.3. What happened to the woman?A. She got fired today.B. She got promoted last week.C. She was fooled by the man.4. What did the man do?A. He gave the woman the wrong information.B. He put the sugar in the black container.C. He added salt to his coffee.5. How long is a day on Mars?A. Less than 24 hours.B. 24 hours and 37 minutes.C. 37 hours.第二节(共15小题;每小题1.5分,满分22.5分)听下面5段对话或独白。
安徽省宿州市芦岭矿中学、朱仙庄矿中学2017-2018学年高二上学期期末联考物理试题

安徽省宿州市芦岭矿中学、朱仙庄矿中学2017-2018学年高二上学期期末联考物理试题一、单选题1. 如图所示,小磁针正上方的直导线与小磁针平行,当导线中通向右的电流时,小磁针会发生偏转。
首先观察到这个实验现象的物理学家和观( )察到的现象是A.物理学家安培,小磁针的S极垂直转向纸内B.物理学家安培,小磁针的N极垂直转向纸内C.物理学家奥斯特,小磁针的S极垂直转向纸内D.物理学家奥斯特,小磁针的N极垂直转向纸内2. 关于静电场,下列说法正确的是()A.电势等于零的物体一定不带电B.电场强度为零的点,电势一定为零C.同一电场线上的各点,电势一定相等D.负电荷沿电场线方向移动时,电势能一定增加3. 如图所示,实线是电场线,一带电粒子只在电场力的作用下沿虚线由A运动到B的过程中,其速度-时间图象是选项中的( )A.B.C.D.4. 一金属球,原来不带电,现沿球的直径的延长线放置一均匀带电的细杆MN,如图所示,金属球上感应电荷产生的电场在球内直径上a,b,c 三点的场强的大小分别为E a、E b、E c,三者相比()A.E a最大B.E b最大C.E c最大D.E a=E b=E c5. 欧姆不仅发现了欧姆定律,还研究了电阻定律,有一个长方体型的金属电阻,材料分布均匀;边长分别为a、b、c,且a>b>c。
电流沿以下方向流过该金属电阻,其中电阻的阻值最小的是()A.B.C.D.6. 显像管原理的示意图如图所示,当没有磁场时,电子束将打在荧光屏正中的O点,安装在管径上的偏转线圈可以产生磁场,使电子束发生偏转.设垂直纸面向里的磁场方向为正方向,若使高速电子流打在荧光屏上的位置由a点逐渐移动到b点,下列变化的磁场能够使电子发生上述偏转的是()二、多选题A .B .C .D .7. 如图所示,半径为r 的圆形空间内,存在着垂直于纸面向外的匀强磁场,一个带电粒子(不计重力),从A 点沿半径方向以速度v 0垂直于磁场方向射入磁场中,并由B 点射出,且∠AOB =120°,则该粒子在磁场中运动的时间为( )A .B .C .D .8. 在如图所示的电路中,闭合开关K 后,当滑动变阻器R 1的滑动片P 向b 端移动时()A .A 1的示数增大,V 的示数减小B .A 1的示数减小,A 2的示数增大C .A 2的示数增大,V 的示数增大D .A 1的示数增大,A 2的示数增大9. 如图所示,甲、乙为两个独立电源的路端电压U 与通过它们的电流I 的关系图线,下列说法中正确的是( )A .路端电压都为U 0时,它们的外电阻相等B.电流都是I0时,两电源的内电压相等C.电源甲的电动势大于电源乙的电动势D.电源甲的内阻小于电源乙的内阻10. 下列说法正确的是()A.处在磁场中的电荷一定受到洛仑兹力的作用B.处在电场中的电荷一定受到电场力的作用C.洛伦兹力不改变带电粒子的动能D.洛伦兹力不改变带电粒子的速度方向11. 如图所示,条形磁铁放在水平桌面上,其中央正上方固定一根直导线,导线与磁铁垂直,并通以垂直纸面向外的电流,()A.磁铁对桌面的压力减小B.磁铁对桌面的压力增大C.受到桌面向左的摩擦力D.受到桌面向右的摩擦力三、实验题12. 为了测量某根金属丝的电阻率,需要测量长为L的金属丝的直径d和电阻R.某同学进行如下几步进行测量:(1)直径测量:该同学把金属丝放于螺旋测微器两测量杆间,测量结果如图1,由图可知,该金属丝的直径d=__.四、解答题(2)欧姆表粗测电阻,他先选择欧姆×10档,测量结果如图2所示,为了使读数更精确些,还需进行的步骤是__.(填字母序号)A .换为×1档,重新测量B .换为×100档,重新测量C .换为×1档,先欧姆调零再测量D .换为×100档,先欧姆调零再测量(3)伏安法测电阻,实验室提供的滑变阻器(0~20Ω),电流表(0~0.6A ,内阻约0.5Ω),电压表(0~3V ,内阻约5kΩ),为了测量电阻误差较小,且电路便于调节,下列备选电路中,应该选择__.(填字母序号)13.用电流表和电压表测干电池的电动势和内电阻,提供的器材如图甲所示.(1)用实线代表导线把图甲所示的实物连接成测量电路_____.(两节干电池串联作为电源,图中有部分线路已连接好)(2)图乙中的6个点表示实验中测得的6组电流I 、电压U 的值,按照这些实验值作出U ﹣I 图线_____,由此图线求得的电源电动势E=__V ,内电阻r=__Ω.(结果保留两位小数)14. 右下图为一示波管中的水平偏转极板,已知极板的长度为L ,两板距离为d ,所加偏转电压为U ,且下板带正电;若一束电子以初速v 0沿极板的中线进入偏转电场,最终电子从P 点飞出。
安徽省淮北市矿业集团公司芦岭煤矿中学2018年高二化学月考试题含解析

安徽省淮北市矿业集团公司芦岭煤矿中学2018年高二化学月考试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 工业上可利用合成气(CO和H2的混合气体)生产甲醇。
已知:CO(g)+2H2(g)CH3OH(g) ΔH=-92.9 kJ/mol一定条件下,该反应在一体积固定的密闭容器中达到平衡。
下列说法正确的是A.该反应的△S<0B.该反应在任何温度下均能自发进行C.向容器中充入少量He,平衡向正反应方向移动D.升高温度平衡向正反应方向移动参考答案:A略2. 质谱图显示,某化合物的相对分子质量为74,燃烧实验发现其分子内碳、氢原子个数之比为2∶5,核磁共振氢谱显示,该物质中只有两种类型的氢原子。
关于该化合物的描述中,不正确的是【】A.该化合物一定为乙醇的同系物 B.该化合物为2--丁醇的同分异构体C.该化合物可能为乙醚 D.该化合物可能为2--甲基--2--丙醇参考答案:A略3. 下列叙述正确的是()A.丙烷分子中3个碳原子一定在同一条直线上B.甲苯分子中7个碳原子都在同一平面C.乙烷分子中碳原子和全部氢原子可能在同一平面上D.2—丁烯分子中4个碳原子可能在同一条直线上参考答案:B略4. 下列情况与平衡移动无关的是:A.用KClO3制取O2时,加入少MnO2作为催化剂B.滴加酚酞的氨水中加入氯化铵固体后红色变浅C.FeCl3滴入沸水中,煮沸片刻得到红褐色胶体D.加热后的纯碱水洗油污比冷碱水效果好参考答案:A略5. 在烧焦的鱼、肉中含有致癌物质3, 4一苯并芘, 其结构简式如右图所示, 它是一种稠环芳香烃, 其分子式是()A. C20H12B. C20H14C. C19H12D. C22H20参考答案:A略6. 铝可以制造多种建筑型材。
铝在空气中能够稳定存在的原因是A.铝的活泼性很差 B.铝的还原性很差C.铝与氧气不反应 D.铝表面有致密的氧化膜参考答案:D铝的活泼性强,在空气中,铝表面容易形成致密的氧化膜。
安徽省宿州市十三所重点中学高二化学上学期期中试题文

宿州市十三所要点中学2018-2019 学年度第一学期期中质量检测高二化学试题(文科)说明: 1、本试卷分第I 卷和第 II卷两部分;满分100分,考试时间60 分钟。
2、请将第 I 卷和第 II 卷两部分的答案用黑笔或蓝色笔写在试卷答题卷上。
可能用到的相对原子质量:H:1 C:12 N:14 O: 16第I 卷(选择题共60分)一、选择题(此题包含20 小题,每题 3 分,共 60 分,每题只有一个选项切合题意)1. 2018 年我国环境日主题是“漂亮中国,我是行动者”。
以下做法不利于保护环境的是()A.使用聚乳酸、聚羟基丁酸酯等可降解塑料B.将废旧电池投于有害垃圾箱,集中回收办理C.焚烧废旧电器回收贵金属D.回收再利用旧木材2.以下污染现象主要与二氧化硫相关的是()A.光化学烟雾B.酸雨C.白色污染D.臭氧层空洞3.以下物质中不行做净水剂的是()A.磺化煤B.高铁酸盐C.活性炭D.明矾4.以下说法中有助于身心健康的是()A.多吃高蛋白的营养物质B.保健食品老小皆宜,人人合用C.大批食用火腿肠等肉腌制品D.多吃蔬菜5.世界地球日旨在动员公众参加到环保运动中,经过绿色低碳生活,改良地球的整体环境。
以下举措不切合这一意义的是()A.使用含磷洗衣粉B.使用自行车出行C.炼铁炉渣制水泥D. 回收旧书报6.饮食宝塔最基层的食品所包含的主要营养成分是()A.糖类B.油脂C.蛋白质D.维生素7.以下相关物质用途的说法中,正确的选项是()① 用明矾来消毒水② 饮食纤维能为人体供给能量③ 石灰石可用于烟道气体脱硫④ 吊兰、芦荟等能够汲取甲醛A. ①②③④B.②③④C.③④D.①②8.以下有机物中,属于高分子化合物的是()A. 甘油B.氨基酸C.葡萄糖D.淀粉9.保护环境是每个公民的责任和义务。
惹起以下环境污染的原由不正确的选项是()A.重金属、农药和难分解有机物等会造成水体污染B.装修资猜中使用的涂料、黏合剂等会造成居室污染C.水体污染会致使地方性甲状腺肿D.CO2和氟氯代烃等物质的大批排放会致使温室效应的加剧10.以下不属于家用厨房燃料的是()A.天然气B.汽油C.液化石油气D.蜂窝煤11.食品是保持人体生命和保证健康的物质基础。
安徽省宿州市朱兰店中学2018年高二化学上学期期末试题含解析

安徽省宿州市朱兰店中学2018年高二化学上学期期末试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 下面是小王在医院做的血常规检查报告单的部分内容,小王应该注意补充的微量元素是A.硒 B.锌 C.铁 D.碘参考答案:C略2. 有一元酸和一元碱两种溶液,其pH分别为2和12,两溶液等体积混合后的pH为()A.大于7 B.小于7C.等于7 D.大于、小于或等于7都有可能参考答案:D考点:酸碱混合时的定性判断及有关ph的计算.专题:电离平衡与溶液的pH专题.分析:根据酸可能是强酸也可能为弱酸,碱可能是强碱也可能为弱碱来分析.解答:解:若酸为一元强酸,碱为一元强碱,则两溶液等体积混合后恰好完全反应生成强酸强碱盐,溶液呈中性,此时pH=7;若酸为一元弱酸,碱为一元强碱,则两溶液等体积混合后酸过量,得酸和盐的混合溶液,根据电离大于水解可知溶液呈酸性,此时pH<7;若酸为一元弱酸,碱为一元弱碱,则两溶液等体积混合后谁过量、溶液显什么性,具体要看酸和碱的相对强弱,即所得溶液可能pH<7,也可能pH>7,也可能PH=7;若酸为强酸,碱为弱碱,则碱过量,所得溶液中含过量的碱和生成的强酸弱碱盐,根据电离大于水解可知,溶液显碱性,即pH>7;通过以上分析可知,由于酸和碱的强弱不明确,故两溶液等体积混合后的pH可能大于7,也可能小于7,也可能等于7,故选D.点评:本题考查了酸碱混合后溶液酸碱性的判断,应注意的是酸和碱的强弱对溶液PH的影响,难度不大.3. 实验测得碳单质、氢气、甲烷的燃烧热(△H)分别为-393.5 kJ/mol、-285.8kJ/mol、-890.3 kJ/mol。
则CH4(g) == C(s) + 2H2(g)的反应焓变(△H)为B略4. 在一定温度下,反应H2(g)+X2(g)HX(g)的平衡常数为10。
若将1.0 mol的HX(g)通入体积为1.0 L的密闭容器中,在该温度时HX(g)的最大分解率接近于() A.5% B.17% C.25% D.33%参考答案:B由题中的反应和数据可知:HX(g) H2(g)+X2(g)的平衡常数K=0.1。
安徽省宿州市埇桥区朱仙庄矿中学高中化学必修一-4.3硫的转化 教案
或是还原剂
你能通过其他的可能反应来说明 S 单质有氧化 硫的化学
性还有还原性吗?
教学环节
教师活动
性质
提示:要想证明 S 单质有氧化性可以找还原性
的物质反应,反之一样。还原性的物质我们之
前总结过有金属单质,氢气等。氧化性的物质
有氧气,HNO3,H2SO4 浓 提示:(1)硫和我们之前学过的氯气都是非金 属单质,从物质分类的角度请你预测一下硫可 以与哪些类别的物质反应? (2):硫的化学性质 3)根据你的预测,设计出实验方案,实施实验 进行验证
板书一、 硫的化合价
-2 -1 0 +4 +6
我们根据硫元素在自然界中的转化给大家模拟
了这个过程,要求大家判定出不用物质中硫元
素的化合价
学生活动 思考回答
设计意图 以此作为切入点可 以激发学生学习兴 趣,便于展开新课。
教学环节
教师活动
学生活动
设计意图
播放幻灯片【展示】自然界中不同价态硫元素
间是如何转化的
H2O H2O2 (不是)
讨论交流
【思考】根据硫的溶解性思考如何洗涤内壁附
有硫的试管?
培养学生运用知识 解决问题的能力
学生回答:CS2
补充热的 NaOH 溶液也可以
通过教师的引导 通过这个反应也引
3S+6NaOH==2Na2S+Na2SO3+3H2O
证明:硫既有氧 出硫的化学性质,氧
化性又有还原性 化性和还原性 在这个氧化还原反应里,大家判断 S 是氧化剂
教材分析 学习硫元素,有利于学生养成科学系统的学习方法。先由硫在自然界中的存在状态再
到不同价态硫元素的转化,进而探讨硫的主要性质——氧化性和还原性。通过本节课
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
安徽省宿州市芦岭矿中学、朱仙庄矿中学2017-2018学年高二上学期期末联考试题注意:1.在本试卷上作答无效,应在答题卡各题指定的答题区域内作答。
2.相对原子质量:H-l C-12 O-16 Na-23 Cl-35.5第Ⅰ卷选择题(共48分)本题包括16小题,每小题3分,共48分。
每小题只有一个选项符合题意。
1.下列有关“化学与生活”描述不正确...的是()A.核能的利用可能会造成放射性污染,应该立即关闭所有核电站B.中国古代利用明矾溶液的酸性清除铜镜表面的铜锈C.泡沫灭火器中使用了盐类水解的原理D.安徽新能源公司生产的锂离子电池可以将化学能转化为电能2.下列物质属于弱电解质的是()A.NaCl B.NH3·H2O C.海水D.蔗糖3.某化学反应的能量变化如图1所示。
下列有关叙述正确的是()A.如图可知a一定使用了催化剂B.该反应为放热反应,ΔH=E1-E2C.使用催化剂,可以改变化学平衡常数D.使用催化剂,可降低该反应的活化能4.下列关于充电电池的叙述,不正确...的是()A.充电电池的化学反应原理是氧化还原反应B.充电电池可以无限制地反复放电、充电,永不损耗C.充电是使放电时的氧化还原反应逆向进行D.较长时间不使用电器时,最好从电器中取出电池,并妥善存放5.下列有关电解应用,正确的是( )A .电解精炼铜时,粗铜作阴极B .电解精炼铜时,溶液浓度基本不变C .在铁制容器上镀铜时,可用CuSO 4溶液作电镀液D .在铁制容器上镀铜时,铁制容器连接外接电源的正极6.下列物质对水的电离平衡不产生...影响的是( ) A .H 2SO 4 B .Ba(OH)2 C .KCl D .CH 3COONa7.下列有关pH 的说法正确的是( )A .常温下,测得0.1 mol·L -1盐酸的pH =1B .测定溶液pH 时,事先将pH 试纸润湿C .pH 相同的醋酸溶液导电性一定比盐酸的弱D .常温下,将pH =1的醋酸溶液稀释1 000倍,测得pH =48.2005年美国化学会刊报道,美国俄勒冈大学的化学家使用了一种新型催化剂,在常温 常压下合成氨,反应可表示为N 2+3H 2 2NH 3 △H <0,有关说法正确的是( )A .该反应△H <0,△S <0,在任何条件下均可自发进行B .新法合成氨不需要在高温条件下,可节约大量能源,极具发展远景C .新法合成氨能在常温下进行是因为不需要断裂化学键D .使用此新型催化剂能让该反应进行完全9.在101kPa 时,1mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的 燃烧热,甲烷的燃烧热是890.3kJ·mol -1,则下列热化学方程式书写正确的是( )A .CH 4(g) +23O 2(g) =CO(g) +2H 2O(l) △H =-890.3 kJ·mol -1B .CH 4(g) +2O 2(g) =CO 2(g) +2H 2O(g) △H =-890.3 kJ·mol -1C .CH 4(g) +2O 2(g) =CO 2(g) +2H 2O(l) △H =+890.3 kJ·mol -1D .CH 4(g) +2O 2(g) =CO 2(g) +2H 2O(l) △H =-890.3 kJ·mol -1 10.25℃时,下列各组离子在指定溶液中可能大量共存的是( )A .无色溶液中:NH 4+、Cu 2+、CO 32-、Cl -B .中性溶液中可能大量存在Na +、Ba 2+、Cl -、NO 3-C .pH 值为1的溶液:Na +、Al 3+、CH 3COO -、SO 42-催化剂D.由水电离的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、K+、HCO3-、Br-11.在0.1 mol·L-1氨水中存在如下电离平衡:NH3·H2O NH4++OH-,对于该平衡,下列叙述正确的是()A.加入水时,溶液中c(OH-) 增大B.加入少量NH4Cl固体,平衡向逆方向移动,电离平衡常数减小C.通入少量HCl气体,溶液中c(NH4+)增大D.降低温度,促进NH3·H2O电离12.已知HCN为弱酸,在0.1mol·L-1的KCN溶液中,下列关系不正确...的是()A.c(K+)>c(CN-) B.c(CN-)>c(HCN)C.c(HCN)+c(CN-)=0.2mol·L-1D.c(K+)+c(H+)=c(CN-)+c(OH-)13.已知反应H2(g) +Br2(g)=2HBr(g) △H=-83kJ·mol-1,1molH2(g) 、1molBr2(g) 分子中化学键断裂时分别需要吸收436kJ、193kJ的能量,则断开1molHBr(g) 分子中化学键需吸收的能量为()A.566kJ B.283kJ C.712kJ D.356kJ14.某温度,在1L恒容密闭容器中,加入10molCO、7molH2S,发生如下反应:CO(g)+H2S(g) COS(g)+H2(g),达平衡时CO物质的量为8 mol,下列说法正确的是()A.该温度下,化学平衡常数K=0.1B.H2S的平衡转化率为20%C.增大CO浓度,平衡正向移动,可以提高CO的转化率D.升高温度,H2S浓度增加,表明该反应正方向是吸热反应15.在密闭容器中发生反应N2O4(g)2NO2(g) △H=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.下列说法正确的是()A.反应温度:T1>T2B.a、b两点的平衡常数:K b>K aC.a、c两点气体的颜色:a浅,c深D.b、c两点的反应速率:v(b)>v(c)16.已知在25℃时,Ksp(AgCl)=1.8×10—10,Ksp(AgI)=8.3×10—17,下列说法错误..的是()A.向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度减小B.由于Ksp(AgCl)>Ksp(AgI),AgCl 沉淀在一定条件下可转化为AgI沉淀C.在AgCl沉淀溶解平衡体系中加入蒸馏水,AgCl的Ksp增大D.向等浓度的NaCl和NaI混合溶液中逐滴加入AgNO3溶液,先出现AgI沉淀第II卷非选择题(共52分)17.(11分)利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值。
已知:①CH4(g)+H2O(g) CO(g)+3H2(g) △H=+206.2kJ·mol-1②CO(g)+H2O(g) CO2(g)+H2(g) △H=-42.3kJ·mol-1(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式___________________。
(2)为了探究反应条件对反应CO(g)+H2O(g)CO2(g)+H2(g) △H=-42.3kJ·mol-1的影响,某活动小组设计了三个实验,实验曲线如图3所示①请依据实验曲线图补充完整表格中的实验条件:X=______℃,Y=______MPa。
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=___________mol·L-1·min-1。
③实验Ⅱ达平衡时CO的转化率________ 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”)。
④在530℃时,平衡常数K=1,若往1L容器中投入0.2 mol CO(g)、0.2 mol H2O(g)、0.1 mol CO2(g) 、0.1 mol H2(g),此时化学反应将向___填正、逆或不)方向移动。
18.(12分)电化学原理在金属防护、能量转换、物质合成等方面应用广泛。
(1)通常可用图4所示的两种方式减缓海水对铁闸门腐蚀,则下列说法正确的是_______(填序号)A.甲图中铁闸门上的固体材料R可以是铜B.乙图中铁闸门应与电源的负极连接C.乙图中铁闸门上发生:Fe-2e-=Fe2+(2)NaClO溶液不仅可以消毒杀菌也可用在一种能量转化率高、无污染的Mg-NaClO 燃料电池中,电池的结构示意图如图5。
则镁为_______(填“X”或“Y”)电极,正极上发生的电极反应为:____________。
(3)Cu2O是种半导体材料,基于绿色化学理念设计制取Cu2O的电解池示意图如图6:①石墨应与电源的____________(填“正极”或“负极”)相连;②当有0.1molCu2O生成时,转移电子的物质的量为____________;③写出阴极的电极反应式:_______________________。
19.(12分)含铬化合物的废水有毒,特别是Cr(Ⅵ)有致癌作用,对农作物及微生物的毒害很大。
目前处理的方法较多,还原沉淀法是较为广泛的处理含铬废水的方法,流程如下:(1)步骤①中存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O该反应的平衡常数表达式K=____________________;碱性溶液中Cr(Ⅵ)离子的颜色呈________________。
(填“黄色”或“橙色”)(2)上述操作Ⅰ的名称为_________,以下物质可用于代替步骤②中的Fe2+的是_____ A.KMnO4(H+) B.HNO3C.Na2SO3(3)步骤③中出水总铬与溶液的pH关系如图7,下列说法不正确...的是____________A.为有效除去Cr3+,加入的碱越多越好B.Cr(OH)3可溶于强碱C.要除去Cr3+,调节pH值最好为7左右(4)已知Ksp [Cr(OH)3]=1.1×10-32,按《污水综合排放标准》,水质中总铬的浓度应小于3×10-5mol·L-1,当步骤③调节pH=6时,该处理后的污水是否达到排放标准?____________(填“是”或“否”)。
20.(17分)[提示:饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%] 方案一:连接图8中甲、乙装置,在洗气瓶a中盛放足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率。
(1)正确的连接顺序为导管口_______(填“A”或“B”)连导管口C,若事先往甲装置的饱和食盐水中滴入酚酞,则电解过程甲装置中________(填“铁棒”或“碳棒”)附近的溶液变红。
(2)电解饱和食盐水总反应的化学方程式为________________________。
方案二:利用甲装置电解后的溶液,通过中和滴定来测定饱和食盐水的电解率。
(3)部分实验过程如下:①用_________________(填“酸式滴定管”或“碱式滴定管”)量取10.00mL电解后的溶液,加入锥形瓶中;②向锥形瓶中加入几滴酚酞试液,用0.2000mol•L-1标准盐酸滴定待测液,边滴边摇动锥形瓶,直到__________________________时停止滴定;③该小组所测实验数据如下:未电解前饱和食盐水的物质的量浓度为5.4mol·L-1,经计算,求出该食盐水的电解率为_______。
