第五章稀溶液的依数性
第五章 稀溶液的依数性

xB
nB nB nB nB M A mA n A nB nA mA MA nB bB nB bB mA m A 1000 1000
2014年7月9日
9
临床医学专业《基础化学》
作者及主讲:张国林
bB M A xB 1000
bB M A p M A p p xB p bB 1000 1000
胶体渗透压 由高分子胶体物质 产生的渗透压力 70 g· L-1 2.9~4 kPa (<0.5%) 调节毛细血管内外 的盐水平衡及维持 血容量
2014年7月9日
36
作用
临床医学专业《基础化学》
作者及主讲:张国林
本章作业:4、5、8、9、11
2014年7月9日
37
作者及主讲:张国林
一、溶液的沸点升高
(一)液体的沸点(Tb) 定义:液体的蒸汽压等于外压(101.3kPa )时的 温度。 (二)溶液的沸点升高(ΔTb)
为什么?
溶液的沸点要高与纯溶剂的沸点的现象。
溶液的沸点升高与溶质的质量摩尔浓度的关系为 ΔTb = Tb - Tb0 = Kb bB 式中Kb为溶剂的质量摩尔沸点升高常数,它只与
n总 cOS V
医学上的渗透浓度常用mol· L-1或mmol· L-1表示。
要使van‘t Hoff公式既适用于难挥发的非电解质稀溶液, 又适用于强电解质稀溶液,其公式可修正为: π=Cos RT
2014年7月9日
29
临床医学专业《基础化学》
作者及主讲:张国林
临床上常用的几种溶液的渗透量 ①生理盐水: Cos 9 2 1000 308mmol L1
对于稀的水溶液,可以认为CB≈ bB,因此上式可 改写为 π = bB RT
稀溶液依数性

仪器:温度计、烧杯、搅拌 器、滴定管等
实验步骤与操作
准备实验器材:烧杯、温度计、搅拌器、 滴定管等
配置稀溶液:按照一定比例配制不同浓 度的稀溶液
测量溶液温度:将溶液搅拌均匀后测量 其温度
滴定操作:将标准溶液滴加入稀溶液中 记录滴定数据
数据处理与分析:根据实验数据分析稀 溶液依数性的规律
实验结果与分析
在制药行业中稀溶 液依数性对于药物 的提取、分离和纯 化等过程具有重要 影响利用稀溶液依 数性可以提高药物 的纯度和收率。
稀溶液依数性在生物学中的应用
渗透压调节:稀 溶液中的溶质分 子可以影响细胞 的渗透压进而影 响细胞的吸水和 膨胀。
物质运输:稀溶 液中的溶质分子 可以影响物质的 跨膜运输例如葡 萄糖和氨基酸在 血液中的运输。
实验数据:测量 了不同浓度溶液 的蒸气压、凝固 点、沸点等数据
结果分析:通过 数据分析验证了 稀溶液依数性与 浓度之间的关系 得出了依数性的 规律
实验结论:实验 结果与理论预测 基本一致进一步 证实了稀溶液依 数性的存在
实验意义:实验 验证了稀溶液依 数性的理论为进 一步研究溶液性 质提供了实验依 据
添加标题
实例分析:以氯化钠为例 氯化钠溶于水后水分子的 偶极受到氯离子和钠离子 的静电吸引作用导致水分 子的偶极方向发生变化从 而影响了溶液的蒸气压、
沸点、凝固点等性质。
稀溶液依数性与溶剂性质的关系
溶剂的种类对稀溶液依数性有影响不同溶剂的稀溶液依数性不同。 溶剂的浓度对稀溶液依数性有影响溶剂浓度越高稀溶液依数性越明显。 溶剂的分子极性对稀溶液依数性有影响分子极性越强稀溶液依数性越明显。 溶剂的粘度对稀溶液依数性有影响粘度越大稀溶液依数性越不明显。
添加副标题
稀溶液的依数性

5
6
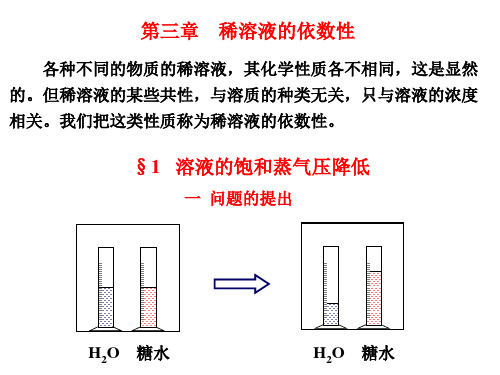
纯溶剂
◆ ◆ 溶液 ◆ ◆◆ ◆ ◆ ◆◆
原因:溶液表面溶剂接触空气的面积减小, 溶剂分子不易逸出,v蒸减小,v凝>v蒸,平 衡向凝结的方向移动,达到新的平衡时, p下降,故蒸气压降低。p=po-p与浓度有 关。
7
注意: 1.溶质:难挥发性非电解质 电解质: Tf=iKfbB
2.稀溶液:bB0.1molkg-1 3.Kf只与溶剂有关,与溶质无关
16
要求:同学们记住 水的Kf=1.86K kg mol-1 应用:汽车水箱防裂 H2O+乙二醇或甘油, 可使水的冰点降低至-30o。 冰盐混合物作为冷冻剂。
蒸发:晾衣 凝结:黄梅天回潮
1
蒸气压
2
与液相处于平衡时的蒸气所具有的压力(压强) 称为该温度下的饱和蒸气压,简称蒸气压,用 p表示,单位为Pa或kPa。P9
液体的蒸气压p与:1.液体的本性有关 2.与温度有关
固体也有蒸气压,如:冰、樟脑、碘等
3
4
二、溶液的蒸气压下降 (Vaper pressure lowering)
27
稀水溶液:bB≈cB
补充题一:在1L水中需加入多少克NaCl 才能防止水在-2℃时结冰,加入NaCl后该 溶液在25 ℃时的渗透压力为多少?
解:
28
(二)渗透浓度 osmolarity
渗透活性物质的物质的量除以溶液的体积。
符号:cos
单位:mol· L-1或mmol· L-1 计算: cos=icB 例2-6 例2-7 表2-5
第一节 溶液的蒸气压下降
一、蒸气压(vaper pressure) H2O(l)====H2O(g) v(蒸发)>v(凝结) v(蒸发)<v(凝结) v(蒸发)=v(凝结) ====
稀溶液的依数性详解
三 拉乌尔定律
1 溶液的浓度
每 dm3 溶液中含溶质的物质的量为摩尔浓度,也经常称为体
积摩尔浓度。( 单位 mol · dm-3 )
这种浓度使用方便,唯一不足就是其数值要随温度变化。
若用每 kg 溶剂中含溶质的物质的量来表示溶液的浓度,则称
为质量摩尔浓度。( 单位 mol ·kg -1 ) 质量摩尔浓度经常用 m 表示。 摩尔分数
随着上方空间里溶剂分子个数的增加,密度的增加, 分子凝
聚回到液相的机会增加。当密度达到一定数值时,凝聚的分子的
个数也达到 N0 个。这时起,上方空间里溶剂分子的个数不再改变,
蒸气的密度也不再改变,保持恒定。
此时,蒸气的压强也不再改变。这个压强称为该温度下溶剂 的饱和蒸汽压,用 p0 表示。这时液相和气相之间实现相平衡。 蒸 凝 发 聚
故有
p = p0 · X质 。 对于稀的水溶液,有
m p p 0 55.5
一定温度下,p0 为常数。故上式可以写成
p = k ·m
( k 为常数,但对于不同溶剂 k 值不同 )
稀溶液饱和蒸气压下降值,与稀溶液的质量摩尔浓度成正比。 这是 Raoult 定律的又一种表述形式。
§2 溶液沸点升高和凝固点降低
液体
蒸 发
凝 聚
气体
3 解释实验现象 过程开始时,水和糖水均以蒸发为主。当蒸气压等于 p 时,
糖水与上方蒸气达到平衡。而 p0 > p ,即水并未与蒸汽达到平衡,
继续蒸发,以致于蒸气压大于 p , 水蒸气分子开始凝聚到糖 水中。
这又使得蒸气压不能达到 p0 于是, H2O 分子从水中蒸
611
稀溶液的依数性

稀溶液的依数性:当溶质溶解在溶剂中形成溶液后,溶液的蒸气压下降,沸点升高,凝固点降低及产生渗透压等性质,只与溶质中粒子的数目有关,而与溶质的本性无关。
由于这类性质的变化,只适用于稀溶液,故称之为稀溶液的依数性。
人工降雨:①根据开尔文公式RTlnPr/P0=2rVm/R’,最初生成的雨滴半径很小,所以其蒸气压很高,此时对平面液体过饱和度达4的水蒸气,对极小的水滴仍未达饱和,所以这个新的液构很难凝聚出来。
②而空气中的灰尘常会作为凝聚中心促使雨滴形成,若在这种水蒸气过饱和度已超过4的云层中,用火箭或撒入干冰提供凝聚中心,使凝聚水滴的曲率半径增大。
由laplace方程,Ps=2Y/R’,其相应的饱和蒸气压变小,蒸汽会还原凝结成冰。
暴沸:①通常在液态有机物中,溶解的空气很少,在蒸馏过程中,液体中形成的蒸汽泡内壁是一个凹液面。
②根据开尔文公式RTlnPr/P0=2rVm/R’可知,凹面上的R’越小,小蒸汽泡内的蒸气压就越低,所以在相同温度下,小蒸汽泡的蒸气压比平面液体的P0低很多;此时液体内部产生气泡所承受的压力P’1=P大气+P平面+Ps,所以当T超过正常沸点时,液体内部的小蒸汽泡无法形成,溶液无法沸腾。
③继续加热,直至小气泡开始形成,气泡一旦形成后便不断变大。
由laplace公式,Ps=2Y/R’,随着R’增大,Ps下降,而P静在气泡上升阶段中不断下降,此时Ti>T正常,故此很容易产生暴沸现象。
盐碱地农作物枯死:①农作物的生长需要水分,然而盐碱地中盐碱浓度大,此时化学势UA 较低,农作物的中心浓度较盐碱地低,其化学式势UB>UA。
②由UB>UA,土地中的渗透压>农作物中的渗透压,农作物中的水分通过细胞壁渗透到土壤中,导致细胞枯萎。
分解电压:电解质在电极上分解生成电解产物所需施加的最小电压。
析出电压:当外加电压等于分解电压时两极的电极电位,是开始析出物质时所必须的最小析出电位。
电极极化的意义:电极上有电流通过时,就会有净反应发生,表明电极失去了原有的平衡状态,电极电位将偏离平衡电位。
大学医学基础化学复习资料

稀溶液的依数性难挥发性非电解质稀溶液的四种依数性,它们均与溶液的质量摩尔浓度成正比,与溶质的本性无关。
∆p = Kb B ∆T f = K f b B (难点) ∆T b = K b b B ᴨ = RTb B (重点)根据依数性,可求出溶质的相对分子量,已知一种依数性,可推算其他几种依数性。
非电解质:渗透浓度 = 物质的量浓度电解质 :渗透浓度 = i ×物质的量浓度混合溶液的渗透浓度 = 非电解质渗透浓度 + 电解质渗透浓度稀溶液 bB ≈ cB临床上规定渗透浓度在280~320 mmol ·L-1的溶液为等渗溶液。
渗透现象产生的条件:有半透膜及膜两侧有渗透浓度差存在。
测定小分子溶质的相对分子质量多用(凝固点降低法)测定蛋白质等大分子化合物的摩尔质量常用(渗透压法)常见等渗溶液: 50 g ·L-1 葡萄糖溶液, 9.0 g ·L -1 NaCl 溶液, 12.5 g ·L -1 NaHCO 3溶液等。
渗透浓度cos(mmol ·L-1):渗透活性物质(溶液中能够产生渗透效应的溶质粒子)的物质的量浓度。
电解质溶液计算电解质溶液依数性的校正因子 i 与解离度的关系: α = i -1 (适用于1-1AB 型)离子强度是溶液中所有离子产生的电场强度的量度: I=21Σb i z i 2 298K 时 I 与γ±的关系:lg γ± = –0.509 |z + z –|(适用于I < 0.01mol •kg–1 的极稀水溶液)c活度与理论浓度的关系 a = γ•c酸碱质子理论:酸碱的定义、共轭关系、反应实质、酸碱的强度。
质子酸、质子碱、两性物质的判断;共轭酸碱对。
H2PO4--的共轭酸:H3PO4H2PO4-的共轭碱:HPO42-[Fe(H2O)6]3+的共轭碱:[Fe(OH)(H2O)5]2+酸解离常数K a、碱解离常数K b的影响因素:本性、温度。
稀溶液的依数性

稀溶液的依数性是说溶液的某些性质与溶质的粒子数的多少有关,与溶质本性无关.依数性分别用拉乌尔定律、沸点升高、凝固点降低和渗透压公式定量描述.溶液的依数性所谓“依数性”顾名思义是依赖于数量的性质.稀溶液中溶剂的蒸气压下降、凝固点降低、沸点升高及渗透压等的数值均与稀溶液中所含溶质的数量有关,这些性质都称为稀溶液的依数性.1.蒸气压下降对二组分稀溶液,溶剂的蒸气压下降已如式(2-67)所述Δp=p*A-pA=p*AxB即Δp的数值正比溶质的数量—溶质的摩尔分数xB,比例系数即为纯A的饱和蒸气压p*A.2.凝固点(析出固态纯溶剂时)降低稀溶液当冷却到凝固点时析出的可能是纯溶剂,也可能是溶剂和溶质一起析出.当只析出纯溶剂时,即与固态纯溶剂成平衡的稀溶液的凝固点Tf比相同压力下纯溶剂的凝固点T*f低,实验结果表明,凝固点降低的数值与稀溶液中所含溶质的数量成正比,比例系数kf叫凝固点下降系数它与溶剂性质有关而与溶质性质无关.详细推导3.沸点升高沸点是液体或溶液的蒸气压p等于外压pex时的温度.若溶质不挥发,则溶液的蒸气压等于溶剂的蒸气压p=pA,对稀溶液pA=p*AxA,pA<p*A,所以在p—T图上稀溶液的蒸气压曲线在纯溶剂蒸气压曲线之下,由图可知,在外压pex时,溶液的沸点Tb必大于纯溶剂羝液的沸点Tb必大于纯溶剂的沸点T*b,即沸点升高.实验结果表明,含不挥发性溶质的稀溶液的沸点升高亦可用热力学方法推出,kb叫沸点升高系数.它与溶剂的性质有关,而与溶质性质无关.4.渗透压若在U形管中用一种半透膜把某一稀溶液和溶剂隔开,这种膜允许溶剂但不允许溶质透过. 实验结果表明,大量溶剂将透过膜进入溶液,使溶液的液面不断上升,直到两液面达到相当大的高度差时才能达到平衡.要使两液面不发生高度差,可在溶液液面上施加额外的压力,假定在一定温度下,当溶液的液面上施加压力为∏时,两液面可持久保持同样水平,即达到渗透平衡,这个∏值叫溶液的渗透压.根据实验得到,稀溶液的渗透压∏与溶质B的浓度cB成正比,比例系数的值为RT,即∏=cBRT(2-99)渗透和反渗透作用在生物学中是十分重要的.在海水淡化技术中亦有重要应用。
大学化学稀溶液的依数性

什么是稀溶液的依数性?
溶液的性质有别于溶质和溶剂,可分为 两类:一类是由溶质的本性决定的;另一类 性质则只与溶质、溶剂微粒(分子、离子) 数的比值有关,而与溶质的本性无关,这类 性质称为稀溶液的依数性。
溶液的性质
非依数性 依数性
颜色 酸碱性 导电性 粘度 相对密度
蒸气压下降 沸点升高 凝固点降低 渗透压
2.1 溶液的蒸气压下降(Vapor Pressure Lowering)
2.1.2 溶液的蒸气压下降
定义 纯溶剂在一定温度下,其蒸气压是一定值,当在 此溶剂中加入少量的难挥发的非电解质溶质时,此 溶液的蒸气压会小于纯溶剂的蒸气压,这种现象称 为溶液的蒸气压下降。
原因 溶液表面的某些部位被溶质分子所占据,而溶
一、溶液的沸点升高
溶液的沸点升高与溶质的质量摩尔浓度的关系 由于 ΔTb ∝ Δp,Δp ∝ bB 故 ΔTb ∝ bB 即 ΔTb = Tb - Tb0 = Kb bB 式中Kb为溶剂的质量摩尔沸点升高常数,它只与
溶剂的本性有关,单位为K·kg·mol-1
溶液的沸点升高是稀溶液的依数性 上式表明 ,难挥发性非电解质稀溶液的沸点升高
利用溶液的沸点升高和凝固点降低都可以测定溶质的相 对分子质量
医学和生物科学实验中凝固点降低法的应用更为广泛。 这是因为:
① 对同一溶剂来说,Kf总是大于Kb,所以凝固点降低法 测定时的灵敏度高;
② 用沸点升高法测定相对分子质量时,往往会因实验温 度较高引起溶剂挥发,使溶液变浓而引起误差;
0.150 (mol kg )
0.100
实验测得溶液中各种溶质的总质量摩尔浓度为
T f b总 K f
1.1 0.591(mol kg 1 ) 1.86
稀溶液的依数性

稀溶液的依数性凝固点是物质的液相和固相建立平衡的温度。
达到凝固点时,液、固两相的蒸气压必定相等,否则两相不能共存。
(纯水的凝固点为273.16 K(0.009 9℃),这时水和冰的蒸气压均为610.6 Pa(4.58 mm Hg))。
溶液凝固点是指从溶液中开始析出溶剂晶体时的温度。
这时体系是由溶液(液相)溶剂(固相)和溶剂(气相)所组成。
(对于水溶液,溶剂固相即纯冰。
由于溶液蒸气压下降,当273.16 K时,冰的蒸气压仍为610.6 Pa,而溶液蒸气压必然低于610.6 Pa,这样,溶液和冰就不能共存,只有在273.15 K以下的某个温度时,溶液蒸气压才能和冰的蒸气压相等,这时的温度才是溶液的凝固点。
这段话可以用图2-5-2表示)溶液的凝固点总是比纯溶剂的低的现象称为凝固点下降。
(溶液浓度越大,蒸气压下降越多,凝固点下降也越多。
在同一溶液中,随着溶剂不断结晶析出,溶液浓度将不断增大,凝固点也将不断下降。
)溶液凝固点下降是由于溶液蒸气压下降引起的。
对于稀溶液,既然蒸气压下降Dp和溶液的质量摩尔浓度mB成正比,这类溶液的凝固点下降也应和质量摩尔浓度有联系。
Raoult根据依数性指出:对于难挥发非电解质的稀溶液,凝固点下降ΔTf和溶液质量摩尔浓度成正比,即:ΔTf=Tf°-Tf=KfmB式中:Tf为溶液的凝固点;Tf°为纯溶剂的凝固点;Kf为溶剂的凝固点下降常数,Kf由溶剂的本性决定而与溶质的种类无关。
凝固点降低的应用1.生活方面:将食盐和冰混合,可以使温度降低到251 K。
氯化钙与冰混合,可以使温度降低到218 K。
(体系温度降低的原因是:当食盐或氯化钙与冰接触时,在食盐或氯化钙的表面形成极浓的盐溶液,而这些浓盐溶液的蒸气压比冰的蒸气压低得多,冰则以升华或熔化的形式进入盐溶液。
进行上述过程都要吸收大量的热,从而使体系的温度降低。
)冬天在室外施工,建筑工人在砂浆中加入食盐或氯化钙;汽车驾驶员在散热水箱中加入乙二醇等等,也是利用这一原理,防止砂浆和散热水箱结冰。
4.8 理想稀溶液的依数性

4.渗透压 .
半透膜是指对于物质的透过有选择性的人造或天然的 例如: 膜。例如:
亚铁氰化铜膜,只允许水透过,而不允 亚铁氰化铜膜,只允许水透过, 许水中的糖透过。 许水中的糖透过。 动物膀胱,只可使水透过, 动物膀胱,只可使水透过,不能使摩尔 质量高的溶质或胶体粒子透过。 质量高的溶质或胶体粒子透过。
解:由题意得 ∆Tf=3.15℃ 因为 ∆Tf = K 凝 b
所以,100g水中应加入的甘油质量为:
m=b·mA·M=1.69mol·kg-1×0.1kg×92g·mol-1=16g
第四章 多组分系统热力学
为由于食盐对草地有损伤,因此有人建 议用化肥如硝酸铵或硫酸铵代替食盐来 融化人行道旁的冰雪。下列化合物各 100g溶于1kg水中,问哪一种冰点下降的 多?若各0.1mol溶于1kg水中,又问哪一 种冰点下降的多? (1)NaCl (2)NH4NO3 (3)(NH4)2SO4
pp +Π来自溶液 半透膜溶剂
范特荷夫渗透压公式 Π = cB RT
第四章 多组分系统热力学
为防止水箱结冰,可加入甘油以降低其 凝固点,如需使凝固点降低到-3.15℃, 在100g水中应加入多少甘油?(甘油的相 对分子量为92)
第四章 多组分系统热力学
∆Tf 3.15℃ b= = = 1.69 mol⋅ kg -1 K 凝 1.86° C⋅ kg⋅ mol-1
1.溶剂蒸气压下降(溶质不挥发时) 1.溶剂蒸气压下降(溶质不挥发时) 溶剂蒸气压下降
2.凝固点下降(仅溶剂以纯固态析出) 2.凝固点下降(仅溶剂以纯固态析出) 凝固点下降 为B的质量摩尔浓度 为凝固点降低系数 只与溶剂的性质有关 3.沸点升高(溶质不挥发时) 沸点升高(溶质不挥发时) 为沸点升高系数 只与溶剂的性质有关
《稀溶液的依数性》习题解答

习 题1. 什么叫稀溶液的依数性?难挥发性非电解质稀溶液的四种依数性之间有什么联系? 答 溶液的蒸气压下降、沸点升高、凝固点降低和渗透压力等性质只与溶质、溶剂微粒数的比值有关,而与溶质的本性无关,因为这类性质的变化规律只适用于稀溶液,所以统称为稀溶液的依数性。
难挥发性非电解质稀溶液的四种依数性之间关系密切,知道一种依数性则可以求出另一种依数性:b f B b f T T p Πb K K K RT∆∆∆==== 2.已知293.15K 时水的饱和蒸气压为2.338kPa ,若将5.00g 尿素[CO (NH 2)2]溶于100g 水中,试问该溶液的蒸气压为多少?解 尿素的摩尔质量M = 60g ·mol -1,溶液中H 2O 的摩尔分数为()-12-1-1100g18g mol H O 0.9855.00g 100g 60g mol 18g mol x ⋅==+⋅⋅ 尿素溶液的蒸气压为p = p 0 x (H 2O) = 2.338 kPa ×0.985= 2.303 kPa3. 将19.0g 某生物碱溶于100g 水中,测得此溶液的凝固点降低值△T f 为0.220K ,试求该生物碱的相对分子质量。
解 水的K f =1.86K ·kg ·mol -1,则-13-119.0g []=1.86K kg mol 1. 6110g mol 0.220K 0.100kgM ⋅⋅⨯=⨯⋅⨯生物碱 由计算结果可知,该生物碱的相对分子质量为1.61×103。
4. 什么叫渗透?渗透压力的定义是什么?渗透现象产生的条件是什么?答 溶剂分子通过半透膜进入溶液的自发过程称为渗透作用,简称渗透。
渗透压力:为维持只允许溶剂分子通过的半透膜所隔开的溶液与溶剂之间的渗透平衡而需要在溶液液面上施加的超额压力等于渗透压力。
产生渗透现象的条件:(1)必须有半透膜存在;(2)半透膜两侧相同体积的液体中溶剂分子数目不相等。
高等化学 稀溶液的依数性

注意:液体的沸点必须指明外压。没有专门 注明压力条件的沸点通常都是指正常沸点。
液体的沸点随着外界压力的改变而改变。
P外↑沸点↑。 17
(二)溶液的沸点升高
实验表明,难挥发非电解质溶液的沸点总 是高于纯溶剂的沸点。这一现象称为溶液的沸 点升高(boiling point elevation)
263
0.260 0
T/K
p/kPa
268
0.401 3
272
0.562 6
273
0.610 6
7
二、溶液的蒸气压下降 ——Raoult定律
(a)纯溶剂
(b)溶液
图2-2 纯溶剂和溶液蒸发-凝聚示意图
8
图2-3 纯溶剂与溶液蒸气压曲线
9
大量的实验证明,含有难挥发性溶质 溶液的蒸气压总是低于同温度纯溶剂的蒸 气压。这种现象称为溶液的蒸汽压下降 (vapor pressure lowering)。
R—气体常数,为8.314×103 Pa·L·mol-1·K-1;
T—体系的温度,单位为K 。
34
Van’t Hoff公式的意义:
在一定温度下,溶液的渗透压力与溶液的 浓度成正比。也就是说,渗透压力与单位体积 溶液中溶质质点的数目成正比,而与溶质的本 性无关。
对于非电解质稀溶液,其物质的量浓度近似 地与质量摩尔浓度相等,即
P0-P = △P = P0 xB
△P 表示溶液的蒸汽压下降。
12
在稀溶液中:
xB
nB nA nB
nB nA
(
nA »nB )
第1节稀溶液的依数性

c.减压蒸馏:降低沸点,避免因高温而影响
产品的质量。
15
三 溶液的凝固点降低
凝固点:物质固液两相蒸汽压相等时 的温度
T/℃
Tf 0
? 1
? 3 2
?
? 4
(水)
时间
16
三 溶液的凝固点降低
重 点
由于溶液的蒸气压下降,难挥发非电解质稀溶液的凝 固点总是低于纯溶剂(水)的凝固点。
温度为0℃时,为热力学温度为273.16K时 P(H2O)=0.6106kPa , P(冰)=0.61kPa P(H2O)>P(冰),蒸汽压不等,蒸汽压大的会向蒸汽 压小的一方转化。 H2O转化为冰。 温度为0℃时,为热力学温度为273.16K时 P(溶液)<P(冰) 冰转化为溶液
原理:温度为100℃时,为热力学温度为373.16K时
重 点
P(H2O)=101.3kPa , P(外界)=101.3kPa
P(H2O)=P(外界),水沸腾 温度为100℃时,为热力学温度为373.16K时 P(溶液)<P(外界), 要想使溶液沸腾,必须升高温度。
12
重 点
△Tb= Tb- Tb0=KbbB KbCB
4
蒸气压的特点
T愈大,P愈大
相同温度下,易挥发性物质蒸气压 大,难挥发性物质蒸气压小。
5
练习题
判断:
由于乙醇比水易挥发,故在相同温度 下,乙醇的蒸汽压大于水的蒸汽压。
6
一、溶液的蒸气压下降(△P)
重 点
当蒸发和凝聚达到平衡的时候,溶液的蒸汽 压要比纯水的蒸汽压低。这种现象称为溶液的 蒸汽压下降。 原因:在一定温度下,若在水中加入难挥发 的非电解质(如蔗糖)形成稀溶液,则溶液中 的水的比例必然少于纯水,这时溶液中的水分 子的蒸发速率比纯水的慢。
稀溶液的依数性

ΔvapSm,A Sm(v,)A Sm(l),A
Tb Tb
Δvap Sm,AdT
RTb ln(1
xB )
xB<<1,温度和相变熵变化不大,则
Δvap Sm,A (Tb Tb )
RTb xB
ΔT
RTb xB Δvap Sm,A
RTb2 xB Δvap Hm,A
再将摩尔分率转化为质量摩尔浓度得书中公式。
(l) A
Tf, p, xB
s
(s) A
Tf , p
s
(s) A
Tf, p
(l) A
Tf , p
(s) A
Tf , p
(l) A
Tf, p, xB
(s) A
Tf, p
与沸点升高的推导几乎一样,可得:
ΔT
Tf Tf
RTf2 xB Δfus Hm,A
4.渗透压
A ( p, xA 1) A ( p , xA )
4He的同位素3He也有超流态。
氦对于低温物理的研究具有重要意义
有四次诺贝尔物理奖与氦有关: 1926年,昂内斯因为建立低温设备制成液氦; 1962年,郎道因为建立4He超流理论; 1996年,奥谢罗夫和理查森因为发现3He超流; 2003年,阿布里科索夫、莱格特和金茨堡因为
建立超导和超流理论。
(l) A
Tb, p, xB
(l A
)
Tb , p
Tb Tb
S (l) m,A
dT
RTb ln(1
xB )
(v) A
Tb, p
(v) A
Tb , p
T T
Sm(v,)AdT
(l) A
Tb, p, xB
01 依数性

易挥发性物 质的 p大, 难挥发性物 质的 p 小。
蒸气压下降的原因?
纯溶剂的表面少量地被加入非挥 发性溶质粒子所占据,使溶剂的表面 积相对减小,单位时间内逸出液面的 溶剂分子数相对比纯溶剂要少。
因此,达到平衡时 溶液的蒸气压就要比纯 溶剂的饱和蒸气压低。
拉乌尔(Raoult)定律
大量的实验证明,在一定温度下, 难 挥发非电解质稀溶液的蒸汽压等于纯溶 剂的蒸汽压与溶剂物质的量分数的乘积。
即该蛋白质的相对分子质量为30569。
渗透压大小与溶质的关系
在一定温度下,稀溶液的渗透压大小 与单位体积内溶液中所含溶质的粒子(分 子和离子)数成正比。
a) 对于非电解质溶液,渗透压 为溶液的浓度; b) 对于电解质溶液,渗透压为 溶液粒子总浓度,即(a+b)cB。
例:比较下列各水溶液的渗透压的大小。 (1)0.1mol · Kg-1 C6H22O6溶液 (2) 0.1mol · Kg-1 CaCl2溶液 (3) 0.1mol · Kg-1 KCl溶液 (4) 1.0mol · L-1 CaCl2溶液
解:
6.840 g 1000g kg-1 -1 bB 0 . 200 0 mol kg 100.0g 342.0g mol-1
100.0 g/18.02g mol-1 xA 100.0 g/18.02g mol-1 6.840g/ 342.0g mol1 55.49 mol 0.9964 (55.49 0.02000)mol
(c)
溶液
渗透压与浓度及温度的关系
• 渗透压定律:
溶液很稀时, cB ≈ bB
Π = cBRT
cB: 物质的量浓度, mol · L-1。 bB:质量摩尔浓度, mol· kg-1。 T:系统的温度,单位为K R:摩尔气体常数, R = 8.315 kPa · L· mol-1.K-1 П:溶液的渗透压,单位为Pa
第1节稀溶液的依数性

稀水溶液
稀溶液的依数性(2) △Tb只与溶质的浓度有关,与溶质的本
性无关。浓度越大,沸点增加的值越大。
13
练习题
难挥发非电解质稀溶液沸腾时, 溶液沸点:
A、不断降低
C、保持不变
B、不断升高 D、无法确定
14
应用:利用溶液的沸点升高
a 测定物质的分子质量
b.鉴别液体的纯度:液体沸点的值是固定 的,有杂质沸点升高。
21
一、渗透
重 点
产生条件
1.半透膜的存在。 2.膜两边有浓度差。
渗透方向
扩散的方向
稀
浓
浓
稀
22
练习:判断渗透方向 0.2mol/L葡萄糖
0.1mol/L葡萄糖
23
二、渗透压
当溶液的一侧上升到一定的 高度,所产生的压力使得溶液一 侧和纯水一侧相互渗透的速度相 等时,液面不再上升,即达到了 渗透平衡,这时液面两侧的高度 差所产生的静压力称为渗透压。
4
蒸气压的特点
T愈大,P愈大
相同温度下,易挥发性物质蒸气压 大,难挥发性物质蒸气压小。
5
练习题
判断:
由于乙醇比水易挥发,故在相同温度 下,乙醇的蒸汽压大于水的蒸汽压。
6
一、溶液的蒸气压下降(△P)
重 点
当蒸发和凝聚达到平衡的时候,溶液的蒸汽 压要比纯水的蒸汽压低。这种现象称为溶液的 蒸汽压下降。 原因:在一定温度下,若在水中加入难挥发 的非电解质(如蔗糖)形成稀溶液,则溶液中 的水的比例必然少于纯水,这时溶液中的水分 子的蒸发速率比纯水的慢。
28
总结 1、难挥发稀溶液的蒸汽压、沸点、凝 固点、渗透压等性质具有依数性。 蒸汽压下降 沸点升高 凝固点下降 渗透压增大 仅与溶质的质点数 有关,与溶质的本 性无关。
无机化学级 溶液依数性 优质课件

德拜 和 休克尔提出:
(一) 离子氛(ion atmosphere):
中心离子周围的那些异性离子群
在强电解质溶液中,由于离子氛的形成, 使离子不能充分表现它应有的性质
离子对的存在,使自由离子的浓度降低, 也使依数性和导电能力的下降
5
离子氛示意图
-
+
离子的有效浓度(表观浓度)总比理论浓度小些
路易斯----活度
1)浓度计算
Π = CBRT = 2×0.02×8.314×298
Π = 99.1kPa
2)活度计算 活度----活度系数---离子强度
I
1 2
B
bB zB2
=
1(0.0212 0.0212) 0.02 2
lg i Azi2 1 I I
lg i
0.50912
1
0.02 0.02
0.0631
Na Cl 0.865 Nac Clc 0.865 0.04 0.0346
RT = 0.0346×8.314×298=85.7 kPa
实验值 86.1 kPa
12
稀溶液的依数性
掌握:
Raoult定律
作业题
电解质溶液
稀溶液 依数性
溶液的蒸气压下降 溶液的沸点升高 溶液的凝固点降低 溶液有渗透压力
ΔP = K·bB ΔTb= Kb·bB ΔTf = Kf·bB
Π = bBRT
各个依数性的原理、 计算公式及其相互联系 渗透压力在医学上的意义
电解质溶液的特殊性
电离度和弱电解质---强电解质
电解质溶液
已解离的分子数
α = 原有分子总数 ×100%
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第五章稀溶液的依数性参考答案P 92综合思考题:解:①根据b f f m k t ⋅=∆得:)(5.086.1)93.0(0.01-⋅=--=kg mol m b再根据)(26.05.052.00C m k t b b b =⨯=⋅=∆ 沸点为:t b =t b o +△t b =100.0+0.26=100.26(C 0)方法2:根据11--=n i α有:2%,25==n α121%25--=i25.1=i AB f f m ik t ⋅=∆ ).(4.086.125.1)93.0(0.01-=⨯--=∆=L mol ik t m ff AB)(26.04.052.025.10C m ik t AB b b =⨯⨯=⋅=∆沸点为:t b =t b o +△t b =100.0+0.26=100.26(C 0)②根据Π=c b R T ≈m b RT=0.5×8.314×298.15=1239.4kPa方法2:Π=ic AB R T ≈im AB RT=1.25×0.4×8.314×298.15=1239.4kPa③根据电离度%100⨯-=ABABb m m m α有: 25%m AB +m AB =m bm AB =0.5/1.25=0.4(mol.kg -1) 由方法2可知:).(4.086.125.1)93.0(0.01-=⨯--=∆=L mol ik t m ff AB根据)()(/)(1kg W mol g M g W m A AB AB AB-⋅=有: 1000100/6.94.0⨯=ABM M AB =240.0(g.mol -1)④ 根据)()(/)(1kg W mol g M g W m A AB AB AB-⋅=有:)(4.0101000.240/6.913--⋅=⨯=kg mol m AB ⑤根据1000)(/⨯⨯+=dW W M W c AB ABAB AB 有:1000096.1/)1006.9(0.240/6.9⨯+=AB c=0.4(mol.L -1) ⑥根据:AAB ABAB n n n X +=有:31015.718/1000.240/6.90.240/6.9-⨯=+=AB XP 95~97 1.解:(1)根据1000W M W W n m AB BA B B ⨯⋅==∵522(g)281.1500W d B =-⨯=-⋅=液V W A∴g)0.58(mol/k 10005229228m B =⨯⨯=(2)根据总n n X ii =∵)0(mol .2918522M W n A ===水水)0.30(mol 9228M W n B ===甘油甘油 99.030.290.29n n n X ==+=甘油水水水 01.030.2930.0n n n X ==+=甘油水甘油甘油5.解:依题意有:)(9010100g W W W B A =-=-=,M B = 58.5(g/mol)(1) 根据:1000W M W W n m AB BA B B ⨯⋅==)/(89.110009058.5101000W M W m A B B B kg mol =⨯⨯=⨯⋅=(2)根据1000W M W 1000B B⨯⨯=⨯=ρ液液V n C BB)1.83(mil/L 1000100/1.07158.510=⨯⨯=)(B C)0(mol .51890M W n A ===水水 )0.17(mol 58.510M W n B ===NaCl NaCl0.975.17.5n n n X ==+=NaCl水水水 03.097.01=-=NaCl X 6. 解:根据1000⨯⋅⋅=⋅=∆AB Bf B f f W M W K m K T ∵g W A 0.20= g W B 1= △T f = 1.32K∴)/(6.25732.10.20100018.61000mol g W T W K M A f B f B =⨯⨯⨯=⨯⋅∆⋅=化学式:S 8 (257.6/32=8.05)7.解:(1)根据1000⨯⋅⋅=⋅=∆AB Bb B b bW M W K m K T∵ g W A 500= g W B 00.9= △T b = 0.0512K K b = 0.51)/(30.1790512.0500100000.951.01000mol g W T W K M A b B b B =⨯⨯⨯=⨯⋅∆⋅=(2)0.60.1230.179%0.40:≈=⨯C B M M C0.12%7.60.130.179%7.6:≈⨯=⨯H B M M H0.6%3.530.1630.179%7.6:≈⨯=⨯H B M M O 故化学式为: 6126O H C10.解:根据1000⨯⋅⋅=⋅=∆AB Bf B f fW M W K m K T∵g W A 200= g W B 6.3= M B = 180(g/mol)g W A 500/= g W B 20/=, 21f f T T ∆=∆ ?/=BM∴10001000///⨯⋅⋅=⨯⋅⋅A B B f A B B f W M W K W M W K)/(0.4006.350020018020///mol g W W W M W M BA AB B B=⨯⨯⨯=⋅⋅⋅= 14 解: ∵K T f 54.0=∆, 86.1=f K根据B f f m K T ⋅=∆, 可得:)/(29.086.154.0L mol K T m ff B ==∆=对于稀溶液:B B m c ≈ 再根据RT m RT c B B ⋅≈⋅=∏ 可得:KPa 43.747314.831029.0=⨯⨯=∏17.试比较下列各组溶液的某些性质的高低(或大小顺序)。
(1) 解:根据B f fm K i T ⋅⋅=∆∵C 12H 22O 11的 i =1,CH 3COOH 的 1<i <2, KCl 的 i=2∴ T C12H22O11>T CH3COOH >T KCl (2) 解:根据B b bm K i T ⋅⋅=∆∵葡萄糖的 i =1, 甘油的 i =1, NaCI 的i =2 ∴沸点 T bNaCI >T b 葡萄糖 = T b 甘油 (3)解:根据B f fm K i T ⋅⋅=∆∵葡萄糖的 i =1,Na 2SO 4的i =3,KNO 3的i =2 ∴凝固点:T f 葡萄糖> T f KNO3 > T f Na2SO4 (4) 解:根据RT c i B ⋅⋅=∏∵葡萄糖的 i =1,CaCI 2的 i =3,KCI 的 i =2∴渗透压:∏葡萄糖 <∏ KCl <∏CaCl2 (5) 解:根据B m iK P⋅=∆∵CaCI 2的 i =3,葡萄糖的i=1,CH 3COOH 的1<i<2 ,NaCI 的i=2, 蔗溏的i=1,∴△P CaCI2 >△P NaCI >△P CH3COOH >△P 葡萄糖 =△P 蔗溏 蒸气压: P 蔗溏= P 葡萄糖 > P CH3COOH > P NaCI > P CaCI2 18.选择正确答案的序号填入括号内。
(1)解:选B 根据AB B b bW M W K T ⨯⨯⋅=∆000M B ↑ b T ∆ ↓ T b ↓∵M C12H22O11 >M C6H12O6>M (NH4)2CO3>M C 3H 8O 3∴T C12H22O11 <T C6H12O6<T (NH4)2CO3<T C 3H 8O 3故选B 。
(2)解:选 B 根据AB B b b W M W K T ⨯⨯⋅=∆000,∵△T b = T b -T b *=373.05-373=0.05(K) ∴)/(0.6010010006.050.005.0mol g M M B B =⇒⋅⨯⨯=故选B 。
(3)解:选 B 根据AB B f f W M W K T ⨯⨯⋅=∆000∵△T f = 1.86K K f =1.86 W B =60g , W A =250g , )/(24025010006086.186.1mol g M M B B =⇒⨯⨯⨯= 故选B 。
(4)解:选D 根据B m iK P⋅=∆∵CaCI 2的i=3,KCI 的i=2,C 6H 12O 6的i=1, ∴△P CaCI2 > △P KCI >△P C6H12O6蒸气压:P CaCI2 < P KCI < P C6H12O6 ,故D 是正确的。
对于A 、根据:icRT=∏有:NaCI 的i=2, 尿素的i=1尿素∏>∏NaCl 故A 是错误的。
对于B ,因为CCl 4和苯是不同的溶剂,其K f 不同,根据B f f m K T ⋅=∆,可知所得的两种溶液的凝固点不同,故B 是错误的。
对于C ,根据AB B b bW M W K T ⨯⨯⋅=∆000, ∵ 葡萄糖蔗糖M M >葡萄糖)蔗糖)(T (T b b ∆<∆ ∴沸点:葡萄糖)蔗糖)(T (T b b <,故C 是错误的。
(5)解:选D 根据AB B f fW M W K T ⨯⨯⋅=∆000∵△T f =T f *-T f = 0.0-(-2)=2.0℃,K f =1.86 ,W A =100g ,M B =92g/mol ∴)(9.910092100086.10.2g W W B B =⇒⨯⨯⨯= 故选D .。
