第二章稀溶液练习题
(完整版)初三化学溶液稀释问题专题练习

(完整版)初三化学溶液稀释问题专题练习溶液稀释问题专题练习⼀.选择题(共14⼩题)(注:第7和第10题双选)1.将100g 98%的浓硫酸注⼊900g⽔中,所得稀硫酸中溶质的质量分数为()A.9.8% B.10.0% C.10.9% D.11.1%2.将10g质量分数为0.1的氯化钠溶液浓度变为0.2,下列操作正确的是()A.蒸发5g⽔B.加⼊氯化钠固体0.1gC.倒出⼀半溶液D.加⼊10g质量分数为0.2的氯化钠溶液3.20℃NaCl的溶解度是36g,把40g的NaCl加⼊到20℃的100g⽔中,充分搅拌,所得溶液中溶质的质量分数是()A.36% B.40% C.28.6% D.26.5%4.20℃时,将40gNaCl放⼊100g⽔中,搅拌后,所得溶液中NaCl的质量分数是(已知20℃时,NaCl 的溶解度为36g)()A .×100%B .×100%C .×100%D .×100%5.将100g质量分数为5%的⾷盐溶液改变成质量分数为10%,则下列操作可⾏的是()A.加⼊5g⾷盐B.蒸发掉50g⽔C.加⼊50g⾷盐D.取出50g溶液即可6.下列说法中正确的是()A.15℃时,KNO3的溶解度是25g,15℃时饱和溶液的溶质质量分数为20%B.24%的NaOH溶液取出⼀半其溶质质量分数为12%C.饱和溶液中析出晶体后,溶质的质量分数⼀定减⼩D.饱和溶液升⾼温度⼀定变成不饱和溶液7.正确反映对应变化关系的图象是()A向⼀定质量的⽔中加⼊硝酸钾晶体B.向⼀定量的氧化铜中通⼊⼀氧化碳⽓体并加热C.⼀定量的镁在空⽓中燃烧D.在盛有空⽓的密闭容器中点燃红磷A.A B.B C.C D.D8.⽤硫酸铜进⾏如图所⽰的实验,对所得溶液的分析正确的是()A.三个溶液中溶质溶解度⼀样B.②溶液是不饱和溶液C.③溶液颜⾊最深D.温度不同,⽆法⽐较①③溶液的溶质质量分数9.分析下列实验图象,得到的结论正确的是()A.双氧⽔溶液制氧⽓,a未使⽤催化剂,B.某温度下,向饱和⽯灰⽔中加⼊b使⽤了催化剂⽣⽯灰,则y轴可以表⽰溶质的质量分数C.分别向⾜量且等质量的盐酸中加⼊铁粉、D.溶质为a、b的两质量相等的饱和溶液,温度由T2降锌粉,则曲线b代表的是加⼊锌粉的情况⾄T1,分别析出不含结晶⽔的a、b固体,则最终两溶液质量相等10.下列图象能正确反映其对应关系的是()A.B.某温度下,向⼀定量的硝酸钾不饱和在两份等质量、等溶质质量分数的过氧化氢溶液中不断加⼊硝酸钾晶体溶液中,⼀份加催化剂,⼀份不加催化剂C.通电使⽔分解D.向盛有等质量、等溶质质量分数的稀硫酸的两⽀试管中,分别加⼊过量的镁和铝11.右图是a,b,c三种固体物质的溶解度曲线,下列叙述正确的是()A.将a、b、c三种物质t1℃时的饱和溶液升温⾄t2℃,所得溶液的溶质质量分数⼤⼩关系是a>b>c B.t2℃时30g物质a加⼊到50g⽔中不断搅拌,形成80g溶液C.t1℃时a,b,c三种物质的饱和溶液中含有溶质质量按由⼩到⼤的顺序排列是b>a=cD.若a中混有少量c,可以采⽤冷却热饱和溶液的⽅法提纯a12.如图,是A,B两种物质的溶解度曲线,下列说法正确的是()A.A,B两种物质的溶解度都随温度升⾼⽽增⼤B.降低温度可使接近饱和的B溶液变为饱和C.A,B两种物质的溶解度均为25g D.t2℃时,A物质的溶解度⼤于B物质的溶解度13.25℃时50克⽔中最多可溶10克A,30℃时50克⽔中最多可溶15克B,则A、B溶解度相⽐较为()A.⽆法⽐较B.A⼤于B C.A⼩于B D.A等于B14.如表是NaCl和KNO3在不同温度下的溶解度,有关说法不正确的是()温度/℃0 10 20 30 40 50 60 70 80溶解度/gNaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8 38.4 KNO313.3 20.9 31.6 45.8 63.9 85.5 110 138 169A.NaCl的溶解度⽐KNO3的溶解度⼤B.两种物质溶解度相等的温度在20℃~30℃之间C.20℃时,NaCl的溶解度为36.0gD.60℃时,将11gKNO3加⼊10g⽔中充分溶解,溶液刚好饱和⼆.填空题(共3⼩题)15.根据表中氯化钠和硝酸钾部分溶解度数据分析,回答下列问题.温度/℃0 10 20 30 40 50 60溶解度/g NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 KNO313.3 20.9 31.6 45.8 63.9 85.5 110(1)10℃时,氯化钠的溶解度是g.(2)硝酸钾的溶解度随温度的升⾼⽽,与硝酸钾相⽐较,氯化钠的溶解度受温度变化影响(填“较⼤”或“较⼩”).(3)20℃时,在100g⽔中加⼊40g硝酸钾,充分搅拌后,将溶液温度升⾼到30℃(不考虑⽔分蒸发),所得溶液是(填”饱和溶液“或”不饱和溶液“).(4)在20℃~30℃的某温度时,氯化钠和硝酸钾的溶解度(x)相同,x的取值范围是.16.溶液是⽣活中的常见现象,不同物质在⽔中的溶解能⼒不同.如表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g⽔).温度(℃)0 20 40 60 80 100KNO313.3 31.6 63.9 110 169 246NaCI 35.7 36.0 36.6 37.3 38.4 39.8(1)如表中的两种物质在40℃时,的溶解度较⼤;请⽤相应的数据列式表⽰该温度时KNO3饱和溶液的质量分数(不要求计算).(2)请写出⼀种将KNO3的不饱和溶液转化为饱和溶液的⽅法.(3)20℃时,将20g NaCl放⼊50g⽔中,所得溶液的质量是g.(4)从NaCl溶液中得到NaCl晶体的⽅法是.17.溶解是⽣活中常见的现象,不同物质在⽔中的溶解能⼒不同.如表是KNO3(硝酸钾)、NaCl(⾷盐)在不同温度下的溶解度(单位:g/100g⽔).温度(℃)0 20 40 60 80 100KNO3(硝酸钾)13.3 31.6 63.9 110 169 246NaCl(⾷盐)35.7 36.0 36.6 37.3 38.4 39.8①上表中的两种物质在40℃时,的溶解度较⼤;请⽤相应的数据列式表⽰该温度时KNO3饱和溶液的质量分数(不要求计算).②请写出⼀种将KNO3的不饱和溶液转化为饱和溶液的⽅法.③20℃时,将20gNaCl放⼊50g⽔中,所得溶液的质量是g.④从NaCl溶液中得到NaCl晶体的⽅法是.⑤KNO3溶液中含有少量NaCl时,可通过的⽅法提纯.⑥对⑤析出的晶体和剩余溶液描述正确的是(填写编号).A、剩余溶液⼀定是KNO3饱和溶液B、剩余溶液⼀定是NaClC、上述⽅法可以将两者完全分离D、析出的晶体中只含有KNO3.三.计算题(共13⼩题)18.20℃时,氯化钠溶解度为36克.计算20℃时,68克氯化钠饱和溶液中含溶质的质量为.19.实验室⼀瓶新购进的浓硫酸,其标签的部分内容如图所⽰.(1)若该瓶硫酸还没有开瓶使⽤,瓶内溶质的质量为g(计算结果保留到0.1,下同)(2)若要配制9.8%的稀硫酸400g,则需⽤该浓硫酸质量为g.20.制作“叶脉书签”需要100g溶质质量分数为10%的氢氧化钠溶液.请问:(1)氢氧化钠中钠元素的质量分数是;(2)配制时需要氢氧化钠固体的质量是g;(3)若⽤20%的氢氧化钠溶液和⽔配制,需要20%的氢氧化钠溶液质量是g.21.现有家⽤⾷⽤碱12g(主要成分为Na2CO3,其它成分不与酸反应),向其中加⼊某未知浓度的稀盐酸100g,恰好完全反应,称得剩余物质的总质量为107.6g,请计算:(1)该⾷⽤碱中Na2CO3的质量(2)该稀盐酸中溶质的质量分数.22.若⽤溶质质量分数为18%的氯化钠溶液配制500g溶质质量分数为0.9%的⽣理盐⽔,需要18%的氯化钠溶液多少克?需⽔多少克?23.实验室若配制50g质量分数3%的NaCl溶液,则需6%的NaCl溶液g.24.将100g溶质质量分数20%的氯化钠溶液稀释成5%的溶液,需加⽔多少克?(解题步骤)25.欲⽤溶质质量分数为15%的氯化钠溶液配制300g溶质质量分数为10%的氯化钠溶液,求需15%的氯化钠溶液多少克?(解题步骤)26.要配置50g浓度为5%的氯化钠溶液回答下列问题:(1)需要氯化钠的质量g,⽔的质量(2)取上述配好的溶液25g稀释成2.5%的溶液加⽔g(3)50g 5%的氯化钠溶液变为10%氯化钠溶液需要加⼊15%氯化钠溶液g.27.现对80g5%的氯化钠溶液进⾏如下操作,请计算所得溶液的溶质质量分数:(1)加⼊20g氯化钠固体,完全溶解:;(2)加⼊20g20%的氯化钠溶液:.28.60℃时,将36g硝酸钾完全溶于204g⽔中,制成硝酸钾溶液.(1)该溶液中溶质的质量分数为多少?(2)将该溶液平均分成三等份:①取第⼀份,将温度升⾼到90℃,此时溶质的质量分数为多少?②取第⼆份,若要使其溶质的质量分数⽐原来增加⼀倍,需加⼊硝酸钾固体约多少克?③取第三份,若要使其溶质的质量分数变为原来的⼀半,需加⽔多少克?29.实验室⼀瓶新购进的浓硫酸,其标签的部分内容如图所⽰.(1)若该瓶硫酸还没有开封使⽤,瓶内溶质的质量为多少g?(计算结果保留⾄0.1)(2)若要配制9.8%的稀硫酸400g,则需⽤该浓硫酸质量为多少g?若量取浓硫酸时采⽤仰视的⽅法,则配制的溶液溶质质量分数9.8%(填“⼤于”、“等于”或“⼩于”).30.现有溶质质量分数为10%的硝酸钾溶液70克,加⼊50克硝酸钾,还有20克未溶解,求所得溶质质量分数?。
稀溶液的依数性练习题

稀溶液的依数性练习题 Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】稀溶液依数性一、判断题1、水的液-汽两相平衡线,是水的蒸气压曲线。
()2、在t℃时,液体A较液体B有较高的蒸气压,由此可以合理推断A比B有较低的正常沸点。
()3、一个溶液所有组分的摩尔分数总和为1。
()4、 mol·kg-1甘油的水溶液和 mol·kg-1甘油的乙醇溶液,应有相同的沸点升高。
()5、质量分数的蔗糖水溶液和质量分数的果糖水溶液有相同的渗透压。
()6、K b的物理意义可以认为就是1 mol·kg-1溶液的沸点升高值。
()7、纯溶剂通过半透膜向溶液渗透的压力叫作渗透压。
()8、溶液的蒸汽压与溶液的体积有关,体积愈多,蒸汽压愈大。
()9、通常指的沸点是蒸汽压等于外界压力时液体的温度。
()10、 mol·kg-1甘油的水溶液和 mol·kg-1蔗糖水溶液,有相同的渗透压。
()二、选择题1、处于恒温条件下的一封闭容器中有两个杯子,A杯为纯水,B杯为蔗糖溶液。
防止总够长时间后则发现()。
A.A杯水减少,B杯水满后不再变化 B.B杯水减少,A杯水满后不再变化C.A杯变成空杯,B杯水满后溢出 D.B杯水干并有蔗糖晶体,A杯水满后溢出2、不挥发的溶质溶于水形成溶液之后,将使其()。
A.熔点高于0℃ B.熔点低于0℃ C.熔点仍为0℃ D.熔点升降与加入物质分子量有关3、不挥发的溶质溶于水后会引起()。
A.沸点升降 B.熔点升降 C.蒸气压升高 D.蒸气压下降4、16克I2溶于100克乙醇(C2H5OH)所配成的溶液,其密度为0.899 g·mL-1,碘溶液的b值和c值那个大()。
A.b>c B.b<c C.b=c D.不能确定5、在稀溶液的凝固点降低公式中的b所代表的是溶液的()。
A.溶质的质量摩尔浓度 B.溶质的摩尔分数 C.溶剂的摩尔分数 D.溶液的(物质的量)浓度6、质量摩尔浓度的定义是在何物质中所含溶质的量(mol)()。
稀溶液的依数性练习题

稀溶液的依数性练习题Revised on November 25, 2020稀溶液依数性一、判断题1、水的液-汽两相平衡线,是水的蒸气压曲线。
()2、在t℃时,液体A较液体B有较高的蒸气压,由此可以合理推断A比B有较低的正常沸点。
()3、一个溶液所有组分的摩尔分数总和为1。
()4、 mol·kg-1甘油的水溶液和 mol·kg-1甘油的乙醇溶液,应有相同的沸点升高。
()5、质量分数的蔗糖水溶液和质量分数的果糖水溶液有相同的渗透压。
()6、K b的物理意义可以认为就是1 mol·kg-1溶液的沸点升高值。
()7、纯溶剂通过半透膜向溶液渗透的压力叫作渗透压。
()8、溶液的蒸汽压与溶液的体积有关,体积愈多,蒸汽压愈大。
()9、通常指的沸点是蒸汽压等于外界压力时液体的温度。
()10、 mol·kg-1甘油的水溶液和 mol·kg-1蔗糖水溶液,有相同的渗透压。
()二、选择题1、处于恒温条件下的一封闭容器中有两个杯子,A杯为纯水,B杯为蔗糖溶液。
防止总够长时间后则发现()。
A.A杯水减少,B杯水满后不再变化 B.B杯水减少,A杯水满后不再变化C.A杯变成空杯,B杯水满后溢出 D.B杯水干并有蔗糖晶体,A杯水满后溢出2、不挥发的溶质溶于水形成溶液之后,将使其()。
A.熔点高于0℃ B.熔点低于0℃ C.熔点仍为0℃ D.熔点升降与加入物质分子量有关3、不挥发的溶质溶于水后会引起()。
A.沸点升降 B.熔点升降 C.蒸气压升高 D.蒸气压下降4、16克I2溶于100克乙醇(C2H5OH)所配成的溶液,其密度为0.899 g·mL-1,碘溶液的b值和c值那个大()。
A.b>c B.b<c C.b=c D.不能确定5、在稀溶液的凝固点降低公式中的b所代表的是溶液的()。
A.溶质的质量摩尔浓度 B.溶质的摩尔分数 C.溶剂的摩尔分数 D.溶液的(物质的量)浓度6、质量摩尔浓度的定义是在何物质中所含溶质的量(mol)()。
习题参考第二章稀溶液的依数性

第二章 稀溶液的依数性 难题解析例 2-1 已知异戊烷C 5H 12的摩尔质量M = 72.15 g·mol -1,在20.3℃的蒸气压为77.31 kPa 。
现将一难挥发性非电解质0.0697g 溶于0.891g 异戊烷中,测得该溶液的蒸气压降低了2.32 kPa 。
(1)试求出异戊烷为溶剂时Raoult 定律中的常数K ;(2)求加入的溶质的摩尔质量。
解 (1)AA B AB B A B B M m n n n n n n X =≈+= B B A 0A AB 0B 0ΔKb b M p M m n p x p p ==== K = p 0M A 对于异戊烷有 K = p 0M A = 77.31 kPa×72.15 g·mol -1=5578 kPa·g·mol -1 = 5.578 kPa·kg·mol -1(2)AB B B Δm M m K Kb p == 11A B B mol g 188kg 10000.891kPa 32.2g 0697.0mol kg kPa 578.5Δ--⋅=⨯⋅⋅=⋅=m p m K M 例2-2 一种体液的凝固点是-0.50℃,求其沸点及此溶液在0℃时的渗透压力(已知水的K f =1.86 K·kg·mol -1,K b =0.512K·kg·mol -1)。
解 稀溶液的四个依数性是通过溶液的质量摩尔浓度相互关连的,即RTK T K T K p b ∏≈===f f b b B ΔΔΔ 因此,只要知道四个依数性中的任一个,即可通过b B 计算其他的三个依数性。
B f f b K T =∆11-f f B kg mol 269.0mol kg K 86.1K 500.0Δ-⋅=⋅⋅==k T b K 138.0kg mol 269.0mol kg K 512.0Δ-1-1B b b =⋅⨯⋅⋅==b k T 故其沸点为100+0.138 = 100.138℃ 0℃时的渗透压力 RT b cRT B ≈=∏ = 0.269mol·L -1×8.31J·K -1·mol -1×273K = 0. 269mol·L -1×8.31kPa·L·K -1·mol -1×273K = 610 kPa 例2-3 按溶液的凝固点由高到低的顺序排列下列溶液: ① 0.100mol·kg -1的葡萄糖溶液 ② 0.100mol·kg -1的NaCl 溶液 ③ 0.100mol·kg -1的尿素溶液 ④ 0.100mol·kg -1的萘的苯溶液 解 这里要考虑多种因素:溶剂的凝固点、溶剂的摩尔凝固点降低常数、溶液的质量摩尔浓度、溶质是电解质还是非电解质。
最新第二章 稀溶液依数性习题解析

第一章 稀溶液依数性习题解析1. 一杯糖水和一杯等量的纯水同时放置,那杯水蒸发得快,为什么?答:在相同温度下,糖水溶液的蒸气压低于纯水,即纯水易于挥发,所以蒸发得快。
2. 冬天,室外水池结冰时,腌菜缸里的水为什么不结冰?答:腌菜缸里是盐的水溶液,溶液的凝固点比纯水低,冬天室外水池结冰时温度为0℃,此时的温度还不到溶液的凝固点,所以腌菜缸里的水不结冰。
3. 0.01mol ·kg -1葡萄糖(C 6H 1206)、盐(NaCl )水及蔗糖(C 12H 22O 11)溶液的沸点相同吗?答:不相同,盐(NaCl )水的沸点高。
4. 在20℃时水的饱和蒸气压为2.34 kPa 。
若于100g 水中溶有10.0 g 蔗糖(C 12H 22O 11 ,相对分子质量M r= 342),求此溶液的蒸气压。
解;先求溶液中溶剂的摩尔分数:995.03420.1002.1810002.18100111=⋅+⋅⋅=---mol g g mol g g mol g gA χ 根据拉乌尔定律可求出溶液的蒸气压p = p 0 x = 2.34kPa ×0.995 = 2.33kPa5. 甲溶液由1.68 g 蔗糖(C 12H 22O 11,M r=342)和20.00 g 水组成,乙溶液由2.45 g M r=690 的某非电解质和20.00 g 水组成。
(1) 在相同温度下,哪份溶液的蒸气压高?(2) 将两份溶液放入同一个恒温密闭的钟罩里,时间足够长,两份溶液浓度会不会发生变化,为什么?(3)当达到系统蒸气压平衡时,转移的水的质量是多少?答:(1)先比较两份溶液中的水的摩尔分数 甲溶液:996.034268.102.180.2002.180.20111=⋅+⋅⋅=---mol g g mol g g mol g gA χ乙溶液:997.069045.202.180.2002.180.20111=⋅+⋅⋅=---mol g g mol g g mol g gA χ 乙溶液溶剂的摩尔分数大,所以乙溶液的蒸气压大。
基础化学题库(题库+标准答案)

第二章稀溶液依数性练习题一、就是非题(共10题)1、溶液得沸点就是指溶液沸腾温度不变时得温度。
( )2、溶液与纯溶剂相比沸点升高、凝固点降低就是由于溶剂摩尔分数减小引起得。
( )3、等物质得量硝酸钾与碳酸钾分别加入等量得水中,该两溶液得蒸气压下降值相等。
( )4、凡就是浓度相等得溶液都就是等渗溶液。
( )5、溶液得蒸气压下降与沸点升高仅适用于难挥发得非电解质溶质,而凝固点降低及渗透压则不受此限制。
( )6、电解质浓溶液也有依数性变化规律,但不符合拉乌尔定律得定量关系。
( )7、一定量得电解质加入纯水中,此溶液得沸点一定高于100℃,但无法定律计算。
( )8、任何两种溶液用半透膜隔开,都有渗透现象发生。
( )9、分散质粒子大小在合适得范围内,高度分散在液体介质中就能形成稳定得溶胶。
( )10、 AlCl3、MgCl2、KCl三种电解质对负溶胶得聚沉值依次减小。
( )二、选择题 ( 共11题 )1、以下论述正确得就是(A)饱与溶液一定就是浓溶液(B)甲醇就是易挥发性液体,溶于水后水溶液凝固点不能降低(C)强电解质溶液得活度系数皆小于1(D)质量摩尔浓度数值不受温度变化2、已知乙醇与苯得密度分别为0、800 g·cm3与0、900 g·cm3,若将86、3cm3乙醇与 901 cm3苯互溶, 则此溶液中乙醇得质量摩尔浓度为( )(A) 1、52 mol·dm3 (B) 1、67 mol·dm3(C) 1、71 mol·kg1 (D) 1、85 mol·kg13、 2、5 g 某聚合物溶于 100 cm3水中, 20℃时得渗透压为 100 Pa, 则该聚合物得相对分子质量就是( )(A) 6、1×102 (B) 4、1×104 (C) 6、1×105 (D) 2、2×1064、 1、0 mol·dm3蔗糖得水溶液、1、0mol·dm3乙醇得水溶液与1、0 mol·dm3乙醇得苯溶液, 这三种溶液具有相同得性质就是 ( )(A) 渗透压 (B) 凝固点(C) 沸点 (D) 以上三种性质都不相同5、 1、17 % 得 NaCl 溶液产生得渗透压接近于( )(相对原子质量: Na 23, Cl 35、5) (A) 1、17 % 葡萄糖溶液 (B) 1、17 % 蔗糖溶液(C) 0、20 mol·dm3葡萄糖溶液 (D) 0、40 mol·dm3蔗糖溶液6、同温同浓度得下列水溶液中, 使溶液沸点升高最多得溶质就是( )(A) CuSO4 (B) K2SO4(C) Al2(SO4)3(D) KAl(SO4)27、要使溶液得凝固点降低 1、00℃ , 必须向 200 g 水中加入 CaCl2得物质得量就是(水得K f=1、86 K·kg·mol1)( )(A) 1、08 mol (B) 0、108 mol (C) 0、0540 mol (D) 0、0358 mol8、某难挥发非电解质稀溶液得沸点为 100、400℃ , 则其凝固点为 ( ) (水得K b= 0、512 K·kg·mol1, K f= 1、86 K·kg·mol1)(A) 0、110℃ (B) 0、400℃ (C) 0、746℃ (D) 1、45℃9、与纯溶剂相比,溶液得蒸气压( )(A) 一定降低(B) 一定升高(C) 不变(D) 需根据实际情况做出判断,若溶质就是挥发性很大得化合物就不一定降低10、 60℃时, 180 g水中溶有 180 g葡萄糖, 已知60℃时水得蒸气压为19、9kPa, C6H12O6得相对分子质量为 180, 则此水溶液得蒸气压应为( )(A) 1、81 kPa (B) 9、95 kPa (C) 15、9 kPa (D) 18、1 kPa11、若氨水得质量摩尔浓度为 mmol·kg1,则其中NH3得摩尔分数为( ) mm(A) ───── (B) ──────────1000/18 [(100017m)/18]+mm(C) ─────── (D) 不确定(1000/18) + m三、填空题 ( 共 8题 )1、 (2 分)体温为 37℃时, 血液得渗透压为 775 kPa, 此时与血液具有相同渗透压得葡萄糖(相对分子质量为 180)静脉注射液得浓度应为 __________________ g·dm3。
第2章稀溶液的依数性
1.测定体液渗透压有什么意义? 2.渗透压力的测定步骤: 了解血液透析的原理(自学)
60
练习
1、相同温度下,下列溶液中渗透 压最大的是 A、0.01mol/L CaCl2 B、0.2mol/L 蔗糖溶液 C、生理盐水 0.154 mol/L (NaCl)
6
重
蒸气压P (饱和蒸气压):
点
在一定温度下,液相和气相达到平 衡,此时,蒸气所具有的压力。
蒸气压的特点 P12:表2-1
T愈大,P愈大
7
重
纯固体的蒸气压
点
升华
H2O(s) 凝结 H2O(g)
冰
-25℃
与固相处于平衡时的蒸气所 具有的压力。
P.13.表2-2 T愈大,P愈大
8
重
蒸气压的特点
点
P12:表2-1,2-2
溶液的渗透压()
3
第二章 稀溶液的依数性 第一节 溶液的蒸气压下降 第二节 溶液的沸点升高和凝固点降低 第三节 溶液的渗透压
4
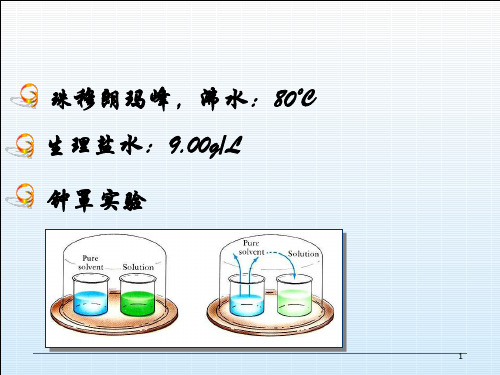
第一节 溶液的蒸汽压下降 钟罩实验
5
一、蒸汽压
蒸发
H2O(l) 凝结
H2O(g)
Po
H2O 25℃
溶液中有少数能量较大的分子有脱 离母体进入空间的倾向------逃逸倾向。
凝固点: Pb = Pf
0.610 0
T/ 0C
11
练习题
判断:
由于乙醇比水易挥发,故在相同温度
下,乙醇的蒸汽压大于水的蒸汽压。
12
重
三、溶液的蒸气压下降(△P) 点
难挥发性的溶质:本身并不产生 蒸气压(葡萄糖、尿素)
H2O
25℃
葡萄糖
稀溶液练习题

稀溶液练习题一、选择题1-1、将难挥发的非电解质溶于溶剂后,将会引起()A 沸点下降B 凝固点升高C 渗透压下降D 蒸气压下降1-2、比溶剂更容易挥发的溶质溶于溶剂之后可能会引起()A 沸点上升B 凝固点降低C 蒸气压上升D 渗透压下降二、填空题1-3、难挥发非电解质稀溶液的通性又称为稀溶液的依数性,它包括;;;。
1-4、拉乌尔(F·M·Raoult)于1887年得出如下结论:在一定温度下,非溶液的蒸气压下降与溶质的分数成正比。
1-5、在纯水、以及浓度均为0.1mol/kg的KCl、K2SO4、蔗糖(C12H22O11)、NaAc溶液中,沸点最高的是,沸点最低的是。
1-6、比较下列溶液渗透压的大小:1.0% 的C12H22O11 1.0% 的C3H6O30.1mol/kg C2H5OH 0.1 mol/kg C12H22O110.1 mol/kg HCl1-7、难挥发非电解质稀溶液的依数性表现为蒸气压下降,沸点上升,凝固点下降和渗透压。
其中蒸气下降的数学表达式为,沸点上升的数学表达式为。
0.1mol/kg 乙醇水溶液(K f=1.86)的凝固点下降为。
300K,0.1mol/L葡萄糖水溶液的渗透压约为 kP a。
1-8、一定温度下、100kPa的大气中,水的饱和蒸气压为3.0kPa。
实际测出某处水蒸气的分压为2.0kPa,则该处的相对湿度是,水蒸气的压力分数为,H2O的物质的量分数为。
三、计算题1-9、计算98%浓硫酸(M=98.07)(d=1.84)的c。
1-10、计算38.0%盐酸(M=36.46)溶液的b。
1-11、已知水的凝固点下降常数K f=1.86。
试计算:(1)0.1mol/kg NaCl水溶液的凝固点。
(2)300K,0.1mol/L NaCl水溶液的渗透压。
《稀溶液的依数性》习题解答

习 题1. 什么叫稀溶液的依数性?难挥发性非电解质稀溶液的四种依数性之间有什么联系? 答 溶液的蒸气压下降、沸点升高、凝固点降低和渗透压力等性质只与溶质、溶剂微粒数的比值有关,而与溶质的本性无关,因为这类性质的变化规律只适用于稀溶液,所以统称为稀溶液的依数性。
难挥发性非电解质稀溶液的四种依数性之间关系密切,知道一种依数性则可以求出另一种依数性:b f B b f T T p Πb K K K RT∆∆∆==== 2.已知293.15K 时水的饱和蒸气压为2.338kPa ,若将5.00g 尿素[CO (NH 2)2]溶于100g 水中,试问该溶液的蒸气压为多少?解 尿素的摩尔质量M = 60g ·mol -1,溶液中H 2O 的摩尔分数为()-12-1-1100g18g mol H O 0.9855.00g 100g 60g mol 18g mol x ⋅==+⋅⋅ 尿素溶液的蒸气压为p = p 0 x (H 2O) = 2.338 kPa ×0.985= 2.303 kPa3. 将19.0g 某生物碱溶于100g 水中,测得此溶液的凝固点降低值△T f 为0.220K ,试求该生物碱的相对分子质量。
解 水的K f =1.86K ·kg ·mol -1,则-13-119.0g []=1.86K kg mol 1. 6110g mol 0.220K 0.100kgM ⋅⋅⨯=⨯⋅⨯生物碱 由计算结果可知,该生物碱的相对分子质量为1.61×103。
4. 什么叫渗透?渗透压力的定义是什么?渗透现象产生的条件是什么?答 溶剂分子通过半透膜进入溶液的自发过程称为渗透作用,简称渗透。
渗透压力:为维持只允许溶剂分子通过的半透膜所隔开的溶液与溶剂之间的渗透平衡而需要在溶液液面上施加的超额压力等于渗透压力。
产生渗透现象的条件:(1)必须有半透膜存在;(2)半透膜两侧相同体积的液体中溶剂分子数目不相等。
人教版初三下册溶液配制和稀释典型习题+详解

溶液配制练习一、固-水例1:配制50 g质量分数为5%的氯化钠钠溶液,需要氯化钠多少克?水多少亳升?解析:这是溶液配制最基本、最典型的类型。
可由公式:溶质质量=溶液质量×溶质质量分数;溶剂质量=溶液质量—溶质质量和体积=质量/密度直接计算。
氯化钠质量=50 g×5%=2.5 g 水的质量=50 g—2.5 g =47.5 g水的体积=47.5 g/1 g/ ml=47.5 ml例2:配制500 ml质量分数为10%的氢氧化钠溶液(密度为1.1 g/cm3)需要氢氧化钠和水的质量各多少?解析:此题涉及溶液密度,要注意转化成质量来计算。
溶液中只有质量有加和关系,体积不能直接进行和差计算。
氢氧化钠溶质质=500 ml1.1 g/cm310%=55 g水的质量=500 ml1.1 g/cm3—55 g=495 g(不要计算成500—55=445)二、液-水例3:用25%的氯化钠溶液和水配制30kg10%的食盐溶液。
需要25%的氯化钠溶液和水各多少kg?解析:紧紧抓住配制前后的等量关系是关键。
可以利用配制前后溶质、溶剂的相对应相等来列方程解决。
设需要25%的氯化钠溶液和水质量为x和y25%x=30k g10%,解得x=12k g;Y=30k g—12k g=18k g例4:某工厂化验室配制5000 g20%的盐酸,需要38%的盐酸(密度为1.19 g/cm3)和水各多少毫升?解析:可以直接利用质量列方程计算。
设需要30%的盐酸体积为x,水的体积为y,5000 g×20%=x×1.19 g/cm338% 解得x=2212 mlY=5000 g—2212 ml×1.19 g/cm338% =2453 ml三、液-液例5:要配制20%的食盐溶液100 g,需要10%和50%的食盐溶液各多少亳升?解析:此题可根据溶液配制前后的溶质、溶剂、溶液相等来列出议程组解决。
2013 第二章 稀溶液的依数性

• 沸点升高 (boiling point elevation)
• 凝固点降低 (freezing point depression)
• 渗透压 (osmotic pressure)
Organic Chem
教学要求
了解稀溶液的蒸气压下降、沸点升高、凝固点 降低的原因。 熟悉稀溶液的蒸气压下降、沸点升高、凝固点 降低的概念及相关计算。
Organic Chem
2. 用盐和冰的混合物作冷却剂 例如:采用NaCl和冰,温度可以降到–22oC, 用CaCl2·2H2O和冰,温度可以降到–55oC。 汽车水箱中加甘油或乙二醇
Tf↓
Organic Chem
第四节
1. 渗透现象
溶液的渗透压
纯 水
蔗糖溶液(浓)
一、渗透现象和渗透压
Organic Chem
积溶液中所含溶质的粒子数丌等,所以渗透压也丌同。 如:0.3mol· -1 葡萄糖溶液的渗透压是0.3mol· -1 L L 的NaCl溶液渗透压的一半。
Organic Chem
练习题3
• 判断下列各对溶液渗透压的高低,幵指出水的渗透方向 。(假定有理想半透膜隔开)。 (1)0.0278 mol·L-1葡萄糖溶液不0.0146mol·L-1
Organic Chem
第二节
溶液的沸点升高
一、液体的沸点 液体的沸点是液体的蒸气压等 于外界压强时的温度。 液体的正常沸点是指外压为 101.3kPa 时的沸点。
Organic Chem
液体的沸点随外压变化
外压大——沸点高 外压小——沸点低
Organic Chem
二、溶液的沸点升高
Δp = p* - p = p*A – p*A xA = p*A xB
第二章稀薄溶液的依数性

水 (a) 半透膜
h
(b)
(C)
基础化学 Basic chemistry
一、渗透现象和渗透压 1.渗透现象:溶剂分子通 过半透膜由稀溶液进入 浓溶液的扩散现象
0.1mol/L
水 葡萄糖
H2O多 H2O少 H2O
半透膜
水渗透方向:稀 浓 必具两个条件:
①有半透膜存在 ②膜两侧浓度不等
基础化学 Basic chemistry
O 0.6106
H2O
冰
Tf0 0℃
T/K
水和冰的蒸气压曲线
基础化学 Basic chemistry
结论
1. p与液体的本性有 关。易挥发性物质 的 p大,难挥发性 物质的 p 小。
2.温度升高,p增大 3.固体物质的蒸气压
一般很小
基础化学 Basic chemistry
二.溶液的蒸气压下降 —Raoult定律 封闭箱中,长时间后,糖水、纯水液 面的变化?若改为两杯浓度不同的糖 水,其结果又会怎样?
解: ∵ ∏ = c R T
∴ c = ∏/ RT =3.04×103/(8.314×298) =0.126mol/L
基础化学 Basic chemistry
结论
1.非电解质的依数性:
△P= KbB
△Tf= KfbB
△Tb= KbbB
=bB RT
△P K
△Tb = Kb
=
△Tf Kf
=
RT
=bB
Tb= 100.015(℃)
基础化学 Basic chemistry
2. 难挥发非电解质稀溶液沸腾时,溶液 浓度逐渐增大,导致溶液沸腾的温度
A.不断降低 C.保持不变
B.不断升高
初三化学 溶液稀释问题专题练习

溶液稀释问题专题练习一、单选题1.用浓盐酸配制一定溶质质量分数的稀盐酸,实验时必不可少的一组仪器是( ) A.玻璃棒量筒烧杯胶头滴管B.托盘天平量筒烧杯玻璃棒C.托盘天平玻璃棒烧杯胶头滴管D.量筒烧杯漏斗玻璃棒2.通常状况下,下列溶液的溶质为液体的是( )A.蔗糖溶液 B.酒精溶液 C.氯化钠溶液 D.澄清石灰水3.某氯化钠溶液中溶质的质量分数是20%,则下列说法中不正确的是( )A.溶质质量∶溶剂质量=1∶4B.溶剂质量∶溶液质量=4∶5C.溶质质量∶溶液质量=1∶5D. 100 g水中含有20 g氯化钠4.有关溶液的说法正确的是( )A.具有均一性、稳定性的液体一定是溶液B.配制溶液时,搅拌可以增大固体溶质的溶解度C.饱和溶液的浓度一定比不饱和溶液的浓度大D.融雪剂的原理是利用某些物质水溶液的凝固点低于0 ℃5.下列溶液中,溶质和溶剂在常温下都是液态的是( )A.蔗糖水 B.碘酒 C.酒精溶液 D.高锰酸钾溶液6.下列有关溶液的说法不正确的是( )A.可口可乐汽水和白蒲黄酒都属于溶液B.固体物质的溶解度不一定都随温度的升高而增大C.一定温度下,向氯化钠饱和溶液中加入水后会变成不饱和溶液D.某物质在100 g溶剂里达到饱和状态时所溶解的质量就是该物质的溶解度7.在温度不变的条件下,下列欲使溶质的质量分数变为原来2倍的方法,最可行的是( )A.将20 g硝酸钾饱和溶液蒸发掉10 g水B.将20 g硝酸钾不饱和溶液蒸发掉10 g水C.在10 g 10%的硝酸钾溶液中加入5 g 40%的硝酸钾溶液D.在10 g硝酸钾不饱和溶液中加入10 g硝酸钾固体8.关于饱和溶液和不饱和溶液的说法中正确的是( )A.饱和溶液一定是浓溶液B.不饱和溶液一定是稀溶液C.饱和溶液一定比不饱和溶液浓D.在相同温度下,同种溶质的饱和溶液一定比不饱和溶液浓一些9.三种不含结晶水的固体物质甲、乙、丙的溶解度曲线如下图,下列说法正确的是( )A.将t1℃时的三种物质的饱和溶液升温至t2℃时,所得溶液的的溶质质量分数大小顺序是乙>甲>丙B.在t2℃时,甲、乙两饱和溶液中含的溶质质量一定相等C.甲、乙、丙三种物质的饱和溶液升温都会转化为不饱和溶液D.要从含有少量甲的乙溶液中得到较多的乙晶体,通常可采用降温结晶的方法10.下列关于溶液的说法正确的是( )A.溶液都是均一、稳定的纯净物B.饱和溶液的浓度一定大于不饱和溶液的浓度C.温度和溶剂的种类不会影响物质的溶解性D.配制一定溶质质量分数的溶液需要经过计算、称量(量取)、溶解等步骤11.下图是KNO和NaCl 的溶解度曲线。
(最新整理)初三化学下册溶液练习题含详细答案

C.
D.
3.t℃时,向一支盛有 0.15g 熟石灰的烧杯中加入 50g 水,充分振荡后静置,烧杯底部仍有未
溶解的白色固体.下列相关叙述正确的是( )
第 2 页(共 36 页)
初三化学下册溶液练习题含详细答案
A.升高温度上层清液变为不饱和溶液 B.t℃时,熟石灰的溶解度为 0。3g C.烧杯中溶液的质量小于 50.15g D.上层清液中溶质质量分数大于 0。3% 4.如图为甲乙两物质的溶解度曲线,下列说法正确的是( )
第 6 页(共 36 页)
初三化学下册溶液练习题含详细答案
B.配制溶液时,搅拌溶液可以增大溶质的溶解度
C.将 10%的 KNO3 溶液倒出一半,剩余溶液中溶质的质量分数为 20% D.饱和溶液在一定条件下可转化为不饱和溶液
19.下列可以作为溶质的是( )
A.只有固体 B.只有液体
C.只有气体 D.固体、液体或气体
初三化学下册溶液练习题含详细答案
初三化学下册溶液练习题含详细答案
编辑整理:
尊敬的读者朋友们: 这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对 文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(初三化学下册溶液练习题含详 细答案)的内容能够给您的工作和学习带来便利。同时也真诚的希望收到您的建议和反馈,这将是 我们进步的源泉,前进的动力。 本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快 业绩进步,以 下为初三化学下册溶液练习题含详细答案的全部内容。
鲁教版《第二章 水和溶液》复习测试卷及答案

—鲁教版《第二章 水和溶液》复习测试卷及答案(第二章,测试时间:60分钟,卷面总分:60分)一、选择题(每题2分,共20分)1“低碳生活”是指减少能源消耗、节约资源,从而减少二氧化碳排放的生活方式。
下列不符合“低碳生活” 的做法是( )A .用篮子代替塑料袋B .经常开车上班C .使用节能灯泡D .节约每一滴水2下列实验操作不正确的是( )A .检查装置气密性B .取用固体药品C .加热高锰酸钾D .熄灭酒精灯3.以下属于纯净物的是 ( )A.高锰酸钾受热后的固体B.向上排气法得到得氢气C.磷在氧气中燃烧生成的白烟D.蜡燃烧的生成物4、人类对火星的探索取得了重大突破,下图是火星大气成分含量示意图。
与空气的成分相比较,下列说法中正确的是A .火星大气中N 2的体积分数小于空气中N 2的体积分数B .火星大气中CO 2的体积分数小于空气中CO 2的体积分数C .火星大气中O 2的体积分数大于空气中O 2的体积分数D .火星上大气中有稀有气体,空气中没有稀有气体 5.农业科技人员向农民建议:利用温室进行植物生产时,可向温室内通人适量的二氧化碳,这是因为 ( )A .二氧化碳可使害虫窒息死亡从而防治病虫害B .二氧化碳可产生温室效应从而提高室温CO 2 N 2 Ar火星的大气组成C.施用后可促进植物的光合作用D.施用后可防止火灾6.一氧化氮气体难溶于水,密度略大于空气。
常温下易与空气中的氧气反应生成红棕色的二氧化氮,实验室收集一氧化氮,宜采用的方法是 ( )A.向上排空气法 B.排水法C.向上排空气法或排水法 D.向下排空气法或排水法7.造成空气污染的是()①汽车尾气②煤燃烧产生的烟尘和气体③动物呼出的气体④化工厂排放的废气⑤植物光合作用产生的气体⑥沙尘暴A. ①②③B.④⑤⑥C.①②③④D.①②④⑥8.11月首届“世界低碳与生态大会暨技术博览会”在我国举行。
下列做法中不符合...“低碳经济”理念的是()A、改造或淘汰高能耗、高污染产业B、大力发展火力(用煤作燃料)发电C、研制和开发新能源替代传统能源D、优化建筑设计,增强室内自然采光,减少照明用电9.下面有关气体的制取、收集和检验方法不正确的是A.实验室可用甲装置来制取氧气 B.乙装置可用来制取、检验二氧化碳C.收集氢气可用丙装置 D.丁装置可用来收集氧气10.比较、推理是化学学习常用的方法,以下是根据一些反应事实推导出的影响化学反应的因素,其中推理不合理的是 ( )C 双氧水在常温下较难分解,而在加入二氧化锰后迅速分解催化剂D 铜片在空气中很难燃烧,铜粉在空气中较易燃烧反应物的种类二、填空题(40分)11、水是重要的自然资源。
稀溶液的依数性练习题

稀溶液依数性一、判断题1、水的液-汽两相平衡线,是水的蒸气压曲线。
()2、在t℃时,液体A较液体B有较高的蒸气压,由此可以合理推断A比B有较低的正常沸点。
()3、一个溶液所有组分的摩尔分数总和为1。
()4、0.1 mol·kg-1甘油的水溶液和0.1 mol·kg-1甘油的乙醇溶液,应有相同的沸点升高。
()5、质量分数0.01的蔗糖水溶液和质量分数0.01的果糖水溶液有相同的渗透压。
()6、K b的物理意义可以认为就是1 mol·kg-1溶液的沸点升高值。
()7、纯溶剂通过半透膜向溶液渗透的压力叫作渗透压。
()8、溶液的蒸汽压与溶液的体积有关,体积愈多,蒸汽压愈大。
()9、通常指的沸点是蒸汽压等于外界压力时液体的温度。
()10、0.1 mol·kg-1甘油的水溶液和0.1 mol·kg-1蔗糖水溶液,有相同的渗透压。
()二、选择题1、处于恒温条件下的一封闭容器中有两个杯子,A杯为纯水,B杯为蔗糖溶液。
防止总够长时间后则发现()。
A.A杯水减少,B杯水满后不再变化B.B杯水减少,A杯水满后不再变化C.A杯变成空杯,B杯水满后溢出D.B杯水干并有蔗糖晶体,A杯水满后溢出2、不挥发的溶质溶于水形成溶液之后,将使其()。
A.熔点高于0℃B.熔点低于0℃C.熔点仍为0℃D.熔点升降与加入物质分子量有关3、不挥发的溶质溶于水后会引起()。
A.沸点升降B.熔点升降C.蒸气压升高D.蒸气压下降4、16克I2溶于100克乙醇(C2H5OH)所配成的溶液,其密度为0.899 g·mL-1,碘溶液的b值和c值那个大()。
A.b>c B.b<c C.b=c D.不能确定5、在稀溶液的凝固点降低公式中的b所代表的是溶液的()。
A.溶质的质量摩尔浓度B.溶质的摩尔分数C.溶剂的摩尔分数D.溶液的(物质的量)浓度6、质量摩尔浓度的定义是在何物质中所含溶质的量(mol)()。
初中化学苏版初三下册第二单元溶液溶液的浓度溶液的稀释和浓缩课后微练习2

初中化学苏版初三下册第二单元溶液溶液的浓度溶液的稀释和浓缩课后微练习 2班级 ______姓名 __________ 学号 _______1.欲将 80 g 质量分数为 20%的 NaOH 溶液稀释到质量分数为10%,需加水 __________g2.某同学用 25 ℃的水溶解必定量的NaCl,充足搅拌后发现杯底还有部分 NaCl 晶体没有溶解。
而后该同学又用酒精灯加热至部溶解。
那么在加热前后,以下各量没有发生改变的是〔60 ℃,固体全〕A、NaCl的溶解度B、溶质的质量C、溶剂的质量D、溶质的质量分数3.以下相关〝配制50g 溶质质量分数为6%的氯化钠溶液〞的操作错误的选项是〔〕A、使用托盘天平前,要先取下支撑托盘的垫圈,再调理天平均衡B、称取氯化钠前,要在天平两头的托盘上分别放质量同样的纸片C、挪动游码使其右边对齐3g 的刻度线,而后将氯化钠加到天平的右盘上D、取用规格为 50mL 的量筒量取 17mL 水,快到所需刻度时改用胶头滴管定容4.用氯化钠配制 100 g 溶质质量分数为0.9%的生理盐水 ,现有以下操作:①配制溶液;②称取氯化钠固体;③过滤;④量取蒸馏水;⑤计算。
正确的操作次序是〔〕A、①②③④B、⑤②④①C、⑤①②④D、③②④①5.化学实验室取用16 g 硫酸铜粉末,可配制8%的硫酸铜溶液g;假定用 20%的硫酸铜溶液 100 g 加水稀释,可得8%的硫酸铜溶液g。
6. ToC 时,将某硝酸钾溶液蒸发,第一次蒸发掉10 克水,并冷却到原温度,没有晶体析出,第二次蒸发掉10 克水,冷却到原温度析出晶体2克,第三次蒸发掉10 克水并冷却到原温度析出晶体的质量应为〔〕A、等于 2 克B、大于或等于 2 克C、不等于 2 克D、小于或等于 2 克7.天气闷热时鱼爱靠近水面游,是因为氧气的溶解度受以下哪个因素的影响降落〔〕A、温度B、压强C、浮力D、密度8. 20℃时,氯化钠的溶解度为36g/100g 水。
中考化学专项练习之溶液---浓溶液、稀溶液与饱和溶液、不饱和溶液的关系(含解析、全国.docx

中考化学专项练习之溶液-一浓溶液.稀溶液与饱和溶液、不饱和溶液的关系(含解析.全国通用)【答案】1. A2. c3. D4. c5. D6. D7. D8. B9. D 10. A11. A 12. A 13. D 14. B 15. B16. A 17. B 1& A 19. A 20. A21. D 22. C 23. D 24. D 25. A26. A 27. A 2& D 29. C 30. D31. A 32. C 33. D 34. D 35. C36. C 37. C 3& A 39. C 40. D41. D 42. D43.错误44.错误45.甲;乙;乙;甲;饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液46.交叉;II【解析】1.解:A、溶液中各部分的性质和溶质质量分数都相同,故正确;B、溶液有的有一定的颜色,如硫酸铜溶液为蓝色,故错误;C、均一、稳定的液体不一定是溶液,如水,是纯净物,故错误;D、饱和溶液不一定是浓溶液,故错误;故选A.根据已有的知识进行分析,溶液具有均一性和稳定性,但不一定无色.本题考查了溶液的特征,完成此题,可以依据已有的知识进行.2.解:A、均一、稳定的液体不一定是溶液,如水是均一、稳定的液体但不是溶液,故选项说法错误;B、饱和溶液不一定是浓溶液,也可能是稀溶液,故选项说法错误.C、向不饱和溶液中增加溶质,不饱和溶液继续溶解溶质而变成饱和溶液,故选项说法正确;D、蒸谓水是纯净物,不是溶液,故选项说法错误. 故选C.溶液是均一、稳定的混合物;溶液的本质特征是均一性、稳定性,属于混合物;据此逐项进行分析判断.本题难度不大,掌握溶液的本质特征(均一性、稳定性、混合物)是解答此类题的关键.3.解:A、溶液不一定都是无色的,有些溶液是带有颜色的,如硫酸铜溶液是蓝色的;无色透明的液体不一定都是溶液,如水;故选项说法错误.B、由于分子间有间隔,溶质和溶剂体积之和小于溶液体积,溶质和溶剂质量之和一定等于溶液质量,故选项说法错误.C、浓溶液不一定是饱和溶液,饱和溶液不一定是浓溶液,也可能是稀溶液,如氢氧化钙的饱和溶液为稀溶液,故选项说法错误.D、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量,溶解度不受溶剂质量、溶液质量多少的影响,温度会影响固体溶解度大小,搅拌一定不会增大固体溶解度,故选项说法正确.故选:D.A、根据溶液是均一、稳定的混合物,进行分析判断.B、根据分子间有间隔,进行分析判断.C、浓稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系.D、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量.本题难度不大,了解固体物质溶解度的影响因素、浓稀溶液与溶液是否饱和的关系等是正确解答本题的关键.4.解:A、饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,溶液的饱和与溶液的浓稀没有关系,故A错误;B、均一、稳定的液体如果是纯净物时,那么该液体就不是溶液,故B错误;C、pH>7的溶液一定是碱性溶液,故C正确;D、不饱和溶液降温不一定能变成饱和溶液,如熟石灰的溶解度随温度和升高而降低,熟石灰的不饱和溶液降温会更加不饱和,故D错误;故选:C.根据溶液的特点、饱和溶液与溶液浓稀的关系的判断方法来回答本题.熟记溶液的特点:均一性、稳定性、属于混合物•溶液的饱和与溶液的浓稀没有关系.5.解:A、甲试管中固体全部溶解,10毫升水中溶解20g蔗糖,说明甲试管中的溶液为浓溶液,故A错;B、乙试管底部有固体,说明溶液已经饱和,10毫升水中溶解了不到0・2g蔗糖熟石灰,说明乙试管中的溶液为稀溶液,故B 错;C、蔗糖溶液中的蔗糖全部溶解,可能刚好饱和,也可能不饱和,故c错;D、在相同温度下,相同的溶剂中溶解的蔗糖质量大于熟石灰的质量,所以该实验现象说明该温度下蔗糖的溶解度比熟石灰大,故D 正确.故选D.溶液的浓稀和是否饱和没有关系,饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,溶液的浓和稀与含溶质的多少有关. 解答本题关键是知道溶液的浓稀和是否饱和没有关系,饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液.6.解:A、浓稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系,饱和溶液可能是浓溶液,也可能是稀溶液,两者之间是交叉关系,故选项说法错误.B、浓稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系,饱和溶液可能是浓溶液,也可能是稀溶液,两者之间是交叉关系,故选项说法错误.C、在一定温度下、一定量的溶剂里,不能继续溶解这种溶质的溶液是饱和溶液,还能继续溶解这种溶质的溶液是不饱和溶液,饱和溶液与不饱和溶液属于并列关系,故选项说法错误.D、浓稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系,不饱和溶液可能是浓溶液,也可能是稀溶液,不饱和溶液与稀溶液之间是交叉关系,故选项说法正确.故选:D.根据饱和溶液与溶液浓稀的关系、饱和溶液与不饱和溶液的关系,进行分析判断即可.本题难度不大,了解饱和溶液与溶液浓稀的关系、饱和溶液与不饱和溶液的关系是正确解答本题的关键.7.解:A、溶液不一定是均一、稳定的无色透明液体,例如硫酸铜溶液是蓝色,故A错;B、溶液浓稀和是否饱和没有关系,浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液,故B错;C、没说溶液是否达到饱和,所以不能确定硝酸钾的溶解度,故C错;D、溶液具有均一性,各部分性质相同,故D正确.故选D.A、溶液可以有颜色;B、溶液浓稀和是否饱和没有关系;C、根据溶解度的四要素考虑;D、根据溶液的均一性考虑. 解答本题关键是熟悉溶液的特点,知道溶解度的四要素.&解:A、熟石灰充分溶解后,烧杯底部仍有未溶解的白色固体,所以t°C时,向一支盛有0.15 g熟石灰的烧杯中加入50 g 水,充分振荡后静置,固体没有完全溶解,烧杯中溶液的质量小于50. 15g,故A正确;B、气体物质的溶解度与温度和压强有关,与水的用量无关,故B错误;C、饱和溶液是溶液中是否能能够再溶解某种固体,溶液的浓、稀指的是溶液的溶质质量分数,所以饱和溶液可能是浓溶液,不饱和溶液也可能是稀溶液,故C正确;D、汽油可以溶解油污,所以汽油作溶剂可以去除衣物上的油污,故D正确.故选:B.A、根据熟石灰充分溶解后,烧杯底部仍有未溶解的白色固体进行分析;B、根据气体物质的溶解度与温度和压强有关,与水的用量无关进行分析;C、根据饱和溶液是溶液中是否能能够再溶解某种固体,溶液的浓、稀指的是溶液的溶质质量分数进行分析;D、根据汽油可以溶解油污进行分析.本题主要考查了与溶液有关的一些基础知识,难度不大,需要在平时的学习中加强记忆即可完成.9.解:A、不饱和溶液与稀溶液无关,所以稀溶液不一定是不饱和溶液,故A错误;B、饱和溶液与浓溶液无关,所以在一定温度下的饱和溶液不一定是浓溶液,故B错误;C、不同的物质溶解度受温度的影响不同,有的随温度的升高溶解度增大,也有的降低,故C错误;D、在一定温度下,同种溶质的饱和溶液一定比不饱和溶液要浓,故D正确.故选:1)・A、根据不饱和溶液与稀溶液无关进行解答.B、根据饱和溶液与浓溶液无关进行解答;C、根据有的物质的溶解度随温度的降低而增大进行解答;D、根据饱和溶液的含义进行解答.此题考查了饱和溶液的概念,强调了叙述饱和溶液应该指明一定温度、某种溶质的饱和溶液.10.解:A、根据溶液的定义可知溶液由溶质和溶剂两部分组成的,故A正确;B、饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,故B错误;C、无色澄清液体不一定是溶液,如水是无色澄清液体,但由于水不是混合物,故不是溶液;故C错误;I)、溶液中可以含有两种或两种以上的溶质,故D错误.故选A.A、溶液是由溶质和溶剂组成的;B、根据溶液的浓稀和饱和、不饱和的关系分析;C、无色透明液体不一定是溶液;D、溶液中可以含有两种或两种以上的溶质.解答本题要掌握溶液的概念、特征方面的内容,只有这样才能对相关方面的问题做出正确的判断.11.解:A、溶剂的定义:能溶解其他物质的物质叫做溶剂,故A正确;B、溶液是指均一稳定的混合物,均一的、稳定的液体不一定是溶液,例如蒸憾水,故B错;C、溶液可以有颜色,例如硫酸铜溶液是蓝色,故c错;D、饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,故D错. 故选A.A、根据溶剂的定义考虑;B、溶液是指均一稳定的混合物;C、溶液可以有颜色;D、饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液.解答本题关键是熟悉溶剂、溶质的定义,知道溶液的特点,饱和溶液与溶液浓稀的关系.12.解:A、饱和溶液不一定是浓溶液,也可能是稀溶液,如氢氧化钙的饱和溶液为稀溶液,故选项说法错误.B、糖水、汽水均是均一、稳定的混合物,均属于溶液,故选项说法正确.C、洗洁精具有乳化作用,能将大的油滴分散成细小的油滴随水冲走,洗洁精去油污是因为洗洁精具有乳化功能,故选项说法正确.D、一种或几种物质分散到另一种物质中,形成均一的、稳定的混合物叫做溶液,溶液都是均一、稳定的混合物,故选项说法正确. 故选:A.A、浓稀溶液是溶液中所含溶质质量分数的大小,溶液是否饱和与溶液的浓稀没有必然联系.B、根据溶液是均一、稳定的混合物,进行分析判断.C、根据洗洁精具有乳化作用,进行分析判断.D、根据溶液的特征,进行分析判断.本题难度不大,掌握浓稀溶液与是否饱和的关系、溶液是均一、稳定的混合物、乳化作用等并能灵活运用是正确解答本题的关键.13.解:A、均一稳定的混合物属于溶液,均一稳定的液体不一定是溶液,例如蒸憾水不属于溶液,故A错;B、饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,故B错;C、汽油能溶解油污,所以汽油洗涤油污属于溶解现象,故C错;D、将氢氧化钠溶于水放出热量,所得溶液温度升高,故D正确. 故选D.A、根据溶液是指在一定条件下溶质分散到溶剂中形成的是均一稳定的混合物;B、根据溶液的浓稀和是否饱和的关系考虑;C、汽油能溶解油污;D、根据氢氧化钠溶于水会放出热量考虑.解答本题关键是熟悉溶液的特点,知道饱和溶液与溶液浓稀的关系,常见物质溶于水温度的变化.14.解:A、溶剂不一定是水,碘酒中溶剂是酒精,不含有水,故A错;B、溶液是均一、稳定的混合物,故B正确;C、浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液,溶液的浓稀与饱和不饱和没有关系;故错误;D、溶液不一定无色,故错误. 故选B.A、根据溶剂不一定是水考虑;B、根据溶液的特点考虑;C、根据溶液的浓稀与饱和不饱和的关系考虑;I)、根据溶液的特点考虑.解答本题关键是要熟悉溶液的特点,溶质和溶剂的种类,并能灵活进行判断.15.解:A、溶液不一定是无色的,如常见的硫酸铜溶液、氯化铁溶液等都是有色溶液,所以选项错误;B、溶液都是均一、稳定的混合物,正确;C、饱和溶液不一定是浓溶液,错误;I)、物质溶解时经常伴随着能量的变化.有些物质溶解使溶液的温度升高,如氢氧化钠固体、浓硫酸等;有些物质溶解溶液的温度几乎不变,如氯化钠等;有些物质溶解使溶液的温度降低,如硝酸镀等.错误.故选B.溶液的概念是一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物.可根据溶液的组成进行分析.根据物质溶于水时的吸热、放热现象进行分析判断.本题难度不大,掌握溶液的本质特征、组成、作用、物质溶于水时的吸热、放热现象等是解答本题的关键.16.解:A、常温下氢氧化钙的溶解度小于O.Olg,常温下氢氧化钙的饱和溶液即饱和的澄清石灰水是稀溶液不是浓溶液,A说法正确.B、碘酒是碘的酒精溶液,碘是溶质,酒精是溶剂,B说法不正确.C、硫酸铜溶液是蓝色透明的混合物,C说法不正确.I)、溶解度是指一定温度下100g溶剂水中达到饱和状态所溶解的这种溶质的质量,不是100g溶液中含有该物质的质量,D说法不正确.故答案选A.A、根据常温下氢氧化钙的溶解度小于O.Olg分析.B、根据碘酒是碘的酒精溶液,碘是溶质,酒精是溶剂分析.C、根据硫酸铜溶液是蓝色透明的混合物分析.D、根据溶解度是指一定温度下100g溶剂水中达到饱和状态所溶解的溶质的质量分析.本题从多角度考查溶液的相关知识,要注意溶液是均一稳定的但不一定都是无色透明的,有的溶液有颜色;溶解度的概念把握要准确,一定要注意四大要素:一定温度、100g溶剂、饱和状态、溶解的溶质的质量,四个要素一定要准确.17.解:溶液的浓、稀与饱和、不饱和之间没有必然的联系,故选B.(1)在温度一定、溶剂的量一定的情况下,不能再溶解某种溶质的溶液是饱和溶液;还能继续溶解某种溶质的溶液是不饱和溶液.(2)浓溶液、稀溶液是相对的,质量分数大的溶液是浓溶液;溶质质量分数小的是稀溶液.饱和溶液、不饱和溶液的判断看当温度、溶剂的量一定的情况下,溶质是否能再溶解;而浓溶液、稀溶液判断的依据是溶质的质量分数的大小,质量分数大的是浓溶液,质量分数小的是稀溶液.18.解:设用50 g溶质质量分数为10%的NaCl溶液配制溶质质量分数为5%的NaCl溶液需要加水的质量为x,则50 gX10%= (50 g+x) X5%,解得x=50 g.故A说法错误;B、酒精和水都是由分子构成的物质,它们的分子之间都存在一定的间隔.当把酒精和水混合以后,两种分子不发生化学反应,两种物质的分子相互穿插渗透,进入彼此的分子间隔,所以总体积会小于二者的体积之和.故B说法正确;C、饱和溶液、不饱和溶液不是根据浓、稠确定的,饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,故C说法正确.D、汽油是良好的有机溶剂,油脂易溶解于汽油,衣服沾上少量的油渍可以用汽油去除,是利用了溶解原理.故D说方法正确;故选:A.A、根据计算溶质质量分数的公式计算分析;B、两种液体混合,体积变小,是因为彼此的分子进入对方的分子间隔中;C、饱和溶液、不饱和溶液不是根据浓、稠确定的;D、根据洗涤油脂的原理判断,洗涤的原理主要有三种:利用溶解原理、利用乳化作用、利用水解反应. 本题考查溶质质量分数的计算,洗涤的原理,分子的特性以及饱和溶液的判断,知识的较多,需要细心考虑.19.解:A、饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液,故A错误;B、汽油能溶解油污,所以汽油可溶解衣服上的油渍,故B正确;C、水垢的主要成分是碳酸钙,醋溶液可以与碳酸钙反应生成可溶性的醋酸钙,所以可用醋溶液可洗涤水垢,故C正确;D、长期用硬水洗涤的衣物会变硬,故D正确. 故选:A.A、根据饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液进行解答;B、根据汽油能溶解油污进行解答;C、根据水垢的主要成分是碳酸钙,醋溶液可以与碳酸钙反应生成可溶性的醋酸钙进行解答;I)、根据硬水的危害进行解答.通过回答本题知道了饱和溶液的特点和溶液浓稀的关系,溶液均一稳定的特点.20.解:A、浓溶液不一定是饱和溶液,故A错误;B、稀溶液可能是饱和溶液,故B正确;C、饱和溶液与不饱和溶液间可相互转化,只要改变溶液中溶质和溶剂的比例关系就行,故C正确;I)、浑浊的液体不具有均一性和稳定性,所以不属于溶液,故I)正确. 故选:A.A、根据浓溶液不一定是饱和溶液进行解答;B、根据稀溶液可能是饱和溶液进行解答;C、根据饱和溶液与不饱和溶液间可相互转化进行解答;I)、根据浑浊的液体不具有均一性和稳定性进行解答. 本题主要考查了饱和与不饱和、浓稀溶液的判断标准,以及概念的严密性.21.解:根据题意可以知道在20°C时10mL水中加入0. lg熟石灰,结果没有完全溶解,说明此时的溶液为该温度下的饱和溶液,同时可以得出水中溶解的氢氧化钙的质量很少,是相对比较稀的溶液,同时氢氧化钙是无色,其溶于水后也是无色的,故选项D是错误的.故选D.根据题意可以知道10mL水中加入O.lg熟石灰,结果没有完全溶解,说明此温度下的溶液为饱和溶液,同时可以得岀水中溶解的氢氧化钙的很少,是相对较稀的溶液,可以据此答题.熟练掌握饱和溶液和不饱和溶液的定义,并能够区分判断溶液是否饱和,知道溶液的浓与稀与溶液是否饱和没有必然的联系..22.解:A、熟石灰在室温时的溶解度很小,所以饱和石灰水不是浓溶液,故A错误;B、无色的液体不一定是溶液,例如水就不是溶液,故B错误;C、由溶液的性质可知溶液具有均一性和稳定性,故C正确;D、溶液不一定是固体溶于水形成的,例如酒精溶于水,酒精就是液体,故D错误.故选:C.A、根据熟石灰在室温时的溶解度很小进行解答;B、根据无色的液体不一定是溶液进行解答;C、根据溶液的性质可知溶液具有均一性和稳定性进行解答;D、根据溶液不一定是固体溶于水形成的进行解答.解答本题要充分理解溶液的特征方面的知识,只有这样才能对相关方面的问题做出正确的判断.解:A、浓溶液不一定是饱和溶液进,故A错误;B、压强增大,气体的溶解性增大,故B错误;C、均一、稳定的液体不一定是溶液,例如水就是均一、稳定的液体但不是溶液,故C错误;D、有的固体物质溶解度随温度升高而减小,例如氢氧化钙,故D正确.故选:1)・A、根据浓溶液不一定是饱和溶液进行解答;B、根据压强增大,气体的溶解性增大进行解答;C、根据均一、稳定的液体不一定是溶液进行解答;D、根据有的固体物质溶解度随温度升高而减小进行解答.此题考查了饱和溶液和浓溶液的关系,强调了叙述饱和溶液应该指明一定温度、某种溶质的饱和溶液.24.解:A、由于气体和氢氧化钙等溶解度随温度的降低而增大固体物质来说,将其饱和溶液降温时,是没有溶质析出的;所以,该选项是错误的.B、根据溶液的概念可知,溶剂是唯一的,但是溶质可以是多种可溶性物质.因此,某物质的饱和溶液是可以再溶解其它可溶性物质的.所以,该选项是错误的.C、由于溶液的浓稀是指一定质量的溶液中含溶质的多少,多的则浓,少的则稀;而溶液的饱和和不饱和是指一定温度下,一定量溶剂里能否再溶解某种溶质,能溶的为其不饱和溶液,不能溶的为其饱和溶液.对溶解度随温度的升高而增大的固体物质来说,其高温时的不饱和溶液有可能比其低温时的饱和溶液的浓度要高;而对特殊溶质氢氧化钙等溶解度随温度的升高而减小的固体物质来说,其低温的不饱和溶液有可能比其高温时的饱和溶液的浓度要高.因此,饱和溶液不一定比不饱和溶液浓.所以,该选项是错误的.I)、由于溶液具有均一性、稳定性,所以一定温度下,饱和溶液中的溶质和溶剂的质量比是个定值;因此,该选项是正确的. 故选D.根据固体、气体溶解度的概念、影响因素及其随温度的变化规律,饱和溶液与不饱和溶液及其与溶液浓稀的关系,以及溶液的概念、组成及其特点等相关知识;进行细心地分析推断即可完成该题.本题主要考查了固体、气体溶解度的概念、影响因素及其随温度的变化规律,当然,也考查了饱和溶液与不饱和溶液及其与溶液浓稀的关系,还考查了溶液的概念、组成及其特点等相关知识.因此,这是一道考查的知识点多、知识面广综合题.解答时,一定要认真思考推断,方可柳暗花明,进而得出正确的答案了.25.解:A、在相同温度下,同种物质的饱和溶液比不饱和溶液的溶质的质量分数大,所以相同质量的同种物质的饱和溶液一定比不饱和溶液中所含的溶质多.故正确;B、当温度、压强、溶质质量不变时,不饱和溶液可能变为饱和溶液,例如恒温蒸发溶剂.故错误;C、当温度、压强、溶质质量不变时,饱和溶液可能变为不饱和溶液,例如当温度、压强、溶质质量不变时,向溶液中加水.故错误;D、一定温度下,某固体物质饱和溶液不一定是浓溶液,因为饱和溶液的浓稀还和溶质的溶解度有关.故错误. 故选A.饱和溶液和不饱和溶液在一定条件下可以相互转化,饱和溶液与溶液的浓稀没有必然的联系.解答本题时要充分理解饱和溶液与不饱和溶液在一定条件下的相互转化方面的关系,只有这样才能对问题做出正确的判断.26.解:A、15°C时,KNO?,的溶解度是25g, 15°C时饱和溶液的溶质质量分数为三切•山叱X 100%二20%,故选项说法正确.B、溶液具有均一性,24%的NaOH溶液取出一半其溶质质量分数仍为24%,故选项说法错误.C、饱和溶液中析出晶体,可能采用的是恒温蒸发溶剂的方法,所得溶液仍为该温度下的饱和溶液,溶质的质量分数不变,溶质的质量分数不一定减小,故选项说法错误.D、饱和溶液升高温度不一定变成不饱和溶液,如氢氧化钙的溶解度随着温度的升高而减小,升高温度后氢氧化钙的溶解度减小,溶液仍为饱和溶液,故选项说法错误.故选:A.A、根据饱和溶液中溶质质量分数二溥肉叟• I叫X100%,进行分析判断.B、根据溶液具有均一性,进行分析判断.C、根据饱和溶液中析出晶体,可能采用的是恒温蒸发溶剂的方法,进行分析判断.D、根据饱和溶液与不饱和溶液的相互转化进行分析判断.本题难度不大,掌握饱和溶液中溶质质量分数二丽E^xioo%、溶液具有均一性、结晶的方法等是正确解答本题的关键.27.解:A.因为该溶液饱和后恒温蒸发掉10g水,要析岀3g晶体,而刚开始恒温蒸发掉10g水,只析岀了2g晶体,所以原溶液一定不是饱和溶液,故正确;溶液的浓稀只是相对来说的,所以不能讨论原溶液的浓稀;故错误;C.原溶液为不饱和溶液,而最后的溶液是该温度下的饱和溶液,所以最后的溶液一定比原溶液浓,故错误;D.最后剩余溶液一定为该温度下这种物质的饱和溶液,故错误. 故选A.根据饱和溶液与不饱和溶液的概念分析.本题考查了饱和溶液和不饱和溶液的相关知识,饱和溶液:一定温度下,一定量的溶剂里不能继续溶解某物质的溶液;不饱和溶液:一定温度下,一定量溶剂里还能继续溶解某物质的溶液.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章-稀溶液-练习题————————————————————————————————作者:————————————————————————————————日期:第二章稀溶液依数性练习题一、是非题(共10题)1.溶液的沸点是指溶液沸腾温度不变时的温度。
( )2. 溶液与纯溶剂相比沸点升高、凝固点降低是由于溶剂摩尔分数减小引起的。
( )3. 等物质的量硝酸钾和碳酸钾分别加入等量的水中,该两溶液的蒸气压下降值相等。
( )4. 凡是浓度相等的溶液都是等渗溶液。
()5. 溶液的蒸气压下降和沸点升高仅适用于难挥发的非电解质溶质,而凝固点降低及渗透压则不受此限制。
()6. 电解质浓溶液也有依数性变化规律,但不符合拉乌尔定律的定量关系。
( )7. 一定量的电解质加入纯水中,此溶液的沸点一定高于100℃,但无法定律计算。
( )8. 任何两种溶液用半透膜隔开,都有渗透现象发生。
( )9. 分散质粒子大小在合适的范围内,高度分散在液体介质中就能形成稳定的溶胶。
()10.AlCl3、MgCl2、KCl三种电解质对负溶胶的聚沉值依次减小。
()二、选择题( 共11题)1. 以下论述正确的是()(A)饱和溶液一定是浓溶液(B)甲醇是易挥发性液体,溶于水后水溶液凝固点不能降低(C)强电解质溶液的活度系数皆小于1(D)质量摩尔浓度数值不受温度变化2.已知乙醇和苯的密度分别为0.800g·cm-3和0.900g·cm-3,若将86.3cm3乙醇和901 cm3苯互溶, 则此溶液中乙醇的质量摩尔浓度为-----------------------------------------------------()(A) 1.52 mol·dm-3(B) 1.67mol·dm-3(C)1.71 mol·kg-1(D) 1.85mol·kg-13. 2.5 g某聚合物溶于100 cm3水中, 20℃时的渗透压为100 Pa, 则该聚合物的相对分子质量是----------------------------------------------------------------------------------------------------( )(A) 6.1×102(B)4.1×104(C) 6.1×105(D) 2.2×1064. 1.0 mol·dm-3蔗糖的水溶液、1.0mol·dm-3乙醇的水溶液和1.0mol·dm-3乙醇的苯溶液,这三种溶液具有相同的性质是-----------------------------------------------------------------( )(A)渗透压(B) 凝固点(C) 沸点(D)以上三种性质都不相同5. 1.17 %的NaCl 溶液产生的渗透压接近于-----------------------------------------------( )(相对原子质量: Na23,Cl 35.5)(A)1.17 % 葡萄糖溶液(B) 1.17 % 蔗糖溶液(C)0.20 mol·dm-3葡萄糖溶液(D) 0.40 mol·dm-3蔗糖溶液6. 同温同浓度的下列水溶液中, 使溶液沸点升高最多的溶质是--------------------------()(A)CuSO4(B)K2SO4(C)Al2(SO4)3(D)KAl(SO4)27. 要使溶液的凝固点降低1.00℃,必须向200 g水中加入CaCl2的物质的量是(水的Kf=1.86 K·kg·mol-1)--------------------------------------------------------------------------------( )(A) 1.08 mol(B) 0.108 mol (C)0.0540 mol (D)0.0358mol8.某难挥发非电解质稀溶液的沸点为100.400℃,则其凝固点为---------------------()(水的Kb= 0.512K·kg·mol-1,K f= 1.86 K·kg·mol-1)(A) -0.110℃(B) -0.400℃(C) -0.746℃(D)-1.45℃9. 与纯溶剂相比,溶液的蒸气压-----------------------------------------------------------------()(A)一定降低(B)一定升高(C) 不变(D) 需根据实际情况做出判断,若溶质是挥发性很大的化合物就不一定降低10. 60℃时, 180g水中溶有180 g葡萄糖,已知60℃时水的蒸气压为19.9 kPa, C6H12O6的相对分子质量为180,则此水溶液的蒸气压应为------------------------------------------------( )(A) 1.81 kPa (B) 9.95kPa (C)15.9kPa(D) 18.1kPa11.若氨水的质量摩尔浓度为mmol·kg-1,则其中NH3的摩尔分数为---------------------( )mm(A) ─────(B) ──────────1000/18 [(1000-17m)/18]+mm(C) ───────(D)不确定(1000/18) +m三、填空题( 共8题)1. (2 分)体温为37℃时, 血液的渗透压为775 kPa, 此时与血液具有相同渗透压的葡萄糖(相对分子质量为180)静脉注射液的浓度应为__________________ g·dm-3。
2. (2分)当13.1 g未知难挥发非电解质溶于500 g苯中, 溶液凝固点下降了2.3K, 已知苯的Kf= 4.9K·kg·mol-1,则该溶质的相对分子质量为_______________。
3. (2分)在100g 水中溶有4.50g 某难挥发非电解质, 于-0.465℃时结冰, 则该溶质的摩尔质量为_________________ (已知水的Kf= 1.86 K·kg·mol-1)。
4.(2 分)樟脑的熔点是178.0℃, 取某有机物晶体0.0140g,与0.201 g樟脑熔融混合(已知樟脑的Kf=40.0K·kg·mol-1),测定其熔点为162.0℃,此物质的摩尔质量为__________________。
5.(2分)2.6g某非挥发性溶质溶解于62.5 g水中, 该溶液的沸点为100.78℃, 已知H2O的Kb= 0.51K·kg·mol-1, 该溶质的摩尔质量为___________________。
6. (2分)若37℃时人体眼睛的渗透压为770 kPa,则所用眼药水的总浓度(假定溶质全是非电解质)应为_______________________mol·dm-3。
7. (2分)对下列几种水溶液, 按其凝固点由低到高的排列顺序是________________。
(1)0.1 mol·kg-1C6H12O6(2) 1mol·kg-1C6H12O6(3) 0.1 mol·kg-1NaCl (4) 1 mol·kg-1NaCl(5) 0.1 mol·kg-1CaCl2(6) 0.1mol·kg-1 HAc8.(2 分)若萘(C10H8)的苯溶液中,萘的摩尔分数为0.100,则该溶液的质量摩尔浓度为_________________________。
四、计算题( 共7 题) 1.(10分)某浓度的蔗糖溶液在-0.250℃时结冰.此溶液在25.0℃时的蒸气压为多少? 渗透压为多少? (已知纯水在25℃时的蒸气压为3130Pa, 水的凝固点下降常数为 1.86 K·kg·mol-1)2.(10 分)某非电解质 6.89 g 溶于100g 水中, 将溶液分成两份, 一份测得凝固点为- 1.00℃, 另一份测得渗透压在0℃时为1.22×103kPa。
根据凝固点下降实验求该物质相对分子质量, 并判断渗透压实验是否基本准确?(水的Kf= 1.86K·kg·mol-1 )3. (10分)称取某碳氢化合物3.20g,溶于50.0g苯(K f=5.12K·kg·mol-1)中,测得溶液的凝固点比纯苯下降了0.256℃。
(1) 计算该碳氢化合物的摩尔质量; (2) 若上述溶液在25℃时的密度为0.920 g·cm-3 ,计算溶液的渗透压。
4.(10 分)临床上用的葡萄糖(C6H12O6)等渗液的凝固点降低值为0.543℃,溶液的密度为1.085 g·cm-3。
试求此葡萄糖溶液的质量分数和37℃时人体血液的渗透压为多少?(水的K f= 1.86 K·kg·mol-1 )5. (10 分)已知10.0 g葡萄糖(相对分子质量180)溶于400 g 乙醇(相对分子质量60.0),乙醇沸点升高了0.143℃,而某有机物2.00 g溶于100g乙醇时,其沸点升高了0.125℃,在20℃乙醇的蒸气压为5851 Pa。
试求(1)该有机物的摩尔质量是多少?(2) 在20℃该有机物乙醇溶液的蒸气压是多少? 6.(5 分)KNO3在373K 和293K时的溶解度分别为246g/(100 g水)和32 g/(100g水)。
现有9.9 mol·kg-1KNO3溶液100 g从373K冷却至293 K,将析出固体KNO3多少克? (相对原子质量: K 39,N14)7.(10 分)取2.67 g AlBr3溶于200g 水中, 测得溶液的凝固点为- 0.372℃;0.753 gBBr3溶于50.0 g 水中,测得此溶液的凝固点为- 0.112℃。
通过计算判断这两种盐在水中的电离情况。
( 水的K f= 1.86 K·kg·mol-1;相对原子质量:B11;Al27;Br 80。
)五、问答题( 共2题) 1.(5分) 乙二醇的沸点是197.9℃, 乙醇的沸点是78.3℃, 用作汽车散热器水箱中的防冻剂,哪一种物质较好? 请简述理由。
2. (5 分) 有一种称“墨海”的带盖砚台,其结构如图所示,当在砚台中加入墨汁,在外圈加入清水,并盖严,经足够长的时间,砚中发生了什么变化? 请写出现象并解释原因。
