:钠镁铝铁方程式过关
高一上四大基本金属元素钠镁铝铁单质及其化合物化学和对应离子方程式总结
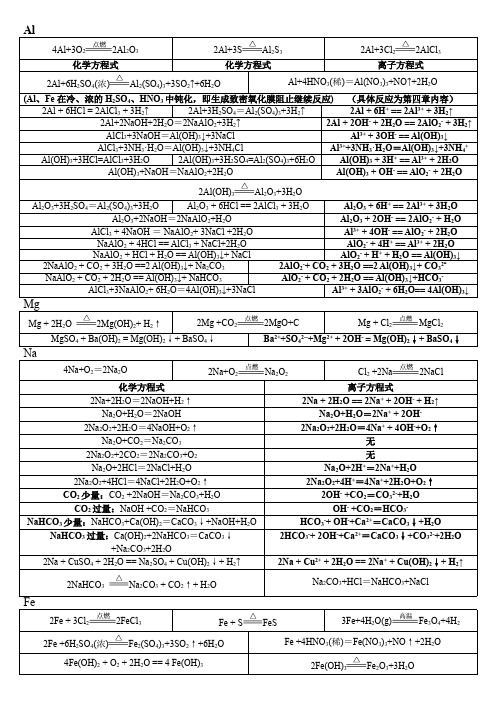
NO3- + 2+
Fe3+ + 3H2O
Fe(OH)3(胶体) + 3H+
Cl2 少量: 6FeBr2 + 3Cl2 == 2FeCl3 +4FeBr3 Cl2 过量:2FeBr2+ 3Cl2 == 2FeCl3 + 2Br2
2Fe2+ + Cl2 == 2Fe3+ + 2Cl2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl-
Al2O3+3H2SO4=Al2(SO4)3+3H2O Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 6H+ == 2Al3+ + 3H2O Al2O3+2NaOH=2NaAlO2+H2O Al2O3 + 2OH- == 2AlO2- + H2O AlCl3 + 4NaOH = NaAlO2+ 3NaCl +2H2O Al3+ + 4OH- == AlO2- + 2H2O NaAlO2 + 4HCl == AlCl3 + NaCl+2H2O AlO2- + 4H+ == Al3+ + 2H2O NaAlO2 + HCl + H2O == Al(OH)3↓+ NaCl AlO2- + H+ + H2O == Al(OH)3↓ 2NaAlO2 + CO2 + 3H2O ==2 Al(OH)3↓+ Na2CO3 2AlO2-+ CO2 + 3H2O ==2 Al(OH)3↓+ CO32NaAlO2 + CO2 + 2H2O == Al(OH)3↓+ NaHCO3 AlO2- + CO2 + 2H2O == Al(OH)3↓+HCO3AlCl3+3NaAlO2+ 6H2O=4Al(OH)3↓+3NaCl Al3+ + 3AlO2- + 6H2O== 4Al(OH)3↓
铁、钠、铝知识点和方程式总结

钠铝及重要化合物知识点小结(★为必背方程式)一、钠及其化合物(一)钠 Na1、单质钠的物理性质:钠质软、银白色、熔点低、密度比水的小但比煤油的大。
★2、单质钠的化学性质: ① 钠与O 2反应常温下:4Na + O 2=2Na 2O ★(新切开的钠放在空气中容易变暗)加热时:2Na + O 2==Na 2O 2 ★(钠先熔化后燃烧,发出黄色火焰,生成淡黄色固体Na 2O 2。
)钠在空气中的变化过程:Na ―→Na 2O ―→NaOH ―→Na 2CO 3·10H 2O (结晶)―→Na 2CO 3(风化),最终得到是一种白色粉末。
一小块钠置露在空气中的现象:银白色的钠很快变暗(生成Na 2O ),跟着变成白色固体(NaOH),然后在固体表面出现小液滴(NaOH 易潮解),最终变成白色粉未(最终产物是Na 2CO 3)。
② 钠与H 2O 反应2Na +2H 2O =2NaOH +H 2↑ ★离子方程式:2Na ++2H 2O =2Na ++2OH -+H 2↑(注意配平)实验现象:钠浮在水面上,熔成小球,在水面上游动,有哧哧的声音,最后消失,在反应后的溶液中滴加酚酞,溶液变红。
“浮——钠密度比水小;游——生成氢气;响——反应剧烈;熔——钠熔点低;红——生成的NaOH 遇酚酞变红”。
③ 钠与盐溶液反应如钠与CuSO 4溶液反应,应该先是钠与H 2O 反应生成NaOH 与H 2,再和CuSO 4溶液反应,有关化学方程式: 2Na +2H 2O =2NaOH +H 2↑ CuSO 4+2NaOH =Cu(OH)2↓+Na 2SO 4 总的方程式:2Na +2H 2O +CuSO 4=Cu(OH)2↓+Na 2SO 4+H 2↑实验现象:钠熔成小球,在液面上四处游动,有蓝色沉淀生成,有气泡放出K 、Ca 、Na 三种单质与盐溶液反应时,先与水反应生成相应的碱,碱再和盐溶液反应④ 钠与酸反应:2Na +2HCl =2NaCl +H 2↑(反应剧烈) 离子方程式:2Na +2H +=2Na ++H 2↑3、钠的存在:以化合态存在。
钠铝铁的有关反应方程式

钠的有关反应方程式、1、Na+O 2常温:4Na+O 2==2Na 2O2、Na+O 2加热:2Na+O 2==Na 2O 23、Na 与Cl 2反应:2Na +Cl 2===2NaCl4、Na 与S 反应:2Na+S=== Na 2S5、Na 与水反应:2Na+ 2H 2O== 2NaOH+H 2↑6、Na 与HCl 反应: △点燃2Na+2HCl==2NaCl+H 2↑7、Na 与CuSO 4溶液反应:2Na+ 2H 2O+ CuSO 4==Cu (OH )2↓+Na 2SO 4+ H 2↑8、Na 与FeCl 3溶液反应:6Na+ 6H 2O+2FeCl 3==2Fe (OH )3↓+6NaCl+ 3H 2↑ 9、Na 2O 与H 2O 反应:Na 2O+H 2O==2NaOH10、Na 2O 与CO 2反应:Na 2O+CO 2== Na 2CO 311、Na 2O 在空气中加热 :2Na 2O + O 2== 2Na 2O 2 △△12、Na2O2与H2O反应:2Na2O2+2H2O==4NaOH+O2↑13、Na2O2与CO2反应:2Na2O2+2CO2== 2Na2CO3+ O2↑14、Na2CO3溶液与少量HCl溶液反应:Na2CO3+HCl(少量)=NaCl+ NaHCO315、Na2CO3溶液与过量HCl溶液反应:Na2CO3+2HCl(过量)=2NaCl+ H2O+CO2↑16、Na2CO3溶液中通过量CO2气体:Na2CO3 +CO2+H2O=2NaHCO317、Na2CO3溶液与CaCl2溶液:Na2CO3+ CaCl2=CaCO3↓+2NaCl18、Na2CO3溶液与Ba(OH)2溶液反应:Na2CO3+ Ba(OH)2= BaCO3↓+2NaOH19、NaHCO3溶液与HCl溶液反应:HCO3-+H+=CO2↑+H2O20、NaHCO3溶液与NaOH溶液:NaHCO3+NaOH= Na2CO3+ H2O21、NaHCO3溶液与少量Ba(OH)2溶液反应:2NaHCO3+ Ba(OH)2少=Na2CO3+BaCO3↓+2H2O 22、NaHCO3与过量Ba(OH)2溶液:NaHCO3+ Ba(OH)2过=NaOH+BaCO3↓+H2O23、NaHCO 3受热分解:2NaHCO 3=== Na 2CO 3 +CO 2↑+H 2O24、Ca (HCO 3)2与少量NaOH 溶液反应:Ca (HCO 3)2+NaOH (少)=CaCO 3↓+NaHCO 3+H 2O25、Ca (HCO 3)2与过量NaOH 溶液反应:Ca (HCO 3)2+2NaOH (多)=CaCO 3↓+Na 2CO 3+2H 2O26、Mg 在CO 2气体中燃烧:2Mg+ CO 2==== C+2MgO27、Mg 与沸水反应:Mg+2H 2O=== Mg (OH )2+H 2↑铝及其化合物的反应方程式: △点燃 △1、Al 与O 2反应:4Al +3O 2=2Al 2O 32、Al 与Cl 2反应:2Al +3Cl 2==2AlCl 33、Al 与Fe 3O 4高温下反应:8Al+3 Fe 3O 4===9 Fe+4Al 2O 34、Al 与沸水反应: 2Al +6H 2O===2 Al (OH )3+3H 2↑5、Al 与盐酸反应:2Al +6HCl==2AlCl 3+3H 2↑6、Al 与NaOH 溶液反应2Al+2NaOH+2H 2O==2NaAlO 2+3H 2↑7、Al 与Ba (OH )2溶液:2Al+ Ba (OH )2 +2H 2O=Ba (AlO 2)2 +3H 2↑8、Al 2O 3与盐酸反应:Al 2O 3+6HCl=2AlCl 3+ 3H 2O9、Al 2O 3与NaOH 溶液反应:高温 点燃 △Al2O3+2NaOH=2NaAlO2+ H2O10、Al2O3与Ba(OH)2溶液反应:Al2O3+ Ba(OH)2=Ba(AlO2)2+ H2O 11、Al(OH)3与盐酸溶液反应:Al(OH)3+3H+=Al3++ 3H2O12、Al(OH)3与NaOH溶液反应:Al(OH)3+OH-=AlO2-+2H2O13、Al(OH)3受热分解:△2Al(OH)3=== Al2O3+ 3H2O14、AlCl3溶液与少量的NaOH溶液:Al3++3OH-(少量)=Al(OH)3↓15、AlCl3溶液与过量NaOH溶液反应:Al3++4OH-(过量)== AlO2-+2H2O16、Al2(SO4)3与过量氨水:Al3++3NH3·H2O =Al(OH)3↓+3NH4+17、Al2(SO4)3溶液与少量的Ba(OH)2溶液反应:Al2(SO4)3+3Ba(OH)2(少量)= 2Al(OH)3↓+3BaSO4↓18、Al2(SO4)3溶液与过量的Ba(OH)2溶液反应Al2(SO4)3+4Ba(OH)2(过量)= Ba(AlO2)2+3 BaSO4↓+4H2O 19、KAl(SO4)2溶液与少量的Ba(OH)2溶液反应2KAl(SO4)2+3Ba (OH)2(少量)=K2SO4+3BaSO4↓+2Al(OH)3↓20、KAl(SO4)2溶液与过量的Ba(OH)2溶液反应KAl(SO4)2+2Ba(OH)2(过量)=KAlO2+2BaSO4↓+2H2O铁及其化合物的有关化学方程式:1、Fe 在O 2中燃烧:3Fe+2O 2====Fe 3O 42、Fe 在Cl 2中燃烧:2Fe+3Cl 2====2FeCl 33、Fe 与S 反应:Fe+S===FeS4、Fe 与高温水蒸气反应:3Fe+4H 2O(g)====Fe 3O 4+4H 25、Fe 与盐酸溶液反应:Fe+2HCl=FeCl+H 2↑6、Fe 与CuSO 4溶液反应: 点燃点燃 高温Fe+CuSO 4=FeSO 4+Cu7、Fe 与AgNO 3溶液反应:Fe+2AgNO 3 =Fe (NO 3)2+2Ag8、Fe 与FeCl 3溶液反应: Fe+2FeCl 3=3FeCl 29、FeO 在空气中受热发生反应:6FeO+O 2===2Fe 3O 410、FeO 与CO 高温加热:FeO+CO====Fe+CO 2↑11、FeO 与H 2高温加热:FeO+H 2==== Fe+H 2O12、FeO 与Al 高温加热: △ △高温 高温3FeO+2Al====Al 2O 3+3Fe13、Fe 2O 3与CO 高温加热14、Fe 2O 3与H 2高温加热15、Fe 2O 3与Al 高温加热16、Fe 3O 4与CO 高温加热17、Fe 3O 4与H 2高温加热18、Fe 3O 4与Al 高温加热:3Fe 3O 4+8Al====4Al 2O 3+9Fe19、FeO 与盐酸溶液反应:FeO+2HCl==FeCl 2+H 2O20、Fe 2O 3与盐酸溶液反应: 高温 高温Fe2O3+6H+==2Fe3++3H2O21、Fe(OH)2在空气中被氧化:4Fe(OH)2+O2+2H2O===4Fe(OH)322、Fe(OH)3受热分解:△2Fe(OH)3=== Fe2O3+3H2O23、Fe(OH)3与盐酸反应:Fe(OH)3+3H+==Fe3++3H2O24、FeCl3溶液与NH3·H2O溶液反应:Fe3++3NH3·H2O== Fe(OH)3↓+3NH4+25、Fe2(SO4)3溶液与NaOH溶液反应:Fe2(SO4)3+6 NaOH==2Fe(OH)3↓+3Na2SO426、FeCl3溶液与氢硫酸(H2S水溶液)的反应:2FeCl3+H2S==2FeCl2+2HCl+S↓27、FeCl3溶液与KI溶液反应:2FeCl3+2KI==2FeCl2+2KCl+I228、Fe2(SO4)3溶液与Na2SO3溶液反应:Fe2(SO4)3+ Na2SO3+ H2O==2FeSO4+ Na2SO4+ H2SO4 29、FeCl3溶液与Fe粉反应:2FeCl3+Fe== 3FeCl230、Fe2(SO4)3溶液与过量的Cu粉反应:Fe2(SO4)3+Cu==2FeSO4+CuSO431、FeCl3溶液与过量的Zn粒反应:2FeCl3+3Zn===3ZnCl2+2Fe32、Fe2(SO4)3溶液与金属Na的反应:Fe2(SO4)3+6Na+ 6H2O == 2Fe(OH)3↓+ 3Na2SO4+3 H2↑33、FeCl3溶液与KSCN溶液的反应:FeCl3+3KSCN===Fe(SCN)3+3KCl34、FeCl2溶液与过量的NaOH溶液反应:FeCl2+2NaOH== Fe(OH)2↓+2NaCl35、FeSO4溶液与过量的氨水反应:FeSO4+2NH3·H2O== Fe(OH)2↓+(NH4)2 SO437、FeCl2溶液中滴加氯水(Cl2的水溶液):2FeCl2+ Cl2===2FeCl3。
2020金属及其化合物的常用化学方程式和对应离子方程式(钠镁铝铁)
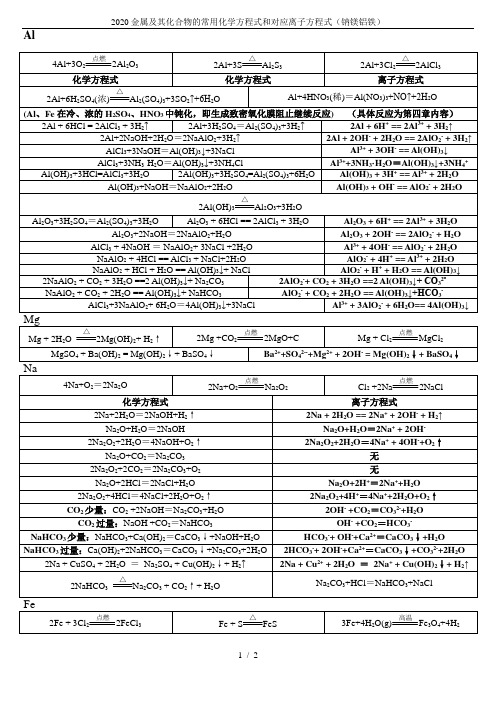
4Al+3O2 2Al2O3
2Al+3S Al2S3
2Al+3Cl2 2AlCl3
化学方程式
化学方程式
离子方程式
2Al+6H2SO4(浓) Al2(SO4)3+3SO2↑+6H2O
Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O
(Al、Fe在冷、浓的H2SO4、HNO3中钝化,即生成致密氧化膜阻止继续反应)(具体反应为第四章内容)
2HCO3-+2OH-+Ca2+=CaCO3↓+CO32-+2H2O
2Na + CuSO4+ 2H2O=Na2SO4+ Cu(OH)2↓+ H2↑
2Na + Cu2++ 2H2O=2Na++ Cu(OH)2↓+ H2↑
2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+HCl=NaHCO3+NaCl
2FeCl3+Cu=2FeCl2+CuCl2(用于雕刻铜线路板)
2Fe3++ Cu == 2Fe2++ Cu2+
2FeCl3+2KI=2FeCl2+2KCl+I2
2Fe3++2I-=2Fe2++I2
2FeCl3+H2S=2FeCl2+2HCl+S↓
2Fe3++ H2S == 2Fe2++ S↓+ 2H+
Fe
2Fe + 3Cl2 2FeCl3
钠镁铝所有方程式总结【最全】

钠及其化合物的方程式总结一、Na 单质1、钠在空气中燃烧(黄色的火焰):2Na + O 2 Na 2O 22、钠块在空气中变暗 :4Na + O 2=2Na 2O3、Na 2O 在空气中加热(变黄):2Na 2O + O 2 2Na 2O 24、金属锂在空气中燃烧 :4Li + O 2 2Li 2O5、钠与水反应(浮、熔、游、响、红) 2Na + 2H 2O = 2NaOH + H 2 ↑ 2Na + 2H 2O = 2Na + + 2OH - + H 2 ↑ 二、Na 2O 、Na 2O 2的相关反应:1、碱性氧化物Na 2O 与水的反应 :Na 2O +H 2O =2NaOH2、过氧化钠与水的反应(放热反应、Na 2O 2是强氧化剂,可用于漂白) 2Na 2O 2 + 2H 2O = 4NaOH + O 2 ↑ 2Na 2O 2 + 2H 2O = 4Na ++ 4OH -+O 2↑3、碱性氧化物Na 2O 与CO 2的反应Na 2O + CO 2 = Na 2CO 34、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源(供氧剂),原因是: 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 25、Na 2O + SO 2 = Na 2SO 3 Na 2O 2 + SO 2 = Na 2SO 46、Na 2O + 2HCl = 2NaCl + H 2O7、2Na 2O 2 +4HCl = 4NaCl + 2H 2O + O 2 ↑ 三、NaHCO 3与Na 2CO 31、小苏打受热分解: 2NaHCO 3Na 2CO 3 + H 2O +CO 2 ↑2、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热 NaHCO 3 + NaOHNa 2CO 3 + H 2O3、若是氢氧化钠和碳酸氢钠溶液中反应有离子方程式:NaHCO 3+NaOH = Na 2CO 3+H 2O HCO 3-+OH - = H 2O +CO 32- 4、向NaOH 溶液中通入少量CO 2 :2NaOH + CO 2 = Na 2CO 3 + H 2O△△△△5、继续通入过量CO2 :Na2CO3 + CO2 + H2O = 2 NaHCO3总反应方程式:NaOH + CO2 = NaHCO36、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液Na2CO3+2HCl =2NaCl+H2O+CO2↑CO32-+2H+=H2O+CO2↑②纯碱溶液中滴加盐酸,至过量Na2CO3+HCl =NaHCO3+NaCl CO32-+H+=HCO3-NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=H2O+CO2↑7、Na2CO3溶液、NaHCO3溶液与Ca(OH)2反应:Na2CO3+Ca(OH)2 =CaCO3↓+2NaOHNaHCO3+Ca(OH)2(多)=CaCO3↓+NaOH +H2O2NaHCO3+Ca(OH)2(少)=CaCO3↓+Na2CO3+2H2O8、Na2CO3溶液、NaHCO3溶液与CaCl2反应:Na2CO3+CaCl2 =CaCO3↓+2 Na ClNaHCO3溶液与CaCl2 不反应铝及其化合物的化学方程式和离子方程式一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O6、铝和氢氧化钠溶液反应:2Al+2NaOH+2H2O 2NaAlO2+3H2↑2Al+2OH-+2H2O 2AlO2-+3H2↑7、铝和浓硝酸共热:Al+6HNO3 Al(NO3)3+3NO2↑+3H2O Al+6H++3NO3-Al3++3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2O Al+4H++NO3-Al3++NO ↑+2H2O9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu 2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al2O3+3H2SO4 Al2(SO4)3+3H2O Al2O3+6H+2Al3++3H2O2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH2NaAlO2+H2O Al2O3+2OH-2AlO2-+H2O3、电解氧化铝的熔融液:2Al 2O 3 4Al +3O 2↑三、氢氧化铝1、氢氧化铝与稀硫酸反应: 2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反应: Al(OH)3 +NaOHNaAlO 2+2H 2O Al(OH)3 +OH -AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3 Al 2O 3+3H 2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合: Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4 ↓ SO 42-+Ba 2+BaSO 4 ↓2、硫酸铝的水溶液呈酸性: Al 2(SO 4)3+6H 2O2Al(OH)3 +3H 2SO 4 Al 3++3H 2OAl(OH)3 +3H +3、硫酸铝溶液中加入少量的氢氧化钠溶液: Al 2(SO 4)3 +6NaOH3Na 2SO 4+2Al(OH)3 ↓ Al 3++3OH-Al(OH)3 ↓4、向硫酸铝溶液中加足量的氢氧化钠溶液: Al 2(SO 4)3 +8NaOH2NaAlO 2+3Na 2SO 4+4H 2O Al 3++4OH -AlO 2-+2H 2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液: Al 2(SO 4)3 +3Ba(OH)22Al(OH)3 ↓+3BaSO 4 ↓2Al 3++3SO 42-+3Ba 2++6OH -2Al(OH)3 ↓+3BaSO 4 ↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液: Al 2(SO 4)3 +4Ba(OH)2Ba(AlO 2)2 +3BaSO 4 ↓+4H 2O2Al 3++3SO 42-+3Ba 2++8OH -2AlO 2-+3BaSO 4 ↓+4H 2O7、向明矾溶液中加入少量的氢氧化钡溶液: 3Ba(OH)2 +2KAl(SO 4)22Al(OH)3 ↓+3BaSO 4 ↓+K 2SO 43Ba 2++6OH -+2Al 3++3SO 42-3BaSO 4 ↓+2Al(OH)3 ↓冰晶石电解8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O Al(OH)3+NaOH AlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaCl AlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2O AlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓铁及其化合物的化学方程式和离子方程式一、Fe单质1、铁在氧气中燃烧:3Fe+2O2Fe3O42、铁在氯气中燃烧:2Fe+3Cl22FeCl33、常温条件下铁锈的形成:4Fe+3O2+2H2O2[Fe2O3 ·H2O]4、高温条件铁与氧气(Fe过量)反应:2Fe+O22FeO5、铁和硫共热:Fe+S FeS6、铁与水蒸气在高温条件下反应:3Fe+4H2O Fe3O4+4H27、铁与稀硫酸反应:Fe+H2SO4FeSO4+H2 ↑ Fe+2H+Fe2++H2 ↑8、少量的铁与浓硫酸共热:2Fe+6H2SO4(浓) Fe2(SO4)3+3SO2 ↑+6H2O9、少量的铁与浓硝酸共热:Fe+6HNO3(浓) Fe(NO3)3+3NO2 ↑+3H2O Fe+6H++3NO3-Fe3++3NO2 ↑+3H2O10、少量的铁与稀硝酸反应:Fe+4HNO3Fe(NO3)3+NO↑ +2H2O Fe+4H++NO3-Fe3++NO ↑+2H2O11、过量的铁与稀硝酸反应:3Fe+8HNO33Fe(NO3)2+2NO ↑+4H2O 3Fe+8H++2NO3-3Fe2++2NO +4H2O12、铁与硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu Fe+Cu2+Fe2++Cu13、铁与硝酸银溶液反应:Fe+2AgNO3Fe(NO3)2+2Ag Fe+2Ag+Fe2++2Ag14、铁与氯化铁溶液反应:Fe+2FeCl33FeCl2 Fe+2Fe3+3Fe2+二、氧化亚铁1、氧化亚铁在空气中加热:6FeO+O2 2Fe3O42、氧化亚铁与一氧化碳高温反应:FeO+CO Fe+CO23、氧化亚铁与铝粉在高温下反应:3FeO+2Al Al2O3+3Fe4、氧化亚铁与稀硫酸反应:FeO+H2SO4FeSO4+H2O FeO+2H+Fe2++H2O5、氧化亚铁与浓硫酸反应:2FeO+4H2SO4(浓)Fe2(SO4)3+SO2 ↑+4H2O6、氧化亚铁与浓硝酸反应:FeO+4HNO3(浓)Fe(NO3)3+NO2 ↑+2H2O FeO+4H++NO3-Fe3++NO2 ↑+2H2O7、氧化亚铁与稀硝酸反应:3FeO+10HNO33Fe(NO3)3+NO ↑+5H2O 3FeO+10H++NO3-3Fe3++NO ↑+5H2O三、四氧化三铁1、四氧化三铁与铝粉高温下反应:8Al+3Fe3O44Al2O3+9Fe2、四氧化三铁与一氧化碳高温下反应:Fe3O4+4CO3Fe+4CO23、四氧化三铁溶于稀盐酸:Fe3O4+8HCl FeCl2+2FeCl3+4H2O Fe3O4+8H+Fe2++2Fe3++4H2O4、四氧化三铁溶于浓硫酸:2Fe3O4+10H2SO4(浓)3Fe2(SO4)3+SO2 ↑+10H2O5、四氧化三铁溶于浓硝酸:Fe3O4+10HNO3(浓)3Fe(NO3)3+NO2 ↑+5H2OFe3O4+10H++NO3-3Fe3++NO↑ +5H2O6、四氧化三铁溶于稀硝酸:3Fe3O4+28HNO39Fe(NO3)3+NO ↑+14H2O3Fe3O4+28H++NO3-9Fe3++NO ↑+14H2O7、四氧化三铁溶于氢碘酸:Fe3O4+8HI3FeI2+I2+4H2O Fe3O4+8H+3Fe2++I2+4H2O四、氧化铁1、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe2、一氧化碳和氧化铁高温下反应:Fe2O3+3CO2Fe+3CO23、氧化铁溶液稀盐酸:Fe2O3+6HCl2FeCl3+3H2O Fe2O3+6H+2Fe3++3H2O4、氧化铁与氢碘酸反应:Fe2O3+6HI2FeI2+I2+3H2O Fe2O3+6H++2I-2Fe2++I2+3H2O五、氢氧化亚铁1、氢氧化亚铁与稀硫酸反应:Fe(OH)2+H2SO4FeSO4+2H2O Fe(OH)2+2H+Fe2++2H2O2、氢氧化亚铁与浓硫酸反应:2Fe(OH)2+4H2SO4(浓)Fe2(SO4)3+SO2 ↑+6H2O3、氢氧化亚铁与浓硝酸反应:Fe(OH)2+4HNO3(浓)Fe(NO3)3+NO2 ↑+3H2OFe(OH)2+4H++NO3-Fe3++NO2 ↑+3H2O4、氢氧化亚铁与稀硝酸反应:3Fe(OH)2+10HNO33Fe(NO3)3+NO↑ +8H2O3Fe(OH)2+10H++NO3-3Fe3++NO↑ +8H2O5、氢氧化亚铁在空气中被氧化:4Fe(OH)2+O2+2H2O4Fe(OH)36、氢氧化亚铁隔绝空气加热:Fe(OH)2FeO+H2O7、氢氧化亚铁在空气中加热:4Fe(OH)2+O22Fe2O3+4H2O六、氯化亚铁1、铝与氯化亚铁溶液反应:2Al+3FeCl22AlCl3+3Fe 2Al+3Fe2+2Al3++3Fe2、锌与氯化亚铁溶液反应:Zn+FeCl2ZnCl2+Fe Zn+Fe2+Zn2++Fe3、氯化亚铁暴露在空气中变质:12FeCl2+3O2+6H2O8FeCl3+4Fe(OH)3 ↓ 12Fe2++3O2+6H2O8Fe3++4Fe(OH)3 ↓4、酸化的氯化亚铁溶液中通入氧气:4FeCl2+O2+4HCl4FeCl3+2H2O 4Fe2++O2+4H+4Fe3++2H2O5、氯化亚铁溶液中通入氯气:2FeCl2+Cl22FeCl32Fe2++Cl22Fe3++2Cl-6、氯化亚铁溶液中加入溴水:6FeCl2+3Br24FeCl3+2FeBr32Fe2++Br22Fe3++2Br-7、氯化亚铁溶液呈酸性:FeCl2+2H2O Fe(OH)2+2HCl Fe2++2H2O Fe(OH)2+2H+8、氯化亚铁溶液中加入氢氧化钠溶液:FeCl2+2NaOH Fe(OH)2 ↓+2NaCl Fe2++2OH-Fe(OH)2 ↓9、氯化亚铁溶液中加入氨水:FeCl2+2NH3·H2O Fe(OH)2↓+2NH4Cl Fe2++2NH3·H2O Fe(OH)2↓+2NH4+10、氯化亚铁溶液中加入四羟基铝酸钠溶液:FeCl2+2Na[Al(OH)4] Fe(OH)2 ↓+2Al(OH)3 ↓+2NaClFe2++2[Al(OH)4]-+4H2O2Al(OH)3 ↓+Fe(OH)2 ↓11、氯化亚铁溶液中加入硝酸银溶液:FeCl2+2AgNO3Fe(NO3)2+2AgCl↓Ag++Cl-AgCl↓12、氯化亚铁溶液中加入硫化钠溶液:FeCl2+Na2S FeS↓+2NaCl Fe2++S2-FeS↓13、硫酸亚铁溶液与浓硫酸反应:2FeSO4+2H2SO4(浓)Fe2(SO4)3+SO2↑+2H2O14、硝酸亚铁溶液与浓硝酸反应:Fe(NO3)2+2HNO3(浓)Fe(NO3)3+NO2↑+H2OFe2++2H++NO3-Fe3++H2O+NO2↑15、硝酸亚铁溶液与稀硝酸反应:3Fe(NO3)2+10HNO33Fe(NO3)3+NO ↑+5H2O3Fe2++10H++NO3-3Fe3++NO↑ +5H2O16、酸化的氯化亚铁被过氧化氢所氧化:2FeCl2+H2O2+2HCl2FeCl3+2H2O 2Fe2++H2O2+2H+2Fe3++2H2O17、过氧化钠与氯化亚铁溶液反应:4Na2O2+4FeCl2+6H2O4Fe(OH)3 ↓+8NaCl+O2 ↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O218、次氯酸钠溶液与氯化亚铁溶液反应2FeCl2+5NaClO+5H2O2Fe(OH)3↓+5NaCl+4HClO2Fe2++5ClO-+5H2O2Fe(OH)3↓+Cl-+4HClO19、硫酸酸化的酸性高锰酸钾与氯化亚铁溶液反应5FeCl2+KMnO4+4H2SO4=3FeCl3+Fe2(SO4)3+MnSO4 +KCl+4H2O5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O七、氯化铁1、少量的锌和氯化铁溶液反应:Zn+2FeCl32FeCl2+ZnCl2Zn+2Fe3+2Fe2++Zn2+2、过量的锌与氯化铁溶液反应:3Zn+2FeCl33ZnCl2+2Fe 3Zn+2Fe 3+3Zn 2++2Fe3、铁与氯化铁溶液反应:Fe +2FeCl 33FeCl2Fe+2Fe3+3Fe2+4、铜和氯化铁溶液反应:Cu+2FeCl32FeCl2+CuCl2Cu+2Fe3+2Fe2++Cu2+5、向氯化铁溶液中通入二氧化硫:2FeCl3+SO2+2H2O2FeCl2+H2SO4+2HCl2Fe3++SO2+2H2O2Fe2++4H++SO42-6、氯化铁溶液呈酸性:FeCl3+3H2O Fe(OH)3+3HCl Fe3++3H2O Fe(OH)3+3H+7、氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaCl Fe3++3OH-Fe(OH)3↓8、向氯化铁溶液中加入氨水:FeCl3+3NH3·H2O Fe(OH)3↓+3NH4Cl Fe3++3NH3·H2O Fe(OH)3↓+3NH4+9、向氯化铁溶液中加入碳酸钠溶液:2FeCl3+3Na2CO3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑2Fe3++3CO32-+3H2O2Fe(OH)3↓+3CO2↑10、向氯化铁溶液中加入碳酸氢钠溶液:FeCl3+3NaHCO3Fe(OH)3↓+3NaCl+3CO2↑Fe3++3HCO3-2Fe(OH)3↓+3CO2↑11、向氯化铁溶液中加入四羟基合氯酸钠溶液:FeCl3+3Na[Al(OH)4] Fe(OH)3↓+3Al(OH)3↓+3NaClFe3++3[Al(OH)4]-Fe(OH)3↓+3Al(OH)3↓12、向氯化铁溶液中加入次氯酸钠溶液:FeCl3+3NaClO+3H2O Fe(OH)3↓+3NaCl+3HClOFe3++3ClO-+3H2O Fe(OH)3↓+3HClO13、向氯化铁溶液中通入硫化氢:2FeCl3+H2S2FeCl2+S↓ +2HCl 2Fe 3++H 2S 2Fe 2++S ↓+2H +14、向氯化铁溶液中加入氢碘酸:2FeCl3+2HI2FeCl2+I2+2HCl 2Fe3++2I-2Fe2++I215、向氯化铁溶液中加入少量的硫化钠溶液:2FeCl3+Na2S2FeCl2+S↓ +2NaCl 2Fe3++S2-2Fe2++S ↓16、向氯化铁溶液中加入过量的硫化钠溶液:2FeCl3+3Na2S2FeS↓+S↓ +6NaCl 2Fe3++3S2-2FeS+S ↓17、氯化铁溶液与碘化钾溶液混合:2FeCl3+2KI2FeCl2+I2+2KCl 2Fe3++2I-2Fe2++I218、氯化铁溶液与硝酸银溶液混合:FeCl3+3AgNO33AgCl↓ +Fe(NO3)3Ag++Cl-AgCl↓19、氯化铁溶液中加入硫氰化钾溶液:FeCl3+3KSCN Fe(SCN)3+3KCl Fe3++3SCN-Fe(SCN) 320、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3。
高中化学方程式钠,铝,铁全部

钠及其化合物的化学方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反应:4Na+O22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+CuOH2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2AlOH3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOH2、氧化钠与二氧化碳反应:Na2O+CO2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O CuOH2↓+Na2SO45、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2AlOH3↓+6NaCl6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2CuOH2↓+2Na2SO4+O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4AlOH3↓+12NaCl+3O2↑6、向氯化铝溶液中加过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O4FeOH3↓+4Na2SO4+O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO2NaHCO39、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2NaHSO311、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2O17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:AlOH3+NaOH NaAlO2+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO324、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+CuOH2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH FeOH3↓+3NaCl26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH AlOH3↓+3NaCl27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:CaHCO32+NaOH CaCO3↓+NaHCO3+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:CaHCO32+2NaOH CaCO3↓+Na2CO3+2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:MgHCO32+2NaOH MgOH2↓+2NaHCO335、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:MgHCO32+4NaOH MgOH2↓+Na2CO3+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO32、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+CaOH2CaCO3↓+2NaOH2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaCl3、碳酸钠溶液呈碱性:Na2CO3+H2O NaHCO3+NaOH4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaCl5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO38、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO39、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2AlOH3↓+6NaCl+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2FeOH3↓+6NaCl+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+NaOH2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3AlOH3↓+3NaCl+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3FeOH3↓+3NaCl+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+CaOH2 =CaCO3↓+NaOH+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液: 2NaHCO3+CaOH2 =CaCO3↓+Na2CO3+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O铝及其化合物的化学方程式 一、铝1、铝在氧气中燃烧:4Al +3O 22Al 2O 32、铝在氯气中燃烧:2Al +3Cl 22AlCl 33、铝和硫共热:2Al +3S Al 2S 34、铝与稀硫酸反应:2Al +3H 2SO 4Al 2SO 43 +3H 2 ↑5、铝和氢氧化钠溶液反应:2Al +2NaOH +2H 2O2NaAlO 2+3H 2 ↑6、铝和浓硫酸共热:2Al +6H 2SO 4Al 2SO 43 +3SO 2 ↑+6H 2O7、铝和浓硝酸共热:Al +6HNO 3AlNO 33 +3NO 2 ↑+3H 2O8、铝和稀硝酸反应:Al +4HNO 3AlNO 33 +NO ↑+2H 2O8、铝和硝酸银溶液反应:Al +3AgNO 3AlNO 33 +3Ag 9、铝与硫酸铜溶液反应:2Al +3CuSO 4Al 2SO 43 +3Cu10、铝和氧化铁高温下反应:2Al +Fe 2O 3Al 2O 3+2Fe 11、铝和四氧化三铁高温共热:8Al +3Fe 3O 44Al 2O 3+9Fe 12、铝和氧化铜高温共热:2Al +3CuO Al 2O 3+3Cu 13、铝和二氧化锰高温共热:4Al +3MnO 22Al 2O 3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al 2O 3+3H 2SO 4Al 2SO 43 +3H 2O2、氧化铝与氢氧化钠溶液反应:Al 2O 3+2NaOH 2NaAlO 2+H 2O3、电解氧化铝的熔融液:2Al 2O 34Al +3O 2 ↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2AlOH 3 +3H 2SO 4Al 2SO 43 +6H 2O2、氢氧化铝与氢氧化钠溶液反应:AlOH 3 +NaOHNaAlO 2+2H 2O3、加热氢氧化铝:2AlOH 3 Al 2O 3+3H 2O四、硫酸铝冰晶石电解1、硫酸铝溶液与氯化钡溶液混合:Al2SO43+3BaCl22AlCl3+3BaSO4↓2、硫酸铝的水溶液呈酸性:Al2SO43+6H2O2AlOH3+3H2SO43、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2SO43+6NaOH3Na2SO4+2AlOH3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2SO43+8NaOH2NaAlO2+3Na2SO4+4H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2SO43+3BaOH22AlOH3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2SO43+4BaOH2BaAlO22+3BaSO4↓+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3BaOH2+2KAlSO422AlOH3↓+3BaSO4↓+K2SO48、向明矾溶液中加入足量的氢氧化钡溶液:KAlSO42+2BaOH2KAlO2+2BaSO4↓+2H2O9、向硫酸铝溶液中加入氨水:Al2SO43+6NH3·H2O2AlOH3↓+3NH42SO410、向硫酸铝溶液中加入碳酸钠溶液:Al2SO43+3Na2CO3+3H2O2AlOH3↓+3Na2SO4+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2SO43+6NaHCO32AlOH3↓+3Na2SO4+6CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2SO43+3Na2S+6H2O2AlOH3↓+3Na2SO4+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2SO43+6NaHS+6H2O2AlOH3↓+3Na2SO4+6H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2SO43+3Na2SiO3+6H2O2AlOH3↓+3Na2SO4+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2SO43+6NaAlO2+12H2O3Na2SO4+8AlOH3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AIOH3+NaOH2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O AlOH3↓+NaCl↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2AlOH3↓+Na2CO35、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O AlOH3+NaHCO36、向偏铝酸钠溶液中加入硫酸铝溶液:Al2SO43+6NaAlO2+12H2O3Na2SO4+8AlOH3↓7、向偏铝酸钠溶液中加氯化铵:NaAlO2+NH4Cl+H2O AlOH3↓+NaCl+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O3AlOH3↓+FeOH3↓+3NaCl铁及其化合物的化学方程式一、铁1、铁在氧气中燃烧:3Fe+2O2Fe3O42、铁在氯气中燃烧:2Fe+3Cl22FeCl33、常温条件下铁锈的形成:4Fe+3O2+2H2O2Fe2O3·H2O4、高温条件铁与氧气反应:2Fe+O22FeO5、铁和硫共热:Fe+S FeS6、铁与水蒸气在高温条件下反应:3Fe+4H2O Fe3O4+4H27、铁与稀硫酸反应:Fe+H2SO4FeSO4+H2↑8、少量的铁与浓硫酸共热:2Fe+6H2SO4Fe2SO43+3SO2↑+6H2O9、过量的铁与浓硫酸共热:Fe+2H2SO4FeSO4+SO2↑+2H2O10、少量的铁与浓硝酸共热:Fe+6HNO3FeNO33+3NO2↑+3H2O11、过量的铁与浓硝酸共热:Fe+4HNO3FeNO32+2NO2↑+2H2O12、少量的铁与稀硝酸反应:Fe+4HNO3FeNO33+NO↑+2H2O13、过量的铁与稀硝酸反应: 3Fe+8HNO33FeNO32+2NO ↑+4H2O14、铁与硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu15、铁与硝酸银溶液反应:Fe+2AgNO3FeNO32+2Ag16、铁与氯化铁溶液反应:Fe+2FeCl33FeCl2二、氧化亚铁1、氧化亚铁在空气中加热:6FeO+O22Fe3O42、氧化亚铁与一氧化碳高温反应:FeO+CO Fe+CO23、氧化亚铁与铝粉在高温下反应:3FeO+2Al Al2O3+3Fe4、氧化亚铁与稀硫酸反应:FeO+H2SO4FeSO4+H2O5、氧化亚铁与浓硫酸反应:2FeO+4H2SO4Fe2SO43+SO2↑+4H2O6、氧化亚铁与浓硝酸反应:FeO+4HNO3FeNO33+NO2↑+2H2O7、氧化亚铁与稀硝酸反应:3FeO+10HNO33FeNO33+NO ↑+5H2O三、四氧化三铁1、四氧化三铁与铝粉高温下反应:8Al+3Fe3O44Al2O3+9Fe2、四氧化三铁与一氧化碳高温下反应:Fe3O4+4CO3Fe+4CO23、四氧化三铁溶于稀盐酸:Fe3O4+8HCl FeCl2+2FeCl3+4H2O4、四氧化三铁溶于浓硫酸:2Fe3O4+10H2SO43Fe2SO43+SO2↑+10H2O5、四氧化三铁溶于浓硝酸:Fe3O4+10HNO33FeNO33+NO2↑+5H2O6、四氧化三铁溶于稀硝酸:3Fe3O4+28HNO39FeNO33+NO ↑+14H2O6、四氧化三铁溶于氢碘酸:Fe3O4+8HI3FeI2+I2+4H2O四、氧化铁1、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe2、一氧化碳和氧化铁高温下反应:Fe2O3+3CO2Fe+3CO23、氧化铁溶液稀盐酸:Fe2O3+6HCl2FeCl3+3H2O4、氧化铁与氢碘酸反应:Fe2O3+6HI2FeI2+I2+3H2O五、氢氧化亚铁1、氢氧化亚铁与稀硫酸反应:FeOH2+H2SO4FeSO4+2H2O2、氢氧化亚铁与浓硫酸反应:2FeOH2+4H2SO4Fe2SO43+SO2↑+6H2O3、氢氧化亚铁与浓硝酸反应:FeOH2+4HNO3FeNO33+NO2↑+3H2O4、氢氧化亚铁与稀硝酸反应:3FeOH2+10HNO33FeNO33+NO↑+8H2O5、氢氧化亚铁在空气中被氧化:4FeOH2+O2+2H2O4FeOH36、氢氧化亚铁隔绝空气加热:FeOH2FeO+H2O7、氢氧化亚铁在空气中加热:4FeOH2+O22Fe2O3+4H2O六、氢氧化铁1、氢氧化铁与稀硫酸反应:2FeOH3+3H2SO4Fe2SO43+6H2O2、氢氧化铁溶于氢碘酸:2FeOH3+6HI2FeI2+I2+6H2O3、加热氢氧化铁:2FeOH3Fe2O3+3H2O七、氯化亚铁1、铝与氯化亚铁溶液反应:2Al+3FeCl22AlCl3+3Fe2、锌与氯化亚铁反应:Zn+FeCl2ZnCl2+Fe3、氯化亚铁暴露在空气中变质:12FeCl2+3O2+6H2O8FeCl3+4FeOH3↓4、酸化的氯化亚铁溶液中通入氧气:4FeCl2+O2+4HCl4FeCl3+2H2O5、氯化亚铁溶液中通入氯气:2FeCl2+Cl22FeCl36、氯化亚铁溶液中加入溴水:6FeCl2+3Br24FeCl3+2FeBr37、氯化亚铁溶液呈酸性:FeCl2+2H2O FeOH2+2HCl8、氯化亚铁溶液中加入氢氧化钠溶液:FeCl2+2NaOH FeOH2↓+2NaCl9、氯化亚铁溶液中加入氨水:FeCl2+2NH3·H2O FeOH2↓+2NH4Cl10、氯化亚铁溶液中加入偏铝酸钠溶液:FeCl2+2NaAlO2+4H2O FeOH2↓+2AlOH3↓+2NaCl11、氯化亚铁溶液中加入硝酸银溶液:FeCl2+2AgNO3FeNO32+2AgCl↓12、氯化亚铁溶液中加入硫化钠溶液:FeCl2+Na2S FeS↓+2NaCl13、硫酸亚铁溶液与浓硫酸反应:2FeSO4+2H2SO4Fe2SO43+SO2↑+2H2O14、硝酸亚铁溶液与浓硝酸反应:FeNO32+2HNO3FeNO33+NO2↑+H2O15、硝酸亚铁溶液与稀硝酸反应:3FeNO32+10HNO33FeNO33+NO ↑+5H2O16、酸化的氯化亚铁被过氧化氢所氧化:2FeCl2+H2O2+2HCl2FeCl3+2H2O17、过氧化钠与氯化亚铁溶液反应:4Na2O2+4FeCl2+6H2O4FeOH3↓+8NaCl+O2↑18、次氯酸钠溶液与氯化亚铁溶液反应2FeCl2+5NaClO+5H2O2FeOH3↓+5NaCl+4HClO八、氯化铁1、少量的锌和氯化铁溶液反应:Zn+2FeCl32FeCl2+ZnCl22、过量的锌与氯化铁溶液反应:3Zn+2FeCl33ZnCl2+2Fe3、铁与氯化铁溶液反应:Fe+2FeCl33FeCl24、铜和氯化铁溶液反应:Cu+2FeCl32FeCl2+CuCl25、向氯化铁溶液中通入二氧化硫:2FeCl3+SO2+2H2O2FeCl2+H2SO4+2HCl6、氯化铁溶液呈酸性:FeCl3+3H2O FeOH3+3HCl7、氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH FeOH3↓+3NaCl8、向氯化铁溶液中加入氨水:FeCl3+3NH3·H2O FeOH3↓+3NH4Cl9、向氯化铁溶液中加入碳酸钠溶液:2FeCl3+3Na2CO3+3H2O2FeOH3↓+6NaCl+3CO2↑10、向氯化铁溶液中加入碳酸氢钠溶液:FeCl3+3NaHCO3FeOH3↓+3NaCl+3CO2↑11、向氯化铁溶液中加入偏铝酸钠溶液:FeCl3+3NaAlO2+6H2O FeOH3↓+3AlOH3↓+3NaCl12、向氯化铁溶液中加入次氯酸钠溶液:FeCl3+3NaClO+3H2O FeOH3↓+3NaCl+3HClO13、向氯化铁溶液中通入硫化氢:2FeCl3+H2S2FeCl2+S↓+2HCl14、向氯化铁溶液中加入氢碘酸:2FeCl3+2HI2FeCl2+I2+2HCl15、向氯化铁溶液中加入少量的硫化钠溶液:2FeCl3+Na2S2FeCl2+S↓+2NaCl16、向氯化铁溶液中加入过量的硫化钠溶液:2FeCl3+3Na2S2FeS↓+S↓+6NaCl17、氯化铁溶液与碘化钾溶液混合:2FeCl3+2KI2FeCl2+I2+2KCl18、氯化铁溶液与硝酸银溶液混合:FeCl3+3AgNO33AgCl↓+FeNO3319、氯化铁溶液中加入硫氰化钾溶液:FeCl3+3KSCN FeSCN3+3KCl20、氧化镁投入到氯化铁溶液中: 3MgO+2FeCl3+3H2O3MgCl2+2FeOH321、氢氧化镁投入到氯化铁溶液中:3MgOH2+2FeCl33MgCl2+2FeOH3。
化学方程式(高三复习 金属)

化学方程式(高三复习金属)NaOH+Al2O3=NaOH(过量)+CO2=NaOH+CO2(过量)=Na2CO3、NaHCO3Na2CO3+SiO2高温Na2CO3+ HCl=NaHCO3+HCl=NaHCO3+ Ca(OH)2(不足)=NaHCO3+ Ca(OH)2(足量)=NaHCO3+AlCl3=NaHCO3+FeCl3=NaHCO3△C6H5ONaC6H5ONa+CO2+H2O→NaHNaH+H2O=二、常见金属1.镁(Mg)Mg+OMg+ H2O△Mg+Cl点燃Mg+CO点燃MgOMgO+ HCl=MgO+H2O=Mg(OH)2Mg(OH)2+ HCl=MgCO3MgCO3+ HCl=MgCO3+H2O△MgCO3△Mg(HCO3)2Mg(HCO3)2+ HCl=Mg(HCO3)2△2.铝(Al)Al+ OAl+ Cl2△Al+ MnO2高温Al+Cr2O3高温Al+Fe2O3高温Al+ HCl=Al+ NaOH+ H2O=Al+ H2SO4(浓)Al2O3、Al(OH)3Al2O3+ H2SO4=Al2O3+ NaOH=Al(OH)3△Al(OH)3+ HCl=Al(OH)3+NaOH=铝盐AlCl3+ NaOH(不足)=AlCl3+ NaOH(足量)=AlCl3+ NH3·H2O=AlCl3+ NaHCO3=AlCl3+ NaAlO2+ H2O=偏铝酸盐NaAlO2+ HCl(不足)+ H2O=NaAlO2+ HCl(足量)=NaAlO2+ CO2(不足)+ H2O=NaAlO2+ CO2(足量)+ H2O=3.铁(Fe) Fe+ Cl2 Fe+ OFe+S△Fe+I2△Fe+ H2O(g)Fe+ H2SO4(浓)△Fe+ HNO3(浓)△Fe(不足)+ HNO3(稀)=Fe(足量)+ HNO3(稀)=FeO 、 Fe2O3、Fe3O4FeO+ HNO3(稀)=Fe2O3+ HNO3(稀)=Fe2O3+ Al高温Fe2O3+ CO△Fe2O3+ HCl=Fe3O4+ HCl(浓)△Fe(OH)2、Fe(OH)3Fe(OH)2+O2+ H2O=Fe(OH)3△FeCl2、FeCl3FeCl2+ NaOH=FeCl2+Cl2=FeCl3+Fe=FeCl3+Cu=FeCl3+H2SO3+H2O=FeCl3+H2S=FeCl3+ KI=FeCl3+ H2O△FeCl3+ KSCN=FeCl3+ NaOH=FeCl3+ NaHCO3=FeS、FeS2FeS+ HCl=FeS+ HNO3(稀)=FeS2+ O2高温三、其他金属1.锰KMnO4KMnO4△KMnO4+ HCl(浓)=MnO2MnO2+ HCl(浓)△2.铜(Cu)Cu+S△Cu+Cl点燃CuO+ NH3△CuO+ HCl=Cu(OH)2△CuCl2+H2S=CuSO4+H2S=Cu(OH)2+ HCl=Cu(OH)2+H2SO4=4.铅Pb、PbO2FeS+ HCl=PbO2+ HCl(浓)△铅盐Pb(NO3)2+H2S=。
高一化学必修一:钠镁铝铁方程式过关

钠镁铝铁方程式过关写出下列反应的化学方程式,是离子反应的只写出离子方程式【所有同学必须学会的化学反应】1,钠与氧气________________________________________________________________ 2,钠与硫磺________________________________________________________________ 3,钠与氧气常温时在空气中___________________________________________________ 4,钠与氧气在空气中燃烧_____________________________________________________ 5,钠与水__________________________________________________________________ 6,钠与盐酸________________________________________________________________ 7,钠与醋酸________________________________________________________________ 8,氧化钠与水______________________________________________________________ 9,氧化钠与盐酸____________________________________________________________ 10,氧化钠与CO2____________________________________________________________ 11,过氧化钠与CO2__________________________________________________________ 12,过氧化钠与水____________________________________________________________ 13,过氧化钠与盐酸__________________________________________________________ 14,纯碱溶液与足量盐酸______________________________________________________ 15,纯碱溶液与氯化钙________________________________________________________ 16,纯碱溶液与石灰水________________________________________________________ 17,纯碱溶液与足量醋酸溶液__________________________________________________ 18,纯碱溶液中通入CO2______________________________________________________ 19,小苏打加热______________________________________________________________ 20,小苏打溶液与盐酸________________________________________________________ 21,小苏打溶液与烧碱________________________________________________________22,小苏打溶液与醋酸_______________________________________________________ 23,烧碱溶液与盐酸__________________________________________________________ 24,烧碱溶液与醋酸_________________________________________________________ 25,烧碱溶液与氯化铵溶液共热________________________________________________ 26,烧碱溶液与胆矾溶液______________________________________________________ 27,氧化钠投入胆矾溶液中____________________________________________________ 28,镁与氧气________________________________________________________________ 29,镁与水共热______________________________________________________________ 30,镁与稀盐酸______________________________________________________________ 31,铝与盐酸________________________________________________________________ 32,铝与烧碱________________________________________________________________ 33,三氧化二铝与硫酸溶液____________________________________________________ 34,三氧化二铝与烧碱溶液____________________________________________________ 35,氢氧化铝与烧碱溶液______________________________________________________ 36,氯化铝溶液与偏铝酸钠溶液混合____________________________________________ 37,将过量的氨水逐滴滴加入氯化铝溶液中______________________________________ 38,将过量的烧碱逐滴滴加入氯化铝溶液中______________________________________ 39,将过量的氯化氢气体逐滴通入偏铝酸钠溶液中________________________________ 40,铁与氯气________________________________________________________________ 41,铁与碘共热______________________________________________________________ 42,红热的铁与水蒸气反应____________________________________________________ 43,铁与硫磺共热____________________________________________________________44,铁与稀硫酸______________________________________________________________ 45,铁投入胆矾溶液中________________________________________________________ 46,铁投入三氯化铁溶液中____________________________________________________ 47,氯化亚铁溶液与烧碱溶液__________________________________________________ 48,氯化亚铁溶液与纯碱溶液__________________________________________________ 49,三氯化铁溶液与烧碱溶液__________________________________________________ 50,往三氯化铁溶液中投入铜片________________________________________________ 51,氢氧化亚铁在空气中放置__________________________________________________ 52,四氧化三铁与盐酸________________________________________________________ 53,氢氧化亚铁与稀硝酸______________________________________________________ 54,三氯化铁溶液中滴入硫氰化钾溶液__________________________________________ 55,氯气通入绿矾溶液中______________________________________________________【下列反应供有能力、有兴趣的同学选择】56,钾与氯化铁溶液__________________________________________________________ 57,将盐酸逐滴滴入纯碱溶液中________________________________________________ 58,将纯碱溶液逐滴滴入盐酸中________________________________________________ 59,小苏打溶液与足量石灰水_________________________________________________ 60,小苏打溶液与少量石灰水__________________________________________________ 61,足量烧碱溶液与碳酸氢钙溶液______________________________________________ 62,少量烧碱溶液与碳酸氢钙溶液_____________________________________________ 63,足量烧碱溶液与CO2______________________________________________________ 64,少量烧碱溶液与CO2______________________________________________________ 65,过量CO2慢慢通入澄清石灰水中____________________________________________ 66,少量CO2通入澄清石灰水中________________________________________________ 67,过氧化钠投入硫酸铁溶液中________________________________________________ 68,将过量的CO2气体逐渐通入偏铝酸钠溶液中__________________________________ 69,氧化亚铁与稀硝酸________________________________________________________ 70,氧化铁与氢碘酸__________________________________________________________ 71,氢氧化铁与氢碘酸________________________________________________________ 72,将硫化氢气体通入饱和的三氯化铁溶液中____________________________________ 73,绿矾溶液中加入适量的稀硫酸和双氧水______________________________________ 74,碘化钾淀粉溶液中加入三氯化铁溶液________________________________________ 75,SO2通入氯化钡与三氯化铁的混合溶液中____________________________________。
金属+非金属化学方程式整理(全)

金属化学方程式整理一、钠、镁、铝及其化合物1、 钠暴露在空气中4Na+O 2==2Na 2O ; 钠在空气中点燃:2Na+O 2 == Na 2O 22、 2Na+2H 2O==2NaOH +H 2↑3、 2Na+2HCl==2NaCl +H 2↑4、 钠投入硫酸铜溶液中:2Na+2H 2O==2NaOH +H 2 ↑ CuSO 4+2NaOH==Cu(OH)2↓+Na 2SO 4 总:2Na+2H 2O+CuSO 4== Cu(OH)2↓+Na 2SO 4 +H 2 ↑5、 Mg+2HCl==MgCl 2+H 2↑ ( Mg+2H +==Mg 2++H 2 ↑ ) 2Al+6HCl ==2AlCl 3+3H 2↑ ( 2Al+6H +==2Al 3++3H 2 ↑ )6、 2Al+2NaOH+2H 2O ==2NaAlO 2+3 H 2↑( 2Al+2OH -+2H 2O ==2AlO 2-+3 H 2↑ )7、 2Na 2O 2+2H 2O==4NaOH+O 2↑ ( 2Na 2O 2+2H 2O==4Na ++4OH -+O 2↑)8、 2Na 2O 2+2CO 2==2Na 2CO 3+O 29、 Na 2O + 2HCl == 2NaCl + H 2O ( 说明Na 2O 是碱性氧化物 ) 10、2Na 2O 2 + 4HCl==4NaCl + 2H 2O + O 2↑ ( Na 2O 2不是碱性氧化物 )11、Na 2CO 3 + 2HCl == 2NaCl + H 2O + CO 2↑ ( CO 32- +2H + == H 2O + CO 2↑)12、NaHCO 3 + HCl== NaCl + H 2O + CO 2↑ ( HCO 3- + H + == H 2O + CO 2↑) 13、2NaHCO 3= Na 2CO 3+H 2O+CO 2↑14、Al 2O 3 + 6HCl == 2AlCl 3 + 3H 2O ( Al 2O 3 + 6H +== 2Al 3++ 3H 2O )15、Al 2O 3 + 2NaOH = 2NaAlO 2 + H 2O ( Al 2O 3 + 2OH - ==2AlO 2- + H 2O )16、AlCl 3 + 3NH 3·H 2O== Al(OH)3↓+ 3NH 4Cl (实验室制氢氧化铝)Al 3++3NH 3· H 2O== Al(OH)3↓+3NH 4+17、Al(OH)3+3HCl==AlCl 3+3H 2O ( Al(OH)3+3H +== Al 3++3H 2O )18、Al(OH)3+NaOH==NaAlO 2+2H 2O ( Al(OH)3+OH - ==AlO 2-+2H 2O ) 19、2Al(OH)3 == Al 2O 3+3H 2O20、少量CO 2通入NaOH 溶液:2NaOH+ CO 2== Na 2CO 3+ H 2O ( 2OH -+ CO 2==CO 32-+ H 2O )21、足量CO 2通入NaOH 溶液:NaOH+ CO 2== NaHCO 3 ( OH -+ CO 2==HCO 3- ) △△ △22、少量NaOH 加入AlCl 3溶液:AlCl 3+3NaOH== Al(OH)3↓+3NaCl ( Al 3++3OH - ==Al(OH)3↓ )23、足量NaOH 加入AlCl 3溶液:AlCl 3+4NaOH== NaAlO 2+3NaCl+2 H 2O ( Al 3++4OH - == AlO 2-+2H 2O )24、Na 2CO 3 与NaHCO 3相互转化Na 2CO 3+ H 2O+ CO 2==2NaHCO 3 (CO 32-+ H 2O+ CO 2== 2HCO 3-)NaHCO 3+NaOH== Na 2CO 3+ H 2O (HCO 3-+ OH - == CO 32-+ H 2O )25、氯碱工业(电解饱和食盐水):2NaCl +2 H 2O==== 2NaOH +H 2↑+Cl 2↑26、侯氏(侯德榜)制(纯)碱法(饱和食盐水中先通氨气,再通二氧化碳)①NaCl +NH 3+H 2O+ CO 2==NaHCO 3↓+NH 4Cl②2NaHCO 3=== Na 2CO 3+H 2O+CO 2↑ 二、铁及其化合物1、Fe+2HCl==FeCl 2+H 2↑ ( Fe +2H +=Fe 2++H 2↑)Fe+CuSO 4==FeSO 4+Cu ( Fe +Cu 2+=Fe 2++Cu )2、FeO+2HCl=FeCl 2 +H 2O ( FeO +2H +=Fe 2++H 2O )3、Fe 2O 3+6HCl=2FeCl 3 +3H 2O ( Fe 2O 3+6H +=2Fe 3++3H 2O )4、Fe 3O 4+8HCl=FeCl 2 +2FeCl 3+4H 2O ( Fe 3O 4+8H += Fe 2++2Fe 3++4H 2O )5、Fe 2 + 2OH = Fe(OH)26、Fe 3 + 3OH = Fe(OH)37、4Fe(OH)2+O 2+2H 2O=4Fe(OH)3 (现象:白色沉淀迅速变成灰绿色,最后变为红褐色)8、2Fe(OH)3 == Fe 2O 3+3H 2O9、Fe(OH)2+2HCl=FeCl 2 +2H 2O ( Fe(OH)2 +2H +=Fe 2++2H 2O )10、Fe(OH)3+3HCl=FeCl 3+3H 2O ( Fe(OH)3 +3H +=Fe 3++3H 2O )11、Fe 3 +3SCN =Fe(SCN)3 (现象:溶液呈红色。
金属钠铁铜铝镁方程式答案

钠及其化合物一、金属钠1.刚切开钠的断面很快变暗化学方程式:4Na+O2=2Na2O2.钠在空气中燃烧2Na+O2Na2O23.钠与硫的反应:2Na + S = Na2S钠与氯气反应:2Na+Cl22NaCl4.过量钠投入稀盐酸中,化学方程式:①2Na+2HCl=2NaCl+H2↑;②2Na +2H2O =2NaOH+H2↑离子方程式:①2Na+2H+=2Na++H2↑;②2Na+2H2O=2Na++2OH-+H2↑5.钠投入硫酸铜溶液中化学方程式:①2Na+2H2O=2NaOH+H2↑②2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 6.钠与熔融盐(如TiCl4)的反应4Na + TiCl44NaCl + Ti7.金属Na制取金属KNa + KCl NaCl+K ↑8.氧化钠与水反应Na2O + H2O = 2NaOHNa2O + H2O = 2Na+ + 2OH-9.氧化钠与CO2反应Na2O + CO2 = Na2CO310.氧化钠与盐酸反应Na2O + 2HCl = 2NaCl + H2ONa2O + 2H+ = 2Na+ + H2O11.氧化钠在空气中加热2NaO+O22Na2O2三、过氧化钠—不是碱性氧化物,是过氧化物12.过氧化钠投入水中化学方程式:2Na2O2+2H2O =4NaOH+O2↑离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑13.呼吸面具中过氧化钠做供氧剂2Na2O2+2CO2 =2Na2CO3+O214.过氧化钠与盐酸反应2Na2O2 + 4HCl = 4NaCl + 2H2O + O2↑2Na2O2 + 4H+ = 4Na+ + 2H2O + O2↑四、碳酸钠(纯碱、苏打),碳酸氢钠(小苏打)15.向纯碱溶液中逐滴滴加盐酸,至过量:化学方程式:化学方程式:①Na2CO3+HCl=NaHCO3+NaCl②NaHCO3+HCl=NaCl+H2O+CO2↑离子方程式:① CO32-+H+=HCO3-②HCO3-+H+=H2O+CO2↑16.向稀盐酸中滴加纯碱溶液化学方程式:Na2CO3+2HCl=2NaCl+H2O+CO2↑离子方程式:CO32-+2H+=H2O+CO2↑17.碳酸钠溶液中滴入几滴澄清石灰水化学方程式:Ca(OH)2 + Na2CO3====CaCO3↓+ 2NaOH 离子方程式:Ca2+ + CO32- ==== CaCO3↓18.向碳酸钠溶液中滴入几滴氯化钙溶液化学方程式:Na2CO3+CaCl2=CaCO3↓+2NaCl离子方程式:CO32- + Ca2+ === CaCO3↓19.向碳酸钠溶液中滴入几滴氢氧化钠溶液不反应20.除去碳酸氢钠溶液中混有的少量碳酸钠化学方程式:Na2CO3 + CO2 + H2O====2NaHCO3 21.除去碳酸钠固体中混有的少量碳酸氢钠2NaHCO3Na2CO3 +H2O+ CO2↑22.碳酸氢钠溶液与稀盐酸化学方程式:NaHCO3+HCl=NaCl+H2O+CO2↑离子方程式:HCO3-+H+=H2O+CO2↑23.碳酸氢钠溶液与烧碱.化学方程式:NaHCO3+NaOH = Na2CO3+H2O 离子方程式:HCO3-+OH-=CO32-+H2O 24.向烧碱溶液中通入少量二氧化碳.化学方程式:CO2+2NaOH = Na2CO3+H2O离子方程式:CO2+2OH-=CO32-+H2O25.向烧碱溶液中通入过量二氧化碳化学方程式:NaOH+CO2=NaHCO3离子方程式:OH-+CO2= HCO3-26.向碳酸氢钠溶液中滴入几滴氯化钙溶液不反应27.碳酸氢钠与足量氢氧化钙溶液HCO3-+Ca2+ +OH-=CaCO3↓ +H2O28.碳酸氢钠与少量氢氧化钙溶液2HCO3-+Ca2+ +2OH-=CaCO3↓ +2H2O +CO32-29.过量......Na2CO3溶液:析出NaHCO3晶体..CO2通入饱和Na2CO3 + H2O + CO2 = 2NaHCO3↓2Na++CO32- + H2O + CO2 = 2NaHCO3↓29.用饱和..NaHCO3溶液除去CO2中混有的SO2气体2NaHCO3 + SO2 = Na2SO3 + 2CO2↑+H2O30.碳酸氢钠与硫酸氢钠溶液的反应NaHCO3+ NaHSO4=Na2SO4+CO2↑+H2OHCO3--+ H+=CO2↑+H2O五、氢氧化钠(烧碱、火碱、苛性钠)32.氢氧化钠与少量CO2的反应2NaOH + CO2 = Na2CO3 + H2O2OH- + CO2 = CO32- + H2O33.氢氧化钠与醋酸的反应NaOH + CH3COOH = CH3COONa+H2OOH- + CH3COOH = CH3COO-+H2O34.少量NaOH溶液与足量Ca(HCO3)2溶液Ca(HCO3)2+NaOH=CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-=CaCO3↓+H2O35.足量NaOH溶液与少量Ca(HCO3)2溶液Ca(HCO3)2+2NaOH=CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O七、氯化钠36、电解熔融的NaCl2NaCl(熔融)2Na+Cl2↑37、电解饱和食盐水化学方程式:2NaCl+2H2O2NaOH+H2↑+Cl2↑离子方程式:2Cl-+2H2O2OH-+H2↑+Cl2↑38、氯化钠固体与浓硫酸反应NaCl + H2SO4(浓)NaHSO4+HCl↑2NaCl + H2SO4(浓)Na2SO4+2HCl↑39、侯氏制碱法NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl2NaHCO3Na2CO3 +H2O+ CO2↑铁及其化合物1、Fe在纯O2中燃烧3Fe + 2O2Fe3O42、Fe与S的反应Fe + S FeS3、Fe与Cl2点燃2Fe + 3Cl22FeCl3(剧烈燃烧,大量棕褐色的烟)4、Fe与水蒸汽反应3Fe+4H2O(g)Fe3O4+4H25、Fe与稀硫酸反应化学方程式:Fe+H2SO4===FeSO4+H2↑;离子方程式:Fe+2H+===Fe2++H2↑;6、Fe与氯化铜溶液反应化学方程式:Fe+CuCl2===Cu+FeCl2;离子方程式:Fe+Cu2+===Cu+Fe2+;7、Fe3O4粉末和稀盐酸化学方程式:Fe3O4+8HCl====FeCl2+2FeCl3+4H2O;离子方程式:Fe3O4+8H+====Fe2++2Fe3++4H2O8、CO还原磁性氧化铁(工业炼铁)化学方程式:Fe3O4+4CO 3Fe+4CO2;9、CO还原氧化铁(工业炼铁)化学方程式:Fe2O3+3CO2Fe+3CO210、向氯化铁中滴加氢氧化钠溶液化学方程式:FeCl3+3NaOH====Fe(OH)3↓+3NaCl;离子方程式:Fe3++3OH-====Fe(OH)3↓;11、氢氧化铁胶体的制备FeCl3+3H2O Fe(OH)3(胶体)+3HCl12、向硫酸亚铁溶液滴加过量氨水,生成白色沉淀,迅速变灰绿色,最终变成红褐色,生成白色沉淀化学方程式:FeSO4+2NH3·H2O====Fe(OH)2↓+(NH4)2SO4;离子方程式:Fe2++2NH3·H2O====Fe(OH)2↓+2NH4+;白色沉淀迅速变灰绿色最终变成红褐色,化学方程式4Fe(OH)2+O2+2H2O====4Fe(OH)313、氢氧化铁受热分解化学方程式:2Fe(OH)3Fe2O3+3H2O14、除去FeCl2溶液中的FeCl3化学方程式:2FeCl3+Fe = 3FeCl2离子方程式:2Fe3+ + Fe = 3Fe2+15、除去FeCl3溶液中的FeCl2化学方程式:2FeCl2+Cl2 =2FeCl3离子方程式:2Fe2+ + Cl2 = 2Fe3+ +2Cl-16、用氯化铁溶液制作铜制印刷电路板化学方程式:2FeCl3+Cu = 2FeCl2 +CuCl2离子方程式:2Fe3++Cu=2Fe2++Cu2+17、Fe3+的检验,(1)常用硫氰酸钾溶液离子方程式:Fe3++3SCN- =Fe(SCN)3(2)加氢氧化钠溶液Fe3++3OH-====Fe(OH)3↓18、氯化亚铁中Fe2+的检验:(1)常用:先滴加硫氰化钾溶液,观察后,再加氯水,化学方程式:①2FeCl2+Cl2 =2FeCl3;②FeCl3+3KSCN=Fe(SCN)3+3KCl;离子方程式:①2Fe2+ + Cl2 = 2Fe3+ +2Cl-;②Fe3++3SCN- =Fe(SCN)3;(2)可以加氢氧化钠溶液,现象:白色沉淀迅速变灰绿色最终变成红褐色;化学方程式:①FeCl2+2NaOH====Fe(OH)2↓+2NaCl;②4Fe(OH)2+O2+2H2O====4Fe(OH)3;19、氯化铁溶液中加入KI,离子方程式:2Fe3++2I-=2Fe2++I220.氯化亚铁使酸性高锰酸钾褪色离子方程式:MnO4- + 8H+ + 5Fe2+= Mn2++ 5Fe3+ + 4H2O21.氯化亚铁中滴入双氧水离子方程式:2Fe2++H2O2+2H+=2Fe3+2H2O22.氯化铁与碳酸钠的水解互促反应离子方程式:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑23.氯化铁与碳酸氢钠的水解互促反应离子方程式:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑铝及其化合物1.铝箔在氧气中剧烈燃烧化学方程式:4Al + 3O22Al2O32.表面被氧化的铝片溶于过量稀盐酸,化学方程式:①Al2O3 +6HCl =2AlCl3 + 3H2O②2Al+6HCl=2AlCl3+3H2↑离子方程式:①Al2O3 + 6H+ =2Al3+ + 3H2O②2Al+6H+=2Al3++3H2↑3.表面被氧化的铝片溶于过量氢氧化钠溶液,化学方程式:①Al2O3 + 2NaOH+3 H2O=2 Na[Al(OH)4]②2Al+2NaOH +6H2O=2Na[Al(OH)4]+3H2↑离子方程式:①Al2O3+2OH- +3 H2O== 2[Al(OH)4]-②2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑4、氢氧化铝中加稀盐酸化学方程式:Al(OH)3+3HCl=AlCl3+3H2O离子方程式:Al(OH)3 +3H+ = Al3++ 3H2O5、氢氧化铝中加烧碱溶液化学方程式:Al(OH)3+NaOH=Na[Al(OH)4]离子方程式:Al(OH)3+OH-=[Al(OH)4]-6.制备氢氧化铝(1)往硫酸铝溶液中加过量氨水,化学方程式:Al2(SO4)3+6NH3·H2O====2Al(OH)3↓+3(NH4)2SO4离子方程式:Al3+ + 3NH3·H2O =Al(OH)3↓ +3NH4+(2)往四羟基合铝酸钠溶液中通过量二氧化碳,化学方程式:Na[Al(OH)4]+CO2 = Al(OH)3↓+ NaHCO3离子方程式:[Al(OH)4]- +CO2 = Al(OH)3↓+ HCO3-7.往四羟基合铝酸钠溶液中通少量二氧化碳,化学方程式:2Na[Al(OH)4]+CO2 = 2Al(OH)3↓+ Na2CO3+H2O离子方程式:2[Al(OH)4]- +CO2 = 2Al(OH)3↓+ CO32-+H2O8.氢氧化铝受热分解2Al(OH)3Al 2O3+3H2O9.往氯化铝溶液中逐滴滴加烧碱溶液,至过量氢氧化钠不足时:AlCl3+3NaOH = Al(OH)3↓+3NaClAl3++3OH- = Al(OH)3↓氢氧化钠过量后:Al(OH)3+NaOH = Na[Al(OH)4]Al(OH)3+OH- =[Al(OH)4]-10、往氯化铝溶液中加入过量烧碱溶液化学方程式:AlCl3+4NaOH = Na[Al(OH)4]+3NaCl离子方程式:Al3++4OH- =[Al(OH)4]-11.往四羟基合铝酸钠溶液中逐滴滴加稀盐酸,至过量化学方程式:①Na[Al(OH)4]+HCl =Al(OH)3↓+ NaCl+H2O②Al(OH)3+3HCl=AlCl3+3H2O离子方程式:①[Al(OH)4]- +H+=Al(OH)3↓+H2O;②Al(OH)3 +3H+ = Al3++ 3H2O12.往四羟基合铝酸钠溶液中加入过量的稀盐酸,化学方程式:Na[Al(OH)4]+4HCl =AlCl3+ NaCl+4H2O离子方程式:[Al(OH)4]- +4H+=Al3++4H2O;13.往NaOH溶液中逐滴滴入AlCl3溶液至过量.化学方程式:AlCl3+4NaOH = Na[Al(OH)4]+3NaCl3 Na[Al(OH)4]+AlCl3=4Al(OH)3↓+3NaCl离子方程式:Al3++4OH- =[Al(OH)4]-3[Al(OH)4]- +Al3+=4Al(OH)3↓14.明矾与氢氧化钡溶液至铝离子完全沉淀化学方程式:2KAl(SO4)2+3Ba(OH)22Al(OH)3↓+K2SO4+3BaSO4↓离子方程式:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓15.明矾溶液与氢氧化钡溶液至硫酸根完全沉淀化学方程式:KAl(SO4)2+2Ba(OH)22BaSO4↓+K[Al(OH)4]离子方程式: Al3++2SO42-+2Ba2++4OH-=[Al(OH)4]-+2BaSO4↓16.氢氧化铝的碱式电离和酸式电离Al(OH)3Al3++3OH-Al(OH)3+H2O⇌[Al(OH)4]-+H+17.泡沫灭火器的原理离子方程式:Al3++3HCO3-=Al(OH)3↓+3CO2↑18.硫酸铝与碳酸钠溶液离子方程式:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑19、氯化铝与硫化钠溶液离子方程式:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑20、明矾:KAl(SO4)2·12H2O(十二水合硫酸铝钾)明矾净水:溶于水时产生Al(OH)3胶体,能吸附水中悬浮的杂质而沉淀。
重难点二 常见金属钠、镁、铝、铁与非金属的反应
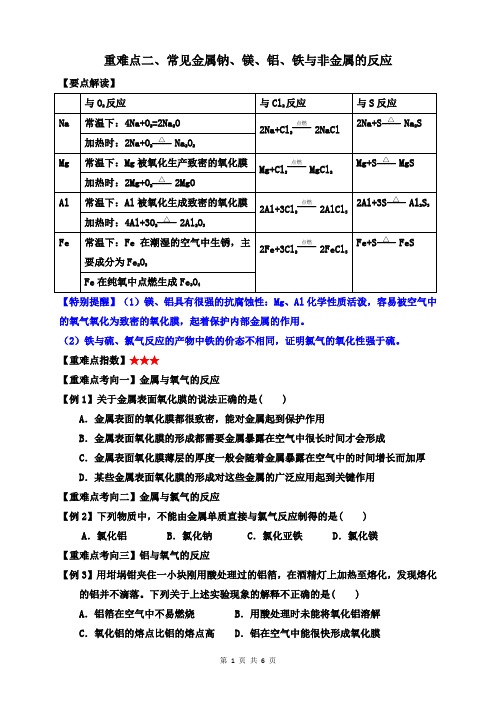
重难点二、常见金属钠、镁、铝、铁与非金属的反应【要点解读】【特别提醒】(1)镁、铝具有很强的抗腐蚀性:Mg、Al化学性质活泼,容易被空气中的氧气氧化为致密的氧化膜,起着保护内部金属的作用。
(2)铁与硫、氯气反应的产物中铁的价态不相同,证明氯气的氧化性强于硫。
【重难点指数】★★★【重难点考向一】金属与氧气的反应【例1】关于金属表面氧化膜的说法正确的是( )A.金属表面的氧化膜都很致密,能对金属起到保护作用B.金属表面氧化膜的形成都需要金属暴露在空气中很长时间才会形成C.金属表面氧化膜薄层的厚度一般会随着金属暴露在空气中的时间增长而加厚D.某些金属表面氧化膜的形成对这些金属的广泛应用起到关键作用【重难点考向二】金属与氯气的反应【例2】下列物质中,不能由金属单质直接与氯气反应制得的是( ) A.氯化铝 B.氯化钠 C.氯化亚铁 D.氯化镁【重难点考向三】铝与氧气的反应【例3】用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落。
下列关于上述实验现象的解释不正确的是( )A.铝箔在空气中不易燃烧 B.用酸处理时未能将氧化铝溶解C.氧化铝的熔点比铝的熔点高 D.铝在空气中能很快形成氧化膜【重难点特训】1.(双选)金属钠分别在过量的O2和Cl2中燃烧,产生的现象相同点是( )A.都产生白烟B.都产生黄色火焰C.都发光发热 D.都生成白色固体2.(多选)下列实验描述,符合事实的是( )A.金属钠暴露在空气中,表面变暗,生成白色固体氧化钠B.用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼的白光,放出大量的热,产生白色固体C.用坩埚钳夹住铝箔在酒精灯上点燃,发出耀眼的白光,放出大量的热D.用坩埚钳夹住铝箔在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落下来3.从金属利用的历史看,先是青铜器时代,而后是铁器时代,铝的冶炼是近百年的事.决定金属使用年代先后顺序的关键因素是( )A.金属的活动性 B.金属的导电性C.金属的延展性 D.地壳中金属元素的含量4.小明家中收藏了一件200年前的铝制佛像,该佛像至今仍保存完好。
金属及其化合物的化学方程式

金属及其化合物一、钠及其化合物(一)记忆口诀钠块银白质柔软,置于空气色变白,燃烧产物黄色固,阴阳比数1比2呼吸潜水供氧剂,氧化性强可漂白,黄豆钠块投入水,浮熔游嘶小变红,钠酸反应更剧烈,钠盐反应水优先,钠要保存煤油中,失火要用沙盖灭,钠钾火焰的焰色,黄紫蓝玻要记熟,纯碱苏打小苏打,小的受热遇碱变苏打,遇酸皆放CO(读C、O、2),碳酸钠中速度慢。
2(二))钠及其化合物化学方程式配平方法:氧化还原反应据电子守恒配平。
非氧化还原反应:设1法,把跟其他元素联系较多的物质系数设为1,利用彼此联系配平。
1.钠与氧气反应常温4Na+O=2Na O(白色)22加热2Na+O2Na O(淡黄色)222.钠与水反应2Na+2H O=2NaOH+H↑现象:浮熔游嘶小红222Na+2H O=2Na++2OH-+H↑223.氧化钠与水反应Na O+H O=2NaOH22Na O+H O=2Na++2OH-224.过氧化钠与水反应2Na O+2H O=4NaOH+O↑22222Na O+2H O=4Na++4OH-+O↑22225.过氧化钠与二氧化碳反应2Na O+2CO=2Na CO+O2222326.少量二氧化碳与氢氧化钠溶液反应2NaOH+CO=Na CO+H O22322OH-+CO=CO2-+H O232足量二氧化碳与氢氧化钠溶液反应NaOH+CO=NaHCO2OH-+CO=HCO-2337.碳酸钠与少量盐酸反应Na CO+HCl=NaCl+NaHCO233CO2-+H+=HCO-33碳酸钠与足量盐酸反应Na CO+2HCl=2NaCl+CO↑+H O2322CO2-+2H+=CO↑+H O322碳酸钠溶液中逐滴滴入稀盐酸先无气体生成,有气体生成;稀盐酸中滴加碳酸钠溶液立即有气体生成;两试剂滴加顺序不同,现象不同8.碳酸氢钠与盐酸反应 NaHCO +HCl = NaCl + CO + H O322HCO - + H + = CO ↑+ H O322碳酸钠与碳酸氢钠分别与同浓度的盐酸反应,碳酸氢钠与盐酸反应产生气体的速度快些9.碳酸氢钠与氢氧化钠溶液反应NaHCO + NaOH = Na CO + H O3232HCO - + OH -= CO 2-+ H O33 210.碳酸钠溶液中通入二氧化碳 Na CO + CO + H O = 2NaHCO 23223CO 2-+ CO + H O =2HCO -3223饱和碳酸钠溶液中通入足量的二氧化碳有晶体( N aHCO )析出311.加热碳酸氢钠固体2NaHCO二、镁铝及其化合物(一)记忆口诀3 Na CO + CO ↑+ H O (提纯、差量法计算)2 3 2 2二氧化碳镁条燃,铝热反应很耀眼。
钠镁铝铁及其化合物方程式和离子方程式锦集

Na 、Mg 、Al 、Fe 及其化合物的化学方程式和离子方程式一、Na 及其化合物的化学方程式和离子方程式 (1)Na 的反应 1、钠和水反应:方程式: 2Na+2H 2O=2NaOH+H 2↑ 离子方程式: 2Na+2H 2O=2Na +2OH -+H 2↑ 2.钠分别和氧气、硫、氯气:2Na+O 2Na 2O 2 (或加热) 4Na+O 2 = 2Na 2O 2Na+S =Na 2S 2Na+Cl 22NaCl 3.钠分别和盐酸(或硫酸)、醋酸方程式: 2Na+2HCl=2NaCl+H 2↑ 离子方程式: 2Na+2H +=2Na ++H 2↑ 方程式: 2Na+H 2SO 4=Na 2SO 4+H 2↑ 离子方程式: 2Na+2H +=2Na ++H 2↑方程式:2Na+2CH 3COOH=2CH 3COONa+H 2↑ 离子方程式: 2Na+2CH 3COOH=2CH 3COO -+2Na ++H 2↑ 4.钠分别和硫酸铜溶液、氯化铁溶液方程式: 2Na +2H 2O+CuSO 4=Cu(OH)2↓+Na 2SO 4+H 2↑ 离子方程式: 2Na +2H 2O+Cu 2+=Cu(OH)2↓+2Na ++H 2↑ 方程式: 6Na +6H 2O+2FeCl 3=2Fe(OH)3↓+6NaCl+3H 2↑ 离子方程式: 6Na +6H 2O+2Fe 3+=2Fe(OH)3↓+6Na ++3H 2↑(2)Na 的氧化物反应 1.氧化钠分别与水、盐酸方程式: Na 2O+H 2O=2NaOH 离子方程式: Na 2O+H 2O=2Na ++2OH - 方程式: Na 2O+2HCl=2NaCl+H 2O 离子方程式: Na 2O+2H +=2Na ++H 2O 2.过氧化钠分别与盐酸、水方程式: 2Na 2O 2+4HCl=4NaCl+2H 2O+O 2↑ 离子方程式: 2Na 2O 2+4H + =4Na ++2H 2O+O 2↑ 方程式: 2Na 2O 2+2H 2O=4NaOH+O 2↑ 离子方程式: 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ 3.过氧化钠分别与二氧化碳:2Na 2O 2+2CO 2=2Na 2CO 3+O 2 (3)Na 2CO 3、NaHCO 3盐的反应1.分别加热碳酸钠和碳酸氢钠固体(鉴别固体Na 2CO 3、NaHCO 3的方法)碳酸钠受热不分解 2NaHCO 3Na 2CO 3+H 2O+CO 2↑ 2.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的盐酸反应少量的盐酸时:Na 2CO 3+HCl =NaHCO 3 +NaCl CO 32-+H +=HCO 3-NaHCO 3+HCl =NaCl+CO 2↑+H 2O HCO 3-+H +=CO 2↑+H 2O过量的盐酸时:Na 2CO 3+2HCl =2NaCl+CO 2↑+H 2O CO 32-+2H +=CO 2↑+H 2ONaHCO3+HCl=NaCl+CO2↑+H2O HCO3-+H+=CO2↑+H2O3.碳酸钠和碳酸氢钠溶液分别与少量(或过量)的醋酸反应少量的醋酸时:Na2CO3+CH3COOH=NaHCO3+CH3COONaCO32-+ CH3COOH=HCO3-+ CH3COO-NaHCO3+CH3COOH=CH3COONa+CO2↑+H2OHCO3-+ CH3COOH=CO2↑+H2O+ CH3COO-过量的醋酸时:Na2CO3+2CH3COOH=2CH3COONa+ CO2↑+H2OCO32-+ 2CH3COOH=2CH3COO-+CO2↑+H2ONaHCO3+CH3COOH=CH3COONa+CO2↑+H2OHCO3-+ CH3COOH=CO2↑+H2O+ CH3COO-4.二氧化碳通入到碳酸钠溶液中(或通入到饱和的碳酸钠溶液中)CO2+ Na2CO3+H2O=2 NaHCO3CO2+CO32-+H2O=2 HCO3-或 CO2+ Na2CO3+H2O=2 NaHCO3↓ CO2+2Na++CO32-+H2O=2 NaHCO3↓5.碳酸钠溶液与澄清石灰水(或氢氧化钠溶液)混合方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH离子方程式: CO32-+ Ca2+=CaCO3↓碳酸钠溶液与氢氧化钠溶液混合不发生反应6. 碳酸氢钠与少量(或过量)的澄清石灰水混合 (类似:澄清石灰水可以改为氢氧化钡溶液)少量澄清石灰水:2NaHCO3+Ca(OH)2=2H2O+CaCO3↓+ Na2CO32 HCO3-+Ca2++2OH-=2H2O+CaCO3↓+ CO32-过量澄清石灰水:NaHCO3+Ca(OH)2=H2O+CaCO3↓+ NaOHHCO3-+Ca2++OH-=H2O+CaCO3↓7.碳酸氢钠与氢氧化钠溶液混合方程式: NaHCO3+ NaOH=Na2CO3+ H2O 离子方程式: HCO3-+OH-=H2O+CO32-8.电解熔融状态的氯化钠、电解饱和食盐水(注意电极反应式的书写)2NaCl(熔融)=Na+Cl2↑ 2NaCl+2H2OCl2↑+H2↑+2NaOH 2Cl-+2H2OCl2↑+H2↑+2OH- 9.碳酸钠溶液、碳酸氢钠溶液滴2滴酚酞试液都呈色,为什么(用方程式或离子方程式表示) 溶液呈红色CO32-+H2O HCO3-+OH-溶液呈碱性HCO3-+H2O H2CO3+ OH-溶液呈碱性二、Mg、Al及其化合物的化学方程式和离子方程式(1)Mg的反应1.镁在空气中燃烧2Mg + O2 2MgO 3Mg +N2 Mg3N2 2Mg + CO2 2MgO + C2.镁能溶解在氯化铵溶液中Mg + 2NH4Cl = MgCl2 + H2↑+ NH3↑ Mg + 2NH4+= Mg2+ + H2↑+ NH3↑(2) Al的反应3.铝是活泼金属,为什么可以直接存放在空气中,用简单的文字和方程式说明:4Al+3O2=2Al2O3在铝的表面形成致密的氧化铝薄膜,将铝和空气隔绝。
钠和铝及其化合物方程式总结

钠及其化合物的反应方程式1.金属钠的化学性质:钠露置空气中变暗:4Na+O2=2Na2O(白色)钠的燃烧:2Na+O2Na2O2(淡黄色) (反应条件不同,产物不同)钠与氯气反应:2Na+ Cl2===2NaCl钠与硫单质反应:2Na+S=Na2S钠投入水中:2Na+2H2O=2NaOH+H2↑2Na+2H2O=2Na++2OH–+H2↑(现象:浮、熔、游、响、红)钠与盐酸(先酸后水):2Na+ 2HCl===2NaCl+H2↑2Na+ 2H+===2Na++H2↑钠与硫酸铜溶液(先水后盐):①2Na+2H2O=2NaOH+H2↑②2NaOH+CuSO4=Cu(OH)2↓+Na2SO42Na+2H2O+CuSO4=Na2SO4+Cu(OH)2↓+H2↑(总式)2.氧化钠的化学性质:氧化钠与水:Na2O+H2O=2NaOH Na2O+H2O=2Na++2OH–氧化钠与二氧化碳:Na2O+CO2=Na2CO3(不在水溶液中进行)氧化钠与盐酸:Na2O+2HCl=2NaCl+H2O Na2O+2H+=2Na++H2O3.过氧化钠的化学性质(漂白性、强氧化性):过氧化钠与水:2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2H2O=4Na++4OH–+O2↑过氧化钠与二氧化碳:2Na2O2+2CO2=2Na2CO3+O24.碳酸钠与碳酸氢钠的化学性质:碳酸氢钠受热分解:2NaHCO3Na2CO3+H2O+CO2↑碳酸钠与酸的反应:Na2CO3+HCl =NaCl+ NaHCO3(酸少量)CO32–+ H+= HCO3-Na2CO3+2HCl=2NaCl+H2O+CO2↑(酸足量)CO32–+ 2H+=CO2↑+H2O 碳酸氢钠与澄清石灰水反应:2NaHCO3+Ca(OH)2(过量)=CaCO3↓+2NaOH+H2O2NaHCO3+Ca(OH)2(少量)=CaCO3↓+Na2CO3+H2O碳酸氢钠与酸的反应:NaHCO3+HCl=NaCl+H2O+CO2↑HCO3-+H+=CO2↑+H2O 碳酸钠转换成碳酸氢钠(Na2CO3→NaHCO3):①通入CO2:Na2CO3+H2O+CO2=2NaHCO3CO32–+H2O+CO2=2HCO3-②加入适量稀盐酸:Na2CO3+HCl =NaCl+ NaHCO3 CO32–+ H+= HCO3-碳酸氢钠转换成碳酸钠(NaHCO3→Na2CO3):①碳酸氢钠受热分解:2NaHCO3Na2CO3+H2O+CO2↑(除去NaHCO3最佳方法)②加入适量氢氧化钠:NaHCO3+NaOH= Na2CO3 + H2O HCO3-+OH-=CO32–+H2O铝及其化合物的反应方程式5.金属铝的化学性质:铝在空气中常温或加热条件下都生成致密的氧化膜:4Al+3O2=2Al2O3铝与稀盐酸的反应:2Al+6HCl===2AlCl3+3H2↑2Al+6H+=2Al3++3H2↑铝与氢氧化钠的反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑2Al+2OH–+2H2O=2AlO2–+3H2↑6.氧化铝的化学性质:(物理性质:难溶于水,熔点高,硬度大)氧化铝与稀盐酸的反应:Al2O3+6HCl=2AlCl3+3H2O Al2O3+6H+=2Al3++3H2O 氧化铝与氢氧化钠的反应:Al2O3+2NaOH=2NaAlO2+H2O Al2O3+2OH–=2AlO2―+H2O氢氧化铝的热稳定性差,受热易分解:2Al(OH)3Al 2O 3+3H 2O铝三角①少量OH - AlCl 3+3NaOH==Al(OH)3↓+3NaCl Al 3++3OH -==Al(OH)3↓ 加入NH 3·H 2O Al 2(SO 4)3+6NH 3·H 2O==2Al(OH)3↓+3(NH 4)2SO 4 Al 3++3NH 3·H 2O==Al(OH)3↓+3NH 4+②少量H +(除CO 2) Al(OH)3+3HCl==AlCl 3+3H 2O Al(OH)3+3H +==Al 3++3H 2O ③过量H + NaAlO 2+4HCl==AlCl 3+NaCl+2H 2O AlO 2-+4H +==Al 3++2H 2O ④过量OH - AlCl 3+4NaOH==NaAlO 2+3NaCl+2H 2O Al 3++4OH -==AlO 2-+2H 2O ⑤加入OH - Al(OH)3+NaOH==NaAlO 2+2H 2O Al(OH)3+OH -==AlO 2-+2H 2O ⑥少量H + NaAlO 2+HCl+H 2O==Al(OH)3↓+NaCl AlO 2-+H ++H 2O==Al(OH)3↓ 加入Al 3+ 3NaAlO 2+AlCl 3+6H 2O==4Al(OH)3↓+3NaCl 3AlO 2-+Al 3++6H 2O==4Al(OH)3↓ Al 3+ AlO 2-Al(OH)3 ① OH -(少量)/NH 3·H 2O ②H +(除CO 2) ④OH -(过量) ③H +(过量) ⑤OH - ⑥H +(少量)/Al 3+/CO 2通入CO2(CO2少量时) 2NaAlO2+CO2+3H2O==2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O==2Al(OH)3↓+CO32-(CO2过量时)NaAlO2+CO2+2H2O==Al(OH)3↓+NaHCO3AlO2-+CO2+2H2O==Al(OH)3↓+HCO3-Welcome To Download !!!欢迎您的下载,资料仅供参考!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
钠镁铝铁方程式过关1.钠与水
2.过氧化钠与CO2
3.过氧化钠与水
4.小苏打加热
5.小苏打溶液与足量石灰水
6.足量烧碱溶液与碳酸氢钙溶液
7.镁在二氧化碳中燃烧
8.铝与烧碱
9.铝热反应
10.三氧化二铝与烧碱溶液
11.氢氧化铝与烧碱溶液
12.将过量的氨水逐滴滴加入氯化铝溶液中
13.将过量的烧碱逐滴滴加入氯化铝溶液中
14.将过量的CO2气体逐渐通入偏铝酸钠溶液中
15.将过量的氯化氢气体逐滴通入偏铝酸钠溶液中
16. 红热的铁与水蒸气反应
17.铁投入三氯化铁溶液中
18. 往三氯化铁溶液中投入铜片
19. 氢氧化亚铁在空气中放置
20. 氯气通入氯化亚铁溶液中
硅及氯气方程式过关
1.硅与氢氧化钠溶液反应
2.工业上制备单质硅
3.二氧化硅与氢氧化钠溶液反应
4.向硅酸钠溶液中通足量的二氧化碳
5.工业制玻璃的主要反应
6.用氢氟酸腐蚀玻璃
7.铁在氯气中燃烧
8.氯气入水
9.漂白粉久置于空气中变质
10.用氢氧化钠溶液进行氯气的尾气处理
11.实验室制备氯气的原理
12.将二氧化硫通入氯水中。
