九年级化学原子的构成同步测试题2
人教版九年级上册化学-3.2-原子的结构-同步测试

人教版九年级上册化学 3.2 原子的结构同步测试一、单选题1.下面是五种粒子的结构示意图,下列说法错误的是()A. 图中粒子共能表示四种元素B. 图中表示阳离子的是bC. 图中表示阴离子的是c、eD. 若b、e的元素符号分别为X、Y,那么它们能形成化学式为XY2的化合物2.科学家计划用质子数为20的钙离子,轰击核电荷数为98的铜元素靶,使两元素的原子核合并在一起,合成核电荷数为118的新元素,下列对此理解正确的是()A. 新元素的原子核外电子数为116B. 新元素的原子序数为118C. 变化过程中元素种类没有发生改变D. 新元素的相对原子质量为1183.下列粒子结构示意图中,表示离子的是( )A. B. C. D.4.中国科学技术名词审定委员会已确定第116号元素Lv的名称为鉝。
已知一种鉝原子的中子数为173,下列关于该原子的说法错误的是()A. 质子数为116B. 核电荷数为116C. 核外电子数为173D. 相对原子质量为2895.我国的“神州五号”载人飞船已发射成功,“嫦娥”探月工程也正式启动.据科学家预测,月球的土壤中吸附着百万吨的氦(He﹣3),其原子核中质子数为2,中子数为1,每百吨氦(He﹣3)核聚变所释放出的能量相当于人类一年消耗的能量.下列关于氦(He﹣3)元素说法正确的是()A. 原子核外电子数为3B. 相对原子质量为2C. 原子结构示意图为D. 氦原子容易失去两个电子6.下列说法不正确的是A. 原子的质量几乎都集中在原子核中B. 原子通过得失电子变成离子,但离子不能变成原子C. 原子、分子、离子都是构成物质的微粒。
D. 由分子构成的物质发生化学变化时,分子本身一定改变7.科学家可以通过测定古生物化石中的碳﹣14含量来推算古生物的年代.碳﹣14原子的核电荷数为6,相对原子质量为14,则原子的核外电子数为()A. 14B. 8C. 6D. 208.下列粒子结构示意图中,表示阳离子的是()A. B. C. D.9.关于下列四种粒子的说法中,不正确的是()A. 粒子N若得到一个电子就可以变成带一个单位正电荷的阳离子B. 以上四种粒子分属于三种不同元素C. 粒子M具有相对稳定的结构D. 上述粒子中有两个是离子,两个是原子10.某种核原料的原子,原子核内含有1个质子和2个中子,下列关于该原子的说法正确的是()A. 核电荷数为3B. 电子总数为2C. 属于氢元素D. 相对原子质量为1二、填空题11.如图是某原子的结构示意图,已知该粒子在化学反应中易得到2个电子形成稳定结构.Y=________,X=________.12.原子的构成包括原子核和________ 两部分.(2)某元素的原子结构示意图是,它属于________ (填“金属”或“非金属”)元素,该原子的核内有________ 个质子,在化学反应中容易________ 电子成为阳离子.(3)上述原子在元素周期表中的信息如图,由此可知此原子的相对原子质量约为________ (填整数),中子数为________ .13.(1)将元素、分子、原子、离子、中子或电子,选择正确的填入下列空格内:Na与Na+属于同一种________ ;带电的原子或原子团叫________ .(2)在SO2、粉尘、CO2、CO几种物质中,选择正确的填入下列空格内:用煤炉取暖时发生中毒,原因之一是由于室内________ ;煤燃烧时会产生引起温室效应的是________ 气体,污染空气的________ 气体.14.阴离子X2﹣核外有18个电子,则,X2﹣核内的质子个数为:________,元素符号是________.15.M元素的离子为M2+,其核外电子数为a,核内中子数为b,则M的相对原子质量为________。
人教版九年级化学 第三单元 课题2 原子的结构 同步练习 有答案

课题2 原子的结构一选择题1.化学变化中的最小粒子是( )A.原子B.分子C.质子D.中子2.已知1个C-12原子的质量为akg,则实际质量为b kg的另一种原子的相对原子质量为( )A.12b/a kgB.12b/aC.12a/bD.12a/b kg3.已知某原子的实际质量为Mg,又知碳原子的质量为N g ,则该原子的相对原子质量为( )A. B. C. D.4.某些花岗岩石材中含有放射性氡。
氡原子的质子数为86,中子数为136,这种氡原子核外电子数为( )A.50B.86C.136D.2225.下列说法正确的是( )A.原子不能再分B.原子核都是由质子和中子构成的C.相对原子质量只是一个比,没有单位D.原子可以构成分子,也可以直接构成物质6.下列关于原子的叙述正确的是( )A.原子是不能再分的粒子B.一切物质都是由原子直接构成的C.一切原子的原子核由质子和中子构成D.原子核内质子数必等于核外电子数7.英国科学家道尔顿最先确立了原子学说,他的中心论点主要有:①原子是不能再分的粒子;②原子是微小的实心球;③同种元素的原子,其性质和质量都相同。
而现代科学实验表明:同种元素的原子内部有相同的质子数和不一定相同的中子数。
从现代的观点看,你认为道尔顿的三个论点中,不确切的是( )A.①B.①③C.②③D.①②③8.“神舟”五号不仅将杨利伟送上太空,实现了亿万中国人的梦想,同时还承担着其他的科研任务。
比如探索宇宙中可能存在完全由反粒子构成的物质——反物质。
物质与反物质相遇会发生“湮灭”现象,释放出巨大的能量,在能源研究领域中前景可观。
正电子、负质子等都是反粒子。
它们与通常所说的电子、质子相比较,质量相等但电性相反。
请你推测,反氢原子的结构可能是( )A.由一个带正电荷的质子与一个带负电荷的电子构成B.由一个带负电荷的质子与一个带正电荷的电子构成C.由一个带正电荷的质子与一个带正电荷的电子构成D.由一个带负电荷的质子与一个带负电荷的电子构成9..为形象展示水分解的微观过程,某同学制作了一些模型,表示相应的微观粒子。
课题2 原子结构 同步练习 人教版九年级上册化学(含解析答案)

原子的结构练习一.选择题(共24小题)1.原子不显电性的原因是()A.构成原子的各部分不带电B.原子是电中性的实心球C.原子带电,但忽略不计D.原子核和核外电子带电,电量相等且电性相反2.(2020•鞍山)原子核中一定含有的粒子是()A.中子B.质子C.电子D.质子和电子3.(2020春•东营期末)下列关于原子构成的叙述正确的是()A.原子是由原子核和核外电子构成,而原子核则一定是由质子和中子构成B.在原子中,核内的质子数与核外的电子数不一定相等C.原子里有相对很大的空间,电子在这个空间里作高速运动D.在原子中质子带正电,核外电子带负电,所以整个原子也是带电的4.(2020春•上城区期末)小金绘制了某元素三种同位素的结构示意图并对其进行了相关阐述,不合理的是()A.图示的是氢元素,排在元素周期表首位B.表示的电子带负电,质量远小于质子C.表示的中子不带电,三种同位素的中子数不同D.表示的质子带正电,与中子的个数和质量都相等5.(2020•枣庄)1911年,英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。
根据实验,不能获得的结论是()A.金原子核带正电B.金原子核外电子带负电C.金原子核体积很小D.金原子核的质量比α粒子大得多6.(2020•潍坊)科学家发现一种只有四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。
它与天体中的中子星构成类似。
有关该粒子的说法不正确的是()A.不显电性B.失去一个中子后显+1价C.质量相当于一个氦(He)原子的质量D.在现有的周期表中不可能有它的位置7.(2020•定海区模拟)人类对原子结构的认识为现代量子理论的建立奠定了基础,如图几位科学家对原子的观点,按出现的先后顺序排列正确的是()A.③④①②B.③①②④C.③①④②D.③②①④8.(2020春•萧山区校级月考)如图为核聚变的示意图,其中甲、乙、丙表示三种原子,根据如图所示,下列说法中错误的是()A.质子数:甲=乙<丙B.中子数:甲<乙=丙C.质量:甲<乙<丙D.上述说法不全对9.(2020•启东市模拟)如图为碳原子的结构模型图,其中a、b、c是该碳原子内的三种不同粒子,下列说法不正确的是()A.碳原子核中可能含有6个c和6个bB.碳原子的质量主要集中在b和c上C.决定原子种类的粒子是cD.碳原子中含有6个a和8个c10.(2020•环江县三模)下列有关原子与离子的说法不正确的是()A.原子变成离子,电子层数一定发生改变B.原子、离子都可以构成物质C.同种元素的原子与离子的化学性质是不同的D.离子是指带电的原子或原子团11.下列关于Mg和Mg2+两种粒子的判断中,正确的是()①核电荷数相同②核外电子数相等③Mg2+比Mg稳定④质子数相等⑤电子层数相同A.①③④⑤B.②⑤C.①③④D.①⑤12.(2020•西华县三模)下列说法正确的是()A.分子大,原子小B.能直接构成物质的粒子有分子、原子、质子C.分子之间有间隙,原子之间没有间隙D.原子失去或得到电子后会形成离子13.(2020•新疆模拟)关于氯化钠的说法正确的是()A.Na+的最外层的电子数为1B.Cl﹣的结构示意图为C.Na+和Cl﹣靠静电作用结合成NaClD.Na+和Cl﹣都是带电的,因此氯化钠也带电14.(2020•许昌一模)一种元素的原子变成其阴离子时()A.得失电子都有可能B.一定失去电子C.一定得到电子D.既不得到电子也不失去电子15.(2019秋•铁锋区期末)下列粒子可以通过得到电子变成原子的是()A.F B.S2﹣C.D.16.(2020•微山县二模)下列对于Fe、Fe2+、Fe3+的说法不正确的是()A.核电荷数相同B.相对原子质量相同C.属于同一种微粒D.属于同一种元素17.(2020•沐川县校级模拟)如图结构示意图表示的粒子中,属于阴离子的是()A.B.C.D.18.(2019秋•河口县期末)下列关于四种粒子的结构示意图中,有关它们的说法正确的是()A.它们表示四种不同的元素B.②表示的原子容易失去电子C.①③④表示的元素都是非金属元素D.①④表示的是阳离子19.(2020•大武口区校级一模)甲、乙、丙、丁表示四种粒子的结构示意图,下列说法不正确的是()A.甲、乙属于同种元素B.丁中x=8C.甲、乙、丙具有相似的化学性质D.甲表示阴离子20.(2020•烟台)2019年诺贝尔化学奖得主在锂离子电池研发领域做出了重要贡献。
新人教版九年级化学上册3.2原子的构成同步测试

新人教版九年级上册《3.2 原子的构成》同步练习卷一、填空题(共5小题,每小题3分,满分15分)1.原子很小,原子核更小,电子在原子核外很大的空间里作的运动.科学研究表明,在含有多个电子的原子中,核外电子具有不同的,离核近的电子,离核越远,电子.2.核外电子的分层运动又叫做.到目前为止,人们发现元素原子核外电子的排布中,最少的只有层,最多的有层.最外层电子数最多不超过个(只有1层的,电子不超过个).3.原子结构示意图表示的意义:以镁原子为例:表示镁原子的核电荷数(质子数)为,核外共有个电子层,第一层上有个电子,最外层上有个电子.4.稀有气体的原子最外层有个电子(氦为个电子),是一种的结构,氦、氩等化学性质比较;钠、镁等金属的原子最外层电子数一般都于4个,在化学反应中易电子;氯、氧等非金属原子的最外层电子数一般都4个,在化学反应中易电子,都趋于达到的结构.5.叫做离子,原子失去电子会带上电,叫做离子,原子得到电子会带上电,叫做离子.像氯化钠这种由阴、阳离子相互作用形成的化合物叫做离子化合物.二、基础训练6.某原子的结构示意图为:,下列说法正确的是()A.该原子中所含的质子数为16B.该原子属于金属元素的原子C.该原子属于非金属元素的原子D.该原子的核外电子数为67.根据钠原子结构示意图不能确定的是()A.质子数B.电子层数C.相对原子质量D.元素种类8.下列陈述不正确的是()A.分子可以分解成原子B.原子由原子核和电子构成C.阳离子得到电子变成原子D.原子失去电子变成阴离子9.某元素负二价阴离子的结构示意图为,则该元素原子所含的质子数为()A.6 B.8 C.10 D.1210.下表列出了一些生活中常见元素的原子结构示意图.下列叙述错误的是()A.上表中,8种元素原子的核外电子层数相同B.S、Cl、Ar的原子在化学反应中都易得到电子,形成带负电荷的阴离子C.上表中,非金属元素原子的最外层电子数都大于4个D.从Na到Ar,随着核电荷数的递增,原子核外最外层电子数从1个递增到8个三、能力训练11.据科学家预测,月球的土壤中吸附着百万吨的氦(He﹣3),其原子核中质子数为2、中子数为1,每百吨氦(He﹣3)核聚变所释放出的能量相当于目前人类一年消耗的能量.下列关于氦(He﹣3)元素的说法正确的是()A.原子核外电子数为3 B.相对原子质量为2C.原子结构示意图为D.原子结构示意图为12.某粒子结构示意图为,下列对该粒子的说法中不正确的是()A.核内一定有10个质子B.核外电子是分层排布的C.具有稳定结构D.可能是阳离子或阴离子或稀有气体原子13.下列结构示意图,表示阴离子的是()A.B.C.D.14.下列结构示意图中表示阳离子的是()A.B.C.D.15.原子失去最外层电子或最外层得到电子之后,一定不会引起的改变是()①核外电子总数②化学性质③相对原子质量④粒子的电性⑤原子核⑥电子层数⑦最外层电子数.A.①⑤ B.②⑤ C.③⑤ D.②④⑥16.对于Fe、Fe2+、Fe3+三种粒子的判断正确的是()①核电荷数相同②核外电子数相同③电子层结构完全相同④相对原子质量几乎相等.A.①②③④ B.①③ C.①④ D.②③四、解答题(共3小题,满分0分)17.(1)用数字和化学符号表示:2个氧原子,3个钠离子.(2)镁的原子结构示意图为.Mg原子再化学反应中容易(填“得到”或“失去”)2个电子.18.Na与Na+的比较:(1)Na与Na+的化学性质不同,是因为;(2)Na与Na+的质量几乎相等,是因为;(3)Na与Na+属于粒子,是因为.19.在一个水分子中(H2O),共有个质子,个电子.在一个氢氧根离子中(OH﹣),共有个质子,个电子.五、迁移拓展20.根据下列几种粒子的结构示意图,回答问题:(1)其中属于阴离子的是.(填序号,下同)(2)属于金属原子的是.(3)具有相似化学性质的粒子是.21.(2016•湘桥区模拟)如图1为某粒子的结构示意图,则(1)该粒子有个电子层,X的值为;(2)该粒子的化学性质与下列(如图2)(填序号)元素的化学性质最相似.新人教版九年级上册《3.2 原子的构成》同步练习卷参考答案与试题解析一、填空题(共5小题,每小题3分,满分15分)1.原子很小,原子核更小,电子在原子核外很大的空间里作高速的运动.科学研究表明,在含有多个电子的原子中,核外电子具有不同的能量,离核近的电子能量低,离核越远,电子能量越高.【考点】原子的定义与构成.【专题】物质的微观构成与物质的宏观组成.【分析】原子很小,原子核更小,电子在原子核外很大的空间里作高速运动;在含有多个电子的原子中,核外电子具有不同的能量;离核近的电子能量低,离核越远,电子能量越高.【解答】解:原子很小,原子核更小,电子在原子核外很大的空间里作高速运动;在含有多个电子的原子中,核外电子具有不同的能量;离核近的电子能量低,离核越远,电子能量越高.故答案为:高速;能量;能量低;能量越高.【点评】解答本题关键是知道原子核外电子的运动情况,和能量高低.2.核外电子的分层运动又叫做分层排布.到目前为止,人们发现元素原子核外电子的排布中,最少的只有一层,最多的有七层.最外层电子数最多不超过8个(只有1层的,电子不超过2个).【考点】核外电子在化学反应中的作用.【专题】物质的微观构成与物质的宏观组成.【分析】根据核外电子排布的规律分析回答.【解答】解:在含有多个电子的原子中,核外的电子具有不同的运动状态,核外电子的分层运动又叫做分层排布.到目前为止,人们发现元素原子核外电子的排布中,最少的只有一层,最多的有七层.最外层电子数最多不超过8个(只有1层的,电子不超过2个).故答为:分层排布;一;七;8;2.【点评】本题的难度不大,了解核外电子的运动状态及排布规律是解答本题的基础.3.原子结构示意图表示的意义:以镁原子为例:表示镁原子的核电荷数(质子数)为12,核外共有3个电子层,第一层上有2个电子,最外层上有2个电子.【考点】原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层.若最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子.【解答】解:以镁原子为例:表示镁原子的核电荷数(质子数)为12,原子核外有3个电子层,第一层上有2个电子,最外层上有2个电子.答案:12;3;2;2.【点评】本题难度不大,考查学生对原子结构示意图及其意义的理解,了解原子结构示意图的意义是正确解题的关键.4.稀有气体的原子最外层有8个电子(氦为2个电子),是一种相对稳定的结构,氦、氩等化学性质比较稳定;钠、镁等金属的原子最外层电子数一般都小于4个,在化学反应中易失去电子;氯、氧等非金属原子的最外层电子数一般都大于4个,在化学反应中易得到电子,都趋于达到稳定的结构.【考点】核外电子在化学反应中的作用.【专题】物质的微观构成与物质的宏观组成.【分析】根据已有的原子核外电子的特点进行分析解答即可.【解答】解:稀有气体的原子最外层有8个电子(氦为2个电子),是一种相对稳定的结构,氦、氩等化学性质比较稳定;钠、镁等金属的原子最外层电子数一般都小于4个,在化学反应中易失去电子;氯、氧等非金属原子的最外层电子数一般都大于4个,在化学反应中易得到电子,都趋于达到稳定的结构.故填:8,2,相对稳定,稳定,小,失去,大于,得到,稳定.【点评】本题考查的是原子核外电子的特点,完成此题,可以依据已有的知识进行.5.带电荷的原子或是原子团叫做离子,原子失去电子会带上正电,叫做阳离子,原子得到电子会带上负电,叫做阴离子.像氯化钠这种由阴、阳离子相互作用形成的化合物叫做离子化合物.【考点】原子和离子的相互转化.【专题】物质的微观构成与物质的宏观组成.【分析】根据已有的离子的形成和离子形成的物质的类别进行分析解答即可.【解答】解:带电荷的原子或是原子团称为离子,原子失去电子形成带正电荷的阳离子,得到电子形成带负电荷的阴离子,由离子形成的化合物称为离子化合物,故填:带电荷的原子或是原子团,正,阳,负,阴.【点评】本题考查的是离子的形成的知识,完成此题,可以依据已有的知识进行.二、基础训练6.某原子的结构示意图为:,下列说法正确的是()A.该原子中所含的质子数为16B.该原子属于金属元素的原子C.该原子属于非金属元素的原子D.该原子的核外电子数为6【考点】原子结构示意图与离子结构示意图;元素的简单分类.【分析】原子结构示意图圆内数字为原子的质子数、“+”表示原子核带正电;圆外的弧线为电子层、弧线上的数字为该层上的电子数、离圆最近的弧线表示第一层,依次向外为第二层、第三层等;离圆最远的弧线表示最外层.【解答】解:由原子的结构示意图直接得到:原子所含的质子数为8和核外电子数为2+6=8;最外层电子数为6,大于4,所以该原子属于非金属元素的原子.故选C.【点评】金属元素的原子的最外层电子数一般小于4,非金属元素的原子最外层电子数一般大于或等于47.根据钠原子结构示意图不能确定的是()A.质子数B.电子层数C.相对原子质量D.元素种类【考点】原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】根据原子结构示意图中,圆圈内的数字为原子核内的质子数,圆圈数为电子层数,质子数决定元素种类,元素的相对原子质量=质子数+中子数,进行解答.【解答】解:根据原子结构示意图,该原子核内有11个质子,该原子所表示的元素为钠元素,电子层数为3,综上所述,根据原子的结构示意图,可确定该原子的元素种类、质子数及电子层数,因不能判断该原子的中子数,不能确定元素的相对原子质量.故选C.【点评】本题考查学生对原子结构示意图知识的理解与掌握,并能在解题中灵活应用的能力.8.下列陈述不正确的是()A.分子可以分解成原子B.原子由原子核和电子构成C.阳离子得到电子变成原子D.原子失去电子变成阴离子【考点】分子和原子的区别和联系;原子的定义与构成;原子和离子的相互转化.【专题】结合课本知识的信息.【分析】根据原子的构成,分子和原子的区别和联系,阴离子和阳离子的概念考虑本题.【解答】解:A、分子和原子的联系是分子是由原子构成的,所以分子可以分解成原子,故A正确;B、原子是由居于原子中心的带正电的原子核和核外带负电的电子构成,故B正确;C、阳离子是失去电子的原子,再得到电子就可能又变成原子了,故C正确;D、原子失去电子变成阳离子,故D错误.故选D.【点评】通过回答本题知道了分子是由原子构成的,原子分为原子核和核外电子,原子失去电子变成阳离子,得到电子变成阴离子.9.某元素负二价阴离子的结构示意图为,则该元素原子所含的质子数为()A.6 B.8 C.10 D.12【考点】原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】根据题意,某元素负二价阴离子的结构示意图为,该阴离子是原子得到两个电子得到的,其核内质子数不变,据此进行分析判断.【解答】解:某元素负二价阴离子的结构示意图为,该离子的核内质子数为8;该阴离子是原子得到两个电子得到的,原子转化为离子的过程中核内质子数不变,则该元素原子所含的质子数为8.故选:B.【点评】本题难度不大,掌握粒子结构示意图的含义、原子和离子的相互转化是正确解答本题的关键.10.下表列出了一些生活中常见元素的原子结构示意图.下列叙述错误的是()A.上表中,8种元素原子的核外电子层数相同B.S、Cl、Ar的原子在化学反应中都易得到电子,形成带负电荷的阴离子C.上表中,非金属元素原子的最外层电子数都大于4个D.从Na到Ar,随着核电荷数的递增,原子核外最外层电子数从1个递增到8个【考点】原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】A、由常见元素的原子结构示意图中的核外电子层数进行分析判断.B、根据S、Cl、Ar的原子的最外层电子数进行分析判断.C、根据表中非金属元素原子的最外层电子数进行分析判断.D、根据从Na到Ar原子核外最外层电子数的排列规律进行分析判断.【解答】解:A、由常见元素的原子结构示意图可知,8种元素原子的核外电子层数相同,均为3层,故选项说法正确.B、S、Cl的最外层电子数分别为6、7,大于4,在化学反应中易得到电子形成阴离子;Ar的原子最外层电子数为8,为稳定结构,不易得失电子;故选项说法错误.C、上表中,非金属元素原子的最外层电子数不一定都大于4个,如硅原子的最外层电子数为4,属于非金属元素,故选项说法错误.D、从Na到Ar,随着核电荷数的递增,原子核外最外层电子数从1个递增到8个,故选项说法正确.故选:BC.【点评】本题难度不大,考查学生对原子结构示意图及其意义的理解,了解原子结构示意图的意义是正确解题的关键.三、能力训练11.据科学家预测,月球的土壤中吸附着百万吨的氦(He﹣3),其原子核中质子数为2、中子数为1,每百吨氦(He﹣3)核聚变所释放出的能量相当于目前人类一年消耗的能量.下列关于氦(He﹣3)元素的说法正确的是()A.原子核外电子数为3 B.相对原子质量为2C.原子结构示意图为D.原子结构示意图为【考点】原子的有关数量计算.【专题】物质的微观构成与物质的宏观组成.【分析】根据原子的相关知识进行解答给题目,主要要用到的知识点:①原子结构示意图是表示原子核电荷数和电子层排布的图示形式②原子结构示意图分层排布规律:第一层最多2个电子,第二层最多8个电子③在原子中,核内质子数=核外电子数④相对原子质量≈质子数+中子数,据此分析即可.【解答】解:A、因为He﹣3原子核内含有2个质子,带两个单位正电荷,由核外电子数=核内质子数可得,核外电子数应为2,故A错误.B、因为其相对原子质量≈质子数+中子数=1+2=3;故B错C、核内质子数为2的He元素的原子结构示意图圆圈中质子数的数值应为2,故C错误.D、原子结构为核内2个质子,核外2个电子,该结构示意图符合该特点且核外电子排布正确,故D 正确.故选D.【点评】了解原子的定义和构成:原子由原子核和核外电子构成,其中原子核由质子和中子构成的;了解核外电子在化学反应中的作用,掌握相对原子质量的概念及其计算.12.某粒子结构示意图为,下列对该粒子的说法中不正确的是()A.核内一定有10个质子B.核外电子是分层排布的C.具有稳定结构D.可能是阳离子或阴离子或稀有气体原子【考点】原子结构示意图与离子结构示意图.【专题】微观粒子模拟图型.【分析】A、在原子结构示意图中,质子数等于核外电子数;而在离子结构示意图中,质子数不等于核外电子数;B、微粒的核原子电子根据电子能量的高低分层排布;C、最外层电子数为8的微粒,具有稳定结构;D、微粒结构示意图中,质子数等于核外电子数时,微粒为原子;质子数大于核外电子数时,微粒为阳离子;质子数小于核外电子数时,微粒为阴离子.【解答】解:A、若微粒为原子,质子数等于核外电子数,核内有10个质子;若微粒为离子,质子数不等于核外电子数,核内质子数一定不是10个;故A不正确;B、微粒的结构示意图表明,核外10个电子分两层排布;故B正确;C、该微粒最外层电子数为8,属于8电子稳定结构;故C正确;D、若X=10,微粒为原子,具有稳定结构,为稀有气体原子;若X>10,微粒为阳离子;若X<10,微粒为阴离子;故D正确;故选A.【点评】微粒的结构示意图中,质子数=核外电子数,微粒为原子;质子数>核外电子数,微粒为阳离子;质子数<核外电子数,微粒为阴离子.13.下列结构示意图,表示阴离子的是()A.B.C.D.【考点】原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】根据当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子;据此进行分析解答.【解答】解:A、质子数=核外电子数=9,为原子,故选项错误.B、质子数=核外电子数=10,为原子,故选项错误.C、质子数=13,核外电子数=10,质子数>核外电子数,为阳离子,故选项错误.D、质子数=16,核外电子数=18,质子数<核外电子数,为阴离子,故选项正确.故选:D.【点评】本题难度不大,考查学生对粒子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.14.下列结构示意图中表示阳离子的是()A.B.C.D.【考点】原子结构示意图与离子结构示意图.【专题】物质的微观构成与物质的宏观组成.【分析】根据当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子;进行解答.【解答】解:A、质子数=核外电子数,为原子结构示意图,故A不符合题意;B、质子数<核外电子数,为阴离子结构示意图,故B不符合题意;C、质子数=核外电子数,为原子结构示意图,故C不符合题意;D、质子数>核外电子数,为阳离子结构示意图,故D符合题意;故选:D.【点评】本题考查学生对原子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.15.原子失去最外层电子或最外层得到电子之后,一定不会引起的改变是()①核外电子总数②化学性质③相对原子质量④粒子的电性⑤原子核⑥电子层数⑦最外层电子数.A.①⑤ B.②⑤ C.③⑤ D.②④⑥【考点】原子和离子的相互转化.【专题】物质的微观构成与物质的宏观组成.【分析】根据原子失去最外层电子或最外层得到电子之后,最外层电子数、核外电子数发生了改变,据此进行分析解答.【解答】解:原子失去最外层电子或最外层得到电子之后,①核外电子总数、⑦最外层电子数、粒子的电性均发生了改变;⑥电子层数可能发生改变,也可能不变.决定元素化学性质的是最外层电子数,由于最外层电子数发生了改变,故化学性质发生了改变.决定相对原子质量的是质子数与中子数,由于原子失去最外层电子或最外层得到电子之后,质子数与中子数没有改变,故相对原子质量不变.原子失去最外层电子或最外层得到电子之后,原子核没有发生改变.故一定不会引起的改变是③⑤.故选:C.【点评】本题难度不大,掌握原子和离子的相互转化并能灵活运用是正确解答本题的关键.16.对于Fe、Fe2+、Fe3+三种粒子的判断正确的是()①核电荷数相同②核外电子数相同③电子层结构完全相同④相对原子质量几乎相等.A.①②③④ B.①③ C.①④ D.②③【考点】原子和离子的相互转化.【专题】物质的微观构成与物质的宏观组成.【分析】1个Fe失去2个电子形成Fe2+,失去3个电子形成Fe3+;元素是质子数(即核电荷数)相同的一类原子的总称,同种元素的粒子是质子数相同;据此结合题意进行分析判断.【解答】解:①1个Fe失去2个电子形成Fe2+,失去3个电子形成Fe3+,它们的核电荷数没有发生改变,它们的核电荷数相同,故选项说法正确.②1个Fe失去2个电子形成Fe2+,失去3个电子形成Fe3+,则Fe3+、Fe2+、Fe三种粒子的核外电子数不同,故选项说法错误.③1个Fe失去2个电子形成Fe2+,失去3个电子形成Fe3+,它们的电子层结构不完全相同,故选项说法错误.④Fe3+、Fe2+、Fe三种粒子的核外电子数不同,而原子的质量主要是集中在原子核上,则三者的质量几乎相等,故选项说法正确.故①④说法正确.故选:C.【点评】本题难度不大,掌握原子和离子的相互转化、原子的构成等是正确解答本题的关键.四、解答题(共3小题,满分0分)17.(1)用数字和化学符号表示:2个氧原子2O,3个钠离子3Na+.(2)镁的原子结构示意图为.Mg原子再化学反应中容易失去(填“得到”或“失去”)2个电子.【考点】化学符号及其周围数字的意义;原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.【解答】解:(1)原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.所以2个氧原子,就可表示为:2O;离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字,故3个钠离子可表示为:3Na+;(2)镁原子核内有12个质子,核外有3个电子层,第一层上有2个电子、第二层上有8个电子,最外层上有2个电子,其原子结构示意图为:;镁原子最外层电子数为2个,小于4,故在化学反应中易失去2个电子;故答案为:(1)2O;3Na+;(2);失去;【点评】本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.18.Na与Na+的比较:(1)Na与Na+的化学性质不同,是因为最外层电子数不同;(2)Na与Na+的质量几乎相等,是因为原子的质量主要集中在原子核上;(3)Na与Na+属于同种元素粒子,是因为核内的质子数相同.【考点】原子和离子的相互转化.【专题】物质的微观构成与物质的宏观组成.【分析】根据同种元素的原子和离子的关系进行分析解答即可.【解答】解:钠原子失去电子最外层电子形成稳定结构,失去电子,核内的质子数不变,因此元素的种类不变,电子的质量很小,因此钠原子和钠离子的质量几乎相等,故填:(1)最外层电子数不同;(2)原子的质量主要集中在原子核上;(3)同种元素,核内的质子数相同.【点评】本题考查的是原子和离子的关系,完成此题,可以依据已有的知识进行.。
九年级化学上册3.2原子的构成同步测试(精品解析)

《3.2原子的构成》一、填空题(共5小题,每小题3分,满分15分)1.原子很小,原子核更小,电子在原子核外很大的空间里作 的运动.科学研究表明,在含有多个电子的原子中,核外电子具有不同的 ,离核近的电子 ,离核越远,电子 .2.核外电子的分层运动又叫做 .到目前为止,人们发现元素原子核外电子的排布中,最少的只有 层,最多的有 层.最外层电子数最多不超过 个(只有1层的,电子不超过 个).3.原子结构示意图表示的意义:以镁原子为例:表示镁原子的核电荷数(质子数)为 ,核外共有 个电子层,第一层上有 个电子,最外层上有 个电子.4.稀有气体的原子最外层有 个电子(氦为 个电子),是一种 的结构,氦、氩等化学性质比较 ;钠、镁等金属的原子最外层电子数一般都 于4个,在化学反应中易 电子;氯、氧等非金属原子的最外层电子数一般都 4个,在化学反应中易 电子,都趋于达到 的结构.5. 叫做离子,原子失去电子会带上 电,叫做 离子,原子得到电子会带上 电,叫做 离子.像氯化钠这种由阴、阳离子相互作用形成的化合物叫做离子化合物.二、基础训练6.某原子的结构示意图为:,下列说法正确的是( )A.该原子中所含的质子数为16B.该原子属于金属元素的原子C.该原子属于非金属元素的原子D.该原子的核外电子数为67.根据钠原子结构示意图不能确定的是( )A.质子数 B.电子层数 C.相对原子质量 D.元素种类8.下列陈述不正确的是( )A.分子可以分解成原子 B.原子由原子核和电子构成C.阳离子得到电子变成原子 D.原子失去电子变成阴离子9.某元素负二价阴离子的结构示意图为,则该元素原子所含的质子数为( )A.6 B.8 C.10 D.1210.下表列出了一些生活中常见元素的原子结构示意图.下列叙述错误的是( )A.上表中,8种元素原子的核外电子层数相同B.S、Cl、Ar的原子在化学反应中都易得到电子,形成带负电荷的阴离子C.上表中,非金属元素原子的最外层电子数都大于4个D.从Na到Ar,随着核电荷数的递增,原子核外最外层电子数从1个递增到8个三、能力训练11.据科学家预测,月球的土壤中吸附着百万吨的氦(He﹣3),其原子核中质子数为2、中子数为1,每百吨氦(He﹣3)核聚变所释放出的能量相当于目前人类一年消耗的能量.下列关于氦(He﹣3)元素的说法正确的是( )A.原子核外电子数为3 B.相对原子质量为2C.原子结构示意图为D.原子结构示意图为12.某粒子结构示意图为,下列对该粒子的说法中不正确的是( )A.核内一定有10个质子B.核外电子是分层排布的C.具有稳定结构D.可能是阳离子或阴离子或稀有气体原子13.下列结构示意图,表示阴离子的是( )A. B. C. D.14.下列结构示意图中表示阳离子的是( )A. B. C. D.15.原子失去最外层电子或最外层得到电子之后,一定不会引起的改变是( )①核外电子总数②化学性质③相对原子质量④粒子的电性⑤原子核⑥电子层数⑦最外层电子数.A.①⑤ B.②⑤ C.③⑤ D.②④⑥16.对于Fe、Fe2+、Fe3+三种粒子的判断正确的是( )①核电荷数相同②核外电子数相同③电子层结构完全相同④相对原子质量几乎相等.A.①②③④ B.①③ C.①④ D.②③四、解答题(共3小题,满分0分)17.(1)用数字和化学符号表示:2个氧原子 ,3个钠离子 .(2)镁的原子结构示意图为 . Mg原子再化学反应中容易 (填“得到”或“失去”)2个电子.18.Na与Na+的比较:(1)Na与Na+的化学性质不同,是因为 ;(2)Na与Na+的质量几乎相等,是因为 ;(3)Na与Na+属于 粒子,是因为 .19.在一个水分子中(H2O),共有 个质子, 个电子.在一个氢氧根离子中(OH﹣),共有 个质子, 个电子.五、迁移拓展20.根据下列几种粒子的结构示意图,回答问题:(1)其中属于阴离子的是 .(填序号,下同)(2)属于金属原子的是 .(3)具有相似化学性质的粒子是 .21.(2016•湘桥区模拟)如图1为某粒子的结构示意图,则(1)该粒子有 个电子层,X的值为 ;(2)该粒子的化学性质与下列(如图2) (填序号)元素的化学性质最相似.新人教版九年级上册《3.2原子的构成》同步练习卷参考答案与试题解析一、填空题(共5小题,每小题3分,满分15分)1.原子很小,原子核更小,电子在原子核外很大的空间里作 高速 的运动.科学研究表明,在含有多个电子的原子中,核外电子具有不同的 能量 ,离核近的电子 能量低 ,离核越远,电子 能量越高 .【考点】原子的定义与构成.【专题】物质的微观构成与物质的宏观组成.【分析】原子很小,原子核更小,电子在原子核外很大的空间里作高速运动;在含有多个电子的原子中,核外电子具有不同的能量;离核近的电子能量低,离核越远,电子能量越高.【解答】解:原子很小,原子核更小,电子在原子核外很大的空间里作高速运动;在含有多个电子的原子中,核外电子具有不同的能量;离核近的电子能量低,离核越远,电子能量越高.故答案为:高速;能量;能量低;能量越高.【点评】解答本题关键是知道原子核外电子的运动情况,和能量高低.2.核外电子的分层运动又叫做 分层排布 .到目前为止,人们发现元素原子核外电子的排布中,最少的只有 一 层,最多的有 七 层.最外层电子数最多不超过 8 个(只有1层的,电子不超过 2 个).【考点】核外电子在化学反应中的作用.【专题】物质的微观构成与物质的宏观组成.【分析】根据核外电子排布的规律分析回答.【解答】解:在含有多个电子的原子中,核外的电子具有不同的运动状态,核外电子的分层运动又叫做分层排布.到目前为止,人们发现元素原子核外电子的排布中,最少的只有一层,最多的有七层.最外层电子数最多不超过8个(只有1层的,电子不超过2个).故答为:分层排布;一;七;8;2.【点评】本题的难度不大,了解核外电子的运动状态及排布规律是解答本题的基础.3.原子结构示意图表示的意义:以镁原子为例:表示镁原子的核电荷数(质子数)为 12 ,核外共有 3 个电子层,第一层上有 2 个电子,最外层上有 2 个电子.【考点】原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层.若最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子.【解答】解:以镁原子为例:表示镁原子的核电荷数(质子数)为12,原子核外有3个电子层,第一层上有2个电子,最外层上有2个电子.答案:12;3;2;2.【点评】本题难度不大,考查学生对原子结构示意图及其意义的理解,了解原子结构示意图的意义是正确解题的关键.4.稀有气体的原子最外层有 8 个电子(氦为 2 个电子),是一种 相对稳定 的结构,氦、氩等化学性质比较 稳定 ;钠、镁等金属的原子最外层电子数一般都 小 于4个,在化学反应中易 失去 电子;氯、氧等非金属原子的最外层电子数一般都 大于 4个,在化学反应中易 得到 电子,都趋于达到 稳定 的结构.【考点】核外电子在化学反应中的作用.【专题】物质的微观构成与物质的宏观组成.【分析】根据已有的原子核外电子的特点进行分析解答即可.【解答】解:稀有气体的原子最外层有8个电子(氦为2个电子),是一种相对稳定的结构,氦、氩等化学性质比较稳定;钠、镁等金属的原子最外层电子数一般都小于4个,在化学反应中易失去电子;氯、氧等非金属原子的最外层电子数一般都大于4个,在化学反应中易得到电子,都趋于达到稳定的结构.故填:8,2,相对稳定,稳定,小,失去,大于,得到,稳定.【点评】本题考查的是原子核外电子的特点,完成此题,可以依据已有的知识进行.5. 带电荷的原子或是原子团 叫做离子,原子失去电子会带上 正 电,叫做 阳 离子,原子得到电子会带上 负 电,叫做 阴 离子.像氯化钠这种由阴、阳离子相互作用形成的化合物叫做离子化合物.【考点】原子和离子的相互转化.【专题】物质的微观构成与物质的宏观组成.【分析】根据已有的离子的形成和离子形成的物质的类别进行分析解答即可.【解答】解:带电荷的原子或是原子团称为离子,原子失去电子形成带正电荷的阳离子,得到电子形成带负电荷的阴离子,由离子形成的化合物称为离子化合物,故填:带电荷的原子或是原子团,正,阳,负,阴.【点评】本题考查的是离子的形成的知识,完成此题,可以依据已有的知识进行.二、基础训练6.某原子的结构示意图为:,下列说法正确的是( )A.该原子中所含的质子数为16B.该原子属于金属元素的原子C.该原子属于非金属元素的原子D.该原子的核外电子数为6【考点】原子结构示意图与离子结构示意图;元素的简单分类.【分析】原子结构示意图圆内数字为原子的质子数、“+”表示原子核带正电;圆外的弧线为电子层、弧线上的数字为该层上的电子数、离圆最近的弧线表示第一层,依次向外为第二层、第三层等;离圆最远的弧线表示最外层.【解答】解:由原子的结构示意图直接得到:原子所含的质子数为8和核外电子数为2+6=8;最外层电子数为6,大于4,所以该原子属于非金属元素的原子.故选C.【点评】金属元素的原子的最外层电子数一般小于4,非金属元素的原子最外层电子数一般大于或等于47.根据钠原子结构示意图不能确定的是( )A.质子数 B.电子层数 C.相对原子质量 D.元素种类【考点】原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】根据原子结构示意图中,圆圈内的数字为原子核内的质子数,圆圈数为电子层数,质子数决定元素种类,元素的相对原子质量=质子数+中子数,进行解答.【解答】解:根据原子结构示意图,该原子核内有11个质子,该原子所表示的元素为钠元素,电子层数为3,综上所述,根据原子的结构示意图,可确定该原子的元素种类、质子数及电子层数,因不能判断该原子的中子数,不能确定元素的相对原子质量.故选C.【点评】本题考查学生对原子结构示意图知识的理解与掌握,并能在解题中灵活应用的能力.8.下列陈述不正确的是( )A.分子可以分解成原子 B.原子由原子核和电子构成C.阳离子得到电子变成原子 D.原子失去电子变成阴离子【考点】分子和原子的区别和联系;原子的定义与构成;原子和离子的相互转化.【专题】结合课本知识的信息.【分析】根据原子的构成,分子和原子的区别和联系,阴离子和阳离子的概念考虑本题.【解答】解:A、分子和原子的联系是分子是由原子构成的,所以分子可以分解成原子,故A正确;B、原子是由居于原子中心的带正电的原子核和核外带负电的电子构成,故B正确;C、阳离子是失去电子的原子,再得到电子就可能又变成原子了,故C正确;D、原子失去电子变成阳离子,故D错误.故选D.【点评】通过回答本题知道了分子是由原子构成的,原子分为原子核和核外电子,原子失去电子变成阳离子,得到电子变成阴离子.9.某元素负二价阴离子的结构示意图为,则该元素原子所含的质子数为( )A.6 B.8 C.10 D.12【考点】原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】根据题意,某元素负二价阴离子的结构示意图为,该阴离子是原子得到两个电子得到的,其核内质子数不变,据此进行分析判断.【解答】解:某元素负二价阴离子的结构示意图为,该离子的核内质子数为8;该阴离子是原子得到两个电子得到的,原子转化为离子的过程中核内质子数不变,则该元素原子所含的质子数为8.故选:B.【点评】本题难度不大,掌握粒子结构示意图的含义、原子和离子的相互转化是正确解答本题的关键.10.下表列出了一些生活中常见元素的原子结构示意图.下列叙述错误的是( )A.上表中,8种元素原子的核外电子层数相同B.S、Cl、Ar的原子在化学反应中都易得到电子,形成带负电荷的阴离子C.上表中,非金属元素原子的最外层电子数都大于4个D.从Na到Ar,随着核电荷数的递增,原子核外最外层电子数从1个递增到8个【考点】原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】A、由常见元素的原子结构示意图中的核外电子层数进行分析判断.B、根据S、Cl、Ar的原子的最外层电子数进行分析判断.C、根据表中非金属元素原子的最外层电子数进行分析判断.D、根据从Na到Ar原子核外最外层电子数的排列规律进行分析判断.【解答】解:A、由常见元素的原子结构示意图可知,8种元素原子的核外电子层数相同,均为3层,故选项说法正确.B、S、Cl的最外层电子数分别为6、7,大于4,在化学反应中易得到电子形成阴离子;Ar的原子最外层电子数为8,为稳定结构,不易得失电子;故选项说法错误.C、上表中,非金属元素原子的最外层电子数不一定都大于4个,如硅原子的最外层电子数为4,属于非金属元素,故选项说法错误.D、从Na到Ar,随着核电荷数的递增,原子核外最外层电子数从1个递增到8个,故选项说法正确.故选:BC.【点评】本题难度不大,考查学生对原子结构示意图及其意义的理解,了解原子结构示意图的意义是正确解题的关键.三、能力训练11.据科学家预测,月球的土壤中吸附着百万吨的氦(He﹣3),其原子核中质子数为2、中子数为1,每百吨氦(He﹣3)核聚变所释放出的能量相当于目前人类一年消耗的能量.下列关于氦(He﹣3)元素的说法正确的是( )A.原子核外电子数为3 B.相对原子质量为2C.原子结构示意图为D.原子结构示意图为【考点】原子的有关数量计算.【专题】物质的微观构成与物质的宏观组成.【分析】根据原子的相关知识进行解答给题目,主要要用到的知识点:①原子结构示意图是表示原子核电荷数和电子层排布的图示形式②原子结构示意图分层排布规律:第一层最多2个电子,第二层最多8个电子③在原子中,核内质子数=核外电子数④相对原子质量≈质子数+中子数,据此分析即可.【解答】解:A、因为He﹣3原子核内含有2个质子,带两个单位正电荷,由核外电子数=核内质子数可得,核外电子数应为2,故A错误.B、因为其相对原子质量≈质子数+中子数=1+2=3;故B错C、核内质子数为2的He元素的原子结构示意图圆圈中质子数的数值应为2,故C错误.D、原子结构为核内2个质子,核外2个电子,该结构示意图符合该特点且核外电子排布正确,故D正确.故选D.【点评】了解原子的定义和构成:原子由原子核和核外电子构成,其中原子核由质子和中子构成的;了解核外电子在化学反应中的作用,掌握相对原子质量的概念及其计算.12.某粒子结构示意图为,下列对该粒子的说法中不正确的是( )A.核内一定有10个质子B.核外电子是分层排布的C.具有稳定结构D.可能是阳离子或阴离子或稀有气体原子【考点】原子结构示意图与离子结构示意图.【专题】微观粒子模拟图型.【分析】A、在原子结构示意图中,质子数等于核外电子数;而在离子结构示意图中,质子数不等于核外电子数;B、微粒的核原子电子根据电子能量的高低分层排布;C、最外层电子数为8的微粒,具有稳定结构;D、微粒结构示意图中,质子数等于核外电子数时,微粒为原子;质子数大于核外电子数时,微粒为阳离子;质子数小于核外电子数时,微粒为阴离子.【解答】解:A、若微粒为原子,质子数等于核外电子数,核内有10个质子;若微粒为离子,质子数不等于核外电子数,核内质子数一定不是10个;故A不正确;B、微粒的结构示意图表明,核外10个电子分两层排布;故B正确;C、该微粒最外层电子数为8,属于8电子稳定结构;故C正确;D、若X=10,微粒为原子,具有稳定结构,为稀有气体原子;若X>10,微粒为阳离子;若X<10,微粒为阴离子;故D正确;故选A.【点评】微粒的结构示意图中,质子数=核外电子数,微粒为原子;质子数>核外电子数,微粒为阳离子;质子数<核外电子数,微粒为阴离子.13.下列结构示意图,表示阴离子的是( )A. B. C. D.【考点】原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】根据当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子;据此进行分析解答.【解答】解:A、质子数=核外电子数=9,为原子,故选项错误.B、质子数=核外电子数=10,为原子,故选项错误.C、质子数=13,核外电子数=10,质子数>核外电子数,为阳离子,故选项错误.D、质子数=16,核外电子数=18,质子数<核外电子数,为阴离子,故选项正确.故选:D.【点评】本题难度不大,考查学生对粒子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.14.下列结构示意图中表示阳离子的是( )A. B. C. D.【考点】原子结构示意图与离子结构示意图.【专题】物质的微观构成与物质的宏观组成.【分析】根据当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子;进行解答.【解答】解:A、质子数=核外电子数,为原子结构示意图,故A不符合题意;B、质子数<核外电子数,为阴离子结构示意图,故B不符合题意;C、质子数=核外电子数,为原子结构示意图,故C不符合题意;D、质子数>核外电子数,为阳离子结构示意图,故D符合题意;故选:D.【点评】本题考查学生对原子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.15.原子失去最外层电子或最外层得到电子之后,一定不会引起的改变是( )①核外电子总数②化学性质③相对原子质量④粒子的电性⑤原子核⑥电子层数⑦最外层电子数.A.①⑤ B.②⑤ C.③⑤ D.②④⑥【考点】原子和离子的相互转化.【专题】物质的微观构成与物质的宏观组成.【分析】根据原子失去最外层电子或最外层得到电子之后,最外层电子数、核外电子数发生了改变,据此进行分析解答.【解答】解:原子失去最外层电子或最外层得到电子之后,①核外电子总数、⑦最外层电子数、粒子的电性均发生了改变;⑥电子层数可能发生改变,也可能不变.决定元素化学性质的是最外层电子数,由于最外层电子数发生了改变,故化学性质发生了改变.决定相对原子质量的是质子数与中子数,由于原子失去最外层电子或最外层得到电子之后,质子数与中子数没有改变,故相对原子质量不变.原子失去最外层电子或最外层得到电子之后,原子核没有发生改变.故一定不会引起的改变是③⑤.故选:C.【点评】本题难度不大,掌握原子和离子的相互转化并能灵活运用是正确解答本题的关键.16.对于Fe、Fe2+、Fe3+三种粒子的判断正确的是( )①核电荷数相同②核外电子数相同③电子层结构完全相同④相对原子质量几乎相等.A.①②③④ B.①③ C.①④ D.②③【考点】原子和离子的相互转化.【专题】物质的微观构成与物质的宏观组成.【分析】1个Fe失去2个电子形成Fe2+,失去3个电子形成Fe3+;元素是质子数(即核电荷数)相同的一类原子的总称,同种元素的粒子是质子数相同;据此结合题意进行分析判断.【解答】解:①1个Fe失去2个电子形成Fe2+,失去3个电子形成Fe3+,它们的核电荷数没有发生改变,它们的核电荷数相同,故选项说法正确.②1个Fe失去2个电子形成Fe2+,失去3个电子形成Fe3+,则Fe3+、Fe2+、Fe三种粒子的核外电子数不同,故选项说法错误.③1个Fe失去2个电子形成Fe2+,失去3个电子形成Fe3+,它们的电子层结构不完全相同,故选项说法错误.④Fe3+、Fe2+、Fe三种粒子的核外电子数不同,而原子的质量主要是集中在原子核上,则三者的质量几乎相等,故选项说法正确.故①④说法正确.故选:C.【点评】本题难度不大,掌握原子和离子的相互转化、原子的构成等是正确解答本题的关键.四、解答题(共3小题,满分0分)17.(1)用数字和化学符号表示:2个氧原子 2O ,3个钠离子 3Na+ .(2)镁的原子结构示意图为 . Mg原子再化学反应中容易 失去 (填“得到”或“失去”)2个电子.【考点】化学符号及其周围数字的意义;原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.【解答】解:(1)原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.所以2个氧原子,就可表示为:2O;离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字,故3个钠离子可表示为:3Na+;(2)镁原子核内有12个质子,核外有3个电子层,第一层上有2个电子、第二层上有8个电子,最外层上有2个电子,其原子结构示意图为:;镁原子最外层电子数为2个,小于4,故在化学反应中易失去2个电子;故答案为:(1)2O;3Na+;(2);失去;【点评】本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.18.Na与Na+的比较:(1)Na与Na+的化学性质不同,是因为 最外层电子数不同 ;(2)Na与Na+的质量几乎相等,是因为 原子的质量主要集中在原子核上 ;(3)Na与Na+属于 同种元素 粒子,是因为 核内的质子数相同 .【考点】原子和离子的相互转化.【专题】物质的微观构成与物质的宏观组成.【分析】根据同种元素的原子和离子的关系进行分析解答即可.【解答】解:钠原子失去电子最外层电子形成稳定结构,失去电子,核内的质子数不变,因此元素的种类不变,电子的质量很小,因此钠原子和钠离子的质量几乎相等,故填:(1)最外层电子数不同;(2)原子的质量主要集中在原子核上;(3)同种元素,核内的质子数相同.【点评】本题考查的是原子和离子的关系,完成此题,可以依据已有的知识进行.19.在一个水分子中(H2O),共有 10 个质子, 10 个电子.在一个氢氧根离子中(OH﹣),共有 9 个质子, 10 个电子.【考点】分子和原子的区别和联系;原子和离子的相互转化.【专题】物质的微观构成与物质的宏观组成.【分析】根据水分子、氢氧根离子的构成以及核电荷数与核内质子数、电子数的关系进行分析解答.【解答】解:一个水分子是由两个氢原子和一个氧原子构成的,氢原子的核电荷数是1,核内的质子数是1,氧原子的核电荷数是8,核内的质子数是8,故一个水分子共有质子数是:1×2+8=10,分子中质子数等于核外电子数,所以电子数也为10;在一个氢氧根离子中,一个氢原子和一个氧原子构成的,氢原子的核电荷数是1,核内的质子数是1,氧原子的核电荷数是8,质子数是8,所以氢氧根离子核内的质子数是1+8=9,氢氧根离子中(OH﹣)是得到1个电子后形成,所以电子数9+1=10.故答案为:10;10;9;10.【点评】本题难度不大,掌握化分子与离子的构成是正确解答本题的关键.五、迁移拓展20.根据下列几种粒子的结构示意图,回答问题:。
人教版九年级化学上册第三单元 课题2 原子的结构 习题精选 同步训练(含答案)

资料二:2012年8月16日“嫦娥一号”从月球返回信息表明,月球中含有丰富3He(3表示相对原子质量),同时测了月球上14种元素的含量和分布:K、Th(钍)、U(铀)、O、Si、Mg、Al、Ca、Fe、Ti(钛)、Na、Mn(锰)、Cr(铬)、Gd(钆)。
(2)在化学反应中容易得到电子的是_____________。
三、材料分析题
1、人们为揭示原子结构的奥秘,经历了漫长的探究过程。1897年汤姆生发现电子并提出类似“西瓜”的原子模型。1911年卢瑟福等人为探索原子的内部结构又进行了下面的实验:用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔,发现:①大多数α粒子能穿透金箔而不改变原来的运动方向;②一小部分α粒子改变了原来的运动方向;③有极少数α粒子被弹了回来。如图所示。
2、写出下列各式中数字表示的意义。
(1) 中最内层的“2”表示____________________;
(2)2Ca2+中前面的“2”表示____________________;
(3)Ca2+右上角的“2”表示____________________。
3、根据下列粒子的结构示意图回答问题:
(1)属于相对稳定结构的是_____________(填序号,下同),其中失去最外层电子达到稳定结构的是_____________,得到电子达到稳定结构的是_____________;
请结合上述材料回答:
(1)“嫦娥一号”从月球返回信息表明,月球中含有丰富He-3原子,它可能成为未来核能的重要原料。He-3原子核内( )
新人教版九年级(上)《3.2 原子的结构》同步练习卷(2)

得到一个 H+,形成水合氢离子(H3O+).下列对上述过程的描述不合理的是( ) A.元素的种类没有变
B.微粒的组成发生了改变
C.微粒的化学性质发生了改变
D.12.(3 分)科学家设想宇宙中可能存在完全由反粒子构成的物质﹣﹣反物质,物质与反物
质相遇会释放出巨大的能量,在能源研究领域中前景可观.正电子、负质子等都是反粒
原子;氮气,氮气由氮元素组成,1 个氮分子,1 个氮分子由 2 个氮原子构成;2 个氮原子;
2 个氮分子;每个水分子中含有 2 个氢原子; 20.道尔顿;阿伏伽德罗;汤姆生; 21.铁
原子;碳原子;水分子;碳原子和氧原子;6 个氧原子;氩原子;
三、简答题
22.
; 23.
;
声明:试题解析著 作权属菁优网 所有,未经书 面同意,不得 复制发布
日期:2019/4/8 5 :05:27;用 户:qgjyus er1054 8;邮箱:qg jyus er10548.21957 750;学号:2 1985556
第5页(共5页)
13.(3 分)碳的原子量是( )
A.12 克
B.12
C.1.993×10﹣26 千克
D. 克
14.(3 分)在原子中( ) A.质子数一定等于中子数 B.质子数不一定等于电子数
第2页(共5页)
C.质子数、中子数、电子数三者都相等 D.原子核所带电量跟核外电子的电量相等 15.(3 分)下列关于原子的叙述正确的是( ) A.物质都是由原子构成的 B.原子是由质子和电子构成的 C.原子是由质子和中子构成的 D.原子是由原子核和核外电子构成的 二、填空题
20.(3 分)英国科学家
于 19 世纪提出了近代原子学说;意大利的科学家
九年级化学上册3.2原子的构成同步测试(含参考答案)

《3.2原子的构成》一、填空题(共5小题,每小题3分,满分15分)1.原子很小,原子核更小,电子在原子核外很大的空间里作 的运动.科学研究表明,在含有多个电子的原子中,核外电子具有不同的 ,离核近的电子 ,离核越远,电子 .2.核外电子的分层运动又叫做 .到目前为止,人们发现元素原子核外电子的排布中,最少的只有 层,最多的有 层.最外层电子数最多不超过 个(只有1层的,电子不超过 个).3.原子结构示意图表示的意义:以镁原子为例:表示镁原子的核电荷数(质子数)为 ,核外共有 个电子层,第一层上有 个电子,最外层上有 个电子.4.稀有气体的原子最外层有 个电子(氦为 个电子),是一种 的结构,氦、氩等化学性质比较 ;钠、镁等金属的原子最外层电子数一般都 于4个,在化学反应中易 电子;氯、氧等非金属原子的最外层电子数一般都 4个,在化学反应中易 电子,都趋于达到 的结构.5. 叫做离子,原子失去电子会带上 电,叫做 离子,原子得到电子会带上 电,叫做 离子.像氯化钠这种由阴、阳离子相互作用形成的化合物叫做离子化合物.二、基础训练6.某原子的结构示意图为:,下列说法正确的是( )A.该原子中所含的质子数为16B.该原子属于金属元素的原子C.该原子属于非金属元素的原子D.该原子的核外电子数为67.根据钠原子结构示意图不能确定的是( )A.质子数 B.电子层数 C.相对原子质量 D.元素种类8.下列陈述不正确的是( )A.分子可以分解成原子 B.原子由原子核和电子构成C.阳离子得到电子变成原子 D.原子失去电子变成阴离子9.某元素负二价阴离子的结构示意图为,则该元素原子所含的质子数为( )A.6 B.8 C.10 D.1210.下表列出了一些生活中常见元素的原子结构示意图.下列叙述错误的是( )A.上表中,8种元素原子的核外电子层数相同B.S、Cl、Ar的原子在化学反应中都易得到电子,形成带负电荷的阴离子C.上表中,非金属元素原子的最外层电子数都大于4个D.从Na到Ar,随着核电荷数的递增,原子核外最外层电子数从1个递增到8个三、能力训练11.据科学家预测,月球的土壤中吸附着百万吨的氦(He﹣3),其原子核中质子数为2、中子数为1,每百吨氦(He﹣3)核聚变所释放出的能量相当于目前人类一年消耗的能量.下列关于氦(He﹣3)元素的说法正确的是( )A.原子核外电子数为3 B.相对原子质量为2C.原子结构示意图为D.原子结构示意图为12.某粒子结构示意图为,下列对该粒子的说法中不正确的是( )A.核内一定有10个质子B.核外电子是分层排布的C.具有稳定结构D.可能是阳离子或阴离子或稀有气体原子13.下列结构示意图,表示阴离子的是( )A. B. C. D.14.下列结构示意图中表示阳离子的是( )A. B. C. D.15.原子失去最外层电子或最外层得到电子之后,一定不会引起的改变是( )①核外电子总数②化学性质③相对原子质量④粒子的电性⑤原子核⑥电子层数⑦最外层电子数.A.①⑤ B.②⑤ C.③⑤ D.②④⑥16.对于Fe、Fe2+、Fe3+三种粒子的判断正确的是( )①核电荷数相同②核外电子数相同③电子层结构完全相同④相对原子质量几乎相等.A.①②③④ B.①③ C.①④ D.②③四、解答题(共3小题,满分0分)17.(1)用数字和化学符号表示:2个氧原子 ,3个钠离子 .(2)镁的原子结构示意图为 . Mg原子再化学反应中容易 (填“得到”或“失去”)2个电子.18.Na与Na+的比较:(1)Na与Na+的化学性质不同,是因为 ;(2)Na与Na+的质量几乎相等,是因为 ;(3)Na与Na+属于 粒子,是因为 .19.在一个水分子中(H2O),共有 个质子, 个电子.在一个氢氧根离子中(OH﹣),共有 个质子, 个电子.五、迁移拓展20.根据下列几种粒子的结构示意图,回答问题:(1)其中属于阴离子的是 .(填序号,下同)(2)属于金属原子的是 .(3)具有相似化学性质的粒子是 .21.(2016•湘桥区模拟)如图1为某粒子的结构示意图,则(1)该粒子有 个电子层,X的值为 ;(2)该粒子的化学性质与下列(如图2) (填序号)元素的化学性质最相似.新人教版九年级上册《3.2原子的构成》同步练习卷参考答案与试题解析一、填空题(共5小题,每小题3分,满分15分)1.原子很小,原子核更小,电子在原子核外很大的空间里作 高速 的运动.科学研究表明,在含有多个电子的原子中,核外电子具有不同的 能量 ,离核近的电子 能量低 ,离核越远,电子 能量越高 .【考点】原子的定义与构成.【专题】物质的微观构成与物质的宏观组成.【分析】原子很小,原子核更小,电子在原子核外很大的空间里作高速运动;在含有多个电子的原子中,核外电子具有不同的能量;离核近的电子能量低,离核越远,电子能量越高.【解答】解:原子很小,原子核更小,电子在原子核外很大的空间里作高速运动;在含有多个电子的原子中,核外电子具有不同的能量;离核近的电子能量低,离核越远,电子能量越高.故答案为:高速;能量;能量低;能量越高.【点评】解答本题关键是知道原子核外电子的运动情况,和能量高低.2.核外电子的分层运动又叫做 分层排布 .到目前为止,人们发现元素原子核外电子的排布中,最少的只有 一 层,最多的有 七 层.最外层电子数最多不超过 8 个(只有1层的,电子不超过 2 个).【考点】核外电子在化学反应中的作用.【专题】物质的微观构成与物质的宏观组成.【分析】根据核外电子排布的规律分析回答.【解答】解:在含有多个电子的原子中,核外的电子具有不同的运动状态,核外电子的分层运动又叫做分层排布.到目前为止,人们发现元素原子核外电子的排布中,最少的只有一层,最多的有七层.最外层电子数最多不超过8个(只有1层的,电子不超过2个).故答为:分层排布;一;七;8;2.【点评】本题的难度不大,了解核外电子的运动状态及排布规律是解答本题的基础.3.原子结构示意图表示的意义:以镁原子为例:表示镁原子的核电荷数(质子数)为 12 ,核外共有 3 个电子层,第一层上有 2 个电子,最外层上有 2 个电子.【考点】原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】原子结构示意图中,圆圈内数字表示核内质子数,弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层.若最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子.【解答】解:以镁原子为例:表示镁原子的核电荷数(质子数)为12,原子核外有3个电子层,第一层上有2个电子,最外层上有2个电子.答案:12;3;2;2.【点评】本题难度不大,考查学生对原子结构示意图及其意义的理解,了解原子结构示意图的意义是正确解题的关键.4.稀有气体的原子最外层有 8 个电子(氦为 2 个电子),是一种 相对稳定 的结构,氦、氩等化学性质比较 稳定 ;钠、镁等金属的原子最外层电子数一般都 小 于4个,在化学反应中易 失去 电子;氯、氧等非金属原子的最外层电子数一般都 大于 4个,在化学反应中易 得到 电子,都趋于达到 稳定 的结构.【考点】核外电子在化学反应中的作用.【专题】物质的微观构成与物质的宏观组成.【分析】根据已有的原子核外电子的特点进行分析解答即可.【解答】解:稀有气体的原子最外层有8个电子(氦为2个电子),是一种相对稳定的结构,氦、氩等化学性质比较稳定;钠、镁等金属的原子最外层电子数一般都小于4个,在化学反应中易失去电子;氯、氧等非金属原子的最外层电子数一般都大于4个,在化学反应中易得到电子,都趋于达到稳定的结构.故填:8,2,相对稳定,稳定,小,失去,大于,得到,稳定.【点评】本题考查的是原子核外电子的特点,完成此题,可以依据已有的知识进行.5. 带电荷的原子或是原子团 叫做离子,原子失去电子会带上 正 电,叫做 阳 离子,原子得到电子会带上 负 电,叫做 阴 离子.像氯化钠这种由阴、阳离子相互作用形成的化合物叫做离子化合物.【考点】原子和离子的相互转化.【专题】物质的微观构成与物质的宏观组成.【分析】根据已有的离子的形成和离子形成的物质的类别进行分析解答即可.【解答】解:带电荷的原子或是原子团称为离子,原子失去电子形成带正电荷的阳离子,得到电子形成带负电荷的阴离子,由离子形成的化合物称为离子化合物,故填:带电荷的原子或是原子团,正,阳,负,阴.【点评】本题考查的是离子的形成的知识,完成此题,可以依据已有的知识进行.二、基础训练6.某原子的结构示意图为:,下列说法正确的是( )A.该原子中所含的质子数为16B.该原子属于金属元素的原子C.该原子属于非金属元素的原子D.该原子的核外电子数为6【考点】原子结构示意图与离子结构示意图;元素的简单分类.【分析】原子结构示意图圆内数字为原子的质子数、“+”表示原子核带正电;圆外的弧线为电子层、弧线上的数字为该层上的电子数、离圆最近的弧线表示第一层,依次向外为第二层、第三层等;离圆最远的弧线表示最外层.【解答】解:由原子的结构示意图直接得到:原子所含的质子数为8和核外电子数为2+6=8;最外层电子数为6,大于4,所以该原子属于非金属元素的原子.故选C.【点评】金属元素的原子的最外层电子数一般小于4,非金属元素的原子最外层电子数一般大于或等于4 7.根据钠原子结构示意图不能确定的是( )A.质子数 B.电子层数 C.相对原子质量 D.元素种类【考点】原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】根据原子结构示意图中,圆圈内的数字为原子核内的质子数,圆圈数为电子层数,质子数决定元素种类,元素的相对原子质量=质子数+中子数,进行解答.【解答】解:根据原子结构示意图,该原子核内有11个质子,该原子所表示的元素为钠元素,电子层数为3,综上所述,根据原子的结构示意图,可确定该原子的元素种类、质子数及电子层数,因不能判断该原子的中子数,不能确定元素的相对原子质量.故选C.【点评】本题考查学生对原子结构示意图知识的理解与掌握,并能在解题中灵活应用的能力.8.下列陈述不正确的是( )A.分子可以分解成原子 B.原子由原子核和电子构成C.阳离子得到电子变成原子 D.原子失去电子变成阴离子【考点】分子和原子的区别和联系;原子的定义与构成;原子和离子的相互转化.【专题】结合课本知识的信息.【分析】根据原子的构成,分子和原子的区别和联系,阴离子和阳离子的概念考虑本题.【解答】解:A、分子和原子的联系是分子是由原子构成的,所以分子可以分解成原子,故A正确;B、原子是由居于原子中心的带正电的原子核和核外带负电的电子构成,故B正确;C、阳离子是失去电子的原子,再得到电子就可能又变成原子了,故C正确;D、原子失去电子变成阳离子,故D错误.故选D.【点评】通过回答本题知道了分子是由原子构成的,原子分为原子核和核外电子,原子失去电子变成阳离子,得到电子变成阴离子.9.某元素负二价阴离子的结构示意图为,则该元素原子所含的质子数为( )A.6 B.8 C.10 D.12【考点】原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】根据题意,某元素负二价阴离子的结构示意图为,该阴离子是原子得到两个电子得到的,其核内质子数不变,据此进行分析判断.【解答】解:某元素负二价阴离子的结构示意图为,该离子的核内质子数为8;该阴离子是原子得到两个电子得到的,原子转化为离子的过程中核内质子数不变,则该元素原子所含的质子数为8.故选:B.【点评】本题难度不大,掌握粒子结构示意图的含义、原子和离子的相互转化是正确解答本题的关键.10.下表列出了一些生活中常见元素的原子结构示意图.下列叙述错误的是( )A.上表中,8种元素原子的核外电子层数相同B.S、Cl、Ar的原子在化学反应中都易得到电子,形成带负电荷的阴离子C.上表中,非金属元素原子的最外层电子数都大于4个D.从Na到Ar,随着核电荷数的递增,原子核外最外层电子数从1个递增到8个【考点】原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】A、由常见元素的原子结构示意图中的核外电子层数进行分析判断.B、根据S、Cl、Ar的原子的最外层电子数进行分析判断.C、根据表中非金属元素原子的最外层电子数进行分析判断.D、根据从Na到Ar原子核外最外层电子数的排列规律进行分析判断.【解答】解:A、由常见元素的原子结构示意图可知,8种元素原子的核外电子层数相同,均为3层,故选项说法正确.B、S、Cl的最外层电子数分别为6、7,大于4,在化学反应中易得到电子形成阴离子;Ar的原子最外层电子数为8,为稳定结构,不易得失电子;故选项说法错误.C、上表中,非金属元素原子的最外层电子数不一定都大于4个,如硅原子的最外层电子数为4,属于非金属元素,故选项说法错误.D、从Na到Ar,随着核电荷数的递增,原子核外最外层电子数从1个递增到8个,故选项说法正确.故选:BC.【点评】本题难度不大,考查学生对原子结构示意图及其意义的理解,了解原子结构示意图的意义是正确解题的关键.三、能力训练11.据科学家预测,月球的土壤中吸附着百万吨的氦(He﹣3),其原子核中质子数为2、中子数为1,每百吨氦(He﹣3)核聚变所释放出的能量相当于目前人类一年消耗的能量.下列关于氦(He﹣3)元素的说法正确的是( )A.原子核外电子数为3 B.相对原子质量为2C.原子结构示意图为D.原子结构示意图为【考点】原子的有关数量计算.【专题】物质的微观构成与物质的宏观组成.【分析】根据原子的相关知识进行解答给题目,主要要用到的知识点:①原子结构示意图是表示原子核电荷数和电子层排布的图示形式②原子结构示意图分层排布规律:第一层最多2个电子,第二层最多8个电子③在原子中,核内质子数=核外电子数④相对原子质量≈质子数+中子数,据此分析即可.【解答】解:A、因为He﹣3原子核内含有2个质子,带两个单位正电荷,由核外电子数=核内质子数可得,核外电子数应为2,故A错误.B、因为其相对原子质量≈质子数+中子数=1+2=3;故B错C、核内质子数为2的He元素的原子结构示意图圆圈中质子数的数值应为2,故C错误.D、原子结构为核内2个质子,核外2个电子,该结构示意图符合该特点且核外电子排布正确,故D正确.故选D.【点评】了解原子的定义和构成:原子由原子核和核外电子构成,其中原子核由质子和中子构成的;了解核外电子在化学反应中的作用,掌握相对原子质量的概念及其计算.12.某粒子结构示意图为,下列对该粒子的说法中不正确的是( )A.核内一定有10个质子B.核外电子是分层排布的C.具有稳定结构D.可能是阳离子或阴离子或稀有气体原子【考点】原子结构示意图与离子结构示意图.【专题】微观粒子模拟图型.【分析】A、在原子结构示意图中,质子数等于核外电子数;而在离子结构示意图中,质子数不等于核外电子数;B、微粒的核原子电子根据电子能量的高低分层排布;C、最外层电子数为8的微粒,具有稳定结构;D、微粒结构示意图中,质子数等于核外电子数时,微粒为原子;质子数大于核外电子数时,微粒为阳离子;质子数小于核外电子数时,微粒为阴离子.【解答】解:A、若微粒为原子,质子数等于核外电子数,核内有10个质子;若微粒为离子,质子数不等于核外电子数,核内质子数一定不是10个;故A不正确;B、微粒的结构示意图表明,核外10个电子分两层排布;故B正确;C、该微粒最外层电子数为8,属于8电子稳定结构;故C正确;D、若X=10,微粒为原子,具有稳定结构,为稀有气体原子;若X>10,微粒为阳离子;若X<10,微粒为阴离子;故D正确;故选A.【点评】微粒的结构示意图中,质子数=核外电子数,微粒为原子;质子数>核外电子数,微粒为阳离子;质子数<核外电子数,微粒为阴离子.13.下列结构示意图,表示阴离子的是( )A. B. C. D.【考点】原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】根据当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子;据此进行分析解答.【解答】解:A、质子数=核外电子数=9,为原子,故选项错误.B、质子数=核外电子数=10,为原子,故选项错误.C、质子数=13,核外电子数=10,质子数>核外电子数,为阳离子,故选项错误.D、质子数=16,核外电子数=18,质子数<核外电子数,为阴离子,故选项正确.故选:D.【点评】本题难度不大,考查学生对粒子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.14.下列结构示意图中表示阳离子的是( )A. B. C. D.【考点】原子结构示意图与离子结构示意图.【专题】物质的微观构成与物质的宏观组成.【分析】根据当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子;进行解答.【解答】解:A、质子数=核外电子数,为原子结构示意图,故A不符合题意;B、质子数<核外电子数,为阴离子结构示意图,故B不符合题意;C、质子数=核外电子数,为原子结构示意图,故C不符合题意;D、质子数>核外电子数,为阳离子结构示意图,故D符合题意;故选:D.【点评】本题考查学生对原子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.15.原子失去最外层电子或最外层得到电子之后,一定不会引起的改变是( )①核外电子总数②化学性质③相对原子质量④粒子的电性⑤原子核⑥电子层数⑦最外层电子数.A.①⑤ B.②⑤ C.③⑤ D.②④⑥【考点】原子和离子的相互转化.【专题】物质的微观构成与物质的宏观组成.【分析】根据原子失去最外层电子或最外层得到电子之后,最外层电子数、核外电子数发生了改变,据此进行分析解答.【解答】解:原子失去最外层电子或最外层得到电子之后,①核外电子总数、⑦最外层电子数、粒子的电性均发生了改变;⑥电子层数可能发生改变,也可能不变.决定元素化学性质的是最外层电子数,由于最外层电子数发生了改变,故化学性质发生了改变.决定相对原子质量的是质子数与中子数,由于原子失去最外层电子或最外层得到电子之后,质子数与中子数没有改变,故相对原子质量不变.原子失去最外层电子或最外层得到电子之后,原子核没有发生改变.故一定不会引起的改变是③⑤.故选:C.【点评】本题难度不大,掌握原子和离子的相互转化并能灵活运用是正确解答本题的关键.16.对于Fe、Fe2+、Fe3+三种粒子的判断正确的是( )①核电荷数相同②核外电子数相同③电子层结构完全相同④相对原子质量几乎相等.A.①②③④ B.①③ C.①④ D.②③【考点】原子和离子的相互转化.【专题】物质的微观构成与物质的宏观组成.【分析】1个Fe失去2个电子形成Fe2+,失去3个电子形成Fe3+;元素是质子数(即核电荷数)相同的一类原子的总称,同种元素的粒子是质子数相同;据此结合题意进行分析判断.【解答】解:①1个Fe失去2个电子形成Fe2+,失去3个电子形成Fe3+,它们的核电荷数没有发生改变,它们的核电荷数相同,故选项说法正确.②1个Fe失去2个电子形成Fe2+,失去3个电子形成Fe3+,则Fe3+、Fe2+、Fe三种粒子的核外电子数不同,故选项说法错误.③1个Fe失去2个电子形成Fe2+,失去3个电子形成Fe3+,它们的电子层结构不完全相同,故选项说法错误.④Fe3+、Fe2+、Fe三种粒子的核外电子数不同,而原子的质量主要是集中在原子核上,则三者的质量几乎相等,故选项说法正确.故①④说法正确.故选:C.【点评】本题难度不大,掌握原子和离子的相互转化、原子的构成等是正确解答本题的关键.四、解答题(共3小题,满分0分)17.(1)用数字和化学符号表示:2个氧原子 2O ,3个钠离子 3Na+ .(2)镁的原子结构示意图为 . Mg原子再化学反应中容易 失去 (填“得到”或“失去”)2个电子.【考点】化学符号及其周围数字的意义;原子结构示意图与离子结构示意图.【专题】化学用语和质量守恒定律.【分析】本题考查化学用语的意义及书写,解题关键是分清化学用语所表达的对象是分子、原子、离子还是化合价,才能在化学符号前或其它位置加上适当的计量数来完整地表达其意义,并能根据物质化学式的书写规则正确书写物质的化学式,才能熟练准确的解答此类题目.【解答】解:(1)原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.所以2个氧原子,就可表示为:2O;离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字,故3个钠离子可表示为:3Na+;(2)镁原子核内有12个质子,核外有3个电子层,第一层上有2个电子、第二层上有8个电子,最外层上有2个电子,其原子结构示意图为:;镁原子最外层电子数为2个,小于4,故在化学反应中易失去2个电子;故答案为:(1)2O;3Na+;(2);失去;【点评】本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度较易.18.Na与Na+的比较:(1)Na与Na+的化学性质不同,是因为 最外层电子数不同 ;(2)Na与Na+的质量几乎相等,是因为 原子的质量主要集中在原子核上 ;(3)Na与Na+属于 同种元素 粒子,是因为 核内的质子数相同 .【考点】原子和离子的相互转化.【专题】物质的微观构成与物质的宏观组成.【分析】根据同种元素的原子和离子的关系进行分析解答即可.【解答】解:钠原子失去电子最外层电子形成稳定结构,失去电子,核内的质子数不变,因此元素的种类不变,电子的质量很小,因此钠原子和钠离子的质量几乎相等,故填:(1)最外层电子数不同;(2)原子的质量主要集中在原子核上;(3)同种元素,核内的质子数相同.【点评】本题考查的是原子和离子的关系,完成此题,可以依据已有的知识进行.19.在一个水分子中(H2O),共有 10 个质子, 10 个电子.在一个氢氧根离子中(OH﹣),共有 9 个质子, 10 个电子.【考点】分子和原子的区别和联系;原子和离子的相互转化.。
《原子的构成》配套练习 2022年九年级化学附答案
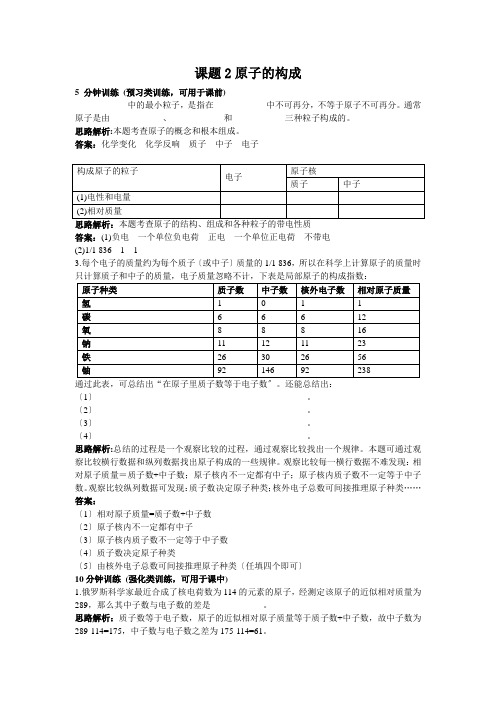
课题2原子的构成5 分钟训练(预习类训练,可用于课前)____________中的最小粒子,是指在____________中不可再分,不等于原子不可再分。
通常原子是由____________、____________和____________三种粒子构成的。
思路解析:本题考查原子的概念和根本组成。
答案:化学变化化学反响质子中子电子思路解析:本题考查原子的结构、组成和各种粒子的带电性质答案:(1)负电一个单位负电荷正电一个单位正电荷不带电(2)1/1 8361 13.每个电子的质量约为每个质子〔或中子〕质量的1/1 836,所以在科学上计算原子的质量时只计算质子和中子的质量,电子质量忽略不计,下表是局部原子的构成指数:通过此表,可总结出“在原子里质子数等于电子数〞。
还能总结出:〔1〕________________________________________________。
〔2〕________________________________________________。
〔3〕________________________________________________。
〔4〕________________________________________________。
思路解析:总结的过程是一个观察比较的过程,通过观察比较找出一个规律。
本题可通过观察比较横行数据和纵列数据找出原子构成的一些规律。
观察比较每一横行数据不难发现:相对原子质量=质子数+中子数;原子核内不一定都有中子;原子核内质子数不一定等于中子数。
观察比较纵列数据可发现:质子数决定原子种类;核外电子总数可间接推理原子种类……答案:〔1〕相对原子质量=质子数+中子数〔2〕原子核内不一定都有中子〔3〕原子核内质子数不一定等于中子数〔4〕质子数决定原子种类〔5〕由核外电子总数可间接推理原子种类〔任填四个即可〕10分钟训练(强化类训练,可用于课中)1.俄罗斯科学家最近合成了核电荷数为114的元素的原子,经测定该原子的近似相对质量为289,那么其中子数与电子数的差是____________。
2022-2023学年九年级化学人教版上册3

3.2 原子的结构同步测试卷一、单选题(本大题共15小题,共30分)1.下列关于分子、原子、离子的说法中,错误的是()A. 分子、原子、离子都是在不断运动的粒子B. 分子是由原子构成的一种粒子C. 分子、原子、离子都是不显电性的粒子D. 分子、原子、离子都是构成物质的基本粒子2.考古学家通过测定碳14的含量等方法将人类生活在黄土高原的历史推前至距今212万年。
碳14原子的核电荷数为6,相对原子质量为14,则该原子核外电子数为()A. 6B. 8C. 14D. 203.一种铁原子的原子核内有26个质子和30个中子,该原子的核外电子数为()A. 4B. 26C. 30D. 564.我国“高分5号”卫星天线是用钛镍形状记忆合金制成的。
如图所示为镍的原子结构示意图,关于该原子的叙述错误的一项是()A. 它的核电荷数为28B. 它有4个电子层C. 它的质子数大于核外电子数D. 它易失电子李涛同学撰写的“心目中的原子”短文中,阐述了以下观点,你认为不正确的是()A. 原子可以转化为离子B. 原子是最小的微观粒子C. 有些物质是由原子构成的D. 原子可以“搭建”成分子5.推理是研究和学习化学的一种重要方法。
正电子、负质子都是反粒子,它们跟通常所说的电子、质子相比较,质量相等,但电性相反。
科学家已发现反氢原子。
你推测反氢原子的结构可能是()A. 由一个带负电的质子和一个带正电的电子构成B. 由一个质子和一个电子构成C. 由一个带负电的质子和一个电子构成D. 由一个质子和一个带正电的电子构成6.下列对原子性质和构成的叙述: ①原子是化学变化中的最小粒子; ②原子在不停地运动; ③物质都是由原子构成的; ④原子核都是由质子和中子构成的; ⑤原子不显电性。
其中不正确的是()A. ① ②B. ③ ④C. ③ ⑤D. 只有 ④7.下列物质由离子构成的是()A. 二氧化碳B. 水C. 金刚石D. 氯化钠8.小明从如图某粒子结构示意图中,获取了下列信息,其中错误的是()A. 表示阴离子B. 核电荷数为12C. 有两个电子层D. 表示相对稳定结构9.某原子R的原子核带x个正电荷,则R2+离子的核外电子总数()A. x−2B. x+2C. xD. 无法确定10.科学理论在传承中不断发展,科学家们传承前人的正确观点,纠正错误观点,形成科学理论。
人教版九年级化学上册 3.2 原子的结构 同步练习题精选 (Word版附答案)

第三单元物质构成的奥秘课题2 原子的结构同步练习题附答案一、选择题:1.下列粒子(微粒)中不能直接构成物质的是()A.原子B.分子C.离子D.电子2.1999年度诺贝尔化学奖获得者艾哈迈德·泽维尔(AhmedHzewail)开创了化学研究新领域,他使运用激光光谱技术观测化学反应时分子中原子运动成为可能。
你认为该技术不能观察到的是()A.原子中原子核的内部结构B.化学反应中原子的运动C.化学变化中生成物分子的形成D.化学反应中反应物分子的分解3.反质子、正电子都属于反粒子,它们分别与质子、电子的质量、电量相等,但电性相反。
欧洲的科研机构曾宣称已制造出了反氢原子,那么,根据你的理解,下列关于反氢原子的结构叙述正确的是()A.由一个带正电的质子和一个带负电的电子构成B.由一个带负电的质子和一个带正电的电子构成C.由一个带负电的质子和一个带负电的电子构成D.由一个带负电的质子和两个带负电的电子构成4.我国著名化学家中国科学院院士张青莲教授为测定元素的相对原子质量作出了突出贡献。
某种原子的相对原子质量为192,中子数为115,这种原子的核电荷数为()A.96 B.77 C.115 D.1925.著名科学家居里夫人首先发现某些原子具有放射性,即原子能自动地放射出一些特定粒子。
一种元素的原子经过放射变成了另一种元素的原子,据此推断放射出的粒子一定是()A.电子B.中子C.质子D.原子核6.在化学反应里,元素的原子结构发生变化的是()A.质子数B.最外层电子C.中子数D.核电荷数7.下列关于原子结构的说法中,错误的是()A.核电荷数一定等于质子数B.相对原子质量约等于质子数和中子数之和C.质子数一定不等于中子数D.一般来说,原子是由质子、中子、电子构成8.下列有关原子的说法中正确的是()A.原子都是由质子、中子和核外电子构成的B.原子的种类是由原子核内的质子数所决定的C.原子中不存在带电微粒,因而整个原子不显电性D.原子的质量主要集中在质子和电子上9.据中央电视台2001 年6 月3 日对云南抚仙湖湖底古城考古的现场报道,科学家曾通过对古生物遗骸中的碳-14 含量来推断古城的年代。
人教版九年级化学第3单元课题2原子的结构同步练习试卷【精品】

课题2 (一)原子的构成、原子核外电子的排布一.原子的构成1.原子的构成()(每个带个单位电荷)()原子()(不带电)()(每个带个单位电荷)(1)为什么原子不显电性?。
(2)原子核都含有中子吗?。
2.在原子中:核电荷数= =二.原子核外电子排布1.原子核外的电子是排布的,离核较远的电子具有的能量较。
2.原子的核外电子的表示方法——原子结构示意图。
①小圆圈表示①小圆圈内的数字表示①弧线表示①弧线上的数字表示3.分析课本54页图3-12,第一层最多排_____个,第二层最多排_____,最外层不能超过______个(只有一层的不超过_____个)。
4.迄今已发现的元素原子核外电子至少_____层,最多_____层。
1.原子(普通的氢除外)中的原子核是()A.由电子和质子构成B.由质子和中子构成C.由电子和中子构成D.不能再分2.在原子里质子数等于()A.中子数B.中子数和电子数之和C.最外层电子数D.核电荷数3.下列说法中错误的是()A.一切原子的原子核都是由质子和中子构成的B.原子在化学变化中不再发生改变C.分子可以直接构成物质,原子也可以D.分子间有一定的间隙4.原子呈中性的原因是()A.构成原子的各种微粒都不带电B.原子核外的电子数大于核内的质子数C.原子核所带电量与核外电子所带电量相等,电性相反D.核内质子数等于核电荷数5.某微粒的结构示意图如右图所示,下列有关说法错误的是()A.X=13 B.Y=8C.该微粒核外有3个电子层D.核内中子数为136.如图是某元素的原子结构示意图.下列说法不正确的是()A.该原子的质子数为12B.该原子的核外有三个电子层C.该原子的核外电子数为12D.该原子的最外层电子数为87.将分子、原子、原子核、质子、中子或电子,分别填入下列有关空格内:(1)构成物质的粒子有多种,有的物质是由构成的,如铁、汞、碳、硫、氖气等;有的物质是由构成的,如氧气、氮气、水、二氧化碳等。
初三上分子和原子、原子的构成同步习题

初三上分子和原子、原子的构成同步习题初三上分子和原子、原子的构成同步习题(带答案人教版)第一节、分子和原子命题人:扶余二中孙亚华审题人:宋福军1、“墙角数枝梅,凌寒独自开、遥知不是雪,唯有暗香”(王安石《梅花》)、诗人在远处就能闻到梅花香味的原因是( )。
A、分子很小B、分子是可分的、分子之间有间隔 D、分子在不断地运动2、淀粉溶液遇碘变蓝色,实验表明无论是固体碘还是碘蒸气,均能使淀粉溶液变蓝色。
这一现象说明 ( ) A、同种分子质量相等 B、同种分子体积相、同种分子性质相同 D、同种分子运动速度相同3、下列变化中,能证明分子可分的事实是()。
A、水蒸发变成水蒸气B、用过滤的方法除去海水中难溶性的杂质、海水通过蒸馏得到淡化 D、水在直流电作用下变成氢气和氧气4.下列物质中含有氧分子的是()。
A、水B、过氧化氢、空气 D、二氧化碳二、填空题:5、利用分子的知识解释下列问题,请选择合适的选项:A、分子不断运动,温度升高时运动加快。
B、分子很小。
、分子之间有间隔,温度发生变化时,间隔大小随之改变。
(1)、酒精温度计能指示温度高低,是因为。
(2)夏天的水比冬天蒸发得快,说明。
(3)糖水可以透过滤纸,说明。
(4)可以将大量的氧气压缩到天蓝色的钢瓶中,是因为。
6、下列物质中:①空气②酱油③食醋④汞⑤水⑥矿泉水⑦氧气⑧氢气⑨二氧化碳⑩铁。
由分子构成的是,由原子构成的是。
7、某同学手划伤了,用消毒药水涂在伤口上(主要成分为过氧化氢H22),发现伤口上有气泡产生,问生成的气体是(填气体的名称)。
水不能作为消毒剂,而过氧化氢却能而且氧气不能消毒,由此得出是氧消毒的。
三、实验题:8、某兴趣小组做以下实验探究分子的运动如下图所示。
请回答实验中的有关问题(注:酚酞是一种酸碱指示剂,遇碱性物质变红;遇酸性物质不变色,氨水呈碱性):(1)实验1:在盛有少量蒸馏水的小烧杯中滴入2~3滴酚酞试液,再向其中滴加浓氨水,看到的现象是,实验1得出结论是。
原子的构成检验题含答案

北京市丰台区普通中学2016年10月初三化学人教版九年级上册第三章物质构成的奥秘课题2 原子的结构原子的构成同步检验题1.下列关于原子的叙述,错误的是( )A.原子呈电中性 B.原子是实心球体C.原子由原子核与核外电子构成 D.原子可以构成分子2.绝大多数原子的原子核中含有( )A.质子、中子、电子 B.质子、电子C.中子、电子 D.质子、中子3.紫薯中含有被誉为“抗癌大王”的硒元素。
已知硒原子的核电荷数为34,中子数为44,则硒原子的核外电子数为( )A.10 B.34 C.44 D.784.对“整个原子为何不带电”问题的猜想无意义的一项是( )A.原子核与核外电子所带电量相等,但电性相反B.质子的质量与中子的质量相等C.原子中所有粒子也许都不带电D.质子与核外电子所带电量相等,但电性相反5.氮元素的原子结构示意图为。
(1)“+7”表示__________________及_____________________。
(2)弧线表示___________。
(3)弧线上的数字表示_____________________。
6.在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子填在相应横线上:(1)能直接构成纯净物的是_____________;(2)能保持物质化学性质的是____________;(3)化学变化中最小的粒子是____________;(4)带正电荷的是_______________;(5)带负电荷的是_____________;(6)不显电性的是__________________;(7)在同一原子中数目相等的是_______________。
7.下列关于原子的叙述正确的是( )A.原子由原子核和核外电子构成 B.原子由原子核和中子构成C.原子由质子和电子构成 D.原子由质子和中子构成8.下列说法正确的是( )A.在原子里质子数等于中子数 B.原子核位于原子中央,体积较大C.原子的质量主要集中在原子核上 D.电子在原子核外静止不动9.如图是某元素的原子结构示意图。
人教版九年级化学上册:3.2原子的结构 同步检测题(word版,含解析)

原子的结构同步检测题一、选择题(每小题只有一个选项符合题意。
每小题2分,共12分)1.构成物质的粒子有分子、原子和离子,有关这三种粒子的说法错误的是( )A.分子和原子都在不断运动,而离子是静止的B.同种原子可能构成不同种分子C.同一元素的两种粒子,其原子核内质子数一定相同D.当原子失去或者得到电子后,其性质发生了改变2.关于相对原子质量,下列说法正确的是( )A.相对原子质量就是原子质量B.由于原子质量数值比较小,使用不方便,所以采用相对原子质量C.相对原子质量是原子质量与碳12原子质量的比值D.碳原子相对原子质量是12g3.下列微粒结构示意图中,表示阴离子的是( )A B C D4.已知核内有6个质子和6个中子的碳原子的质量为m kg,一个钼原子的质量为8m kg,则钼的相对原子质量为( )A.96B.72C.48D.365.两种微粒的结构示意图是Na和Na+,其中相同的是( )A.电子数B.质子数C.电子层数D.所带电荷数6.已知M2-离子核外有n个电子,则该原子的原子核内质子数为( )A.nB.n-2C.n+2D.22-n二、填空与简答题(每空2分,共44分)7.(学练优)用适当的化学符号表示:(1)钙原子(Ca)失去两个电子变成的离子是__________;(2)硫原子(S)得到2个电子变成的离子是__________;(3)铝原子(Al)失去三个电子变成的离子是__________;(4)氯原子(Cl)得到1个电子变成的离子是__________;(5)氯原子和钠原子之间通过得失电子而结合形成的化合物是_________。
8.根据下列粒子的结构示意图,回答问题:(1)具有相对稳定结构的是________;(2)属于阴离子的是________;(3)属于金属元素原子的是________。
9.下图是物质与其构成粒子之间的关系图。
回答下列问题:(1)金属铁是由_______(填“原子”、“分子”或“离子”,下同)构成的,氯化钠是由_________构成的。
人教版九年级化学上册_3.2_原子的结构_同步检测题(有答案解析)

人教版九年级化学上册3.2 原子的结构同步检测题学校:__________ 班级:__________ 姓名:__________ 考号:__________一、选择题(本题共计 14 小题,每题 3 分,共计42分,)1. 卢瑟福为探索原子的内部结构进行了“粒子散射实验“.用一束带正电的、质量比电子大得多的高速运动的粒子轰击金箱.如图中,可能是粒子运动轨迹的是()A. B. C. D.2. 所有原子的结构中都含有的是()A.质子、中子、电子B.质子、电子C.中子、电子D.质子、中子3. 我国“嫦娥工程”探月计划的一个重要目标是开发月球新能源–“氦”,吨氦就能满足我国一年所有的能源需求.关于氦原子的说法正确的是()A.质子数为,电子数为B.质子数为,电子数为C.质子数为,电子数为D.质子数为,电子数为4. 原子结构模型的建立经历了几代科学家的不断完善和修正,如图所示的结构模型为()A.道尔顿的实心球模型B.波尔的分层结构模型C.汤姆生的西瓜模型D.卢瑟福的核式结构模型5. 已知核外有个电子,其相对原子质量为(为整数),则这种元素的原子中含有的中子数为()A. B. C. D.6. 已知氦的原子核是由一个中子和两个质子构成的,其一个原子中,电子数为()A. B. C. D.7. 某学习小组的同学在关于原子和原子核的讨论中,有以下四种说法:下列组合中,都正确的是()①原子由位于中心的原子核和核外电子构成;②带负电荷的电子在原子核外空间里绕核运动;③质子数相同的原子,原子种类一定相同;④原子核一定是由质子和中子构成的。
A.①②B.②④C.①③D.③④8. 原子核中一定含有()A.质子B.中子C.质子、中子D.质子、中子、电子9. 下列原子的说法中不正确的是()A.原子是化学变化中的最小微粒B.含有相同中子数的原子,是同一种原子C.同一种原子质子数相等D.原子不显电性,因为核内质子数等于核外电子数10. 科学家曾通过测定古生物遗骸的碳含量来推测古城年代.碳原子的核电荷数为,相对原子质量为.下列关于碳原子的说法中错误的是()A.中子数为B.质子数为C.电子数为D.质子数与中子数之和为11. 化学上常用元素符号左下角数字表示原子的质子数,左上角的数字示原子的中子数与质子数之和,如表示核内有个质子和个中子的碳原子.下列关于和的说法中错误的是()A.各一个原子相比较,质子数相同B.各一个原子相比较,中子数不同C.各一个原子相比较,核外电子数相同D.属于同种碘原子12. 下列有关原子的说法正确的是()A.原子中的质子数与中子数一定相等B.原子的质量主要集中在原子核中C.原子是不能再分的最小微粒D.原子不显电性是因为在原子中不存在带电荷的微粒13. 化学变化中的最小微粒是()A.原子B.分子C.质子D.中子14. 原子是构成物质的基本粒子.下列有关原子的叙述不正确的是()A.原子的质子数等于核外电子数B.氧气、水、二氧化碳等物质中都含有氧元素,其中氧原子核内质子数都为C.在化学变化中,原子的核电荷数和核外电子数都不发生改变D.原子质量主要集中在原子核上二、多选题(本题共计 3 小题,每题 3 分,共计9分,)15. 卢瑟福在测定原子构成时做了如下实验:用粒子(带正电的氦核)轰击一张极薄的金箔,发现大多数粒子通过了金箔,极少数粒子发生偏转或被弹回.根据上述现象得出以下结论,其中正确的是()A.金原子是实心球体,紧密排列B.金原子核的质量比氦核大得多C.金原子核带正电D.金原子质量与氦核质量相当16. 原子是构成物质的基本粒子,下列有关原子的叙述错误的是()A.原子在化学变化中能够再分B.原子质量主要集中在原子核上C.原子的质量等于核电荷数D.原子的体积及在化学变化中的表现由电子决定17. 下列关于原子核的说法正确的是()A.所有的原子核都是由质子和中子构成的B.原子核在原子中所占的体积很小C.原子核居于原子中心,带正电荷D.原子的质量主要集中在原子核上三、填空题(本题共计 3 小题,每题 3 分,共计9分,)18. 原子是由原子核和核外________构成,原子核一般是由________、________构成的,质子带________,中子________.由于________所带电量和________所带电量相等,但________,因此整个原子不显电性.核电荷数________________.19. 如表是某原子(在中为元素符号,为原子的质子数、为该原子的质量数)的相关数据:分析以上数据,你得到了哪些结论?请写出其中三条:(1)________;(2)________;(3)________.20. 在原子中,中子数与质子数或核外电子数________(一定或不一定)相等.四、解答题(本题共计 1 小题,共计10分,)21. (10分)碳的半衰期为年,古董市场有一副达•芬奇的绘画,测得其碳的含量为原来的,根据这个信息,请你从时间上判断这幅画是不是赝品.(提示:只要用仪器测出文物中现有的碳的含量,再与它原始的碳水平相比,就能进行文物的年度鉴定)五、实验探究题(本题共计 2 小题,每题 15 分,共计30分,)22. 探究原子结构的奥秘.【情景提供】世纪以前,人们一直以为原子是不可分的,直到年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索.【提出问题】电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?【进行实验】年英国科学家卢瑟福进行了著名的粒子轰击金箔实验.实验做法如图和图:(1)放射源放出粒子(带正电荷),质量是电子质量的倍;(2)金箔厚度(等于),重叠了层左右的原子;(3)荧光屏粒子打在上面发出闪光;(4)显微镜通过显微镜观察闪光,且通过度转动可观察不同角度粒子的到达情况.【收集证据】绝大多数粒子穿过金箔后仍沿原来的方向前进,但是有少数粒子却发生了较大的偏转,并且有极少数粒子的偏转超过,有的甚至几乎达到,像是被金箔弹了回来.【猜想与假设】粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的.【解释与结论】(1)卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是________.(2)金箔包含了层金原子,绝大多数粒子穿过后方向不变,说明________..原子的质量是均匀分布的.原子内部绝大部分空间是空的.原子是实心的.原子中心有一个很大的核(3)在图中线条中,不可能是粒子(带正电)的运动轨迹的是________......23. 探究原子结构的奥秘.年英国科学家卢瑟福进行了著名的粒子轰击金箔实验.实验做法如图:(1)放射源-放射性物质放出粒子(带正电荷),质量是电子质量的倍;(2)金箔-作为靶子,厚度,重叠了层左右的原子;(3)荧光屏粒子打在上面发出闪光;(4)显微镜-通过显微镜观察闪光,且通过度转动可观察不同角度粒子的到达情况.【收集证据】绝大多数粒子穿过金箔后仍沿原来的方向前进,但是有少数粒子却发生了偏转,并且有极少数粒子发生较大的偏转甚至像是被金箔弹了回来.【解释与结论】(1)若原子质量、正电荷在原子内均匀分布,则极少数粒子就________(填“会”或“不会”)发生大角度散射.卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是________.(2)金箔包含了层金原子,绝大多数粒子穿过后方向不变,说明________;“很小的结构”具有什么样的性质________.参考答案与试题解析【2019年春中考复习】人教版九年级化学上册 3.2 原子的结构同步检测题一、选择题(本题共计 14 小题,每题 3 分,共计42分)1.【答案】C【考点】原子的定义与构成【解析】根据原子由居于原子中心带正电的原子核和核外带负电的电子构成进行分析解答;【解答】解:、由于原子中有带正电的原子核,同种电荷互相排斥,所以粒子遇到原子核会改变运动方向向下;故错误;、原子中有一个很大的空间,原子不是一个实心球体;所以粒子可能不改变方向,故正确;、由于原子中有带正电的原子核,所以粒子遇到原子核会改变运动方向;故正确;、原子中有体积很小,质量大的带正电的原子核,粒子如正面碰上原子核会被弹回来;故正确;故选.2.【答案】B【考点】原子的定义与构成【解析】根据已有的原子的构成进行分析解答,原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,但是不是所有的原子中都含有中子,例如氢原子,据此解答.【解答】解:原子是由原子核和核外电子构成的,原子核是由质子和中子构成的,但是不是所有的原子中都含有中子,例如氢原子,故原子中一定含有质子和电子,观察选项,故选.3.【答案】B【考点】原子的定义与构成【解析】根据原子的构成分析,在原子中,质子数=电子数=原子序数.【解答】氦元素的原子序数是,核内质子数是,核外电子数是,故正确,、、错误。
九年级化学原子的构成同步测试题2

课题1 原子的构成每个带电荷1、原子电荷每个带电荷2、原子核内的质子带正电荷,中子不带电,因此,原子核带电荷,原子核所带的正电荷数(即核电荷数)与核内数相等,也与核外数相等。
因此,原子。
3、在原子中:数== 数== 数。
4、不同种类的原子,核内的数不同,核外的数也不同。
决定原子种类的是数。
5、相对原子质量约为数与数之和,即相对原子质量≈数+ 数。
原子的质量主要集中在上,的质量很小,可忽略不计。
一、选择题1、据中央电视台对云南抚仙湖湖底古城考古的现场报道,科学家曾通过测定古生物遗骸中的14C含量来推断古城年代,14C原子的核电荷数为6,相对原子质量为14.下列关于14C原子的说法中错误的是A、中子数为6B、质子数为6C、电子数为6D、质子数和中子数之和为142、下列叙述中错误的是①原子是化学变化中的最小粒子②原子是不能再分的粒子③一切物质都是由原子直接构成的④一切原子核都是由质子和中子构成的⑤原子不显电性⑥原子之间有间隔A、①②B、②③④C、③⑤D、③⑥3、著名科学家居里夫人首先发现某些原子具有放射性,即原子能自动地放射出一些固定的粒子。
一种元素的原子经过放射变成了另一种元素的原子,据此推断放射出的粒子一定有A、电子B、中子C、质子D、原子二、填空题在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子,填在相应的横线上:⑴能保持物质化学性质的粒子是;⑵化学变化中的最小粒子是;⑶带正电荷的粒子是;⑷不显电性的粒子是;⑸质量最小的粒子是;⑹在同一原子中数目相等的粒子是;⑺决定原子质量大小的粒子主要是。
三、简答题:1、以氧原子为例,说明构成原子的粒子有哪几种。
它们是怎样构成原子的?为什么整个原子不显电性?2、现有质量相同的钠、镁、铝三块金属,哪一种金属含的原子最多?哪一种金属含的原子最少?为什么?课后延伸1、原子是由原子核和核外电子构成的。
为了研究原子内部结构,1911年英国科学家卢瑟福用一束高速运动的α粒子轰击金箔时(金的相对原子质量是197),发现三种实验现象:⑴大多数α粒子不改变原有的运动方向,原因是;⑵有一小部分α粒子改变了原有的运动路径,原因是;⑶极少数的α粒子被反弹回来,原因是。
九年级化学上册3.2原子的结构同步测试新版新人教版20181008314

人教版九年级上册化学 3、2原子的结构同步测试一、单选题1、以下是四种微粒的结构示意图,下列有关各微粒的说法中,错误的是()A、④是一种阴离子B、③④属于同种元素C、①的化学性质比较稳定D、②容易得到电子2、王芳同学学习化学后,对装修新房的爸爸说“如果厨房不装抽油烟机,家具将会粘满油渍.”王芳这样说的科学依据是()A、分子很大B、分子在不断运动C、分子之间有间隔D、分子可以分成原子3、碘-131(质子数与中子数之和)具有放射性,对人体有害.而生活中的碘盐、碘酒所含的碘-127对人体无害.碘-131和碘-127是同种元素的不同原子,核电荷数均为53.下列说法正确的是()A、碘是一种金属元素B、碘-127原子核外有74个电子C、碘-131原子核内有78个电子D、碘-131和碘-127核内中子数不同4、科学家发现某些原子具有放射性,即原子能自动地放射出一些固定的粒子.据此推断,当一种元素的原子经放射后,变成了另一种元素的原子.它一定放射了()A、中子B、质子C、该原子的原子核D、电子5、用“分子的观点”解释下列现象,不正确的是A、湿衣晾干——分子不停地运动B、水结成冰——分子发生变化C、干冰升华——分子间间隔变大D、轮胎充气——分子间有间隔6、氚是氢的一种同位素,氚原子含有1个质子和2个中子.下列示意图能正确表示氚原子结构的是()A、B、C、D、7、下列关于原子和分子的叙述正确的是( )A、分子大而原子小B、分子能运动,而原子不能运动C、在化学反应中,原子不发生变化,而分子发生了变化D、原子是不能再分的最小微粒8、科学家用石墨烯膜制成“筛子”,可以筛掉盐类物质.当海水流过该膜时,钠离子和氯离子被水分子包裹而不能通过,独立的水分子却能通过(如图).下列关于石墨烯膜“筛掉”氯化钠的说法错误的是()A、该过程属于物理变化B、该过程可应用于海水淡化C、“筛掉”氯化钠过程类似于过滤操作D、“筛掉”氯化钠后的海水溶质质量分数增大9、有科学家研究发现,氧气可通过高能真空紫外线照射二氧化碳直接产生,该化学反应模型如图所示,关于该反应的说法错误的是()A、属于分解反应B、反应中的最小微粒是分子C、符合质量守恒定律D、为制取氧气提供了新方法10、下列事实,不适合用“微粒间有空隙”的性质来解释的是()A、一定体积的气体加压后体积变小B、一定量的水结冰后体积变大C、室内的电线在冬天变短夏天变长D、1L大豆与1L黄沙混合后体积小于2L11、某元素的相对原子质量是31,原子核外有三个电子层,最外层有5个电子,则该元素原子核中的中子数是()A、12B、15C、16D、1712、(2015•济宁)“茉莉的香气清新淡雅,能够使人心情放松;檀木的香气持久醇厚,能缓解紧张焦虑的情绪….”从微观角度分析,语句中隐含的分子性质有()①分子的质量很小②分子之间有间隔③分子是不断运动的④不同分子性质不同.A、①②B、③④C、①③D、②④二、填空题13、已知两种离子A2+和B2﹣的核外电子数相同,其中B原子的质子数为a,则A原子的质子数为________14、某元素的原子结构示意图为,该元素原子核内的质子数为________,该元素容易________(填“得到”或“失去”)电子15、化学与生活息息相关.(1)漫步在公园中,闻到花香的原因是________;铝可以压制成铝箔,说明铝具有良好的________ .(2)防毒面具中使用活性炭,这是利用了活性炭的________ 作用.(3)下列不能为人体提供能量的营养素是________ (填字母序号).a.糖类 b.油脂 c.维生素 d.无机盐(4)皂角素是一种碱性的物质,皮肤沾上它会奇痒难忍.你认为可选用下列________ (填字母序号)来涂抹止痒.a.食醋(含醋酸3%﹣5%) b.稀氨水 c.纯碱溶液.(5)“骨头汤能补钙”中的钙是指________ (填“元素”或“原子”),用井水洗衣服时,肥皂不易起泡沫且产生浮渣,该井水是________ (填“硬水”或“软水”).16、如图是硫原子的结构示意图,请回答:(1)硫原子的质子数是________ ;(2)硫原子核外有________个电子层;在化学反应中相对较易________ (填“得到”或“失去”)电子.17、由分子构成的物质在发生物理变化时,________没有变化;由分子构成的物质在生化学变化时,________变成了________的分子.由分子构成的物质,如果是同种分子构成的就是________,由不同种分子构成的就是________.18、下图为某反应在同一容器中反应前后部分分子种类的示意图.回答下列问题:(1)氮元素和氢元素的本质区别是________ , 1个A分子中共含有________个原子,C代表的是________.(2)反应物中缺少某种物质,在反应前方框内应补充的微粒是________(填序号).(3)该反应中B和C的质量比为________.19、图中A、B、C、D是四种粒子的结构示意图.请回答下列问题:(1)图中A、B、C、D中属于同种元素粒子的是(填字母)________ .(2)A、B、C、D四种粒子中,属于阴离子的是(填字母)________ .(3)D是中性粒子,x的数值=________ .三、实验探究题20、对课本的实验改进是创新精神和能力的体现;宏观实验、微观探析是化学学习的重要方式和途径.【问题情景】在课外活动中,小萍按照课本实验(见图1)探究分子的运动时,闻到了刺激性的氨味,于是,小萍在老师的指导下,设计了如图2的实验装置,进行同样的实验,可以迅速观察到明显现象,得到了和课本实验同样的结论.【实验探究与结论】小萍用图2装置进行实验.(1)滴入少量浓氨水后,湿润的酚酞滤纸条发生的变化是________;从分子运动的角度分析,此现象可说明的结论是________.(2)用初中的化学知识分析,固体氢氧化钠的作用是________.(提示:氢氧化钠固体能溶于水且放出大量热量)(3)和课本实验比较,小萍改进后的装置的优点是________ (只需写一点). (4)【思维拓展】小蕊受小萍实验的启发,将图2装置进一步改装成图3装置,用于验证二氧化碳的性质.小蕊查阅资料得知:稀硫酸中含有硫酸(化学式H2SO4),没有挥发性,可与碳酸钠反应生成二氧化碳、硫酸钠和水,写出上述反应的符号表达式________. (5)打开活塞K滴入稀硫酸后,两条用紫色石蕊试液润湿的试纸发生的相同变化是________,不同变化是________,小蕊从课本实验中知道,二氧化碳和水本身都不能使石蕊变色,因而她认为以上两个变化验证的二氧化碳的性质分别是________、________.四、综合题21、据《自然》杂志报道,科学家最近研究出一种以锶(Sr)做钟摆的钟,它是世界上最精确的钟,锶的原子结构示意图如所示,请回答:(1)锶原子的核电荷数为________(2)锶原子核外电子层数为________(3)锶原子最外层容易________电子(填“得”或“失”),得到的离子符号为________.22、下图为某化学变化的微观示意图(其中“O”、“ ”代表不同元素的原子),据图回答下列问题.(1)上述物质中,属于单质的是________(填“A”、“B”或“C”);(2)化学变化前后,下列选项中一定不会改变的是_________;(填序号) A、原子的种类B、原子的数目C、分子的种类D、分子的数目(3)该反应中,物质A、B、C的分子个数之比为________.答案解析部分一、单选题1、【答案】A2、【答案】B3、【答案】D4、【答案】B5、【答案】B6、【答案】A7、【答案】C8、【答案】D9、【答案】B10、【答案】D11、【答案】C12、【答案】B二、填空题13、【答案】a+414、【答案】12;失去15、【答案】微粒在不断运动;延展性;吸附;cd;a;元素;硬水16、【答案】16;三;得到17、【答案】分子;分子;其它;纯净物;混合物18、【答案】质子数不同; 4;H2O;③;10:919、【答案】AB;C;8三、实验探究题20、【答案】(1)变红色;分子不断运动(2)氢氧化钠溶于水放热,加快氨气分子的运动速率(3)节约药品 (或不污染环境、现象明显等合理即可)(4)H2SO4 + Na2CO3→ CO2 + Na2SO4 + H2O(5)都变红;下面的先变红;二氧化碳能与水反应生成碳酸;二氧化碳密度比空气大四、综合题21、【答案】(1)38(2)5(3)失;Sr2+22、【答案】(1)A(2)A,B(3)1:2:2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四单元物质构成的奥秘
课题1 原子的构成2
我夯基我达标
1.某些花岗岩石材中含有放射性元素氡。
一种氡原子的质子数为86,中子数为136,这种氡原子核外电子数为()
A.50
B.86
C.136
D.222
思路解析:此题考查对原子结构以及原子结构中粒子数之间等量关系的理解程度,解此题的关键在于掌握原子结构中的等量关系。
即核电荷数 =质子数 =电子数(电荷等量关系),相对原子质量 =质子数+中子数(质量等量关系)。
由题意,氡元素的质子数为86,则原子核外电子数为86;又由于中子数为136,则相对原子质量为222。
答案:B
2.下列说法正确的是()
A.原子不能再分
B.原子核都是由质子和中子构成的
C.相对原子质量只是一个比,没有单位
D.原子可以构成分子,也可以直接构成物质思路解析:本题主要考查原子不能再分是指在化学反应中,而在原子核变化中,原子可以再分,故A不正确。
除有一种氢原子核是由一个质子而无中子构成之外,其他原子的原子核都由质子和中子构成,B不正确。
相对原子质量有单位,单位为1,一般不写,C不正确。
物质可以由分子、原子等粒子构成,而分子则由原子构成,故D正确。
答案:D
3.有两种原子,一种原子核内有17个质子和18个中子,另一种原子核内有17个质子和19个中子,则它们不相等的是()
A.核电荷数
B.核外电子数
C.原子质量
D.原子的带电荷量
思路解析:中子数的不同使得相对原子质量不等,也就是原子的质量不等。
这种原子数相同、中子数不同的原子互称同位素。
答案:C
4.“神舟”五号不仅将杨利伟送上太空,实现了亿万中国人的梦想,同时还承担着其他的科研任务。
比如探索宇宙中可能存在完全由反粒子构成的物质——反物质。
物质与反物质相遇会发生“湮灭”现象,释放出巨大的能量,在能源研究领域中前景可观。
正电子、负质子等
都是反粒子。
它们与通常所说的电子、质子相比较,质量相等但电性相反。
请你推测,反氢原子的结构可能是()
A.由一个带正电荷的质子与一个带负电荷的电子构成
B.由一个带负电荷的质子与一个带正电荷的电子构成
C.由一个带正电荷的质子与一个带正电荷的电子构成
D.由一个带负电荷的质子与一个带负电荷的电子构成
思路解析:根据所给信息,反氢原子是由1个反质子和反电子构成的,反质子带一个单位负电荷,反电子带一个单位正电荷。
答案: B
5.居里夫人是著名科学家,两次获得诺贝尔奖。
她首先发现某些原子具有放射性,即原子能自动地放射出一些固定的粒子。
一种元素的原子经过放射变成了另一种元素的原子,据此可推断放射出的粒子是()
A.电子
B.中子
C.质子
D.原子核
思路解析:原子结构中,质子数决定了原子的种类,如果“一种元素的原子经过放射变成了另一种元素的原子”,那么一定是质子数发生了变化。
答案:C
6.英国科学家道尔顿最先确立了原子学说,他的中心论点主要有:①原子是不能再分的粒子;
②原子是微小的实心球;③同种元素的原子,其性质和质量都相同。
而现代科学实验表明:同种元素的原子内部有相同的质子数和不一定相同的中子数。
从现代的观点看,你认为道尔顿的三个论点中,不确切的是()
A.①
B.①③
C.②③
D.①②③
思路解析:(1)原子是可以再分的,且并不是实心球;(2)由于原子的质量主要集中在原子核上,质子和中子的质量决定了原子的质量,而自然界中有许多质子数相等、中子数不等的原子,如C-12和C-14,原子核内均有6个质子,前者原子核中有6个中子,后者原子核中有8个中子。
答案:D
我综合我发展
7.在分子、原子、原子核、质子、中子、电子等粒子中,找出符合下列条件的粒子填在相应的横线上:
(1)能保持物质化学性质的粒子是________。
(2)化学变化中的最小粒子是________。
(3)带正电荷的粒子是________。
(4)不显电性的粒子是________。
(5)质量最小的粒子是________。
(6)在同一原子中数目相等的粒子是________。
(7)决定原子质量大小的粒子主要是________。
思路解析:注意分子、原子、中子的不显电性及原子核带正电,这些易忽视的问题。
思路解析:总结的过程是一个观察比较的过程,通过观察比较找出规律。
本题可通过观察比较横行数据和纵列数据找出原子构成的一些规律。
观察比较每一横行数据不难发现:相对原子质量=质子数+中子数;原子核内不一定都有中子;原子核内质子数不一定等于中子数。
观察比较纵列数据可发现:质子数决定原子种类;由核外电子总数可间接推理原子种类……答案:(1)相对原子质量=质子数+中子数
(2)原子核内不一定都有中子
(3)原子核内质子数不一定等于中子数
(4)质子数决定原子种类
(5)由核外电子总数可间接推理原子种类(任填四个即可)
我创新我超越
9.科学研究发现:氮气不活泼,在3000 ℃时仅有0.1%的分子分裂。
在0 ℃常压条件下,向密闭容器M中充入一定量氮气,而后升高温度(不超过300 ℃,压强不变),若该密闭容器的体积增大了一倍,几位同学设想了四种M内分子变化示意图,你认为合理的是哪一种?
图4-1
思路解析:此题运用实例来说明分子的性质。
解此题的关键在于理解变化过程中粒子的变化。
在物理变化过程中,构成物质的分子没有裂解为原子,分子的种类、分子的质量和大小、分子的个数都没有发生改变。
温度升高,使得分子运动速度加快,间隙变大,而分子的个数、质量和大小不发生改变。
答案:B。
