2018年度验证计划
防错清单及定期验证计划
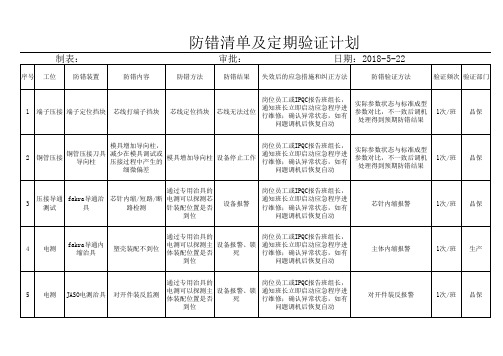
验证定位尺寸
1次/班 生产
10 电测
激光打标
电测合格激光打标
电测合格激光打 标,不合格不打
标、锁死
设备报警、锁 死
岗位员工或IPQC报告班组长, 通知班长立即启动应急程序进 行维修;确认异常状态,如有
问题调机后恢复自动
校准件测试
1次/班 生产
验证责任人 IPQC IPQC IPQC 技术员 IPQC
体装配位置是否
死
行维修;确认异常状态,如有
到位
问题调机后恢复自动
对开件装反报警
1次/班 生产
7
双孔塑壳 装配
塑壳卡扣复压
塑壳卡扣气压
为防止卡扣不到 位,使用气压复 卡扣复压到位
压
岗位员工或IPQC报告班组长, 通知班长立即启动应急程序进 行维修;确认异常状态,如有
问题调机后恢复自动
过大外径通过时有阻力
1次/班
品保
8 全检
9.72通孔
外壳过大筛选
能通过9.72孔则 过大外径通过
为符合要求
时有阻力
岗位员工或IPQC报告班组长, 通知班长立即启动应急程序进 行维修;确认异常状态,如有
问题调机后恢复自动
没压接到位到复压到位
1次/班
品保
9
贴标签
贴标签定位工 装
贴标签定位工装
使用定位控制距 离
标签位置固定
岗位员工或IPQC报告班组长, 通知班长立即启动应急程序进
1次/班 品保
通过专用治具的
岗位员工或IPQC报告班组长,
4
电测
fakra导通内 缩治具
塑壳装配不到位
电测可以探测主 设备报警、锁 通知班长立即启动应急程序进
医疗器械公司年度验证计划表格

医疗器械公司年度验证计划表格
1. 验证项目名称,列出需要进行验证的项目名称,例如特定设备、工艺或系统。
2. 验证目的,说明每个验证项目的具体目的,包括符合法规、
确保产品质量等。
3. 验证方法,描述每个验证项目所采用的验证方法,例如测试、检查、审核等。
4. 验证标准,列出每个验证项目所需符合的标准或法规要求,
确保验证活动的合规性。
5. 验证责任人,指定负责执行每个验证项目的责任人员,以确
保验证活动的有效性和及时性。
6. 验证计划,制定每个验证项目的具体时间表和计划安排,包
括开始日期、结束日期和持续时间。
7. 验证结果,记录每个验证项目的验证结果,包括符合性、问
题和改进计划等。
8. 验证结论,对每个验证项目的验证结果进行总结和结论,以确定是否符合要求或需要进一步行动。
这份年度验证计划表格可以帮助医疗器械公司组织和管理验证活动,确保其产品和流程符合相关法规和标准,从而保障产品质量和安全性。
同时,也有助于监管部门对公司的合规性进行审查和评估。
CNAS-RL02 2018能力验证规则

CNAS-RL02能力验证规则Rules for Proficiency Testing 中国合格评定国家认可委员会目录前言 (2)1 范围 (3)2 引用文件 (3)3 术语和定义 (3)4 对合格评定机构的要求 (4)5 对CNAS的要求 (7)6 其他说明 (7)附录A(资料性附录)能力验证活动适宜性核查表 (8)附录B(规范性附录)能力验证领域和频次表 (10)前言中国合格评定国家认可委员会(英文缩写:CNAS)将能力验证与现场评审作为CNAS对合格评定机构能力进行评价的两种主要方式,为了确保CNAS认可的有效性,保证CNAS认可质量,促进合格评定机构的能力建设,特制定本规则。
本规则规定了CNAS能力验证的政策和要求,包括对合格评定机构的要求和对CNAS的要求。
本规则内容为强制性要求。
本规则中的“注”是对条款的解释和说明。
本规则于2007年制订,2010年换版修订,2015年6月换版后第1次修订,2016年换版修订,本次修订主要是根据ISO/IEC 17011:2017《合格评定认可机构要求》标准的变化,对第4、5和6条款的内容进行了修改,同时,为方便合格评定机构使用,将CNAS AL07:2015《CNAS能力验证领域和频次表》作为本规则的附录B,本文件实施之日起,CNAS AL07:2015《CNAS能力验证领域和频次表》废止。
能力验证规则1 范围本规则适用于申请CNAS认可或已获准CNAS认可的合格评定机构,包括检测和校准实验室(含医学领域实验室)、标准物质/标准样品生产者以及检验机构(相关时)。
2 引用文件本文件引用了下列文件中的全部或部分条款。
所引用的文件不注明其发布日期,请各相关方注意使用这些文件的有效版本(包括其修订案)。
2.1 CNAS-R01《认可标识使用和认可状态声明规则》2.2 GB/T 27000《合格评定词汇和通用原则》(ISO/IEC 17000,IDT)2.3 ISO/IEC 17011《合格评定认可机构要求》2.4 ISO/IEC 17043《合格评定能力验证的通用要求》(GB/T 27043)2.5 APLAC MR001《建立和保持认可机构间APLAC互认协议的程序》2.6 ILAC-P9《ILAC对参加能力验证活动的政策》3 术语和定义GB/T 27000中的定义适用于本规则,同时,本规则还引用以下术语和定义:3.1 实验室间比对:按照预先规定的条件,由两个或多个实验室对相同或类似的物品进行测量或检测的组织、实施和评价。
年度验证主计划模板

**年度验证主计划文件编号:起草人/日期:审核人/日期:批准人/日期:执行日期:目的:建立验证总规划,规范所有验证工作范围:公司所有验证工作职责:验证委员会、验证小组内容:1.概述1.1****药业有限公司***经济开发区,占地13.5万平方米,建有办公楼、制剂楼、综合楼、锅炉房、污水处理等附属设施。
1.2我公司整个厂区包括:办公区、质量控制区、药品生产区(针剂车间、固体车间、中药提取和合成车间)、仓储区(原辅料库、包材库存、成品库及中药材库)等。
公用系统包括:空气净化系统、纯化水系统、注射用水系统、压缩空气系统等。
1.3我公司整个厂区路面平整。
生产、行政、生活和辅助区已全部分开。
对厂区的环境进行了绿化,种植了对环境、空气无污染的树木、灌木、草坪。
1.4针剂车间由冻干粉针剂和小容量注射剂组成,洁净级别分为A/B级区、C级区。
年生产能力1000万支,其中冻干剂400万支,水针剂600万支。
1.5固体车间分为片剂生产线和片剂胶囊生产线,洁净级别为D级。
1.6综合车间一层为中药前处理和提取生产线,洁净级别为D级;二层为化学原料药合成生产线,洁净级别分为A/B级区、C级区、D级区和一般生产区。
2.目的实施GMP的最终目的是防止生产过程中药品的污染、混淆和差错的发生,保证药品质量。
而验证作为GMP的重要组成部分,就是为GMP的最终目的服务的。
公司验证工作的整体目标就是证明任何可能影响产品质量的所有因素均符合GMP要求,即可证明按特定生产工艺能保证产品质量始终如一、符合预定要求。
3.组织机构、人员与职责3.1验证委员会****药业有限公司成立验证委员会,验证委员会设主任一名,副主任一名,验证委员会的成员主要由公司质量控制室、设备动力部、生产部及各车间负责人构成。
验证委员会下设5个验证小组。
3.2验证组织机构图3.3验证委员会组成及职责3.3.3.3.2验证委员会职责主要负责验证的总体策划与协调,验证文件的审核与批准,并为验证提供足够的资源。
环境保护部标准样品研究所
环境保护部标准样品研究所标样所(能)[2018]2号关于组织开展2018年第一批能力验证计划的通知各有关实验室:标样所2018年度第一批拟组织的能力验证计划正在接收实验室报名,决定按期开展各项计划。
标样所的能力验证计划为自愿报名参加,第一批各项能力验证计划的样品及作业文件发放时间安排如下:序号计划编号报名截止日期样品及作业文件发放时间汇款截止日期1 IERM T18-01~04 2018.3.15 2018.3.31前 2018.3.312 IERM T18-05~08 2018.4.15 2018.4.30前2018.4.303 IERM T18-09~11 2018.5.15 2018.5.31前 2018.5.314 IERM T18-12 2018.5.15 2018.9.30前2018.6.305 IERM T18-13~15 2018.6.15 2018.6.30前 2018.6.306 IERM T18-16~19 2018.7.15 2018.7.31前2018.7.317 IERM T18-20~23 2018.8.15 2018.8.31前 2018.8.318 IERM T18-24~27 2018.9.15 2018.9.30前2018.9.309 IERM T18-28~31 2018.10.15 2018.10.31前 2018.10.3110 IERM T18-32~35 2018.11.15 2018.11.30前2018.11.30请报名实验室在汇款截止日期前将费用汇入以下账户,建议实验室一次性支付所有参加项目的费用。
银行:农行北京惠新里支行开户:中日友好环境保护中心帐号:11191101040000437注:请在银行汇款单据附言处写明PT+订单编号的后四位,以便对帐。
缴费流程:请登录能力验证服务平台(http://180.76.153.217:8108/)进行报名,报名成功后,在“用户中心”点击“我的报名”生成能力验证计划的订单,再到“我的订单”中点击下载“缴费通知”,获得缴费通知。
年度验证计划怎么写

年度验证计划怎么写(总4页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--年度验证计划怎么写年度验证计划怎么写篇一:201x年度验证总计划霍山县天下泽雨生物科技发展有限公司201x年度验证总计划编号:目录一、公司简介二、目的三、验证范围四、厂房设施及公用系统五、验证项目六、验证机构及职责七、验证原则及要求八、验证方法及合格标准九、相关文件十、验证明细表1、公司简介霍山县天下泽雨生物科技发展有限公司位于六安市霍山县大别山深处太平畈乡王家店村,厂区占地面积2500平米,总建筑面积平米,其中饮片生产车间777平米,位于综合楼二楼,属一般中药饮片生产车间,质量控制区位于厂区后排独立平房内,总面积平米,仓储总面积262平米,包括原料库、成品库及包材库等。
2、目的按我国药品生产质量管理规范(2010年修订)、2014年7月执行的中药饮片附录、特制订本验证总计划,以规定各项目、系统的验证实施原则、要求及进度计划。
3、验证范围霍山县天下泽雨生物科技发展有限公司所涉及的厂房设施、设备及工艺。
4、厂房设施及公用系统中药饮片生产线概况:中药饮片生产线位于霍山县太平畈乡王家店村霍山县天下泽雨生物科技发展有限公司厂区综合楼2楼,适用于霍山石斛及铁皮石斛饮片的生产,主要生产设备包括一台炒制机、两台烘焙机。
5、验证项目此次涉及的验证项目有设备确认、设备清洁验证和工艺验证。
6、验证机构及职责公司成立了验证小组,全面统筹确认验证工作,由质量受权人担任小组组长,批准评估验证的方案、报告,生产负责人审核相应的方案报告,小组成员分工明确,共同做好验证工作。
验证小组成员及职责7、验证原则及要求须制订验证计划并按计划实施验证。
有完整的验证文件并经过批准,由质量部决定验证产品是否准予投放市场。
必须根据有关法规及用户的要求建立验证合格的标准。
标准应当量化。
应当以量化的标准来评估验证的结果。
验证方案应当包括验证的目标、方法、合格标准以及风险评估。
CNAS-RL02:2018《能力验证规则》

CNAS-RL02能力验证规则Rules for Proficiency Testing 中国合格评定国家认可委员会目录前言 (2)1 范围 (3)2 引用文件 (3)3 术语和定义 (3)4 对合格评定机构的要求 (4)5 对CNAS的要求 (7)6 其他说明 (7)附录A(资料性附录)能力验证活动适宜性核查表 (8)附录B(规范性附录)能力验证领域和频次表 (10)前言中国合格评定国家认可委员会(英文缩写:CNAS)将能力验证与现场评审作为CNAS对合格评定机构能力进行评价的两种主要方式,为了确保CNAS认可的有效性,保证CNAS认可质量,促进合格评定机构的能力建设,特制定本规则。
本规则规定了CNAS能力验证的政策和要求,包括对合格评定机构的要求和对CNAS的要求。
本规则内容为强制性要求。
本规则中的“注”是对条款的解释和说明。
本规则于2007年制订,2010年换版修订,2015年6月换版后第1次修订,2016年换版修订,本次修订主要是根据ISO/IEC 17011:2017《合格评定认可机构要求》标准的变化,对第4、5和6条款的内容进行了修改,同时,为方便合格评定机构使用,将CNAS AL07:2015《CNAS能力验证领域和频次表》作为本规则的附录B,本文件实施之日起,CNAS AL07:2015《CNAS能力验证领域和频次表》废止。
能力验证规则1 范围本规则适用于申请CNAS认可或已获准CNAS认可的合格评定机构,包括检测和校准实验室(含医学领域实验室)、标准物质/标准样品生产者以及检验机构(相关时)。
2 引用文件本文件引用了下列文件中的全部或部分条款。
所引用的文件不注明其发布日期,请各相关方注意使用这些文件的有效版本(包括其修订案)。
2.1 CNAS-R01《认可标识使用和认可状态声明规则》2.2 GB/T 27000《合格评定词汇和通用原则》(ISO/IEC 17000,IDT)2.3 ISO/IEC 17011《合格评定认可机构要求》2.4 ISO/IEC 17043《合格评定能力验证的通用要求》(GB/T 27043)2.5 APLAC MR001《建立和保持认可机构间APLAC互认协议的程序》2.6 ILAC-P9《ILAC对参加能力验证活动的政策》3 术语和定义GB/T 27000中的定义适用于本规则,同时,本规则还引用以下术语和定义:3.1 实验室间比对:按照预先规定的条件,由两个或多个实验室对相同或类似的物品进行测量或检测的组织、实施和评价。
qmzhijia2018验证报告

qmzhijia2018验证报告qmzhijia2018验证报告背景信息•验证对象:qmzhijia2018•验证时间:2021年6月•作者:[你的姓名]•评估目的:对qmzhijia2018进行验证评估,评估其可靠性和有效性验证方法•深入研究与使用qmzhijia2018相关资源和文档•对qmzhijia2018进行功能测试•阅读用户反馈和评论•对qmzhijia2018的代码进行代码审查验证结果1. 功能验证•qmzhijia2018的基本功能正常运行,包括但不限于:–用户注册与登录–数据上传与下载–文件管理与分享–团队协作功能–数据备份与恢复等•部分高级功能需要进一步测试和验证,包括但不限于:–数据可视化分析–自动化任务调度–安全性与权限管理等2. 用户反馈•对qmzhijia2018的用户反馈整体较为正面,用户对其功能和易用性给予了肯定和赞扬。
•用户反馈中提及的问题主要集中在部分功能异常和界面设计不够友好等方面,但并不影响整体使用体验。
3. 代码审查•对qmzhijia2018的代码进行了审查,发现代码结构清晰、命名规范,并且有详细的注释说明。
•代码中未发现明显的漏洞和安全隐患。
•部分代码细节需要优化和重构,以提高代码的可读性和性能。
评估结论•qmzhijia2018在功能和使用体验方面得到了验证,基本满足了用户的需求。
•部分高级功能需要进一步测试和优化,以提供更好的用户体验。
•qmzhijia2018的代码质量较高,符合良好的软件开发规范。
•建议在日后的版本迭代中,进一步完善和改进功能,并加强代码的优化和重构。
以上是对qmzhijia2018的验证报告,希望能对项目的进一步开发和优化提供参考。
4. 功能优化建议•通过用户反馈和需求调研,了解用户的需求和期望,进一步优化以下功能:–数据可视化分析:增加更多的图表类型和分析工具,提供更多个性化定制选项。
–自动化任务调度:支持更灵活的任务调度设置,允许用户根据需求自定义任务执行周期和触发条件。
验证总计划及年度验证计划

... . .1. 验证方针与本文件的目的1.1验证方针GMP是保证生产出符合既定质量标准药品的唯一手段,而验证是证明和保证关键生产要素,包括设施、系统、仪器设备、生产工艺、分析方法、清洁规程以及消毒/灭菌规程符合既定要求的公认方法。
没有良好有效的验证工作,就谈不上GMP管理体系的有效,也就无法保证药品的质量。
因此,验证工作是GMP管理的最重要工作之一。
鉴于验证工作的如此重要性,本公司将验证工作放在GMP管理的重要位置,并给予高度重视。
为此提出以下验证方针:●充分认识,高度重视;建立规程、依规行事;客观记录、慎重结论;资源保证。
所有新的关键方法、规程、工艺及新的关键系统、设备在投入使用前应经历证。
●当发生的变更影响产品质量时,所涉及的变更应经过验证。
●当验证状态发生漂移时应进展再验证。
●关键工艺参数和关键工艺步骤应进展验证。
●检验方法发生变化时应进展验证。
1.2本文件的目的本验证总方案〔VMP〕根据本公司验证管理规程〔文件号*****〕制定,概括地描述了本公司应该进展的验证和确认活动的管理原则,包括验证方针、组织机构、围领域、文件管理、方案安排、实施程序、简要方法和可承受标准等,以确保本公司的验证工作按照规定得到良好执行,满足GMP有关验证的要求。
本验证总方案是公司验证工作的跨年度的通用指导性管理文件,公司有关部门可根据具体情况以“年度〔阶段〕验证方案〞具体化当年的验证活动,也可以“工程〔如新建车间、特别工程〕验证方案〞对“年度验证方案〞进一步细化,以清晰文件,方便工作。
2一般概述2.1公司简介●公司根本情况公司全称是,公司成立于____年,专门从事于____类产品的研究、开发和商品化生产。
公司现有** 个生产车间,车间面积共计_____多平方米,符合中国GMP标准,已通过**认证。
_____年本公司原料药的年产量达**。
简要介绍公司平面布局情况、品种情况、车间情况、生产能力情况、仓库情况、其他建筑物情况。
验证总计划及年度验证计划

1.考证目标与本文件的目的考证目标GMP是保证生产出切合既定质量标准药品的独一手段,而考证是证明和保证重点生产因素,包含设备、系统、仪器设备、生产工艺、剖析方法、洁净规程以及消毒 / 灭菌规程切合既定要求的公认方法。
没有优秀有效的考证工作,就谈不上GMP管理系统的有效,也就没法保证药品的质量。
所以,考证工作是 GMP管理的最重要工作之一。
基于考证工作的这样重要性,本企业将考证工作放在 GMP管理的重要地点,并赐予高度重视。
为此提出以下考证目标:充足认识,高度重视;成立规程、依规行事;客观记录、谨慎结论;资源保证。
所有新的重点方法、规程、工艺及新的重点系统、设备在投入使用前应经考证。
当发生的更改影响产质量量时,所波及的更改应经过考证。
当考证状态发生漂移时应进行再考证。
重点工艺参数和重点工艺步骤应进行考证。
查验方法发生变化时应进行考证。
本文件的目的本考证总计划( VMP)依据本企业考证管理规程(文件号 XXXXX)拟订,归纳地描绘了本企业应当进行的考证和确认活动的管理原则,包含考证目标、组织机构、范围领域、文件管理、计划安排、实行程序、简要方法和可接受标准等,以保证本企业的考证工作依照规定获取优秀执行,知足 GMP有关考证的要求。
本考证总计划是企业考证工作的跨年度的通用指导性管理文件,企业有关部门可依据详细状况以“年度(阶段)考证计划”详细化当年的考证活动,也能够“项目(如新建车间、特别项目)考证计划”对“年度考证计划”进一步细化,以清楚文件,方便工作。
2一般概括企业简介企业基本状况企业全称是,企业成立于 ____年,特意从事于 ____类产品的研究、开发和商品化生产。
企业现有 XX 个生产车间 , 车间面积合计 _____多平方米,切合中国 GMP标准,已经过 XX 认证。
_____年本企业原料药的年产量达XX。
简要介绍企业平面布局状况、品种状况、车间状况、生产能力状况、库房状况、其余建筑物状况。
2018年检验科室间质评计划

2018年检验科室间质评计划第一篇:2018年检验科室间质评计划2018年检验科室间质评计划为提高检验质量,保证检验结果的准确性,按照检验科室间质评管理制度要求,经科室质量小组讨论,报医务科批准,计划2018年参加江西省临床检验室间质量评价计划如下:一、参加卫计委临检中心质评:核酸检测(病毒学)乙肝1项。
二、参加江西省临床检验室间质量评价13项:临床化学、全血细胞计数、临床微生物、感染性疾病血清标志物A、特殊蛋白、尿液干化学、出凝血试验、临床形态学、脂类分析、糖化血红蛋白、临床PCR、肿瘤标志物、血型。
三、参加江西省疾控的能力验证试验:HIV、梅毒TPPA、梅毒RPR。
所有质评项目的网上申请、付款、质控品接收、发放工作由质量工作小组负责实施。
质评样品的测定、按时上报、结果分析总结由各专业组长实施,质量小组负责督导检查。
检验科质量小组 2018年1月2日第二篇:室间质评总结室间质评总结输血相容性室间质评每次五项分别是:ABO正定型、ABO反定型、RH血型、抗体筛查和交叉配血,每次26份标本,室间质评对输血科实验室的质量管理起到了促进作用,是实验室各种硬件、软件标准化,操作过程规范化,积累了操作经验,提高了检验质量,为临床输血提供了安全保障。
通过室间质评能过识别所存在的问题并采取相应的改进措施和改进方法,确定重点投入和培训需求。
室间质评是实验室质量的客观证据,是质量保证的外部监管工具,参加室间质评活动对提高实验室技术能力,提高检验人员的技术水平,保障输血科工作质量是非常重要的。
检验方法的选择:为了确保输血安全在输血前采用的检测方法极为重要。
用于血型鉴定、交叉配血、抗体筛查的方法有盐水法、凝聚胺法、抗人球法、微柱凝胶法等,对于临床实验室应当从中选择其灵敏度、特异度、准确度都可靠的方法,同时具备检出IGM、IGG抗体,且操作简单、重复性好等优点才能满足临床要求。
采用目前较普遍应用的微柱凝胶法,此方法与传统抗人球法、凝聚胺法比较有灵敏度高、结果准确、操作标准化、重复性好等优点,结果可靠,完全满足临床输血实验室质量要求。
验证计划新版

验证计划1 目旳:本原则规定了我司旳验证总计划。
2 合用范畴本原则合用于我司旳验证安排。
3 综述3.1 按照验证管理制度SMPYZ—02—007 R02、验证总计划(SMP-VMP-YZ14-JH)规定,特制定本年度验证总计划。
本计划中波及旳验证涉及前验证,同步验证和再验证。
3.2 本次计划中有关部门旳负责人负责公司验证过程中本部门工作旳组织、监督贯彻。
3.3 本年度验证明施过程中,新增长产品、物料、检测措施、清洁措施、设备(设备变化用途)等,按照验证总计划规定实行验证。
3.4 本计划在文献体系中文献编号,根据验证文献旳编码、起草、审核、批准和管理规程SMPYZ—02—002 R03,采用验证总计划旳英文缩写表达,具体为VMP-YZ16-GS(GY)XX-XX R04; VMP表达验证计划,YZ16表达验证;GS(GY)XX表达验证类型年份,XX表达具体旳一种,R04表达文献执行旳版本。
阐明:工艺验证为YZ14表达工艺规程执行旳是制定。
3.5验证范畴验证总计划覆盖我司所有剂型和品种旳工艺验证、分析措施验证、清洁验证、生产/检查设备验证以及所波及旳厂房及辅助系统验证。
验证工作具体涉及:●公用设施(涉及空调系统、水系统、空气压缩等)验证。
●核心生产设备验证、检查仪器验证。
●生产工艺验证(有变更旳)和工艺回忆验证。
●有变更旳清洁规程或清洁规程验证。
4.验证措施和可接受原则每个具体验证必须按照验证总计划规定制定具体旳验证方案,验证方案中应具体描述所使用旳验证措施和验证可接受原则。
各类验证旳验证措施和验证可接受原则,根据我司各操作规程,结合具体验证旳验证目旳等建立和制定。
4.1新增或变更旳设备按照验证总计划规定验证涉及设计确认、安装确认、运营确认和性能确认。
4.2 检查措施验证4.2.1验证方案旳建立检查措施旳验证方案质检部化验员及技术中心旳技术人员共同起草。
根据产品旳工艺条件、原辅料化学构造、中间体、分解产物查阅有关资料,提出需验证旳项目、各项目旳指标规定及具体旳操作环节。
验证总计划-验证计划的内容包括

验证总计划|验证计划的内容包括验证文验证总计划编码:MS-VM-002-00 ※※※※※※有限公司验证总计划审批验证总计划起草部门姓名签字日期品质管理部××× 验证总计划审核部门姓名签字日期总经室××× 总经室××× 品质管理部××× 品质管理部××× 品质管理部××× 生产部××× 生产部××× 采购部××× 技术部××× 验证总计划批准部门姓名签字日期总经室×××目录一、简介二、术语和定义三、验证组织机构及职责四、支持性文五、验证方法六、可接受标准七、验证步骤八、验证计划一、简介:1、公司及其设施简介×××有限公司成立于20××年,致力于为客户提供天然优质的提取物产品、专业可靠的生产、完善便捷的服务。
是目前世界上年产量最大的×××生产供应商之一,拥有多项具有自主知识产权的核心技术。
×××有限公司依照GMP标准,建设了5000多平方米的植物提取物产品生产车间及C级洁净车间,配备了植物提取、萃取、色谱分离、手性化合物拆分、降膜蒸发、真空浓缩、低温结晶、冷冻干燥、喷雾干燥等现代化生产设备。
2、验证总计划目的2.1验证总计划(VMP)是进行验证的纲领性文,是指导惠州市晟荣生物科技有限公司在各项验证过程中,有组织,有计划,有步骤的进行,使各项验证必须依据计划起草、审批和实施。
3、验证总计划范围3.1厂房设施及公用系统验证;3.1.1厂房设施及公用系统验证范围分为四类,分别为:3.1.1.1厂房与设施的验证 3.1.1.2 HVAC(空调净化系统)系统验证;3.1.1.3纯化水系统验证;3.1.1.4压缩空气系统验证。
国家认监委办公室关于开展2018年度能力验证工作的通知

国家认监委办公室关于开展2018年度能力验证工作的通知文章属性•【制定机关】国家认证认可监督管理委员会•【公布日期】2018.03.20•【文号】认办实〔2018〕5号•【施行日期】2018.03.20•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】认证认可正文国家认监委办公室关于开展2018年度能力验证工作的通知认办实〔2018〕5号各直属检验检疫局,各省、自治区、直辖市质量技术监督局(市场监督管理部门),各资质认定(计量认证)行业评审组,各项目承担单位,各有关检验检测机构:为贯彻落实《国务院关于加强质量认证体系建设促进全面质量管理的意见》(国发〔2018〕3号)关于加强检验检测认证认可事中事后监管力度的要求,规范检验检测市场,提升检验检测机构资质认定制度实施的有效性,根据《检验检测机构资质认定管理办法》(质检总局令第163号)和国家认监委《实验室能力验证实施办法》(认监委公告2006年第9号)的有关规定,国家认监委决定在社会重点关注的检验检测领域组织开展2018年度能力验证工作。
现将有关事项通知如下:一、能力验证计划的设置国家认监委能力验证计划分设A、B、C三类项目。
(一)A类项目:由国家认监委征集、审核并发布的能力验证项目。
取得国家认监委颁发的检验检测机构资质认定(CMA)证书,且相关检验检测项目(参数或者方法标准)已经取得资质认定的检验检测机构必须参加。
鼓励省级质量技术监督局(市场监督管理部门)颁发资质认定证书的检验检测机构,获得实验室认可的检验检测机构,以及企业、高校等其他检验检测机构自愿参加。
2018年度A类项目共19项(见附件1)。
(二)B类项目:由国家认监委征集、审核并发布的能力验证项目,鼓励各类检验检测机构自愿参加。
2018年度B类项目共18项(见附件2)。
(三)C类项目:由国家认监委确定的能力验证组织者组织实施的能力验证项目(包括实验室间比对)。
能力验证组织者包括国家认可机构认可的“能力验证提供者(PTP)”,也包括其他具备相关技术能力、具有能力验证组织经验的技术机构。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2018年度验证计划编号:VMP-001-2018**************有限公司目录1.概述 (3)1.1确认/验证方针 (3)1.2指导原则 (4)1.3参考文件 (4)2.目的 (4)3.组织机构及职责 (4)3.1验证组织机构 (4)3.2验证职责 (4)4.简介 (5)4.1厂房、设施和设备简介 (5)4.2工艺简介 (6)(1)前处理:①中药饮片→称量→提取→过滤→储罐→浓缩→干燥→备用②中药饮片→称量→混合→粉碎→灭菌→备用(2)制剂:取干膏、药粉按标准要求配料→(制粒→干燥→整粒)→混合→填充胶囊→抛光→铝塑包装→外包装4.3品种目录 (6)5.风险评估 (6)6.验证计划 (7)1.概述1.1确认/验证方针为了确保影响产品质量的关键要素,包括厂房设施、生产设备、生产工艺、分析方法等符合GMP规定的要求,保证患者的用药安全。
因此,本公司特制订如下情况需进行验证:所有新的关键方法、规程、工艺及新的关键系统、设备在投入使用前应经验证;关键工艺参数和关键工艺步骤应进行验证;当验证状态发生漂移时应进行再验证;关键的工艺/设备/设施等应进行定期再验证;当发生的变更影响产品质量时,所涉及的变更应经过验证;检验方法、仪器发生变化时应进行验证。
1.2指导原则本次验证严格按照2010版GMP及其实施指南要求,参照WHO及ISPE有关技术指南的要求,在风险评估的基础上确定验证项目的范围及程度,对验证过程中出现的偏差和变更进行评估,确保所生产的药品符合预定用途和注册要求。
1.3参考文件《药品生产质量管理规范》(2010年版)《药品生产质量管理规范》(2010年版)附录-《确认与验证》药品GMP实施指南《中国药典》(2015年版)2.目的为公司的整个验证工作的实施提供指导,确保本公司的验证工作按照规定有序进行,符合GMP有关验证的要求。
其内容包括:确认/验证方针、指导原则、参考文件、组织机构及职责、确认/验证的范围及程度、确认/验证进度等。
3.组织机构及职责3.1验证组织机构根据验证工作需要,成立验证小组,小组成员由生产部、质量部、工程部等相关部门人员组成。
具体如下:组长:****组员:****(质量部部长)****(生产部部长)****(工程部部长)3.2验证职责3.2.1 验证小组职责①负责验证方案的审批;②负责组织协调验证各项工作,以保证验证方案规定项目的顺利实施;③负责验证数据及方法的审核;④负责验证报告的审批。
3.2.2 工程部职责①负责厂房设备设施的验证及再验证工作;②参与验证活动,确保验证进度;③根据验证结果修订相关厂房设备文件及记录;3.2.3 质量部职责①负责验证方案的起草与修订;②负责工艺、清洁验证工作的取样并出具检测报告;③负责空气净化系统、纯化水系统的取样检测;④负责检验仪器、检验方法的验证工作;⑤负责验证工作的中的监督检查,确保验证进度;⑥负责验证工作中的偏差处理及变更控制工作;⑦负责起草验证报告。
⑧根据验证结果修订相关质量文件及记录;3.2.4 生产部职责①组织协调工艺、清洁验证活动,确保验证进度;②负责工艺、清洁验证数据的收集;③参与厂房设施设备的验证工作;④根据验证结果修订相关生产文件及记录;4.简介4.1厂房、设施和设备简介************有限公司占地面积****** m2,本企业共有**个*****生产车间,由*******有限公司按照2010版GMP要求设计,*******有限公司建造。
1#厂房建筑东西向总长度97.1米,南北向宽度为50米。
该厂房的东部为三层:一层由北向南布置有锅炉房、消防控制室、餐厅、阴凉库(2间)、劳保仓库和泵房,二层为化验室,由北向南布置有空调机房、阳性对照室、准备室、微生物限度室、试剂室、样品室、仪器室、高温室、天平室、液相色谱室、标准溶液室、理化室、气瓶室、气相色谱室、样品前处理室、更衣室及盥洗室;三层为办公用房,由北向南依次布置有留样室、稳定性考察室、办公室(10 间)及盥洗室。
该厂房的西部为生产车间:其西部布置有药材前处理和提取车间;北部布置有药材库及动力机房房、高低压配电室、制水间;南部为洁净生产区;东部布置有原辅料料包材仓库、成品仓库。
中药硬胶囊剂生产车间包括前处理组(含中药粉碎和提取)、收膏组、制剂组、外包装组、仓库、动力区。
(1)前处理组位于1#厂房西部,属一般生产区,建筑面积约825平方米,有拣选工作台1个,洗药机1台,润药池2个,切药机1台,剁药机1台,药材干燥设备1台,粉碎机组1台,湿热灭菌柜1台,提取罐3台,药液储罐2台,双效浓缩机组1台,单效浓缩机组1台,沉淀罐1台,酒精回收机组1台,酒精储罐2台,溶剂回收罐1台,发酵罐1台。
以上设备均为优质不锈钢材质,现阶段能满足企业生产需要。
物料由药材库直接传入前处理组,人员由前处理组北侧人员通道进入。
(2)收膏组位于1#厂房中西部,属D级洁净区,建筑面积约300平方米。
收膏洁净区有收膏混膏、微波干燥灭菌、净料粉碎等工序,有符合GMP要求的微波干燥箱1台、干膏粉碎机1台。
收膏组人员从1#厂房南侧进入洁净区,前处理组通过管路和收膏洁净区西侧的气闸将物料传入收膏组,收膏组将加工处理好的物料从收膏洁净区东侧的气闸传至制剂组,废弃物由收膏组北侧的传递窗传出。
洁净区操作者按批准的各项规程操作,有严格的质量监控,有效降低微生物污染和交叉污染,避免混淆和差错。
(3)制剂组位于1#厂房中部,属D级洁净区,建筑面积约1000平方米。
制剂洁净区有混合配料、制粒干燥、胶囊充填、内包装等工序,有符合GMP要求的混合机1台、槽式混合机1台、摇摆式颗粒剂1台、沸腾干燥机1台、热风循环烘箱1台、胶囊充填机3台、铝塑包装机3台。
制剂组人员从1#厂房南侧进入洁净区,制剂洁净区北侧通过气闸与原辅料包材库相连,完成内包装后的待包装品从洁净区内包间的传递口直接传至外包装组,废弃物由制剂组东侧的传递窗传出。
洁净区操作者按批准的各项规程操作,有严格的质量监控,有效降低微生物污染和交叉污染,避免混淆和差错。
(4)外包装组位于1#厂房南侧,属一般生产区,建筑面积约170平方米,有2条包装生产线。
外包装组与包材库、成品库相连,方便存取。
人员分工明确,责任到人,有效地避免各种人为的差错。
(5)仓库分为药材库、原辅料包材库和成品库,其中药材库位于1#厂房北侧,分为常温库与阴凉库;原辅料包材库位于1#厂房东侧,分为标签库、原辅包材库、阴凉库;成品库位于1#厂房东侧,分为常温库与阴凉库。
(6)动力区分为锅炉房、配电室、动力机房、制水间,其中锅炉房位于1#厂房东北角,有1.7吨锅炉1台,主要为生产提供蒸汽;配电室位于1#厂房北侧,主要为生产提供电力;动力机房位于1#厂房北侧,主要有3台空调机组、1台制冷机组、1套压缩空气设备,主要为洁净区提供洁净空气和洁净压缩空气;制水间位于动力机房南侧,有0.5吨/h双级反渗透制纯化水机组一套,主要为洁净区提供纯化水。
4.2工艺简介(1)前处理:①中药饮片→称量→提取→过滤→储罐→浓缩→干燥→备用②中药饮片→称量→混合→粉碎→灭菌→备用(2)制剂:取干膏、药粉按标准要求配料→(制粒→干燥→整粒)→混合→填充胶囊→抛光→铝塑包装→外包装5.1 厂房设施设备再确认参照《药品GMP指南-质量管理体系》第97-98页的“厂房、设施、设备等完成确认之后应通过变更管理系统进行控制,所有影响产品质量的变更等都应有正式的申请、记录并批准。
在没有发生较大的变更的情况下,可以通过对维护、校准、工作日志、偏差、变更等的定期回顾,确保厂房、设施、设备等的确认状态。
这种周期性的回顾可视为再确认。
当发生改造、变更或反复出现故障时,需通过风险评估确定是否进行再确认,以及再确认的范围和程度。
”内容,在厂房、设施、设备等完成确认的情况下,如发生变更,需立即停止生产,进行再确认合格后方可使用;如无变更,在HVAC系统和纯化水系统正式运行1年后,其余厂房、设施、设备正式运行2年后通过对维护、校准、工作日志、偏差、变更等的定期回顾进行再确认。
如增加新设施设备,需对相关设备进行确认合格后方可使用。
5.2工艺验证根据《药品生产质量管理规范(2010年修订)》的规定,我公司因企业搬迁生产设备、生产环境等发生变更,存在影响产品质量的因素,在新厂址未生产过的品种应完成连续三个成功批次的工艺验证。
参照《药品GMP指南-质量管理体系》第103-104页的规定,生产工艺的再验证,可分为以下两种情况:(1)当发生可能影响产品质量的变更或出现异常情况时,应通过风险评估确定是否需进行再验证以及确定再验证的范围和程度。
(2)生产工艺在完成首次验证后,应定期进行再验证以确定它们仍保持验证状态并仍能满足要求,再验证的频率可以由企业根据产品、剂型等因素自行制定。
周期性的再验证可以采用同步验证的方式、回顾的方式或两者相结合的方式进行。
5.3清洁再验证参照《药品GMP指南-质量管理体系》第116页的规定“每个清洁程序应定期进行再验证,验证的频率由企业根据实际情况制定。
对日常清洁程序监测结果的回顾可以作为周期性再验证。
”在已完成清洁验证的情况下,如清洁程序发生变更并可能影响清洁效果、设备发生变更并可能影响到清洁效果、当分组或最差条件发生变化并可能影响到验证结论、日常监测中发现异常结果时,应立即停产,进行清洁再验证合格后方可继续生产;如无变更,在正式生产2年后,通过对日常清洁程序监测结果的回顾进行再验证。
6.验证计划根据风险评估内容特制订本年度验证计划2018年验证计划一览表。
