化工热力学第二章 PVT
合集下载
化工热力学-流体的 p-V-T 关系

Z
Z
Z
1
q
Z
或
Z
0.026196
Z
Z
0.026196
1.026196 Z 6.6060 0.026196
将 Z= 代入上式右边,迭代计算后得到收敛值Z=0.04331。
V l ZRT 0.043318.314350 133.3 cm3mol1
p
0.9457
为了比较计算结果,在例2/5-1的情况下,运用四种立方型状态 方程所计算得到的V v及V l 值列表如下:
第二章 流体的 p-V-T 关系
(一)纯流体的三维相图
自由度与相律
(二)纯流体的二维相图
异戊烷的p-V图
p-T相图
T-V图
(三)纯流体 pVT 行为的模型化
→ 什么是状态方程?
f p,V,T 0
dV
V T
p
dT
V p
T
dp
V=V(T,p)
p=p(T,V )
(四)理想气体
只有在Zc相等的条件下,对比态原理才能成立
以ω为第三参数的对应状态原理
Z f pr ,Tr ,
偏心因子
Pitzer: 物质对比饱和蒸汽压的对数,与对比温度的倒数呈 下列线性关系
log
prS
a 1
1 Tr
prS
pS pc
球形分子虽然临界参数相差很大,但在Tr=0.7时,对比蒸气压 logprS = -1 。
ZC 3/8 1/3 1/3 0.30740
临界压缩因子Zc
VDW: 3/8 RK/SRK: 1/3 PR: 0.3047
立方型状态方程的数值求解
p
RT
V b
V
化工热力学第2章 流体的PVT关系和状态方程

P
RT V b
V
a
V
b
a
ac
T
0.42748
R 2Tc2 Pc
T
b 0.08664 RTc Pc
T
1
0.48
1.574
0.176
2
1
T 0.5 r
2
在临界点: T 1
优点
➢ 与RK方程相比,SRK方程大大提高了表达纯物质汽液平 衡的能力,使之能用于混合物的汽液平衡计算,故在工 业上获得了广泛的应用。
6.734m3
/ kmol
V1
6.814
4.2486.734 6.7346.734
0.08058 0.08058
6.198
V2
6.814
4.2486.198 6.1986.198
0.08058 0.08058
6.146
V3 6.141 V4 6.140 V 6.140m3 / kmol
( 2 ) SRK方程
Thiesen, 1885年提出 Onnes, 1901年改进
pV a(1 b' p c' p2 d ' p3 .....) 原型 p 0 理想气体
Z pV 1 Bp Cp2 Dp3 RT
Z pV 1 B C D
RT
V V2 V3
B B RT
C C B2 R2T 2
8.3142 408.12.5
a 0.42768 3.648 103
2.725104 kPa m6 K 0.5 / kmol2
b 0.08664 8.314 408.1 0.08058m3 / kmol 3.648 103
RT
a
P V b T1/2V V b
化工热力学第2章流体的PVT关系
时,这种流体就处于对比状态。
例如:H2 和N2这两种流体
对于H2
状态点记为1,P1 V1 T1
Tr1 =T1/TcH2
Pr1=P1/PcH2
对于N2
状态点记为2,P2 V2 T2
Tr2 =T2/TcN2
Pr2=P2/PcN2
当Tr1=Tr2 ,Pr1=Pr2 时,此时就称这两种流体处
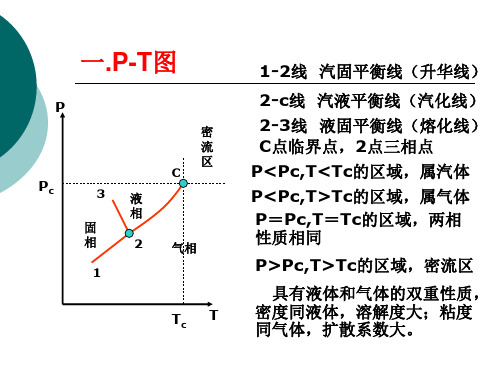
一.P-T图
P
Pc
3液
相
固
相
2
1
密 流 区 C
气相
Tc T
1-2线 汽固平衡线(升华线)
2-c线 汽液平衡线(汽化线) 2-3线 液固平衡线(熔化线) C点临界点,2点三相点 P<Pc,T<Tc的区域,属汽体 P<Pc,T>Tc的区域,属气体 P=Pc,T=Tc的区域,两相 性质相同
P>Pc,T>Tc的区域,密流区
压缩因 子,方 程的计 算值和 实测值 的符合 程度是 判断方 程的优 劣标志 之一。
2. R-K Equation (1949年,Redlich and Kwong)
(1) R-K Eq的一般形式:
P
RT V-b
-
a T0.5V(V
b)
(2-11)
① R-K Equation中常数值不同于范德华方程中的a、b值, 不能将二者混淆。 在范德华方程中,修正项为a/V2,没有考虑温度的影响 在R-K方程中,修正项为,考虑了温度的影响。 ② R-K Equation中常数a、b值是物性常数,具有单位。
为表征物质分子的偏心度,既非球型分子偏离球对称的 程度,简单流体为0
R-K Eq经过修改后,应用范围扩宽。 SRK Eq:可用于两相PVT性质的计算,对烃类计算,其 精确度很高。
例如:H2 和N2这两种流体
对于H2
状态点记为1,P1 V1 T1
Tr1 =T1/TcH2
Pr1=P1/PcH2
对于N2
状态点记为2,P2 V2 T2
Tr2 =T2/TcN2
Pr2=P2/PcN2
当Tr1=Tr2 ,Pr1=Pr2 时,此时就称这两种流体处
一.P-T图
P
Pc
3液
相
固
相
2
1
密 流 区 C
气相
Tc T
1-2线 汽固平衡线(升华线)
2-c线 汽液平衡线(汽化线) 2-3线 液固平衡线(熔化线) C点临界点,2点三相点 P<Pc,T<Tc的区域,属汽体 P<Pc,T>Tc的区域,属气体 P=Pc,T=Tc的区域,两相 性质相同
P>Pc,T>Tc的区域,密流区
压缩因 子,方 程的计 算值和 实测值 的符合 程度是 判断方 程的优 劣标志 之一。
2. R-K Equation (1949年,Redlich and Kwong)
(1) R-K Eq的一般形式:
P
RT V-b
-
a T0.5V(V
b)
(2-11)
① R-K Equation中常数值不同于范德华方程中的a、b值, 不能将二者混淆。 在范德华方程中,修正项为a/V2,没有考虑温度的影响 在R-K方程中,修正项为,考虑了温度的影响。 ② R-K Equation中常数a、b值是物性常数,具有单位。
为表征物质分子的偏心度,既非球型分子偏离球对称的 程度,简单流体为0
R-K Eq经过修改后,应用范围扩宽。 SRK Eq:可用于两相PVT性质的计算,对烃类计算,其 精确度很高。
化工热力学第二章-----流体的PVT关系 [兼容模式]
![化工热力学第二章-----流体的PVT关系 [兼容模式]](https://img.taocdn.com/s3/m/83ffab71a26925c52cc5bf48.png)
24
MH方程
方程情况 ( 1 ) MH 方程是 1955 年 Martin 教授和我国学者候虞钧 教授提出的。首次发表在杂志AIChE J(美国化学工程 师会刊)上。有9个参数。 (2)为了提高该方程在高密度区的精确度,Martin于 1959年对该方程进一步改进。 (3)1981年候虞钧教授等又将该方程的适用范围扩展 到液相区,改进后的方程称为MH-81型方程。
0.5 r 2
k 0.3746 1.54226 0.26992 2
a( T )=a( T )=f (Tc,pc, Tr ,ω)
15
P-R方程
方程使用情况: (1)RK方程和SRK方程在计算临界压缩因子Zc和液 体密度时都会出现较大的偏差,PR方程弥补这 一明显的不足; (2)它在计算饱和蒸气压、饱和液体密度等方面有更 好的准确度; (3)是工程相平衡计算中最常用的方程之一。
8
van der Waals方程
1873年van der Waals(范德华) 首次提出了能表达从气态 到液态连续性的状态方程 :
•参数: (1)a/V2—分子引力修正项。 由于分子相互吸引力存在,分子撞击器壁的力减小,造成压力 减小。 (2)b —分子本身体积的校正项。 分子本身占有体积,分子自由活动空间减小,由V变成V-b。 分子自由活动空间的减小造成分子撞击器壁的力增大。b增大, 造成压力增大。
2
一、纯物质的P-T关系
1-2线 汽固平衡线(升华线)
P
A
Pc
C
超临 界流 体区
2-c线 汽液平衡线(汽化线) 2-3线 液固平衡线(熔化线) C点临界点,2点三相点 P<Pc, T<Tc的区域,属汽体 P<Pc, T>Tc的区域,属气体
化工热力学第二章 流体的pVT关系

化工热力学
第二章 流体的PVT关系
第2章 流体的p-V-T关系
流体指除固体以外的流动相的总称。均 匀流体一般分为液体和气体两类。
南阳理工学院 生化学院
化工热力学
第二章 流体的PVT关系
重点内容
纯物质的p-V-T关系
状态方程 立方型状态方程 多参数状态方程 对应态原理及其应用 流体的蒸气压、蒸发焓和蒸发熵
方程形式: p RT a(T )
V b V (V b)
Soave 是把R-K 方程中的常数a 看作是温度的函数,在SRK 方程中,a 不仅是物性的函数,而且还是温度的函数,只有在特 定的温度下,对于某一物质而言, a 才能为定值。
方程常数:
a(T
)
ac
(Tr
,)
0.42748
混合规则与混合物的p-V-T关系 液体的p-V-T关系
南阳理工学院 生化学院
化工热力学
第二章 流体的PVT关系
本章要求:
1.了解纯物质的P-T图和P-V图 2.正确、熟练地应用R-K方程、两项维里方程计 算单组分气体的P-V-T关系 3.正确、熟练地应用三参数普遍化方法计算单组 分气体的P-V-T关系 4.了解计算真实气体混合物P-V-T关系的方法, 并会进行计算。
化工热力学
第二章 流体的PVT关系
V T
p
V
V V p T
dV dT dp V
对于液体,由于其具有不可压缩性,体积膨胀系数和等温 压缩系数是温度和压力的弱函数,其数值可以从文献或工具书 中查到。因此,在液体的温度和压力变化不大时,可以将体积 膨胀系数和等温压缩系数当作常数,则
第二章 流体的PVT关系
第2章 流体的p-V-T关系
流体指除固体以外的流动相的总称。均 匀流体一般分为液体和气体两类。
南阳理工学院 生化学院
化工热力学
第二章 流体的PVT关系
重点内容
纯物质的p-V-T关系
状态方程 立方型状态方程 多参数状态方程 对应态原理及其应用 流体的蒸气压、蒸发焓和蒸发熵
方程形式: p RT a(T )
V b V (V b)
Soave 是把R-K 方程中的常数a 看作是温度的函数,在SRK 方程中,a 不仅是物性的函数,而且还是温度的函数,只有在特 定的温度下,对于某一物质而言, a 才能为定值。
方程常数:
a(T
)
ac
(Tr
,)
0.42748
混合规则与混合物的p-V-T关系 液体的p-V-T关系
南阳理工学院 生化学院
化工热力学
第二章 流体的PVT关系
本章要求:
1.了解纯物质的P-T图和P-V图 2.正确、熟练地应用R-K方程、两项维里方程计 算单组分气体的P-V-T关系 3.正确、熟练地应用三参数普遍化方法计算单组 分气体的P-V-T关系 4.了解计算真实气体混合物P-V-T关系的方法, 并会进行计算。
化工热力学
第二章 流体的PVT关系
V T
p
V
V V p T
dV dT dp V
对于液体,由于其具有不可压缩性,体积膨胀系数和等温 压缩系数是温度和压力的弱函数,其数值可以从文献或工具书 中查到。因此,在液体的温度和压力变化不大时,可以将体积 膨胀系数和等温压缩系数当作常数,则
化工热力学第二章.

第2章流体的p-V-T关系
主要内容
1) 流体的压力p、摩尔体积V 和温度T是物质最基
本的性质;
2)p、V、T 性质可以通过实验直接测量;
3)pVT+c p ig能推算其它不能直接从实验测量的热力
学性质如H、S、U、G等。
1
)
c
A B
对任何气体,
根据气体的临界参数,即可求出Z
计算常数需要
同时适用于汽液两相,
(1)
(2) EOS
(3)
与立方型状态方程相比,多参数状态方程的优多参数方程的基础是
能同时适用于汽、液两相
在计算和关联烃类混合物时极有价值;计算结果明显高于立方型状态方程;
该方程的数学规律性较弱,给方程的求解。
化工热力学第二章 PVT

有了p-V-T关系,热力学的大多数问题均可得到解 决。
2
第二章 内容
§2.1 纯流体的p-V-T相图 §2.2 气体状态方程(EOS) §2.3 对应态原理和普遍化关联式 §2.4 液体的p-V-T性质 §2.5 真实气体混合物p-V-T关系
§2.6 状态方程的比较和选用
3
§2.1 纯流体的p-V-T相图
48.1
49.7 71.7 41.9 37.5 37.5
32.2
9.2 36.5 96.6 196.6 135.0
0.203
0.218 0.450 0.217 0.232 0.228
31
超临界流体萃取过程简介
将萃取原料装入萃取釜。采用CO2为超临界溶剂。 CO2气体经热交换器冷凝成液体; 用加压泵把压力提升到工艺过程所需的压力(应高于CO2的 pc),同时调节温度 ,使其成为超临界CO2流体。 CO2流体作为溶剂从萃取釜底部进入,与被萃取物料充分接 触,选择性溶解出所需的化学成分。 含溶解萃取物的高压CO2流体经节流阀降压到低于CO2的pc 以下进入分离釜,由于CO2溶解度急剧下降而析出溶质,自 动分离成溶质和CO2气体二部分,前者为过程产品,定期从 分离釜底部放出,后者为循环CO2气体,经过热交换器冷凝 成CO2液体再循环使用。 整个分离过程是利用CO2流体在超临界状态下对有机物有极 高的溶解度,而低于临界状态下对有机物基本不溶解的特性, 将CO2流体不断在萃取釜和分离釜间循环,从而有效地将需 32 要分离提取的组分从原料中分离出来。
1)由于刚性容器体积保持不变, 因此加热过程在等容线上变化,到 达B1时,汽液共存相变为液相单相; 继续加热,当T>Tc,则最终单相为 超临界流体,即C1点。
热力化学第二章 流体P-V-T性质

是用于烃类气体的计算精度很高;
0.5 1 m1 Tr0.5
用计算机多用SRK方程,手算多用RK方程。
Tr—对比温度, Tr=T/TC ; ω—物质的偏心因子
m 0.480 1.574 0.176 2
2.2 流体的状态方程
3. 立方型方程——PR方程 RT a 方程形式: p V b V V b bV b 式中a、b为常数: 2 RTC a 0.45724 pc 普遍化关联式:
3. 立方型方程——RK方程
说明: a、b的物理意义与vdW方程相同,数值不同。 vdW方程,a/V2没有考虑温度;RK方程,考虑了温 度的影响。所以, RK 方程中 a 、 b 是物性常数,具有 单位。 计算精度高于 vdW 方程,尤其适用于非极性和弱 极性的化合物。 RK方程较成功用于气相p-V-T的计算,但液相效果 较差,也不能预测纯流体的蒸汽压(即汽液平衡)。
2 2 2 2
2.3 对比态原理及其应用
1. 普遍化EOS
P22,例题2-4
定义:用对比参数代入EOS得到的方程式。 普遍化RK方程
1 4.934 h Z - 1.5 (1) 1 h Tr 1 h
0.08664 Pr h ZTr
Z pV RT
(2)
2) 1) Z 0 1 式( 普遍化 h 0 式( Z1 Z1 - Z0 pVT EOS 特点:
华北科技学院
化工热力学
Chemical Engineering Thermodynamics
第二章 流体的p-V-T 性质
2.1 纯物质的p-V-T 行为
1. 纯物质的p-V图 p
T4 T5 液 T3
T2 T1
天津大学化工热力学第2章流体pVT关系

的第二维里系数和立方型状态方程的混合规则。
a
3
2.1 纯物质的p –V –T关系
a
4
2.1 纯物质的p –V –T关系
固液
C
液 汽液
汽固
图2-1 纯物质的p –V –T图
a
5
纯物质的T—V图
a
6
纯物质的T—V图
C点临界点,所对应的温度和压力
C
是纯物质气液平衡的最高温度和最 高压力点
复习:临界温度、临界压力
算中更准确。
a
27
Peng-Robinson方程(简称PR方程)
方程形式: pV R TbVVba TbVb
方程参数:
a T a T 0 . 4 5 7 2 4 R 2 T c 2 /p c T
b0.07780RTc/pc
(T)1k(1Tr0.5)2
k 0 .3 7 4 6 1 .5 4 2 2 6 0 .2 6 9 9 2 2
RT a
• 参数: p V b V2
a/V2 — 分子引力修正项。
由于分子相互吸引力存在,分子撞击器壁的力减小,造成压力减小。
b —分子本身体积的校正项。
分子本身占有体积,分子自由活动空间减小,由V变成V-b。分子 自由活动空间的减小造成分子撞击器壁的力增大。b增大,造成 压力增大
a
21
• 参数a和b获得途径:
(2)方程利用统计力学分析分子间的作用力,具有坚实的理论基础 。 方程形式: 压力形式: ZpV1B pC p2D p3
R T
体积形式: Z1VBVC2 VD3
密度形式: Z1B C 2D 3
维里系数:B ( B ) C (C ) D ( D ) ……分别称为第二、第三、第四……维 里(virial)系数。 对于特定的物质,它们是温度的函数。
a
3
2.1 纯物质的p –V –T关系
a
4
2.1 纯物质的p –V –T关系
固液
C
液 汽液
汽固
图2-1 纯物质的p –V –T图
a
5
纯物质的T—V图
a
6
纯物质的T—V图
C点临界点,所对应的温度和压力
C
是纯物质气液平衡的最高温度和最 高压力点
复习:临界温度、临界压力
算中更准确。
a
27
Peng-Robinson方程(简称PR方程)
方程形式: pV R TbVVba TbVb
方程参数:
a T a T 0 . 4 5 7 2 4 R 2 T c 2 /p c T
b0.07780RTc/pc
(T)1k(1Tr0.5)2
k 0 .3 7 4 6 1 .5 4 2 2 6 0 .2 6 9 9 2 2
RT a
• 参数: p V b V2
a/V2 — 分子引力修正项。
由于分子相互吸引力存在,分子撞击器壁的力减小,造成压力减小。
b —分子本身体积的校正项。
分子本身占有体积,分子自由活动空间减小,由V变成V-b。分子 自由活动空间的减小造成分子撞击器壁的力增大。b增大,造成 压力增大
a
21
• 参数a和b获得途径:
(2)方程利用统计力学分析分子间的作用力,具有坚实的理论基础 。 方程形式: 压力形式: ZpV1B pC p2D p3
R T
体积形式: Z1VBVC2 VD3
密度形式: Z1B C 2D 3
维里系数:B ( B ) C (C ) D ( D ) ……分别称为第二、第三、第四……维 里(virial)系数。 对于特定的物质,它们是温度的函数。
本热力学2章PVT

Pc=3.648MPa
ω =0.176
m 0.480 1.574 0.176 0.176 0.176 2 0.7516
T 1 0.48 1.574 0.176 0.1760.1762 1 0.73510.5
1.2259
2
bp 8.0582 105 3.704 105 B 0.01197 RT 8.314 300
P、V、T
可以直接测量 热力学基本方 不可直接测量,但工程实际需要 程——U H S G A间的关系
U、H、S、G、A、CP等
可见,PVT关系为化工过程开发提供基础数据。
纯物质的P-V-T关系
液 固 固 液 汽
液
临界点 气
固
临界点 气
汽
凝固时收缩
凝固时膨胀
纯物质的P-V-T相图
纯物质P-V-T相图的投影图
误差
(6.031 6.1015 ) 10 2 / 6.031 10 2 1.2%
( 2 ) PR方程 k 0.3746 1.54226 0.26992 2
0.3746 1.54226 0.176 0.26992 0.176 2 0.6377
Z
1 A h 1 h ( ) 9.5163( ) 2 2 1 h B 1 2h h 1 h 1 2h h
B 0.01075 Z Z
h
取初值Z=1迭代计算,迭代4次得: Z=0.9012
V ZRT 0.9012 8.314 300 6.0685 10 2 m3 / mol p 3.704 10 5
Chemical Engineering Thermodynamics
化工热力学讲义-2-第二章-流体的p-V-T关系

h 0.2387
Z 1 1 0.5335 0.2387 0.8829 1 0.2387 0.2387 1 0.2387
即Z1和Z0之间相差颇大,需进行第二次迭代。
第二次迭代:取 Z 2 Z 1 0.8829
则:p
ZRT V
0.8829 8.314 323.16 1.25 104
2.3.1两参数对比态原理
一、原理的导出
令:Tr T T,C
pr
p p,C
Vr
V VC
1 r
式中:Tr、pr、Vr、ρr称为对比温度、对比压力、对比摩尔体积、对比密度。
对于van der Waals方程,上节课中已经推导并得到:
a
9 8
RVCT,C
b VC,同时: 3
pC
3 8
RTC VC
将以上各值代入van der Waals方程,得:
分析:BpC 是无因次的,可以看作对比第二维里系数。 RTC
以下要解决的是该系数的计算问题:对于指定的气体来说,B仅仅 是温度的函数,B的普遍化关系只与对比温度有关,与压力无关。
因此Pitzer提出如下关联式:
BpC B 0 B1
RTC 式中B0、B1只是对比温度的函数,由下列关系式确定:
B0
Z Z 0 Z 1
式中Z0、Z1则是(pr、Tr)的复杂函数,和ω无关。根据 实验数据得到的Z0、Z1和(pr、Tr)的函数关系见P15页 图2-7(a)(b)和图2-8(a)(b)。工程计算时,具体数 据参见附录三
二、SRK、PR、PT方程的普遍化
SRK、PR两方程式中显然引入了Pitzer提出的偏心因子概念, 对它们的普遍化(见第9页表2-3)显示,它们是基于Pitzer提 出的三参数对应态原理。具体推导过程略。
Z 1 1 0.5335 0.2387 0.8829 1 0.2387 0.2387 1 0.2387
即Z1和Z0之间相差颇大,需进行第二次迭代。
第二次迭代:取 Z 2 Z 1 0.8829
则:p
ZRT V
0.8829 8.314 323.16 1.25 104
2.3.1两参数对比态原理
一、原理的导出
令:Tr T T,C
pr
p p,C
Vr
V VC
1 r
式中:Tr、pr、Vr、ρr称为对比温度、对比压力、对比摩尔体积、对比密度。
对于van der Waals方程,上节课中已经推导并得到:
a
9 8
RVCT,C
b VC,同时: 3
pC
3 8
RTC VC
将以上各值代入van der Waals方程,得:
分析:BpC 是无因次的,可以看作对比第二维里系数。 RTC
以下要解决的是该系数的计算问题:对于指定的气体来说,B仅仅 是温度的函数,B的普遍化关系只与对比温度有关,与压力无关。
因此Pitzer提出如下关联式:
BpC B 0 B1
RTC 式中B0、B1只是对比温度的函数,由下列关系式确定:
B0
Z Z 0 Z 1
式中Z0、Z1则是(pr、Tr)的复杂函数,和ω无关。根据 实验数据得到的Z0、Z1和(pr、Tr)的函数关系见P15页 图2-7(a)(b)和图2-8(a)(b)。工程计算时,具体数 据参见附录三
二、SRK、PR、PT方程的普遍化
SRK、PR两方程式中显然引入了Pitzer提出的偏心因子概念, 对它们的普遍化(见第9页表2-3)显示,它们是基于Pitzer提 出的三参数对应态原理。具体推导过程略。
化工热力学流体的PVT关系

在临界点处
PC
3 8
RTC VC
ZC
PCVC RTC
3 0.375 8
立方型方程的特点: ⑴根的情况,见P-V相图; ⑵它是由范得华1873年提出的,是一个有实际意义的状
态方程,曾获得诺贝尔奖; ⑶是第一个同时能计算汽液两相的方程; ⑷两相修整过于简单,准确度低; ⑸改进的形式为RK、PR方程; ⑹但是改进的形式均以vdW为基础。
汽液两相区的比容差随温度和压 力的上升而减少,外延至ΔV=0点, 可求得Pc,Vc和Tc.
临界点处,等温线既是极值 点又是拐点
自由度: f N P 2
P 0 V TTc
2P V 2
T Tc
0
三.P-V-T关系
在单相区 f(P,V,T)=0 隐函数 显函数 V=V(P,T) P=P(V,T) T=T(P,V)
形式
P RT - a(T) V - b V(V b)
(2-14)
b 0.08664RTc Pc
R-K Eq中 a=f(物性) SRK Eq中 a=f(物性,T)
a(T
)
a(T
c
)
(Tr
,
)
0.42748
R
2Tc2 Pc
(Tr
,
)
(Tr ,) 0.5 1 m'(1 Tr0.5 )
m' 0.481.574 - 0.1752
为表征物质分子的偏心度,既非球型分子偏离球对称的 程度,简单流体为0
R-K Eq经过修改后,应用范围扩宽。 SRK Eq:可用于两相PVT性质的计算,对烃类计算,其 精确度很高。
关于两常数(立方型)状态方程,除了我们介绍的 范德华、R-K、SRK Eq以外,还有许多方程,包括我们 讲义上的P-R Eq (2-19)和P-T Eq
化工热力学-第2章_流体的pVT关系-华东理工大学

代入式(2-12)
p RT a 8.314 273.15 1.5588 0.5 V b T V (V b) 4.636 2.6806 105 273.150.5 4.636 (4.636 2.6806) 1010
8.8307 107 (Pa)
23
2.2.1.7 立方型状态方程求解
工程计算通常采用迭代法进行计算 已知p、T,计算V 的过程。
现以PR方程为例,经恒等变形后可得:
( k 1 )
V
b p V
( k )2
RT a 2bV ( k ) b 2
初值设定方法:
对于汽相: V ( 0 ) RT p ——即以理想气体作为初值
R 2Tc 2.5 (8.314) 2 (126.2) 2.5 a 0.42748 0.42748 1.5588(Pa m 6 K 0.5 mol -2 ) pc 3.394 106 b 0.08664 RTc 8.314 126.2 b 0.08664 2.6802 10 5(m 3 mol -1) pc 3.394 106
3
2
2.5
R Tc 0.42748 pc
2
2.5
RTc 2 1 RTc b 0.08664 3 pc pc
Z c 1/ 3 0.333
RK 方程的特点:
RK方程的计算准确度有较大的提高;
用以预测气相pVT计算,效果较好,但对液相效果较差。
改进方法:把a/T 0.5改为温度函数 a(T), 得SRK方程。
0.48 1.57 0.040 0.176 0.0402 1 2.16440.5 0.3069 1
化工热力学-第2章 p-V-T关系和状态方程-60

固 液
固液
临界点 气
汽
图2-1 纯物质的p-V-T相图
2.2 纯物质的p-V-T相图
c点:临界点(Critical Point),该点表示纯物质汽-液 两相可以共存的最高温度TC和最高压力pc。在图中高 于TC和pc的区域称为超临界流体区,在这个区域流体 的属性不同于气体也不同于液体,它具有特殊的属性。
Z PV 1 B C D
RT
V V2 V3
B、C …(或B’、C’…)称作virial系数,两种virial系数 之间是相互联系的。
2.5 多常数状态方程——virial方程
用压力或体积表示的维里方程中的常数,都具有一定的 物理意义:
B,B′:第二维里系数,它表示对一定量的真实气体,两 个分子间的作用所引起的真实气体与理想气体的偏差。
一般认为,方程常数更多的高次型状态方程,适用的 范围更大,准确性更高。更多的方程常数,就需要更 多的流体物性的信息来确定,方程所包含的流体的信 息愈多,方程的预测效果就愈好。
2.4 立方型状态方程——体积根的求解
临界点,方程有三重实根,Vc 当T<Tc,压力为相应温度下
的饱和蒸气压时,方程有三个 实根,最大根是气相摩尔体积, 最小根是液相摩尔体积,中间 根无意义; 其他情况时,方程有一实根和 两个虚根,其实根为液相摩尔 体积或气相摩尔体积。
Soave是把RK方程中的常数看作是温度的函数
p
RT V b
V
a
V
b
偏心因子
a aC Tr ,
并规定其在临界温度下的值为1,即 Tr 1, 1
2.4 立方型状态方程——SRK方程
ac
0.42748 R2Tc2 pc
b
化工热力学讲义-1-第二章-流体的p-V-T关系

pVT性质实验装置简介
装置组成
高压容器、温度计、压力计、体积测量系统等。
工作原理
通过改变流体的压力、体积和温度,测量相应 的物理量变化。
适用范围
适用于气体、液体等多种流体的pVT性质测定。
实验步骤和数据处理
02
01
03
实验步骤 1. 准备实验装置,检查各部件完好。 2. 将待测流体注入高压容器中,密封容器。
p-v-t关系
p-v-t关系是指流体的压力、体积和温度之间的关系。对于理想气体, 其p-v-t关系符合理想气体状态方程,即pV=nRT,其中p为压力,V 为体积,T为温度,n为摩尔数,R为气体常数。对于实际气体,其 p-v-t关系需要考虑分子间的相互作用力和分子本身的体积等因素, 因此需要使用更复杂的状态方程来描述。
THANK YOU
感谢聆听
02
流体的压缩性与膨胀性
压缩因子及计算方法
01
压缩因子的定义
表示实际气体与理想气体偏差程 度的物理量,用Z表示。
02
压缩因子的计算方 法
通过实验测定不同温度、压力下 的气体体积,利用状态方程计算 得到。
03
压缩因子与气体性 质的关系
不同气体的压缩因子不同,与气 体的分子结构、相互作用力等因 素有关。
行提供依据。
管道压力损失计算
在管道输送过程中,流体的 压力和体积会发生变化,通 过流体的p-v-t关系可以计算 出管道的压力损失,以便优
化管道设计和运行参数。
管道泄漏检测
利用流体的p-v-t关系,可以 实时监测管道内流体的状态 变化,从而及时发现管道泄 漏等异常情况。
化学反应过程中的体积变化问题
反应体积变化预测
反应器压力控制
化工热力学-第2章-流体的p-–V--T关系-127

如何解决?
如何解决?
只有建立能反映流体p-V-T关系的解析形式 才能解决。
这就是状态方程Equation of State(EOS) 的由来。
EOS反映了体系的特征,是推算实验数据之 外信息和其它物性数据不可缺少的模型。
流体P-V-T数据+状态方程EOS是计算热力学性 质最重要的模型之一。
单相区 两相平衡线(饱和曲线)
汽化曲线、熔化曲线、升华曲线 三相点(Tt,Pt)和临界点(Tc,Pc,Vc) 等容线
临界等容线V=Vc、V>Vc、V<Vc
纯物质的p –T图
A
B 三相点
纯物质的p –T图
从 A 点到 B 点,即从液体到汽体,但 没有穿过相界面,这个变化过程是渐变的
超临界流体区 (T>Tc和P>Pc)
过冷液体区
汽液两相平衡区 F=C-P+2=1
过热蒸汽区
饱和液相线
饱和汽相线
作业
1、纯物质由蒸汽变成液体,是否必须经过冷凝的相 变化过程?为什么,举例说明。
2、当压力大于临界压力时,纯物质是否就以液态存 在。
3、由于分子间相互作用力的存在,实际气体的摩尔 体积一定小于相同压力下的理想气体的摩尔体积, 所以理想气体的压缩因子等于1,实际气体的压缩因 子就一定小于1?
2.Diagram p
Phases of a pure substance
T
e
ab c
d
Subcooled 1kg
t<ts
a
b
Saturated
t=ts
e
v
c
Saturated
t=ts
b
c
合工大-化工热力学-第二章_流体的PVT关系

a 0.42748R T
2
2.5 c
/ pc
(2-7a)
b 0.08664 RTc / pc
(2-7b)
RK 方程 (Zc=1/3=0.333) 适用非极性和弱极性化
合 物 , 计 算 准 确 度 比 van der Waals 方 程 (Zc=3/8=0.375)有很大提高,但对多数强极性化合物 有较大偏差。
(2-3)
据相律可知,单相纯流体的 p、V、T 性质中任意两个确定后,体系的状态也就 确定了。
2.2
状态方程的重要价值表现为:
用状态方程可精确地代表相当广泛范围内的 p-V-T 数 据,从而大大减少实验测定的工作量;即 关联和推算 的方法。根据有限的实验数据关联出状态方程,有了 状态方程就可推算更大温度、压力范围的数据;
b 0.07780 RTc / pc
(2-11b) (2-11c) (2-11d)
(T ) [1 k (1 Tr 0.5 )]2
k 0.3746 1.54226 0.26992 2
2.2.2
Peng-Robinson(PR) 方 程 中 常
数a仍是温度的函数,对体积表达的更
2.2.2
立方型方程形式简单,方程中一般只 有两个常数,且常数可用纯物质临界性质 和偏心因子计算。
表2-2 列出了立方型方程的三次展开式。
摩尔体积V 和压缩因子Z 的三次展开式 (2-14)~(221) 在 临界点 方程有 三重实根 所求实根 即为Vc
2.2.2
最大根是饱和 气相摩尔体积 当 T<Tc P=饱 和蒸汽 压 方程 有三 个实 根 中间的根 无物理意义 最小根是饱和 液相摩尔体积
2.2.2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甲烷:Tc= -82.62℃,pc=4.536 MPa, 。
问:室温下能否通过加压使天然气变成LNG ? 气体“液化”的先决条件是物质T<Tc。
22
临界点——最重要的性质
23
2. 制冷剂的选择
在选择氟里昂替代品时,离不开p-V-T数 据。 制冷剂工作特点:低压饱和蒸汽室温下饱 和液体交替变化。 对制冷剂的要求:
§2.1.1 T -V图 §2.1.2 P-V图 §2.1.3 P-T图 §2.1.4 P-V-T立体相图 §2.1.5 纯流体P-V-T关系的应用
21
§2.1.5 纯流体p-V-T关系的应用
1.气体液化和低温技术 流体p-V-T关系的最大应用就是气体的液化。 如空气液化、天然气液化。 为了便于储运,一般需将天然气制成液化天然气 (LNG)。
1)由于刚性容器体积保持不变, 因此加热过程在等容线上变化,到 达B1时,汽液共存相变为液相单相; 继续加热,当T>Tc,则最终单相为 超临界流体,即C1点。
2)当水慢慢加热后,则状态从位 于汽液共存区的A2,变为汽相单相 B2,继续加热,当T>Tc,则最终 单相为临界流体C2。
20
§2.1 纯流体的P-V-T相图
1)临界温度要高,否则在常温或普通低温范 围内不能被液化; 2) 在冷凝温度下的蒸汽压也不宜过高; 3)为了使蒸发压力高于大气压力。
制冷剂的选择离不开p-V-T数据。
24
3.液化气成分的选择 【例2-4】液化气是理想的气体燃料。对家庭用液化气 的要求是加压后变成液体储于高压钢瓶里,打开减压阀 后即汽化,以便燃烧。请你根据对液化气储存和使用的 要求来选择液化气成分。
溶液+萃取质A 原料A+B 萃取质A
萃取
萃取残质B
循环萃取剂
分离
新鲜萃取剂
33
§2.2 状态方程(EOS)
§2.2.1 状态方程(EOS)的定义 §2.2.2 理想气体的状态方程 §2.2.3 气体的非理想性 §2.2.4 真实气体的状态方程 §2.2.4.1 van der Waals范德华状态方程 §2.2.4.2 Redlich-Kwong状态方程 §2.2.4.3 Soave- Redlich-Kwong状态方程 §2.2.4.4 Peng-Robinson状态方程 §2.2.4.5 Virial(维里)状态方程 §2.2.5 状态方程的小结
恒温线
9
临界点—p-V-T中最重要的性质
1)Tc、pc 是纯物质能够呈现汽液平衡时的最高温度 和最高压力。 要使气体液化温度绝对不能超过Tc 。 气体“液化”的先决条件是T<Tc,否则无论施加多大 的压力都不可能使之液化。 2)临界等温的数学特征:等于临界温度的等温线在 临界点出现水平拐点。 P V TC 0 在C点 重要! 10 2 P V 2 TC 0 在C点
8
§2.1.2 P-V图
临界点
P
T 1点、2线、 2 2
V 0
P V
在C点 4区 T 0 在C点
④
超临界流体区 (T>Tc和P>Pc)
①过冷液体区L
③汽液两相平衡区 F=C-P+2=1
②过热蒸汽区
什么是正 常沸点?
①饱和液相线
(泡点线)
②饱和汽相线 (露点线 )
30
各种溶剂的临界特性
流体名称 分子式 临界压力 (bar) 临界温度 (℃) 临界密度 (g/cm3)
二氧化碳
水 氨
CO2
H2 O NH3
72.9
217.6 112.5
31.2
374.2 132.4
0.433
0.332 0.235
乙烷
乙烯 氧化二氮 丙烷 戊烷 丁烷
C2H6
C 2 H4 N2O C 3 H8 C5H12 C4H10
如何描述两相共存区不同的状态点?
纯物质从饱和液体点D到饱和蒸汽点E,
T和P保持不变的,只有体积在变化。
x
V Vl 1 x Vg x
( x — 干度。 x 1 0 指饱和蒸汽在湿蒸汽
Vg V
11
·
Vl
中所占的mol或wt )
·
—系统所处两相状态点。
§2.1.3 P-T图
有了p-V-T关系,热力学的大多数问题均可得到解 决。
2
第二章 内容
§2.1 纯流体的p-V-T相图 §2.2 气体状态方程(EOS) §2.3 对应态原理和普遍化关联式 §2.4 液体的p-V-T性质 §2.5 真实气体混合物p-V-T关系
§2.6 §2.1.1 T –V 图 §2.1.2 p-V 图 §2.1.3 p-T 图 §2.1.4 p-V-T 立体相图 §2.1.5 纯流体p-V-T关系的应用及思考
4
§2.1.1 T –V 图
在常压下加热水
T 5
2 1
3 4
5
v
6
临界点
§2.1.1 T -V图
气体
液体
液体和蒸汽
饱和液相线 (泡点线) 饱和汽相线 (露点线)
表1 各种气体的Tc、pc以及正常沸点Tb
物质 Tc , ℃ pc ,atm Tb , ℃ 燃烧值,kJ/g
甲烷 乙烷 丙烷 正丁烷 正戊烷 正己烷
-82.62 32.18 96.59 151.9 196.46 234.4
45.36 48.08 41.98 37.43 33.32 29.80
-161.45 -88.65 -42.15 -0.5 36.05 68.75
具有气体一样的低粘度和高扩散系数。 在临界状态附近 ,溶质在超临界流体中的溶解度
对T、P的变化很敏感 ;
T、P微小变化会导致溶解度有几个数量级的突变 ;
超临界流体技术正是利用了这一特性,通过对T、
P的调控来进行物质的分离。
29
3)超临界萃取技术的工业应用: 超临界流体包括 : CO2 、H2O、甲苯、甲醇、乙醇等。 只有CO2 应用最多。价廉、易得、无毒,具有惊人的溶解 能力。 临界条件温和:Tc=31.1 ℃ ;pc =7.4MPa。
34
§2.2.1 状态方程(EOS)的定义
EOS是计算热力学性质最重要的模型之一。 为何?
1. EOS是物质P-V-T关系的解析式.即用一个EOS
即可精确地代表相当广泛范围内的P、V、T实验数据, 借此可精确地计算所需的P、V、T数据。 2. 用EOS可计算不能直接从实验测定的其它热力学 性质——(H,S,G)数据。
体分子本身的体积可忽略不计。
•理想气体EOS是f(P,V,T) =0 中最简单的一种形式。
36
研究理想气体的实际意义
1 在较低压力和较高温度下可用理想气体方程 进行计算。
例如:在大气环境下的空气、氮气以及常压高温
条件下的燃烧烟气等均可视为理想气体。
2 为真实气体状态方程计算提供初始值。
3 判断真实气体状态方程的极限情况的正确程 度,当 P 0 或者 V 时,任何的状 态方程都还原为理想气体方程。
5 4 1
3(T降低)
2
17
V
【例2-2】
: 现有一过程,从pV 图的状态点 a( 过 热蒸气 ) 出发,到达 状态点d(过冷液 体)可以有两种途 径:①均相途径 (a→b→c→d) ; ② 非 均 相 途 径 (a→b’→ c’→d) 。 请在 p-T 图上画出 对应的路径。
18
【例2-2】
7
§2.1.2 P-V图
P 0.2Mpa P 1Mpa T =150 C
o
P 0.4762Mpa T =150oC
P 0.4762Mpa T =150 C
o
P 0.4762Mpa T =150oC
T =150oC
P s (T1 ) P s (T2 )
T Tc Tc T1 Tc T2 Tc
1)过热蒸汽等温冷凝为过冷液体; 2)过冷液体等压加热成过热蒸汽; 3)饱和蒸汽可逆绝热膨胀 4)饱和液体恒容加热; 5) 在临界点进行的恒温膨胀
16
P
C
1)过热蒸汽等温冷凝为过冷液体; 2)过冷液体等压加热成过热蒸汽; 3)饱和蒸汽可逆绝热膨胀; 4)饱和液体恒容加热; 5)在临界点进行的恒温膨胀
甲烷 乙烷 丙烷
Ⅹ 32.18 ℃ Ⅹ
151.9℃
室内压力 1atm
27
4. 超临界流体萃取技术
1)定义:在T>Tc和P>Pc区域内,气体、液体变得不可区 分,形成的一种特殊的流体,称为超临界流体。
超临界流体区
(T>Tc和P>Pc)
28
2)特点:超临界流体兼具气体和液体两者的优点。
具有液体一样的溶解能力和密度等 ;
汽化曲线、熔化曲线、升华曲线
三相点(Tt,Pt)和临界点(Tc,Pc,Vc) 等容线
临界等容线V=Vc、V>Vc、V<Vc
13
§2.1.4 P-V-T立体相图
P-V-T立体相图
14
§2.1.4 P-V-T立体相图
水的P-V-T立体相图
15
【例2-1】 将下列纯物质经历的过程表示在 p-V图上:
2点、3线、
4区
临界等容线
液固平衡线
超临界流体区 液体区
(T>Tc和P>Pc)
临界点 固体区
汽液平衡线
气体区
三相点F=C-P+2=0
12
汽固平衡线
水的三相点:0.0098℃
P-T图的特征、相关概念
问:室温下能否通过加压使天然气变成LNG ? 气体“液化”的先决条件是物质T<Tc。
22
临界点——最重要的性质
23
2. 制冷剂的选择
在选择氟里昂替代品时,离不开p-V-T数 据。 制冷剂工作特点:低压饱和蒸汽室温下饱 和液体交替变化。 对制冷剂的要求:
§2.1.1 T -V图 §2.1.2 P-V图 §2.1.3 P-T图 §2.1.4 P-V-T立体相图 §2.1.5 纯流体P-V-T关系的应用
21
§2.1.5 纯流体p-V-T关系的应用
1.气体液化和低温技术 流体p-V-T关系的最大应用就是气体的液化。 如空气液化、天然气液化。 为了便于储运,一般需将天然气制成液化天然气 (LNG)。
1)由于刚性容器体积保持不变, 因此加热过程在等容线上变化,到 达B1时,汽液共存相变为液相单相; 继续加热,当T>Tc,则最终单相为 超临界流体,即C1点。
2)当水慢慢加热后,则状态从位 于汽液共存区的A2,变为汽相单相 B2,继续加热,当T>Tc,则最终 单相为临界流体C2。
20
§2.1 纯流体的P-V-T相图
1)临界温度要高,否则在常温或普通低温范 围内不能被液化; 2) 在冷凝温度下的蒸汽压也不宜过高; 3)为了使蒸发压力高于大气压力。
制冷剂的选择离不开p-V-T数据。
24
3.液化气成分的选择 【例2-4】液化气是理想的气体燃料。对家庭用液化气 的要求是加压后变成液体储于高压钢瓶里,打开减压阀 后即汽化,以便燃烧。请你根据对液化气储存和使用的 要求来选择液化气成分。
溶液+萃取质A 原料A+B 萃取质A
萃取
萃取残质B
循环萃取剂
分离
新鲜萃取剂
33
§2.2 状态方程(EOS)
§2.2.1 状态方程(EOS)的定义 §2.2.2 理想气体的状态方程 §2.2.3 气体的非理想性 §2.2.4 真实气体的状态方程 §2.2.4.1 van der Waals范德华状态方程 §2.2.4.2 Redlich-Kwong状态方程 §2.2.4.3 Soave- Redlich-Kwong状态方程 §2.2.4.4 Peng-Robinson状态方程 §2.2.4.5 Virial(维里)状态方程 §2.2.5 状态方程的小结
恒温线
9
临界点—p-V-T中最重要的性质
1)Tc、pc 是纯物质能够呈现汽液平衡时的最高温度 和最高压力。 要使气体液化温度绝对不能超过Tc 。 气体“液化”的先决条件是T<Tc,否则无论施加多大 的压力都不可能使之液化。 2)临界等温的数学特征:等于临界温度的等温线在 临界点出现水平拐点。 P V TC 0 在C点 重要! 10 2 P V 2 TC 0 在C点
8
§2.1.2 P-V图
临界点
P
T 1点、2线、 2 2
V 0
P V
在C点 4区 T 0 在C点
④
超临界流体区 (T>Tc和P>Pc)
①过冷液体区L
③汽液两相平衡区 F=C-P+2=1
②过热蒸汽区
什么是正 常沸点?
①饱和液相线
(泡点线)
②饱和汽相线 (露点线 )
30
各种溶剂的临界特性
流体名称 分子式 临界压力 (bar) 临界温度 (℃) 临界密度 (g/cm3)
二氧化碳
水 氨
CO2
H2 O NH3
72.9
217.6 112.5
31.2
374.2 132.4
0.433
0.332 0.235
乙烷
乙烯 氧化二氮 丙烷 戊烷 丁烷
C2H6
C 2 H4 N2O C 3 H8 C5H12 C4H10
如何描述两相共存区不同的状态点?
纯物质从饱和液体点D到饱和蒸汽点E,
T和P保持不变的,只有体积在变化。
x
V Vl 1 x Vg x
( x — 干度。 x 1 0 指饱和蒸汽在湿蒸汽
Vg V
11
·
Vl
中所占的mol或wt )
·
—系统所处两相状态点。
§2.1.3 P-T图
有了p-V-T关系,热力学的大多数问题均可得到解 决。
2
第二章 内容
§2.1 纯流体的p-V-T相图 §2.2 气体状态方程(EOS) §2.3 对应态原理和普遍化关联式 §2.4 液体的p-V-T性质 §2.5 真实气体混合物p-V-T关系
§2.6 §2.1.1 T –V 图 §2.1.2 p-V 图 §2.1.3 p-T 图 §2.1.4 p-V-T 立体相图 §2.1.5 纯流体p-V-T关系的应用及思考
4
§2.1.1 T –V 图
在常压下加热水
T 5
2 1
3 4
5
v
6
临界点
§2.1.1 T -V图
气体
液体
液体和蒸汽
饱和液相线 (泡点线) 饱和汽相线 (露点线)
表1 各种气体的Tc、pc以及正常沸点Tb
物质 Tc , ℃ pc ,atm Tb , ℃ 燃烧值,kJ/g
甲烷 乙烷 丙烷 正丁烷 正戊烷 正己烷
-82.62 32.18 96.59 151.9 196.46 234.4
45.36 48.08 41.98 37.43 33.32 29.80
-161.45 -88.65 -42.15 -0.5 36.05 68.75
具有气体一样的低粘度和高扩散系数。 在临界状态附近 ,溶质在超临界流体中的溶解度
对T、P的变化很敏感 ;
T、P微小变化会导致溶解度有几个数量级的突变 ;
超临界流体技术正是利用了这一特性,通过对T、
P的调控来进行物质的分离。
29
3)超临界萃取技术的工业应用: 超临界流体包括 : CO2 、H2O、甲苯、甲醇、乙醇等。 只有CO2 应用最多。价廉、易得、无毒,具有惊人的溶解 能力。 临界条件温和:Tc=31.1 ℃ ;pc =7.4MPa。
34
§2.2.1 状态方程(EOS)的定义
EOS是计算热力学性质最重要的模型之一。 为何?
1. EOS是物质P-V-T关系的解析式.即用一个EOS
即可精确地代表相当广泛范围内的P、V、T实验数据, 借此可精确地计算所需的P、V、T数据。 2. 用EOS可计算不能直接从实验测定的其它热力学 性质——(H,S,G)数据。
体分子本身的体积可忽略不计。
•理想气体EOS是f(P,V,T) =0 中最简单的一种形式。
36
研究理想气体的实际意义
1 在较低压力和较高温度下可用理想气体方程 进行计算。
例如:在大气环境下的空气、氮气以及常压高温
条件下的燃烧烟气等均可视为理想气体。
2 为真实气体状态方程计算提供初始值。
3 判断真实气体状态方程的极限情况的正确程 度,当 P 0 或者 V 时,任何的状 态方程都还原为理想气体方程。
5 4 1
3(T降低)
2
17
V
【例2-2】
: 现有一过程,从pV 图的状态点 a( 过 热蒸气 ) 出发,到达 状态点d(过冷液 体)可以有两种途 径:①均相途径 (a→b→c→d) ; ② 非 均 相 途 径 (a→b’→ c’→d) 。 请在 p-T 图上画出 对应的路径。
18
【例2-2】
7
§2.1.2 P-V图
P 0.2Mpa P 1Mpa T =150 C
o
P 0.4762Mpa T =150oC
P 0.4762Mpa T =150 C
o
P 0.4762Mpa T =150oC
T =150oC
P s (T1 ) P s (T2 )
T Tc Tc T1 Tc T2 Tc
1)过热蒸汽等温冷凝为过冷液体; 2)过冷液体等压加热成过热蒸汽; 3)饱和蒸汽可逆绝热膨胀 4)饱和液体恒容加热; 5) 在临界点进行的恒温膨胀
16
P
C
1)过热蒸汽等温冷凝为过冷液体; 2)过冷液体等压加热成过热蒸汽; 3)饱和蒸汽可逆绝热膨胀; 4)饱和液体恒容加热; 5)在临界点进行的恒温膨胀
甲烷 乙烷 丙烷
Ⅹ 32.18 ℃ Ⅹ
151.9℃
室内压力 1atm
27
4. 超临界流体萃取技术
1)定义:在T>Tc和P>Pc区域内,气体、液体变得不可区 分,形成的一种特殊的流体,称为超临界流体。
超临界流体区
(T>Tc和P>Pc)
28
2)特点:超临界流体兼具气体和液体两者的优点。
具有液体一样的溶解能力和密度等 ;
汽化曲线、熔化曲线、升华曲线
三相点(Tt,Pt)和临界点(Tc,Pc,Vc) 等容线
临界等容线V=Vc、V>Vc、V<Vc
13
§2.1.4 P-V-T立体相图
P-V-T立体相图
14
§2.1.4 P-V-T立体相图
水的P-V-T立体相图
15
【例2-1】 将下列纯物质经历的过程表示在 p-V图上:
2点、3线、
4区
临界等容线
液固平衡线
超临界流体区 液体区
(T>Tc和P>Pc)
临界点 固体区
汽液平衡线
气体区
三相点F=C-P+2=0
12
汽固平衡线
水的三相点:0.0098℃
P-T图的特征、相关概念
