氮族元素PPT
合集下载
氮族元素PPT课件全文

NH2OH可与醛、酮形成肟,是聚酰胺纤维和尼龙的中间体
(3) 叠氮酸 HN3
无色液体或气体
12
3
∶N-N=N∶
1 sp2 杂化 2 sp杂化 π34
H
N2H4+HNO2=HN3+2H2O
NaOH Zn
撞击
NaN3 Zn(N3)2+H2↑
N2↑ +H2↑
AgN3、Cu(N3) 2 、Pb(N3)2 、Hg(N3) 2作为雷管引爆剂 NaN3、KNO3、SiO2为主要成分用于汽车安全气囊
熔点63K,沸点75K,1mL水仅溶0.023mL,标况下密度为1.25g/L
(2)N2分子中1个σ键和2个π键,无未成对电子,反磁性 (3) N2 不活泼,具有特殊的稳定性,常温下不与任何元
素化合,升高温度可促进反应活性
(4)与锂、钙、镁等活泼金属可生成离子型化合物 室温下仅有 6Li + N2 → 2Li3N
2024/8/19
NH2OH 白色固体
N2H4 无色液体
14
联氨 (NH2-NH2,肼)性质
无色发烟液体,熔点275K,沸点386.5K,极性溶剂,与水 互溶,可溶解多种盐,溶液导电性好
热稳定性差(N-N键能小),250 ℃分解为NH3、N2和H2 二元弱碱(碱性小于NH3)
N2H4 + H2O N2H5+ + OH- K1= 1.7×10-6 N2H5+ + H2O N2H6+ + OH- K2= 7.6×10-15 氧化还原性 酸性溶液中强氧化剂,碱性溶液中是强还原剂 配位性 如 Co(N2H4)6Cl2 、 Fe(N2H4)2Cl2
氮族元素
2024/8/19
(3) 叠氮酸 HN3
无色液体或气体
12
3
∶N-N=N∶
1 sp2 杂化 2 sp杂化 π34
H
N2H4+HNO2=HN3+2H2O
NaOH Zn
撞击
NaN3 Zn(N3)2+H2↑
N2↑ +H2↑
AgN3、Cu(N3) 2 、Pb(N3)2 、Hg(N3) 2作为雷管引爆剂 NaN3、KNO3、SiO2为主要成分用于汽车安全气囊
熔点63K,沸点75K,1mL水仅溶0.023mL,标况下密度为1.25g/L
(2)N2分子中1个σ键和2个π键,无未成对电子,反磁性 (3) N2 不活泼,具有特殊的稳定性,常温下不与任何元
素化合,升高温度可促进反应活性
(4)与锂、钙、镁等活泼金属可生成离子型化合物 室温下仅有 6Li + N2 → 2Li3N
2024/8/19
NH2OH 白色固体
N2H4 无色液体
14
联氨 (NH2-NH2,肼)性质
无色发烟液体,熔点275K,沸点386.5K,极性溶剂,与水 互溶,可溶解多种盐,溶液导电性好
热稳定性差(N-N键能小),250 ℃分解为NH3、N2和H2 二元弱碱(碱性小于NH3)
N2H4 + H2O N2H5+ + OH- K1= 1.7×10-6 N2H5+ + H2O N2H6+ + OH- K2= 7.6×10-15 氧化还原性 酸性溶液中强氧化剂,碱性溶液中是强还原剂 配位性 如 Co(N2H4)6Cl2 、 Fe(N2H4)2Cl2
氮族元素
2024/8/19
无机化学教学15章氮族元素PPT课件

THANKS FOR WATCHING
感谢您的观看
应;而一氧化氮与氢气反应生成氨气,氮元素从+2价降低到-3价,发
生还原反应。
氮族元素的配位反应
01
02
03
配位键的形成
氮族元素可以与配位体形 成配位键,如氮元素与氢 离子形成配位键。
配位反应的规律
配位反应遵循电子配对原 则,即电子总数为偶数的 电子对。
配位反应的实例
硫酸铵与氢氧化钡反应生 成硫酸钡沉淀和氨气,其 中硫酸根离子中的硫与氢 离子形成配位键。
砷在历史上曾用于制造杀 虫剂、防腐剂和颜料等, 但现在已被禁止或限制使 用,因为其具有剧毒性和 致癌性。
无机化学教学15章氮族元 素ppt课件
02 氮族元素的物理性质
氮族元素的原子结构
氮族元素位于元素周期表第VA 族,包括氮(N)、磷(P)、
砷(As)、锑(Sb)和铋 (Bi)。
氮族元素的原子结构特点是价电 子数为5,最外层电子排布为 ns²np³。
总结
磷的含氧酸和含氧酸盐是无机化学中重要的化合物,它们在自然界 中广泛存在,并具有多种应用,如磷肥可用于农业生产。
砷的含氧酸和含氧酸盐
含氧酸
砷酸、亚砷酸、次砷酸等。
含氧酸盐
砷酸盐、亚砷酸盐、次砷酸盐等。
总结
砷的含氧酸和含氧酸盐在无机化学中具有一定的研究价值, 它们在自然界中广泛存在,并具有潜在的应用前景,如砷 化合物在药物和农药等领域的应用。
由于价电子数相同,氮族元素的 原子半径相近,具有相似的电子
结构和性质。
氮族元素的单质和化合物
氮族元素的单质包括氮气、磷 单质、砷单质等。
氮族元素的化合物种类繁多, 包括氧化物、氢化物、含氧酸 及其盐等。
第一章氮族元素--精品-资料.ppt

三、最高价氧化物对应的水化物的酸性 HNO3 > H3PO4 > H3AsO4 >H3SbO4
(硝酸) (磷酸) (砷酸) (锑酸) HNO2 > H3PO3 > H3AsO3 >H3SbO3
(亚硝酸)(亚磷酸)(亚砷酸)(亚锑酸)
第一节 氮和磷
一、氮气
1、在于空气中 • 化合态形式存在于多种无机物及有机物中
3、用排水法收集12mlNO于试管中,然后向倒立于水槽中 的该试管内间歇地通入氧气共12ml ,下列说法正确的是
( A D)
A、剩余氧气
B、剩余NO
C、试管中气体为红棕色
D、试管内气体先变为红棕色,后红棕色消失,反复几次,最后剩余无 色气体
有关混合气体(NO2、NO、O2、CO2、H2O) 的计算技巧
1mol镁在空气中燃烧生成的质量一定在100/3g~40g之间
二、足量的镁在1mol空气、氮气、氧气、二 氧化碳中燃烧生成的固体质量由大到小的次序是 _氮__气__>_空__气__>_二__氧__化__碳__>__氧__气__________.
2Mg + O2 =点=燃= 2MgO
(80g)
3Mg + N2 =点=燃= Mg3N2
第一章 氮族元素
一、氮族元素在周期表中的位置及元素的名称和符号
• ——第VA族
•名称 符号 主要化合价
氮
-3、+1 、
N +2、+3、
+4、+5
磷P
-3、+3、
砷 As +5
锑 Sb
+3、+5
铋 Bi
密度 熔沸点
原 子 半 径 逐 渐
(硝酸) (磷酸) (砷酸) (锑酸) HNO2 > H3PO3 > H3AsO3 >H3SbO3
(亚硝酸)(亚磷酸)(亚砷酸)(亚锑酸)
第一节 氮和磷
一、氮气
1、在于空气中 • 化合态形式存在于多种无机物及有机物中
3、用排水法收集12mlNO于试管中,然后向倒立于水槽中 的该试管内间歇地通入氧气共12ml ,下列说法正确的是
( A D)
A、剩余氧气
B、剩余NO
C、试管中气体为红棕色
D、试管内气体先变为红棕色,后红棕色消失,反复几次,最后剩余无 色气体
有关混合气体(NO2、NO、O2、CO2、H2O) 的计算技巧
1mol镁在空气中燃烧生成的质量一定在100/3g~40g之间
二、足量的镁在1mol空气、氮气、氧气、二 氧化碳中燃烧生成的固体质量由大到小的次序是 _氮__气__>_空__气__>_二__氧__化__碳__>__氧__气__________.
2Mg + O2 =点=燃= 2MgO
(80g)
3Mg + N2 =点=燃= Mg3N2
第一章 氮族元素
一、氮族元素在周期表中的位置及元素的名称和符号
• ——第VA族
•名称 符号 主要化合价
氮
-3、+1 、
N +2、+3、
+4、+5
磷P
-3、+3、
砷 As +5
锑 Sb
+3、+5
铋 Bi
密度 熔沸点
原 子 半 径 逐 渐
氮族元素PPT课件

(一) 氨和铵盐
1、 氨的制备
工业制备:ຫໍສະໝຸດ 催化剂N2 + 3 H2 高温、高压 2 NH3
300×105~700×105 Pa,约400~450 ℃
实验室制备: 2 NH4Cl(s) + Ca(OH)2(s) △ CaCl2(s) + 2 NH3↑+ 2 H2O
Mg3N2 + 6 H2O = 3 Mg(OH)2 + 2 NH3↑
氮元素
(二)联氨(肼)
2、 联氨的制备
2 NH3 + C1O- = N2H4 + C1- + H2O (NH2)2CO + NaClO + 2 NaOH = N2H4 + NaCl +
高温高压 与氢气反应: N2 + 3 H2 催 化 剂 2 NH3
与氧气反应: 与金属反应:
放电
N2 + O2
2 NO
250℃ 6 Li + N2 △ 2 Li3N
(IA 族)
3 Ca + N2 = Ca3N2 (IIA 族)
氮元素
(三)N2 的制备
1、工业制备 液体空气分馏,氮气先逸出
150×105 Pa 左右压强下钢瓶运输和使用
氮元素
2 、 氨分子的结构
不等性 sp3 杂化,有一对孤电子对 , 分子呈三角锥形结构,键角变小至 10718’ 。
3、 氨的物理性质
气态:常温常压下是具有刺激性气味的无色气体 溶液:在 20℃ 时 l dm3 水可溶解 700 dm3 氨 液态:2NH3 NH4+ + NH2-
KӨ = 1.9 10-33(-55 ℃)
氮族元素.ppt

合成氨
但工业合成用哈伯法:
高温、高压
N2(g)+3H2(g) 催化剂 2NH3(g)
Fritz Haber
1868-1934,德国物理 化学家,因发明氮气 和氨气直接合成氨的 方法,获1918年诺贝 尔化学奖 。
合成氨
1998年两位希腊化学家George Marnellos和Michael Stoukides(阿里 斯多德大学)发明一种合成氨新方法 (Science,2 Oct. 1998)。在常压下,令 H2与用He稀释的N2分别通入一加热 到570oC的以锶-铈-钇-钙钛矿多孔陶 瓷(SCY)为固体电解质的电解池中, 用覆盖在固体电解质内外表面的多 孔钯多晶薄膜的催化,转化为氨, 转化率达到78%!比近一个世纪的 哈伯法合成氨工艺通常转化率为1015%高的多。
配位反应 氮原子上的孤电子对与其它离子或分子形成 共价配,如:[Ag(NH3)2]+和BF3·NH3 都是氨配合物
弱碱性
NH3·H2O的 Kb = 1.810-5,可与酸发生中和反应
氨的衍生物 - 肼(N2H4)
制备:次氯酸钠氧化氨(氨过量),获得肼的稀溶液
NaClO + 2NH3=N2H4 + NaCl + H2O 不稳定性:联氨分子中N原子都用 sp3 杂化轨道形成键。
本族元素形成正价的趋势较强,如NF3、PBr5、AsF5、 SbCl5、BiCl3、SbCl3等,形成共价化合物是本族元 素的特征。
氮气的制备
工业上制N2:分馏液态空气。制取高纯N2需将N2通过 灼热铜网以除去O2,通过P2O5除去H2O之后,储入 钢瓶,黑瓶黄字。而O2是蓝瓶黑字,最危险的是H2 瓶,深绿瓶红字。
N2H5+ + H2O = N2H62+ + OH- K2=9.010-16 (H2联9氨8K分子)
氮族元素PPT教学课件

N2O4
NO2+SO2=NO+SO3 通常情况下纯的二氧化氮是纯净物吗?
能用湿润的淀粉KI试纸鉴别NO2和溴蒸气吗?
NO2+2KI+H2O=NO+2KOH+I2
周红杰课件 07.9
氮的氧化物——NO与NO2的性质比较
物性 毒性
NO
无无色色,、刺难激溶性气味
有毒(机理同CO)
NO2
红棕红色棕色、,易刺溶激、性刺气激味性味
周红杰课件 07.9
拓展:氮的氧化物跟氧混合后溶于水的数量分析
周红杰课件 07.9
[例1]同温同压下,在3支相同体积的试管中分别充有等体积
混合的2种气体,它们是①NO和NO2;②NO2和O2;③NH3和N2。 现将3支试管均倒置于水槽中,充分反应后,试管中剩余气
体的体积分别为V1、V2、V3,则下列关系正确的是 ( B )
周红杰课件 07.9
【例2】NO分子因污染空气而臭名昭著。近年来,发现少量的
NO在生物体内许多组织中存在,它有扩张血管、免疫、增强记
忆的功能,而成为当前生命科学的研究热点。NO亦被称为“明
星分子”,试回答下列问题:
(1)NO的危害在于 A C D (填以下项目的编号)。
A. 破坏臭氧层 B. 高温下能使一些金属被氧化
NO2+SO2=NO+SO3 NO2+2KI+H2O=NO+2KOH+I2
周红杰课件 07.9
能力·思维·方法
【例1】Murad等三位教授最早提出NO分子在人体内 有独特功能,近年来此领域研究有很大发展,因此这 三位教授荣获了1998年诺贝尔医学及生理学奖。下列
关于NO的叙述不正确的是( D )
氮族元素PPT课件

光谱纯 N2 由叠氮化钠热分解制得 2NaN3 △ 2Na + 3N2 (g)
实验室:氯化铵和亚硝酸钠饱和溶液相互作用 NH4Cl + NaNO2 NaCl + NH4NO2 NH4NO2 煮沸 N2(g) + 2H2O
2020/1/6
8
2、氮的氢化物
-3 -2 -1
-1/3
NH3 N2H4 NH2OH HN3
-3 -3
最大配
位数 4
6
-3 (-3) 两性 碱性
氨 膦 胂 SbH3 BiH3 碱性减弱,稳定性下降
氮、磷是非金属元素,砷和锑为准金属,铋是金属元素
氮族价电子层结构是ns2np3
最高氧化数为+5;与电负性较大元素结合氧化值主要是+3和+5 自上而下,+3化合物稳定性增强,+5的化合物稳定性减弱
与有空轨道的化合物直接化合,如:F3B NH3、NH4+ 2)取代反应 (氨解反应)
Na + 2 NH3 623K 2NaNH2 + H2
Ca + 2 NH3
CaNH + H2
2Al + 2 NH3
2AlN + 3H2
COCl2 + 2NH3 = CO(NH2)2 + 2HCl
2020/1/6
11
3)氧化反应
氢化物的酸碱性取决于与氢直接相连原子上
的电子云密度, 电子云密度越小,酸性越强。
(1)氨和铵盐
NH3分子中N采取不等性sp3杂化,三角锥形分子结构 NH3制备
实验室: (NH4)2SO4 + CaO → CaSO4 + H2O + NH3 2NH4Cl Ca(OH)2 CaCl2 2H2O 2NH3 (g)
实验室:氯化铵和亚硝酸钠饱和溶液相互作用 NH4Cl + NaNO2 NaCl + NH4NO2 NH4NO2 煮沸 N2(g) + 2H2O
2020/1/6
8
2、氮的氢化物
-3 -2 -1
-1/3
NH3 N2H4 NH2OH HN3
-3 -3
最大配
位数 4
6
-3 (-3) 两性 碱性
氨 膦 胂 SbH3 BiH3 碱性减弱,稳定性下降
氮、磷是非金属元素,砷和锑为准金属,铋是金属元素
氮族价电子层结构是ns2np3
最高氧化数为+5;与电负性较大元素结合氧化值主要是+3和+5 自上而下,+3化合物稳定性增强,+5的化合物稳定性减弱
与有空轨道的化合物直接化合,如:F3B NH3、NH4+ 2)取代反应 (氨解反应)
Na + 2 NH3 623K 2NaNH2 + H2
Ca + 2 NH3
CaNH + H2
2Al + 2 NH3
2AlN + 3H2
COCl2 + 2NH3 = CO(NH2)2 + 2HCl
2020/1/6
11
3)氧化反应
氢化物的酸碱性取决于与氢直接相连原子上
的电子云密度, 电子云密度越小,酸性越强。
(1)氨和铵盐
NH3分子中N采取不等性sp3杂化,三角锥形分子结构 NH3制备
实验室: (NH4)2SO4 + CaO → CaSO4 + H2O + NH3 2NH4Cl Ca(OH)2 CaCl2 2H2O 2NH3 (g)
《氮族元素》课件

例如,氨气与氯化银反应可以生成氯氨络合物,这是配位反应。
03
氮族元素的重要化合物
氮的化合物
01
02
03
氮的氧化物
一氧化氮、二氧化氮、三 氧化二氮等,是大气的主 要污染物之一,对人类健 康和生态环境造成危害。
氮的氢化物
氨气和联氨等,是重要的 化工原料,可用于合成化 肥、药物等。
氮的卤化物
氯化铵、溴化铵等,是重 要的无机盐,可用于制造 炸药、染料等。
氮族元素的绿色合成方法研究
绿色氢化物合成法
利用氢化物作为还原剂,在温和条件 下合成氮族元素化合物,具有节能、 环保、高效等优点。
生物合成法
利用微生物或酶催化,将氮气转化为 氮族元素化合物,具有可持续性和环 境友好性。
氮族元素在新能源领域的应用研究
燃料电池催化剂
氮族元素化合物如铂、钯等具有良好的电化学活性,可用作燃料电池的催化剂,提高电 池性能。
3
金属表面处理
氮族元素化合物可以用于金属表面处理,如镀锌 、镀铬等,可以提高金属的耐腐蚀性和美观度。
05
氮族元素的未来发展
氮族元素的新材料研究
氮化物陶瓷
氮化物陶瓷具有高硬度、高熔点、高 化学稳定性等优点,在高温、耐磨、 耐腐蚀等领域有广泛应用。
氮化物薄膜
氮化物薄膜具有良好的光学、电学和 力学性能,在光电器件、传感器、太 阳能电池等领域有潜在应用。
磷的化合物
磷的氧化物
五氧化二磷和三氧化二磷 等,是制备磷酸和磷肥的 重要原料。
磷的氢化物
磷烷和磷化氢等,是制备 磷化合物的重要中间体。
磷的卤化物
氯化磷和溴化磷等,可用 于制备有机磷农药和染料 等。
砷的化合物
砷的氧化物
03
氮族元素的重要化合物
氮的化合物
01
02
03
氮的氧化物
一氧化氮、二氧化氮、三 氧化二氮等,是大气的主 要污染物之一,对人类健 康和生态环境造成危害。
氮的氢化物
氨气和联氨等,是重要的 化工原料,可用于合成化 肥、药物等。
氮的卤化物
氯化铵、溴化铵等,是重 要的无机盐,可用于制造 炸药、染料等。
氮族元素的绿色合成方法研究
绿色氢化物合成法
利用氢化物作为还原剂,在温和条件 下合成氮族元素化合物,具有节能、 环保、高效等优点。
生物合成法
利用微生物或酶催化,将氮气转化为 氮族元素化合物,具有可持续性和环 境友好性。
氮族元素在新能源领域的应用研究
燃料电池催化剂
氮族元素化合物如铂、钯等具有良好的电化学活性,可用作燃料电池的催化剂,提高电 池性能。
3
金属表面处理
氮族元素化合物可以用于金属表面处理,如镀锌 、镀铬等,可以提高金属的耐腐蚀性和美观度。
05
氮族元素的未来发展
氮族元素的新材料研究
氮化物陶瓷
氮化物陶瓷具有高硬度、高熔点、高 化学稳定性等优点,在高温、耐磨、 耐腐蚀等领域有广泛应用。
氮化物薄膜
氮化物薄膜具有良好的光学、电学和 力学性能,在光电器件、传感器、太 阳能电池等领域有潜在应用。
磷的化合物
磷的氧化物
五氧化二磷和三氧化二磷 等,是制备磷酸和磷肥的 重要原料。
磷的氢化物
磷烷和磷化氢等,是制备 磷化合物的重要中间体。
磷的卤化物
氯化磷和溴化磷等,可用 于制备有机磷农药和染料 等。
砷的化合物
砷的氧化物
14第十四章氮族元素-PPT精品文档

液氨溶解活泼金属生成蓝色溶液: Na →Na+ + eNa+ + xNH3= Na(NH3)x+ e- + yNH3 = (NH3)y- (蓝色) 该溶液能导电,较稳定,有强还原性,蒸干得到原来的碱金 属,放置产生氢气。金属液氨溶液的特性是含“氨合电子”。 T4、分别写出Mg3N2和 Li3N的水解反应式。(思考) 2-5 氮的含氧化物(P659) T5、写出NO的MO式,说明键级,比较NO与N2的稳定性。
11 3.04
34 2.19
47 2.18
2019/2/25
2
§14-2 氮和它的化合物 2-1 氮的成键特征(P641)
1. 离子键:如Mg 3N2,Li3N等。 2. 共价键: 三个共价单键,如NH3、NCl3, N以sp3杂化; 一个共价单键和一个共价双键,如Cl-N=O,N以sp2杂化;
实验室法: NH4Cl+NaNO2 = NaCl+N2↑+ 2H2O 除O2,使气体通过炽热的铜丝; 除NH3,使气体通过浓硫酸洗涤; 除H2O,使气体通过碱石灰干燥剂。 其它反应: (NH4)2Cr2O7(s) = N2↑+ Cr2O3 + 4H2O 8NH3 + 3Br2(aq) = N2↑+ 6NH4Br T2、写出NH4Cl、 (NH4)2SO4、 (NH4)3PO4 和NH4NO3热分解 反应式。(P654)
2019/2/25 4
T3、写出NH3、N2H4(l)、NH2OH(s)和HN3(s)的结构 式;指出N原子的杂化方式;比较碱性的大小,并说明碱 性大小原因。(P655-659)
1 2 3
∶N=N≡N∶
N3-
H
顺式联氨(肼) N以sp3杂化 羟氨 N以sp3杂化
11 3.04
34 2.19
47 2.18
2019/2/25
2
§14-2 氮和它的化合物 2-1 氮的成键特征(P641)
1. 离子键:如Mg 3N2,Li3N等。 2. 共价键: 三个共价单键,如NH3、NCl3, N以sp3杂化; 一个共价单键和一个共价双键,如Cl-N=O,N以sp2杂化;
实验室法: NH4Cl+NaNO2 = NaCl+N2↑+ 2H2O 除O2,使气体通过炽热的铜丝; 除NH3,使气体通过浓硫酸洗涤; 除H2O,使气体通过碱石灰干燥剂。 其它反应: (NH4)2Cr2O7(s) = N2↑+ Cr2O3 + 4H2O 8NH3 + 3Br2(aq) = N2↑+ 6NH4Br T2、写出NH4Cl、 (NH4)2SO4、 (NH4)3PO4 和NH4NO3热分解 反应式。(P654)
2019/2/25 4
T3、写出NH3、N2H4(l)、NH2OH(s)和HN3(s)的结构 式;指出N原子的杂化方式;比较碱性的大小,并说明碱 性大小原因。(P655-659)
1 2 3
∶N=N≡N∶
N3-
H
顺式联氨(肼) N以sp3杂化 羟氨 N以sp3杂化
氮族元素--精品PPT课件_OK
第十二章 氮族元素
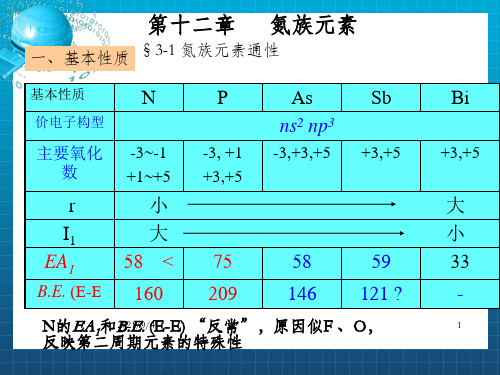
一、基本性质 §3-1 氮族元素通性
基本性质
N
价电子构型
主要氧化 数
r I1 EA1
B.E. (E-E
-3~-1 +1~+5
小 大 58 <
160
P
-3, +1 +3,+5
75 209
As ns2 np3
-3,+3,+5
Sb
+3,+5
58
59
146 121 ?
N反的映E第A二1和周B20期.2E1/9.元/(4E素-E的) “特反殊常性”,原因似F 、O,
砷 黄砷 As4 分子晶体 灰砷 金属状晶体(层状)
锑 黄锑 Sb4 分子晶体 灰锑 金属状晶体(层状)
铋 金属晶体,(层状)(教材P.80,图3-4)
2021/9/4
13
As、Sb、Bi皆为亲硫元素→硫化物存在
As2S3, As2S5 Sb2S3, Sb2S5 Bi2S3 3.2 As、Sb、Bi与N、P的比较
它的分子结构如图学方程式
(2) 在上述生成的含氧酸溶液中滴加AgNO3溶液, 有银析出,在试管口有红棕色气体出现,写出反应的化学方程
式。
(3)在NaH2PO4溶液中加入AgNO3溶液,有黄色沉淀生成,请设 计一个简单实验,确定沉淀的成分是
Ag2H2PO4还是Ag3PO4.
可以置换Au+、Ag+、Cu2+、Pb2+
(2)在热碱溶液中歧化
P4 3KOH 20231/H9/42O PH3 3KH2PO2
类似Cl2、Br2、I2、S
( 次磷酸钾) 12
2.2 红磷 结构:有人认为是若干白磷分子断开一键后 互相结合为链状。 化性不如白磷活泼
一、基本性质 §3-1 氮族元素通性
基本性质
N
价电子构型
主要氧化 数
r I1 EA1
B.E. (E-E
-3~-1 +1~+5
小 大 58 <
160
P
-3, +1 +3,+5
75 209
As ns2 np3
-3,+3,+5
Sb
+3,+5
58
59
146 121 ?
N反的映E第A二1和周B20期.2E1/9.元/(4E素-E的) “特反殊常性”,原因似F 、O,
砷 黄砷 As4 分子晶体 灰砷 金属状晶体(层状)
锑 黄锑 Sb4 分子晶体 灰锑 金属状晶体(层状)
铋 金属晶体,(层状)(教材P.80,图3-4)
2021/9/4
13
As、Sb、Bi皆为亲硫元素→硫化物存在
As2S3, As2S5 Sb2S3, Sb2S5 Bi2S3 3.2 As、Sb、Bi与N、P的比较
它的分子结构如图学方程式
(2) 在上述生成的含氧酸溶液中滴加AgNO3溶液, 有银析出,在试管口有红棕色气体出现,写出反应的化学方程
式。
(3)在NaH2PO4溶液中加入AgNO3溶液,有黄色沉淀生成,请设 计一个简单实验,确定沉淀的成分是
Ag2H2PO4还是Ag3PO4.
可以置换Au+、Ag+、Cu2+、Pb2+
(2)在热碱溶液中歧化
P4 3KOH 20231/H9/42O PH3 3KH2PO2
类似Cl2、Br2、I2、S
( 次磷酸钾) 12
2.2 红磷 结构:有人认为是若干白磷分子断开一键后 互相结合为链状。 化性不如白磷活泼
二轮复习氮族元素.ppt

(4) NO、NO2、 O2三种混合气体通入水中,可先按(1) 求出NO2与H2O反应生成的NO的体积,再加上原混合气体 中的NO的体积即为NO的总体积,再按(3)方法进行计 算。
值得注意的是: 4NO2+O2和4NO+3 O2从组成上均相当 与2N2O5的组成。即(2)、(3)两种情况中的总反应 式都与N2O5+ H2O 2HNO3等效。这不仅是记忆(2) (3)二式的方法,也为上述问题的解决提供了新的思 路。即利用混合气体中N、O原子个数比进行分析判断:
(3)磷的两种同素异形体白磷和红磷的比较
单质
白磷
红磷
分子结构 P4正四面体,分子晶体
色态
白色蜡状固体
结构复杂,分子晶体 暗红色粉末
溶 解 性 不溶于水,易溶于二硫化碳 不溶于水和二硫化碳
毒性
剧毒
着火点、 保存
40℃,易自燃,储存在水中
转化
白磷
隔绝空气加热到260℃ 加热到416℃以上冷却
无
毒
240℃,可燃,储 存在密闭瓶中
3Cu+8HNO3(稀)
3Cu(NO3)2+2NO↑+2H2O
(2)与活泼金属反应
Fe、Al遇浓硝酸钝化,加热则反应(一般生成NO2)
Mg、Zn常温下可以与任何浓度的硝酸反应(还原 产物可以是NO2、NO、N2、NH4NO3等。)
1. 浓硝酸保存在有玻璃塞的棕色试剂瓶中,为什么?还有哪 些试剂如此保存?
=4︰1,恰好完全反应 V(NO2):V(O2) > 4︰1,NO2过量剩余气体为NO
<4︰1, O2过量,剩余气体为O2
(3)NO和O2同时通入水中,其反应是:
4NO+3O2+2H2O
氮族元素精选教学PPT课件

2.最高价均为+5价,最高价氧化物通式为R2O5,对应水 化物通式为HRO3或H3RO4。
3.均有+3价化合物。其氧化物为R2O3,对应水化物为 HRO2或H3RO3。
4.气态氢化物通式为RH3。
特殊性 :
1.氮元素最高价含氧酸写法为HNO3,其余为 H3RO4。
2.+5价氮元素有较强氧化性,+5价磷元素 则不显氧化性。
假如人生不曾相遇,我不知道自己有那样一个习惯,收集你的欢笑,收集你的感情,收集你的一切一切。 假如人生不曾相遇,我不能深刻的体会孤独和忧伤,有着莫名的感动,激荡着热泪盈眶的心情入眠。
假如人生不曾相遇,我不会保持着一个人的想象,即使这想象难免寂寞无奈,但我仍然坚持着这样的梦想。 假如人生不曾相遇,我怎会理解一个人的孤独是那样铭心,但却可以释放自我的彷徨与无助。含泪的沧桑,无限的困惑,因为遇见了你,才会有更深的意义。可为什么在爱的时候,总伴着淡淡的心伤?
3.氮元素的变价最多,其氧化物种类最多, 五种正价,但有六种氧化物。
(三)氮族元素的单质物理性质及递变规律
第一节 氮和磷
(一)氮的存在 1.
2.N2的工业制法: (1)物理方法:
(2)化学方法:
(二)氮气的物理性质: 无色无味,难溶于水,比空气稍轻。
(三)氮气的化学性质
2.氮气的化学性质
氮族元素
(一)氮族元素的名称符号及在周期表中的位置
氮族元包括氮(N)、磷(P)、砷(As)、锑(Sb)、 鉍(Bi)五种元素,在周期表中位于VA族。
(二)氮族元素的相似性、递变性、特殊性
相似性
1.最外电子层上均有5个电子,能获得3个电子,在与 金属、氢气反应时显-3价,有氧化性,在与O2反应时显 正价,有还原性。
《氮族元素》PPT课件

OH
OH
焦磷酸 四元酸
Kθ a1
3.0×10-2
06.01.2021
P
HO
H
HO
亚磷酸 二元酸
5.0×10-2
整理ppt
P
H
H
HO
次磷酸 一元酸
1.0×10-2
17
T26.怎样鉴别磷酸盐、焦磷酸盐和偏磷酸盐?(思考)
加AgNO3溶液,都有沉淀,但颜色不同:
Ag3PO4
Ag4P2O7
AgPO3
黄
白色 白色
2NH3 + ClO- = N2H4 + Cl- + H2O 在催化剂作用下,H2还原NO2得到NH2OH(s)
液氨溶解活泼金属生成蓝色溶液: Na →Na+ + e- Na+ + xNH3= Na(NH3)x+ e- + yNH3 = (NH3)y- (蓝色) 该溶液能导电,较稳定,有强还原性,蒸干得到原来的碱金
16
T24.画出H3PO4的结构式,说明磷与非羟基氧的成键特征。(P681)
O
P
HO OH
OH
三元酸
氢键
两个d←pπ键
Kθ a1
=7.6×10-3
属于中强酸,无氧化性。
T25.分别画出H4P2O7、H3PO3、H3PO2的结构式,指出各是几元
酸,比较酸性的强弱。(p682-688)
O
O
O
O
HO P O P OH
属,放置产生氢气。金属液氨溶液的特性是含“氨合电子”。
T4、分别写出Mg3N2和 Li3N的水解反应式。(思考) 2-5 氮的含氧化物(P659)
T5、写出NO的MO式,说明键级,比较NO与N2的稳定性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.NO2 红棕色,有刺激性,有毒的气体,溶于 水,跟水反应。 (l) NO2不能用排水法收集,只能用排空气法。 (2) NO2具有氧化性,可使KI淀粉试纸变蓝, 鉴别NO2和溴蒸气不能用淀粉KI试纸。可用加水 振荡法或加AgNO3溶液法。 (3)氮的氧化物都是大气污染物,其中NO2是 造成光化学污染的主要因素。
氮 族
元
素
(一)氮族元素的名称符号及在周期表中的位置
氮族元包括氮(N)、磷(P)、砷(As)、锑(Sb)、 鉍(Bi)五种元素,在周期表中位于VA族。
(二)氮族元素的相似性、递变性、特殊性 相似性 1.最外电子层上均有5个电子,能获得3个电子,在与 金属、氢气反应时显-3价,有氧化性,在与O2反应时显 正价,有还原性。
3. H3PO4 纯净的是无色晶体,通常用的80 %的磷酸为无色粘稠状液体,是高沸点、中 等强度的三元酸。跟碱反应,根据量的不同, 可形成三种盐。 如:Na3PO4 Na2HPO4 NaH +4 +5 +6
1.五种正价,六种氧化物: N2O、NO、N2O3、NO2、N2O4、N2O5,只有N2O3 、
N2O5, 分别属于HNO2 和 HNO3的酸酐。
2.NO 无色有毒的气体,难溶于水,主要表现 还原性。 2NO+O2=2NO2(红棕色)(NO检验方法) 故:NO与 O2不能共存,收集NO只能用排水法 不能用排空气法。
4.有关混合气体(NO2、NO、O2等)与水反应的计 算 (l) NO2 、 NO (或N2)混合气体溶于水,一般 利用: 3NO2+H2O=2HNO3+NO 方程式 用差量法计算。
(2)NO2、O2的混合气体溶于水的计算,先分段 讨论 ①若O2过量,只用总方程式 4NO2+O2+2H2O=4HNO3计算 ②若NO2过量,剩余的气体是NO,应先用方程 式:3NO2+H2O=2HNO3+NO算出过量的NO2,再用 总方程式4NO2+O2+2H2O=4HNO3计算O2和参加此 反应的NO2
2.最高价均为+5价,最高价氧化物通式为R2O5,对应水 化物通式为HRO3或H3RO4。 3.均有+3价化合物。其氧化物为R2O3,对应水化物为 HRO2或H3RO3。
4.气态氢化物通式为RH3。
特殊性 : 1.氮元素最高价含氧酸写法为HNO3,其余为 H3RO4。 2.+5价氮元素有较强氧化性,+5价磷元素 则不显氧化性。 3.氮元素的变价最多,其氧化物种类最多, 五种正价,但有六种氧化物。
(3)NO、O2混合气体溶于水用方程式 4NO+3O2+2H2O=4HNO3讨论分析计算 (4)NO2、NO、O2三种混合气体通入水中先用方程式: 3NO2+H2O=2HNO3+NO 求出NO2和水反应生成的NO,然后按(3)法进行分析 计算。
三、磷
2.P2O5 白色团体,易吸水,是一种酸性固 体干燥刑,属酸性氧化物
(三)氮族元素的单质物理性质及递变规律
第一节 氮和磷
(一)氮的存在 1.
2.N2的工业制法: (1)物理方法:
(2)化学方法:
(二)氮气的物理性质: 无色无味,难溶于水,比空气稍轻。
(三)氮气的化学性质
2.氮气的化学性质
(四)氮气的用途
1.合成氨、制氮肥、硝酸 2.作保护气
(五)氮的固定 1.定义:将游离的氮(N2)转变为氮的化合物的过程 2.方法:
