氮族元素课件
合集下载
第15章 氮族元素 大学一年级 无机化学 课件

2. 氮的氧化物
• 一氧化氮(NO) 性质: 无色气体,水中溶解度较小。
2NOO2 2NO2 2NOCl2 2NOC氯 l( 化亚硝)酰 Fe2 NO[Fe(NO2)]
制备:
4N 3 (g H 5)2 ( O g 铂8 丝 ) 0 C 网 04 NO 62 ( O H g)
3 C 8H u 3 ( 稀 )N 3O C 3 )2 u 2 (N N 42 O O H O
5H3N 3O P 3H 3P4 O 5NO(g) 2H3 N S O H 2S4 O 2NO 103 H 32 N I 6 O H 3 1I0 O 2 N 2 O H O
大部分金属可溶于硝酸,硝酸被还原的 程度与金属的活泼性和硝酸的浓度有关。
Cu 4HNO3 (浓)
Cu(NO3 )2 2NO2 2H2O
M3g N26H 2O 2N3H 3Mg(2OH) M3g P26H 2O 2P3H 3Mg(2OH)
P4 3KOH 3H 2O
PH 3 2KH2PO 2
次磷酸钾
性质:无色气体,似大蒜臭味,剧毒
强还原性:P3 H 2O 2 H 3P4 O
2. 磷的氧化物
O2(足)
P 4 O 2( 不 足 ) P 4O 6 O 2 P 4O 10
聚磷酸(n个磷酸脱n-1个H2O)
n=3 三(聚)磷酸
O
O
n=2 焦磷酸
O
HO P O HHO P O HHO P OH
OH
OH
OH
O
O
O
HO P O P O P OH 2H2O
OH
OH
OH
•(聚)偏磷酸
(聚)偏磷酸 (n个H3PO4脱n个H2O) 偏磷酸:HPO3(n=1),四(聚)偏磷酸:(HPO3)4
无机化学课件氮族元素

(iii) 王水的氧化性:浓HNO3:浓HCl为3:1 叫做 王水,它的氧化性比硝酸更强,可溶解金、铂等不活 泼金属(实际上是多种氧化剂+配位剂Clˉ在起作用)
D.硝化反应—— 与有机化合物发生反应,生成 硝基化合物(RNO2).
硝酸盐NO3ˉ: (i) 结构: 正三角形,sp2杂化,有个大π36键
盐溶液显酸性(水解) 与碱溶液的反应:
NH4+ + OH- == NH3 + H2O
(iii) NH4+ 的鉴别: A. 若NH4+量多,可用加强碱加热,用湿润的蓝 色石蕊试纸(变兰)检验气体;
B. 若NH4+量少,加Nessler试剂(K2[HgI4]的KOH 溶液)检验(通常为红棕色)
NH4+ + [HgI4]2- + OH-
白磷、红磷的物理性质
白磷
红磷
色、态
白色蜡状
红棕色粉末
溶解性 毒性
着火点
不溶于水,溶于CS2 剧毒
40℃ , 易自燃
不溶于水和CS2 无毒 240℃
保存 用途 分子结构
相互转化
密封,保存于冷水中
密封,防止吸湿
制高纯度磷酸
制安全火柴、火药
P4 正四面体 键角60°
结构复杂
白磷
隔绝空气加热到260℃ 红磷
氨气的化学性质:
可发生三类反应:
A. 加合反应:NH3作为一种典型的Lewis碱,可与许多 金属离子(如Ag+、Cu2+、Co3+、Ni2+)形成配合物;与某些盐 晶体加合(如8NH3+CaCl2 → CaCl2·8NH3 )
B. 取代反应:NH3中的氢可被活泼的金属取代生成氨 基化合物(-NH2)和氢气。
氮族元素PPT课件全文

NH2OH可与醛、酮形成肟,是聚酰胺纤维和尼龙的中间体
(3) 叠氮酸 HN3
无色液体或气体
12
3
∶N-N=N∶
1 sp2 杂化 2 sp杂化 π34
H
N2H4+HNO2=HN3+2H2O
NaOH Zn
撞击
NaN3 Zn(N3)2+H2↑
N2↑ +H2↑
AgN3、Cu(N3) 2 、Pb(N3)2 、Hg(N3) 2作为雷管引爆剂 NaN3、KNO3、SiO2为主要成分用于汽车安全气囊
熔点63K,沸点75K,1mL水仅溶0.023mL,标况下密度为1.25g/L
(2)N2分子中1个σ键和2个π键,无未成对电子,反磁性 (3) N2 不活泼,具有特殊的稳定性,常温下不与任何元
素化合,升高温度可促进反应活性
(4)与锂、钙、镁等活泼金属可生成离子型化合物 室温下仅有 6Li + N2 → 2Li3N
2024/8/19
NH2OH 白色固体
N2H4 无色液体
14
联氨 (NH2-NH2,肼)性质
无色发烟液体,熔点275K,沸点386.5K,极性溶剂,与水 互溶,可溶解多种盐,溶液导电性好
热稳定性差(N-N键能小),250 ℃分解为NH3、N2和H2 二元弱碱(碱性小于NH3)
N2H4 + H2O N2H5+ + OH- K1= 1.7×10-6 N2H5+ + H2O N2H6+ + OH- K2= 7.6×10-15 氧化还原性 酸性溶液中强氧化剂,碱性溶液中是强还原剂 配位性 如 Co(N2H4)6Cl2 、 Fe(N2H4)2Cl2
氮族元素
2024/8/19
(3) 叠氮酸 HN3
无色液体或气体
12
3
∶N-N=N∶
1 sp2 杂化 2 sp杂化 π34
H
N2H4+HNO2=HN3+2H2O
NaOH Zn
撞击
NaN3 Zn(N3)2+H2↑
N2↑ +H2↑
AgN3、Cu(N3) 2 、Pb(N3)2 、Hg(N3) 2作为雷管引爆剂 NaN3、KNO3、SiO2为主要成分用于汽车安全气囊
熔点63K,沸点75K,1mL水仅溶0.023mL,标况下密度为1.25g/L
(2)N2分子中1个σ键和2个π键,无未成对电子,反磁性 (3) N2 不活泼,具有特殊的稳定性,常温下不与任何元
素化合,升高温度可促进反应活性
(4)与锂、钙、镁等活泼金属可生成离子型化合物 室温下仅有 6Li + N2 → 2Li3N
2024/8/19
NH2OH 白色固体
N2H4 无色液体
14
联氨 (NH2-NH2,肼)性质
无色发烟液体,熔点275K,沸点386.5K,极性溶剂,与水 互溶,可溶解多种盐,溶液导电性好
热稳定性差(N-N键能小),250 ℃分解为NH3、N2和H2 二元弱碱(碱性小于NH3)
N2H4 + H2O N2H5+ + OH- K1= 1.7×10-6 N2H5+ + H2O N2H6+ + OH- K2= 7.6×10-15 氧化还原性 酸性溶液中强氧化剂,碱性溶液中是强还原剂 配位性 如 Co(N2H4)6Cl2 、 Fe(N2H4)2Cl2
氮族元素
2024/8/19
无机化学教学15章氮族元素PPT课件

THANKS FOR WATCHING
感谢您的观看
应;而一氧化氮与氢气反应生成氨气,氮元素从+2价降低到-3价,发
生还原反应。
氮族元素的配位反应
01
02
03
配位键的形成
氮族元素可以与配位体形 成配位键,如氮元素与氢 离子形成配位键。
配位反应的规律
配位反应遵循电子配对原 则,即电子总数为偶数的 电子对。
配位反应的实例
硫酸铵与氢氧化钡反应生 成硫酸钡沉淀和氨气,其 中硫酸根离子中的硫与氢 离子形成配位键。
砷在历史上曾用于制造杀 虫剂、防腐剂和颜料等, 但现在已被禁止或限制使 用,因为其具有剧毒性和 致癌性。
无机化学教学15章氮族元 素ppt课件
02 氮族元素的物理性质
氮族元素的原子结构
氮族元素位于元素周期表第VA 族,包括氮(N)、磷(P)、
砷(As)、锑(Sb)和铋 (Bi)。
氮族元素的原子结构特点是价电 子数为5,最外层电子排布为 ns²np³。
总结
磷的含氧酸和含氧酸盐是无机化学中重要的化合物,它们在自然界 中广泛存在,并具有多种应用,如磷肥可用于农业生产。
砷的含氧酸和含氧酸盐
含氧酸
砷酸、亚砷酸、次砷酸等。
含氧酸盐
砷酸盐、亚砷酸盐、次砷酸盐等。
总结
砷的含氧酸和含氧酸盐在无机化学中具有一定的研究价值, 它们在自然界中广泛存在,并具有潜在的应用前景,如砷 化合物在药物和农药等领域的应用。
由于价电子数相同,氮族元素的 原子半径相近,具有相似的电子
结构和性质。
氮族元素的单质和化合物
氮族元素的单质包括氮气、磷 单质、砷单质等。
氮族元素的化合物种类繁多, 包括氧化物、氢化物、含氧酸 及其盐等。
氮族元素精选教学PPT课件

2.最高价均为+5价,最高价氧化物通式为R2O5,对应水 化物通式为HRO3或H3RO4。
3.均有+3价化合物。其氧化物为R2O3,对应水化物为 HRO2或H3RO3。
4.气态氢化物通式为RH3。
特殊性 :
1.氮元素最高价含氧酸写法为HNO3,其余为 H3RO4。
2.+5价氮元素有较强氧化性,+5价磷元素 则不显氧化性。
假如人生不曾相遇,我不知道自己有那样一个习惯,收集你的欢笑,收集你的感情,收集你的一切一切。 假如人生不曾相遇,我不能深刻的体会孤独和忧伤,有着莫名的感动,激荡着热泪盈眶的心情入眠。
假如人生不曾相遇,我不会保持着一个人的想象,即使这想象难免寂寞无奈,但我仍然坚持着这样的梦想。 假如人生不曾相遇,我怎会理解一个人的孤独是那样铭心,但却可以释放自我的彷徨与无助。含泪的沧桑,无限的困惑,因为遇见了你,才会有更深的意义。可为什么在爱的时候,总伴着淡淡的心伤?
3.氮元素的变价最多,其氧化物种类最多, 五种正价,但有六种氧化物。
(三)氮族元素的单质物理性质及递变规律
第一节 氮和磷
(一)氮的存在 1.
2.N2的工业制法: (1)物理方法:
(2)化学方法:
(二)氮气的物理性质: 无色无味,难溶于水,比空气稍轻。
(三)氮气的化学性质
2.氮气的化学性质
氮族元素
(一)氮族元素的名称符号及在周期表中的位置
氮族元包括氮(N)、磷(P)、砷(As)、锑(Sb)、 鉍(Bi)五种元素,在周期表中位于VA族。
(二)氮族元素的相似性、递变性、特殊性
相似性
1.最外电子层上均有5个电子,能获得3个电子,在与 金属、氢气反应时显-3价,有氧化性,在与O2反应时显 正价,有还原性。
氮族元素PPT课件

(一) 氨和铵盐
1、 氨的制备
工业制备:ຫໍສະໝຸດ 催化剂N2 + 3 H2 高温、高压 2 NH3
300×105~700×105 Pa,约400~450 ℃
实验室制备: 2 NH4Cl(s) + Ca(OH)2(s) △ CaCl2(s) + 2 NH3↑+ 2 H2O
Mg3N2 + 6 H2O = 3 Mg(OH)2 + 2 NH3↑
氮元素
(二)联氨(肼)
2、 联氨的制备
2 NH3 + C1O- = N2H4 + C1- + H2O (NH2)2CO + NaClO + 2 NaOH = N2H4 + NaCl +
高温高压 与氢气反应: N2 + 3 H2 催 化 剂 2 NH3
与氧气反应: 与金属反应:
放电
N2 + O2
2 NO
250℃ 6 Li + N2 △ 2 Li3N
(IA 族)
3 Ca + N2 = Ca3N2 (IIA 族)
氮元素
(三)N2 的制备
1、工业制备 液体空气分馏,氮气先逸出
150×105 Pa 左右压强下钢瓶运输和使用
氮元素
2 、 氨分子的结构
不等性 sp3 杂化,有一对孤电子对 , 分子呈三角锥形结构,键角变小至 10718’ 。
3、 氨的物理性质
气态:常温常压下是具有刺激性气味的无色气体 溶液:在 20℃ 时 l dm3 水可溶解 700 dm3 氨 液态:2NH3 NH4+ + NH2-
KӨ = 1.9 10-33(-55 ℃)
化学课件《氮族元素》优秀ppt 人教课标版

2.NO 无色有毒的气体,难溶于水,主要表 现还原性。
2NO+O2=2NO2(红棕色)(NO检验方法) 故:NO与 O2不能共存,收集NO只能用排水法 不能用排空气法。
3.NO2 红棕色,有刺激性,有毒的气体,溶于 水,跟水反应。
(l) NO2不能用排水法收集,只能用排空气法。 (2) NO2具有氧化性,可使KI淀粉试纸变蓝, 鉴别NO2和溴蒸气不能用淀粉KI试纸。可用加水 振荡法或加AgNO3溶液法。 (3)氮的氧化物都是大气污染物,其中NO2是 造成光化学污染的主要因素。
――[阿萨·赫尔帕斯爵士] 115.旅行的精神在于其自由,完全能够随心所欲地去思考.去感觉.去行动的自由。――[威廉·海兹利特]
116.昨天是张退票的支票,明天是张信用卡,只有今天才是现金;要善加利用。――[凯·里昂] 117.所有的财富都是建立在健康之上。浪费金钱是愚蠢的事,浪费健康则是二级的谋杀罪。――[B·C·福比斯] 118.明知不可而为之的干劲可能会加速走向油尽灯枯的境地,努力挑战自己的极限固然是令人激奋的经验,但适度的休息绝不可少,否则迟早会崩溃。――[迈可·汉默] 119.进步不是一条笔直的过程,而是螺旋形的路径,时而前进,时而折回,停滞后又前进,有失有得,有付出也有收获。――[奥古斯汀] 120.无论那个时代,能量之所以能够带来奇迹,主要源于一股活力,而活力的核心元素乃是意志。无论何处,活力皆是所谓“人格力量”的原动力,也是让一切伟大行动得以持续的力量。――[史迈尔斯] 121.有两种人是没有什么价值可言的:一种人无法做被吩咐去做的事,另一种人只能做被吩咐去做的事。――[C·H·K·寇蒂斯] 122.对于不会利用机会的人而言,机会就像波浪般奔向茫茫的大海,或是成为不会孵化的蛋。――[乔治桑] 123.未来不是固定在那里等你趋近的,而是要靠你创造。未来的路不会静待被发现,而是需要开拓,开路的过程,便同时改变了你和未来。――[约翰·夏尔] 124.一个人的年纪就像他的鞋子的大小那样不重要。如果他对生活的兴趣不受到伤害,如果他很慈悲,如果时间使他成熟而没有了偏见。――[道格拉斯·米尔多] 125.大凡宇宙万物,都存在着正、反两面,所以要养成由后面.里面,甚至是由相反的一面,来观看事物的态度――。[老子]
第15章-氮族元素ppt课件

NH 4Cl NaNO 2 NaCl 2H2O N2
杂质:NH3 ,NO ,O2 , H2O等
(NH4 )2 Cr2O7 (s) N2 (g) Cr2O3 4H2O
8NH3 3Br2(aq) N2(g) 6NH4Br 2NH3 2CuO(s) N2(g) 3H2O 3Cu
2Na 2NH3 350 C 2NaNH2 H2 2Mg 2NH3 Mg3N2 3H2
K3[Cr(CN)6 ] 3K 液氨 K6[Cr(CN)6 ] K2[M(CN)4 ] 2K 液氨 K4[M(CN)4] (M Ni, Pd, Pt)
4. 氨 参 与 的主要 化 学 反 应
a. 配 位 反 应 : NH3 是Lewis碱
F3B + :NH3 = F3B:NH3
NH3 + HCl → NH4Cl
Zn2 2NH2 Zn(NH2 )2 2NH2 Zn(NH2 )42
3. 形成氨合电子
活泼的碱金属或碱土金属液氨稀溶液呈蓝色, 浓溶液呈青铜色;溶液的导电能力强于任何电解质 溶液,类似金属,顺磁性,强还原性。
M1+(x+y)NH3 =M1(NH3)+y +e(NH3)x-(蓝色) M2+(2x+y)NH3 =M2(NH3)2+y +2e(NH3)x-(蓝色)
N2 具有很高的稳定性, 实验表明3000℃时 只有0.1%N2 解离.
N2 分子是已知的双原子分子中最稳定的.
15-1-2 N2的化学性质
一. 与活泼金属形成晶格能大的离子型化合物
室温下,N2 仅能与Li反应: 6Li + N2 = 2Li3N
( 有实际意义的反应温度为250℃)
ⅡA族金属都要在加热条件下才能形成氮化物:
第 15 章 氮族元素
杂质:NH3 ,NO ,O2 , H2O等
(NH4 )2 Cr2O7 (s) N2 (g) Cr2O3 4H2O
8NH3 3Br2(aq) N2(g) 6NH4Br 2NH3 2CuO(s) N2(g) 3H2O 3Cu
2Na 2NH3 350 C 2NaNH2 H2 2Mg 2NH3 Mg3N2 3H2
K3[Cr(CN)6 ] 3K 液氨 K6[Cr(CN)6 ] K2[M(CN)4 ] 2K 液氨 K4[M(CN)4] (M Ni, Pd, Pt)
4. 氨 参 与 的主要 化 学 反 应
a. 配 位 反 应 : NH3 是Lewis碱
F3B + :NH3 = F3B:NH3
NH3 + HCl → NH4Cl
Zn2 2NH2 Zn(NH2 )2 2NH2 Zn(NH2 )42
3. 形成氨合电子
活泼的碱金属或碱土金属液氨稀溶液呈蓝色, 浓溶液呈青铜色;溶液的导电能力强于任何电解质 溶液,类似金属,顺磁性,强还原性。
M1+(x+y)NH3 =M1(NH3)+y +e(NH3)x-(蓝色) M2+(2x+y)NH3 =M2(NH3)2+y +2e(NH3)x-(蓝色)
N2 具有很高的稳定性, 实验表明3000℃时 只有0.1%N2 解离.
N2 分子是已知的双原子分子中最稳定的.
15-1-2 N2的化学性质
一. 与活泼金属形成晶格能大的离子型化合物
室温下,N2 仅能与Li反应: 6Li + N2 = 2Li3N
( 有实际意义的反应温度为250℃)
ⅡA族金属都要在加热条件下才能形成氮化物:
第 15 章 氮族元素
氮族元素--精品PPT课件_OK
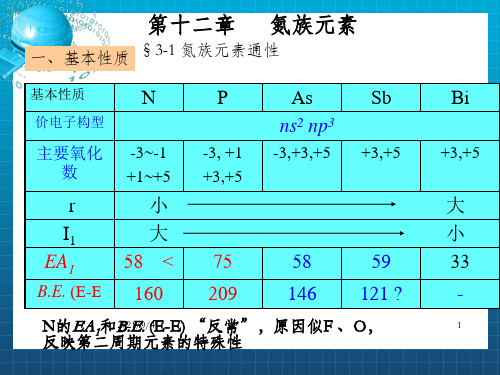
第十二章 氮族元素
一、基本性质 §3-1 氮族元素通性
基本性质
N
价电子构型
主要氧化 数
r I1 EA1
B.E. (E-E
-3~-1 +1~+5
小 大 58 <
160
P
-3, +1 +3,+5
75 209
As ns2 np3
-3,+3,+5
Sb
+3,+5
58
59
146 121 ?
N反的映E第A二1和周B20期.2E1/9.元/(4E素-E的) “特反殊常性”,原因似F 、O,
砷 黄砷 As4 分子晶体 灰砷 金属状晶体(层状)
锑 黄锑 Sb4 分子晶体 灰锑 金属状晶体(层状)
铋 金属晶体,(层状)(教材P.80,图3-4)
2021/9/4
13
As、Sb、Bi皆为亲硫元素→硫化物存在
As2S3, As2S5 Sb2S3, Sb2S5 Bi2S3 3.2 As、Sb、Bi与N、P的比较
它的分子结构如图学方程式
(2) 在上述生成的含氧酸溶液中滴加AgNO3溶液, 有银析出,在试管口有红棕色气体出现,写出反应的化学方程
式。
(3)在NaH2PO4溶液中加入AgNO3溶液,有黄色沉淀生成,请设 计一个简单实验,确定沉淀的成分是
Ag2H2PO4还是Ag3PO4.
可以置换Au+、Ag+、Cu2+、Pb2+
(2)在热碱溶液中歧化
P4 3KOH 20231/H9/42O PH3 3KH2PO2
类似Cl2、Br2、I2、S
( 次磷酸钾) 12
2.2 红磷 结构:有人认为是若干白磷分子断开一键后 互相结合为链状。 化性不如白磷活泼
一、基本性质 §3-1 氮族元素通性
基本性质
N
价电子构型
主要氧化 数
r I1 EA1
B.E. (E-E
-3~-1 +1~+5
小 大 58 <
160
P
-3, +1 +3,+5
75 209
As ns2 np3
-3,+3,+5
Sb
+3,+5
58
59
146 121 ?
N反的映E第A二1和周B20期.2E1/9.元/(4E素-E的) “特反殊常性”,原因似F 、O,
砷 黄砷 As4 分子晶体 灰砷 金属状晶体(层状)
锑 黄锑 Sb4 分子晶体 灰锑 金属状晶体(层状)
铋 金属晶体,(层状)(教材P.80,图3-4)
2021/9/4
13
As、Sb、Bi皆为亲硫元素→硫化物存在
As2S3, As2S5 Sb2S3, Sb2S5 Bi2S3 3.2 As、Sb、Bi与N、P的比较
它的分子结构如图学方程式
(2) 在上述生成的含氧酸溶液中滴加AgNO3溶液, 有银析出,在试管口有红棕色气体出现,写出反应的化学方程
式。
(3)在NaH2PO4溶液中加入AgNO3溶液,有黄色沉淀生成,请设 计一个简单实验,确定沉淀的成分是
Ag2H2PO4还是Ag3PO4.
可以置换Au+、Ag+、Cu2+、Pb2+
(2)在热碱溶液中歧化
P4 3KOH 20231/H9/42O PH3 3KH2PO2
类似Cl2、Br2、I2、S
( 次磷酸钾) 12
2.2 红磷 结构:有人认为是若干白磷分子断开一键后 互相结合为链状。 化性不如白磷活泼
《氮族元素》PPT课件

OH
OH
焦磷酸 四元酸
Kθ a1
3.0×10-2
06.01.2021
P
HO
H
HO
亚磷酸 二元酸
5.0×10-2
整理ppt
P
H
H
HO
次磷酸 一元酸
1.0×10-2
17
T26.怎样鉴别磷酸盐、焦磷酸盐和偏磷酸盐?(思考)
加AgNO3溶液,都有沉淀,但颜色不同:
Ag3PO4
Ag4P2O7
AgPO3
黄
白色 白色
2NH3 + ClO- = N2H4 + Cl- + H2O 在催化剂作用下,H2还原NO2得到NH2OH(s)
液氨溶解活泼金属生成蓝色溶液: Na →Na+ + e- Na+ + xNH3= Na(NH3)x+ e- + yNH3 = (NH3)y- (蓝色) 该溶液能导电,较稳定,有强还原性,蒸干得到原来的碱金
16
T24.画出H3PO4的结构式,说明磷与非羟基氧的成键特征。(P681)
O
P
HO OH
OH
三元酸
氢键
两个d←pπ键
Kθ a1
=7.6×10-3
属于中强酸,无氧化性。
T25.分别画出H4P2O7、H3PO3、H3PO2的结构式,指出各是几元
酸,比较酸性的强弱。(p682-688)
O
O
O
O
HO P O P OH
属,放置产生氢气。金属液氨溶液的特性是含“氨合电子”。
T4、分别写出Mg3N2和 Li3N的水解反应式。(思考) 2-5 氮的含氧化物(P659)
T5、写出NO的MO式,说明键级,比较NO与N2的稳定性。
14第十四章氮族元素-PPT精品文档

液氨溶解活泼金属生成蓝色溶液: Na →Na+ + eNa+ + xNH3= Na(NH3)x+ e- + yNH3 = (NH3)y- (蓝色) 该溶液能导电,较稳定,有强还原性,蒸干得到原来的碱金 属,放置产生氢气。金属液氨溶液的特性是含“氨合电子”。 T4、分别写出Mg3N2和 Li3N的水解反应式。(思考) 2-5 氮的含氧化物(P659) T5、写出NO的MO式,说明键级,比较NO与N2的稳定性。
11 3.04
34 2.19
47 2.18
2019/2/25
2
§14-2 氮和它的化合物 2-1 氮的成键特征(P641)
1. 离子键:如Mg 3N2,Li3N等。 2. 共价键: 三个共价单键,如NH3、NCl3, N以sp3杂化; 一个共价单键和一个共价双键,如Cl-N=O,N以sp2杂化;
实验室法: NH4Cl+NaNO2 = NaCl+N2↑+ 2H2O 除O2,使气体通过炽热的铜丝; 除NH3,使气体通过浓硫酸洗涤; 除H2O,使气体通过碱石灰干燥剂。 其它反应: (NH4)2Cr2O7(s) = N2↑+ Cr2O3 + 4H2O 8NH3 + 3Br2(aq) = N2↑+ 6NH4Br T2、写出NH4Cl、 (NH4)2SO4、 (NH4)3PO4 和NH4NO3热分解 反应式。(P654)
2019/2/25 4
T3、写出NH3、N2H4(l)、NH2OH(s)和HN3(s)的结构 式;指出N原子的杂化方式;比较碱性的大小,并说明碱 性大小原因。(P655-659)
1 2 3
∶N=N≡N∶
N3-
H
顺式联氨(肼) N以sp3杂化 羟氨 N以sp3杂化
11 3.04
34 2.19
47 2.18
2019/2/25
2
§14-2 氮和它的化合物 2-1 氮的成键特征(P641)
1. 离子键:如Mg 3N2,Li3N等。 2. 共价键: 三个共价单键,如NH3、NCl3, N以sp3杂化; 一个共价单键和一个共价双键,如Cl-N=O,N以sp2杂化;
实验室法: NH4Cl+NaNO2 = NaCl+N2↑+ 2H2O 除O2,使气体通过炽热的铜丝; 除NH3,使气体通过浓硫酸洗涤; 除H2O,使气体通过碱石灰干燥剂。 其它反应: (NH4)2Cr2O7(s) = N2↑+ Cr2O3 + 4H2O 8NH3 + 3Br2(aq) = N2↑+ 6NH4Br T2、写出NH4Cl、 (NH4)2SO4、 (NH4)3PO4 和NH4NO3热分解 反应式。(P654)
2019/2/25 4
T3、写出NH3、N2H4(l)、NH2OH(s)和HN3(s)的结构 式;指出N原子的杂化方式;比较碱性的大小,并说明碱 性大小原因。(P655-659)
1 2 3
∶N=N≡N∶
N3-
H
顺式联氨(肼) N以sp3杂化 羟氨 N以sp3杂化
氮族元素PPT课件

光谱纯 N2 由叠氮化钠热分解制得 2NaN3 △ 2Na + 3N2 (g)
实验室:氯化铵和亚硝酸钠饱和溶液相互作用 NH4Cl + NaNO2 NaCl + NH4NO2 NH4NO2 煮沸 N2(g) + 2H2O
2020/1/6
8
2、氮的氢化物
-3 -2 -1
-1/3
NH3 N2H4 NH2OH HN3
-3 -3
最大配
位数 4
6
-3 (-3) 两性 碱性
氨 膦 胂 SbH3 BiH3 碱性减弱,稳定性下降
氮、磷是非金属元素,砷和锑为准金属,铋是金属元素
氮族价电子层结构是ns2np3
最高氧化数为+5;与电负性较大元素结合氧化值主要是+3和+5 自上而下,+3化合物稳定性增强,+5的化合物稳定性减弱
与有空轨道的化合物直接化合,如:F3B NH3、NH4+ 2)取代反应 (氨解反应)
Na + 2 NH3 623K 2NaNH2 + H2
Ca + 2 NH3
CaNH + H2
2Al + 2 NH3
2AlN + 3H2
COCl2 + 2NH3 = CO(NH2)2 + 2HCl
2020/1/6
11
3)氧化反应
氢化物的酸碱性取决于与氢直接相连原子上
的电子云密度, 电子云密度越小,酸性越强。
(1)氨和铵盐
NH3分子中N采取不等性sp3杂化,三角锥形分子结构 NH3制备
实验室: (NH4)2SO4 + CaO → CaSO4 + H2O + NH3 2NH4Cl Ca(OH)2 CaCl2 2H2O 2NH3 (g)
实验室:氯化铵和亚硝酸钠饱和溶液相互作用 NH4Cl + NaNO2 NaCl + NH4NO2 NH4NO2 煮沸 N2(g) + 2H2O
2020/1/6
8
2、氮的氢化物
-3 -2 -1
-1/3
NH3 N2H4 NH2OH HN3
-3 -3
最大配
位数 4
6
-3 (-3) 两性 碱性
氨 膦 胂 SbH3 BiH3 碱性减弱,稳定性下降
氮、磷是非金属元素,砷和锑为准金属,铋是金属元素
氮族价电子层结构是ns2np3
最高氧化数为+5;与电负性较大元素结合氧化值主要是+3和+5 自上而下,+3化合物稳定性增强,+5的化合物稳定性减弱
与有空轨道的化合物直接化合,如:F3B NH3、NH4+ 2)取代反应 (氨解反应)
Na + 2 NH3 623K 2NaNH2 + H2
Ca + 2 NH3
CaNH + H2
2Al + 2 NH3
2AlN + 3H2
COCl2 + 2NH3 = CO(NH2)2 + 2HCl
2020/1/6
11
3)氧化反应
氢化物的酸碱性取决于与氢直接相连原子上
的电子云密度, 电子云密度越小,酸性越强。
(1)氨和铵盐
NH3分子中N采取不等性sp3杂化,三角锥形分子结构 NH3制备
实验室: (NH4)2SO4 + CaO → CaSO4 + H2O + NH3 2NH4Cl Ca(OH)2 CaCl2 2H2O 2NH3 (g)
《氮族元素》课件

例如,氨气与氯化银反应可以生成氯氨络合物,这是配位反应。
03
氮族元素的重要化合物
氮的化合物
01
02
03
氮的氧化物
一氧化氮、二氧化氮、三 氧化二氮等,是大气的主 要污染物之一,对人类健 康和生态环境造成危害。
氮的氢化物
氨气和联氨等,是重要的 化工原料,可用于合成化 肥、药物等。
氮的卤化物
氯化铵、溴化铵等,是重 要的无机盐,可用于制造 炸药、染料等。
氮族元素的绿色合成方法研究
绿色氢化物合成法
利用氢化物作为还原剂,在温和条件 下合成氮族元素化合物,具有节能、 环保、高效等优点。
生物合成法
利用微生物或酶催化,将氮气转化为 氮族元素化合物,具有可持续性和环 境友好性。
氮族元素在新能源领域的应用研究
燃料电池催化剂
氮族元素化合物如铂、钯等具有良好的电化学活性,可用作燃料电池的催化剂,提高电 池性能。
3
金属表面处理
氮族元素化合物可以用于金属表面处理,如镀锌 、镀铬等,可以提高金属的耐腐蚀性和美观度。
05
氮族元素的未来发展
氮族元素的新材料研究
氮化物陶瓷
氮化物陶瓷具有高硬度、高熔点、高 化学稳定性等优点,在高温、耐磨、 耐腐蚀等领域有广泛应用。
氮化物薄膜
氮化物薄膜具有良好的光学、电学和 力学性能,在光电器件、传感器、太 阳能电池等领域有潜在应用。
磷的化合物
磷的氧化物
五氧化二磷和三氧化二磷 等,是制备磷酸和磷肥的 重要原料。
磷的氢化物
磷烷和磷化氢等,是制备 磷化合物的重要中间体。
磷的卤化物
氯化磷和溴化磷等,可用 于制备有机磷农药和染料 等。
砷的化合物
砷的氧化物
03
氮族元素的重要化合物
氮的化合物
01
02
03
氮的氧化物
一氧化氮、二氧化氮、三 氧化二氮等,是大气的主 要污染物之一,对人类健 康和生态环境造成危害。
氮的氢化物
氨气和联氨等,是重要的 化工原料,可用于合成化 肥、药物等。
氮的卤化物
氯化铵、溴化铵等,是重 要的无机盐,可用于制造 炸药、染料等。
氮族元素的绿色合成方法研究
绿色氢化物合成法
利用氢化物作为还原剂,在温和条件 下合成氮族元素化合物,具有节能、 环保、高效等优点。
生物合成法
利用微生物或酶催化,将氮气转化为 氮族元素化合物,具有可持续性和环 境友好性。
氮族元素在新能源领域的应用研究
燃料电池催化剂
氮族元素化合物如铂、钯等具有良好的电化学活性,可用作燃料电池的催化剂,提高电 池性能。
3
金属表面处理
氮族元素化合物可以用于金属表面处理,如镀锌 、镀铬等,可以提高金属的耐腐蚀性和美观度。
05
氮族元素的未来发展
氮族元素的新材料研究
氮化物陶瓷
氮化物陶瓷具有高硬度、高熔点、高 化学稳定性等优点,在高温、耐磨、 耐腐蚀等领域有广泛应用。
氮化物薄膜
氮化物薄膜具有良好的光学、电学和 力学性能,在光电器件、传感器、太 阳能电池等领域有潜在应用。
磷的化合物
磷的氧化物
五氧化二磷和三氧化二磷 等,是制备磷酸和磷肥的 重要原料。
磷的氢化物
磷烷和磷化氢等,是制备 磷化合物的重要中间体。
磷的卤化物
氯化磷和溴化磷等,可用 于制备有机磷农药和染料 等。
砷的化合物
砷的氧化物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
考考自已
能证明氮元素比磷元素非金属性强的事实是( D )
(A)氮气在常温下是气体,而磷单质是固体。 与分子间作用力大小有关,与元素非金属性强弱无关
(B)氮气在空气中不能燃烧,而磷在空气中能燃烧。 因氮气分子稳定性比磷强
(C)NH3 极易溶于水,而PH3 难溶于水。 与分子间的作用力有关
(D) NH3在空气中不可燃,而PH3可燃。 表明磷元素比氮元素更易与氧结合。
氮族元素
学会读书
请阅读课本165页至166页
重点掌握
⑴ 氮族元素在周期表中的位置及原子结构特点 ⑵ 氮族元素的相似性和递变规律 ⑶ 氮族元素的原子结构和性质间的关系
练习 与 思考
画出 7N 和15P 的原子结构示意图。 根据砷、锑、铋元素在周期表中的位置,画出它 们的原子结构示意图。
7N 15P 电子排布: 2,5 2,8,5
哪一种氮族元素有同素异形体?
磷 (有红磷、白磷等) 砷 (有灰砷等)
请注意区别同素异形体和同位素两个概念
怎样证明氮、磷、砷元素的非金属性逐渐减弱?
氮 N2O5 HNO3
酸
NH3
稳 定
磷 P2O5 H3PO4
性 减
砷 As2O5 H3AsO4 弱
PH3 AsH3
性 降 低
为什么氮、磷、砷元素的非金属性逐渐减弱?
+1
+2
+3
+4
N2O NO N2O3 NO2
+5
N2O5
-3
NH3
标出下列化合物中磷元素的化合价
+5
P2O5
+5
H3PO4
+3
PCl3
-3
PH3Βιβλιοθήκη 为什么锑和铋元素没有负化合价?
锑和铋是金属元素
练习 与 思考
为什么氮、磷、砷单质的物理性质变化规律与 锑、铋单质的物理性质变化规律不同?
氮、磷、砷单质在固态时是分子晶体。(熔沸点升高) 锑、铋单质在固态时是金属晶体。(熔沸点降低)
电子层数增加,原子半径增大,获得电子的
趋势逐渐减弱,所以非金属性逐渐减弱。
硝酸分子所含的氧原子比磷酸、砷酸少。为什么? 氮原子半径小,限制了它跟氧原子成键的数目。
考考自已
现有X、Y两种ⅤA族元素,下列事实不能说明X的非金属性
比Y强的是 ( C )
(A)两种元素所形成的酸的酸性强弱:H3XO4 > H3YO4 (B)两种元素所形成的气态氢化物的稳定性: XH3 > YH3 (C)两种元素所形成的最高价氧化物的稳定性: X2O3 > Y2O3 (D)两种元素所形成的气态氢化物的还原性: YH3 > XH3
原子结构的异同点:
33As
2,8,18,5
51 Sb
2,8,18,18,5
83Bi
2,8,18,32,18,5
最外层5个电子 — ⅤA族 随核电荷数增大,电子层数增多,原子半径增大。
练习 与 思考
氮族元素化合价有何相似?有何不同?
最高正价+5价,有多种价态,负化合价-3价(非金属)
请写出氮元素氧化物和氢化物的化学式
