6(贵金属Ir)
贵金属种类、特点。用途

一、贵金属的种类根据金属的物理性质和化学性质以及在自然界中的储蓄量,到目前为止已知的贵金属有金、银、铂、钯、铑、铱、锇、钌八种元素。
这八种金属又可分为金、银、铂族金属。
铂族金属包括铂、钯、铑、铱、锇、钌。
而铑、铱、锇、钌四种元素又称稀有铂族元素。
二、贵金属的特点1、化学性能稳定,不易被氧化,不易与一般是试剂起作用,能较长时间的保持其性能及瑰丽的色泽。
2、优异的物理性能及独特的催化活性。
3、在自然界中含量稀少。
三、贵金属的性质1金(AU)金的化学符号是AU,原子序数是79,源自体积为10.11,晶体结构为面心立体晶格,原子量为196.688。
自然金是单同位素体,已知有质量数为183~204的同位素共22个,只有同位素197的金最稳当。
金的原子半径为1.46埃,由于许多金属的原子半径与金的原子半径非常接近,如:银的原子半径为1.44埃,铂的原子半径为1.39埃,这就是许多金属能与金形成合金的主要原因。
金的熔点为1063~1067℃,这是由于测量的手段不同。
通常金的熔点在1062.7~1067.4℃之间变化。
同样,金的沸点也因测量手段的不同而导致结果的差异,在2700~2950℃之间变化着。
熔融的液体金具有较大的挥发性,熔化后的金会随着温度的升高而不断地挥发。
民间的“真金不怕火炼”俗语,是在10000~1300℃的温度内而言,这是因为当时熔金炉和熔金坩埚的局限,只要黄金一旦熔化,也就没有必要升温了。
所以,并非不管温度多高,黄金永远不会有损耗。
金在不同的温度中,它的密度也有变化,通常为19.328 g/cm3,在20℃的环境中,金的密度为19.32 g/cm3。
但金在1063℃熔化时,它的密度只有17.38 g/cm3,1063℃凝固状态时为18.28 g/cm3。
金的硬度很低,为2.5,它的延伸率为40%~50%,横截面收缩率为90%~94%。
金具有良好的韧性和可锻性,可制成极薄的金箔,1盎司的金箔可贴满3cm2的面积,它还具有良好的延伸性,通常1克黄金可以拉成320m的金丝,如果在现在加工条件下,可拉成到3400m以上。
贵金属交易知识点总结

贵金属交易知识点总结贵金属是指在自然界中比较稀有,并且在工业、艺术及货币等方面都有较高价值的金属。
主要的贵金属有金、银、铂和钯等。
在贵金属交易中,投资者可以通过贵金属交易市场进行交易,获得相应的投资收益。
贵金属市场的波动较大,投资者需要对贵金属交易有一定的了解,才能够在交易中获得更多的收益。
一、贵金属市场概况贵金属市场是指金、银、铂和钯等贵金属的交易市场。
贵金属市场具有以下特点:1. 市场波动大:贵金属市场的价格波动较大,受影响因素较多,包括宏观经济政策、地缘政治等因素。
2. 需求多样化:贵金属具有工业、艺术及货币等多种用途,因此市场需求多样化。
3. 投资特性强:贵金属被认为是一种避险资产,具有较强的投资价值。
4. 交易市场较为复杂:贵金属交易市场包括期货市场、现货市场和衍生品市场等,投资者需要对这些市场有所了解。
二、贵金属交易的形式1. 贵金属现货交易:贵金属现货交易是指投资者以实物的方式进行贵金属交易,通常在国际市场进行交易。
2. 贵金属期货交易:贵金属期货交易是指投资者通过交易所进行贵金属的期货交易,具有较高的杠杆效应。
3. 贵金属衍生品交易:贵金属衍生品交易是指投资者通过金融衍生品进行贵金属交易,包括期权、差价合约等。
三、贵金属交易的相关知识点1. 贵金属价格形成机制:贵金属价格受到多种因素的影响,包括供求关系、宏观经济政策、地缘政治等因素。
2. 贵金属交易的风险管理:贵金属交易具有较大的市场波动性,投资者需要进行风险管理,包括止损、仓位控制等。
3. 贵金属交易策略:投资者可以通过各种贵金属交易策略进行交易,包括趋势策略、震荡策略等,以获得更多的投资收益。
4. 贵金属市场监管:贵金属交易市场受到各种监管,投资者需要了解相关的监管规定,以保护自身的投资权益。
四、贵金属交易的交易技巧1. 了解市场热点:投资者需要及时了解贵金属市场的热点信息,以把握市场趋势。
2. 选择合适的交易时机:投资者需要通过技术分析、基本面分析等手段,选择合适的交易时机。
锇铱钌

项链:选择项链时,要考虑装饰的效果,如果要突 出项链上的挂件,项链就不宜太长太粗;如果只想 突出项链的美观,那就要注意其款式,一般选花型 项链较适宜。项链的大小应视人而定。脖子粗的, 尺寸要大,反之要小。此外,项链的选择也应与服 装的领式配合。颈脖短的女性,可将衣领开成V形 或垂重敞开形,以此来强颈顶长的感觉,然后再配 上长而细的项链和一个小小的心形项坠,与V形领 相吻配,露在领口正中,这样就会显得颈长而苗条 了。
铂金首饰
PT 950 PT 900 PT 850 日本四种纯度,欧洲一般为PT950,我国也 大多为PT950,在美国只有PT950以上才能标注 Platnum 钯金,镀铑首饰 稀金饰品,以铜为主要材料,配稀土和其他金属组 成的新型防金特殊材料,酷似K金 亚金材料,由铜铝镍制成的合金,似K金,硬度高, 不变色。
佩戴戒指有何讲究
大拇指上一般不戴戒指,如戴即表示正在寻
觅对象;戴在食指上表示想求婚;戴在中指 上表示已订婚或已有对象;戴在无名指上表 示已订婚或已结婚;戴在小指上表示独身主 义或已离婚。有人用更简单的“追、求、订、 婚、离”五个字说明将戒指分别戴在5个手指 上的含义和暗示
配色的风格反映出设计者的喜、怒、哀、乐, 具有浓厚民族文化色彩。佩戴某种颜色的首 饰反映出佩戴者的文化修养、思想意识、爱 好、性格,同时也反映了佩戴者的愿望和情 绪
主要的化学性质
Au H2SO4 A HNO3 A 王水 D 熔融Na2o2D
Ag B D D A
Pt A A D D
Pd Rh A A D A D A D B
Ir Os A A A D A D C D
Ru A A A C
重要化合物
OsO4,RuCl3
铱的相关内容

铱铱基本资料拼音:yīyǐ繁体字:铱部首:钅部外笔画:6总笔画:11繁体部首:金部外笔画:6总笔画:14五笔86&98:QYEY仓颉:XCYHV笔顺编号:31115413534四角号码:80732UniCode:CJK统一汉字U+94F1基本字义铱● 铱元素iridiumEnglis◎ iridium元素名称:铱元素原子量:192.2元素类型:金属体积弹性模量:GPa 320原子化焓:kJ /mol @25℃ 628铱热容:J /(mol² K) 25.10导热系数:W/(m²K) 147导电性:10^6/(cm ²Ω )0.197熔化热:(千焦/摩尔) 26.10汽化热:(千焦/摩尔) 604.0原子体积:(立方厘米/摩尔) 8.54密度:(g/cm^3 )22.42元素在宇宙中的含量:(ppm)0.002元素在太阳中的含量:(ppm) 0.002地壳中含量:(ppm) 0.000003氧化态:Main Ir+3, Ir+4 Other Ir0, Ir+1, Ir+2, Ir+5, Ir+6 晶体结构:晶胞为面心立方晶胞,每个晶胞含有4个金属原子。
晶胞参数:a = 383.9 pm b = 383.9 pm c = 383.9 pm α = 90° β= 90° γ = 90°莫氏硬度:6.5声音在其中的传播速率:(m/S) 4825发现人:台奈特(Tennant)发现年代:1803年发现过程: 1803年,由英国人台奈特(Tennant)发现。
元素描述:第一电离能9.1电子伏特。
银白色金属,硬而脆。
热加工时,只要不退火,可延展加工成细丝和薄片;一旦退火,就失去延展性变铱铱属铂系元素。
铂系元素几乎完全成单质状态存在,高度分散在各种矿石中,例如原铂矿、硫化镍铜矿、磁铁矿等。
铂系元素几乎无例外地共同存在,形成天然合金。
在含铂系元素矿石中,通常以铂为主要成分,而其余铂系元素则因含量较小,必须经过化学分析才能被发现。
简述铂族金属

共生矿的冶金特点
• 开发共生矿资源,必须注意的几点: • 大量的硅酸盐脉石和铁与其它11多种有价
金属的有效分离。 • 有色金属与贵金属的分离 • 8种贵金属相互分离,以及精炼为纯金属产
品等一系列技术问题。 • 全面回收11种有价金属,实现共生资源的
有效综合利用。
共生矿开发工艺流程:
对于微量组分的贵金属, 其有效提取包括 富集、分离、精炼三个阶段
• 富集: 首先用选矿和火法熔炼分离硅酸盐脉石,使 全部有价金属富集在铜镍锍中。
• 分离: 硫酸介质中加压氧化浸出及氯化物介质中选 择性氯化浸出贱金属,使贵金属尽快富集在不溶 渣中,进入贵金属冶金系统。
• 精炼: 包括提取和制备高品位贵金属精矿—-贵金 属,全面有效溶解-相互分离-分别精炼为产品等 过程。
参考文献
• 栗亚芝、陈博--铂族金属资源勘查利用现状 分析
• 刘时杰--铂族金属提取冶金技术发展及展望 • 李艳--铂族金属在现代工业中的应用
Thank You
型催化剂、第二代 Pt/Rh双金属和第三代 Pt/Rh /Pd三金属三效 催化剂.汽车工业是消 耗PGM的第一大用户。
PGM由于具有高的物 理化学稳定性,高电导 率和热导率及特有的电 学、磁学等性能,在半 导体器件制造生产中起 关键作用,特别是近40 年来,半导体器件显著 的发展趋势是体积小、 速度快、功能多、功 耗低,因此Pt复合材料
• 铂族金属以其特别可贵 的性能和资源珍稀而著称; 与金、银合称“贵金属”
铂族金属在现在社会的应用
1
铂族金属在工业上的应用
2 医药领域的应用
3 生活上的应用
铂族金属在工业上的应用
汽车工业
半导体工业
PGM在汽车工业中的 主要作用就是制成催化
贵金属知识

贵金属知识一、贵金属的定义:地球上含量少,分布分散,开采复杂,价格昂贵。
二、贵金属主要包括:金、银、铂、钌(liao)、铑(lao)、钯(ba)、锇(e)、铱(yi)八种元素。
三、贵金属分布:1、世界黄金产量:南非、俄罗斯、美国、巴西、加拿大、澳大利亚为多。
2、铂金主要产地:加拿大、俄罗斯、非洲。
3、我国四大黄金产地:胶东、豫西、黑龙江、陕甘川三角地带。
据估计,地球中黄金总量约为:48×1014吨,但在地球各圈层中分布十分不均匀。
地核中金的含量约为47.8×1014吨,占地球金储量的99.58%,地幔中金的含量约为0.2×1014吨,占地球金储量的0.42%;地球表面金含量只占地球中黄金储量的极少部分四、黄金含量与分类1、千足金——是指含金量不小于999的金称千足金。
千足金在首饰成色命名中是最高值,印记为“千足金”、“金999”、“G999”、“AU999”。
2、足金——是指含金量千分数不小于990的金称为足金。
印记为“足金”、“金990”、“G990”、“AU990”。
3、K金:为了克服千足金与足金硬度低、颜色单一、易磨损、花纹不细巧的缺点,通常在纯金中加入一些其他金属元素以增加首饰金的硬度、变换色调、降低其熔点,这样就出现了成色高低有别、含金量明显不同的合金首饰,并冠以“Karat”一词。
K金制是国际流行的黄金计量标准,K金的完整表示法为“Karat gold”,并赋予K 金准确的含金量标准,形成了一系列的K金饰品。
K金分类:22K金:含金量为91.6%,含少量银和铜,色泽略逊于黄金。
印记为“金916”、“G22K”、“AU916”。
18K金:含金量为75%,其余为银铜等金属,色泽随银铜的比例发生变化,18K 金硬度适中,延展性较为理想,适合镶嵌各种宝石,成品不易变形、边缘不锋利、不断裂、毛峰情况较少,是一种集保值与装饰性于一体的理想首饰金。
印记为“金750”、“G18K”、“AU750”。
铂钯铑金银矿石化验

地质及化探:普查样品、槽(坑)探样品、钻孔样品、分散流样品、次生晕样品、原生晕样品等
矿石矿物:铜铅锌矿石、金矿石、钼矿石、钨矿石、钛矿石、锡矿石、锑矿石、铋矿石、汞矿石、钴矿石、镍矿石、铬矿石、铁矿石、锰矿石、磷矿石、萤石、铝土矿、硫铁矿及岩石全分析等 Atx中国矿权网
精矿产品:铜精矿、铅精矿、锌精矿、金精矿、锡精矿、锑精矿、钨精矿、钼精矿等
铂族金属包括铂(Pt)、钯(Pd)、锇(Os)、铱(Ir)、钌(Ru)、铑(Rh)六种金属。 铂族金属以其特别可贵的性能和资源珍稀而著称;与金、银合称“贵金属”。但其发现与利用相对于金、银来说要晚得多。金、银在人类纪元之前的墓葬中就有发现,而人类对铂族金属的了解和利用,不过两百多年的历史。其中铂发现最早,1735年由尤尔洛(A.De.Ulloa)发现,其余几种元素都迟至19世纪才陆续有所了解,如钯是1804年由沃拉斯顿(W.H.Wollaston)发现,钌是1845年科劳斯(K.Claus)发现。虽然发现较晚,但很快了解到它们有一些可贵的功能,因而被广泛应用于现代工业和尖端技术中。因此被称为“现代贵金属”。据报道,从公元前4000年到19世纪末,全球累计产金2.9万t,19世纪世界平均年产金123t;到1973~1980年,世界平均年产金量达1375t。铂族金属的世界产量从1969年开始超过100t,80年代末便翻了一番,达到200t(张文朴,1997),90年代初年产近300t。从这些数据不难体会出“贵金属”与“现代贵金属”深层的涵义:二者都是珍稀而贵重,而铂族元素虽然绝对数量比不上金、银,但其发展的速度深刻体现出“现代”的涵义。 铂族金属既具有相似的物理化学性质,又有各自的特性。它们的共同特性是:除了锇和钌为钢灰色外,其余均为银白色;熔点高、强度大、电热性稳定、抗电火花蚀耗性高、抗腐蚀性优良、高温抗氧化性能强、催化活性良好。各自的特性又决定了不同的用途。例如铂还有良好的塑性和稳定的电阻与电阻温度系数,可锻造成铂丝、铂箔等;它不与氧直接化合,不被酸、碱侵蚀,只溶于热的王水中;钯可溶于浓硝酸,室温下能吸收其体积350~850倍的氢气。铑和铱不溶于王水,能与熔融氢氧化钠和过氧化钠反应,生成溶解于酸的化合物;锇与钌不溶于王水,却易氧化成四氧化物。中南大学化验中心提供各种矿石化验服务,我们可以提供铂钯铑金银矿石化验,铍矿石化验,钽铌矿化验,铂族元素化验,铼铟锗锆锶稀有稀散金属化验,铁矿石化验,铜矿石化验,锰矿石化验,铅矿石分析,锌矿石化验,钼矿石化验,钴矿石化验,镍矿石化验,金矿石化验,银矿石化验,钒钛磁铁矿石化验,铝土矿矿石化验,稀土矿石化验,高岭土矿石化验,膨润土化验,凹凸土化验,多金属矿石化验等各种矿石化验,X射线荧光光谱定性半定量分析,ICP-AES全元素定性定量分析化验服务。中南大学化学成分分析中心是可以出具权威性检验报告的具备CMA计量认证资质的实验室,我们始终贯彻公正、准确、可靠、及时的质量方针,严格执行国家及行业标准规范,保证检测数据的准确性、真实性, 检测结果的科学性和正确性,对每个矿石化验检测数据负法律责任。欢迎各地新老客户来人来电光临惠顾!铂钯铑金银矿石化验请找谢老师 15084821323检测业务种类 Atx中国矿权网
贵金属的分析化学性质及其资源

贵金属的分析化学性质及其资源贵金属是钌(Ru)、铑(Rh)、钯(Pd)、锇(Os)、铱(Ir)、铂(Pt)、银(Ag)、金(Au)的统称,其中前六种元素称为铂族金属。
贵金属在自然界中含量甚微,价格昂贵,是有色金属中的贵重金属。
人类发现和应用最早的金属是金和银。
公元前,埃及、印度和中国用金和银制作高贵的装饰工艺品及货币。
金源自古英文名“Geolo”,意为黄色,元素符号“Au”由拉丁名“Aurum”而来,意为“灿烂”。
银的元素符号由白色而来。
铂是1735年西班牙科学家安东尼奥•乌洛阿(AntoniodeUlloa)在平托河金矿中发现的。
第一个科学研究的铂试样是1741年由科学家伍德(CharlesWood)从牙买加带到英国,引起国际上科学家的极大兴趣。
铂起源于西班牙文“Platina”(意为稀有的银)。
1803年英国的沃拉斯顿(WillianHydeWollaston)用NH4Cl从王水溶液中沉淀出(NH4)2[PtCl6]后,在母液中发现钯,并以1802年新发现的小行星“Pallas”命名。
1803~1804年英国沃拉斯顿在提炼铂、钯的废渣中,从一种玫瑰色盐里发现铑(希腊文意为玫瑰)。
1803年英国坦南特(SmithsonTennant)在研究王水溶解铂后的剩余残渣中发现一种颜色多变的化合物,命名为铱(拉丁文意为虹),而另一种物质的氧化物能挥发出特殊气味,命名为锇,源于“Osme”、(希腊文意为气味)。
钌是1844年俄国喀山大学化学系教授克劳斯(Kapn KapnoBNN Knayc)首先发现的,他从乌拉尔铂矿渣中制得(NH4)2[RuCl6],经煅烧后获得金属钌(拉丁文意为俄罗斯)。
铂族金属虽然发现较晚,直到本世纪初才真正进入工业规模的生产,但由于其特有的优良性质,使之成为现代科学、尖端技术和现代工业中必不可少的重要材料之一,应用范围也日益广泛。
贵金属是热和电的良好导体,具有高温稳定性,抗化学腐蚀,抗氧化性和低膨胀系数等性能。
Ir和IrRh40合金的组织结构与性能研究-贵金属

2016年11月 贵 金 属 Nov. 2016第37卷第S1期Precious MetalsV ol.37, No.S1收稿日期:2016-04-12 基金项目:国家自然科学基金(51361014)、稀贵金属综合利用国家重点实验室开放课题(SKL-SPM-201527)、云南省重点项目(2016FA053) 第一作者:蔡宏中,男,高级工程师,研究方向:稀贵金属功能材料。
E-mail :chz@ *通讯作者:胡昌义,男,研究员,研究方向:稀贵金属功能材料。
E-mail :hcy@Ir 和IrRh 40合金的组织结构与性能研究蔡宏中1, 2,易健宏2,魏 燕1,张诩翔1,郑 旭1,陈 力1,胡昌义1 *(1. 昆明贵金属研究所 稀贵金属综合利用新技术国家重点实验室,昆明 650106;2. 昆明理工大学 材料科学与工程学院,昆明 650093)摘 要:用光学显微镜和扫描电镜对尺寸为Φ6 mm 的加工态Ir 和IrRh 40合金棒材的金相组织、高温氧化后的组织和IrRh 40/GH3128合金焊缝进行了研究;采用力学试验机对IrRh 40/GH3128的焊接强度进行了研究。
结果表明,Rh 的加入在Ir 中能起到了明显的细化晶粒作用,显著提高了Ir 的抗氧化性能;IrRh 40与GH3128合金的焊接性能良好,焊缝强度可达到474 MPa 。
关键词:金属材料;Ir ;IrRh 40;组织结构;性能中图分类号:TG146.3 文献标识码:A 文章编号:1004-0676(2016)S1-0028-04Study on Microstructure and Properties of Ir and IrRh 40 AlloyCAI Hongzhong 1, 2, YI Jianhong 2, WEI Yan 1, ZHANG Xuxiang 1, ZHENG Xu 1, CHEN Li 1, 2, HU Changyi 1 *(1. State Key Laboratory of Advanced Technologies for Comprehensive Utilization of Platinum Metals,Kunming Institute of Precious Metals, Kunming 650106, China;2. Faculty of Materials and Engineering, Kunming University of Science and Technology, Kunming 650093, China)Abstract: Microstructure of processing state, microstructure after high temperature oxidation of Ir and IrRh 40 alloy bar with 6 mm were investigated by means of optical microscope (OM), scanning electron microscope (SEM); the weld fracture and welding strength of IrRh 40/GH3128 alloy were studied by OM, SEM and tensile testing machine. The results indicate that addition of Rh play a significant role in refining the grain size of Ir. The oxidation resistance of Ir is improved by addition of Rh .The welding performance of IrRh 40 and GH3128 alloy is good. Tension strength of the weld line can reach 474 MPa. Key words: metal materials; Ir; IrRh 40; structure; properties铂族金属铱熔点高(2440)℃,强度高,高温下不与碳反应形成碳化物,2100℃时仍具有很低的氧渗透率,可以在2200℃的弱氧化性气氛和高速气流冲刷下长期工作不受严重损失[1-4]。
贵金属基础认识

铂金
铂金,元素符号Pt,英文名称Platinum,密度21.4,摩 式硬度4.3,熔点1769℃。
铂金按含金量不同一般用Pt950,Pt900,Pt850, Pt800来表示。
铂金一般鉴定方法:
观色:铂金的颜色呈银色泛灰色调,细究可以发现与白银、铱 金等贵金属的银白色调有明显区分。 试软硬:铂金的硬度在4.3左右,虽然比黄金硬度略大,但高纯 度的薄款铂金首饰依旧可以用手扳动 比重法:空气中重量/(空气中重量-水中重量) 掂重:铂金的密度比黄金还要高,所以铂金首饰掂在手里的坠 感会更明显。 条痕酸测:同样是在试金石上划金道,铂金不溶于酸也不溶于 王水,所以硝酸、王水点测金道都不会有变化。 火烧法:铂金的物理化学性质稳定,高温火枪下依旧不会有变 化 测金仪:略。
白银
• 白银,元素符号Ag,英文 名称Silver,密度10.5,摩 式硬度2.7,熔点961℃。
• 按含金量区分,一般用 S990,S925,S900,S800 等表示。市面上常说的藏 银,是一种含银量很少的 合金,传统的藏银一般是 30%的银加70%的铜掺杂而 成。
其他贵金属
• 铱金:银白色,元素符号 Ir,具强金属光泽,密度 22.56,摩式硬度为7,熔 点高达2454℃,化学稳定 性高,常用于工业用途。 • 钯金:银白色,元素符号 Pd,密度12,摩式硬度44.5,熔点1555℃,溶于硝 酸和王水。因外观与铂金 相似,市面上常用钯金首 饰来充铂金首饰。
市面上常见黄金首饰印记: 足金:Au9999 Au999 Au99 G24k 24k (千)足金 等 等 K金(亦称素金,彩金): G22k G20k G18k G14k Au750 等等 镀金首饰:GP 包金首饰:GF 其中18k金一般有三色金,分别 为18k黄金、18k白金、18k玫 瑰金
(首饰贵金属材料及工艺学)首饰贵金属材料及工艺学

根据考古资料论证,在公元前七百多年时,古埃及人已能 将铂金加工成工艺水平较高的铂金饰品。
中美洲的印第安人,远在哥伦布发现新大陆之前,也盛行 过铂金饰物。
然而,除此之外其它地区的人们对铂金则一无所知,直到 十六世纪初,西班牙殖民帝国逐渐形成,大批的西班牙冒 险家蜂涌到非洲和美洲去探金寻宝。当时,在厄瓜多尔的 河流中淘金时,一再发现有一种白色金属混杂在黄金中, 其实就是珍贵的铂金。但由於当时科学不发达,识别能力 低下,面对著银晃晃的铂金,那些殖民统治者却把它称之 为“劣等碎银”而弃之。
铑(Rh)、钯(Pd)、锇(Os)和铱(Ir)发现于1803- 1804年,钌(Ru)发现于1844年。
1803年沃拉斯顿从粗铂中分离出新元素钯和铑 .
1804年英国化学家坦南特等人用王水溶解粗铂时 发现铱(Ir)命名意为“彩虹女神”(Iris) ,锇也是在 1803年坦南特等人用王水溶解粗铂时发现。
又叫“原金”、“天然金”或“荒金”,是人们从矿山或
河床边开采出来、未经提炼的黄金。凡经过提炼的黄金称
为“熟金”。熟金中因加入其他元素而使黄金在色泽上出
现变化,人们通常把被加入了金属银而没有其他金属的熟
金称之为“清色金”,而把被掺入了银和其他金属的黄金 称为“混色金”。K金是混色金成色的一种表示方式, 4.1666%黄金成分为lK。黄金按K金成色高低可以表示为 24K、22K、20K和18K等,24K黄金的含金量99.998%, 基本视为纯金,22K黄金含量为91.665%。黄金成色还可 以直接用含量百分比表示,通常是将黄金重量分成1000份 的表示法,如金件上标注9999的为99.99%,而标注为 586的为58.6%。
第一性原理研究贵金属Co、Rh、Ir的表面能和表面功函数

第一性原理研究贵金属Co、Rh、Ir的表面能和表面功函数曾祥明;欧阳楚英;雷敏生【摘要】应用基于密度泛函理论的第一性原理计算了Co、Rh、Ir等3种贵金属的3个低密勒指数表面(100)、(110)和(111)的表面能及功函数.对Co、Rh、Ir的3个不同表面的计算结果进行了对比与分析,计算值和实验值符合得较好.对于Ir(100)表面,以表面能和功函数作为Slab层数的函数研究了它们的收敛性,计算结果表明表面能收敛于0.01 J/m2,功函数收敛于0.04 eV.【期刊名称】《江西师范大学学报(自然科学版)》【年(卷),期】2010(034)004【总页数】6页(P340-345)【关键词】第一性原理;表面能;功函数;密度泛函理论【作者】曾祥明;欧阳楚英;雷敏生【作者单位】江西师范大学,物理与通信电子学院,江西,南昌,330022;江西省光电子重点实验室,江西,南昌,330022;江西师范大学,物理与通信电子学院,江西,南昌,330022;江西省光电子重点实验室,江西,南昌,330022;江西师范大学,物理与通信电子学院,江西,南昌,330022;江西省光电子重点实验室,江西,南昌,330022【正文语种】中文【中图分类】O481随着当今科学和技术的发展,表面科学已经越来越显示出其在基础研究领域中的重要性,而其中一个重要的课题就是研究固体表面上发生的物理和化学反应过程.2007年10月德国Gerhard Ertl教授因为他在研究固体表面化学反应方面的工作而获得了诺贝尔奖[1].研究固体表面上的物理和化学反应,首先必须了解表面的基本性质,如表面能、表面功函数等[2].在催化工业领域中,以Rh、Ir、Pt、Pd、Ru等为代表的Ⅷ-A族贵金属具有非常重要的作用,在很多化学反应中都是最好的催化剂[3-5].由于这些贵金属表面性质在很多领域都具有广泛应用,近来有大量的理论和实验对其进行了研究[6-7].很多先进材料表面的加工处理过程至关重要,如各种电学、磁学、光学设备,传感器、催化剂、硬质涂层等.因此,深入认识金属的表面性质对高新技术的发展具有推动作用.表面能和功函数是描述金属表面电子特性的2种最基本的物理量,它们对解释各种表面现象具有重要意义[8].表面能是描述金属表面基本属性的重要参数,它在解释各种物理化学过程(如晶格生长、催化)中起着决定性作用.用实验测表面能通常比较复杂,通过第一性原理计算的方法能很好地弥补实验数据的不足.功函数是描述金属表面特性的另一个重要参数,它对解释很多表面现象(如表面吸附等)具有决定性作用[9].在多数情况下,功函数的实验值仅适用于多晶材料,实验上测量金属功函数非常复杂,特别是要确定金属在不同表面上功函数的差异,不仅需要纯度高的、颗粒粒度比较大的金属单晶体,而且实验工艺也非常复杂[10-12].然而,通过第一性原理从头计算的方法,能够比较方便地计算不同表面的功函数,从理论上估算出这些贵金属的表面功函数.本文应用基于密度泛函理论(Density Functional Theory,简称DFT)的第一性原理计算方法,研究了Ⅷ-A族元素中的Co、Rh、Ir(同具有7外层电子结构)3种金属的3个低密勒指数表面(100)、(110)和(111)的表面能及功函数,对这些计算结果和实验进行比较,计算结果和实验符合得较好,并从物理上对这些计算结果进行了分析. 采用基于密度泛函理论第一性原理方法和超软赝势平面波方法,用程序包VASP(Vienna ab initio simula-tion package)[13-14]进行计算.计算中选用缀加平面波赝势(PAW)[15-16],电子之间的交换关联能选用Perdew-Wang(PW91)[17]的广义梯度近似(generalized gradient approximation,GG A)[18],GG A理论已被广泛地运用于固体电子结构的计算中.布里渊区中使用Monkorst-Pack[19]k-点网格,k点数的选用满足在倒空间中k点分割小于0.1Å-1.计算中,对平面波切断能ENCUT及 k-points数目进行优化,再增大平面波切断能 ENCUT或 k-points数目,体系的总能量差小于1 meV.本文首先计算了面心立方(FCC)结构的金属Co、Rh、Ir平衡时的理论晶格常数,如表1所示,计算结果与实验值符合得较好,实验值和理论值误差大约为1%.表面能和功函数的计算采用周期性平板晶胞(Slab)模型来模拟表面[20].表面直接由体块切割得到,分别建立(100)、(110)、(111)表面模型,其原子结构如图1所示(左边为侧视图,右边为俯视图).从图1可以看出,3个表面中,(110)面的层间距最小,因此其面密度最小,而(111)面的层间距最大,因此其面密度最大.采用7层原子(2×2)的超原胞,真空区域的高度取15Å,从而可以忽略不同层晶之间的相互作用.在计算中,采用了选择性分子动力学的方法,把7层原子的中间一层固定,而对其他几层原子进行驰豫,直到所有原子间的受力小于0.01 eV/Å为止.在晶体进行表面切割过程中,由于要打断晶体内部的一些存在键,在表面形成悬挂键,因此体系能量上升,导致表面变得不稳定.表面能是一个衡量表面稳定性的指标,其定义为将一个晶体切割成2部分所需要的能量,也就是产生2个表面所需要的能量.在单原子晶体的Slab超晶胞中,表面能通常是按照单位面积上的总能变化来计算[21-22]其中 n表示Slab中包含原子的个数,Eslab是所选Slab超晶胞的总能,而 Ebulk是体材料每个原胞的能量(每个原胞包含一个原子).A是平板晶胞的表面积,2表示从体材料切割表面时产生了上下2个等价的表面.对于足够厚的Slab超晶胞,其内部性质和体材料性质非常相似,因而表面能将随着Slab厚度的增加而趋于稳定,若 Eslab与 Ebulk的精度完全一致,则方程(1)能精确求出表面能.然而,在计算中存在一些不可避免的差异(如k点网格不可能完全相同),体块和表面的精度也不可能完全一致,这将导致表面能σ随着n的增加而线性地出现偏差.为了更准确地计算表面能,本文采用如下方法[23]:体块能量 Ebulk不是由单独的体相计算得到,而是首先分别计算层数逐渐增加的Slab所对应的能量 Eslab(n),并拟合出 Eslab(n)与层数 n的关系,当 n足够大时由拟合的直线斜率来得出体块能量 Ebulk,这样就避免了由于参数不一致带来的误差.对于Ir(100)表面,通过计算原子层数分别为3、5、7、9、11、13的Slab超晶胞对应的表面能,探讨了表面能随Slab厚度的变化,如表2所示.从表2中可以看到,即使对于很薄的Slab,表面能的波动也很小,表面能很容易收敛到0.01 J/m2.由公式(1)计算得到的Co、Rh、Ir各表面的表面能如表3所示.在面心立方结构晶体的3个表面中,面密度从大到小依次是(111)、(100)、(110),从而层间距从大到小也依次是(111)、(100)、(110),由于原子间距越小相互作用越强,要切割表面越难,需要的能量越大,也即对应的表面能越大.因此,对面心立方的晶体,表面能的大小应该近似满足由表3可知,Co、Rh、Ir的(111)面表面能最小,是最稳定的表面.Co、Rh、Ir表面能的计算结果与(2)式的关系一致,由计算结果和实验值进行比较可知,理论值和实验值符合得较好.功函数定义为把固体中的一个电子转移到远离表面时所需要的能量,通常用Ф表示.在热发射中,固体中的电子克服势垒逃离到真空所需要的能量即为功函数,在场发射中,固体中电子通过量子隧道到达真空所经过的势垒高度为功函数.因此,功函数小的金属比功函数大的金属容易失去电子.在光电效应中,如果一个能量比功函数大的光子照射到金属上,则会发生光电发射.19世纪70年代Lang和K ohn第一次提出了利用基于密度泛函理论(DFT)的第一性原理来计算单质的功函数,在Lang和 K ohn提出的jellium模型中,固体中的离子实和电子是均匀分布的,唯一的变量是电子密度[25].此后该理论得到了进一步的发展,它可以适用于更复杂的单质,如过渡金属和贵金属[26].在本文计算的Slab模型中,功函数由费米能级和远离表面的静电势能(取真空区域中间的值)计算得出,公式为即真空能级减去费米能级.首先以Ir(100)表面为例,测试了功函数和Slab原子层数的关系,通过逐渐增加Slab 的厚度,分别计算了3、5、7、9、11、13层原子的Slab的功函数,计算结果表明,当层数增加到7层时功函数就已经收敛,由表4可知功函数值并没有随层数的增加而趋于稳定,而是存在一定的上下震荡,这主要是由于量子尺寸效应造成的[27-28].因而,本文对功函数的计算,都采用了7层原子模型进行.图2描述了Co、Rh、Ir的静电势能沿垂直表面方向(z轴)的变化关系,Slab模型由7层原子组成,静电势能由驰豫后的Slab模型通过静态计算得到.从图2可以看出,在真空区域的势能曲线是一条平坦的直线,这说明势函数在真空区域已经收敛.真空区域取多大才能使势能函数收敛取决于Slab的厚度,在7层原子的Slab模型中真空区域取15Å就能保证功函数的收敛.由图2可知,3个表面的静电势能在原子层内的震荡强度从大到小依次是(111)、(100)、(110)面,这是由于原子之间的相互作用造成的,与分析表面能时的结果一致.由于(110)面层间距非常小,因此原子之间的相互作用非常强,导致在[110]方向上,也即(110)Slab中的z方向,金属的势函数变化非常小.对于(111)面,其面间距非常大,从而沿着[111]方向看,静电势起伏非常大,在靠近原子中心位置处,其势能非常低,而在2层原子中间,原子势场达到最大,其势函数达到了费米能级的大小.从整体上来看,金属是一个等势体,因此各个方向上,势函数的平均值应该相同.从图2可以看出,虽然不同方向上势函数波动很大,但同种金属的势函数在不同方向上的平均值基本相同.一般来说,表面能越大则功函数越小,因此功函数值的大小依次是表5总结了各个表面的功函数和相应的实验数据.从表5可以看出,Co、Rh、Ir的功函数计算结果基本满足(4)式的关系,实验值也与(4)式相符,计算结果与实验值符合得很好.对于很多金属,表面能和功函数的实验测量过程非常复杂,测量结果具有很大的不确定性,关于表面能和功函数的实验数据比较少,因此,第一性原理计算提供了一种准确估计表面能和功函数的方法.本文计算了Co、Rh、Ir的表面能和功函数,所有的结果都是基于密度泛函理论的第一性原理计算,交换关联能采用广义梯度近似(GG A),表面能和功函数的计算都是使用理论平衡晶格常数.计算结果收敛得很好,预示着这种计算方法是合理的.Co、Rh、Ir的表面能和功函数的计算结果符合理论预期的结果,并且与实验值符合得较好.对于Ir(100)表面,探讨了它的表面能和功函数与Slab模型原子层数的关系,计算结果表明,当Slab层数增加到7层时表面能和功函数都已经收敛.对于很多金属,表面能和功函数的实验结果都具有很大的不确定性和未知性,而本文的计算结果与实验值符合得比较好,这说明,第一性原理计算是能准确描述金属表面性质的重要方法,它很好地补充了实验数据的不足,为研究金属表面性质提供了一个很好的理论指导.【相关文献】[1] Ertl G.Dynamics of reactions at surfaces[J].Advances In Catalysis,2000,45:1-69.[2] Imbihl R,Ertl G.Oscillatory kinetics in heterogeneous catalysis[J].ChemicalReviews,1995,95:697-733.[3] Perry M C,Cui X H,Powell M T,et al.Optically active iridium imidazol-2-ylidene-oxazoline complexes:Preparation and use in asymmetric hydrogenation ofarylalkenes[J].Journal of the American Chemical Society,2003,125(1):113-123.[4] 张婷,雷敏生,邱新平.CO吸附于 PtRu合金(100)面上的DFT理论研究 [J].江西师范大学学报:自然科学版,2005,29(2):99-103.[5] 熊志华,欧阳企振,周珏,等.用第一性原理研究贵金属(Cu、Ag、Au)[J].江西师范大学学报:自然科学版,2005,29(5):445-448.[6] 颜超,吕海峰,张超,等.Pt(111)表面低能溅射现象的分子动力学模拟 [J].物理学报,2006,55(3):1351-1357.[7] Shetty S G,Jansen A PJ,van Santen R A.Theoretical investigation of NO dissociation on Ru(11(2)over-bar1)surface and nanoparticle[J].J Phys Chem C,2009,113(46):19749-19752.[8] Sa’adi H,Hamad B.First-priciples investigations of iridium low indexsurfaces[J].Journal of Physics and Chemistry of Solids,2008,69(10):2457-2464.[9] Skriver HL,Rosengaard N M.Surface energy and work function of elementalmetals[J].Phys Rev B,1992,46:11.[10] Helander M G,Greiner M T,Wang ZB,et al.Pitfalls in measuring workfunction using photoelectron spectroscopy[J].Applied Surface Science,2010,256(8):2602-2605.[11] JiaJ F,Inoue K,Hasegawa Y,et al.Local workfunctionfor Cu(111)-Au surface studied by scanning tunneling microscopy[J].Journal of Vacuum Science andTechnolagy,1997,15(6):1861-1864.[12] Livneh T,Asscher M.Work function study of the adsorption,lateral repulsion,and fragmentation of CH3Br on Ru(001)[J].J Phys Chem B,1997,101(38):7505-7519.[13] Kresse G,Hafner J.Ab initio molecular dynamics for liquid metals[J].Phys RevB,1993,47:558-561.[14] Kresse G,Furthmuller J.Characterization of carbon bondson theSiC(001)c(2×2)surface[J].Phys RevB,1996,54:10304-10307.[15] Blochl P E.Projector augmented-wave method[J].Phys Rev B,1994,50:17953-17979.[16] Kresse G,Joubert D.From ultrasoft pseudopotentials to the projector augmented-wave method[J].Phys Rev B,1999,59:1758-1775.[17] PerdewJ P,Wang Y.Accurate and simple analytic representation of the electron-gas correlation energy[J].Phys Rev B,1992,45:13244-13249.[18] PerdewJ P,ChevaryJ A.Atoms,molecules,solids,and surfaces:applicationsof the generalized gradient approximationfor exchange and correlation[J].Phys RevB,1992,46:6671-6687.[19] Monkhorst HJ,Pack J D.Special points for Brillouin-zone integrations[J].Phys RevB,1976,13:5188-5192.[20] Payne M C,Teter M P.Iterative minimization techniquesfor ab initio total-energy calculations:molecular dynamics and conjugate gradients[J].Rev Mod Phys,1992,64:1045-1097.[21] Stropp A,Kresse G.The shortcomings of semi-local and hybrid functionals:what we can learn from surface science studies[J].New J Phys,2008,10:63020-63036.[22] Gross A.Theoretical surface science:a microscopic perspective[M].Berlin:Springer,2003.[23] Fiorentini V,Methfessel M.Extracting convergent surface energies from slab calculations[J].J Phys Condens Matter,1996,8:6525-6529.[24] de Boer F R,Boom R,Mattens W C M,et al.Cohesion in metals[M].Amsterdam:North-Holland,1988.[25] Lang N D,K ohn W.Theory of metal surfaces:work function[J].Phys Rev B,1971(3):1215-1223.[26] Methfessel M,Hennig D,Scheffler M.Trends of the surface relaxations,surface energies,and work functions of the 4d transition metals[J].Phys Rev B,1992,46:4816-4829.[27] Wei C M,Chou M Y.Theory of quantum size effects in thin Pb(111)films[J].Phys Rev B,2002,66:233408-233411.[28] 冯庆.锐钛矿型TiO2空位缺陷性质的第一性原理研究 [J].重庆师范大学学报:自然科学版,2009,26(1):78-81.[29] Nieuwenhuys B E,Bouwman R,Sachtler W M H.The changes in work function of group Ib and Ⅷmetals on xenon adsorption,determined by field electro n and photoelectron emission[J].Thin Solid Films,1974,21(1):51-58.[30] Strayer R W,Mackie W,Swanson L W.Work function measurements by the field emission retarding potential method[J].Surf Sci,1973,34(2):225-248.[31] Yuichi Ikuno,K oichi Kusakabe.A determination method of the work function using the slab model with a first-principles electronic structure calculation[J].E-J Surf Sci Nanotech,2008,6:103-106.[32] Michaelson H B.The work function of the elements and its periodicity[J].J Appl Phys,1977,48(11):4729-4733.。
贵金属的性质及贵金属的分类知识点解说.

贵金属的性质及贵金属的分类知识点解说一、贵金属的分类贵金属元素是指金、银和铂族(铑、钌、钯、锇、铱、铂)共八种元素,在元素周期表中位于第五、六周期的第Ⅷ族和第IB副族中。
由于镧系收缩使得第二过渡元素(钌、铑、钯、银)与第三过渡元素(锇、铱、铂、金)的化学性质相差很小,因此贵金属元素的化学性质十分相近。
铂族元按其密度不同,分为轻重两组。
钌、铑、钯为轻族;锇、铱、铂为重族。
二、贵金属的分析化学性质(一)化学性质1.金金具有很高的化学稳定性,即使在高温条件下也不与氧发生化学作用,这大概就是在自然界中能够以自然金、甚至是以微小金颗粒存在的重要原因。
金与单一的盐酸、硫酸、硝酸和强碱均不发生化学反应。
金能够溶解在盐酸和硝酸的混合酸中,其中在王水中的溶解速率是最快的。
用于分析化学中的金标准溶液通常就是以王水溶解纯金来制备,但需要用盐酸反复蒸发除去多余的硝酸或氮氧化合物。
在有氧化剂存在的盐酸中,如H2O2、KMnO4、KClO3、KBrO3、KNO3和溴水等,金也能够很好被溶解,这主要是由于盐酸与氧化剂相互作用产生新生态的氯气同金发生反应所致。
2.银银有较高的化学稳定性,常温下不与氧发生化学作用,在自然界同样能够以元素形态存在。
当与其他元素发生化学反应时,通常形成正一价的银化合物。
在某些条件下也可生成二价化合物,例如AgO和AgF2,但这些化合物不稳定。
金属银易溶于硝酸生成硝酸银,也易溶于热的浓硫酸生成硫酸银,而不溶于冷的稀硫酸中。
银在盐酸和王水中并不会很快溶解,原因在于初始反应生成的Ag-以AgCl沉淀沉积在金属表面而形成一层灰黑色的保护膜,阻止了银的进一步溶解。
但是如果在浓盐酸中加入少量的硝酸,银的溶解是比较快的。
这是因为形成的AgCl又生成可溶性的AgCl2-络离子。
这一反应对含银的贵金属合金材料试样的溶解是很有用的。
银与硫接触时,会生成黑色硫化银;与游离卤作用生成相应的卤化物。
银饰品在空气中长久放置或佩戴后失去光泽常常与其表面上硫化物及其氯化物的形成有关。
贵金属资料简介
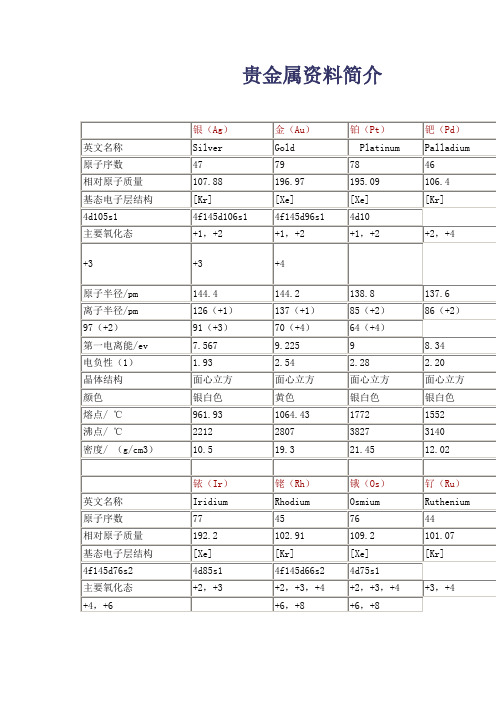
银(Ag)
金(Au)
铂(Pt)
钯(Pd)
英文名称
Silver
Gold
Platinum
Palladium
原子序数
47
79
78
46
相对原子质量
107.88
196.97
195.09
106.4
基态电子层结构
[Kr]
[Xe]
[Xe]
[Kr]
4d105s1
4f145d106s1
4f145d96s1
熔点/℃
2410
1966
2700
2310
沸点/℃
4130
3727
>5300
2900
密度/(g/cm3)
22.42ຫໍສະໝຸດ 12.422.4812.30
Osmium
Ruthenium
原子序数
77
45
76
44
相对原子质量
192.2
102.91
109.2
101.07
基态电子层结构
[Xe]
[Kr]
[Xe]
[Kr]
4f145d76s2
4d85s1
4f145d66s2
4d75s1
主要氧化态
+2,+3
+2,+3,+4
+2,+3,+4
+3,+4
+4,+6
+6,+8
2.54
2.28
2.20
晶体结构
面心立方
面心立方
面心立方
面心立方
颜色
银白色
贵金属分析方法全集

1 贵金属的分析化学性质及其资源贵金属是钌(Ru)、铑(Rh)、钯(Pd)、锇(Os)、铱(Ir)、铂(Pt)、银(Ag)、金(Au)的统称,其中前六种元素称为铂族金属。
贵金属在自然界中含量甚微,价格昂贵,是有色金属中的贵重金属。
人类发现和应用最早的金属是金和银。
公元前,埃及、印度和中国用金和银制作高贵的装饰工艺品及货币。
金源自古英文名“Geolo”,意为黄色,元素符号“Au”由拉丁名“Aurum”而来,意为“灿烂”。
银的元素符号由白色而来。
铂是1735年西班牙科学家安东尼奥•乌洛阿(AntoniodeUlloa)在平托河金矿中发现的。
第一个科学研究的铂试样是1741年由科学家伍德(CharlesWood)从牙买加带到英国,引起国际上科学家的极大兴趣。
铂起源于西班牙文“Platina”(意为稀有的银)。
1803年英国的沃拉斯顿(WillianHydeWollaston)用NH4Cl从王水溶液中沉淀出(NH4)2[PtCl6]后,在母液中发现钯,并以1802年新发现的小行星“Pallas”命名。
1803~1804年英国沃拉斯顿在提炼铂、钯的废渣中,从一种玫瑰色盐里发现铑(希腊文意为玫瑰)。
1803年英国坦南特(SmithsonT ennant)在研究王水溶解铂后的剩余残渣中发现一种颜色多变的化合物,命名为铱(拉丁文意为虹),而另一种物质的氧化物能挥发出特殊气味,命名为锇,源于“Osme”、(希腊文意为气味)。
钌是1844年俄国喀山大学化学系教授克劳斯(Kapn KapnoBNN Knayc)首先发现的,他从乌拉尔铂矿渣中制得(NH4)2[RuCl6],经煅烧后获得金属钌(拉丁文意为俄罗斯)。
铂族金属虽然发现较晚,直到本世纪初才真正进入工业规模的生产,但由于其特有的优良性质,使之成为现代科学、尖端技术和现代工业中必不可少的重要材料之一,应用范围也日益广泛。
贵金属是热和电的良好导体,具有高温稳定性,抗化学腐蚀,抗氧化性和低膨胀系数等性能。
珠宝知识—贵金属

三、破坏性鉴别 1、试硬度 纯金较软,用大头针可划痕,用牙咬有牙痕。 2、火烧测金 将首饰烧火后冷却,如仍是黄色则是金,若黑色为仿品。 3、试硬度 :黄金的延展性极佳,容易弯折,假的或成色低 的,弯折时有坚硬的感觉。 4、酸试验:金饰中滴入硝酸,无变化的是真金 5、试金石测定: 试金石是一种黑色熔石或硅质板岩,硬度 较大,将金饰在试金石上一划,会留下鲜明的金黄痕迹。
(AU)
3.铜质首饰 铜质首饰色为黄中带红,发假,光泽较暗,质地较软, 重量轻飘。 4.铜合金首饰(铜锡合金) 铜合金首饰颜色发白,质硬质轻,久戴掉色,会使皮 肤发黑。 无论是镀金首饰、包金首饰、还是铜首饰、亚金首饰,一 般不带类似黄金首饰的印签。或所带印签不同于黄金首 饰,如有的首饰刻有英文字母“GK”,其含义是“镀金”。 或者印签字迹模糊不清,歪歪斜斜,消费者应通过辨认 首饰上是否有印签、印签是否符合上述规定、印签是否 清晰等方面内容,以判别黄金首饰真伪。
黄金能在工业与科学技术上的应用主要是它的物理性 质和化学性质适用于工业与科学技术上,因此有理由广 泛的用到现代高新技术 产业中去,如: a 金在电子工业中的应用
b 金在宇航工业中的应用 c 金在医学方面的应用等
(AU)
黄金的鉴别及护理
常见的仿金首饰与鉴别 1、镀金首饰 镀金首饰是在其它金属首饰表面用 电镀法镀上一层金色,颜色与真金首 饰相仿,金黄光亮,新时较难辨认。 但镀金首饰手感较轻飘,质地较硬, 牙咬无印,用久易褪色。有的电镀不 好的镀金首饰,颜色不是发红就是发 白,或者发花。
(AU)
铂金(Pt)
铂金(Platinum) 化学元素代码 (Pt) 熔点:1773.5℃ 硬度:4~4.5度。 密度:21.45g/cc 色泽:天然白,不褪色 延展性:1克铂克拉2公里长 化学性:抗氧化,抗腐蚀 主要产地:南非、俄罗斯 铂金被尊为贵金属之王。因其及其 稀缺,年产量仅为黄金的5%,制成 一盎司黄金花5周,耗1吨矿石。制 成一盎司铂金花8周,耗10吨矿石。
首饰用贵金属材料的基本性质

1 贵金属的氧化性质 钌、铑、钯、锇、铱、银在空气中灼烧
形成各种组分的氧化物,但氧化物均不稳 定,稳定温度范围较窄或有挥发性
铂族元素与氧亲和力较低
Pt<Pd<Rh<Ir<Ru<Os 铂只有粉末状可以和氧结合
2 贵金属与无机酸、碱的反应 (1)与无机酸的反应
贵金属的电离价位较高,这就决定了它们在常 温下是很稳定的,不易与酸碱等活泼的非金属元 素反应。 a铂族元素 HCl:铂族元素不溶于 HNO3 :除了钯,其余不溶 H2SO4 :铂、铱、钯不反应 王水:铂、钯可溶;铑、铱、钌不溶 HCl+H2H2:可溶解铂、钯
金的常见价态是3价,金很难被氧化,所以3价 金是一种很强的氧化剂,3价金很容易被还原为金 属金,可还原3价金的物质较多
(5)银 银的常见价态为1价,只有强氧化剂氧化时才
能得到2价银,如臭氧和硝酸氨
4 贵金属的化合物和络合物
所有贵金属都有d-电子层结构,尤其是 铂族金属,其4d(或5d)电子未充满,给 那些电子给予体的电子充填提供了空轨道, 可形成分子杂化轨道,故能生成稳定的络 合物。贵金属的卤化物中,氯化物和氯络 化物是一种重要的化合物,它是制备多数 贵金属标准溶液的主要形态,也是分析化 学中常用的形态。贵金属的化合物和络合 物是进行贵金属分析测试的主要物质。
贵金属材料的基本性质综述
贵金属材料的物理性质; 贵金属材料的力学性质; 贵金属材料的化学性质;
第1节 贵金属材料的物理性质
1 .晶体结构
铑、钯、银、铱、铂、金为面心立方结构 钌、锇为密排六方结构 均为最紧密堆积,配位数均为12
2 .光学性质
银为银白色、金为金黄色 钌为蓝白色、铑为银白色、钯为钢白色、锇为蓝 白色、铱为白色、铂为锡白色 是很好的电镀材料和反光材料 可见光范围:390—780nm
贵金属催化剂中对硅含量的限制

贵金属催化剂中对硅含量的限制1.引言1.1 概述贵金属催化剂是一类在化学反应中起催化作用的重要材料。
它们通常由贵金属(如铂、钯、铑等)以及其他辅助成分(如氧化物、碳等)组成。
贵金属催化剂在许多领域都有广泛的应用,包括汽车尾气处理、化学合成、能源转化等。
然而,贵金属催化剂中存在的硅含量却对其性能产生了限制。
硅是一种普遍存在于自然界中的元素,易与贵金属催化剂发生相互作用。
当催化剂中的硅含量过高时,会导致催化剂的活性降低、选择性变差,并可能引发催化剂的失活。
因此,对硅含量进行严格的限制是确保贵金属催化剂高效稳定运行的关键。
本文的主要目的是探讨贵金属催化剂中对硅含量的限制及其对催化剂性能的影响。
首先,我们将介绍贵金属催化剂的定义和应用,以及硅在贵金属催化剂中的作用。
随后,我们将详细分析对硅含量的限制如何影响贵金属催化剂的活性、选择性和稳定性。
最后,我们将展望未来的研究方向,以进一步提高贵金属催化剂的性能和应用。
通过对贵金属催化剂中对硅含量的限制进行深入研究,我们可以更好地理解贵金属催化剂的性能和机制,并为其合理设计和优化提供指导。
期望通过本文的探讨,能够促进贵金属催化剂领域的研究与应用,为实现可持续发展和环境友好化学过程做出贡献。
文章结构是写作过程中非常重要的一部分,它有助于读者理解文章的逻辑结构和组织方式。
本文主要探讨贵金属催化剂中对硅含量的限制,并分为引言、正文和结论三个部分。
以下是对文章1.2文章结构的具体内容:1.2 文章结构本文将按照以下结构展开对贵金属催化剂中对硅含量的限制问题的探讨。
首先,在引言部分,我们将对本文的研究背景和意义进行概述,介绍贵金属催化剂在化学领域的重要性以及硅在催化剂中的作用。
引言部分将引发读者的兴趣,使其更好地理解文章的内容和目的。
接下来,正文将分为两个主要部分。
首先,我们将在2.1部分详细介绍贵金属催化剂的定义和应用。
这部分将探讨贵金属催化剂在各种化学反应中的广泛应用以及其在环境保护、能源转化以及有机合成等领域中的重要作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第六章镀铱
第一节概述
铱(Iridium)在元素周期表中的原子序数为77,元素符号为Ir,原子量192.22。
1803年英国化学家坦南特、法国化学家德斯科蒂等用王水溶解粗铂时,从残留在器皿底部的黑色粉末中发现了两种新元素—锇和铱。
铱的元素名来源于拉丁文,由于被发现时其化合物绚丽多彩,所以借取希腊神话中代表彩虹的女神Iris而命名,原意是“彩虹”。
铱在地壳中的含量为千万分之一,常与其他铂系元素一起分散于冲积矿床和砂积矿床的各种矿石中。
自然界存在两种同位素:铱191、铱193。
铱为银白色金属,熔点2410°C,沸点4130°C,密度22.421g/cm³;晶体结构为立方面心;质硬而脆,难以加工。
铱的主要参数见表6-1。
铱是已知最耐腐蚀的金属,即使在热王水中也很难溶解。
只有铱粉可缓慢溶于王水,稍受熔融的强碱侵蚀;铱可缓慢地被熔融的铅、镉、锡、银、金腐蚀,迅速地被熔融的铜、铝、锌、镁腐蚀;铱在强热时可与氧、氟、氯发生反应;铱有形成配位化合物的强烈倾向和良好的催化性能。
由于铱质地坚硬,难以加工,通常与铂熔成合金用于耐磨、耐高温、耐腐蚀的器件上,以提高其强度;铱的金属互化物是超导体材料。
表6-1 铱的一些主要参数
铱还可以与锇一起用于高级金笔尖、并用于制造坩埚及其他特殊容器。
其合金可用于标准重量和量度衡,耐热合金等。
镀铱/钛电极作为各种电解用的电极也得到了广泛的应用。
尤其是铱能与铂形成合金、就使得铱的应用范围更为加大。
作为制氯电极,由于铱的氯气过电压低,对产生氯气及氧气时的耐久性好,与其他电极相比显得更具优越性。
第二节电镀铱及其合金
一.电镀铱
铱在化合物中呈1,3,4价。
其水溶液中的化合物中的铱呈3,4价。
镀铱的报告不多[1]。
镀铱时使用的化合物有3价的也有4价的。
但是,4价化合物的电流效率特别低,难以实用。
而且当镀层增厚时容易出现裂纹。
一般说来,镀铱产品,可以是坩埚表面,电接点材料的接点部位,电极表面等。
引进镀铱,有如下几个优点:1)与物蒸发镀的坩埚镀膜相比,设备及工艺流程要来得简便,成本上有优势。
2)与电接点采用镀Rh相比,镀铱层的耐热性更佳,成本更低。
3)与电极表面涂布铱化合物后进行多次烧成相比,则生产工艺可以大幅度缩短。
因而直接镀铱是具有很大有吸引力的。
电镀铱/钛电极有如下的特长:
1)过电压低;
2)耐久;
3)制造工艺简便。
图6-1为过电压的测定结果[2]。
图
6-1 Pt/Ti 、Pt ·Ir/Ti 电极的过电压比较
从图中可以看出,铂·铱/钛电极的氧及氯气的过电压比铂/钛电极的低。
即是说,如用在工业电解上,不仅消耗的电力少,而且象食盐电解时,所需进行的反应(氯气生成反应)的效率也要高。
来田胜继等[3]提出了镀铱的方案。
使用的镀液成份见表6-2。
表6-2 水溶液镀铱工艺
试验方法为:使用钨制坩埚,在其上预先镀上白金,再使用该镀液进行镀铱。
镀液准备为将六溴化铱(Ⅲ)酸钠加到丙二酸二钠后,在85℃的条件下用磁力搅拌器搅拌1小时后供使用。
(m 过电
(V
v s N H 电流密度 A /c m
2 ) in
通过此法获得的镀层可到8μm且有光泽而无裂纹。
认为完全可以达到使用水平。
其电流效率为100%,电镀速度为1.58μm /hr。
同时其硬度及耐热性可与物理蒸发的镀膜媲美,因而可以大大削减成本。
同时使用该溶液还可以在引线框架上进行镀铱,获得的镀层可到8μm且有光泽而无裂纹。
其电流效率为100%,电镀速度为1.5μm /h。
且其硬度及密着性可以与镀Rh媲美。
耐热性则在镀Rh部件之上。
另外还使用该镀液对DSA电极进行电镀铱试验。
当在钛烧结电极上预镀白金后,用同样的方法进行镀铱。
与电极表面涂布铱化合物后进行多次烧成相比,硬度及耐热性同等,但生产工艺可以大幅度缩短。
更具有成本上的优势。
为了改善电流效率的稳定性及镀膜厚度的均一性,盐川等[3]通过对镀液选用合适的表面活性剂及硼酸以外的pH缓冲剂,从而获得了无空洞,平滑,致密的铱镀层。
并且可以使用到印制线路板上的镀盲孔中去。
在盐川的试验中使用的配线间距为30~200μm,盲孔直径为30~200μm,盲孔深度为5~10μm。
镀液工艺如表6-3[3、4]:
表6-3 印制线路板的盲孔镀铱工艺配方
将上表中获得的镀层通过萤光X线进行膜厚的测定,用金属显微镜进行镀层外观及表面状态的测定,用胶带剥离试验进行镀层结合强度的评价。
并且使用扫描电子显微镜对盲孔镀层的分散性进行了评价。
其结果见表6-4[3、4]。
表6-4 表3条件下的铱镀层评价结果
由此可见,通过此法得到的电镀铱层性能好,用在镀盲孔上也是没有问题的。
二.镀铱铂合金
吴丰等[5]通过从3价的氯化铱镀液中获得了铱铂的合金镀。
其代表组成及其工艺条件如表6-5。
表6-5 铱铂合金镀组成及其工艺条件
其中,氢氧化钠与盐酸用来调节pH值,pH以3~4比较合适,pH过低则会引起电镀速度变慢;pH过高则会引起镀液中的杂质生成。
图6-2为镀液中的铱离子的摩尔浓度比与合金中铱的含量的关系图[5]。
从中可以看出,随着溶液中的铱离子浓度的增加,镀层中的铱离子浓度呈直线增加。
由此可以得出,可以根据需要通过控制镀液中的铱与铂的浓度比来控制铱铂合金镀层中的铱的含量。
)
%
(
比
尔
摩
量
含
的
铱
的
中
液
镀
镀层中的铱的组成比(%)
图6-2镀液中的Ir/Pt浓度比与镀膜中Ir/Pt成份比的关系图
第三节化学镀铱
化学镀铱可以用在电解水用的阳极上,森浩章等[6~7]通过改善铱与肼的配合物的合成方法,再将其用到化学镀铱上,可以大大提高铱的利用效率。
其反应率可以达到85%以上。
其方法为:先将全氟碳磺酸阴离子交换膜Nafion117(Dupont Co.,制)用砂纸打粗,再用10%盐酸煮沸后用热水洗净。
再将如此处理后的膜再在1mg/ml氨铂(四价)配合物水溶液中浸泡3小时。
水洗后,将该膜在0.05%NaBH4水溶液中(60℃)浸泡4小时将膜上的铂还原为铂(铂的量为1mg/cm2)(称为Pt膜)。
最后将该膜用于镀铱。
镀铱溶液组成如表6-6所示。
表6-6 化学镀铱工艺
如此得到的Ir为4.08mg/cm2,Ir的收率为94.2%。
同时,通过补充K[Ir(N2H5)Cl5]以保证其浓度在2~3mM,同时用N2H4·H2O将pH调节在2.3~3.0,并用同样的方法在Pt膜上进行化学镀铱连续进行了10次操作。
每次都能得到3mg/cm2(膜面积),连续镀时Ir的收率都在90%以上。
见表6-7[6]。
表6-7 化学镀铱连续处理时的铱收率状况
齐藤哲[8]使用氢硼化钠作为还原剂,制作铱与氢硼化钠配合物的工艺可以更为简便。
通过将5mmol/L的氯化铱钾10ml与各种浓度的氢硼化钾溶液混合,并用氢氧化钠或稀硫酸来调节其pH值。
得到的溶液用来进行化学镀铱。
得到的镀层牢固均一,铱的析出效率也高。
参考文献
1.斉藤由美子:特開平6-316786
2.高橋正雄,増子昇等.工業電解の化学;アグネ、1987:198
3.来田勝継,葛島俊夫:特開平7-34289
4.塩川和彦,中村裕樹:特開く2004-52014
5.呉豊,村上秀之,原田広史等:特開2004-137523
6.森浩章,前沢彰二,小黒啓介:特開平8-158059
7. Hiroaki Mori, Shoji Maezawa, Keisuke Oguro, et al: US PAT.5895881(1999) 8.斉藤哲:特開平11-131249。
