茉莉酸诱导的拟南芥叶片蛋白质组分析
植物JAZ基因的功能及生理作用

植物JAZ基因的功能及生理作用摘要:JAZ(Jasmonate ZIM-domain)蛋白是植物中茉莉酸信号调控途径中重要的负调控因子,他的出现使茉莉酸类物质的研究得到了极大的进展。
本文将具体介绍JAZ基因的功能、生理作用以及JAZ基因在几种植物中的作用。
关键字:JAZ;功能;生理作用;茉莉酸信号传递JAZ是茉莉酸响应的抑制因子,其研究主要以模拟生物拟南芥为研究对象,细菌、真菌、动物基因组中未发现JAZ同源基因,这和很多的研究结果一样,因此JAZ基因为植物特有。
此外,在低等水生藻类植物中也未能检测到JAZ及其同源基因,所以很有可能JAZ基因有可能起源于陆生植物[1]。
研究发现,在拟蓝芥中的12个JAZ蛋白中,除了保守的ZIM结构域外,在靠近C端还有一个保守的jas结构域,但它们只有十三个氨基酸完全相同,且氨基酸的数目范围是131~352,所以JAZ成员在氨基酸数量上有很大差异。
此外,其两个结构域的相对位置也不固定。
ZIM结构域含有28个氨基酸,一般位于JAZ蛋白的中间,在他的N端含有一个TIFY基序,C端有两个不变的丙氨酸[2]。
由于保守的ZIM结构域,JAZs是属于TIFY蛋白的大基因家族,他们不含任何已知结构域,但某些JAZs定位于细胞核。
此外,JZA家族基因之间能发生同源互作和异源互作,也能与茉莉酸相关的转录因子结合[3]。
1、JAZ基因的功能在JAZ基因的研究中,我们发现植物基因组中的重复基因JAZ家族可分为多个亚家族,这是由于在进化过程中,JAZ亚家族间发生功能分化,即不同的JAZ亚家族可能具有不同的功能[1]。
JAZ蛋白功能的行驶方式是通过一系列因子的互作完成,主要分为五类:包括F-box受体、bHLH转录因子、R2R3MYB转录因子、荷尔蒙信号通路涉及到的转录因子、共阻遏物以及JAZ家族本身[4]。
在不同的植物中,过表达JAZs的表型不同:水稻过表达TIFY11b可以增加籽粒大小;大豆过表达GsJAZ2可以增加植物对盐碱的敏感性;烟草中过表达NaHAZd和NaJAZh分别可以抑制花蕾脱落和促进尼古丁的合成[4]。
拟南芥花期调控模式的比较分析

拟南芥花期调控模式的比较分析拟南芥是植物界实验研究的重要模式生物之一,其花期调控机制一直是研究者们所关注的热点。
花期调控是指植物在不同环境条件下,通过基因调控来控制开花的时间和数量,从而适应外部环境以促进种群繁衍。
调控模式分为内源性与外源性调控。
其中内源性调控是指来自植物本身的调节作用,包括脱落酸(DA)、激素、基因表达调控等。
而外源性调控则是指来自外部环境刺激的调节作用。
环境因素如光周期、温度、营养等会影响调控基因的表达,从而影响开花时间。
本文主要讨论拟南芥的内源性调控模式,分别从激素调控和基因表达调控两个方面进行比较分析。
一、激素调控激素是植物生长与发育不可或缺的调节因子,可以通过激素信号传递途径来调控开花。
目前已知有多种激素参与调控拟南芥的开花,如赤霉素、茉莉酸、乙烯酸等。
1.1 赤霉素调控赤霉素是一种重要的内源性植物激素,参与了多个植物发育过程,包括开花。
调控方式主要是通过调节转录因子的表达来影响花期。
拟南芥中的赤霉素信号途径主要包括赤霉素受体GID1与F-box蛋白 SLEEPY1(SLY1)的相互作用调控,以及SPINDLY与 HY5蛋白相互作用的过程。
1.2 茉莉酸调控茉莉酸在拟南芥的开花过程中也具有重要的调控作用。
茉莉酸不仅可以调节开花的具体时间,还可以影响开花的数量。
具体而言,茉莉酸可以诱导拟南芥中APETALA1(AP1)和LEAFY(LFY)这两个花干细胞标志性转录因子的表达,从而促进拟南芥的开花。
1.3 乙烯酸调控乙烯酸虽然也是一种植物内源性激素,但其调控拟南芥开花的机制与其他激素存在较大区别。
拟南芥中的乙烯酸信号途径主要是由乙烯酸受体ERF1介导的。
ERF1蛋白在感应乙烯酸信号后,可以直接结合在AP1、LFY等转录因子的DNA 序列上,从而增强它们的表达,促进开花。
二、基因表达调控除激素外,基因表达调控也是拟南芥花期调控的重要模式。
根据基因的功能不同,可以将其归为役使、代理、拮抗因子三大类。
2023-2024学年北京市清华大学附属中学朝阳学校、望京学校高二上学期期中生物试题

2023-2024学年北京市清华大学附属中学朝阳学校、望京学校高二上学期期中生物试题1.人体内环境中的蛋白质不具有的功能是()A.调节机体生命活动B.作为氧运输的载体C.抗击入侵的病原体D.维持内环境渗透压2.内环境稳态是维持机体正常生命活动的必要条件。
下列相关叙述中,正确的是()A.冬季由于气温偏低,人体内酶的活性会降低B.细胞内高Na +、细胞外高K +有利于神经细胞产生兴奋C.葡萄糖在内环境中彻底氧化分解为生命活动提供能量D.内环境稳态有利于机体新陈代谢中酶促反应的正常进行3.神经元之间信息的传递依赖突触结构,如图是递质在突触处传递信息的过程。
下列叙述正确的是()A.递质贮存于突触小泡中,为及时迅速释放做好准备B.兴奋传至突触前末端引发贮存的递质主动转运出膜C.递质与相应受体结合后均会导致突触后细胞的兴奋D.递质激活受体后可进入突触后细胞内发挥作用4.一氧化氮(NO)可参与神经调节(如图)。
突触前膜释放的谷氨酸(Glu)与后膜上的受体结合,促进Na+和Ca2+内流。
突触后神经元Ca2+浓度升高会促进NO合成,NO进入突触前神经元引起Glu持续释放。
下列叙述正确的是()A.Ca 2+浓度升高可激活NOS的活性B.NO作为激素将信息传递给突触前神经元C.NO和Glu以相同的方式运出细胞D.Glu持续释放是负反馈调节的结果5.研究发现,脂肪细胞中存在一种成纤维生长因子1(FCF1),其调节血糖的部分机制如下图。
据下图分析下列说法错误的是()A.FGF1可以通过减少血糖的来源降低血糖B.FGF1和PDE3B对血糖的调节具有相反作用C.胰岛素需经体液运输到达脂肪细胞起作用D.这一发现可为糖尿病的治疗提供新的思路6.如图表示健康人和Graves病人激素分泌的调节机制,a、b、c为三种激素。
下列叙述错误的是()A.图中c随体液运送至全身作用于靶器官或靶细胞B.图中抗体的作用与促甲状腺激素释放激素的作用相似C.甲状腺细胞释放的c对下丘脑具有反馈调节作用D.由图分析可推知Graves病是一种自身免疫病7.细胞外葡萄糖浓度调节胰岛素分泌的过程如图,对其理解错误..的是()A.图中所示细胞是胰岛B细胞B.Ca 2+内流促使细胞通过胞吐方式释放胰岛素C.细胞外葡萄糖浓度升高会促使胰岛素释放D.抑制K +通道关闭的药物也能促进胰岛素释放8.肾上腺素具有提高心脏收缩力、加快心率并促进血管收缩的作用。
国内植物蛋白质组学研究进展

下调. 通过 质 谱 分 析最 终 鉴定 出 1 蛋 白质 , O种 它
们分别参与热胁迫、 氨基酸代谢 、 核苷酸代谢、 光 合作用和碳代谢等 , 并且可能在拟南芥叶片应答
茉 莉酸 诱导 过程 中起 到 重要 作 用 . 热 激蛋 白是 如 植 物应 对逆 境胁 迫 的防 卫机 制 成 员 , 在逆 境 胁 其 迫 下 的表达 量增 加 可 提 高植 物 的防御 能 力 . 且 而 热 激蛋 白作 为抗 氧化 剂 , 以清 除过剩 的活性 氧 , 可
显著的蛋 白质点. 这些蛋 白质在解除种子休 眠这
一
复杂的发育过程 中扮演 了不同角色, 它们分别
涉及环境胁迫反应 、 细胞循环 、 信号转导和贮藏蛋
白代谢 等生 理活 动.
1 2 温度胁 迫 .
陆兆明等 利用蛋 白质组学技术研究 双孢 蘑菇 0 菌株在常温与高温胁迫下 的蛋 白质表达 2
1 植 物 抗 逆 的蛋 白质 组 学
1 1 激素胁 迫 .
素 提高水 稻耐盐 性 的途 径 中发 挥 一 定 的作 用 . 孙
国忠等 利 用 蛋 白质 组 学 技 术 比较解 除 休 眠 前
后小 麦胚在 A A和 H O 处 理后 的蛋 白质表 达情 B :
潘 怡欧 等 ¨ 对茉 莉 酸 诱 导 的拟 南 芥 叶 片 进
系 T i un 2 6 Y 5接种 条 锈菌 C 3 的蛋 a h ag 9 / r c Y 2后 白质组变 化进行 分析 . 经小 麦 叶片总蛋 白的提取 、
提 高 自身热休 克蛋 白的表达量 来保 护使其 免受外
界 有害 的高 温影 响 ; 异柠 檬 酸 裂 解酶 是 乙醛 酸 而
郭鸿亮
( 哈尔滨师范大学)
拟南芥NBS1_互作蛋白的筛选和鉴定

引文格式:吴钒漳, 孙旭东, 徐慧妮. 拟南芥NBS1互作蛋白的筛选和鉴定[J]. 云南农业大学学报(自然科学), 2023, 38(4):558−565. DOI: 10.12101/j.issn.1004-390X(n).202202008拟南芥NBS1互作蛋白的筛选和鉴定*吴钒漳1, 孙旭东2, 徐慧妮1 **(1.昆明理工大学 生命科学与技术学院,云南 昆明 650500;2. 中国科学院 昆明植物研究所,云南 昆明 650201)摘要: 【目的】筛选拟南芥中NBS1的互作蛋白,探究NBS1蛋白的新功能,为后续研究奠定基础。
【方法】利用酵母双杂交技术筛选拟南芥cDNA 文库,对得到的序列进行BLAST 比对、亚细胞定位分析和基因本体注释。
【结果】共有221个阳性克隆,测序后通过BLAST 比对得到97个与NBS1互作的蛋白,包括膜蛋白、转运蛋白和折叠蛋白等,它们主要定位于细胞质、细胞核和叶绿体等,主要富集于4个分子功能、5个细胞组分和13个生物过程。
【结论】拟南芥中与NBS1互作的蛋白在刺激响应、信号转导和细胞代谢等方面发挥着重要作用,也证明NBS1是一种多功能蛋白,但其功能及分子机制还需进一步研究。
关键词: 拟南芥;NBS1;蛋白互作;酵母双杂交;基因本体注释中图分类号: Q949.748.306 文献标志码: A 文章编号: 1004–390X (2023) 04−0558−08Screening and Identifying Interaction Proteins ofNBS1 in Arabidopsis thalianaWU Fanzhang 1,SUN Xudong 2,XU Huini 1(1. Faculty of Life Science and Technology, Kunming University of Science and Technology, Kunming 650500,China; 2. Kunming Institute of Botany, Chinese Academy of Sciences, Kunming 650201, China)Abstract: [Purpose ]To screen the interaction protein and explore the new function of NBS1 pro-tein in Arabidopsis thaliana , laying the foundation for further research. [Methods ]The yeast two-hybrid technology was used to screen the interaction proteins of NBS1 from A. thaliana cDNA lib-rary. BLAST alignment, subcellular localization analysis and gene ontology annotations were per-formed on the obtained sequences. [Results ]There were 97 proteins interacted with NBS1 in 221positive clones by BLAST after sequencing, including membrane proteins, transporters and folding proteins. These proteins were mainly localized in cytoplasm, nucleus and chloroplast, which were mainly enriched in four molecular functions, five cellular components and 13 biological processes.[Conclusion ]The proteins interacting with NBS1 play an important role in stimulus response, sig-nal transduction and cell metabolism. It is also confirmed that NBS1 is a multifunctional protein, but its function and molecular mechanism need further studies.Keywords: Arabidopsis thaliana ; NBS1; protein interaction; yeast two-hybrid; gene ontology云南农业大学学报(自然科学),2023,38(4):558−565Journal of Yunnan Agricultural University (Natural Science)E-mail: ********************收稿日期:2022-02-16 修回日期:2022-03-02 网络首发日期:2023-09-06*基金项目:国家自然科学基金项目(31760582)。
2024年全国高中生生物联赛试题

2024年全国高中生生物联赛试题一、1.下列不属于真核生物基因组DNA特点的是()A.大部分为非编码序列B.含有大量重复序列,例如高度重复的卫星DNAC.功能相关的基因串联在一起,转录产生一条mRNA链D.基因组的完整复制依赖于逆转录2.下列实验方法中能直接鉴定蛋白质磷酸化位点的有()A.蛋白质免疫印迹法B.酶联免疫吸附C.酵母双杂交系统D.质谱分析3.关于豆科植物与根瘤菌的共生关系,下列叙述正确的是()A.根瘤菌为豆科植物提供含氮化合物B.根瘤菌固定的氮元素不会释放到土壤中C.豆科植物为根瘤菌提供生长所需氨基酸D.豆科植物分泌特殊物质,诱导根瘤菌靠近并感染其根部4.三羧酸循环由8步反应组成,其中不可逆的反应是()A.柠檬酸经顺乌头酸转变为异柠檬酸B.异柠檬酸氧化脱羧转变为α-酮戊二酸C.α-酮戊二酸氧化脱羧生成琥珀酰辅酶AD.琥珀酰辅酶A经底物水平磷酸化形成琥珀酸5.与胆固醇合成密切相关的HMG-COA还原酶(H酶)位于内质网膜。
研究者在培养细胞CHO中表达了跨膜结构域融合了GFP的H酶,即H-GFP。
经不同浓度的胆固醇和二氢羊毛甾醇(DHL)处理后,用免疫印迹法检测H酶的表达。
如图所示的实验结果不支持的结论有()A.H酶在DHL缺乏的条件下比较稳定B.DHL能够直接与H酶跨膜结构域结合C.DHL对维持胆固醇稳态发挥调控作用D.DHL导致H酶的翻译过程受阻6.溶菌酶是一个碱性蛋白质,其相对分子质量约为14kDa,用以下方法从蛋清中得到溶菌酶,纯度最高的方法是()A.硫酸铵沉淀,然后有机溶剂沉淀B.硫酸铵沉淀,然后离子交换层析C.等电点沉淀,然后离子交换层析D.有机溶剂沉淀,然后凝胶过滤层析7.已知在正常人体内X蛋白有155个氨基酸,在某疾病中该蛋白长度变为165个氨基酸,下列密码子突变可造成该现象的有()A.GAU→GAC B.CGA→UGAC.UAA→CAA D.UGA→AGU8.可以用来检测蛋白质与RNA分子相互作用的方法有()A.染色质免疫共沉淀B.紫外线交联免疫共沉淀C.RNA pull downD.RNA免疫沉淀9.糖原磷酸化酶a 和磷酸化酶b 是一种酶的两种不同存在形式,下列说法正确的是()A.磷酸化酶b发生二聚化即可转变为磷酸化酶aB.磷酸化酶b上的一个丝氨酸被磷酸化即可转变为磷酸化酶aC.磷酸化酶b作为酶原,可以被蛋白酶切割从而转变为有活性的磷酸化酶aD.葡萄糖分子可以结合磷酸化酶b,通过变构调节的方式将其转变为磷酸化酶a 10.组蛋白八聚体形成直径9nm、高为5nm的圆柱体,人类细胞核的直径为6μm,则组蛋白八聚体占据细胞核体积的百分比最接近()A.约为5%B.约为9%C.约为12%D.约为15%如图显示了DNA复制时,RNA引物预先结合到模板上可以开始DNA合成的位点。
新高考生物第九单元 植物的激素调节(B卷能力提升练)(解析版)
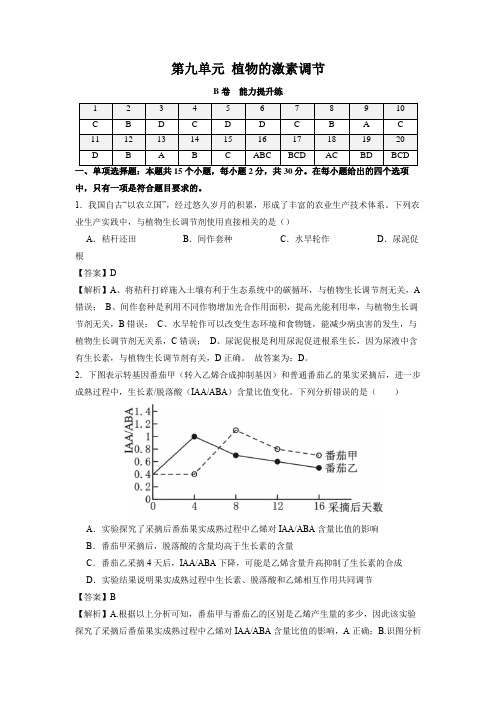
第九单元植物的激素调节B卷能力提升练1 2 3 4 5 6 7 8 9 10C BD C D D C B A C11 12 13 14 15 16 17 18 19 20D B A B C ABC BCD AC BD BCD中,只有一项是符合题目要求的。
1.我国自古“以农立国”,经过悠久岁月的积累,形成了丰富的农业生产技术体系。
下列农业生产实践中,与植物生长调节剂使用直接相关的是()A.秸秆还田B.间作套种C.水旱轮作D.尿泥促根【答案】D【解析】A、将秸秆打碎施入土壤有利于生态系统中的碳循环,与植物生长调节剂无关,A 错误;B、间作套种是利用不同作物增加光合作用面积,提高光能利用率,与植物生长调节剂无关,B错误;C、水早轮作可以改变生态环境和食物链,能减少病虫害的发生,与植物生长调节剂无关系,C错误;D、尿泥促根是利用尿泥促进根系生长,因为尿液中含有生长素,与植物生长调节剂有关,D正确。
故答案为:D。
2.下图表示转基因番茄甲(转入乙烯合成抑制基因)和普通番茄乙的果实采摘后,进一步成熟过程中,生长素/脱落酸(IAA/ABA)含量比值变化。
下列分析错误的是()A.实验探究了采摘后番茄果实成熟过程中乙烯对IAA/ABA含量比值的影响B.番茄甲采摘后,脱落酸的含量均高于生长素的含量C.番茄乙采摘4天后,IAA/ABA下降,可能是乙烯含量升高抑制了生长素的合成D.实验结果说明果实成熟过程中生长素、脱落酸和乙烯相互作用共同调节【答案】B【解析】A.根据以上分析可知,番茄甲与番茄乙的区别是乙烯产生量的多少,因此该实验探究了采摘后番茄果实成熟过程中乙烯对IAA/ABA含量比值的影响,A正确;B.识图分析可知,番茄甲采摘后,脱落酸的含量在开始阶段高于生长素的含量,而大约7天左右到9天之间生长素的含量高于脱落酸,后期脱落酸的含量又高于生长素的含量,B错误;C.根据以上分析可知,番茄乙为普通番茄,在乙烯合成基因的控制下,产生的乙烯含量较高,因此结合图示可知,番茄乙采摘4天后,IAA/ABA下降,可能是乙烯含量升高抑制了生长素的合成,C正确;D.识图分析可知,图示实验结果说明果实成熟过程中是生长素、脱落酸和乙烯相互作用共同调节的结果,D正确。
茉莉酮酸酯诱导植物抗性的分子机制_钟申丽

江西农业学报 2008,20(12):74~76A c t a A g r i c u l t u r a e J i a n g x i茉莉酮酸酯诱导植物抗性的分子机制钟申丽1,2,孙玉诚2,戈峰2,肖铁光1* 收稿日期:2008-09-05基金项目:国家自然科学基金委面上重点项目(30330490);国家科技支撑计划(2006B A D 08A 07-3-2);“十一五”国家粮食丰产工程(62020900001)资助。
作者简介:钟申丽(1984-),女,湖南浏阳人,硕士研究生,研究方向为昆虫生态学。
*通讯作者:肖铁光。
(1.湖南农业大学生物安全科技学院,湖南长沙410128;2.中国科学院动物研究所农业虫鼠害综合治理国家重点实验室,北京100101)摘 要:综述了茉莉酮酸酯的生物合成及其功能、诱导植物抗性反应、识别和介导长距离运输的受伤信号、细胞内的相关受体等方面研究的最新进展。
关键词:茉莉酮酸酯;系统防御反应;诱导抗性;信号传导;植物抗性中图分类号:S 432.21 文献标识码:A 文章编号:1001-8581(2008)12-0074-03Mo l e c u l a r Me c h a n i s m o f P l a n t R e s i s t a n c e I n d u c e db y J a s m o n a t eZ H O N GS h e n -l i 1,2,S U NY u -c h e n g 2,G EF e n g 2,X I A OT i e -g u a n g1*(1.C o l l e g e o f B i o -s a f e t y S c i e n c e s a n d T e c h n o l o g y ,H u n a n A g r i c u l t u r a l U n i v e r s i t y ,C h a n g s h a 410128,C h i n a ;2.S t a t e K e y L a b o r a t o r y o f I n t e g r a t e d M a n a g e m e n t o f P e s t I n s e c t s a n d R o d e n t s ,I n s t i t u t e o f Z o o l o g y ,C h i n e s e A c a d e m y o f S c i e n c e s ,B e i j i n g 100101,C h i n a )A b s t r a c t :T h i s p a p e r r e v i e w e d t h e r e c e n t r e s e a r c hp r o g r e s s i n J a s m o n a t e ,i n c l u d i n g i t s b i o l o g i c a l s y n t h e s i s a n d f u n c t i o n s ;p l a n t r e -s i s t a n c e r e a c t i o n i n d u c e d b y i t ;t r a n s f e r r i n g a n d i d e n t i f i c a t i o n o f p l a n t w o u n ds i g n a l s ;t h e s i g n a l p a t h w a y a n dt h e r e c e p t o r s i n t h e c e l l .K e y w o r d s :J a s m o n a t e ;S y s t e m a t i c a l d e f e n s e r e s p o n s e ;I n d u c e d r e s i s t a n c e ;S i g n a l t r a n s d u c t i o n ;P l a n t r e s i s t a n c e 植物在长期的进化过程中,产生出精妙的诱导抗性的防御系统,它不仅能分辨出捕食者的种类,还能采取不同的信号途径应对胁迫。
拟南芥硫氧还蛋白基因在逆境胁迫下的功能解析的开题报告

拟南芥硫氧还蛋白基因在逆境胁迫下的功能解析的开题报告一、研究背景及意义逆境胁迫是指生物体处于温度、干旱、盐碱、有机污染物滋生等不良环境下的情况。
逆境胁迫会破坏生物体正常的生理功能,从而影响植物的生长发育和产量。
因此,探究植物对逆境胁迫的适应机制,对于提高作物的产量和品质具有重要的意义。
硫氧还蛋白是一种富含半胱氨酸的小分子,可以在植物对逆境胁迫的反应中发挥重要作用。
拟南芥硫氧还蛋白基因ATSOB2的表达可以被干旱、高盐等逆境胁迫所诱导,其蛋白质具有还原硫氧化物的能力,从而帮助植物适应逆境环境。
因此,解析ATSOB2在拟南芥逆境胁迫下的功能机制,可为植物对逆境胁迫的适应能力提供新的思路。
二、研究目的本研究旨在通过构建过表达和缺失拟南芥ATSOB2的转基因植物,探究ATSOB2对拟南芥在干旱和高盐胁迫下生长发育和生理代谢的影响。
三、研究方法1. 构建过表达和缺失拟南芥ATSOB2的转基因植物。
通过克隆ATSOB2 DNA序列,将其构建为过表达和缺失的转化载体,将其转化到拟南芥中,筛选出过表达和缺失ATSOB2的转基因植物株系。
2. 分析ATSOB2在拟南芥逆境胁迫下的表达情况。
在不同的干旱和高盐胁迫下,采集拟南芥的叶片、根系等组织,并通过荧光定量PCR或Western blot分析ATSOB2的表达情况。
3. 探究ATSOB2对拟南芥在逆境胁迫下的生长和生理代谢的影响。
分析过表达和缺失ATSOB2转基因植物在不同逆境胁迫下的生长表现,以及生理代谢指标如叶绿素含量、POD活性、SOD活性等。
四、预期结果1. 构建得到过表达和缺失ATSOB2的转基因植物。
2. 高盐和干旱胁迫下,ATSOB2的表达会受到诱导。
3. 过表达和缺失ATSOB2转基因植物在逆境胁迫下比较,可以发现其生长和生理代谢状态的差异。
五、研究意义1. 为探究植物对逆境胁迫的适应机制提供新思路和方法。
2. 探究了硫氧还蛋白基因ATSOB2在拟南芥逆境胁迫下的功能机制,可为其他相关植物基因的研究提供参考。
COI1参与茉莉酸调控拟南芥吲哚族芥子油苷生物合成过程

COI1参与茉莉酸调控拟南芥吲哚族芥子油苷生物合成过程石璐;李梦莎;王丽华;于萍;李楠;国静;阎秀峰【摘要】芥子油苷是一类具有防御作用的植物次生代谢产物,外源激素茉莉酸对吲哚族芥子油苷的合成具有强烈的诱导作用,但茉莉酸调控吲哚族芥子油苷生物合成的分子机制并不清楚.以模式植物拟南芥(Arabidopsis thaliana)的野生型和coi1-22、coi123两种突变体为研究材料,通过茉莉酸甲酯(MeJA)处理,比较了拟南芥野生型和coi1突变体植株吲哚族芥子油苷含量、吲哚族芥子油苷合成前体色氨酸的生物合成基因(ASA1、TSA1和TSB1)、吲哚族芥子油苷生物合成基因(CYP79 B2、CYP79B3和CYP83B1)及调控基因(MYB34和MYB51)的表达对MeJA的响应差异,由此确定茉莉酸信号通过COI1蛋白调控吲哚族芥子油苷生物合成,即茉莉酸信号通过信号开关COI1蛋白作用于转录因子MYB34和MYB51,进而调控吲哚族芥子油苷合成基因C YP79 B2、C YP79 B3、CYP83B1和前体色氨酸的合成基因ASA1、TSA1、TSB1.并且推断,COI1功能缺失后,茉莉酸信号可能通过其他未知调控因子或调控途径激活MYB34转录因子从而调控下游基因表达.【期刊名称】《生态学报》【年(卷),期】2012(032)017【总页数】7页(P5438-5444)【关键词】茉莉酸;COI1;吲哚族芥子油苷;拟南芥【作者】石璐;李梦莎;王丽华;于萍;李楠;国静;阎秀峰【作者单位】温州大学生命与环境科学学院,温州325035;温州大学生命与环境科学学院,温州325035;温州大学生命与环境科学学院,温州325035;温州大学生命与环境科学学院,温州325035;温州大学生命与环境科学学院,温州325035;温州大学生命与环境科学学院,温州325035;温州大学生命与环境科学学院,温州325035【正文语种】中文芥子油苷(glucosinolate)是一类含氮、含硫的植物次生代谢产物,主要分布于十字花科植物。
211021630_拟南芥bHLH_Ib_转录因子调控FIT_的转录

㊀Guihaia㊀Feb.2023ꎬ43(2):399-404http://www.guihaia-journal.comDOI:10.11931/guihaia.gxzw202103013杨钰洁ꎬ梁岗ꎬ2023.拟南芥bHLHIb转录因子调控FIT的转录[J].广西植物ꎬ43(2):399-404.YANGYJꎬLIANGGꎬ2023.bHLHIbtranscriptionfactorsregulatethetranscriptionofFITinArabidopsisthaliana[J].Guihaiaꎬ43(2):399-404.拟南芥bHLHIb转录因子调控FIT的转录杨钰洁1ꎬ2ꎬ梁㊀岗1∗(1.中国科学院西双版纳热带植物园热带植物资源可持续利用重点实验室ꎬ昆明650223ꎻ2.中国科学院大学生命科学学院ꎬ北京100049)摘㊀要:FIT是调控拟南芥铁稳态的一个关键调控因子ꎬ它在转录水平上受到缺铁诱导ꎬ但其背后的调控机制还不甚清楚ꎮ该研究以拟南芥bHLH38和FIT的单㊁双过表达植物及bHLHIb四突变体植物为材料ꎬ采用缺铁(-Fe)处理实验和定量RT ̄PCR的方法从RNA角度分析了FIT转录水平的变化ꎮ结果表明:(1)在铁充足时ꎬbHLH38过表达植物中FIT的转录水平显著高于其在野生型中的水平ꎮ(2)在bHLHIb四突变体植物中FIT的转录水平不受缺铁诱导ꎮ(3)FIT单过表达不能激活内源FIT的转录ꎬ而在加铁(+Fe)条件下bHLH38和FIT的双过表达则可以激活内源FIT的转录ꎮ(4)在缺铁条件下ꎬ所有植物中FIT的转录水平均与野生型中的FIT水平无明显差异ꎮ基于以上结果认为ꎬbHLHIb转录因子是缺铁诱导FIT转录的必要条件ꎬ而非充分条件ꎮ该研究结果为深入了解植物通过多种途径共同维持铁稳态提供了新的见解ꎮ关键词:铁ꎬ转录调控ꎬ缺铁响应ꎬ铁稳态ꎬ拟南芥中图分类号:Q943㊀㊀文献标识码:A㊀㊀文章编号:1000 ̄3142(2023)02 ̄0399 ̄06bHLHIbtranscriptionfactorsregulatethetranscriptionofFITinArabidopsisthalianaYANGYujie1ꎬ2ꎬLIANGGang1∗(1.KeyLaboratoryofTropicalPlantResourcesandSustainableUseꎬXishuangbannaTropicalBotanicalGardenꎬChineseAcademyofSciencesꎬKunming650223ꎬChinaꎻ2.CollegeofLifeSciencesꎬUniversityofChineseAcademyofSciencesꎬBeijing100049ꎬChina)Abstract:FIT(FER ̄LIKEIRONDEFICIENCY ̄INDUCEDTRANSCRIPTIONFACTOR)isakeyregulatorofFehomeostasisinArabidopsisꎬwhichisupregulatedunderFedeficiencyconditionꎬhoweverꎬtheunderlyingregulatorymechanismisstillunclear.InthisstudyꎬthesingleanddualoverexpressionplantsofA.thalianabHLH38andFITꎬaswellasthebHLHIbquadruplemutantplantsꎬwereusedasresearchmaterialsꎬandFedeficiencytestandquantitativeRT ̄PCRwereusedtoanalyzethechangeofFITtranscriptionlevelfromtheperspectiveofRT ̄RNA.Theresultswereasfollows:(1)UnderFesufficientconditionꎬthetranscriptionlevelofFITsignificantlyincreasedinthebHLH38overexpressionplantscomparedwithinthewildtypeplants.(2)ThetranscriptionofFITdidnotrespondtoFedeficiencyinthebHLHIbquadruplemutantplant.(3)TheoverexpressionofFITcouldnotactivatethetranscriptionofnativeFITꎬandthedualoverexpressionofFITandbHLH38promotedthetranscriptionofnativeFITunderFesufficient收稿日期:2022-09-20基金项目:云南省应用基础研究计划项目(2019FB028ꎬ202001AT070131)ꎮ第一作者:杨钰洁(1995-)ꎬ硕士研究生ꎬ主要从事植物铁营养代谢研究ꎬ(E ̄mail)870417073@qq.comꎮ∗通信作者:梁岗ꎬ博士ꎬ研究员ꎬ主要从事植物矿质营养研究ꎬ(E ̄mail)lianggang@xtbg.ac.cnꎮconditions.(4)TherewasnosignificantdifferencefortheexpressionofFITbetweenthetransgenicormutantplantsandwildtypeplantsunderFedeficiencycondition.TakentogetherꎬthesedatasuggestthatbHLHIbtranscriptionfactorsarenecessaryꎬbutnotsufficientꎬfortheupregulationofFITbyFedeficiency.TheresultsofthisstudyprovidenewinsightsintothevariouswaysthatplantsworktogethertomaintainFehomeostasis.Keywords:IronꎬtranscriptionregulationꎬFedeficiencyresponseꎬFehomeostasisꎬArabidopsisthaliana㊀㊀铁是植物生长发育的重要微量元素之一ꎬ它作为多种酶的辅助因子参与植物的光合作用㊁呼吸作用㊁叶绿素的生物合成㊁植物固氮以及植物激素合成等重要生命过程(Balk&Schaedlerꎬ2014)ꎮ铁是地壳中的第四大元素ꎬ易氧化形成沉淀ꎬ不易被植物利用ꎬ在pH较高的土壤中ꎬ铁的利用率更低(Guerinot&Yiꎬ1994)ꎮ植物缺铁常常导致缺铁症状ꎬ如叶片脉间失绿黄化ꎬ而植物是人类获取铁的重要膳食来源ꎬ植物缺铁会影响人类健康ꎮ植物为了从土壤中获取足够的铁ꎬ已经进化出两种不同的吸收策略ꎬ即非禾本科植物的策略I和禾本科植物的策略Ⅱ(Romheld&Marschnerꎬ1986ꎻGrillet&Schmidtꎬ2019)ꎮ模式植物拟南芥采用的策略I包括土壤酸化㊁Fe3+还原为Fe2+和铁吸收3个步骤ꎮ拟南芥的根际土壤酸化主要由AHA2完成(Santi&Schmidtꎬ2009)ꎬ之后Fe3+被铁还原氧化酶2(ferricreductionoxidase2ꎬFRO2)还原为Fe2+(Robinsonetal.ꎬ1999)ꎬ最后由铁调节转运体1(iron ̄regulatedtransporter1ꎬIRT1)转运进根细胞(Varottoetal.ꎬ2002ꎻVertetal.ꎬ2002)ꎮ禾本科植物如大麦(Hordeumvulgare)㊁玉米(Zeamays)和水稻(Oryzasativa)可以分泌高亲和力的麦根酸(被称为植物铁载体)来直接螯合Fe3+(Walker&Connollyꎬ2008ꎻMorrissey&Guerinotꎬ2009)ꎮ近年来的研究表明ꎬ拟南芥也能分泌铁螯合物(Rodriguez ̄Celma&Schmidtꎬ2013ꎻFourcroyetal.ꎬ2014ꎻSchmidetal.ꎬ2014ꎻSiwinskaetal.ꎬ2018ꎻTsaietal.ꎬ2018)ꎮFIT是策略I机制中的一个关键调控因子ꎬ其功能丧失会导致IRT1和FRO2表达水平的降低和严重的缺铁症状(Vertetal.ꎬ2002ꎻColangelo&Guerinotꎬ2004ꎻJakobyetal.ꎬ2004ꎻYuanetal.ꎬ2005)ꎮFIT与bHLHIb亚家族的四个成员(bHLH38㊁bHLH39㊁bHLH100和bHLH101)相互作用调控缺铁响应(Yuanetal.ꎬ2008ꎻWangetal.ꎬ2013)ꎮ这四个基因都受到缺铁条件的诱导且它们的蛋白功能冗余(Wangetal.ꎬ2013)ꎮFIT也是多种植物激素信号和细胞内信号与缺铁信号联系的中心枢纽ꎮ例如ꎬFIT蛋白的稳定性受到乙烯和一氧化氮(NO)的调节(Garciaetal.ꎬ2010ꎻLingametal.ꎬ2011ꎻMeiseretal.ꎬ2011)ꎮ乙烯信号通路中的转录因子EIN3(ETHYLENEINSENSITIVE3)和EIL1(ETHYLENEINSENSITIVE3 ̄LIKE1)与FIT互作ꎬ并增强其稳定性(Lingametal.ꎬ2011)ꎮNO能抑制FIT蛋白降解ꎬ促进其在缺铁条件下的稳定(Meiseretal.ꎬ2011)ꎮ此外ꎬNO通过GRF11(GENERALREGULATORYFACTOR11)调节FIT转录(Yangetal.ꎬ2013)ꎮ赤霉素是缺铁反应的另一个正调控因子ꎮDELLA蛋白作为赤霉素信号通路的负调控因子ꎬ与FIT蛋白相互作用并抑制FIT蛋白功能(Wildetal.ꎬ2016)ꎮ另外ꎬ茉莉酸通过诱导bHLHIVa亚家族基因(bHLH18㊁bHLH19㊁bHLH20和bHLH25)的表达负调控缺铁反应ꎬ其产物与FIT相互作用并促进FIT的降解(Matsuokaetal.ꎬ2014ꎻCuietal.ꎬ2018)ꎮFIT作为缺铁响应信号中的关键调控因子ꎬ其转录也受到缺铁诱导ꎮLei等(2020)的研究表明ꎬbHLH121直接靶向FIT的启动子ꎬ并正调控后者转录ꎮFIT作为铁稳态信号中的一个关键调控因子ꎬ其自身的转录也受到缺铁条件的诱导ꎮ已有的研究表明ꎬFIT和bHLHIb可以影响FIT的转录(Wangetal.ꎬ2007ꎻNaranjo ̄Arcosetal.ꎬ2017)ꎬ但它们是如何调控FIT表达的还不甚清楚ꎮ本研究重点关注bHLHIb成员bHLH38及FIT转录因子对FIT转录水平的调控ꎬ探讨bHLH38过表达是否可以激活FIT的转录ꎬ在bHLHIb的四突变体植物中FIT转录是否再受缺铁诱导ꎬFIT过表达能否激活内源FIT的转录ꎬ以及bHLH38和FIT的双过表达如何影响FIT的表达ꎮ1㊀材料与方法1.1植物材料和生长条件所用的拟南芥材料为Columbia ̄0生态型ꎮ播种前将种子用70%酒精浸泡15minꎬ之后用蒸馏水清洗至少3次ꎮ将种子铺在培养基上ꎬ4ħ冷藏2d后移到温室进行培养(22ħꎬ光照16h/黑暗8h)ꎮ+Fe培养基ꎬ即1/2MS培养基(1%蔗糖㊁0.7%琼脂A㊁0.1mmol L ̄1Fe(Ⅱ) ̄EDTA㊁pH5.8)ꎻ-Fe培养基ꎬ即其培养基成分除了不加Fe(Ⅱ) ̄EDTA004广㊀西㊀植㊀物43卷以外ꎬ与上面提及的+Fe培养基一样ꎮ论文中所用的FIT过表达植物来自中国科学院遗传发育研究所凌宏清研究组(Cuietal.ꎬ2018)ꎮ1.2载体构建及转基因提取野生型拟南芥根部的RNAꎬ反转录成cDNAꎬ通过PCR获得了bHLH38的全长编码区序列ꎬ并将其克隆到pOCA30双元表达载体上ꎮ用载体来转化农杆菌EHA105ꎬ并利用浸花法转化野生型拟南芥ꎮ将T1代转基因种子置于1/2MS+50mg L ̄1卡那霉素的平板上进行阳性苗筛选ꎮ1.3定量RT ̄PCR分析将在+Fe(0.1mmol L ̄1Fe(Ⅱ) ̄EDTA)垂直板上生长7d的幼苗ꎬ分别移到+Fe和-Fe垂直板上生长3dꎬ之后分离根用液氮冻存ꎮ利用Trizol试剂盒提取根部的总RNAꎬ用反转录试剂盒(TaKaRa)的oligo(dT)18引物反转成cDNAꎮ使用SYBRPremixExTaqTMkit(TaKaRa)定量RT ̄PCR试剂盒在RocheLightCycler480real ̄timePCR仪器上进行定量检测ꎬ其中ACT2用作内参基因ꎮ2㊀结果与分析2.1bHLH38过表达促进了FIT在加铁(+Fe)条件下的表达选择bHLH38作为bHLHIb转录因子的代表开展研究ꎮIRT1和FRO2是FIT和bHLHIb转录因子的靶基因ꎬ受到缺铁条件的诱导ꎮ在我们的实验里ꎬIRT1和FRO2被用作阳性Marker基因ꎮ我们用定量RT ̄PCR检测了缺铁响应基因IRT1㊁FRO2和FIT的表达ꎮ图1结果表明ꎬ在+Fe情况下IRT1㊁FRO2和FIT在bHLH38过表达植物中的表达水平均显著高于它们在WT中的水平ꎻ而在-Fe情况下ꎬ它们在bHLH38过表达植物中的表达则类似于或略低于其在WT中的水平ꎮWT.野生型ꎻb38oe ̄2和b38oe ̄3表示两个独立的bHLH38过表达株系ꎮ数据为3次生物学重复的平均值ꎻ小写字母表示+Fe条件下差异显著ꎬ大写字母表示-Fe条件下差异显著(ANOVAꎬP<0.01)ꎮ下同ꎮWT.Wildtypeꎻb38oe ̄2andb38oe ̄3representtwoindependentbHLH38overexpressionlines.Datarepresentxʃs(n=3)ꎻDifferentletters(uppercaselettersfor-Feꎬlowercaselettersfor+Fe)aboveeachbarindicatestatisticallysignificantdifferences(ANOVAꎬP<0.01).Thesamebelow.图1㊀IRT1㊁FRO2和FIT在bHLH38过表达植物中的表达情况Fig.1㊀ExpressionofIRT1ꎬFRO2andFITinthebHLH38overexpressionplants2.2四突变体植物的FIT转录水平不受缺铁(-Fe)诱导对bHLHIb的四突变体bhlh4x ̄1和bhlh4x ̄2进行缺铁处理(Caietal.ꎬ2021)ꎬ并通过定量RT ̄PCR检测IRT1㊁FRO2和FIT的表达ꎮ图2结果表明ꎬ在+Fe情况下ꎬIRT1和FRO2在bhlh4x ̄1和bhlh4x ̄2中的表达水平均显著低于它们在WT中的水平ꎬ而FIT的表达水平则无明显变化ꎮ相比较而言ꎬ在-Fe情况下ꎬIRT1㊁FRO2和FIT在bhlh4x ̄1和bhlh4x ̄2中的表达水平均显著低于它们在WT中的水平ꎮ2.3外源FIT过表达不能激活内源FIT的转录对FIT过表达植物进行缺铁处理并利用定量RT ̄PCR检测IRT1㊁FRO2和内源FIT的表达(图3)ꎮ我们用跨FIT基因最后一个外显子与3 UTR的一个片段来定量内源FIT的表达ꎮ图3结果表明ꎬ无论是在+Fe还是-Fe的情况下ꎬIRT1和FRO2的表达水平在FIT过表达植物中均轻微上调ꎬ而内源FIT的表达水平在FIT过表达植物和WT植物中则均无显著差异ꎮ2.4在+Fe条件下bHLH38和FIT的双过表达促进了内源FIT的增加先分别对bHLH38和FIT的双过表达植物进行缺铁处理ꎬ再通过定量RT ̄PCR检测IRT1㊁FRO2以及内源FIT的转录变化ꎮ图4结果表明ꎬ在+Fe和-Fe的情况下ꎬ双过表达植物中1042期杨钰洁等:拟南芥bHLHIb转录因子调控FIT的转录WT.野生型ꎻbhlh4x ̄1和bhlh4x ̄2表示两个独立的bHLHIb四突变体ꎮWT.Wildtypeꎻbhlh4x ̄1andbhlh4x ̄2representtwoindependentbHLHIbquadruplemutants.图2㊀IRT1㊁FRO2和FIT在四突变体植物中的表达情况Fig.2㊀ExpressionofIRT1ꎬFRO2andFITinthebhlh4xmutantplantsWT.野生型ꎻFIToe ̄2和FIToe ̄3表示两个独立的FIT过表达株系ꎮWT.WildtypeꎻFIToe ̄2andFIToe ̄3representtwoindependentFIToverexpressionlines.图3㊀IRT1㊁FRO2和FIT在FIT过表达植物中的表达情况Fig.3㊀ExpressionofIRT1ꎬFRO2andnativeFITintheFIToverexpressionplantsWT.野生型ꎻFIToe/b38oe ̄2和FIToe/b38oe ̄4表示两个独立的FIT过表达株系ꎮWT.WildtypeꎻFIToe/b38oe ̄2andFIToe/b38oe ̄4representtwoindependentFITandbHLH38dualoverexpressionlines.图4㊀IRT1㊁FRO2和FIT在双过表达植物中的表达情况Fig.4㊀ExpressionofIRT1ꎬFRO2andnativeFITinthedualoverexpressionplantsIRT1和FRO2的表达水平均高于WT中的表达水平ꎮ相比较而言ꎬ双过表达植物的内源FIT水平只有在+Fe时才高于WTꎬ而在-Fe时与WT的水平相近ꎮ3㊀讨论与结论铁是植物生长发育所必需的一种矿质元素ꎬ而204广㊀西㊀植㊀物43卷铁的可利用性主要依赖于土壤的pH值ꎮ在酸性土壤中部分铁以离子形式存在被植物利用ꎬ但在碱性土壤中铁主要以不溶的氧化状态存在ꎮ由于植物固着生长无法移动ꎬ因此在碱性土壤中生长的植物不得不面对缺铁胁迫ꎮ经过长期的进化ꎬ植物已经进化了一些特殊的机制来适应缺铁环境ꎮ植物能感知铁浓度的变化ꎬ并通过一套严密的铁信号转导系统来激活下游铁吸收相关基因的表达以促进铁的吸收ꎮ在拟南芥的缺铁响应系统中ꎬFIT是一个处于核心位置的调控因子ꎬ它直接控制了铁吸收基因IRT1和FRO2的表达(Schwarz&Bauerꎬ2020)ꎮ但是ꎬFIT自身的转录也受到缺铁的诱导(Colangelo&Guerinotꎬ2004)ꎮ探究FIT在缺铁条件下如何被激活已成为铁信号研究领域的一个热点ꎮ过表达bHLHIb亚家族的成员bHLH39可以在+Fe情况下激活FIT表达(Naranjo ̄Arcosetal.ꎬ2017)ꎬ表明bHLH39在+Fe条件下正调控FIT的表达ꎮ我们分析了bHLHIb中另一个成员bHLH38的过表达植物ꎬ发现FIT的表达趋势类似于其在bHLH39过表达植物的情况ꎬ这证明bHLHIb家族成员之间的功能冗余ꎮ由于较强的功能冗余性ꎬ因此bHLHIb四个成员的单㊁双突变体无明显的缺铁表型ꎬ三突变体表现出轻微的缺铁表型(Sivitzetal.ꎬ2012ꎻWangetal.ꎬ2013ꎻMaureretal.ꎬ2014)ꎬ而四突变体则表现出强烈的缺铁症状(Caietal.ꎬ2021)ꎮ本研究发现ꎬ四突变体中FIT的表达水平在+Fe时没有显著变化ꎬ但在-Fe时显著低于其WT中的水平ꎬ这表明bHLHIb对于-Fe时FIT的上调是必需的ꎮfit突变体中FIT的启动子活性显著低于WT中的水平(Wangetal.ꎬ2007)ꎬ表明FIT对于其自身的转录是必需的ꎮ本研究结果表明ꎬ在FIT过表达植物里ꎬ内源FIT的表达与WT无显著差异ꎬ这表明外源FIT过表达不足以促进内源FIT的转录ꎮ因此ꎬFIT对于FIT自身转录虽是必要条件ꎬ但不是充分条件ꎮ在铁稳态信号转导途径中ꎬFIT通过与bHLHIb成员形成异源二聚体共同激活下游基因IRT1和FRO2的表达(Yuanetal.ꎬ2018ꎻWangetal.ꎬ2013)ꎮ在WT背景下过表达bHLH39可以促进IRT1和FRO2的表达ꎬ而在fit突变体背景下bHLH39却不能激活靶基因IRT1和FRO2(Naranjo ̄Arcosetal.ꎬ2017)ꎬ这说明bHLH39激活IRT1和FRO2的转录需要FIT的参与ꎮ在+Fe情况下ꎬbHLH38过表达及bHLH38和FIT双过表达都可以促进IRT1㊁FRO2和内源FIT的转录ꎮ相比较而言ꎬ在-Fe情况下ꎬ双过表达虽然促进了IRT1和FRO2的表达ꎬ但没有促进FIT的表达ꎬ而bHLH38单过表达对IRT1㊁FRO2和FIT的表达影响不大ꎮ因此ꎬ我们得出结论:bHLHIb是缺铁诱导FIT的必要条件ꎬ而不是充分条件ꎮ当外源FIT蛋白过量表达时ꎬ拟南芥会启动体内的26S蛋白酶降解系统来促进FIT的降解ꎬ最终维持FIT的蛋白相对稳定(Meiseretal.ꎬ2011ꎻSivitzetal.ꎬ2011)ꎮSivitz等(2011)研究认为ꎬ在-Fe情况下ꎬ拟南芥植物需要维持稳定水平的㊁有活性的FIT蛋白ꎬ既可以保证植物吸收足够的铁ꎬ又可以保证植物不会因吸入过多铁而对其产生毒害ꎮ本研究结果表明ꎬFIT转录水平在缺铁条件下已经达到最高值ꎬ即使额外增加正调控它的转录因子的水平也不能提高FIT的转录水平ꎬ这暗示植物不需要或不能维持太高的内源FIT转录本ꎮ这种内源FIT转录本的阈值现象与FIT蛋白的阈值现象非常类似ꎮ我们猜测ꎬ植物可能已经进化出了不同的方式来维持铁稳态ꎮ从RNA和蛋白两方面控制FIT的水平可能是植物维持铁稳态的关键一环ꎮ除了这两方面以外ꎬ拟南芥还能根据铁浓度的变化调整FIT蛋白在细胞核与细胞质的比例以及调整FIT的磷酸化状态(Gratzetal.ꎬ2019ꎬ2020)ꎬ最终维持植物的铁稳态ꎮ本研究从RNA角度研究了FIT的转录变化ꎬ这为今后深入了解植物通过多种途径共同维持铁稳态提供了新的见解ꎮ参考文献:BALKJꎬSCHAEDLERTAꎬ2014.Ironcofactorassemblyinplants[J].AnnRevPlantBiolꎬ65:125-153.BUCKHOUTTJꎬYANGTJWꎬSCHMIDTWꎬ2009.Earlyiron ̄deficiency ̄inducedtranscriptionalchangesinArabidopsisrootsasrevealedbymicroarrayanalyses[J].BMCGenomicsꎬ10:147.CAIYRꎬLIYꎬLIANGGꎬ2021.FITandbHLHIbtranscriptionfactorsmodulateironandcoppercrosstalkinArabidopsis[J].PlantCellEnvironꎬ44(5):1679-1691.COLANGELOEPꎬGUERINOTMLꎬ2004.Theessentialbasichelix ̄loop ̄helixproteinFIT1isrequiredfortheirondeficiencyresponse[J].PlantCellꎬ16(12):3400-3412.CUIYꎬCHENCLꎬCUIMꎬetal.ꎬ2018.FourIVabHLHtranscriptionfactorsarenovelinteractorsofFITandmediateJAinhibitionofironuptakeinArabidopsis[J].MolPlantꎬ11(9):1166-1183.FOURCROYPꎬSISO ̄TERRAZAPꎬSUDREDꎬetal.ꎬ2014.InvolvementoftheABCG37transporterinsecretionofscopoletinandderivativesbyArabidopsisrootsinresponsetoirondeficiency[J].NewPhytolꎬ201(1):155-167.GARCIAMJꎬLUCENACꎬROMERAFJꎬetal.ꎬ2010.Ethyleneandnitricoxideinvolvementintheup ̄regulationofkeygenesrelatedtoironacquisitionandhomeostasisinArabidopsis[J].JExpBotꎬ61(14):3885-3899.GRATZRꎬMANISHANKARPꎬIVANOVRꎬetal.ꎬ2019.3042期杨钰洁等:拟南芥bHLHIb转录因子调控FIT的转录CIPK11 ̄dependentphosphorylationmodulatesFITactivitytopromoteArabidopsisironacquisitioninresponsetocalciumsignaling[J].DevCellꎬ48(5):726-740.GRATZRꎬBRUMBAROVATꎬIVANOVRꎬetal.ꎬ2020.Phospho ̄mutantactivityassaysprovideevidenceforalternativephospho ̄regulationpathwaysofthetranscriptionfactorFER ̄LIKEIRONDEFICIENCY ̄INDUCEDTRANSCRIPTIONFACTOR[J].NewPhytolꎬ225(1):250-267.GRILLETLꎬSCHMIDTWꎬ2019.Ironacquisitionstrategiesinlandplants:notsodifferentafterall[J].NewPhytolꎬ224(1):11-18.GUERINOTMLꎬYIYꎬ1994.Iron:Nutritiousꎬnoxiousꎬandnotreadilyavailable[J].PlantPhysiolꎬ104(3):815-820.JAKOBYMꎬWANGHYꎬREIDTWꎬetal.ꎬ2004.FRU(BHLH029)isrequiredforinductionofironmobilizationgenesinArabidopsisthaliana[J].FEBSLettꎬ577(3):528-534.LINGAMSꎬMOHRBACHERJꎬBRUMBAROVATꎬetal.ꎬ2011.InteractionbetweenthebHLHtranscriptionfactorFITandETHYLENEINSENSITIVE3/ETHYLENEINSENSITIVE3 ̄LIKE1revealsmolecularlinkagebetweentheregulationofironacquisitionandethylenesignalinginArabidopsis[J].PlantCellꎬ23(5):1815-1829.LEIRHꎬLIYꎬCAIYRꎬetal.ꎬ2020.bHLH121functionsasadirectlinkthatfacilitatestheactivationofFITbybHLHIVctranscriptionfactorsformaintainingFehomeostasisinArabidopsis[J].MolPlantꎬ13(4):634-649.MATSUOKAKꎬFURUKAWAJꎬBIDADDIHꎬetal.ꎬ2014.Gibberellin ̄inducedexpressionofFeuptake ̄relatedgenesinArabidopsis[J].PlantCellPhysiolꎬ55(1):87-98.MAURERFꎬNARANJOARCOSMAꎬBAUERPꎬ2014.Responsesofatriplemutantdefectiveinthreeirondeficiency ̄inducedBASICHELIX ̄LOOP ̄HELIXgenesofthesubgroupIb(2)toirondeficiencyandsalicylicacid[J].PLoSONEꎬ9(6):e99234.MEISERJꎬLINGAMSꎬBAUERPꎬetal.ꎬ2011.Posttranslationalregulationoftheirondeficiencybasichelix ̄loop ̄helixtranscriptionfactorFITisaffectedbyironandnitricoxide[J].PlantPhysiolꎬ157(4):2154-2166.MORRISSEYJꎬGUERINOTMLꎬ2009.Ironuptakeandtransportinplants:Thegoodꎬthebadꎬandtheionome[J].ChemRevꎬ109(10):4553-4567.NARANJO ̄ARCOSMAꎬMAURERFꎬMEISERJꎬetal.ꎬ2017.DissectionofironsignalingandironaccumulationbyoverexpressionofsubgroupIbbHLH039protein[J].SciRepꎬ7:10911.ROBINSONNJꎬPROCTERCMꎬCONNOLLYELꎬetal.ꎬ1999.Aferric ̄chelatereductaseforironuptakefromsoils[J].Natureꎬ397(6721):694-697.RODRIGUEZ ̄CELMAJꎬSCHMIDTWꎬ2013.Reduction ̄basedironuptakerevisited:ontheroleofsecretediron ̄bindingcompounds[J].PlantSignalBehavꎬ8(11):e26116.ROMHELDVꎬMARSCHNERHꎬ1986.Evidenceforaspecificuptakesystemforironphytosiderophoresinrootsofgrasses[J].PlantPhysiolꎬ80(1):175-180.SANTISꎬSCHMIDTWꎬ2009.Dissectingirondeficiency ̄inducedprotonextrusioninArabidopsisroots[J].NewPhytolꎬ183(4):1072-1084.SCHMIDNBꎬGIEHLRFHꎬDOLLSꎬetal.ꎬ2014.Feruloyl ̄CoA6ᶄ ̄hydroxylase1 ̄dependentcoumarinsmediateironacquisitionfromalkalinesubstratesinArabidopsis[J].PlantPhysiolꎬ164(1):160-172.SCHWARZBꎬBAUERPꎬ2020.FITꎬaregulatoryhubforirondeficiencyandstresssignalinginrootsꎬandFIT ̄dependentand ̄independentgenesignatures[J].JExpBotꎬ71(5):1694-1705.SIVITZAꎬGRINVALDSCꎬBARBERONMꎬetal.ꎬ2011.Proteasome ̄mediatedturnoverofthetranscriptionalactivatorFITisrequiredforplantiron ̄deficiencyresponses[J].PlantJꎬ66(6):1044-1052.SIVITZABꎬHERMANDVꎬCURIECꎬetal.ꎬ2012.ArabidopsisbHLH100andbHLH101controlironhomeostasisviaaFIT ̄independentpathway[J].PLoSONEꎬ7(9):e44843.SIWINSKAJꎬSIATKOWSKAKꎬOIRYAꎬetal.ꎬ2018.Scopoletin8 ̄hydroxylase:anovelenzymeinvolvedincoumarinbiosynthesisandiron ̄deficiencyresponsesinArabidopsis[J].JExpBotꎬ69(7):1735-1748.TSAIHHꎬRODRÍGUEZ ̄CELMAJꎬLANPꎬetal.ꎬ2018.Scopoletin8 ̄hydroxylase ̄mediatedfraxetinproductioniscrucialforironmobilization[J].PlantPhysiolꎬ177(1):194-207.VAROTTOCꎬMAIWALDDꎬPESARESIPꎬetal.ꎬ2002.ThemetaliontransporterIRT1isnecessaryforironhomeostasisandefficientphotosynthesisinArabidopsisthaliana[J].PlantJꎬ31(5):589-599.VERTGꎬGROTZNꎬDEALDECHAMPFꎬetal.ꎬ2002.IRT1ꎬanArabidopsistransporteressentialforironuptakefromthesoilandforplantgrowth[J].PlantCellꎬ14(6):1223-1233.WALKERELꎬCONNOLLYELꎬ2008.Timetopumpiron:iron ̄deficiency ̄signalingmechanismsofhigherplants[J].CurrOpinPlantBiolꎬ11(5):530-535.WANGHYꎬKLATTEMꎬJAKOBYMꎬetal.ꎬ2007.Irondeficiency ̄mediatedstressregulationoffoursubgroupIbBHLHgenesinArabidopsisthaliana[J].Plantaꎬ226(4):897-908.WANGNꎬCUIYꎬLIUYꎬetal.ꎬ2013.RequirementandfunctionalredundancyofIbsubgroupbHLHproteinsforirondeficiencyresponsesanduptakeinArabidopsisthaliana[J].MolPlantꎬ6(2):503-513.WILDMꎬDAVIEREJMꎬREGNAULTTꎬetal.ꎬ2016.Tissue ̄specificregulationofgibberellinsignalingfine ̄tunesArabidopsisiron ̄deficiencyresponses[J].DevCellꎬ37(2):190-200.YANGJLꎬCHENWWꎬCHENLQꎬetal.ꎬ2013.The14-3-3proteinGENERALREGULATORYFACTOR11(GRF11)actsdownstreamofnitricoxidetoregulateironacquisitioninArabidopsisthaliana[J].NewPhytolꎬ197(3):815-824.YUANYXꎬWUHLꎬWANGNꎬetal.ꎬ2008.FITinteractswithAtbHLH38andAtbHLH39inregulatingironuptakegeneexpressionforironhomeostasisinArabidopsis[J].CellResꎬ18(3):385-397.YUANYXꎬZHANGJꎬWANGDWꎬetal.ꎬ2005.AtbHLH29ofArabidopsisthalianaisafunctionalorthologoftomatoFERinvolvedincontrollingironacquisitioninstrategyIplants[J].CellResꎬ15(8):613-621.(责任编辑㊀蒋巧媛㊀邓斯丽)404广㊀西㊀植㊀物43卷。
DELLA蛋白在植物生长发育中的作用

DELLA蛋白在植物生长发育中的作用蒋梦婷;渠慎春【摘要】DELLA蛋白作为GA信号转导通路中起抑制作用的转录因子,是一类定位在核内的生长抑制蛋白,可以直接与植物体内关键转录因子的蛋白互作,进而在许多植物信号活动中发挥核心作用.该文对近年来国内外有关模式植物及果树、蔬菜、花卉、粮食作物等植物DELLA蛋白基因家族的鉴定、时空表达模式、蛋白结构、参与的GA信号转导机理、与光敏色素互作因子PIF及F-box蛋白的互作及DELLA蛋白在植物种子萌发、形态建成、豆科植物根瘤菌共生、气孔关闭、植物抗逆反应等过程中的重要作用等方面的研究进展进行综述,并比较了DELLA蛋白基因家族在不同物种中的差异,对其今后的研究热点和方向进行了展望,为进一步探讨DELLA蛋白的功能提供信息.【期刊名称】《西北植物学报》【年(卷),期】2018(038)010【总页数】9页(P1952-1960)【关键词】DELLA蛋白;赤霉素(GA);植物激素;信号转导;植物生长发育【作者】蒋梦婷;渠慎春【作者单位】南京农业大学园艺学院,南京210095;南京农业大学园艺学院,南京210095【正文语种】中文【中图分类】Q789赤霉素(gibberellin, GA)作为一种重要的植物激素,几乎参与了高等植物生长和发育的各个过程,如种子萌发、茎和叶片伸长、下胚轴伸长、花的形成、果实的发育等[1]。
DELLA蛋白作为GA信号转导通路中起抑制作用的转录因子,是一类定位在核内的生长抑制蛋白,可以直接与植物体内关键转录因子的蛋白互作,进而在许多植物信号活动中发挥核心作用。
研究表明,DELLA蛋白能被拟南芥O-型岩藻糖转移酶SPINDLY(SPY)岩藻糖化,进而促进了DELLA蛋白与油菜素内酯关键调控子BRASSINAZOLE-RESISTANT1 (BZR1)以及光信号通路关键调控子包括PHYTOCHROME-INTERACTING-FACTOR3 (PIF3) 和PIF4的互作[2]。
茉莉酸辅助的烟草烟碱突变体筛选及分子生理学研究

茉莉酸辅助的烟草烟碱突变体筛选及分子生理学研究烟草是我国种植面积最广的经济作物之一,在国民经济与农业生产中具有重要地位。
烟叶质量是烟草经济价值的直接体现。
其中,烟碱是衡量烟叶化学品质的重要指标,也是影响人们健康的关键因素,适碱少害烟草一直是烟草产业的发展方向。
生产上,传统家系选择法和杂交育种法具有育种周期长、工作量大及优良性状遗传不稳定等缺点,在生物技术快速发展的今天,有必要利用分子生物学技术手段,通过筛选烟草烟碱突变体揭示其分子机理,为烟草低碱品种选育与栽培实践提供理论支撑和生产参考。
茉莉素信号途径参与烟碱合成代谢和植物抗病调控,茉莉酸可以影响种子萌发和根发育,本研究以此为依据,基于茉莉酸敏感性从烟草激活标签突变体库中筛选烟碱突变体,并对突变体进行生理分析和分子鉴定。
主要结果如下:1.茉莉酸辅助筛选烟草烟碱激活标签突变体(1)开发了一种高通量筛选烟草激活标签突变体库的新方法:茉莉酸敏感性辅助筛选烟碱突变体。
首先,在茉莉酸选择压力下筛选萌发时间和根长与对照存在差异的突变体;其次,以这些突变体为材料,通过测定打顶前后烟碱含量筛选烟碱突变体;然后,进一步筛选在三代内保持稳定的茉莉酸敏感性和烟碱含量的的突变体。
这个突变体筛选方法简单高效、省财省力,同时具有挖掘茉莉酸介导的烟碱合成新基因的潜能。
(2)在3000份T1代烟草激活标签突变体库中筛出48个萌发时间和根长具有异常的茉莉酸敏感性的突变体。
进一步筛选后一共找到8个烟碱含量异常的突变体,它们在3代内保持稳定的茉莉酸敏感性和烟碱含量。
这些突变体可以分为两类,第一类的5个突变体在打顶前后具有相同级别的烟碱含量,分别命名为nit3、nit6、nit7、nit9和nit10。
其中nit3和nit6为偏低烟碱突变体,对茉莉酸低敏感;nit7为偏高烟碱突变体,对茉莉酸敏感;nit9和nit10为高烟碱突变体,对茉莉酸高敏感。
第二类的3个突变体在打顶前后具有不同级别的烟碱含量,我们将其称为特殊烟碱突变体,分别命名为nit11、nit14、nit17,其中nit11的烟碱含量在打顶前偏低打顶后偏高,对茉莉酸不敏感;nit14的烟碱含量在打顶前偏低打顶后高,对茉莉酸低敏感;nit17的烟碱含量在打顶前高打顶后偏低,对茉莉酸高敏感。
基于多维组学数据分析挖掘并验证拟南芥PHO1;H10基因功能

基于多维组学数据分析挖掘并验证拟南芥PHO1;H10基因功能PHO1基因家族包含11个成员,分别被命名为PHO1及PHO1;H1-H10,它们的蛋白质序列中均含有SPX和EXS两个功能结构域。
Ribot等人研究发现,拟南芥PHO1;H10基因受多种生物和非生物逆境胁迫调控,包括机械损伤、干旱、冷害、高盐、病原菌侵染等,另外,该基因也受脱落酸(ABA)和茉莉酸(JA)前体物质12-氧-植物二烯酸(OPDA)诱导表达。
许多拟南芥转录组数据表明,PHO1;H10基因可能参与到逆境胁迫及植物激素代谢和信号转导过程中,如水分胁迫(如渗透、干旱和盐胁迫等)、紫外线胁迫等逆境胁迫、ABA和水杨酸(SA)的信号通路等。
但是,关于PHO1:H10基因表达的分子调控机制的进一步探索和对其功能的具体实验验证目前还少见报道。
为此,本研究运用生物信息学平台和分析手段进行多种组学的数据挖掘,对PHO1;H10的表达调控机制和基因功能进行了探索和预测,并通过分子生物学和遗传学等方法对PHO1;H10基因的可能功能进行了初步实验验证。
首先,通过在拟南芥顺式作用元件平台上进行分析发现,PHO1;H10基因的启动子区域包含许多与ABA响应相关的ABRE类的顺式作用元件、干旱响应相关的顺式作用元件如ACGTATERD1等。
进而,利用本实验室研发的植物表观基因组数据整合平台(PCSD)对该基因的染色质状态进行了初步探索,尤其是利用高通量ChIP-seq数据对转录因子结合位点进行深度挖掘发现,PHO1;H10基因的启动子区域存在一系列转录因子如ABI5、HY5、SPCH等的结合位点。
ABI5是ABA信号途径中的一个关键转录因子,可以结合PHO1:H10启动子上的ABRE顺式作用元件;HY5是在光信号转导过程中起重要作用的系统性光信号蛋白,HY5参与调控ABI5基因表达,提示PHO1;H10基因可能同时受光信号和ABA信号调控;SPCH(SPEECHLESS)是调控气孔发育的关键转录因子。
茉莉酸调控次生代谢的原理

茉莉酸调控次生代谢的原理茉莉酸是植物中一种重要的激素,具有调控植物次生代谢的能力。
次生代谢是指植物细胞合成、存储并在植物发生压力、伤害或环境变化时释放的化合物。
茉莉酸通过调节次生代谢物的合成、存储和释放来参与植物的生长发育、抵御外界胁迫等过程。
茉莉酸的调控作用主要通过两个途径实现:茉莉酸信号传导途径和茉莉酸诱导基因表达途径。
茉莉酸信号传导途径是通过感应茉莉酸并转导信号的分子组成的信号途径。
茉莉酸受体(jasmonate receptors)是茉莉酸信号传导途径的核心组分。
茉莉酸受体包括COI1(CORONATINE INSENSITIVE1)等。
当茉莉酸结合到茉莉酸受体上时,激活受体,并与其他下游信号分子相互作用,最终形成信号传导链。
信号传导链上的分子包括JAZ蛋白(jasmonate ZIM-domain),MYC转录因子(MYC transcription factors)等。
JAZ蛋白在茉莉酸未结合受体时与MYC转录因子结合并抑制其活性,形成茉莉酸信号的负调节。
当茉莉酸结合受体时,茉莉酸受体与JAZ蛋白结合,促进JAZ蛋白的降解,从而解除MYC转录因子的抑制,促进转录因子的活性,引发下游靶基因的表达。
这些靶基因编码了一系列参与次生代谢的关键酶,进而调控次生代谢物的合成。
茉莉酸诱导基因表达途径是通过茉莉酸诱导基因表达来调控次生代谢物合成的过程。
茉莉酸可以直接或间接地影响一系列转录因子的表达,进而调控靶基因的表达。
例如,茉莉酸能够激活WRKY(WRKY domain-containing)家族转录因子的表达,WRKY转录因子与WRKY结合因子结合,在次生代谢物合成途径上起到调节作用。
此外,茉莉酸还能够通过激活MYB(MYB domain-containing)转录因子的表达,进一步参与次生代谢物的合成。
茉莉酸调控植物次生代谢的原理可以总结如下:茉莉酸通过茉莉酸受体与下游信号分子相互作用,最终促进了茉莉酸信号的传导。
拟南芥 AtFAD6 基因突变体的构建
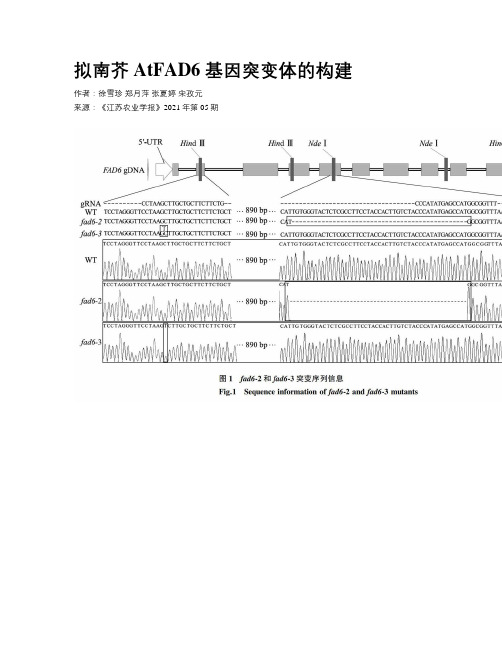
拟南芥 AtFAD6 基因突变体的构建作者:徐雪珍郑月萍张夏婷宋孜元来源:《江苏农业学报》2021年第05期摘要:运用优化后的CRISPR/Cas9基因编辑载体,创建了2个不同的拟南芥脂肪酸去饱和酶6基因( AtFAD6 )突变体,其 AtFAD6 基因的保守位点氨基酸序列均发生变化,同时终止密码子被提前引入,基因功能丧失。
脂肪酸组分分析结果显示,这2种突变体的叶片中单不饱和脂肪酸 16∶ 1和 18∶ 1大量积累,多不饱和脂肪酸 16∶ 3和 18∶ 3含量则大幅下降,同时伴随着叶片发黄、地上部生物量显著降低、抽薹提前 2~ 3 d的表型变化。
多不饱和脂肪酸18∶ 3作为茉莉酸合成的前体物质,其含量的下降致使突变体中茉莉酸信号标记基因 AtVSP1 在叶片中的表达量有所降低,而茎中的表达量提高了40%以上。
所获得的2个 AtFAD6 功能丧失型突变体为进一步研究脂类代谢与植物生长发育之间的关系提供了重要的遗传材料。
关键词:拟南芥; CRISPR/Cas9; 脂肪酸去饱和酶( FAD ); 基因突变体中图分类号: Q754 文献标识码: A 文章编号: 1000-4440(2021)05-1125-06Construction of Arabidopsis AtFAD6 gene mutantXU Xue-zhen, ZHENG Yue-ping, ZHANG Xia-ting, SONG Zi-yuan(School of Agricultural and Food Sciences, Zhejiang A&F University, Hangzhou 311300,China)Abstract: The optimized CRISPR/Cas9 gene editing vector was used to create two distinct Arabidopsis AtFAD6 gene mutant. As the nucleotide sequence of the conserved amino acid residues was mutated, and the stop codon was introduced in advance, the fad6 gene function of these two mutants was completely lost. The results of fatty acid composition analysis showed that monounsaturated fatty acids 16∶ 1 and 18∶ 1 accumulated significantly while the content of polyunsaturated fatty acids 16∶ 3 and 18∶ 3 decreased significantly in the leaves of these two mutants. At the same time, phenotypes of the mutants were appeared, including yellowed leaves,significantly decreased above-ground biomass, and bolting 2- 3 days earlier than wild-type. The paly unsaturated fatty acid 18∶ 3 was used as the precursor substance of jasmonic acid synthesis. The decrease of its content reduced the expression of the jasmonic acid signal marker gene AtVSP1 in the leaves, while the expression in stems increased by more than 40%. The two AtFAD6 loss-of-function mutants obtained in our study provide important genetic material for further research on the relationship between lipid metabolism and plant growth and development.Key words: Arabidopsis ; CRISPR/Cas9; fatty acid desaturase( FAD ); gene mutant不飽和脂肪酸是植物细胞内一类重要的代谢物质,也是植物膜脂的主要结构成分,在植物生长发育、应答各种环境信号等过程中发挥重要作用 [1] 。
拟南芥叶片合成与发育的基因调控研究

拟南芥叶片合成与发育的基因调控研究在植物学研究中,拟南芥被广泛用作模式植物。
作为一种小型、快速生长的植物,拟南芥的生长环境也相较于其他植物更加容易控制,并且基因组之间关系也更为简单,使其成为理想的研究对象。
其中,拟南芥叶片合成与发育的基因调控研究也成为了当今植物学研究的热点之一。
一、拟南芥叶片合成基因的研究总体来看,拟南芥叶片合成基因的研究主要围绕着以下四个方面展开:1.脂肪酸合成途径相关基因的研究脂肪酸是植物生长过程中不可或缺的营养物质。
拟南芥中的FAB1基因和KAS1基因被发现与脂肪酸合成密切相关,通过RNAi技术可以调控FAB1基因在叶片中的表达,进而影响叶片的脂肪酸合成。
2.酚类物质合成途径相关基因的研究酚类物质在植物中具有多种生理功能,包括抗氧化、限制蒸腾等。
拟南芥叶片合成所需的酚类物质主要来源于香豆素合成途径和苯丙酸途径。
PAL、C4H和4CL等基因参与了苯丙酸的合成,而CYP73A5和CYP98A8等基因则是香豆素合成途径上的重要调控因子。
3.淀粉合成途径相关基因的研究淀粉是植物细胞中储存能量的重要化学物质。
拟南芥中的SS、SBE和BE等基因均参与了淀粉的合成和降解过程。
通过对这些基因的调控,可以影响叶片中淀粉的含量,从而影响植物生长和代谢。
4.其他合成途径相关基因的研究除了上述三种主要的叶片合成途径外,拟南芥叶片合成中还存在其他合成途径,如萜烯合成途径和芸苔苷合成途径等。
这些途径上的基因也被广泛地研究和调控,以探讨它们对植物生长的影响。
二、拟南芥叶片发育基因的研究拟南芥叶片的发育过程包括初生叶、成熟叶和老叶三个阶段。
其中,初生叶的发育过程被认为是最为关键的阶段。
在此期间,拟南芥叶片的组织类型、形态和大小等都将被确定。
因此,对拟南芥叶片发育的研究具有重要的理论和应用意义。
1.叶盘形态的发育拟南芥在初生叶的形成过程中,叶盘的形态发育是一个重要的过程。
近期的研究表明,一些基因如ARP3、CDT1和FLP1等可以通过调控微丝骨架来影响叶盘形态。
外源茉莉酸诱导对油菜防御酶活性和4种物质含量及植株生长的影响

才直紿礁步 2021,47(1):128 - 134Plant Protection外源茉莉酸诱导对油菜防御酶活性和 4种物质含量及植株生长的影响冯建雄,常静,李海平**,杨凡,李妍收稿日期:2019-10-08 修订日期:2020-01-12基金项目:国家自然科学基金(31660523)* 通信作者 E-mail :lihaiping5820@hotmail. com(内蒙古农业大学园艺与植物保护学院,呼和浩特010019)摘要 油菜是我国重要的油料作物。
近10年来油菜虫害呈重发态势,而茉莉酸可以诱导植物产生抗虫性。
本研究 测定了外源茉莉酸处理对'大黄'油菜幼苗中防御酶活■性以及可溶性蛋白、可溶性糖、叶绿素、单宁含量及植株生长状况餉影响。
结果显示,以100 fzmol/L 茉莉酸处理后,油菜叶片中过氧化物酶(POD)、多酚氧化酶(PPO)、超氧化 物歧化酶(SOD)和苯丙氨酸解氨酶(PAL)活性较对照均有提高。
其中对PAL 影响最大,48 h 时上升为对照的2. 36倍;POD 和PPO 活性均在12 h 后达到最高,分别比对照增加了 73. 46%和49. 21%;对SOD 活性在处理后 24 h 比对照增加了 14. 93%;胰•蛋白酶抑制剂(TI)活性在茉莉酸处理后48 h 达到最大,比对照提高了 3& 37%,之后逐渐下降,至120 h 时与对照无显著差异;胰凝乳蛋白酶抑制剂(CI)活性在茉莉酸诱导后一直增加,120 h 时是对照 的1. 78倍。
可溶性糖和叶绿素含量在处理120 h 均降到最低,分别比对照降低了 3& 70%和17. 83%。
可溶性蛋白含量则先降低后升高,在处理48 h 后最低,比对照降低47.98%。
可溶性单宁在茉莉酸诱导后含量持续升高,在120 h 时上升为对照的2. 03倍。
油菜根长在茉莉酸处理后28 d 和35 d 显著长于对照;株高和干重均与对照无显著差异。
不同植物激素诱导拟南芥 SDG8的表达模式

不同植物激素诱导拟南芥 SDG8的表达模式刘玲;金苏;曾文婕;宁凡;阮颖【摘要】与植物激素在植物整个生命周期中起着多重作用类似,基因SDG8对植物生长、发育、代谢、抗性等多个方面也具多效性.对拟南芥Col-0和转pSDG8∷GUS植株分别进行KT、ABA、GA3、IAA、MeJA和MeSA喷洒处理24 h后,用GUS试剂和RT-qPCR研究SDG8基因的表达模式.结果显示,在植物营养生长阶段和使用的激素浓度范围内,这6种激素对SDG8基因的表达调控有4种模式:KT高低浓度都抑制表达;ABA低浓度促进表达,高浓度表达量下降;GA3 低浓度与高浓度促进表达的水平相同;随IAA、MeJA和MeSA浓度增加表达水平提高.这些结果从总体上揭示了植物激素对SDG8的表达趋势的影响,对进一步研究植物激素与SDG8基因相互作用有一定的参考价值.%Plant hormones play multiple roles during the whole life of plant,and SDG8 gene also has pleiotropic effects on plant growth,development,metabolism,resistance and so on,but the crosstalk between plant hormones and SDG8 remains elusive.The expression patterns of SDG8 were investigated by qPCR and GUS assay after the treating of Arabidopsis thali-ana Col-0 and pSDG8∷GUS with KT,ABA,GA3,IAA,JA and SA.The results indicated that there were four SDG8 ex-pression models,lower and higher concentration KT suppressed SDG8 gene expression,lower ABA promoted expression while higher ABA reduced expression,GA3 enhanced expression at the same level under lower and higher concentration,IAA,MeJA and MeSA increased expression with the increment of concentration.These results gave us an overall under-standing the expression trend of plant hormones affected onSDG8,which were worthy for further research on interaction of plant hormones and SDG8 genes.【期刊名称】《作物研究》【年(卷),期】2015(029)003【总页数】4页(P226-229)【关键词】植物激素;拟南芥;SDG8;表达模式【作者】刘玲;金苏;曾文婕;宁凡;阮颖【作者单位】湖南农业大学生物科学技术学院,长沙410128;湖南农业大学生物科学技术学院,长沙410128;湖南农业大学生物科学技术学院,长沙410128;湖南农业大学生物科学技术学院,长沙410128;湖南农业大学生物科学技术学院,长沙410128【正文语种】中文【中图分类】Q786;Q946.885表观修饰,如乙酰化、甲基化、泛素化、磷酸化、瓜氨酸化、ADP糖基化的调控在参与植物生长、发育和环境应答的过程中起着重要的作用[1~3]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酶 、 激 蛋 白 、 依 赖 于维 生 素 B 蛋 氨 酸 合 酶 、 嘌 呤 琥 珀 酸 合 酶 、 酸 酐 酶 等 , 些 蛋 白质 可 能 在 拟 南 芥 叶 片应 热 不 。 的 腺 碳 这 答 茉莉 酸反 应 的过 程 中起 到 重 要 作 用 , 一 步 进 行 差 异 蛋 白的 功 能 分 析 对 揭 示 茉 莉 酸 信 号 通 路 和植 物 防 御 , 0 o t fw ih w r u c sf l d n i e sn o n n Arb d p i 1 u h c e e s c e s l i e t id u i g MAL — OF T n lss T e Me A r - s o u y f DIT / OF MS a ay i. h J e
i s o s o M eh l a mo a e n Re p n e t t y s n t J
P AN — U, I L n ln, YiO L U i —i ZHANG u h n ZHANG i g, J — o g, Jn
AN S a — , e g JN J n l g L U Z i e , igh i h ol XU P n ,I u — n , I h — iXIJn — u i i w ( o eeo l t c ne Ji n esy C agh n 10 6 ,hn ) C l g f a i c ,l U i r t,h nc u 0 2 C ia l P nS e in v i 3 A s atPa t po uejs o i ai o e y js o a ( J i rsos a ybo cs essprc - bt c:ln rd c m ne cd r t l am nt MeA)n epnet m n i i t s ,a i r s a m h e o t r e tu
系 具有 重要 的作 用 。
关 键 词 : 南芥 ; 莉 酸 甲 酯 ; 向 电泳 ; 谱 拟 茉 双 质
中 图分 类 号 : 5 Q 1 文 献 标 识 码 : A 文章 编 号 :0 0— 0 1 2 1 ) 2— 0 5— 5 10 7 9 (0 0 0 0 3 0
Pr t o i a y i f Ar b d pss Le fPr t i s o e m c An l ss o a i o i a o e n
摘 要 : 物 在 长 期 进 化 过 程 中形 成 了 自我 防 御 机 制 , 够 产 生 特 异 的 抗 性 蛋 白来 应 对 各 种 生 物 因 子 的 胁 迫 , 中 植 能 其 茉 莉 酸 信 号 途 径 是植 物必 需 的 防御 机 制 。本 研 究 对 拟 南 芥 施 用 茉 莉 酸 处 理 和 对 照 叶 片 蛋 白质 的差 异 表 达 变 化 , 试 并 图通 过 蛋 白质组 学 技 术 来 检 测 茉 莉 酸 诱 导 的 蛋 白质 , 过 蛋 白质 双 向 电 泳 发 现 有 2 个 蛋 白点 发 生 了 显 著 的 变 化 , 通 8 其 中1 9个 蛋 白点 上 调 表达 , 蛋 白点 下 调 表 达 。 选 择 l 9个 O个 差 异 蛋 白点 进 行 了质 谱 鉴 定 , 们 分 别 是 苏 氨 酸 蛋 白激 它
( ) eeteeoea pidt h td .n ti s d w d nie o rtisiv le n js o ae s n l g MS w r h rfr p l ote s y I hs t y, e ie t id sme poen n ov d i a m n t i ai , e u u f g n
华 北 农 学 报 ・2 1 2 2): — 9 0 0, 5( 3 3 5
茉 莉 酸诱 导 的拟 南芥 叶片 蛋 白质 组分 析
潘怡欧 , 琳琳 , 刘 张炬 红 , 张 静 , 安少 利 , 许 鹏 , 军 灵 , 志伟 , 景 会 靳 刘 席
( 林大学 植物科学学院 , 林 长春 吉 吉 10 6 ) 3 0 2
l dy i s c e b v r s J s n t se s n ilsg a a h y fris c ee s n p a t. e et ru d rt n i g a n e th r io e . a mo ae i se t in lp twa o n e td f n e i l n s To g ta b t n e sa d n a e
s o sv r ti si cu e e i e t ro i e p oe n k n s c lr p a th a h c r ti 0 1,n e n e tVB1 me p n ie p oen n l d d s rn -h e n n rt i i a e, h o o l s e ts o k p o en 7 - i d pe d n 2 - t in n y t ea e, d n ls c i ae s n h s c r o i n y r s a d e 1 W e we e a l o d tr n e p o ho i e s n h ts a e y o u c n t y t a e, ab n c a h d a e, n ta . r b e t e emi e a f w r 。
wh c se s n ilfrp a td fn e Oft e e p rme t , 8 p o en s o swih a e s -od c a g d e p e so r ih i se t l n ee s . h x e a o i n s 2 r ti p t t tl a t2 f l h n e x rs in wee
tedfnerso s i pat fr eA, odm ni a e c oh rs ( - E acm a i i asset m t h e s pne n l s J t —i e s nl l t p o i 2D ) co p n dwt m s pc o e y e e n M o w o er es e h r r
