埃索美拉唑杂质 -
QbD理念在药品质量控制中的应用

1QbD 的概念QbD 源于英文quality by design 的缩写[1,2]。
在美国,QbD 是cGMP 的最基本成分,是正确的、基于风险的、充分的、积极的新药开发途径[3]。
QbD 的理念是通过实验设计(DOE),找出影响质量的关键属性参数,建立设计空间(DesignSpace)[4]。
通过科学的验证,对设计空间不断进行改进,最终建立稳健的控制空间[5]。
近些年,随着人力及物料成本的不断上升[6,7],导致药品成本不断提高,药品安全事件层出不穷[8-10]。
QbD 理念的实施,对于提高中国药品的研发水平及药品的质量有很大的帮助[11-13]。
2QBD 理念的变迁过程质量的概念经历过三个阶段,QbT (质量源于检验)、QbP(质量源于生产)、QbD(质量源于设计)。
在QbT 理念时期,在药品生产过程中,人们认为产品质量的好坏是由检验决定的,但是检验仅仅是一种事后行为,并且检验抽取的仅是个别样品,并不足以代表所有样品。
而在药品研发过程中,杂质的控制更多也只是依靠检验,并没有将精力更多的投入到处方工艺的筛选及验证中。
同样,药品分析方法的验证多数是在分析方法已经开发完成后,即方法后期对其验证,此时验证,仅仅只能考察单因素对分析方法的影响,而多个因素的交互作用则完全不被考察,因此,在面对多个变量时,分析方法的稳健性不足以被保证。
在QbP 理念时期,人们意识到检验结果不能完全代表产品的好坏,唯有稳定的生产工艺才是产品质量的保证。
但是若处方在开发阶段就没有经历科学的筛选,充分的优化以及严格的验证,在药品生产过程中仍不足以应对所有变数。
不能完全保证生产出合格的产品。
而在QbD 理念阶段,人们已经意识到,产品的质量控制点应前移至产品开发阶段,在开发阶段找出影响产品质量的关键参数并且充分验证,可以保证应对未来发生的风险,在源头对产品质量进行控制。
而分析方法的开发同样如此,将控制放在方法初期,在初期就对关键质量参数进行筛选和验证,从而保证开发出稳健的分析方法。
自身对照法计算杂质量

1、自身对照现在用的很多,EP上有关物质很多都是自身对照法,自身对照法分两种:一种是加校正因子的,另一种是不加校正因子的。
通常不加校正因子包括两种情况,1》已知杂质的相对校正因子为0.8(0.9)~1.2(1.1),默认为1.0。
2》未知杂质通常也默认为1.0。
如果采用楼主所说的直接采用供试品溶液,那就是面积归一化法了。
采用这种方式进行杂质定量的也有,这个要求主成分和杂质的峰面积在很宽的范围内都成线性(正常样品浓度和杂质限度水平浓度),满足这种情况的较少,但也有。
例如我看到过埃索美拉唑镁的进口注册标准对于杂质的控制采用面积归一化法。
这个方法多用于项目初期,没有对照品的情况下以及监控反应的进行程度。
当上述情况不满足的情况下,就在很宽的范围内浓度与面积不呈线性。
这时就有了自身对照法。
这个方法的优点在于可以尽可能的提高样品浓度,提高杂质暴露的水平;稀释样品溶液至一定倍数,是主成分的浓度与样品中杂质的浓度尽可能接近,具体稀释多少视具体情况而定。
通常稀释样品溶液100倍作为对照溶液进行杂质检测。
也有例外,氢溴酸右美沙芬的稀释倍数是33.3倍。
这个方法还有个优点,特别适合于未知杂质--因为不需要杂质对照品。
但这个方法的缺点就是:运行时间长了(样品+对照溶液)。
还有另外一个缺点就是:对于不太稳定的样品来说,在稳定性期间,随着主成分的降解,杂质的增加,采用这种方式会使杂质的检测结果偏大。
等于间接提高了标准。
2、中国药典采样的方法为什么不是稀释1000倍而是稀释100倍?为什么把供试品稀释100倍作为对照溶液用,而不是用本品的法定对照品稀释100后作为对照溶液用?要知道法定的主成份对照品是不难买到的。
稀释100倍的供试液我们暂且称1%自身对照液,如果供试液中杂质峰面积不大于1%自身对照液主峰面积的0.5,就相当于供试液中杂质峰面积不大于供试液中主峰面积的0.5%.供试液的浓度很大,此时杂质含量高,峰形良好,但主成分峰可能都平顶了,面积无法计算,而1%自身对照液中主成分峰面积峰形可能都好,但是杂质含量太低,可能峰都没跑出来。
埃索美拉唑钠(镁)及其制剂的开发讲解材料

制剂开发过程及优化:详细 阐述埃索美拉唑钠(镁)制剂 的开发过程,包括处方设计 、工艺优化、质量控制等方 面的内容,以及针对制剂性 能的提升所进行的研究和改 进。
药理毒理学研究结果:介绍 埃索美拉唑钠(镁)在药理毒 理学研究方面的主要结果, 包括药效学、药代动力学、 安全性评价等方面的数据, 以证明其有效性和安全性。
含量测定
照高效液相色谱法(附录Ⅴ D)测定。
稳定性考察方案设计与实施结果
影响因素试验
将本品暴露在高温、高湿、强光条件下,观察其性状、含量等关键质量属性的变化情况。结果表明,本品在高温、高 湿条件下稳定,但在强光条件下含量有所下降,提示本品应避光保存。
加速试验
将本品在加速条件下放置3个月,考察其性状、含量等关键质量属性的变化情况。结果表明,本品在加速条件下稳定 ,符合相关要求。
埃索美拉唑钠(镁)为白色或类白色 结晶性粉末,无臭,无味。在水 中易溶,在乙醇中微溶,在丙酮 中不溶。
药理作用及机制
药理作用
埃索美拉唑钠(镁)是一种质子泵抑制 剂,通过特异性地抑制胃壁细胞 H+/K+-ATP酶来阻断胃酸分泌的最 后步骤。
机制
埃索美拉唑钠(镁)在胃内转化为活性形 式后,与胃壁细胞的H+/K+-ATP酶的 α-亚基结合,从而抑制该酶的活性,减 少胃酸的分泌。
埃索美拉唑钠(镁)及 其制剂的开发讲解材 料
• 引言 • 埃索美拉唑钠(镁)介绍 • 制剂开发流程与策略 • 原料选择与质量控制 • 处方设计与优化 • 生产工艺研究与验证 • 质量研究与稳定性考察 • 总结与展望
目录
01
引言
目的和背景
阐述埃索美拉唑钠(镁)及 其制剂的开发过程
本次讲解旨在详细介绍埃索美拉唑钠(镁)及 其制剂从研发到上市的整个过程,包括药物 设计、合成、制剂开发、药理毒理学研究、 临床试验及注册审批等环节。
注射用埃索美拉唑钠的研制及其稳定性考察

注射用埃索美拉唑钠的研制及其稳定性考察随着社会发展,环境变迁,人口结构以及人们生活方式的改变,吸烟、饮酒、情绪紧张、药物刺激等因素引起的消化性溃疡发病率逐渐增高,给患者带来极大的痛苦,且生活质量下降。
因此,消化性溃疡的治疗在临床上越来越受到关注。
基于以上原因,开发生产安全、有效的抗消化性溃疡药物已成为目前药物研究开发的重点和热点之一。
埃索美拉唑是奥美拉唑的S-异构体,是全球首个异构体质子泵抑制剂(proton pump inhibitors,PPI),通过特异性的靶向作用机制减少胃酸分泌,是壁细胞中质子泵的特异性抑制剂,埃索美拉唑较奥美拉唑具有更高的生物利用度和更好的药代动力学性质[1~2]。
埃索美拉唑为弱碱,在壁细胞泌酸微管的高酸环境浓集并转化为活性形式,从而抑制该部位的H+/K+-ATP酶(质子泵),对基础胃酸分泌和刺激的胃酸分泌均产生抑制[3~8]。
埃索美拉唑钠是埃索美拉唑的钠盐,其水溶性较好,但pH依赖性较强,且溶液状态下不太稳定,适合开发成冻干制剂。
其适用于口服不适用的急性胃或十二指肠溃疡出血的低危患者,我们以上市药品“注射用埃索美拉唑钠”为参比制剂,进行仿制研究,开发出适应大生产的处方工艺等,现将研究结果报道如下。
1 仪器与试药仪器:Agilent 1200高效液相色谱仪(美国安捷伦公司);pHS-3C型酸度计(上海雷磁仪器厂);XP204电子天平(***** TOLEDO公司);聚丙烯过滤器(0.2μm,Millipore公司);YB-2型澄明度检测仪(天津大学精密仪器厂);Lyo-5冷冻干燥机(上海东富龙科技有限公司);V20型卡尔费休水分测定仪(***** TOLEDO公司)。
试药:埃索美拉唑钠原料药(江苏正大丰海制药有限公司,批号:***-*****);依地酸二钠(湖南尔康制药有限公司,批号:***-*****);依地酸钙钠(湖南尔康制药有限公司,批号:***-*****);奥美拉唑对照品(中国食品药品检定研究院,批号:*****-*****,含量100.0%);耐信(阿斯利康制药有限公司,批号:PANG(分:***-*****);其他试剂均为市售分析纯。
各种杂质及价格-

专业承接美国、日本、法国、德国、瑞士、意大利、英国等国家参比制剂一次性进口和代购业务,提供进口〔EP、USP、LGC、BP、TLC、TRC、QCC、MC〕和国产对照品,有需要的欢迎联系我咨询哈.市振强生物技术劳先生135******** QQ3004867396各种杂质名称及英文名:依鲁替尼〔Ibrutinib〕杂质6个,palbociclib杂质6个,泰地唑胺杂质tedizolid phosphate 12个达格列净杂质Dapagliflozin 7个,索非布韦杂质sofosbuvir 20个,替卡格雷杂质Ticagrelor 14个,米拉贝隆杂质Mirabegron 10个,TAK 438杂质10个,沃替西汀杂质Vortioxetine 15个,LCZ696杂质6个非布司他杂质Febuxostat 14个泊沙康唑异构体Posaconazole 14个阿普斯特杂质Apremilast 6个阿奇霉素杂质Azithromycin 14个阿考替胺杂质Acotiamide 14个依托考昔杂质Etoricoxib 14个尼达尼布杂质Nintedanib 8个罗库溴铵杂质Rocuronium Bromide 8个恩杂鲁胺杂质Enzalutamide 4个卢帕他定杂质Rupatadine 6个瑞格非尼杂质Regorafenib 20个色瑞替尼杂质Ceritinib 11个依美斯汀杂质Emedastine8个依匹唑派杂质Brexpiprazole6个依帕司他杂质epalrestat6个乌苯美司杂质Ubenimex 19个福多司坦杂质Fudosteine 6个马来酸匹杉琼杂质Maleic acid Chinese fir, Joan 6个扎鲁司特杂质Zafirlukast 6个贝利司他杂质belinostat 6个奥扎格雷的杂质ozagrel 6个酒石酸伐尼克兰片杂质Varenicline Tartrate Tablets 6个莫扎伐普坦杂质Mozavaptan 5个沙芬酰胺杂质Safinamide 4个沃雷生杂质suvorexant 5个依替巴肽杂质Eptifibatide 5个乐伐替尼杂质lenvatinib 8个1.埃索美拉唑杂质esomeprazole impurity2.奥拉西坦杂质oxiracetam3.罗氟司特杂质roflumilast4.阿戈美拉汀杂质Agomelatine5.鲁拉西酮杂质Lurasidone6.莫西沙星杂质moxifloxacin7.阿齐沙坦杂质Azilsartan8.达比加群酯杂质Pradaxa9.利拉利汀杂质Linagliptin10.托法替尼杂质Tofacitinib11.依托考昔杂质12.阿西替尼杂质Axitinib13.维格列汀杂质Vildagliptin14.帕瑞昔布杂质parecoxib15.伊马替尼杂质imatinib16.阿哌沙班杂质Apixaban17.替诺福韦酯杂质Tenofovir Disoproxil Fumarate18.普拉格雷杂质Prasugrel19.伊拉地平杂质isradipine20.利托那韦杂质ritonavir21.培美曲塞二钠杂质pemetrexed disodium22.依达拉奉杂质Edaravone23.吉非替尼杂质gefitinib24.替吉奥杂质BCB25.苯达莫司汀杂质Cephalon26.替加环素杂质Tigecycline27.布南色林杂质Blonanserin28.文拉法辛杂质venlafaxine29.替卡格雷杂质30.利伐沙班杂质Rivaroxaban31.伊曲茶碱杂质Istradefylline32.依度沙班杂质Edoxaban33.三氟胸苷杂质Trifluorothymidine34.盐酸阿考替胺杂质acotiamide hydrochloride35.度洛西汀杂质Duloxetine36.泊沙康唑杂质37.泰地唑胺杂质38.沃替西汀杂质39.乐伐替尼杂志40.卡博替尼杂质Cabozantinib41.依鲁替尼杂质42.恩格列净杂质EMpagliflozin43.辛伐他汀杂质simvastatin44.恩杂鲁胺杂质45. 阿苯达唑Albendazole46. 阿达帕林adapalene47. 阿夫唑嗪alfuzosin48. 阿卡地新acadesine49. 阿立哌唑aripiprazole50. 阿莫曲普坦almotriptan51. 阿莫西林amoxicillin52. 阿瑞吡坦Aprepitant53. 阿昔洛韦acyclovir54. 埃罗替尼erlotinib55. 安非他酮bupropion56. 氨苄青霉素ampicillin57. 氨基葡萄糖Glucosamine58. 氨甲环酸tranexamic59. 氨溴索Ambroxol60. 胺碘酮Amiodarone61. 奥氮平olanzapine62. 奥沙利铂Oxaliplatin63. 奥司他韦oseltamivir64. 保胆键素dihydroxydibutylether65. 保特佐米Bortezomib66. 苯达莫司汀Bendamustin67. 比卡鲁胺bicalutamide68. 吡罗昔康piroxicam69. 吡嗪酰胺Pyrazinamide70. 别嘌醇allopurinol71. 波生坦bosentan72. 布洛芬Ibuprofen73. 布美他尼Bumetanide74. 雌甾四烯estratetraenol75. 醋氯芬酸aceclofenac76. 达非那新Darifenacin77. 大黄酸Diacerein78. 地尔硫卓diltiazem79. 地拉罗司deferasirox80. 氨氯地平Amlodipine81. 硝苯地平nifedipine82. 甲氨蝶呤Methotrexate83. 氨基蝶呤Aminopterin84. 丁螺环酮buspirone85. 多奈哌齐Donepezi86. 多立酮Domperidone87. 恩丹西酮ondansetron88. 恩他卡朋entacapone89. 伐昔洛韦valacyclovir90. 泛昔洛韦famciclovir91. 非布索坦Febuxostat92. 非那雄胺inasteride-ep93. 非诺贝特fenofibrate94. 弗斯特罗定fesoterodine95. 伏立康唑Voriconazole96. 氟替卡松丙酸酯fluticasone-propionate97. 氟维司群Fulvestrant98. 格列吡嗪glipizide99. 桂利嗪cinnarizine100. 环苯扎林cyclobenzaprine101. 加巴喷丁gabapentin102. 甲状旁腺激素西那卡塞Cinacalcet 103. 甲状腺素Levothyroxine104. 卡巴拉汀利凡斯的明Rivastigmine RC's 105. 喹硫平Quetiapine106. 奥美拉唑Omeprazole107. 兰索拉唑Lansoprazol108. 雷贝拉唑Rabeprazole109. 泮托拉唑pantoprazol110. 来氟米特leflunomide111. 雷洛昔芬raloxifene112. 雷莫拉宁Ramoplanin113. 雷奈佐利Linezolid114. 利伐沙班Rivaroxaban115. 利培酮Risperidal116. 罗匹尼罗ropinirole117. 阿替洛尔Atenolol118. 比索洛尔Bisoprolol119. 醋丁洛尔Acebutolol120. 美托洛尔metoprolol121. 奈必洛尔nebivolol122. 氯吡格雷Clopidogrel123. 氯雷他定Loratadine124. 霉酚酸mycophenolate125. 美洛昔康meloxicam126. 孟鲁司特montelukast127. 米氮平mirtazapine128. 尼美舒利nimesulide129. 帕罗西汀Paroxetine130. 帕立酮Paliperidone131. 生丁Dipyridamole Dipyridamole 132. 培美曲塞二钠Pemetrexed-disodium 133. 普拉克索Pramipexole134. 喹那普利Quinapril135. 卡托普利captopril136. 赖诺普利Lisinopril137. 雷米普利Ramipril138. 培哚普利Perindopril Imp139. 群多普利Trandolapril140. 伊拉普利Enalapril141. 普瑞巴林pregabalin142. 瑞格列奈Repaglinide143. 塞来西布Celecoxib144. 噻托溴铵Tiotropium bromide 145. 沙丁胺醇salbutamol146. 沙美特罗salmeterol147. 奥美沙坦Olmesartan 148. 坎地沙坦Candesartan 149. 罗沙坦Losartan150. 替米沙坦Telmisartan151. 缬沙坦Valsartan152. 加替沙星gatifloxacin153. 氟哌酸norfloxacin154. 菲宁达、氧氟沙星Ofloxacin 155. 恩诺沙星enrofloxacin 156. 环丙沙星Ciprofloxacin 157. 莫西沙星moxifloxacin158. 左氧氟沙星Levofloxacin 159. 舍曲林Sertraline160. 舒马曲坦sumatriptan 161. 双醋瑞因diacerein162. 双氯芬酸Diclofenac 163. 他达那非Tadalafil164. 阿托伐他汀atorvastatin 165. 洛伐他汀Lovastatin166. 匹伐他汀pitavastatin 167. 普伐他汀pravastatin 168. 瑞舒伐他汀Rosuvastatin 169. 辛伐他汀Simvastatin 170. 坦索罗辛Tamsulosin 171. 格列美脲glimepiride 172. 吡格列酮pioglitazone 173. 尼扎替丁nizatidine 174. 替卡西林Ticarcillin 175. 酮咯酸氨丁三醇Ketorolac 176. 酮基布洛芬Ketoprofen 177. 头孢氨苄cefalexin178. 头孢克洛cefaclor179. 头孢磺啶cefsulodin180. 托特罗定tolterodine 181. 拓扑替康topotecan182. 万古霉素vanycin183. 文拉伐辛Venlafaxine 184. 那非Sildenafil185. 西他列汀Sitagliptin186. 西酞普兰Citalopram 187. 西替利嗪cetirizine188. 伊立替康Irinotecan189. 伊马替尼imatinib190. 伊曲康唑Itraconazole191. 依泽替米贝ezetimibe192. 左乙拉西坦Levetiracetam193. 佐米曲普坦zolmitriptan194. 唑吡坦zolpidem195. 唑尼沙胺Zonisamide依鲁替尼〔Ibrutinib〕杂质6个,palbociclib杂质6个,泰地唑胺杂质tedizolid phosphate 12个达格列净杂质Dapagliflozin 7个,索非布韦杂质sofosbuvir 20个,替卡格雷杂质Ticagrelor 14个,米拉贝隆杂质Mirabegron 10个,TAK 438杂质10个,沃替西汀杂质Vortioxetine 15个,LCZ696杂质6个非布司他杂质Febuxostat 14个泊沙康唑异构体Posaconazole 14个阿普斯特杂质Apremilast 6个阿奇霉素杂质Azithromycin 14个阿考替胺杂质Acotiamide 14个依托考昔杂质Etoricoxib 14个尼达尼布杂质Nintedanib 8个罗库溴铵杂质Rocuronium Bromide 8个恩杂鲁胺杂质Enzalutamide 4个卢帕他定杂质Rupatadine 6个瑞格非尼杂质Regorafenib 20个色瑞替尼杂质Ceritinib 11个依美斯汀杂质Emedastine8个依匹唑派杂质Brexpiprazole6个依帕司他杂质epalrestat6个乌苯美司杂质Ubenimex 19个福多司坦杂质Fudosteine 6个马来酸匹杉琼杂质Maleic acid Chinese fir, Joan 6个扎鲁司特杂质Zafirlukast 6个贝利司他杂质belinostat 6个奥扎格雷的杂质ozagrel 6个酒石酸伐尼克兰片杂质Varenicline Tartrate Tablets 6个莫扎伐普坦杂质Mozavaptan 5个沙芬酰胺杂质Safinamide 4个沃雷生杂质suvorexant 5个依替巴肽杂质Eptifibatide 5个乐伐替尼杂质lenvatinib 8个。
埃索美拉唑钠CTD申报资料

CD E
2
埃索美拉唑钠 CTD 申报资料
3.2.S.2.2 生产工艺和过程控制 3.2.S.2.2.1 化学反应式:
CD E
3
埃索美拉唑钠 CTD 申报资料
3.2.S.2.2.2 工艺流程图:
优菲拉唑 避光 氮气保护 H2O
甲苯 (2R,3R)-1,1,4,4,四苯基丁四醇 钛酸四异丙酯
CO2
pH=7.3-7.8
CD E
1
埃索美拉唑钠 CTD 申报资料
3.2.S.2 生产信息 3.2.S.2.1 生产商 生产商名称:连云港润众制药有限公司 注 册 地址:连云港经济技术开发区大浦工业区金桥路 16 号 邮 电 传 编:222069 话:0518-86075959 真:0518-86075958
生产 地 址:连云港经济技术开发区大浦工业区金桥路 16 号 邮 电 传 编:222069 话:0518-86075959 真:0518-86075958
4
埃索美拉唑钠 CTD 申报资料
物料 甲苯 优菲拉唑 (2R,3R)-1,1,4,4-四苯基丁四醇 钛酸四异丙酯 N,N-二异丙基乙胺 异丙苯基过氧化氢 甲醇钾
分子量 329.4 426.5 284.2 129.2 152.2 70.1
投料量(Kg) 摩尔量 5.2 1.5 Y Z 0.044 X 0.383 4.55mol ymol zmol 0.34mol xmol 5.46mol
埃索美拉 唑 N,N-二异 丙基乙胺 乙醇 氢氧化钠 异丙苯基 过氧化氢 HPLC监测 甲醇钾/ 甲醇 埃索美拉 唑钾盐 甲醇
活性炭
过滤
浓缩 乙酸乙酯
CD E
合ቤተ መጻሕፍቲ ባይዱ埃索 美拉唑钾 盐
nexium胃药说明书_美国胃药nexium的用法

nexium胃药说明书_美国胃药nexium的用法NEXIUM胃药(埃索美拉唑)它是一种抑酸保护胃粘膜的药物。
下面是小编整理的nexium胃药说明书,欢迎阅读。
nexium胃药说明书详细内容(欢迎点击) ◆nexium胃药的说明书◆nexium胃药一天吃几粒◆快速缓解胃痛的方法nexium胃药商品介绍【药品名称】埃索美拉唑镁肠溶片【商品名】耐信【英文商品名】Nexium【英文或拉丁名】Esomeprazole Magnesium Enteric-coated Tablets【汉语拼音】Aisuomeilazuomei Changrongpian【主要成分】埃索美拉唑镁【化学名】双-S-5-甲氧基-2-{ (4-甲氧基-3,5-二甲基-2-吡啶基)甲基亚磺酰基}-1H-苯并咪唑镁三水合物【结构式及分子式、分子量】分子式:C34H36MgN6O6S23H2O 分子量:767.15【nexium胃药价格】285.00nexium胃药的说明书【药理毒理】药效学特性埃索美拉唑是奥美拉唑的S-异构体,通过特异性的靶向作用机制减少胃酸分泌,为壁细胞中质子泵的特异性抑制剂。
奥美拉唑的R-异构体和S-异构体具有相似的药效学特性。
作用部位和机理埃索美拉唑为一弱碱,在壁细胞泌酸微管的高酸环境中浓集并转化为活性形式,从而抑制该部位的H+/K+-ATP酶(质子泵),对基础胃酸分泌和刺激的胃酸分泌均产生抑制。
对胃酸分泌的影响口服埃索美拉唑20mg和40mg后,在一小时内起效。
重复给以20mg每天一次连续5天,在第5天服药后6~7小时测量,五肽胃泌素刺激引起的平均高峰泌酸量降低90%。
症状性GERD患者每天口服埃索美拉唑20mg和40mg,5天后24小时胃内pH4的时间平均值分别为13小时和17小时。
维持胃内pH4的时间至少8小时、12小时和16小时的患者比例在埃索美拉唑20mg时分别为76%、54%和24%;在40mg时分别为97%、92%和56%。
注射用埃索美拉唑钠-分析方法
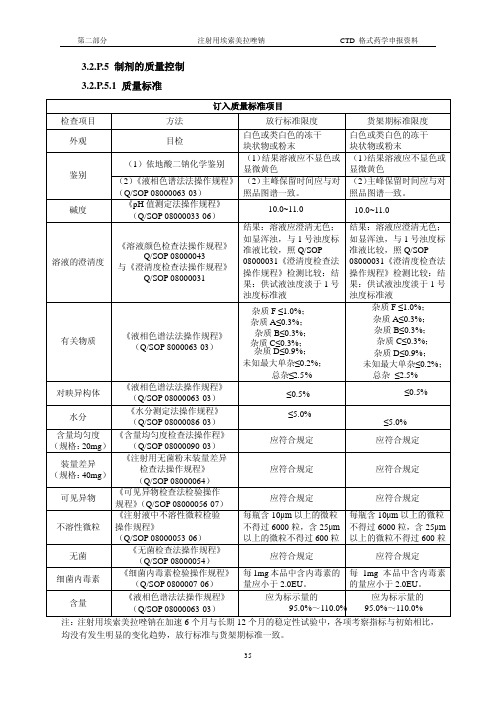
3.2.P.5 制剂的质量控制3.2.P.5.1 质量标准均没有发生明显的变化趋势,放行标准与货架期标准一致。
3.2.P.5.2 分析方法(1)订入标准的分析方法1 性状目检:本品为白色或类白色的冻干块状物或粉末。
2 鉴别2.1. 试药与试剂:硫酸镍、氨试液、丁二酮肟、乙醇、乙二胺四醋酸二钠2.2. 仪器与设备:电子分析天平(万分之一)、高效液相色谱仪。
2.3. 操作方法:a). 依地酸二钠的鉴别:取供试品1瓶,加水5ml使溶解,作为供试品溶液。
取0.008%硫酸镍溶液1ml,加供试品溶液0.5ml,摇匀,加1mol/L氨试液1ml,摇匀,加1%丁二酮肟乙醇溶液1ml,摇匀,放置1分钟,结果溶液应不显色或显微黄色。
另取0.03%乙二胺四醋酸二钠溶液与水各0.5 ml(0.5ml),分别作为阳性对照溶液和空白溶液,同法操作,结果空白溶液应显粉红色。
b). HPLC保留时间法:在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间与对照品溶液主峰的保留时间一致。
3 碱度3.1. 试剂与试液:硼砂标准缓冲液、氢氧化钙标准缓冲液。
3.2. 仪器与用具:旋光仪、电子分析天平、容量瓶。
3.3. 操作方法:取供试品1瓶,加0.9%氯化钠注射液5.2 ml使溶解,照Q/SOP 08000033《pH值测定法操作规程》检测,即得。
3.4. 限度:pH值应为10.0~11.0。
4 溶液的澄清度4.1. 操作方法取可见异物项下的供试品溶液,照Q/SOP 08000043《溶液颜色检查法操作规程》与Q/SOP 08000031《澄清度检查法操作规程》检测。
结果:溶液应澄清无色;如显浑浊,与1号浊度标准液比较,照Q/SOP 08000031《澄清度检查法操作规程》检测比较。
结果:供试液浊度淡于1号浊度标准液5 有关物质5.1. 试剂与试液:乙腈、磷酸氢二钠、氢氧化钠、磷酸。
5.2. 仪器与用具:电子分析天平、移液管、容量瓶、十八烷基硅烷键合硅胶柱、高效液相色谱仪。
埃索美拉唑钠(镁)及其制剂的开发

CH3O H3C N . CH3 CH2Cl H3CO
+
H3CO NH N SH
N N H
N S H3C CH3 OCH3
HCl
O S H3C
H3CO
N N H
N CH3 OCH3
H3CO
N N Na
O S H3 C
N CH3 OCH3
(3)、肠溶片的制剂技术,通过制成一定粒度的肠溶微丸后压片,并确保微
研究、处方工艺的研究,完成了中试放大工作,产品质量指标美国药
典及进口药品的标准。 2、正在进行稳定性的考察,至目前在为止,产品质量稳定。 3、已完成埃索美拉唑镁肠溶片小试处方工艺的研究,近期将进行中 试放大工作。样品的质量指标达到美国药典的要求及进口品的质量水 平。
8、项目研发费用(总费用1400万元)
3、研发内容、技术关键及主要创新点--主要创新 点
(1)、通过公司拥有自主知识产权的发明专利技术,以2-巯基1H-苯并
咪唑与2-氯甲基吡啶盐酸盐为起始原料,进行缩合反应生产高质量的
埃索美拉唑中间体硫醚。 (2)、采用不对称氧化技术并优化工艺参数得到纯度较高的埃索美拉
唑,特别是在不对称氧化后的后处理工序有创新。
4、相关的软件、专利权、非专利技术无形资产摊销费用 10万
8、项目经费概算
经费保障: 项目预算总投资1400万元。 企业每年提取销售收入的3%以上用于研发。企业2009 年实现销售收入4.46亿元,2010年实现销售收入5.56 亿元,2011年实现销售收入6.01亿元,呈上升趋势, 因此,企业自筹部分不存在问题。
1、立 项 背 景 和 意 义
公司现有主打产品金奥康(奥美拉唑肠溶微 丸胶囊,2011年销售收入达1.65亿元,是浙江省 名牌产品)。 埃索美拉唑作为公司后续梯队品种,在研发 上可部分利用奥美拉唑现有的具有知识产权的先 进技术,具有很强的开发价值。 通过本课题的实施有助于进一步提高公司的 产品优势及品种结构提升,达到可持续性发展的 目标。
注射用埃索美拉唑钠

注射用埃索美拉唑钠(耐信)Esomeprazole Sodium for Injection(Nexium)本品为埃索美拉唑钠的无菌冻干品。
含埃索美拉唑钠以埃索美拉唑(C17H19N3O3S)计算,应为标示量的97.0%~109.0%。
【性状】本品为白色或类白色的冻干块状物或粉末。
【鉴别】(1)取本品1瓶,加水5ml使溶解,作为供试品溶液。
取0.008%硫酸镍溶液1ml,加供试品溶液0.5ml,摇匀,加1mol/L 氨溶液1ml,摇匀,加1%丁二酮肟的乙醇溶液1ml,摇匀,放置1分钟,溶液应不显色或显微黄色。
另取0.03%乙二胺四醋酸二钠溶液与水各0.5ml,分别作为阳性对照溶液和空白溶液,同法操作。
阳性对照溶液应不显色或显微黄色,空白溶液应显粉红色。
(2)取奥美拉唑对照品10mg,精密称定,置100ml量瓶中,加磷酸盐缓冲液(pH11.4)(取磷酸钠6.8g和二水合磷酸氢二钠6.2g,加水适量使溶解并稀释至1000ml,摇匀,pH值应为11.3~11.6)15ml 使溶解,加水稀释至刻度,摇匀,精密量取5ml,置25ml量瓶中,加磷酸盐缓冲液(pH11)(取磷酸盐缓冲液(pH11.4)10ml,加水稀释至100ml)稀释至刻度,摇匀,作为对照品溶液;另取本品,加磷酸盐缓冲液(pH11)溶解并定量稀释制成每1ml中约含埃索美拉唑0.01mg的溶液,作为供试品溶液。
照高效液相色谱法(中国药典2005年版二部附录ⅤD)测定,采用手性色谱柱,以α1-酸性糖蛋白(α1-acidglycoprotein)键合硅胶为填充剂,以乙腈-磷酸盐缓冲液(pH6.2)(取磷酸二氢钠2.4g和二水合磷酸氢二钠0.45g,加水适量使溶解并稀释至1000ml,摇匀,pH值应为6.1~6.3)(75∶425)为流动相,检测波长为280nm。
精密量取对照品溶液与供试品溶液各20μl,分别注入液相色谱仪,记录色谱图,对照品溶液中第二个被洗脱峰为埃索美拉唑峰,保留时间约为4分钟,奥美拉唑两个对映体峰的分离度应符合要求。
注射用埃索美拉唑钠-分析方法

3.2.P.5 制剂的质量控制3.2.P.5.1 质量标准均没有发生明显的变化趋势,放行标准与货架期标准一致。
3.2.P.5.2 分析方法(1)订入标准的分析方法1 性状目检:本品为白色或类白色的冻干块状物或粉末。
2 鉴别2.1. 试药与试剂:硫酸镍、氨试液、丁二酮肟、乙醇、乙二胺四醋酸二钠2.2. 仪器与设备:电子分析天平(万分之一)、高效液相色谱仪。
2.3. 操作方法:a). 依地酸二钠的鉴别:取供试品1瓶,加水5ml使溶解,作为供试品溶液。
取0.008%硫酸镍溶液1ml,加供试品溶液0.5ml,摇匀,加1mol/L氨试液1ml,摇匀,加1%丁二酮肟乙醇溶液1ml,摇匀,放置1分钟,结果溶液应不显色或显微黄色。
另取0.03%乙二胺四醋酸二钠溶液与水各0.5 ml(0.5ml),分别作为阳性对照溶液和空白溶液,同法操作,结果空白溶液应显粉红色。
b). HPLC保留时间法:在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间与对照品溶液主峰的保留时间一致。
3 碱度3.1. 试剂与试液:硼砂标准缓冲液、氢氧化钙标准缓冲液。
3.2. 仪器与用具:旋光仪、电子分析天平、容量瓶。
3.3. 操作方法:取供试品1瓶,加0.9%氯化钠注射液5.2 ml使溶解,照Q/SOP 08000033《pH值测定法操作规程》检测,即得。
3.4. 限度:pH值应为10.0~11.0。
4 溶液的澄清度4.1. 操作方法取可见异物项下的供试品溶液,照Q/SOP 08000043《溶液颜色检查法操作规程》与Q/SOP 08000031《澄清度检查法操作规程》检测。
结果:溶液应澄清无色;如显浑浊,与1号浊度标准液比较,照Q/SOP 08000031《澄清度检查法操作规程》检测比较。
结果:供试液浊度淡于1号浊度标准液5 有关物质5.1. 试剂与试液:乙腈、磷酸氢二钠、氢氧化钠、磷酸。
5.2. 仪器与用具:电子分析天平、移液管、容量瓶、十八烷基硅烷键合硅胶柱、高效液相色谱仪。
埃索美拉唑说明书

商品名称:耐信通用名称:艾司奥美拉唑镁肠溶片英文名称:EsomeprazoleMagnesiumEnteric-coated 汉语拼音:AisuomeilazuomeiChangrongPian成份: 本品主要成分为埃索美拉唑镁功能主治(适应症): 胃食管反流性疾病(GERD)-糜烂性反流性食管炎的治疗.-已经治愈的食管炎患者防止复发的长期维持治疗.胃食管反流性疾病(GERD)的症状控制.与适当的抗菌疗法联合用药根除幽门螺杆菌,并且-愈合与幽门螺杆感染相关的十二指肠溃疡-防止与幽门螺杆菌相关的消化性溃疡复发。
用法用量: 药片应和液体一起整片吞服,而不应当咀嚼或压碎。
胃食管反流性疾病(GERD)-糜烂性反流性食管炎的治疗.40mg每日一次,连服四周。
对于食管炎未治愈或持续有症状的患者建议再服药治疗四周。
-已经治愈的食管炎患者防止复发的长期维持治疗.20mg每日一次。
胃食管反流性疾病(GERD)的症状控制没有食管炎的患者20mg每日一次,如果用药4周症状未获控制,应对患者作进一步的检查,一旦症状消除,随后的症状控制可采用即时疗法,即需要时口服20mg,每日一次。
与适当的抗菌疗法联合用药根除幽门螺杆菌,并且-愈合与幽门螺杆菌相关的十二指肠溃疡-预防与幽门螺杆菌相关的消化性溃疡复发埃索美拉唑镁肠溶片20mg+阿莫西林1g+克拉霉素500mg,每日二次,共7天。
不良反应: 在埃索美拉唑的临床试验中已确定或怀疑有下列不良反应,这些反应均没有剂量相关性。
常见反应:头痛、腹痛、腹泻、腹胀、恶心/呕吐、便秘。
少见反应:皮炎、瘙痒、荨麻疹、头昏、口干。
禁忌: 已知对埃索美拉唑,其它苯并咪唑类化合物或本品的任何其他成份过敏者。
注意事项: 当出现任何报警症状(如显著的非有意的体重下降,反复的呕吐,吞咽困难,吐血或黑便),怀疑有胃溃疡或已患有胃溃疡时,应排除恶性肿瘤,因为使用埃索美拉唑溶片治疗可减轻症状,延误诊断。
长期使用该药治疗的患者(特别是使用1年以上者)应定期进行监测。
埃索美拉唑镁肠溶片-耐信说明书

【通用名称】埃索美拉唑镁肠溶片【商品名称】耐信 Nexium【英文名称】Esomeprazole Magnesium Enteric-coated Tablets【成份】本品活性成份及其化学名称、化学结构式、分子式、分子量为:活性成份:埃索美拉唑镁化学名称为:双-S-5-甲氧基-2-{[(4-甲氧基-3,5-二甲基-2-吡啶基)甲基]亚磺酰基}-1H -苯并咪唑镁三水合物化学结构式:分子式: C34H36MgN6O6S2·3H2O分子量:767.15主要成份相关链接:埃索美拉唑镁【性状】本药为肠溶片剂。
20 mg为浅粉红色,40 mg为粉红色,均为长椭圆双凸形。
赋形剂:单硬脂酸甘油酯40-55,羟丙纤维素,羟丙甲纤维素,氧化铁(红棕色,黄色)(E172),硬脂酸镁,甲基丙烯酸及丙烯酸乙酯共聚物(1:1),30%分散剂。
微晶纤维素,人工石蜡,聚乙二醇,聚山梨酯80,交聚维酮,硬脂酰富马酸钠,糖球(蔗糖和黄色淀粉),滑石粉,二氧化钛(E171),枸橼酸三乙酯。
【适应症】胃食管反流性疾病(GERD)-糜烂性反流性食管炎的治疗-已经治愈的食管炎患者防止复发的长期维持治疗-胃食管反流性疾病(GERD)的症状控制与适当的抗菌疗法联合用药根除幽门螺杆菌,并且-愈合与幽门螺杆菌感染相关的十二指肠溃疡-防止与幽门螺杆菌相关的消化性溃疡复发【规格】按C17H19N3O3S计(1)20mg(2)40mg【用法用量】药片应和液体一起整片吞服,而不应当咀嚼或压碎。
对于存在吞咽困难的患者,可将片剂溶于半杯不含碳酸盐的水中(不应使用其他液体,因肠溶包衣可能被溶解),搅拌,直至片剂完全崩解,立即或在30分钟内服用,再加入半杯水漂洗后饮用。
微丸决不应被嚼碎或压破。
对于不能吞咽的患者,可将片剂溶于不含碳酸盐的水中,并通过胃管给药。
重要的是应仔细检查选择的注射器和胃管的合适程度。
准备工作及使用指导如下:通过胃管给药:1. 将片剂放入合适的注射器,并加入约25 mL水及5 mL空气。
埃索美拉唑钠有关物质中奥美拉唑磺酰化物的HPLC定位分析

的含 量 进 行 控 制 。 目前 奥 美 拉 唑磺 酰 化 物 的含 量 测 定方 法 通 常 采 用 准 确 可 靠 、灵 敏度 高 、专 属 性 强 的
约 l ,精 密 称 定 ,置 于 1 rL 量瓶 中 ,用 流动 相 mg O 容 a 溶 解至 刻度 ,摇 匀 ,即得对 照 品溶 液 。
中国抗 生素杂志2 1年 1 月第3 卷 第1 期 02 0 7 0
73 7
文 章 编 号 : 10 .6 92 1 )00 7 3 0 18 8 (0 21—7 30
埃索美 拉唑钠 有关物质 中奥 美拉唑磺 酰化物 的HP C定位 分析 L
余敏 肖- ) X l 余 能: 黎鹏z 侯 胜宏 z 叶祥2 黎 翩3 黄静 - I -
的测 定 ,特别 需要 对 其主 要 杂质 奥美 拉 唑磺酰 化物 [ 】
供试 品溶 液 。
1 . 对 照 品溶液 制备 .2 2 取 奥美 拉 唑( 索 美 拉 唑钠 化 学结 构 与 奥美 拉 唑 埃 相 似 ,在 反相 色 谱 柱 上 的色 谱 行 为相 同 ;故 通 常 采
埃 索美 拉 唑(. 5 甲氧 基一-S一 (一 2()[ 4 甲氧 基一,一 甲 ( 35二
基 一一 啶 基) 2吡 甲基) 亚磺 酰 基]1 苯 并咪 唑) 奥美 拉 一H一 是
抑 制 胃壁 细胞 质 子泵 减 少 胃酸 分 泌 的 异 构 体质 子 泵
抑制 剂 。对 胃食管 反 流性 疾病( R c1 已经 治 愈 GE D)~、 2
b h t e o d t n . n l so T e ma n if e cn a t rf rt e eu to i e i so s me r z l s du y t e o h r c n i o s Co c u i n i h i l n i g f co o h l o r p c s re fe o p a o e o i m n u
注射用埃索美拉唑钠CTD汇总表

E 详细信息参见申报资料 3.2.P.2.1.1(P4)。
2.3.P.2.1.2 辅料
CD 参照 FDA 官方网站原研厂家阿斯利康公司的耐信粉针(NEXIUM.I.V®)说明书[1]:
耐信粉针含埃索美拉唑钠 21.3mg 或 42.5mg,相当于埃索美拉唑 20mg 或 40mg,依地酸
参数
---
预冻: -35℃ 升华温度:0℃ 预抽真空:20Pa 真空度: 15.0±5.0Pa 解析干燥:30℃
轧盖器
---
预冻: -35℃ 升华温度:0℃ 预抽真空:0.40 mbar 真空度:0.150±0.050mbar 解析干燥:30℃
口服液瓶灌轧机 ZG300C 臭氧灭菌柜 LG-CD200 型
主要变化 及原因
中试及大生产灌 装时增加 4%装 量以抵消复溶时 的损失,即每瓶 20.8mg(以埃索
美拉唑计)
支持依据
以原研产 品为对照, 进行各项 质量特性 的比较结 果一致。
小试处方 批量 100 瓶
中试处方 批量 600 瓶
大生产处方 批量 8000 瓶
主要变化及原因 支持依据
以原研产
埃索美拉唑钠 42.5mg
室温 4 月 白色块状物 无色澄明液体 10.8 2.9 100.9 未检出 0.16 未检出 未检出 0.01 0.13 0.06 0.37 MF 2144
加速 3 月 白色块状物 无色澄明液体 10.8 3.1 --- 未检出 0.37 未检出 未检出 0.02 0.41 0.12 0.92
室温 6 月 白色块状物 无色澄明液体 10.7 --- 102.5 未检出 0.16 未检出 未检出 0.02 0.12 0.06 0.36
奥美拉唑杂质列表-杂质对照品

奥美拉唑杂质列表-杂质对照品
序号杂质名称或编号英文名CAS
1奥美拉唑杂质A Omeprazole Impurity A
2奥美拉唑杂质B Omeprazole Impurity B
3奥美拉唑杂质C Omeprazole Impurity C
4奥美拉唑杂质D Omeprazole Impurity D
5奥美拉唑杂质E Omeprazole Impurity E
6奥美拉唑杂质F Omeprazole Impurity F
7奥美拉唑杂质G Omeprazole
Impurity G
奥美拉唑杂质列表-杂质对照品
结构式及CAS
8奥美拉唑杂质H Omeprazole Impurity H
9奥美拉唑杂质I Omeprazole Impurity I
相关杂质1、阿考替胺杂质 2、维格列汀杂质 3、厄洛替尼杂质 4、利伐沙班杂质 5、索拉非尼杂质 6、阿伐那非杂质 7、替卡格雷杂质 8、阿哌沙班杂质 9、米格列奈杂质 10、普拉克索杂质 11、氨氯地平杂质12、非不司他杂质 13、托法替尼杂质 14、达比加群酯杂质 15、埃索美拉唑钠杂质 16、盐酸氨溴索杂质 17、卡格列净杂质 18 索菲布韦杂质 19、依托考昔杂质
及代理其他品牌杂质标准品(EP、USP、LGC、TRC、TLC、MC、SINCO)等。
联系电话:*************转603
深圳菲斯—专注标准品。
杂质限度的自身对照法和外标法

杂质限度的自身对照法和外标法自身对照现在用的很多,EP上有关物质很多都是自身对照法,自身对照法分两种:一种是加校正因子的,另一种是不加校正因子的。
通常不加校正因子包括两种情况,1已知杂质的相对校正因子为0.8(0.9)到1.2(1.1),默认为1.0.2未知杂质通常也默认为1.0。
如果采用楼主所说的直接采用供试品溶液,那就是面积归--化法了。
采用这种。
方式进行杂质定量的也有,这个要求主成分和杂质的峰面积在很宽的范围内都成线性(正常样品浓度和杂质限度水平浓度),满足这种情况的较少,但也有。
例如我看到过埃索美拉唑镁的进口注册标准对于杂质的控制采用面积归--化法。
这个方法多用于项目初期,没有对照品的情况下以及监控反应的进行程度。
当上述情况不满足的情况下,就在很宽的范围内浓度与面积不呈线性。
这时就有了自身对照法。
这个方法的优点在于可以尽可能的提高样品浓度,提高杂质暴露的水平;稀释样品溶液至一定倍数,是主成分的浓度与样品中杂质的浓度尽可能接近,具体稀释多少视具体情况而定。
通常稀释样品溶液100倍作为对照溶液进行杂质检测。
也有例外,氢溴酸右美沙芬的稀释倍数是33.3倍。
这个方法还有个优点,特别适合于未知杂质-因为不需要杂质对照品。
但这个方法的缺点就是:运行时间长了(样品+对照溶液)。
还有另外一个缺点就是:对于不太稳定的样品来说,在稳定性期间,随着主成分的降解,杂质的增加,采用这种方式会使杂质的检测结果偏大。
等于间接提高了标准。
