第六章 元素化学与无机材料
高等无机化学第六章 稀土元素

2.卤化物 半水氟化物可通过氢氟酸溶液与热镧系硝酸盐溶液反应制 得。在真空中加热半水氟化物到300 ℃或在HF气氛中加热到 600 ℃脱水可制得无水LnF3. 氟化物是唯一不溶于水的镧系卤化物。其熔点很高、不吸 湿、很稳定。 从水中结晶析出的氯化物均含结晶水,对其加热得到的不 是无水物,是LnOCl。获取无水氯化物的方法有: (1)在HCl气流中加热水合氯化物,如6.7KPa,400 ℃, 36h。 (2)加热过量NH4Cl与氧化物(或水合氯化物)的混合物 Ln2O3 + 6NH4Cl
6.2.4 镧系元素氧化态
镧系元素失去6s2和5d1或失去6s2或一个4f电子,而表现 为常见的稳定氧化态+3。由于4f的全空、半充满和全充满,
有些元素又有+2和+4。
Ln4+:Ce4+(4f0),Tb4+(4f7); Ln2+:Eu2+(4f7),Yb2+(4f14) Eu2+在水中可稳定存在,是最稳定的离子。 Ce4+是很好的氧化还原氧化还原剂,可在水中长时间稳(动
力学因素)。
Ln3+颜色:
La3+(4f0)、Lu3+(4f14)具有封闭电子构型,在可见区、紫外区均 无吸收;Ce3+(4f1)、Eu3+(4f6)、Gd3+(4f7) 、Tb3+(4f8)吸收带全部 或绝大部分在紫外区,Yb3+(4f13)的吸收带出现在近红外区。它 们的4f轨道为全空、半空、全充满、半充满、或接近全空、全充
300℃
2LnCl3 + 3H2O + 6NH3↑
无水氯化物熔点较高(600~800 ℃)很易吸湿。
用Ca还原SmF3、EuF3、YbF3可得其二氟化物。制备其 它镧系元素的二氟化物,只能在CaF2 or SrF2 orBaF2中, 用 Ca还原LnF3制取。 制备其它二卤化物的一般方法有: (1)稀土金属还原相应的三卤化物 2TmI3 + Tm 3TmI3 (2)在水溶液中以Zn-Hg齐还原Eu3+到Eu2+。 (3)用H2还原三卤化物 2SmCl3 + 1/2H2 SmCl2 + HCl 700℃ (4)加热分解无水三卤化物 2SmI3 2SmI2 + l2(g) (5)在液氨中,金属Sm、Eu、Yb与NH3反应
第6章-元素化学与无机材料-2010-bian

➢ 周期系各族元素最高价态的氧化物及其水合物: 从左到右(同周期):酸性增强,碱性减弱 自上而下(同族):酸性减弱,碱性增强 ➢ 同一元素形成不同价态的氧化物及其水合物 高价态的酸性比低价的态强;低价态的碱性比高价 的态强。
主族元素最高价态氧化物的水合物的酸碱性
-
离子极化作用示意图
离子极化的结果,使正、负离子之间发生了额外 的吸引力,甚至有可能使两个离子的轨道或电子 云产生变形而导致轨道的相互重叠,趋向于生成 极性较小的键(如下图),即离子键向共价键转 变。因而,极性键可以看成是离子键向共价键过 渡的一种形式。
离子键向共价键转变的示意图
影响离子极化作用的重要因素
三、氧化物的熔点、沸点和硬度
➢ 金属性强的元素的氧化物是离子型化合物,如 Na2O、MgO,熔点、沸点大都较高。且高于相应氯 化物的。
➢ 大多数非金属氧化物是共价化合物,如CO2、 N2O5,固态时是分子晶体,熔点、沸点低;SiO2则 是原子晶体,熔点高,硬度大。
➢ 金属性弱的元素的氧化物属过渡型晶体:其中 低价偏向离子晶体或原子晶体,如Cr2O3、 Fe2O3、
❖ 离子变形性(离子可以被极化的程度)
离子变形性大小与离子的结构有关,主要取决于:
➢ 离子的电荷: 随正电荷的减少或负电荷的增加, 变形性增大。 Si4+<Al3+<Mg2+<Na+<F-<O2-
➢ 离子的半径: 随半径的增大,变形性增大。 F-<Cl-<Br-<I-; O2-<S2-
➢ 离子的外层电子构型: 18、9~17等电子构型的离 子变形性较大,具有稀有气体外层电子构型的离 子变形性小。K+<Ag+ ; Ca2+<Hg2+
普通化学课件

6.5.1 配位化合物的组成
1. 配合物的定义 含有中心原子或离子(M)并被若干配位体(L)
配位而形成的化合物(MLn),称为配合物。M 与L结合的方式是:M提供空轨道,L提供孤对电 子与M共享,形成配位键—— L→M
27
6.5.1 配位化合物的组成
中心离子(或原子) 在配合物形成时,中心离子(或原子)有空的
24
6.5 配位化合物 教学大纲
了解配合物的组成、分类,掌握配位数、中
心离子电荷数、配离子电荷数及它们之间的 关系和配合物的命名规则。
理解用杂化轨道理论处理配合物的空间构型。 了解配合物的应用。
25
6.5 配位化合物 6.5.1 配位化合物的组成 6.5.2 配位化合物的命名 6.5.3 配位化合物的空间构型 6.5.4 配离子的解离平衡
能提供多齿配体的配位剂称为螯合剂。
31
多齿配体:
乙二胺(en)
H2
N
CH2
CH2
N
H2
乙二胺四乙酸根 EDTA(Y4-)
O• •OC
H 2C N
•• ••
CH 2
CH 2
CH 2 N
O OC
••
H 2C
CH 2
COO•• 4–
CO O
••
32
6.5.1 配位化合物的组成
中心离子的配位数:配位原子数目。 配位体数:配位体(配体)的数目。
18
6.4.2 氧化物及其水合物的酸碱性 • 2. 酸碱性规律的解释(离子键理论) R(OH)x型化合物可按下列两种方式解离:
若Rx+的正电荷少,半径较大,则Rx+吸引O2-排 斥H+的能力小,发生碱式解离,呈碱性。
第6章元素化学与无机材料.
2.金属的钝化 由于金属在空气中氧化生成的氧化膜具有 较显著的保护作用。
容易产生钝化作用的有铝,铁,铬,镍,钛及其合金
应用:用铁制的容器贮运浓HNO3和浓H2SO4 如果在钢中加入铬、铝和硅等,由于生成的 氧化膜,有效的减慢了钢的氧化。
(2)较不活泼的非金属单质用作还原剂 碳常用于炼铁 3Si+18HF+4HNO3=3H2[SiF6]+4NO(g)+8H2O Si+2NaOH+H2O=Na2SiO3+2H2(g) 一般不与稀酸作用,但可以与氧化性酸反应 S+2HNO3(浓)=H2SO4+2NO(g) C+2H2SO4(浓)=CO2(g)+2SO2(g)+2H2O
p区和和第4周期d区金属及锌的虽也为 负值,但比s区的要大,所以只能溶于酸
第5、6周期d区和ds区金属及铜的>0,所 以不能溶于非氧化性酸
不活泼金属可溶于王水。 3Pt+4HNO3+18HCl=3H2[PtCl6]+4NO(g)+3H2O
Au+HNO3+4HCl=H[AuCl4]+NO(g)+2H2O 铌,钽,钌,铑,锇,铱可溶于浓的HF和HNO3中 此外,铝镓锡铅铬锌还能溶于碱溶液。
σ3s* 3s
σ3s
当有1mol Na时,由此组合的相应分子轨道就有 1mol,这些分子轨道之间的能级相差小,几乎连 成一片,形成了具有一定上限和下限的能带。
这1mol 分子轨道可以容纳2mol 的电子,但实际 上只有1mol 的电子在成键轨道,而另一半是空 的,此时3s能带是未满的,称未满带。
普通化学第6章

金属键和固体能带理论
1mol钠原子的3s轨道能带
固体根据能带理论的分类
能带理论可以用来 说明金属的一些物理 性质:如金属光泽、 导热性、延展性,绝 缘体的绝缘性和半导 体的导电性等;
导体、半导体和绝缘体的能带示意图
§ 6. 2 单质的化学性质
6.2.1 金属单质的还原性 一、各区金属单质的活泼性及其递变情况 金属与氧的作用 金属的溶解 二、金属的钝化 6.2.2 非金属单质的氧化还原性 一、强氧化性 二、还原性 三、歧化反应 四、惰性
当子弹或弹片打到这种新型防弹衣上时,里面的液体会在子弹(或弹片)压 力作用下瞬间转化为一种硬度极高的物质。当外部压力消失后,这种高硬 度物质又恢复到液体状态。传统的防弹衣对这些非常重要的部位无法形成 有效保护。而新一代液体防弹衣则可以保护军人的任何部位,无论人的身 体如何弯曲防弹衣的防护性能都不会受损。
一些基本概念
以Li 为例,1s2 2s1 2p0 1s 轨道充满电子,故组成的能带充满电子,称为满带 2s 轨道电子半充满,组成的能带电子也半满,称为导带 2p 能带中无电子,称为空带 从满带顶到导带底 ( 或空带底 )的能量间隔很大,电子 跃迁困难,这个能量间隔称为禁带
金属锂的能带结构
半导体材料
本征半导体 非本征半导体
超导材料
三、光导纤维
本征半导体(Intrinsic semiconductors )
完全不含杂质且无晶格缺陷的纯净半导体称为本征 半导体。 实际半导体不能绝对地纯净,本征半导体一般是指 导电主要由材料的本征激发决定的纯净半导体。更 通俗地讲,完全纯净的半导体称为本征半导体或I型 半导体。硅和锗都是四价元素,其原子核最外层有 四个价电子。它们都是由同一种原子构成的“单晶 体”,属于本征半导体。
《普通化学》课程学习指南

《普通化学》课程学习指南根据知识模块顺序,教学要求如下一、理论课学习指南第一章热化学与能源基本要求知识点:热力学第一定律,热效应,反应焓变,盖斯定律。
学习目标:了解用弹式热量计测量等容热效应(Qv)的原理,熟悉Qp的实验计算法,了解状态函数的意义,了解化学反应中的焓变的关系;了解Qv与化学反应的内能的关系;初步掌握化学反应的标准摩尔焓变(△rH mθ)的近似计算,适当了解能源中的燃料燃烧反应的热效应。
第二章化学反应的基本原理与大气污染控制知识点:环境化学,热力学第二定律,热力学等温方程,热力学第三定律,标准平衡常数,多重平衡规则,质量作用定律,吉布斯函数变判据,化学平衡的移动原理。
学习目标:了解化应中的熵变及吉布斯函数变在一般条件下的意义;初步掌握化学反应的标准摩尔吉布斯函数变(△rGmθ)的近似计算;能应用△rGm 或△rGmθ判断反应进行的方向;理解标准平衡常数(Kθ)的意义及其与△rGmθ的关系,并初步掌握有关计算;理解浓度,压力和温度对化学元素反应的影响;了解浓度,温度与反应速率的定量关系,了解基元反应和反应级数概念;能用阿仑尼乌斯公式进行初步计算;能用活化能和活化分子的概念说明浓度,催化剂对化学元素反应速率的影响;了解环境化学元素中大气主要污染物及其防治。
第三章水溶液化学知识点:共轭酸碱对,缓冲溶液,溶度积,溶液的通性,酸碱解离平衡,难溶电解质。
学习目标:了解溶液的通性(蒸气压下降,沸点上升,凝固点下降及渗透压);明确酸碱的解离平衡,分级解离和缓冲溶液的概念,能进行溶液pH的基本计算,能进行同离子效应,等离子平衡如缓冲溶液的计算,了解配离子(络离子)的解离平衡移动;初步掌握溶度积和溶液解的基本计算;了解溶度积规则及其应用;了解环境化学中水的主要污染物及其某些处理方法的原理。
第四章电化学与金属腐蚀知识点:电极,氧化还原电对,电极电势,原电池,电动势,电解,化学电源,析氢腐蚀,吸氧腐蚀。
学习目标:了解电极电势的概念,能用能斯特方程式进行有关计算;能应用电极电势的数据判断氧化剂和还原剂的相对强弱及氧化还原反应自发进行的方向和程度;了解摩尔吉布斯函数△rGmθ与原电动势,△rGmθ与氧化还原反应平衡常数的关系;联系电极电势概念,了解电解的基本原理,了解电解在工程实际中的某些应用;了解金属腐蚀及防护原理。
无机材料化学

无机材料化学
无机材料化学是研究无机材料的化学性质、合成方法以及应用领域的一门学科。
无机材料一般指的是没有碳元素或碳元素含量很少的材料,如金属、金属氧化物、无机非金属等。
在无机材料化学中,研究的内容包括材料的结构、晶体结构以及材料与物质之间的相互作用等。
这些研究对于探究物质的性质和应用具有重要意义。
首先,无机材料的结构是研究的重点之一。
通过了解材料的结构,可以揭示材料的性质。
例如,金属材料的结晶结构决定了其导电性和机械性能,而氧化物材料的晶体结构则决定了其光学和磁学性质。
其次,无机材料的合成方法也是研究的重要内容。
针对不同的应用需求,研究人员需要开发出制备特定材料的合成方法。
例如,通过溶剂热法可以合成纳米级的金属氧化物材料,而磁控溅射法可以制备高纯度的薄膜材料。
此外,无机材料在领域中有着广泛的应用。
金属材料常用于工程领域,如铝合金用于航空器制造、钢铁用于建筑结构等。
陶瓷材料具有耐高温、硬度大的特点,广泛应用于电子、能源、航空等领域。
电子材料包括半导体材料和绝缘体材料,被广泛应用于电子器件制造。
此外,无机材料还可以用于化学催化、环境保护、生物学和医疗等领域。
总的来说,无机材料化学是研究无机材料的化学性质、合成方
法以及应用领域的学科。
该学科对于理解无机材料的性质、开发新材料以及解决实际问题具有重要意义。
通过对无机材料化学的研究,可以推动无机材料领域的发展,为人类社会的进步做出贡献。
第六章 元素化学与无机材料

5.写出钾与氧气作用分别生成氧化物、 过氧化物以及超氧化物的三种反应的化学方程式以及 这些生成物与水反应的化学方程式。 解: 生成氧化物 生成过氧化物 生成超氧化物 4K + O2 = 2K2O 2K + O2 = K2O2 K + O2 = KO2
生产物与水的反应分别为 K2O + H2O = 2KOH 2K2O2 + 2H2O = 4KOH + O2 4 KO2 + 2H2O = 4KOH + 3O2
( )
(4)铝和氯气分别是较活波得金属和较活波得非金属单质,因此两者能作用形成典型得离 子键,固态为离子晶体。 ( )
(5)活波金属元素得氧化物都是离子晶体,熔点较高;非金属元素得氧化物都是分子晶体, 熔点较低。 (6)同族元素得氧化物 CO2 和 SiO2,具有相似得物理性质和化学性质。 (7)在配离子中,中心离子的配位数等于每个中心离子所拥有的配位体的数目。 (8)共价化合物呈固态时,均为分子晶体,因此熔点、沸点都低。 解: (1)+ ; (2)+ ; (3)- ; (4)- ; (5)- ; (6)- ; (7)- ; (8)- 。 2.选择题(将所有正确答案的标号填入括号内) (1)在配制 SnCl2 溶液时,为防止溶液产生 Sn(OH)Cl 白色沉淀,应采取的措施是 (a)加碱 (b)加酸 (c)多加水 (d)加热 ( ) (c) AlCl3 (d) KCl ( ) (c) H3AsO4 (d) H3AsO3 ( ) ( ) ( )
6.利用标准热力学函数分别估算下列反应在 873K 时的标准摩尔吉布斯函数变, 然后比较铜、 锰、钠于室温条件下与氧气结合能力的强弱。并将此顺序与铜、锰、钠于室温条件下在水溶 液中的还原性强弱作一比较。从中可得到什么启示。
元素化学与无机材料

元素化学与无机材料元素化学是研究元素的性质、结构、反应和应用的科学领域。
它的研究对象是元素及其化合物的物理化学性质、原子结构、化学键、化合价、反应性等。
无机材料是由无机化合物组成的材料,包括金属、陶瓷和杂化材料等。
元素化学的研究对于理解物质世界的基本组成、化学反应和物质变化具有重要意义。
通过对元素进行深入研究,可以揭示元素之间的相互作用和反应机制,从而推动新材料的发展和应用。
在元素化学中,研究人员根据元素的化学性质将其分类,常用的分类方式包括金属元素、非金属元素和过渡元素等。
金属元素具有良好的导电和导热性能,常用于制造电子器件和金属合金;非金属元素多为气体或固体,常用于制造化学品和塑料等;过渡元素在化学反应中常出现多种价态,具有较高的活性。
除了元素本身的研究,元素化学还涉及到元素与其他物质的反应和化合。
通过研究元素的化合物,可以探索化学反应的机理和能量变化,为控制化学反应提供理论基础。
此外,元素化学还研究了元素间的化学键和化合价的变化。
元素的化学键决定了化合物的稳定性和性质,进一步影响到化合物在材料科学、药物研发和环境保护等领域的应用。
与元素化学相对应的是无机材料的研究。
无机材料是由无机化合物组成的材料,具有独特的物理化学性质和应用。
常见的无机材料包括金属、陶瓷、玻璃和半导体等。
金属是无机材料的一类,具有良好的导电和导热性能,常用于制造金属结构和器件。
陶瓷是一类由金属和非金属元素组成的无机化合物,具有较高的硬度、耐热性和耐腐蚀性,常用于制造陶瓷器、建筑材料和耐火材料。
玻璃是由熔融的硅酸盐形成的非晶态固体,具有良好的透明性和机械强度,广泛应用于建筑、光学和电子设备等领域。
半导体是由一些元素或化合物构成的材料,具有介于导电体和绝缘体之间的导电性能,广泛应用于电子学和光电子学。
无机化学与无机材料

无机化学的未来展望
新材料开发:利用无机化学原理,探索新型无机材料的合成与性质
绿色化学:发展环境友好型的无机化学反应,降低对环境的负面影响 生物无机化学:研究无机物质与生物大分子的相互作用,为药物设计和生 物医学应用提供新思路 无机膜分离技术:在能源、环保等领域具有广泛应用前景
玻璃材料的应用
家居装饰:用于灯具、花瓶、 餐具等,增添家居的艺术气 息和实用性
建筑行业:用于窗户、幕墙、 隔断等,具有美观、节能、 环保等特点
电子产品:用于显示屏、触 摸屏等,具有高透光率、高
硬度、耐磨损等特点
医疗领域:用于医疗器械、 实验室器材等,具有无毒、
无味、无菌等特点
金属氧化物材料的应用
化学惰性:无机材料在化学反应中表现出较低的反应活性,不易与其他物质发生化学反应。
物理性质:无机材料的物理性质如硬度、导热性、导电性等,也对其在各个领域的应用具有 重要影响。
无机材料的稳定性与可靠性
无机材料不易受化学腐蚀, 具有较好的耐腐蚀性。
无机材料的结构不易发生变 化,具有较好的稳定性。
无机材料在高温下不易分解, 具有较高的热稳定性。
透明导电膜:用于制造显示器、太 阳能电池等
陶瓷材料:用于制造高温、高强度、 高硬度的产品
添加标题
添加标题
添加标题
添加标题
催化剂载体:在石油、化工等领域 广泛应用
磁性材料:用于制造电子器件、磁 记录等
无机非金属复合材料的应用
水泥混凝土:用于建筑和土木工程,具有高强度和耐久性
玻璃钢:用于航空、汽车和船舶等领域的轻质结构材料
无机材料化学

无机材料化学无机材料化学是化学领域中的一个重要分支,它研究的是无机材料的结构、性质、合成方法以及在各个领域中的应用。
无机材料是指那些不包含碳元素或者含有少量碳元素的化合物,如金属、金属氧化物、金属硫化物、金属氮化物等。
在生活和工业生产中,无机材料扮演着重要的角色,比如建筑材料、电子材料、催化剂等都是无机材料的重要应用领域。
首先,我们来看一下无机材料的结构和性质。
无机材料的结构多种多样,可以是晶体结构,也可以是非晶结构,还可以是多晶结构。
不同结构的无机材料表现出不同的性质,比如晶体结构的无机材料通常具有良好的机械性能和热学性能,而非晶结构的无机材料则具有较好的光学性能和磁学性能。
此外,无机材料的性能还与其化学成分密切相关,不同的元素组合会导致不同的性能表现,因此合成无机材料时需要对其结构和成分进行精确控制。
其次,无机材料的合成方法也是无机材料化学研究的重要内容。
目前,合成无机材料的方法多种多样,常见的方法包括固相反应、溶液法、气相沉积等。
不同的合成方法适用于不同类型的无机材料,选择合适的合成方法可以有效地控制无机材料的结构和性能。
另外,近年来,还出现了许多新型的合成方法,比如水热法、溶胶-凝胶法等,这些新方法为合成高性能无机材料提供了新的途径。
最后,无机材料在各个领域中的应用也是无机材料化学研究的重要方向。
无机材料广泛应用于建筑材料、电子材料、催化剂、光学材料等领域。
比如,氧化铝、二氧化硅等无机材料在建筑材料中具有良好的耐候性和耐磨性,广泛用于建筑物的装饰和保护;金属氧化物、金属硫化物等无机材料在电子材料中具有良好的导电性和光学性能,被广泛应用于电子元器件的制造;贵金属催化剂、氧化物催化剂等无机材料在化工领域中具有良好的催化性能,被广泛用于化工生产过程中的催化反应。
综上所述,无机材料化学是一个重要的研究领域,它研究的是无机材料的结构、性质、合成方法以及在各个领域中的应用。
通过对无机材料的研究,可以为人类社会的发展提供重要的支撑,推动材料科学和工程技术的发展。
初中九年级(初三)化学 第6章 元素化学与无机材料

Ag、Cu、Au、Al等是最好的导电材料。
金属的纯度以及温度等因素对金属的导电性能影响相当重要。
1 单质的电导率
表6.5 单质的电导率(MS·m-1)
2 固体能带理论
以分子轨道理论为基础。以钠为例,两个3s原子轨道可以组合形成两个分子轨道: 一个能量较低的成键分子轨道和一个能量较高的反键分子轨道。当原子数目n很大 时,分子轨道数也很多,这些分子轨道的能级之间相差极小,形成了具有一定上 限和下限的能带,由于3s原子轨道之间的相互作用,形成3s能带。
思考2:金属单质的还原性主要体现在哪些反应 上?
金属与氧的作用 金属置换H的能力
1 金属单质活泼性规律
同一周期
在短周期中,从左到右金属单质的还原性逐渐减弱。在长周期中的递变情况和
短周期一致,但较为缓慢,也有例外。
同一族
自上而下主副族变化规律相反(ⅢB与相邻的主族一致)。
ⅠA ⅡA
ⅢA
了解重要金属、金属材料、无机非金属材料及纳米材料的特性及应用。
目录
6.1 单质的物理性质 6.2 单质的化学性质 6.3 无机化合物的物理性质 6.4 无机化合物的化学性质 6.5 配位化合物 6.6 无机材料
6.1 单质的物理性质
在目前发现的112种元素中,单质的存在状 态各异,有气态、液态和固态三种。
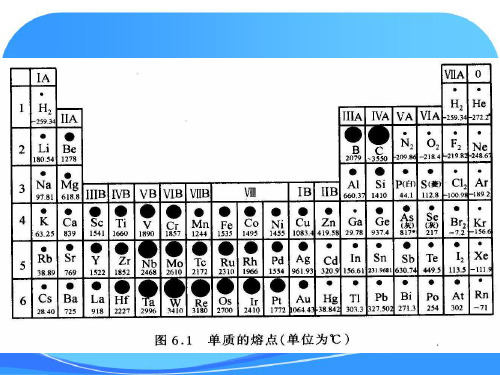
第2、3周期元素的单质 从左到右,逐渐升高,IVA最高,随后降低;
第4、5、6周期元素的单质 从左到右,逐渐升高,VIB最高,随后总趋势是逐渐降低。
即:高熔点、高硬度单质集中在中部,其两侧较低。
1 单质的熔点
表6.1 单质的熔点 (°C)
2 单质的沸点
表6.2 单质的沸点(°C)
元素化学和无机材料

IA:(典型金属) 由上而下: 物理性质降低 VIIA: (分子晶体)由上而下: 物理性质升高
6.1.1熔点、沸点和硬度
从p253图6.1和p254图6.2、图6.3中看出规律
• 同族,从上到下主族元素 原子半径增加
•
还原性增强
•
氧化性减弱
6.2.1金属单质的还原性
金属还原性的能力: 1)金属与氧的作用 2)金属置换氢的能力
S区金属很活泼,具有很强的还原性。 •常温下既能与水,又能与空气中氧气反应,反应十分 激烈。 •与氧反应除生成正常的氧化物外,还能生成过氧化物 或超氧化物。例如: 正常氧化物:Li2O 、CaO 过氧化物:Na2O2 、 BaO2(Be 、 Mg除外) 超氧化物:KO2 、 BaO4(Li 、 Be 、 Mg除外) 过氧化物 、超氧化物均为固体储氧物质,与水作用可 放出O2
2)非金属氯化物的熔、沸点较低(PCl3,CCl4, SiCl4) CCl4有机溶剂。
3)一般金属氯化物的熔、沸点介于两者之间,大多偏 低(AlCl3, FeCl2, ZnCl2)。AlCl3能溶于极性有机溶 剂。
6.3.1卤化物的熔点、沸点和离子极化理论
分析:
NaCl,AlCl3,SiCl4 溶沸点:由高→低 溶解性:易溶于极性→非极性 晶体类型:离子晶体→分子晶体
主要内容
6.1 单质的物理性质 6.1.1 熔点、沸点、硬度和晶体结构 6.1.2 导电性
6.2 单质的化学性质 6.2.1金属单质的还原性 6.2.2非金属单质的氧化还原性
6.3无机化合物的物理性质 6.3.1卤化物的熔点、沸点和离子极化理论 6.3.2氧化物的熔点、沸点和硬度
大学化学:第6章 非金属元素与无机非金属材料

(高纯度或掺杂)。
3 通信原理:
光在芯料和皮料界面上全反射,入射光封闭 在芯料内,经过无数次全反射,锯齿状传播。
激光材料
1 激光的特点:
①光源亮度高; ②方向性极强; ③单色性极好。
白炽灯泡产生的白光是不同 波长、不同颜色的光合成的, 向各方向放射。激光是单一 颜色(单一波长)光形成的, 向一个方向发射,波峰和波 谷都一致
② 同族:
上 n+ r(+) Rn+极化力 R-O键 酸性
↓ ∣↓
↑
↑↑
下 同大
弱
弱弱
3 氧化物的稳定性
① 热分解,如: 2HgO → 2Hg+O2 可用ΔfH判断;
② 置换,如: 2Al+Fe2O3→ Al2O3+2Fe 可用ΔG-T 图判断。
大多数氧化物稳定,不分解。 少数不活泼金属氧化物受热会分解:
但是,超导材料的临界温度都很低,难于实 际应用。寻找高温超导是该领域的首要课题。
1987年 赵宗贤等发现, YBa2Cu3O7-x (Tc = 90K)
1993年 中-瑞合作发现, Hg-Ba-Cu-O (Tc = 133.5K)
磁悬浮列车
磁悬浮列车是由无接触的电磁悬浮、导向 和驱动系统组成的新型交通工具,磁悬浮 列车分为超导型和常导型两大类。
新光加现有的光,两个光子继续激发其它 受激原子,把它们的能量放出,又重复下去。 这种雪球似的放大现象,产生连贯的光束: 激光。
在气体激光器里,光子被有反射镜面的充 气管加速。激光的强度、方向性、单色性使 之能够通过细小透明镜子。发出的激光形成 光柱。
这是世界上最大的激光器, 可以用来熔化很小的样品。
第六章 元素化学与无机材料

第六章元素化学与无机材料迄今为止,人类共发现112种元素,其中90种金属元素,22种非金属元素,这些元素的单质的性质如下:6.1.单质的物理性质6.1.1.熔沸点和硬度6.1.2.导电性和能带理论各单质的导电性差别很大,金属都能导电,是电的良导体;许多非金属单质不能导电,是绝缘体;介于导体和绝缘体之间的是半导体。
金属导电的原因可以用前面金属键部分的自由电子模型来解释,但自由电子模型无法解释半导体的性质。
于是人们又在分子轨道理论的基础上提出固体能带理论来解释上面的问题。
按照分子轨道理论,分子轨道是由参加成键的原子轨道线性组合得到的。
一块金属晶体就是一个大分子,在其中有N个原子,这些原子各提供一个价轨道进行线性组合,得到N分子轨道,这些分子轨道中有N/2成键轨道,N/2反键轨道,由于N的数值非常大,使得各分子轨道的能级差非常小,以至使各分子轨道的能级连成了一片,我们称之为能带,如果能带上未排满电子,那么该金属是导体,如果能带上排满了电子且和相邻空能带之间的能级差相差很大,那么该物质是绝缘体,绝缘体的特征是价电子所处的能带都是满带,且满带与相邻的空带之间存在一个较宽的禁带。
如果能带上排满了电子且和相邻空能带之间的能级差相差不大,那么该物质是半导体。
半导体的能带与绝缘体的相似,但半导体的禁带要狭窄的多。
这就是能带理论。
6.2. 单质的化学性质单质的化学性质通常表现为氧化还原性。
金属单质最突出的性质是它们容易失去自由电子而表现出还原性,而非金属单质在反应中获得电子表现出氧化性,但也有不少非金属单质有时也表现出还原性。
它们这种性质的变化在通常条件下,基本上符合周期系中元素金属性和非金属的递变规律。
6.2.1.金属单质的还原性(1)在短周期中,从左到右由于一方面核电荷数依次增多,原子半径逐渐缩小,另一方面最外层电子数依次增多,同一周期从左到右金属单质的还原性逐渐减弱。
在长周期中总的递变情况和短周期是一致。
同一主族自上而下,核电荷数增加,原子半径增大,金属单质的还原性一般增强,但副族单质的还原性一般自上而下反而减弱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
金刚石
石墨 图6.5 碳的同素异形体
C60
普通化学
6.1.2 导电性和能带理论 1 单质的导电性 金属能三维导电,是电的良导体;许多非金 属单质不能导电,是绝缘体;介于导体与绝缘体 之间的是半导体,例如Si、 Ge等。
思考:单质中最好的导体是什么? Ag、Cu、Au、Al等是最好的导电材料。 金属的纯度以及温度等因素对金属的导电性能影响 相当重要。 普通化学
2 离子型氢化物 氢化物可分为共价型(如HCl),金属型、离 子型等。离子型氢化物可以释放原子态氢,在工 业上作为强还原剂用于还原醛、酮、酯等碳基化 合物。
活泼性极强的碱金属和碱土金属可以与氢气发 生反应生成离子型氢化物: 2Na + H2 = 2NaH Ca + H2 = CaH2
普通化学
6.3 无机化合物的物理性质 无机化合物种类繁多, 情况比较 复杂。这里依照元素的周期性规律和物
氯化物的沸点
s表示升华; d表示分解;LiCl,ScCl3的 数据有一个温度范围,本表取平均值。
IIIA IVA VA VIA
BCl3 CCl4 NCl3 12.5 76.8 <71 IIB AlCl3 SiCl4 PCl3 SCl4 178s 57.6 75.5 -15d
IIIB IVB
VB
VIB
同一族 自上而下主副族变化规律相反(ⅢB与相邻的主族一致)。
ⅠA ⅡA
还 原 性 增 强
ⅢA
ⅦA
氧 化 性 增 强
氧化性增强
ⅢB ⅣB
ⅡB
还原性增强
还增 原强 性 还原性增强不明显
还原性增强
图6.8 金属单质活泼性规律
普通化学
2 温度对单质活泼性的影响*
D rGm (T) ≈ D r Hm (298.15K) - T . D r Sm (298.15K) 化学热力学计算结果表明:在873K的 高温时,单质与氧气结合的能力由强到弱的 顺序大致为: Ca、Mg、Al、Ti、Si、Mn、Na、Cr、Zn、 Fe、H2、C、Co、Ni、Cu 这一顺序与常温时单质的活泼性递变情 况并不完全一致。 温度会影响金属与氧气反应的产物。
目 6.1 6.2 6.3 6.4 6.5 6.6
普通化学
录
单质的物理性质 单质的化学性质 无机化合物的物理性质 无机化合物的化学性质 配位化合物 无机材料
6.1 单质的物理性质 在目前发现的112种元素中,单质的存 在状态各异,有气态、液态和固态三种。
思考:单质的物理性质主要与什么因素有关?
单质的物理性质与它们的原子结构或晶 体结构有关。由于原子结构或晶体结构具有 一定的规律性,因此单质的物理性质也有一 定的规律性。
质结构,尤其是晶体结构理论为基础,
讨论具有代表性的氯化物和氧化物的熔
点、沸点等物理性质以及规律。
普通化学
6.3.1 氯化物的物理性质
氯化物是指氯与电负性比氯小的元素所组成的 二元化合物。
氯化物概述
NaCl、KCl、BaCl2等离子型氯化物熔点较高、稳定性 好的氯化物在熔融状态可用作高温介质(盐浴剂),CaF2、 NaCl、KCl等可以用作红外光谱仪的棱镜。过渡型的无水 氯化物如AlCl3、ZnCl2、FeCl3等可以在极性有机溶剂中溶 解,常用作烷基化反应或酰基化反应的催化剂。性质较稳 定的无水氯化物如CaCl2等常用作干燥剂。 普通化学
2Na2O2(s) + 2CO2(g) = 2Na2CO3(s) + O2(g)
4KO2(s) + 2H2O(g) = 3O2(g) + 4KOH(s) 4KO2(s) + 2CO2(g) = 2K2CO3 + 3O2(g) 普通化学
p区金属元素中只有Al比较活泼,能在空气中与 氧反应,但生成致密的氧化膜。 d区元素也比较不活泼,第四周期元素除Cu外可 以与氧反应,但Cr、Zn也形成致密的氧化膜。
空带 满带
空带 禁带 6.7 导体、半导体和绝缘体的能带模型示意图
普通化学
6.2 单质的化学性质 单质的化学性质通常表现为氧化还原性 金属单质最突出的性质是它们容易失去电子而 表现出还原性
非金属单质的特征是化学反应中能获得电子而 表现出氧化性,但不少非金属单质有时也能表现 出还原性。
1 单质的熔点
表6.1 单质的熔点(C)
普通化学
2 单质的沸点
表6.2 单质的沸点(C)
普通化学
3 单质的硬度
表6.3 单质的硬度(莫氏)
普通化学
5 非 金 属 单 质 的 晶 体 结 构
金属晶体
图6.2 非金属单质的分子和晶体结构示意图
普通化学
C60的发现
1996年 Kroto, Smalley及 Curl三位教授因首先发现 C60而荣获瑞典皇家科学院 颁发的诺贝尔化学奖。
普通化学
值得注意的问题:
歧化反应
有些非金属单质既具有氧化性又具有还原性,其Cl2、Br2、 I2、P4、S8等能发生岐化反应。 Cl2 + H2O = HCl + HClO Cl2 + 2NaOH = NaCl + NaClO + H2O
溴和碘在氢氧化钠中倾向于生成溴酸钠和碘酸钠: Br2 + 6NaOH = 5NaBr + NaBrO3 +3H2O 次氯酸钠 次氯酸钠可以释放出原子氯,后者有极强的杀菌和漂白 作用。因此广泛地用作消毒液和漂白剂。 次氯酸钠在工业上用作氧化剂,可以将芳酮氧化为羧酸: ArCOCH3 + NaOCl = ArCOONa +CH3Cl 普通化学
对于氧化值可变的金属来说,高温下生 成低氧化值的金属氧化物的倾向较大,而常 温下生成高氧化值的金属氧化物的倾向较大。 例如,铁在高温下以生成FeO为主,常温时则 以Fe2O3为主。
D rGm (T)与T 的关系图
普通化学
金属与氧的作用 s区金属与空气作用生成正常的氧化物,也生 成部分过氧化物(Li、Be、Mg除外)。在纯氧气中生 成过氧化物,K、Rb、Cs、Ca、Sr、Ba等在过量的 氧气中燃烧可以生成超氧化物。 过氧化物和超氧化物都是固体储氧物质,它 们与水反应会放出氧气,又可吸收 CO2 并产生 O2 气,所以较易制备的 KO2 常用于急救器或装在防 毒面具中:
第六章
元素化学与无机材料
普通化学
本章学习要求
联系物质结构基础知识 ,了解单质和某些化合物的熔点 、硬度以及导电性等物理性质的一般规律。
联系化学热力学基础知识 , 了解单质氧化还原性的一般 规律。 联系周期系和电极电势 , 明确某些化合物的氧化还原性 和酸碱性等化学性质的一般规律。 了解配合物的组成、命名。了解配合物价键理论的基本 要点以及配合物的某些应用。 了解重要金属、金属材料、无机非金属材料及纳米材料 的特性及应用。 普通化学
图6.3 C60结构图
H. W. 克鲁托 Harold W. Kroto
R. F. 柯尔 Robert F. Curl 图6.4 发现C60的三位科学家
R. E. 史沫莱 Richard E. Smalley
普通化学
碳的同素异形体
金刚石:sp3 网格状 硬度大 石墨:sp2 片层状 润滑性、导电性 C60:类sp2 球烯 多种优异性能
普通化学
氯化物熔点
表6.6 氯化物的熔点 注1:IB~VB,IA~IVA族价态与族数相 同;VIA族为四氯化物,VIB、VA族为 三氯化物。VIIB和VIII族为二氯化物。 注2:Tl、Pb、Bi分别为+1、+2、+3价。
普通化学
IA
HCl -84.9 IIA LiCl BeCl2 1342 520 NaCl MgCl2 1413 1412
图6.6 1mol钠原子的3s轨道能带
3 能带理论的应用
金属晶体中存在这种未满的能带是金属能 导电的根本原因。
绝缘体的特征是价电子所处的能带都是满带, 且满带与相邻的空带之间存在一个较宽的禁 带。 半导体的能带与绝缘体的相似,但半导体的 禁带要狭窄得多。
普通化学
空能级 电子占 用能级 a 导体 空带 禁带
VIIB
VIIIB
IB
KCl CaCl2 ScCl3 TiCl4 VCl4 CrCl3 MnCl2 FeCl3 CoCl2 NiCl2 CuCl2 ZnCl2 GaCl3 GeCl4 AsCl3 SeCl4 1500s >1600 825s 136.4 148.5 1300s 1190 315d 1049 973s 933d 732 201.3 84 130.2 288d CuCl 1490 RbCl SrCl2 YCl3 ZrCl4 NbCl5 MoCl5 1390 1250 1507 331s 254 268 CsCl BaCl2 LaCl3 HfCl4 TaCl5 WCl6 ReCl4 1290 1560 >1000 319s 242 346.7 500 WCl5 275.6 RhCl2 800s AgCl CdCl2 InCl3 SnCl4 SbCl3 TeCl4 1550 960 600 114.1 283 380
思考:副族元素与氧反应的活泼性递变规律同主族元素相比, 有何不同? 同一周期:活泼性递变规律基本一致,但副族元素的变化很
小,性质比较类似。
同一族:主族元素随周期数增加而增加; 副族元素(除Sc副族)随周期数增加而降低。 普通化学
3 金属的溶解 s区金属与水剧烈反应,置换出水中的氢。 p区金属(除Sb、Bi外)和第四周期副族金属( Cu除 外 )的电极电势比H低,可以与盐酸和稀硫酸反应。 d区第五和第六周期金属的电极电势比H高,只能 与氧化性的酸(浓硫酸、浓硝酸、王水等)反应。
普通化学
6.2.1 金属单质的还原性 思考1:金属单质的还原性主要与哪些因素有关? 从结构因素考虑,主要与元素的核电荷数、 原子半径和最外层电子数有关。 思考2:金属单质的还原性主要体现在哪些反应上? 金属与氧的作用 金属置换H的能力
