pET-32b(+)大肠杆菌表达载体说明
大肠杆菌表达操作规程

大肠杆菌表达操作规程大肠杆菌表达操作规程一、实验材料和仪器准备1. 大肠杆菌菌株:选择适合表达目标蛋白的大肠杆菌菌株,如BL21(DE3)、Rosetta(DE3)等。
2. 表达载体:选择适合目标蛋白表达的载体,如pET 系列、pBAD系列等。
3. 目标蛋白基因:基因可以通过PCR扩增获得,或者从其他载体中克隆。
4. 培养基:溶液制备LB培养基,配制好含有适当抗生素的LB琼脂板,另外还需要制备适用于大肠杆菌表达的诱导培养基,如TB、SB等。
5. 抗生素:根据载体的需要,选用适当浓度的抗生素。
二、诱导表达实验操作流程1. 预先培养:取一株原始菌落接种到含有适当抗生素的LB液体培养基中,为了避免突变株的污染,建议每次都从冷冻保存的单一菌落开始。
培养条件为37℃,180rpm,过夜培养。
2. 选取合适菌液接种量:从过夜的预培养液中取2ml,用于接种适当量的诱导培养基。
3. 诱导表达:根据所用的表达载体,将接种量转移到含有适当抗生素的诱导培养基中,继续培养。
4. 培养条件:培养条件根据所选表达载体的要求进行设置,一般为37℃,180rpm。
5. 收集细胞:在适当的时间点,如在菌液浓度达到指定值或培养时间达到一定程度后,通过离心收集细胞。
6. 细胞破碎:采用适当的方法破碎细胞膜,如超声波破碎、冻融法等。
7. 蛋白质提取:以适当的缓冲液提取目标蛋白质。
8. 蛋白质纯化:采用各种纯化方法(如亲和层析法、凝胶过滤法等)对蛋白质进行纯化。
9. 检测和分析:对蛋白质进行SDS-PAGE、Western blot等分析方法进行检测。
三、注意事项1. 培养条件的控制:控制好培养温度、转速和时间等条件,以保证表达的效果。
2. 抗生素浓度的选择:根据所用载体对抗生素的要求,选择适当的浓度以抑制非目标菌株的生长。
3. 提取和纯化条件的选择:选择适当的缓冲液、酶和抑制剂,以保持目标蛋白的活性和稳定性。
4. 实验材料的无菌处理:所有实验材料(包括培养基、平板、显微镜片等)都要经过严格的无菌处理,以防止外源性污染。
pet32a载体上的his蛋白表达条件

pet32a载体上的his蛋白表达条件Pet32a是一种常用的表达载体,用于大肠杆菌中His标签蛋白的高效表达。
His标签是由6个连续的组氨酸残基组成,可以用于方便高效地纯化目标蛋白。
在Pet32a载体中,目标蛋白与截短的Thrombin酶N端连接,形成His-Thrombin蛋白复合体。
这样的连接允许在表达后使用Thrombin 酶进行His标签的切割,得到纯化的目标蛋白。
Pet32a载体的启动子为T7启动子,它能够高效地驱动目标蛋白的表达。
在进行表达之前,需要将目标基因克隆到Pet32a载体中,并利用限制酶切和连接酶进行连接。
连通区域包括5'顺序为T7启动子和截短的Thrombin酶,以及3'顺序为截断的Thrombin裂解位点和聚合酶终止剂。
在大肠杆菌中进行Pet32a载体的转化后,通过大量培养和诱导表达来实现目标蛋白的高效表达。
常用的培养基为LB培养基,可以添加适当的抗生素进行筛选。
常用的抗生素有氨苄青霉素(Ampicillin)和卡那霉素(Kanamycin)。
表达时间和诱导条件是Pet32a载体上的His蛋白表达的关键。
通常情况下,在细胞密度达到指定浓度时,使用异丙硫醇(IPTG)来诱导表达。
IPTG能够拮抗大肠杆菌的阻遏基因,并诱导目标蛋白的高效表达。
常见的IPTG最终浓度为0.1-1 mM,孵育时间为3-24小时。
表达温度一般为37°C,并通过调整培养温度和表达时间来优化表达条件。
在大肠杆菌中进行表达后,目标蛋白一般以包涵体形式表达。
包涵体需要经过裂解和纯化步骤来获得目标蛋白的纯化产物。
对Pet32a载体上His蛋白表达的纯化,一般是通过亲和层析柱进行His标签蛋白的选择性吸附和洗脱。
常见的亲和层析柱包括镍柱、铜柱和锌柱等。
纯化过程还包括目标蛋白的洗脱和去除His-Thrombin蛋白复合体的步骤。
洗脱常用的缓冲液是Imidazole缓冲液,通过改变Imidazole 浓度来实现蛋白洗脱。
大肠杆菌表达系统

大肠杆菌表达系统总结随着分子生物学和蛋白组学的迅猛发展,外源基因表达的遗传操作技术日趋成熟。
表达系统是外源基因表达的核心,常用表达系统一般为模式生物,包括真核表达系统和原核表达系统,其中真核系统包括了哺乳动物细胞表达系统、植物体表达系统、昆虫杆状病毒表达载体系统以及酵母表达系统,原核表达系统则主要为大肠杆菌表达系统。
大肠杆菌是目前应用最广泛的原核表达系统,也是最早进行研究的外源基因表达系统,其遗传学背景清晰、生长快、较易实现高密度培养、成本低、产量高,相较于其它表达系统具有难以比拟的优越性,是商业生产中应用最广泛的表达系统,取得了巨大的科研价值和经济效益。
大肠杆菌表达系统目前广泛应用于表达生产多种蛋白质/多肽类药物和生物化学产品,包括:重组人胰岛素、a2b型干扰素、兰尼单抗、紫色杆菌素和牡丹皮葡萄糖苷等。
据统计,1986-2018年由美国FDA和欧洲EMA批准上市的重组蛋白类药物中有26%来自于大肠杆菌。
与此同时,目前通过大肠杆菌表达的基因工程疫苗也进入市场或处于临床实验阶段,如戊型肝炎疫苗、人乳头瘤病毒疫苗、流感A型疫苗等。
常见的大肠杆菌表达系统有BL21系列、JM109系列、 W3110系列和K802系列等,其中大肠杆菌 BL21( DE3)菌株是目前应用于重组蛋白表达研究最广泛的菌株之一,BL21(DE3)是由大肠杆菌B系列与K-12系列的衍生菌株通过 P1 转导等遗传突变获得的。
该类菌株通常为宿主蛋白酶缺失型,以保证外源蛋白在表达过程中不被降解,维持表达的稳定性。
大肠杆菌表达系统在商业生产中具有巨大的优越性和价值,但建立高效匹配的表达系统是实现商业价值的关键,包括宿主菌、外源基因、载体的选择与匹配。
宿主菌的选择是第一步,对表达活性和表达量影响很大,理想的宿主菌株是蛋白酶缺陷型,避免蛋白酶过多引起的产物不稳定,常见的蛋白酶缺陷型菌株为BL21系列菌株。
其次是外源基因,外源基因决定了是否可获得目的产物,原核基因可在大肠杆菌中直接表达,而真核基因不能再大肠杆菌中直接表达。
pBad gIII C大肠杆菌表达载体说明

pBad/gIII C编号 名称北京华越洋VECT-‐430 pBad/gIII CpBadgIII C载体基本信息载体名称: pBad/gIII C, pBadgIII C, p BadgIIIC. p Bad/gIIIC 质粒类型: 大肠杆菌蛋白表达载体表达水平: 高启动子: araBad克隆方法: 多克隆位点,限制性内切酶载体大小: 4149 b p5' 测序引物及序列: pBAD-‐F: A TGCCATAGCATTTTTATCC3' 测序引物及序列: pBAD-‐R: g atttaatctgtatcagg载体标签: N-‐GIII s ignal, C-‐His, C-‐Myc载体抗性: 氨苄备注: -‐-‐稳定性: 瞬时表达 Transient组成型: 诱导表达病毒/非病毒: 非病毒pBadgIII C载体质粒图谱和多克隆位点信息pBadgIII C载体简介pBAD/gIII载体质粒是衍生于pBR322载体。
载体设计用来在大肠杆菌中进行可调节分泌性表达和纯化重组目的蛋白。
使用基因III信号序列来定位重组蛋白,使其分泌到大肠杆菌周质腔中。
使用大肠杆菌araBAD启动子(pBAD)增强了大肠杆菌重组蛋白可溶性表达的水平。
载体上的调节蛋白AraC能够调控pBad启动子。
pBadgIII C载体序列 AAGAAACCAATTGTCCATATTGCATCAGACATTGCCGTCACTGCGTCTTTTACTGGCTCTTCTCGCTAACCA AACCGGTAACCCCGCTTATTAAAAGCATTCTGTAACAAAGCGGGACCAAAGCCATGACAAAAACGCGTAACA AAAGTGTCTATAATCACGGCAGAAAAGTCCACATTGATTATTTGCACGGCGTCACACTTTGCTATGCCATAG CATTTTTATCCATAAGATTAGCGGATCCTACCTGACGCTTTTTATCGCAACTCTCTACTGTTTCTCCATACC CGTTTTTTGGGCTAACAGGAGGAATTAACCATGAAAAAACTGCTGTTCGCGATTCCGCTGGTGGTGCCGTTC TATAGCCATAGCACCATGGCGGCCGCTCGAGATCTGCAGCTGGTACCATATGGGAATTCGAAGCTTTCTAGA ACAAAAACTCATCTCAGAAGAGGATCTGAATAGCGCCGTCGACCATCATCATCATCATCATTGAGTTTAAAC GGTCTCCAGCTTGGCTGTTTTGGCGGATGAGAGAAGATTTTCAGCCTGATACAGATTAAATCAGAACGCAGA AGCGGTCTGATAAAACAGAATTTGCCTGGCGGCAGTAGCGCGGTGGTCCCACCTGACCCCATGCCGAACTCA GAAGTGAAACGCCGTAGCGCCGATGGTAGTGTGGGGTCTCCCCATGCGAGAGTAGGGAACTGCCAGGCATCA AATAAAACGAAAGGCTCAGTCGAAAGACTGGGCCTTTCGTTTTATCTGTTGTTTGTCGGTGAACGCTCTCCT GAGTAGGACAAATCCGCCGGGAGCGGATTTGAACGTTGCGAAGCAACGGCCCGGAGGGTGGCGGGCAGGACG CCCGCCATAAACTGCCAGGCATCAAATTAAGCAGAAGGCCATCCTGACGGATGGCCTTTTTGCGTTTCTACA AACTCTTTTTGTTTATTTTTCTAAATACATTCAAATATGTATCCGCTCATGAGACAATAACCCTGATAAATG CTTCAATAATATTGAAAAAGGAAGAGTATGAGTATTCAACATTTCCGTGTCGCCCTTATTCCCTTTTTTGCGGCATTTTGCCTTCCTGTTTTTGCTCACCCAGAAACGCTGGTGAAAGTAAAAGATGCTGAAGATCAGTTGGGTGCACGAGTGGGTTACATCGAACTGGATCTCAACAGCGGTAAGATCCTTGAGAGTTTTCGCCCCGAAGAACGT TTTCCAATGATGAGCACTTTTAAAGTTCTGCTATGTGGCGCGGTATTATCCCGTGTTGACGCCGGGCAAGAG CAACTCGGTCGCCGCATACACTATTCTCAGAATGACTTGGTTGAGTACTCACCAGTCACAGAAAAGCATCTT ACGGATGGCATGACAGTAAGAGAATTATGCAGTGCTGCCATAACCATGAGTGATAACACTGCGGCCAACTTA CTTCTGACAACGATCGGAGGACCGAAGGAGCTAACCGCTTTTTTGCACAACATGGGGGATCATGTAACTCGC CTTGATCGTTGGGAACCGGAGCTGAATGAAGCCATACCAAACGACGAGCGTGACACCACGATGCCTGTAGCA ATGGCAACAACGTTGCGCAAACTATTAACTGGCGAACTACTTACTCTAGCTTCCCGGCAACAATTAATAGAC TGGATGGAGGCGGATAAAGTTGCAGGACCACTTCTGCGCTCGGCCCTTCCGGCTGGCTGGTTTATTGCTGAT AAATCTGGAGCCGGTGAGCGTGGGTCTCGCGGTATCATTGCAGCACTGGGGCCAGATGGTAAGCCCTCCCGT ATCGTAGTTATCTACACGACGGGGAGTCAGGCAACTATGGATGAACGAAATAGACAGATCGCTGAGATAGGT GCCTCACTGATTAAGCATTGGTAACTGTCAGACCAAGTTTACTCATATATACTTTAGATTGATTTAAAACTT CATTTTTAATTTAAAAGGATCTAGGTGAAGATCCTTTTTGATAATCTCATGACCAAAATCCCTTAACGTGAG TTTTCGTTCCACTGAGCGTCAGACCCCGTAGAAAAGATCAAAGGATCTTCTTGAGATCCTTTTTTTCTGCGC GTAATCTGCTGCTTGCAAACAAAAAAACCACCGCTACCAGCGGTGGTTTGTTTGCCGGATCAAGAGCTACCA ACTCTTTTTCCGAAGGTAACTGGCTTCAGCAGAGCGCAGATACCAAATACTGTCCTTCTAGTGTAGCCGTAG TTAGGCCACCACTTCAAGAACTCTGTAGCACCGCCTACATACCTCGCTCTGCTAATCCTGTTACCAGTGGCT GCTGCCAGTGGCGATAAGTCGTGTCTTACCGGGTTGGACTCAAGACGATAGTTACCGGATAAGGCGCAGCGG TCGGGCTGAACGGGGGGTTCGTGCACACAGCCCAGCTTGGAGCGAACGACCTACACCGAACTGAGATACCTA CAGCGTGAGCTATGAGAAAGCGCCACGCTTCCCGAAGGGAGAAAGGCGGACAGGTATCCGGTAAGCGGCAGG GTCGGAACAGGAGAGCGCACGAGGGAGCTTCCAGGGGGAAACGCCTGGTATCTTTATAGTCCTGTCGGGTTT CGCCACCTCTGACTTGAGCGTCGATTTTTGTGATGCTCGTCAGGGGGGCGGAGCCTATGGAAAAACGCCAGC AACGCGGCCTTTTTACGGTTCCTGGCCTTTTGCTGGCCTTTTGCTCACATGTTCTTTCCTGCGTTATCCCCT GATTCTGTGGATAACCGTATTACCGCCTTTGAGTGAGCTGATACCGCTCGCCGCAGCCGAACGACCGAGCGC AGCGAGTCAGTGAGCGAGGAAGCGGAAGAGCGCCTGATGCGGTATTTTCTCCTTACGCATCTGTGCGGTATT TCACACCGCATATGGTGCACTCTCAGTACAATCTGCTCTGATGCCGCATAGTTAAGCCAGTATACACTCCGC TATCGCTACGTGACTGGGTCATGGCTGCGCCCCGACACCCGCCAACACCCGCTGACGCGCCCTGACGGGCTT GTCTGCTCCCGGCATCCGCTTACAGACAAGCTGTGACCGTCTCCGGGAGCTGCATGTGTCAGAGGTTTTCAC CGTCATCACCGAAACGCGCGAGGCAGCAGATCAATTCGCGCGCGAAGGCGAAGCGGCATGCATAATGTGCCT GTCAAATGGACGAAGCAGGGATTCTGCAAACCCTATGCTACTCCGTCAAGCCGTCAATTGTCTGATTCGTTA CCAATTATGACAACTTGACGGCTACATCATTCACTTTTTCTTCACAACCGGCACGGAACTCGCTCGGGCTGG CCCCGGTGCATTTTTTAAATACCCGCGAGAAATAGAGTTGATCGTCAAAACCAACATTGCGACCGACGGTGG CGATAGGCATCCGGGTGGTGCTCAAAAGCAGCTTCGCCTGGCTGATACGTTGGTCCTCGCGCCAGCTTAAGA CGCTAATCCCTAACTGCTGGCGGAAAAGATGTGACAGACGCGACGGCGACAAGCAAACATGCTGTGCGACGC TGGCGATATCAAAATTGCTGTCTGCCAGGTGATCGCTGATGTACTGACAAGCCTCGCGTACCCGATTATCCA TCGGTGGATGGAGCGACTCGTTAATCGCTTCCATGCGCCGCAGTAACAATTGCTCAAGCAGATTTATCGCCA GCAGCTCCGAATAGCGCCCTTCCCCTTGCCCGGCGTTAATGATTTGCCCAAACAGGTCGCTGAAATGCGGCT GGTGCGCTTCATCCGGGCGAAAGAACCCCGTATTGGCAAATATTGACGGCCAGTTAAGCCATTCATGCCAGT AGGCGCGCGGACGAAAGTAAACCCACTGGTGATACCATTCGCGAGCCTCCGGATGACGACCGTAGTGATGAA TCTCTCCTGGCGGGAACAGCAAAATATCACCCGGTCGGCAAACAAATTCTCGTCCCTGATTTTTCACCACCC CCTGACCGCGAATGGTGAGATTGAGAATATAACCTTTCATTCCCAGCGGTCGGTCGATAAAAAAATCGAGAT AACCGTTGGCCTCAATCGGCGTTAAACCCGCCACCAGATGGGCATTAAACGAGTATCCCGGCAGCAGGGGAT CATTTTGCGCTTCAGCCATACTTTTCATACTCCCGCCATTCAGAG其他大肠杆菌表达载体:pBV221 ptdTomato pET-‐52b(+) pAmCyan pDsRed-‐Express2 pBV220 pCold-‐GST pColdS-‐SUMO pCold T F pCold I V pCold I II pCold I IpCold I pE-‐SUMO pCold-‐ProS2 pBAD102/D-‐TOPO pBAD202/D-‐TOPO pACYC184 pBAD/Thio-‐TOPO pBad/Myc-‐His C pBad/Myc-‐His B pBad/Myc-‐His A pBad/His C pBad/His B pBad/His A pBAD-‐TOPO pET-‐23b(+) pET-‐23a(+)pET-‐23c(+) pET-‐23(+) pET-‐12b(+) pET-‐12c(+)pET-‐12a(+) pET-‐11b(+) pET-‐11a(+) pET-‐11c(+) pBad24 pQE-‐82L pQE-‐81L pQE-‐80LpQE-‐32 pQE-‐9 pQE-‐16 pQE-‐31pQE-‐60 pQE-‐70 pQE-‐40 pET-‐51b(+)pET-‐50b(+) pET-‐49b(+) pET-‐48b(+) pET-‐47b(+)pET-‐26b(+) pET-‐32a(+) pET-‐21b(+) pET-‐22b(+)pET-‐14b pET-‐16b pET-‐15b pET-‐19bpET-‐20b(+) pET-‐21d(+) pET-‐21c(+) pET-‐21b(+)pET-‐21a(+) pET-‐24a(+) pET-‐24d(+) pET-‐25b(+)pET-‐27b(+) pET-‐28a(+) pET-‐30a(+) pET-‐42a(+)pET-‐43.1c(+) pET-‐43.1b(+) pET-‐43.1a(+) pET-‐44a(+)pET-‐44c(+) pET-‐46 E K/LIC pET-‐37b(+) pTrcHis2 C pTrcHis2 B pTrcHis2 A pET303/CT-‐His pET302/NT-‐His pRSET-‐CFP pRSET-‐EmGFP pRSET-‐BFP pGFPuvpET300/NT-‐DEST pET301/CT-‐DEST pGEM-‐T pBad43pGEX-‐4T-‐3 pGEX-‐5X-‐2 pBlueScript S K(+) pG-‐Tf2pG-‐KJE8 pGro7 pET-‐SUMO pSE380pET-‐17b pET102/D-‐TOPO pCDFDuet-‐1 pMAL-‐p5xpTf16 pET-‐28c(+) pBluescript I I S K(+) pET-‐30b(+) pSUMO pProEX H Tc pProEX H Tb pProEX H Ta pKD3 pKD13 pKD46 pTYB1pTYB2 pTWIN2 pBluescript I I K S(-‐) pTYB12pMAL-‐p5e pACYCDuet-‐1 pEGM-‐11ZF(+) pEGM-‐7ZF(+) PinPoint X a-‐3 PinPoint X a-‐2 PinPoint X a-‐1 pSP73pSP64 pTWIN1 pTYB11 pTXB1pET-‐5b(+) pBad/gIII C pBad/gIII B pBad/gIII ApET-‐5a(+) pMal-‐p4X pMal-‐p2G pkk223-‐3pkk232-‐8 pCYB1 pEZZ18 pBAD18pMAL-‐c5x pMal-‐p2E pMal-‐p2X pET-‐44 E K/LIC pET-‐43.1 E K/LIC pET-‐41 E K/LIC pMal-‐c4X pTrcHis BpET-‐31b(+) pET-‐3b(+) pET-‐41a(+) pGEX-‐3XpGEX-‐4T-‐2 pETDuet-‐1 pGEX-‐4T-‐1 pTrc99apET-‐28b(+) pET-‐His pALEX a,b,c pACYC177pBR322 pKD4 pKD20 pMXB10pEcoli-‐6xHN-‐GFPuv pKJE7 pRSET B pGEX-‐KGpGEX-‐2T pRSFDuet-‐1 pCOLADuet-‐1 pTrcHis C pTrcHis A pET-‐41b(+) pET-‐42b(+) pET-‐3a(+) pGEX-‐6P-‐3 pGEX-‐6P-‐2 pGEX-‐6P-‐1 pGEX-‐5X-‐3 pGEX-‐5X-‐1 pGEX-‐2TK pRSET A pMal-‐c2G pMal-‐c2E pMal-‐c2X pRSET C pQE-‐30pET-‐45b(+) pET-‐44b(+) pET-‐42c(+) pET-‐41c(+) pET-‐40b(+) pET-‐33b(+) pET-‐39b(+) pET-‐32 E K/LIC pET-‐32 X a/LIC pET-‐32c(+) pET-‐32b(+) pET-‐30 X a/LIC pET-‐30 E K/LIC pET-‐30c(+) pET-‐29c(+) pET-‐29b(+) pET-‐29a(+) pET-‐24c(+) pET-‐24b(+) pET-‐24(+) pET-‐23d(+) pET-‐11d(+) pBad33。
基因工程-32大肠杆菌克隆载体课件

这样可以在转化后的大肠杆菌细胞中获得大量 的目的DNA。
第二个优点在于重组体的识别只需一步,仅仅 只要把待筛选的大肠杆菌铺板到含有氨苄青 霉素和X-gal的琼脂培养基上。
而pBR322和pBR327,重组体的筛选都需要把 菌落从一种抗生素培养基原样转移到另一种 抗生素培养基平板。
一个用pUC8做载体的克隆实验比选择pBR322
当被克隆的基因有潜在的危害性时,应优先选 择pBR327。
•基因工程-32大肠杆菌克隆载体
•12
•基因工程-32大肠杆菌克隆载体•13来自pUC8—乳糖选择质粒
pUC8也是一个源自于pBR322的质粒,
只保留了pBR322的复制起点和ampR基因。 ampR基因的核酸序列也被改变了,不再包含唯一
的限制性酶切位点。
到噬菌体M13的短序列中。产生了M13mpl, 它在含有X-gal的琼脂板上形成蓝色的噬菌斑。
M13mpl的lacZ'基因上不含有任何的限制性酶
切位点,但在靠近基因起始位置的地方有一 个GGATTC的序列。改变一个核苷酸就变成
GAATTC,这是EcoRI的识别位点。这个改变
是用体外诱变完成的,产生了M13mp2克隆 载体。
用PstI,PuvI或ScaI酶切后插入DNA会导致氨 苄青霉素抗性基因失活;用BamHI及HindⅢ
等8个限制性内切核酸酶酶切后插入DNA会 导致四环素抗性基因失活。
这意味着pBR322支持很多种不同黏性末端的 DNA片段的导入。
•基因工程-32大肠杆菌克隆载体
•6
第三个优点在于pBR322有相当高的拷贝数
EcoRI的黏性末端。 多接头被插入到M13mp2克隆载体的EcoRI位
点上,形成了一个更加复杂的载体,即 M13mp7。
原核大肠杆菌蛋白表达

原核大肠杆菌蛋白表达系统是一种常用的表达系统,它基于细菌细胞(通常为大肠杆菌)对外源基因的转录和翻译过程。
在表达载体中,包含有启动子、激活子和选择子等元件,这些元件使得外源基因能够被细菌细胞识别、转录成mRNA,并通过翻译过程合成目标蛋白。
大肠杆菌表达载体的要求如下:
1. 操纵子以及相应的调控序列,因为外源基因产物可能会对大肠杆菌有毒害作用。
2. SD序列,即核糖体识别序列,一般SD序列与起始密码子之间间隔7\~13bp翻译效率最高。
3. 多克隆位点以便目的基因插入到适合位置。
此外,目的基因在大肠杆菌表达体系中要表达的基因即外源基因,包括原核基因和真核基因。
原核基因可以在大肠杆菌中直接表达出来,但是真核基因含有内含子不能直接表达,大肠杆菌不能对mRNA进行剪切,从而形成成熟的mRNA,所以真核基因一般以cDNA的形式在大肠杆菌表达系统中表达。
同时还需要提供大肠杆菌能识别的且能转录翻译真核基因的元件。
以上内容仅供参考,如需更多信息,建议查阅相关文献或咨询生物学家。
大肠杆菌表达系统使用指导

第8页/共24页
体系选择
研究基因功能: 大肠杆菌, 裂殖酵母,昆虫细胞, CHO细胞
多肽药物生产: 大肠杆菌, 毕氏酵母, CHO细胞, 乳腺组织
• HSA是包含585个氨基酸残基的单链无糖基化的球形蛋白 质, 分子量65kD。它是人血浆中含量最高的单一蛋白质 (达40g/L), 在体内有维持血液渗透压, 运输营养和其它 重要生物物质的作用。HSA本身是许多内源因子和外源药 物的载体。药物和血清白蛋白结合后。可以减少其生物利 用度, 增加在体内的半衰期至19d之久。
第11页/共24页
各种融合蛋白表达载体
• Protein A • GST(glutathione S-transferase) • CBD (chitin-binding domain, BioLabs;
cellulose-binding domain, Novagen) calmodulin-binding domain, Stratagene) • MBP (maltose-binding protein) • GFP (green fluorescence protein) • Thioredoxin **帮助二硫键形成 • Dsb (periplasma enzyme DsbA, DsbC) ** 二硫键的形成与 • SUMO (small ubiquitin-related modifier) • KSI (ketosteroid isomerase) 基本上全部沉淀 可用亲和层析纯化 帮助可溶化 帮助分泌到周质
大肠杆菌表达

大肠杆菌表达引言大肠杆菌(Escherichia coli)是一种常见的细菌,广泛应用于基因工程和蛋白质表达领域。
大肠杆菌表达系统具有高效、经济且易于操作的特点,因此被广泛用于重组蛋白的生产。
本文将介绍大肠杆菌表达系统的基本原理及其在蛋白质表达中的应用。
大肠杆菌表达系统的基本原理大肠杆菌表达系统采用重组DNA技术,将外源基因插入到大肠杆菌的表达载体中。
表达载体通常包含一个启动子、一个转录终止子、一个选择性抗生素抗性基因和一个参考基因。
启动子能够促使外源基因的转录,转录终止子能够终止转录过程,选择性抗生素抗性基因则能够确保只有带有外源基因的细菌存活下来。
参考基因用于对比表达水平,以评估外源基因的表达效果。
大肠杆菌表达系统的步骤大肠杆菌表达系统的基本步骤如下:1.选择适当的表达载体:根据需要选择合适的表达载体,包括质粒和噬菌体。
2.插入目标基因:将目标基因插入到表达载体中,通常使用限制酶切和连接酶法完成插入。
3.转化大肠杆菌:将重组载体导入大肠杆菌细胞中,通常使用热激转化或电转化的方法。
4.选择性培养:将转化后的菌液接种到选择性培养基上,以筛选含有外源基因的细菌。
5.表达蛋白质:使用适当的培养条件和诱导方法,促使含有外源基因的细菌表达目标蛋白质。
6.蛋白质纯化:利用亲和层析、离子交换层析等技术,对目标蛋白质进行纯化。
大肠杆菌表达系统的应用大肠杆菌表达系统在蛋白质表达领域具有广泛的应用。
以下是一些常见的应用领域:1.重组蛋白质的生产:大肠杆菌表达系统可用于大规模生产重组蛋白质,如重组人胰岛素等。
2.蛋白质结构和功能研究:通过大肠杆菌表达系统,可以表达和纯化具有特定结构和功能的蛋白质,用于研究其结构和功能。
3.抗原制备:大肠杆菌表达系统可以用于表达和纯化目标蛋白质,作为疫苗的抗原。
4.酶的生产:利用大肠杆菌表达系统表达酶,可以实现酶的大规模生产,用于工业生产和生物催化等领域。
总结大肠杆菌表达系统是一种高效、经济且易于操作的蛋白质表达系统。
pET-32c(+)大肠杆菌表达载体说明
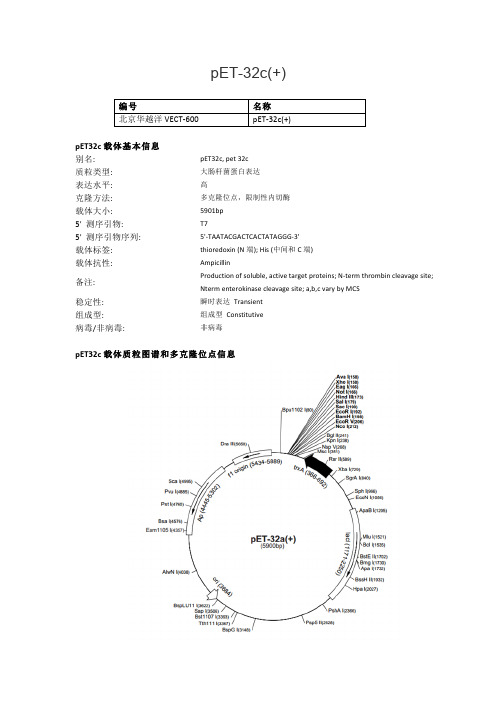
pET-32c(+)编号 名称北京华越洋VECT-‐600 pET-‐32c(+)pET32c载体基本信息别名: pET32c, p et 32c质粒类型: 大肠杆菌蛋白表达表达水平: 高克隆方法: 多克隆位点,限制性内切酶载体大小: 5901bp5' 测序引物: T75' 测序引物序列: 5'-‐TAATACGACTCACTATAGGG-‐3'载体标签: thioredoxin (N端); H is (中间和C端) 载体抗性: Ampicillin备注: Production o f s oluble, a ctive t arget p roteins; N-‐term t hrombin c leavage s ite; Nterm e nterokinase c leavage s ite; a,b,c v ary b y M CS稳定性: 瞬时表达 Transient 组成型: 组成型 Constitutive 病毒/非病毒: 非病毒pET32c载体质粒图谱和多克隆位点信息pET32c载体简介The pET-‐32 series is designed for cloning and high-‐level expression of peptide sequences fused with t he 109aa T rx•Tag™ thioredoxin p rotein (1). C loning s ites a re a vailable f or p roducing f usion proteins a lso c ontaining c leavable H is•Tag® a nd S•Tag™ sequences f or d etection a nd p urification. Unique sites are shown on the circle map. Note that the sequence is numbered by the pBR322 convention, so the T7 expression region is reversed on the circle map. The cloning/expression region of the coding strand transcribed by T7 RNA polymerase is shown below. The f1 origin is oriented s o t hat i nfection w ith h elper p hage w ill p roduce v irions c ontaining s ingle-‐stranded D NA that corresponds to the coding strand. Therefore, single-‐stranded sequencing should be performed u sing t he T7 t erminator p rimer.pET32c载体序列ORIGIN1 ATCCGGATAT AGTTCCTCCT TTCAGCAAAA AACCCCTCAA GACCCGTTTA GAGGCCCCAA 61 GGGGTTATGC TAGTTATTGC TCAGCGGTGG CAGCAGCCAA CTCAGCTTCC TTTCGGGCTT 121 TGTTAGCAGC CGGATCTCAG TGGTGGTGGT GGTGGTGCTC GAGTGCGGCC GCAAGCTTGT 181 CGACGGAGCT CGAATTCGGA TCCACAGATA TCCCATGGCC TTGTCGTCGT CGTCGGTACC 241 CAGATCTGGG CTGTCCATGT GCTGGCGTTC GAATTTAGCA GCAGCGGTTT CTTTCATACC 301 AGAACCGCGT GGCACCAGAC CAGAAGAATG ATGATGATGA TGGTGCATAT GGCCAGAACC 361 AGAACCGGCC AGGTTAGCGT CGAGGAACTC TTTCAACTGA CCTTTAGACA GTGCACCCAC 421 TTTGGTTGCC GCCACTTCAC CGTTTTTGAA CAGCAGCAGA GTCGGGATAC CACGGATGCC481 ATATTTCGGC GCAGTGCCAG GGTTTTGATC GATGTTCAGT TTTGCAACGG TCAGTTTGCC541 CTGATATTCG TCAGCGATTT CATCCAGAAT CGGGGCGATC ATTTTGCACG GACCGCACCA 601 CTCTGCCCAG AAATCGACGA GGATCGCCCC GTCCGCTTTG AGTACATCCG TGTCAAAACT 661 GTCGTCAGTC AGGTGAATAA TTTTATCGCT CATATGTATA TCTCCTTCTT AAAGTTAAAC 721 AAAATTATTT CTAGAGGGGA ATTGTTATCC GCTCACAATT CCCCTATAGT GAGTCGTATT 781 AATTTCGCGG GATCGAGATC GATCTCGATC CTCTACGCCG GACGCATCGT GGCCGGCATC 841 ACCGGCGCCA CAGGTGCGGT TGCTGGCGCC TATATCGCCG ACATCACCGA TGGGGAAGAT 901 CGGGCTCGCC ACTTCGGGCT CATGAGCGCT TGTTTCGGCG TGGGTATGGT GGCAGGCCCC 961 GTGGCCGGGG GACTGTTGGG CGCCATCTCC TTGCATGCAC CATTCCTTGC GGCGGCGGTG 1021 CTCAACGGCC TCAACCTACT ACTGGGCTGC TTCCTAATGC AGGAGTCGCA TAAGGGAGAG 1081 CGTCGAGATC CCGGACACCA TCGAATGGCG CAAAACCTTT CGCGGTATGG CATGATAGCG 1141 CCCGGAAGAG AGTCAATTCA GGGTGGTGAA TGTGAAACCA GTAACGTTAT ACGATGTCGC 1201 AGAGTATGCC GGTGTCTCTT ATCAGACCGT TTCCCGCGTG GTGAACCAGG CCAGCCACGT 1261 TTCTGCGAAA ACGCGGGAAA AAGTGGAAGC GGCGATGGCG GAGCTGAATT ACATTCCCAA 1321 CCGCGTGGCA CAACAACTGG CGGGCAAACA GTCGTTGCTG ATTGGCGTTG CCACCTCCAG 1381 TCTGGCCCTG CACGCGCCGT CGCAAATTGT CGCGGCGATT AAATCTCGCG CCGATCAACT 1441 GGGTGCCAGC GTGGTGGTGT CGATGGTAGA ACGAAGCGGC GTCGAAGCCT GTAAAGCGGC 1501 GGTGCACAAT CTTCTCGCGC AACGCGTCAG TGGGCTGATC ATTAACTATC CGCTGGATGA 1561 CCAGGATGCC ATTGCTGTGG AAGCTGCCTG CACTAATGTT CCGGCGTTAT TTCTTGATGT 1621 CTCTGACCAG ACACCCATCA ACAGTATTAT TTTCTCCCAT GAAGACGGTA CGCGACTGGG 1681 CGTGGAGCAT CTGGTCGCAT TGGGTCACCA GCAAATCGCG CTGTTAGCGG GCCCATTAAG 1741 TTCTGTCTCG GCGCGTCTGC GTCTGGCTGG CTGGCATAAA TATCTCACTC GCAATCAAAT 1801 TCAGCCGATA GCGGAACGGG AAGGCGACTG GAGTGCCATG TCCGGTTTTC AACAAACCAT 1861 GCAAATGCTG AATGAGGGCA TCGTTCCCAC TGCGATGCTG GTTGCCAACG ATCAGATGGC 1921 GCTGGGCGCA ATGCGCGCCA TTACCGAGTC CGGGCTGCGC GTTGGTGCGG ACATCTCGGT 1981 AGTGGGATAC GACGATACCG AAGACAGCTC ATGTTATATC CCGCCGTTAA CCACCATCAA 2041 ACAGGATTTT CGCCTGCTGG GGCAAACCAG CGTGGACCGC TTGCTGCAAC TCTCTCAGGG 2101 CCAGGCGGTG AAGGGCAATC AGCTGTTGCC CGTCTCACTG GTGAAAAGAA AAACCACCCT 2161 GGCGCCCAAT ACGCAAACCG CCTCTCCCCG CGCGTTGGCC GATTCATTAA TGCAGCTGGC 2221 ACGACAGGTT TCCCGACTGG AAAGCGGGCA GTGAGCGCAA CGCAATTAAT GTAAGTTAGC 2281 TCACTCATTA GGCACCGGGA TCTCGACCGA TGCCCTTGAG AGCCTTCAAC CCAGTCAGCT 2341 CCTTCCGGTG GGCGCGGGGC ATGACTATCG TCGCCGCACT TATGACTGTC TTCTTTATCA 2401 TGCAACTCGT AGGACAGGTG CCGGCAGCGC TCTGGGTCAT TTTCGGCGAG GACCGCTTTC 2461 GCTGGAGCGC GACGATGATC GGCCTGTCGC TTGCGGTATT CGGAATCTTG CACGCCCTCG 2521 CTCAAGCCTT CGTCACTGGT CCCGCCACCA AACGTTTCGG CGAGAAGCAG GCCATTATCG 2581 CCGGCATGGC GGCCCCACGG GTGCGCATGA TCGTGCTCCT GTCGTTGAGG ACCCGGCTAG 2641 GCTGGCGGGG TTGCCTTACT GGTTAGCAGA ATGAATCACC GATACGCGAG CGAACGTGAA 2701 GCGACTGCTG CTGCAAAACG TCTGCGACCT GAGCAACAAC ATGAATGGTC TTCGGTTTCC 2761 GTGTTTCGTA AAGTCTGGAA ACGCGGAAGT CAGCGCCCTG CACCATTATG TTCCGGATCT 2821 GCATCGCAGG ATGCTGCTGG CTACCCTGTG GAACACCTAC ATCTGTATTA ACGAAGCGCT 2881 GGCATTGACC CTGAGTGATT TTTCTCTGGT CCCGCCGCAT CCATACCGCC AGTTGTTTAC 2941 CCTCACAACG TTCCAGTAAC CGGGCATGTT CATCATCAGT AACCCGTATC GTGAGCATCC 3001 TCTCTCGTTT CATCGGTATC ATTACCCCCA TGAACAGAAA TCCCCCTTAC ACGGAGGCAT 3061 CAGTGACCAA ACAGGAAAAA ACCGCCCTTA ACATGGCCCG CTTTATCAGA AGCCAGACAT 3121 TAACGCTTCT GGAGAAACTC AACGAGCTGG ACGCGGATGA ACAGGCAGAC ATCTGTGAAT3181 CGCTTCACGA CCACGCTGAT GAGCTTTACC GCAGCTGCCT CGCGCGTTTC GGTGATGACG 3241 GTGAAAACCT CTGACACATG CAGCTCCCGG AGACGGTCAC AGCTTGTCTG TAAGCGGATG 3301 CCGGGAGCAG ACAAGCCCGT CAGGGCGCGT CAGCGGGTGT TGGCGGGTGT CGGGGCGCAG 3361 CCATGACCCA GTCACGTAGC GATAGCGGAG TGTATACTGG CTTAACTATG CGGCATCAGA 3421 GCAGATTGTA CTGAGAGTGC ACCATATATG CGGTGTGAAA TACCGCACAG ATGCGTAAGG 3481 AGAAAATACC GCATCAGGCG CTCTTCCGCT TCCTCGCTCA CTGACTCGCT GCGCTCGGTC 3541 GTTCGGCTGC GGCGAGCGGT ATCAGCTCAC TCAAAGGCGG TAATACGGTT ATCCACAGAA 3601 TCAGGGGATA ACGCAGGAAA GAACATGTGA GCAAAAGGCC AGCAAAAGGC CAGGAACCGT 3661 AAAAAGGCCG CGTTGCTGGC GTTTTTCCAT AGGCTCCGCC CCCCTGACGA GCATCACAAA 3721 AATCGACGCT CAAGTCAGAG GTGGCGAAAC CCGACAGGAC TATAAAGATA CCAGGCGTTT 3781 CCCCCTGGAA GCTCCCTCGT GCGCTCTCCT GTTCCGACCC TGCCGCTTAC CGGATACCTG 3841 TCCGCCTTTC TCCCTTCGGG AAGCGTGGCG CTTTCTCATA GCTCACGCTG TAGGTATCTC 3901 AGTTCGGTGT AGGTCGTTCG CTCCAAGCTG GGCTGTGTGC ACGAACCCCC CGTTCAGCCC 3961 GACCGCTGCG CCTTATCCGG TAACTATCGT CTTGAGTCCA ACCCGGTAAG ACACGACTTA 4021 TCGCCACTGG CAGCAGCCAC TGGTAACAGG ATTAGCAGAG CGAGGTATGT AGGCGGTGCT 4081 ACAGAGTTCT TGAAGTGGTG GCCTAACTAC GGCTACACTA GAAGGACAGT ATTTGGTATC 4141 TGCGCTCTGC TGAAGCCAGT TACCTTCGGA AAAAGAGTTG GTAGCTCTTG ATCCGGCAAA 4201 CAAACCACCG CTGGTAGCGG TGGTTTTTTT GTTTGCAAGC AGCAGATTAC GCGCAGAAAA 4261 AAAGGATCTC AAGAAGATCC TTTGATCTTT TCTACGGGGT CTGACGCTCA GTGGAACGAA 4321 AACTCACGTT AAGGGATTTT GGTCATGAGA TTATCAAAAA GGATCTTCAC CTAGATCCTT 4381 TTAAATTAAA AATGAAGTTT TAAATCAATC TAAAGTATAT ATGAGTAAAC TTGGTCTGAC 4441 AGTTACCAAT GCTTAATCAG TGAGGCACCT ATCTCAGCGA TCTGTCTATT TCGTTCATCC 4501 ATAGTTGCCT GACTCCCCGT CGTGTAGATA ACTACGATAC GGGAGGGCTT ACCATCTGGC 4561 CCCAGTGCTG CAATGATACC GCGAGACCCA CGCTCACCGG CTCCAGATTT ATCAGCAATA 4621 AACCAGCCAG CCGGAAGGGC CGAGCGCAGA AGTGGTCCTG CAACTTTATC CGCCTCCATC 4681 CAGTCTATTA ATTGTTGCCG GGAAGCTAGA GTAAGTAGTT CGCCAGTTAA TAGTTTGCGC 4741 AACGTTGTTG CCATTGCTGC AGGCATCGTG GTGTCACGCT CGTCGTTTGG TATGGCTTCA 4801 TTCAGCTCCG GTTCCCAACG ATCAAGGCGA GTTACATGAT CCCCCATGTT GTGCAAAAAA 4861 GCGGTTAGCT CCTTCGGTCC TCCGATCGTT GTCAGAAGTA AGTTGGCCGC AGTGTTATCA 4921 CTCATGGTTA TGGCAGCACT GCATAATTCT CTTACTGTCA TGCCATCCGT AAGATGCTTT 4981 TCTGTGACTG GTGAGTACTC AACCAAGTCA TTCTGAGAAT AGTGTATGCG GCGACCGAGT 5041 TGCTCTTGCC CGGCGTCAAT ACGGGATAAT ACCGCGCCAC ATAGCAGAAC TTTAAAAGTG 5101 CTCATCATTG GAAAACGTTC TTCGGGGCGA AAACTCTCAA GGATCTTACC GCTGTTGAGA 5161 TCCAGTTCGA TGTAACCCAC TCGTGCACCC AACTGATCTT CAGCATCTTT TACTTTCACC 5221 AGCGTTTCTG GGTGAGCAAA AACAGGAAGG CAAAATGCCG CAAAAAAGGG AATAAGGGCG 5281 ACACGGAAAT GTTGAATACT CATACTCTTC CTTTTTCAAT ATTATTGAAG CATTTATCAG 5341 GGTTATTGTC TCATGAGCGG ATACATATTT GAATGTATTT AGAAAAATAA ACAAATAGGG 5401 GTTCCGCGCA CATTTCCCCG AAAAGTGCCA CCTGAAATTG TAAACGTTAA TATTTTGTTA 5461 AAATTCGCGT TAAATTTTTG TTAAATCAGC TCATTTTTTA ACCAATAGGC CGAAATCGGC 5521 AAAATCCCTT ATAAATCAAA AGAATAGACC GAGATAGGGT TGAGTGTTGT TCCAGTTTGG 5581 AACAAGAGTC CACTATTAAA GAACGTGGAC TCCAACGTCA AAGGGCGAAA AACCGTCTAT 5641 CAGGGCGATG GCCCACTACG TGAACCATCA CCCTAATCAA GTTTTTTGGG GTCGAGGTGC 5701 CGTAAAGCAC TAAATCGGAA CCCTAAAGGG AGCCCCCGAT TTAGAGCTTG ACGGGGAAAG 5761 CCGGCGAACG TGGCGAGAAA GGAAGGGAAG AAAGCGAAAG GAGCGGGCGC TAGGGCGCTG5821 GCAAGTGTAG CGGTCACGCT GCGCGTAACC ACCACACCCG CCGCGCTTAA TGCGCCGCTA 5881 CAGGGCGCGT CCCATTCGCC A//其他大肠杆菌表达载体:pBV221 ptdTomato pET-‐52b(+) pAmCyanpDsRed-‐Express2 pBV220 pCold-‐GST pColdS-‐SUMOpCold T F pCold I V pCold I II pCold I IpCold I pE-‐SUMO pCold-‐ProS2 pBAD102/D-‐TOPOpBAD202/D-‐TOPO pACYC184 pBAD/Thio-‐TOPO pBad/Myc-‐His CpBad/Myc-‐His B pBad/Myc-‐His A pBad/His C pBad/His BpBad/His A pBAD-‐TOPO pET-‐23b(+) pET-‐23a(+)pET-‐23c(+) pET-‐23(+) pET-‐12b(+) pET-‐12c(+)pET-‐12a(+) pET-‐11b(+) pET-‐11a(+) pET-‐11c(+)pBad24 pQE-‐82L pQE-‐81L pQE-‐80LpQE-‐32 pQE-‐9 pQE-‐16 pQE-‐31pQE-‐60 pQE-‐70 pQE-‐40 pET-‐51b(+)pET-‐50b(+) pET-‐49b(+) pET-‐48b(+) pET-‐47b(+)pET-‐26b(+) pET-‐32a(+) pET-‐21b(+) pET-‐22b(+)pET-‐14b pET-‐16b pET-‐15b pET-‐19bpET-‐20b(+) pET-‐21d(+) pET-‐21c(+) pET-‐21b(+)pET-‐21a(+) pET-‐24a(+) pET-‐24d(+) pET-‐25b(+)pET-‐27b(+) pET-‐28a(+) pET-‐30a(+) pET-‐42a(+)pET-‐43.1c(+) pET-‐43.1b(+) pET-‐43.1a(+) pET-‐44a(+)pET-‐44c(+) pET-‐46 E K/LIC pET-‐37b(+) pTrcHis2 CpTrcHis2 B pTrcHis2 A pET303/CT-‐His pET302/NT-‐HispRSET-‐CFP pRSET-‐EmGFP pRSET-‐BFP pGFPuvpET300/NT-‐DEST pET301/CT-‐DEST pGEM-‐T pBad43pGEX-‐4T-‐3 pGEX-‐5X-‐2 pBlueScript S K(+) pG-‐Tf2pG-‐KJE8 pGro7 pET-‐SUMO pSE380pET-‐17b pET102/D-‐TOPO pCDFDuet-‐1 pMAL-‐p5xpTf16 pET-‐28c(+) pBluescript I I S K(+) pET-‐30b(+)pSUMO pProEX H Tc pProEX H Tb pProEX H TapKD3 pKD13 pKD46 pTYB1pTYB2 pTWIN2 pBluescript I I K S(-‐) pTYB12pMAL-‐p5e pACYCDuet-‐1 pEGM-‐11ZF(+) pEGM-‐7ZF(+)PinPoint X a-‐3 PinPoint X a-‐2 PinPoint X a-‐1 pSP73pSP64 pTWIN1 pTYB11 pTXB1pET-‐5b(+) pBad/gIII C pBad/gIII B pBad/gIII ApET-‐5a(+) pMal-‐p4X pMal-‐p2G pkk223-‐3pkk232-‐8 pCYB1 pEZZ18 pBAD18pMAL-‐c5x pMal-‐p2E pMal-‐p2X pET-‐44 E K/LICpET-‐43.1 E K/LIC pET-‐41 E K/LIC pMal-‐c4X pTrcHis BpET-‐31b(+) pET-‐3b(+) pET-‐41a(+) pGEX-‐3XpGEX-‐4T-‐2 pETDuet-‐1 pGEX-‐4T-‐1 pTrc99a pET-‐28b(+) pET-‐His pALEX a,b,c pACYC177 pBR322 pKD4 pKD20 pMXB10 pEcoli-‐6xHN-‐GFPuv pKJE7 pRSET B pGEX-‐KG pGEX-‐2T pRSFDuet-‐1 pCOLADuet-‐1 pTrcHis C pTrcHis A pET-‐41b(+) pET-‐42b(+) pET-‐3a(+) pGEX-‐6P-‐3 pGEX-‐6P-‐2 pGEX-‐6P-‐1 pGEX-‐5X-‐3 pGEX-‐5X-‐1 pGEX-‐2TK pRSET A pMal-‐c2G pMal-‐c2E pMal-‐c2X pRSET C pQE-‐30pET-‐45b(+) pET-‐44b(+) pET-‐42c(+) pET-‐41c(+) pET-‐40b(+) pET-‐33b(+) pET-‐39b(+) pET-‐32 E K/LIC pET-‐32 X a/LIC pET-‐32c(+) pET-‐32b(+) pET-‐30 X a/LIC pET-‐30 E K/LIC pET-‐30c(+) pET-‐29c(+) pET-‐29b(+) pET-‐29a(+) pET-‐24c(+) pET-‐24b(+) pET-‐24(+) pET-‐23d(+) pET-‐11d(+) pBad33。
基因工程-32大肠杆菌克隆载体

技术创新
随着技术的不断进步,基因工程32大肠杆菌克隆载体的效率和安全性将得到提高。法规完善
随着基因工程-32大肠杆菌克隆载 体的应用范围扩大,相关法规和 监管体系也将逐步完善,为技术 的健康发展提供保障。
THANKS FOR WATCHING
感谢您的观看
利用基因工程手段改造微生物,提高微生物对污染物的降解能力,实现对环境污染的生 物修复。
生物监测
通过基因工程技术构建具有特定功能的微生物,实现对环境污染物的实时监测和预警。
05
基因工程-32大肠杆菌克 隆载体的挑战与前景
安全性问题
潜在的健康风险
基因工程-32大肠杆菌克隆载体可能含有对人体有害的基因或基因 片段,导致基因突变或产生新的疾病。
环境影响
基因工程-32大肠杆菌克隆载体可能对环境造成破坏,如基因污染、 生态失衡等。
长期影响未知
由于基因工程-32大肠杆菌克隆载体的应用时间较短,其长期对人 体和环境的影响尚未完全明确。
伦理问题
01
02
03
人类基因干预
基因工程-32大肠杆菌克 隆载体涉及到对人类基因 的干预,可能引发伦理争 议。
基因歧视
1990年代
人类基因组计划启动,推动了基因组学和功能基因组学的研究。
21世纪
基因编辑技术的发展,如CRISPR-Cas9系统,使得对DNA的精确编辑成为可能。
基因工程的应用
医药领域
用于药物研发、疾病诊断和治疗,如胰岛素、 生长激素和肿瘤免疫治疗等。
工业领域
用于生物燃料、生物塑料和生物酶的生产, 以及环境污染的生物治理等。
基因工程-32大肠杆菌克 隆载体的应用可能导致基 因歧视现象的出现,对某 些人群造成不公平待遇。
大肠杆菌蛋白表达策略表达系统与表达载体

大肠杆菌表达系统与蛋白表达纯化大肠杆菌表达系统遗传背景清楚,目的基因表达水平高,培养周期短,抗污染能力强等特点,是分子生物学研究和生物技术产业化发展进程中的重要工具。
因此熟练掌握并运用大肠杆菌表达系统的基本原理和常规操作是对每一个研究生来说是非常必要的。
本章节介绍了实验室常用的大肠杆菌表达系统的构成特点,归纳了利用大肠杆菌表达系统纯化重组蛋白的基本流程和详细操作步骤,并且结合笔者的操作经验,总结了初学者在操作过程中可能遇到的问题和解决策略。
大肠杆菌表达系统的选择与构建表达载体的选择根据启动子的不同这些载体大致可以分为热诱导启动子,如λPL,cspA等和另外一类就是广泛使用的IPTG 诱导的启动子,如lac,trc,tac,T5/lac operator,T5/lac operator等。
根据表达蛋白质的类型可分为单纯表达载体和融合表达载体。
融合表达是在目标蛋白的N端或C端添加特殊的序列,以提高蛋白的可溶性,促进蛋白的正确折叠,实现目的蛋白的快速亲和纯化,或者实现目标蛋白的表达定位。
常用的用于亲和纯化融合标签包括Poly-Arg,Poly-His,Strep-TagⅡ,S-tag,MBP等。
其中His-Tag和GST-Tag 是目前使用最多的。
His Tag大多数是连续的六个His融合于目标蛋白的N端或C端,通过His与金属离子:Cu2+>Fe2+>Zn2+>Ni2+的螯合作用而实现亲和纯化,其中Ni2+是目前使用最广泛的。
His标签具有较小的分子量,融合于目标蛋白的N端和C端不影响目标蛋白的活性,因此纯化过程中大多不需要去除。
目前常使用的表达载体主要是由Novagen提供的pET系列和Qiagen公司提供的pQE系列。
除了His标签外,还原性谷胱甘肽S-转移酶是另一种实验室常用的融合标签。
它可以通过还原性谷胱甘肽琼脂糖亲和层析而快速纯化。
此外,与His相比,GST很多时候能够促进目标蛋白的正确折叠,提高目标蛋白表达的可溶性,因此,对于那些用his标签表达易形成包涵体的蛋白,可以尝试用GST融合表达来改进。
大肠杆菌表达载体,构建方法及其应用

大肠杆菌表达载体,构建方法及其应用大肠杆菌(Escherichia coli)是一种常见的肠道细菌,也是常用的表达宿主。
利用大肠杆菌表达载体,可以将目标基因导入大肠杆菌中进行表达,从而产生大量目标蛋白。
本文将介绍大肠杆菌表达载体的构建方法及其应用。
一、大肠杆菌表达载体的构建方法1. 选择适合的表达载体:常见的大肠杆菌表达载体包括pET系列、pBAD系列和pGEX系列等。
选择适合的表达载体主要考虑载体的复制起源、选择标记、表达调控元件和蛋白纯化标记等因素。
2. 克隆目标基因:将目标基因通过PCR扩增得到目标基因片段,然后利用限制性内切酶切割载体和目标基因片段,将目标基因片段插入载体中。
3. 进行质粒转化:将构建好的重组质粒导入大肠杆菌中。
可以通过化学法、电穿孔法或热冲击法等方法将质粒导入大肠杆菌中。
4. 筛选与鉴定:经过转化后,利用选择性培养基筛选出含有目标基因的重组大肠杆菌。
通过PCR、限制性酶切和测序等方法对重组菌株进行鉴定,确认目标基因已经成功插入载体。
二、大肠杆菌表达载体的应用1. 蛋白表达:利用大肠杆菌表达载体,可以将目标基因导入大肠杆菌中进行表达,从而大量产生目标蛋白。
这对于研究蛋白的结构、功能及其在生物学过程中的作用具有重要意义。
2. 蛋白纯化:大肠杆菌表达载体常含有蛋白纯化标记,如His标签、GST标签等。
通过这些标记,可以方便地对目标蛋白进行纯化和检测,为后续研究提供了便利。
3. 蛋白互作研究:大肠杆菌表达载体可以用于蛋白互作研究。
通过将目标蛋白与其他蛋白共同表达,可以研究它们之间的相互作用关系,揭示生物学过程中的分子机制。
4. 疫苗研究:大肠杆菌表达载体可以用于疫苗研究。
将目标抗原基因导入大肠杆菌中进行表达,可以获得大量的抗原蛋白,从而用于疫苗的开发和研究。
5. 酶工程:大肠杆菌表达载体可以用于酶工程研究。
通过将目标酶基因导入大肠杆菌中表达,可以进行酶的产量优化、酶的工艺改造等研究,提高酶的生产效率和稳定性。
大肠杆菌表达载体

pGEX-1T—凝血酶
pGEX-2T---凝血酶
pGEX-3T---X因子
位相载体
西南大学生物技术专业 基因工程 14
分泌型融合表达载体----pEZZ18
西南大学生物技术专业 基因工程
15
分泌型表达载体----pINIII-ompA1
西南大学生物技术专业 基因工程
16
四、表达产物的纯化
1 、包涵体 (inclusion body) 的纯化:许多情况下表达产物 在细胞内形成不溶的颗粒状包涵体,可通过机械法、冻融 法、超声波处理等破碎细胞,离心收集包涵体,洗涤去除 杂蛋白,用盐酸胍、尿素和 SDS 溶解包涵体,再通过一定 的法使蛋白质折叠。 有的经上法得到后仍然有活性,有的蛋白一旦形成包涵体后 就没有活性了,但可作为抗原。 2、可溶性蛋白的纯化:表达的蛋白可以细胞内解物的上清部分用于 纯化目标蛋白,甚至可直接作为粗酶液进行生化反应。
西南大学生物技术专业 基因工程 7
3 、内含肽表达载体:如 NEB 公司的 Impact-Twin 系 统,将目的蛋白放在两个可自裂解的内含肽 (intein)中间,在得到融合蛋白以后不通过蛋白 酶消解、只需要调节pH值等条件就将标签蛋白切 除。 4 、分泌表达载体:产物可跨膜分泌至胞周间隙, 可避免受细胞内蛋白酶的降解,或使其正确折叠, 或去除N-端甲硫氨酸,以维护活性。 信号肽(signal peptide) 有碱性磷酸酶信号肽、蛋 白质 A 信号肽(如 Amersham 公司的 pEZZ18 系统)。
西南大学生物技术专业 基因工程
23
2 ) 植 物 Ac-Ds 转 座 子 双 因 子 插 入 突 变 : 玉 米 Ac (activator) 因子是一个转座子,含有完整的转 座酶, Ds (dissociation) 是 Ac 缺失转座酶基因 的缺失体,但具两端的反向重复序列。
外源蛋白在大肠杆菌中的表达

外源蛋白在大肠杆菌中的表达一、引言外源蛋白是指不属于宿主生物体自身的蛋白质,通常是由其他生物体合成的蛋白质。
在大肠杆菌中表达外源蛋白已经成为了基因工程和生物技术领域中的一个重要研究方向。
本文将从大肠杆菌表达外源蛋白的原理、方法、策略等方面进行详细阐述。
二、原理1. 大肠杆菌表达系统原理大肠杆菌表达系统是指利用大肠杆菌作为宿主细胞,通过转化外源DNA进入细胞,使其在细胞内得到表达并产生相应的蛋白质。
这个系统包括三个部分:载体、宿主细胞和诱导剂。
2. 质粒载体质粒载体是指一种环状DNA分子,可以携带外源DNA序列并在大肠杆菌中进行复制和表达。
常用的载体有pUC19、pET28a等。
3. 宿主细胞宿主细胞是指被转化了质粒载体的大肠杆菌细胞。
常用的宿主细胞有BL21(DE3)等。
4. 诱导剂诱导剂是指在宿主细胞中引发表达外源蛋白的物质。
常用的诱导剂有IPTG、L-arabinose等。
三、方法1. 克隆外源DNA序列到质粒载体中将外源DNA序列克隆到质粒载体中,形成表达载体。
常用的方法有限制性酶切和连接法、PCR扩增法等。
2. 将表达载体转化到宿主细胞中将表达载体通过热激转化或电转化等方法导入到宿主细胞中,使其在细胞内进行复制和表达。
3. 选择正常表达的克隆通过筛选,选择出正常表达目标蛋白的克隆。
常用的筛选方法有PCR 检测、Western blotting等。
4. 诱导表达目标蛋白在选定的克隆中加入适量的诱导剂,使其开始表达目标蛋白。
通常在温度、时间、浓度等方面进行调节,以得到最佳效果。
四、策略1. 选择合适的载体和宿主细胞根据需要表达的外源蛋白的不同,选择适合的载体和宿主细胞。
例如,如果需要表达带有His标签的蛋白质,可以选择pET28a载体和BL21(DE3)宿主细胞。
2. 优化表达条件通过调节温度、时间、浓度等参数来优化表达条件,以提高目标蛋白的表达量和纯度。
3. 联合表达将多个外源蛋白基因克隆到同一个载体中,使其在同一宿主细胞中进行联合表达。
pET-30a大肠杆菌表达载体,质粒,菌株

pET-30a大肠杆菌表达载体, pET-30a质粒,菌株?编码?名称规格保存条件北京华越洋生物GHT-20MG pET-30a20mg-20℃,避光,12个月北京华越洋生物GHT-100mg pET-30a100mg-20℃,避光,12个月pET-30a大肠杆菌表达载体, pET-30a质粒,菌株载体信息:? ? ? ? ? ?启动子:T7/lac? ? ? ? ? ?复制子:pBR322 ori? ? ? ? ? ?pET-30a大肠杆菌表达载体, pET-30a质粒,菌株? ? ? ? ? ?载体别名:pET-30a,pET30a,pET 30a? ? ? ? ? ?载体分类:大肠杆菌表达载体? ? ? ? ? ?载体大小:5422 bp? ? ? ? ? ?载体抗性:卡那霉素Kan? ? ? ? ? ?载体标签:N-His, N-S, N-Thrombin, N-EK, C-His? ? ? ? ? ?筛选标记:? ? ? ? ? ?克隆菌株:DH5α? ? ? ? ? ?表达宿主:BL21 (DE3)? ? ? ? ? ?培养条件:37℃,LB? ? ? ? ? ?5' 测序引物:T7:TAATACGACTCACTATAGGG? ? ? ? ? ?3' 测序引物:T7-Ter:TGCTAGTTATTGCTCAGCGG? ? ? ? ? 备注:pET-30a大肠杆菌表达载体, pET-30a质粒,菌株载体简介:? ? ? ? ? ?The maps for pET-30b(+) and pET-30c(+) are the same as pET-30a(+) (shown) with the following exceptions: pET-30b(+) is a 5421bp plasmid; subtract 1bp from each site beyond BamH I at 198. pET-30c(+) is a 5423bp plasmid; add 1bp to each site beyond BamH I at 198. The pET-30a-c(+) vectors carry an N-terminal His?Tag?/thrombin/S?Tag?/enterokinase configuration plus an optional C-terminal His?Tag sequence. Unique sites are shown on the circle map. Note that the sequence is numbered by the pBR322 convention, so the T7 expression region is reversed on the circular map. The cloning/expression region of the coding strand transcribed by T7 RNA polymerase is shown below.?操作说明:? ? ??? ? ?1.请使用华越洋生物定制开箱器打开外包装;? ? ? ? ? ?2.该产品包含20μl质粒,可保存在-20℃冰箱中;? ? ? ? ? ?3.取1μl质粒转化进合适的感受态中;? ? ? ? ? ?4.大量提取质粒并保存适量的甘油菌,置于-80℃长期保藏;? ? ?。
人附睾RNase10基因在大肠杆菌中的表达

人附睾RNase10基因在大肠杆菌中的表达摘要:以人附睾cDNA为模板,PCR扩增RNase10基因,构建pET32b(+)-RNase10体外表达载体,转化大肠杆菌(Escherichia coli)感受态细胞DH5α,挑选阳性克隆,提取质粒转化BL21(DE3),IPTG诱导RNase10基因的表达,采用SDS-PAGE法检测表达产物,结果显示融合蛋白分子量为24 ku,与预期相符,表明人附睾RNase10基因在大肠杆菌中成功表达。
关键词:人附睾RNase10基因;大肠杆菌(Escherichia coli);表达Expression of Human Epididymis RNase10 Gene in Escherichia coliAbstract:Using human epididymis cDNA as template,RNase10 gene was amplified and recombined into prokaryotic expression vector pET32b(+),which was constructed and transform ed into Escherichia coli DH5α. Plasmids were extracted from positive clones,and transformed into BL21(DE3). Furthermore,the protein expression of RNase10 was induced by IPTG. A band about 24 ku was detected by SDS-PAGE,showing that RNase10 of human epididymis was expressed successfully in cell of E. coli DH5α.Key words:RNase10 gene of human epididymis;Escherichia coli;expressionRNase A超家族(Ribonuclease A superfamily)是结构生物学与生物化学领域的研究热点,研究表明RNase A超家族的成员参与消化、血管生成及先天性免疫等多种生物过程[1]。
pet32a质粒说明书

pet32a质粒说明书简介pet32a质粒是一种常用的表达载体,广泛应用于分子生物学研究领域。
它具有较高的复制稳定性和表达效率,使其成为表达重组蛋白的理想选择。
质粒构建pet32a质粒由大小为5363个碱基对的环状DNA组成,包含多个重要的功能模块。
1.杀菌素抗性基因:pet32a质粒表达菌株对氨苄青霉素具有抗性,使得在菌落筛选和培养过程中能够有效避免非转化的细菌的生长。
2.转录起始子(T7 promoter):pet32a质粒使用强大的T7启动子驱动目标基因的转录,确保高效的基因表达。
3.编码序列:pet32a质粒包含了一段编码His-Tag(组氨酸标签)的DNA序列,该序列位于目标基因的N端或C端。
His-Tag是一个短肽序列,方便了对重组蛋白的纯化和检测。
此外,pet32a质粒还包含了截短的thioredoxin(TRX)基因,其中TRX能够促进重组蛋白的正确折叠,并提高可溶性表达的效率。
4.栅和Poly-His标签:pet32a质粒利用T7栅的序列将目标基因与TRX基因连接,同时在目标基因和His-Tag之间引入了Gly-Gly-Gly-Gly-Ser的多肽链,方便了酶切和纯化操作。
5.逆向引物结构:pet32a质粒提供了一个逆向引物结构,用于在克隆过程中的序列检查。
应用pet32a质粒作为一种常用的表达载体,被广泛应用于研究领域的多个方面。
1.表达重组蛋白:pet32a质粒的使用可以高效表达目标基因,并通过His-Tag标签实现简便的纯化过程。
这使得研究人员能够快速获取高纯度的重组蛋白,并用于进一步的功能研究、晶体学分析等。
2.蛋白结构和功能研究:pet32a质粒的TRX基因提供了一个促进蛋白正确折叠的环境,对于蛋白结构和功能的研究非常有帮助。
通过pet32a质粒表达的蛋白可以更好地保持其天然构象,并具有更高的活性。
3.蛋白亲和纯化:利用pet32a质粒表达的重组蛋白上的His-Tag标签,可以通过亲和层析技术快速、高效地纯化目标蛋白。
pet32a大小17

pet32a大小17pet32a是一种常见的载体,其大小为17kb。
它在分子生物学研究中具有广泛的应用。
本文将介绍pet32a的基本特点、构建原理及其在蛋白表达和纯化中的应用。
1. pet32a的基本特点pet32a是一种质粒载体,常用于大肠杆菌(E. coli)中的表达和纯化。
它具有以下基本特点:•大小合适:pet32a质粒的大小为17kb,适中而便于操作。
•多克隆位点:pet32a载体上含有多个限制酶切位点,便于插入目的基因。
•选择标记:pet32a含有大肠杆菌中常用的抗生素抗性基因,例如氨苄青霉素抗性基因(Ampicillin resistance gene),便于筛选正常转化的细胞。
•表达调控:pet32a采用了T7启动子,可以得到高效的蛋白表达。
2. pet32a的构建原理pet32a质粒的构建基于DNA重组技术,主要包括以下步骤:1.选择适当的限制酶:根据目的基因的序列,选择合适的限制酶切割质粒和目的基因。
2.酶切反应:将质粒和目的基因与相应的限制酶在适当的缓冲液条件下进行酶切反应,生成具有互补粘性末端的片段。
3.连接反应:将酶切后的质粒和目的基因片段进行连接反应,生成重组质粒。
4.转化宿主细胞:将重组质粒与大肠杆菌中的宿主细胞进行转化,得到重组细胞。
5.筛选正常细胞:使用抗生素筛选培养基对转化后的细胞进行筛选,得到带有pet32a质粒的正常细胞。
通过以上步骤,我们可以构建带有目的基因的pet32a载体。
3. pet32a在蛋白表达和纯化中的应用pet32a载体在蛋白表达和纯化中广泛应用,其主要原因是其较高的表达效率和纯化可行性。
以下是pet32a在这些领域的应用示例:•蛋白表达:pet32a中T7启动子的高效性质使其成为蛋白表达的理想载体。
目的基因可以通过限制酶切和连接反应与pet32a构建重组质粒后,经过充分培养和诱导表达,获得目的蛋白的高产量表达。
•蛋白纯化:pet32a载体具有His标签,可以轻松将目的蛋白纯化。
绿色荧光蛋白基因原核表达质粒pET32a-AcGFP1的构建及其在大肠杆菌中的高效表达

绿色荧光蛋白基因原核表达质粒 p E T 3 2 a A c G F P 1 的构建及其在大肠杆菌中的高效表达
, 2 # # 霍海龙1 ,赵 跃1 ,王 锐1,侯慧芳3,李卫真4, 张永云5,刘丽仙1,王 配4,霍金龙4
云南农业大学学报 J o u r n a l o f Y u n n a nA g r i c u l t u r a l U n i v e r s i t y , 2 0 1 2 , 2 7( 6 ) :8 2 0- 8 2 5 I S S N1 0 0 4- 3 9 0 X ;C O D E NY N D X A X D O I : 1 0 3 9 6 9 / j i s s n 1 0 0 4- 3 9 0 X( n ) 2 0 1 2 0 6 0 0 9
( 1 .D e p a r t m e n t o f H u s b a n d r ya n dV e t e r i n a r y ,Y u n n a nV o c a t i o n a l a n dT e c h n i c a l C o l l e g eo f A g r i c u l t u r e ,K u n m i n g 6 5 0 0 3 1 , C h i n a ;2 .F a c u l t yo f L i f eS c i e n c e ,Y u n n a nU n i v e r s i t y ,K u n m i n g 6 5 0 0 9 1 ,C h i n a ; 3 .B u r e a uo f A g r i c u l t u r a l M a c h i n e r yA d m i n i s t r a t i o no f X i n z h o uC i t y ,X i n z h o u0 3 4 0 0 0 ,C h i n a ; 4 .C o l l e g eo f A n i m a l S c i e n c ea n dT e c h n o l o g y ,Y u n n a nA g r i c u l t u r a l U n i v e r s i t y ,K u n m i n g 6 5 0 2 0 1 ,C h i n a ;5 .T e a c h i n g ,Y u n n a nA g r i c u l t u r a l U n i v e r s i t y ,K u n m i n g 6 5 0 2 0 1 ,C h i n a ) D e m o n s t r a t i o nC e n t e r o f t h eB a s i cE x p e r i m e n t s o f A g r i c u l t u r a l M a j o r s
重组人胶原蛋白肽在大肠杆菌中的高效表达

重组人胶原蛋白肽在大肠杆菌中的高效表达陈光;吴铭;王刚;孙旸【期刊名称】《吉林大学学报(医学版)》【年(卷),期】2011(37)4【摘要】目的:构建含有胶原蛋白基因的原核表达载体pET32a-CP6,并转入大肠杆菌BL21 (DE3)中进行高效表达,为获得大量可溶的胶原蛋白肽提供可靠依据.方法:将重组表达载体pET32a-CP6转化到大肠杆菌BL21中,以IPTG为诱导剂,对温度、接种量、诱导时机、IPTG诱导浓度等各种发酵参数进行优化,筛选高效表达的发酵条件,并通过Ni-NTA亲和层析进行纯化分析.结果:菌株在37℃、接种量为2%、摇瓶培养约2.5h后,加入终浓度为0.5mmol· L-1的IPTG,37℃诱导5h,收获的蛋白产量最高为31.52 mg· L-1,Western blotting分析该表达产物与人COL6A2单克隆抗体有特异结合能力.结论:优化工程菌高效表达重组人胶原蛋白,纯化重组蛋白.【总页数】5页(P656-660)【作者】陈光;吴铭;王刚;孙旸【作者单位】吉林农业大学生命科学院生物物理实验室,吉林长春130118;吉林农业大学生命科学院生物物理实验室,吉林长春130118;吉林农业大学生命科学院生物物理实验室,吉林长春130118;吉林农业大学生命科学院生物物理实验室,吉林长春130118【正文语种】中文【中图分类】Q78【相关文献】1.重组人野生型P53融合蛋白在大肠杆菌中的高效表达与纯化 [J], 苏先狮;龚国忠;肖新强;黄维亮;邓春明2.重组人载脂蛋白AI米兰变体在大肠杆菌中的高效表达 [J], 丁满生;马文峰;张梅芳;刘大涛;郭美锦;庄英萍;储炬;龚邦强3.重组人BAFF_(134~285)的克隆及在大肠杆菌中的高效表达 [J], 陈麟凤;何凤田;李蓉芬;钟小林4.重组人ZP3蛋白在大肠杆菌中的高效表达 [J], 叶志华;梁建庆5.重组人Flt3配体在大肠杆菌中的高效表达和生物学活性的鉴定 [J], 郁建锋;李大为;马弘冰;吴明媛;周璇;李敏;张学光因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
pET-32b(+)编号 载体名称北京华越洋生物VECT5030 pET-‐32b(+)pET32b载体基本信息别名: pET32b, p et 32b质粒类型: 大肠杆菌蛋白表达表达水平: 高克隆方法: 多克隆位点,限制性内切酶载体大小: 5899bp5' 测序引物: T7或者Trx-‐F5' 测序引物序列: T7: 5'-‐TAATACGACTCACTATAGGG-‐3';Trx-‐F: 5' T TCCTCGACGCTAACCTG 3' 载体标签: thioredoxin (N端); H is (中间和C端) 载体抗性: Ampicillin备注: Production of soluble, active target proteins; N-‐term thrombin cleavage s ite;Nterm e nterokinase c leavage s ite; a,b,c v ary b y M CS稳定性: 瞬时表达 Transient组成型: 组成型 Constitutive病毒/非病毒: 非病毒pET32b载体质粒图谱和多克隆位点信息pET32b载体简介The pET-‐32a-‐c series is designed for cloning and high-‐level expression of peptide sequences fused with the 109aa Trx•Tag™ thioredoxin protein (1). Cloning sites are available for producing fusion proteins also containing cleavable His•Tag® and S•Tag™ sequences for detection and purification. Unique sites are shown on the circle map. Note that t he s equence i s n umbered b y t he p BR322 c onvention, s o t he T7 e xpression r egion i s reversed on the circle map. The cloning/expression region of the coding strand transcribed by T7 RNA polymerase is shown below. The f1 origin is oriented so that infection with helper phage will produce virions containing single-‐stranded DNA that corresponds to the coding strand. Therefore, single-‐stranded sequencing should be performed u sing t he T7 t erminator p rimer .pET32b载体序列ORIGIN1 ATCCGGATAT AGTTCCTCCT TTCAGCAAAA AACCCCTCAA GACCCGTTTA GAGGCCCCAA 61 GGGGTTATGC TAGTTATTGC TCAGCGGTGG CAGCAGCCAA CTCAGCTTCC TTTCGGGCTT 121 TGTTAGCAGC CGGATCTCAG TGGTGGTGGT GGTGGTGCTC GAGTGCGGCC GCAAGCTTGT 181 CGACGGAGCT CGAATTCGGA TCCGATATCG CCATGGCCTT GTCGTCGTCG TCGGTACCCA 241 GATCTGGGCT GTCCATGTGC TGGCGTTCGA ATTTAGCAGC AGCGGTTTCT TTCATACCAG 301 AACCGCGTGG CACCAGACCA GAAGAATGAT GATGATGATG GTGCATATGG CCAGAACCAG 361 AACCGGCCAG GTTAGCGTCG AGGAACTCTT TCAACTGACC TTTAGACAGT GCACCCACTT 421 TGGTTGCCGC CACTTCACCG TTTTTGAACA GCAGCAGAGT CGGGATACCA CGGATGCCAT 481 ATTTCGGCGC AGTGCCAGGG TTTTGATCGA TGTTCAGTTT TGCAACGGTC AGTTTGCCCT 541 GATATTCGTC AGCGATTTCA TCCAGAATCG GGGCGATCAT TTTGCACGGA CCGCACCACT 601 CTGCCCAGAA ATCGACGAGG ATCGCCCCGT CCGCTTTGAG TACATCCGTG TCAAAACTGT 661 CGTCAGTCAG GTGAATAATT TTATCGCTCA TATGTATATC TCCTTCTTAA AGTTAAACAA 721 AATTATTTCT AGAGGGGAAT TGTTATCCGC TCACAATTCC CCTATAGTGA GTCGTATTAA 781 TTTCGCGGGA TCGAGATCGA TCTCGATCCT CTACGCCGGA CGCATCGTGG CCGGCATCAC 841 CGGCGCCACA GGTGCGGTTG CTGGCGCCTA TATCGCCGAC ATCACCGATG GGGAAGATCG 901 GGCTCGCCAC TTCGGGCTCA TGAGCGCTTG TTTCGGCGTG GGTATGGTGG CAGGCCCCGT 961 GGCCGGGGGA CTGTTGGGCG CCATCTCCTT GCATGCACCA TTCCTTGCGG CGGCGGTGCT 1021 CAACGGCCTC AACCTACTAC TGGGCTGCTT CCTAATGCAG GAGTCGCATA AGGGAGAGCG 1081 TCGAGATCCC GGACACCATC GAATGGCGCA AAACCTTTCG CGGTATGGCA TGATAGCGCC 1141 CGGAAGAGAG TCAATTCAGG GTGGTGAATG TGAAACCAGT AACGTTATAC GATGTCGCAG 1201 AGTATGCCGG TGTCTCTTAT CAGACCGTTT CCCGCGTGGT GAACCAGGCC AGCCACGTTT 1261 CTGCGAAAAC GCGGGAAAAA GTGGAAGCGG CGATGGCGGA GCTGAATTAC ATTCCCAACC 1321 GCGTGGCACA ACAACTGGCG GGCAAACAGT CGTTGCTGAT TGGCGTTGCC ACCTCCAGTC 1381 TGGCCCTGCA CGCGCCGTCG CAAATTGTCG CGGCGATTAA ATCTCGCGCC GATCAACTGG 1441 GTGCCAGCGT GGTGGTGTCG ATGGTAGAAC GAAGCGGCGT CGAAGCCTGT AAAGCGGCGG 1501 TGCACAATCT TCTCGCGCAA CGCGTCAGTG GGCTGATCAT TAACTATCCG CTGGATGACC 1561 AGGATGCCAT TGCTGTGGAA GCTGCCTGCA CTAATGTTCC GGCGTTATTT CTTGATGTCT 1621 CTGACCAGAC ACCCATCAAC AGTATTATTT TCTCCCATGA AGACGGTACG CGACTGGGCG 1681 TGGAGCATCT GGTCGCATTG GGTCACCAGC AAATCGCGCT GTTAGCGGGC CCATTAAGTT 1741 CTGTCTCGGC GCGTCTGCGT CTGGCTGGCT GGCATAAATA TCTCACTCGC AATCAAATTC1801 AGCCGATAGC GGAACGGGAA GGCGACTGGA GTGCCATGTC CGGTTTTCAA CAAACCATGC 1861 AAATGCTGAA TGAGGGCATC GTTCCCACTG CGATGCTGGT TGCCAACGAT CAGATGGCGC 1921 TGGGCGCAAT GCGCGCCATT ACCGAGTCCG GGCTGCGCGT TGGTGCGGAC ATCTCGGTAG 1981 TGGGATACGA CGATACCGAA GACAGCTCAT GTTATATCCC GCCGTTAACC ACCATCAAAC 2041 AGGATTTTCG CCTGCTGGGG CAAACCAGCG TGGACCGCTT GCTGCAACTC TCTCAGGGCC 2101 AGGCGGTGAA GGGCAATCAG CTGTTGCCCG TCTCACTGGT GAAAAGAAAA ACCACCCTGG 2161 CGCCCAATAC GCAAACCGCC TCTCCCCGCG CGTTGGCCGA TTCATTAATG CAGCTGGCAC 2221 GACAGGTTTC CCGACTGGAA AGCGGGCAGT GAGCGCAACG CAATTAATGT AAGTTAGCTC 2281 ACTCATTAGG CACCGGGATC TCGACCGATG CCCTTGAGAG CCTTCAACCC AGTCAGCTCC 2341 TTCCGGTGGG CGCGGGGCAT GACTATCGTC GCCGCACTTA TGACTGTCTT CTTTATCATG 2401 CAACTCGTAG GACAGGTGCC GGCAGCGCTC TGGGTCATTT TCGGCGAGGA CCGCTTTCGC 2461 TGGAGCGCGA CGATGATCGG CCTGTCGCTT GCGGTATTCG GAATCTTGCA CGCCCTCGCT 2521 CAAGCCTTCG TCACTGGTCC CGCCACCAAA CGTTTCGGCG AGAAGCAGGC CATTATCGCC 2581 GGCATGGCGG CCCCACGGGT GCGCATGATC GTGCTCCTGT CGTTGAGGAC CCGGCTAGGC 2641 TGGCGGGGTT GCCTTACTGG TTAGCAGAAT GAATCACCGA TACGCGAGCG AACGTGAAGC 2701 GACTGCTGCT GCAAAACGTC TGCGACCTGA GCAACAACAT GAATGGTCTT CGGTTTCCGT 2761 GTTTCGTAAA GTCTGGAAAC GCGGAAGTCA GCGCCCTGCA CCATTATGTT CCGGATCTGC 2821 ATCGCAGGAT GCTGCTGGCT ACCCTGTGGA ACACCTACAT CTGTATTAAC GAAGCGCTGG 2881 CATTGACCCT GAGTGATTTT TCTCTGGTCC CGCCGCATCC ATACCGCCAG TTGTTTACCC 2941 TCACAACGTT CCAGTAACCG GGCATGTTCA TCATCAGTAA CCCGTATCGT GAGCATCCTC 3001 TCTCGTTTCA TCGGTATCAT TACCCCCATG AACAGAAATC CCCCTTACAC GGAGGCATCA 3061 GTGACCAAAC AGGAAAAAAC CGCCCTTAAC ATGGCCCGCT TTATCAGAAG CCAGACATTA 3121 ACGCTTCTGG AGAAACTCAA CGAGCTGGAC GCGGATGAAC AGGCAGACAT CTGTGAATCG 3181 CTTCACGACC ACGCTGATGA GCTTTACCGC AGCTGCCTCG CGCGTTTCGG TGATGACGGT 3241 GAAAACCTCT GACACATGCA GCTCCCGGAG ACGGTCACAG CTTGTCTGTA AGCGGATGCC 3301 GGGAGCAGAC AAGCCCGTCA GGGCGCGTCA GCGGGTGTTG GCGGGTGTCG GGGCGCAGCC 3361 ATGACCCAGT CACGTAGCGA TAGCGGAGTG TATACTGGCT TAACTATGCG GCATCAGAGC 3421 AGATTGTACT GAGAGTGCAC CATATATGCG GTGTGAAATA CCGCACAGAT GCGTAAGGAG 3481 AAAATACCGC ATCAGGCGCT CTTCCGCTTC CTCGCTCACT GACTCGCTGC GCTCGGTCGT 3541 TCGGCTGCGG CGAGCGGTAT CAGCTCACTC AAAGGCGGTA ATACGGTTAT CCACAGAATC 3601 AGGGGATAAC GCAGGAAAGA ACATGTGAGC AAAAGGCCAG CAAAAGGCCA GGAACCGTAA 3661 AAAGGCCGCG TTGCTGGCGT TTTTCCATAG GCTCCGCCCC CCTGACGAGC ATCACAAAAA 3721 TCGACGCTCA AGTCAGAGGT GGCGAAACCC GACAGGACTA TAAAGATACC AGGCGTTTCC 3781 CCCTGGAAGC TCCCTCGTGC GCTCTCCTGT TCCGACCCTG CCGCTTACCG GATACCTGTC 3841 CGCCTTTCTC CCTTCGGGAA GCGTGGCGCT TTCTCATAGC TCACGCTGTA GGTATCTCAG 3901 TTCGGTGTAG GTCGTTCGCT CCAAGCTGGG CTGTGTGCAC GAACCCCCCG TTCAGCCCGA 3961 CCGCTGCGCC TTATCCGGTA ACTATCGTCT TGAGTCCAAC CCGGTAAGAC ACGACTTATC 4021 GCCACTGGCA GCAGCCACTG GTAACAGGAT TAGCAGAGCG AGGTATGTAG GCGGTGCTAC 4081 AGAGTTCTTG AAGTGGTGGC CTAACTACGG CTACACTAGA AGGACAGTAT TTGGTATCTG 4141 CGCTCTGCTG AAGCCAGTTA CCTTCGGAAA AAGAGTTGGT AGCTCTTGAT CCGGCAAACA 4201 AACCACCGCT GGTAGCGGTG GTTTTTTTGT TTGCAAGCAG CAGATTACGC GCAGAAAAAA 4261 AGGATCTCAA GAAGATCCTT TGATCTTTTC TACGGGGTCT GACGCTCAGT GGAACGAAAA 4321 CTCACGTTAA GGGATTTTGG TCATGAGATT ATCAAAAAGG ATCTTCACCT AGATCCTTTT 4381 AAATTAAAAA TGAAGTTTTA AATCAATCTA AAGTATATAT GAGTAAACTT GGTCTGACAG4441 TTACCAATGC TTAATCAGTG AGGCACCTAT CTCAGCGATC TGTCTATTTC GTTCATCCAT 4501 AGTTGCCTGA CTCCCCGTCG TGTAGATAAC TACGATACGG GAGGGCTTAC CATCTGGCCC 4561 CAGTGCTGCA ATGATACCGC GAGACCCACG CTCACCGGCT CCAGATTTAT CAGCAATAAA 4621 CCAGCCAGCC GGAAGGGCCG AGCGCAGAAG TGGTCCTGCA ACTTTATCCG CCTCCATCCA 4681 GTCTATTAAT TGTTGCCGGG AAGCTAGAGT AAGTAGTTCG CCAGTTAATA GTTTGCGCAA 4741 CGTTGTTGCC ATTGCTGCAG GCATCGTGGT GTCACGCTCG TCGTTTGGTA TGGCTTCATT 4801 CAGCTCCGGT TCCCAACGAT CAAGGCGAGT TACATGATCC CCCATGTTGT GCAAAAAAGC 4861 GGTTAGCTCC TTCGGTCCTC CGATCGTTGT CAGAAGTAAG TTGGCCGCAG TGTTATCACT 4921 CATGGTTATG GCAGCACTGC ATAATTCTCT TACTGTCATG CCATCCGTAA GATGCTTTTC 4981 TGTGACTGGT GAGTACTCAA CCAAGTCATT CTGAGAATAG TGTATGCGGC GACCGAGTTG 5041 CTCTTGCCCG GCGTCAATAC GGGATAATAC CGCGCCACAT AGCAGAACTT TAAAAGTGCT 5101 CATCATTGGA AAACGTTCTT CGGGGCGAAA ACTCTCAAGG ATCTTACCGC TGTTGAGATC 5161 CAGTTCGATG TAACCCACTC GTGCACCCAA CTGATCTTCA GCATCTTTTA CTTTCACCAG 5221 CGTTTCTGGG TGAGCAAAAA CAGGAAGGCA AAATGCCGCA AAAAAGGGAA TAAGGGCGAC 5281 ACGGAAATGT TGAATACTCA TACTCTTCCT TTTTCAATAT TATTGAAGCA TTTATCAGGG 5341 TTATTGTCTC ATGAGCGGAT ACATATTTGA ATGTATTTAG AAAAATAAAC AAATAGGGGT 5401 TCCGCGCACA TTTCCCCGAA AAGTGCCACC TGAAATTGTA AACGTTAATA TTTTGTTAAA 5461 ATTCGCGTTA AATTTTTGTT AAATCAGCTC ATTTTTTAAC CAATAGGCCG AAATCGGCAA 5521 AATCCCTTAT AAATCAAAAG AATAGACCGA GATAGGGTTG AGTGTTGTTC CAGTTTGGAA 5581 CAAGAGTCCA CTATTAAAGA ACGTGGACTC CAACGTCAAA GGGCGAAAAA CCGTCTATCA 5641 GGGCGATGGC CCACTACGTG AACCATCACC CTAATCAAGT TTTTTGGGGT CGAGGTGCCG 5701 TAAAGCACTA AATCGGAACC CTAAAGGGAG CCCCCGATTT AGAGCTTGAC GGGGAAAGCC 5761 GGCGAACGTG GCGAGAAAGG AAGGGAAGAA AGCGAAAGGA GCGGGCGCTA GGGCGCTGGC 5821 AAGTGTAGCG GTCACGCTGC GCGTAACCAC CACACCCGCC GCGCTTAATG CGCCGCTACA 5881 GGGCGCGTCC CATTCGCCA//其他大肠杆菌表达载体:pBV221 ptdTomato pET-52b(+) pAmCyanpDsRed-Express2 pBV220 pCold-GST pColdS-SUMOpCold TF pCold IV pCold III pCold IIpCold I pE-SUMO pCold-ProS2 pBAD102/D-TOPO pBAD202/D-TOPO pACYC184 pBAD/Thio-TOPO pBad/Myc-His C pBad/Myc-His B pBad/Myc-His A pBad/His C pBad/His BpBad/His A pBAD-TOPO pET-23b(+) pET-23a(+)pET-23c(+) pET-23(+) pET-12b(+) pET-12c(+)pET-12a(+) pET-11b(+) pET-11a(+) pET-11c(+)pBad24 pQE-82L pQE-81L pQE-80LpQE-32 pQE-9 pQE-16 pQE-31pQE-60 pQE-70 pQE-40 pET-51b(+)pET-50b(+) pET-49b(+) pET-48b(+) pET-47b(+)pET-26b(+) pET-32a(+) pET-21b(+) pET-22b(+)pET-14b pET-16b pET-15b pET-19bpET-20b(+) pET-21d(+) pET-21c(+) pET-21b(+)pET-21a(+) pET-24a(+) pET-24d(+) pET-25b(+) pET-27b(+) pET-28a(+) pET-30a(+) pET-42a(+) pET-43.1c(+) pET-43.1b(+) pET-43.1a(+) pET-44a(+) pET-44c(+) pET-46 EK/LIC pET-37b(+) pTrcHis2 C pTrcHis2 B pTrcHis2 A pET303/CT-His pET302/NT-His pRSET-CFP pRSET-EmGFP pRSET-BFP pGFPuvpET300/NT-DEST pET301/CT-DEST pGEM-T pBad43pGEX-4T-3 pGEX-5X-2 pBlueScript SK(+) pG-Tf2pG-KJE8 pGro7 pET-SUMO pSE380pET-17b pET102/D-TOPO pCDFDuet-1 pMAL-p5xpTf16 pET-28c(+) pBluescript II SK(+) pET-30b(+) pSUMO pProEX HTc pProEX HTb pProEX HTa pKD3 pKD13 pKD46 pTYB1pTYB2 pTWIN2 pBluescript II KS(-) pTYB12pMAL-p5e pACYCDuet-1 pEGM-11ZF(+) pEGM-7ZF(+) PinPoint Xa-3 PinPoint Xa-2 PinPoint Xa-1 pSP73pSP64 pTWIN1 pTYB11 pTXB1pET-5b(+) pBad/gIII C pBad/gIII B pBad/gIII A pET-5a(+) pMal-p4X pMal-p2G pkk223-3pkk232-8 pCYB1 pEZZ18 pBAD18pMAL-c5x pMal-p2E pMal-p2X pET-44 EK/LIC pET-43.1 EK/LIC pET-41 EK/LIC pMal-c4X pTrcHis BpET-31b(+) pET-3b(+) pET-41a(+) pGEX-3XpGEX-4T-2 pETDuet-1 pGEX-4T-1 pTrc99apET-28b(+) pET-His pALEX a,b,c pACYC177pBR322 pKD4 pKD20 pMXB10pEcoli-6xHN-GFPuv pKJE7 pRSET B pGEX-KGpGEX-2T pRSFDuet-1 pCOLADuet-1 pTrcHis C pTrcHis A pET-41b(+) pET-42b(+) pET-3a(+) pGEX-6P-3 pGEX-6P-2 pGEX-6P-1 pGEX-5X-3 pGEX-5X-1 pGEX-2TK pRSET A pMal-c2GpMal-c2E pMal-c2X pRSET C pQE-30pET-45b(+) pET-44b(+) pET-42c(+) pET-41c(+) pET-40b(+) pET-33b(+) pET-39b(+) pET-32 EK/LIC pET-32 Xa/LIC pET-32c(+) pET-32b(+) pET-30 Xa/LIC pET-30 EK/LIC pET-30c(+) pET-29c(+) pET-29b(+) pET-29a(+) pET-24c(+) pET-24b(+) pET-24(+)pET-23d(+) pET-11d(+) pBad33。
