高中化学必修一第二章《化学物质及其变化》复习知识点整理
高中化学必修一二知识点总结

高中化学必修1知识点归纳总结第一章从实验学化学第一节化学实验基本方法一、熟悉化学实验基本操作危险化学品标志,如酒精、汽油——易然液体;浓H2SO4、NaOH(酸碱)——腐蚀品二、混合物的分离和提纯:1、分离的方法:①过滤:固体(不溶)和液体的分离。
②蒸发:固体(可溶)和液体分离。
③蒸馏:沸点不同的液体混合物的分离。
④分液:互不相溶的液体混合物。
⑤萃取:利用混合物中一种溶质在互不相溶的溶剂里溶解性的不同,用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来。
2、粗盐的提纯:(1)粗盐的成分:主要是NaCl,还含有MgCl2、CaCl2、Na2SO4、泥沙等杂质(2)步骤:①将粗盐溶解后过滤;②在过滤后得到粗盐溶液中加过量试剂BaCl2(除SO42-)、Na2CO3(除Ca2+、过量的Ba2+)、NaOH(除Mg2+)溶液后过滤;③得到滤液加盐酸(除过量的CO32-、OH-)调pH=7得到NaCl溶液;④蒸发、结晶得到精盐。
加试剂顺序关键:(ⅰ)Na2CO3在BaCl2之后;(ⅱ)盐酸放最后。
3、蒸馏装置注意事项:①加热烧瓶要垫上石棉网;②温度计的水银球应位于蒸馏烧瓶的支管口处;③加碎瓷片的目的是防止暴沸;④冷凝水由下口进,上口出。
4、从碘水中提取碘的实验时,选用萃取剂应符合原则:①被萃取的物质在萃取剂溶解度比在原溶剂中的大得多;②萃取剂与原溶液溶剂互不相溶; ③萃取剂不能与被萃取的物质反应。
三、离子的检验:①SO42-:先加稀盐酸,再加BaCl2溶液有白色沉淀,原溶液中一定含有SO42-。
Ba2++SO42-=BaSO4↓②Cl-(用AgNO3溶液、稀硝酸检验)加AgNO3溶液有白色沉淀生成,再加稀硝酸沉淀不溶解,原溶液中一定含有Cl-;或先加稀硝酸酸化,再加AgNO3溶液,如有白色沉淀生成,则原溶液中一定含有Cl-。
Ag++Cl-=AgCl↓。
③CO32-:(用BaCl2溶液、稀盐酸检验)先加BaCl2溶液生成白色沉淀,再加稀盐酸,沉淀溶解,并生成无色无味、能使澄清石灰水变浑浊的气体,则原溶液中一定含有CO32-。
(完整版)第二章化学物质及其变化必背知识点

第二章化学物质及其变化知识清单一、物质的分类1. 元素的存在形式有两种,分别是什么?游离态(单质)、化合态(化合物)2.从熔沸点角度看,纯净物和混合物有何差别?纯净物有固定的熔沸点,混合物没有3.只含一种元素的物质一定是纯净物吗?不一定;如氧气与臭氧、石墨与金刚石组成的都是混合物4.从与酸或碱反应的情况看,氧化物是如何分类的。
酸性氧化物:与碱反应生成盐和水的氧化物(如CO2、SO2、SO3、P2O5)碱性氧化物:与酸反应生成盐和水的氧化物(如Na2O、CaO)不成盐氧化物:既不与酸反应,也不与碱反应的氧化物(如CO、NO)5.酸性氧化物一定是非金属氧化物吗?不一定,如Mn2O7非金属氧化物一定是酸性氧化物吗?不一定,如CO、NO碱性氧化物一定是金属氧化物吗?是金属氧化物一定是碱性氧化物吗?不一定,如Al2O3、Mn2O76.酸碱盐是如何定义和再分类的?酸的定义:在水溶液中电离出的阳离子都是H+的化合物。
酸可以分为强酸与弱酸;或含氧酸与无氧酸;或一元酸与多元酸;或氧化性酸与非氧化性酸等;碱的定义:在水溶液中电离出的阴离子全是OH-的化合物。
碱可以分为强碱与弱碱;或一元碱与多元碱等。
盐的定义:由金属阳离子(或铵根离子)与酸根离子组成的化合物盐可以分为正盐与酸式盐;或可溶性盐与难容性盐等盐的溶解性:钾钠硝铵全都溶,盐酸不溶银亚汞;硫酸难容钡和铅,碳酸只溶钾钠铵;钙银硫酸盐微溶;亚硫酸盐似碳酸。
7. 常见物质俗名和化学式生石灰:CaO 熟石灰:Ca(OH)2 石灰石:CaCO3碱石灰:CaO+NaOH烧碱(苛性钠):NaOH 纯碱(苏打):Na2CO3小苏打:NaHCO38.分散系如何分类的?分类的标准是什么?分散系分为溶液、胶体和浊液;分类的标准是分散质粒子的直径大小:其中小于1-100nm属于溶液,1-100nm之间的属于胶体,大于100nm的属于浊液。
9.常见的胶体有哪些?云、烟、雾、牛奶、豆浆、河水、血液、有色玻璃等10.胶体有哪些性质?丁达尔效应、聚沉、电泳、渗析使胶体聚沉的方法有哪些?加热、搅拌、加入电解质溶液、加入胶粒带相反电荷的胶体。
高中化学 必修一 第二章 化学物质及其变化总复习(课件1)

成成才才之之路路·高·高中中新新课课程程·学·学习习指指导导·北·人师教大版版·化·数学学·必·必修修1 1
关于离子能否共存的判断题是考试中的一类传统题。首先 要弄清题干的要求:“共存”还是“不共存”,“可能”还是 “肯定”,是否有如“碱性溶液中”“酸性溶液中”“无色溶 液”等附加条件。具体判断时先看能否发生复分解反应,即生 成沉淀、气体、水等,再看能否发生氧化还原反应。
滴加 Na2CO3 溶液,若有气泡生成,则加入的未知物质的溶液 为 NaCl 溶液;若无气泡生成,则加入的未知物质的溶液为
NaOH 溶液
第二章第一本章章归§纳1总结
成成才才之之路路·高·高中中新新课课程程·学·学习习指指导导·北·人师教大版版·化·数学学·必·必修修1 1
离子反应与离子方程式 ●专题归纳 1.离子方程式的书写及正误判断 (1)离子方程式书写步骤速记口诀: 要写离子方程式,先写化学方程式; 单质沉淀气弱质,仍然保留化学式; 可溶可离电解质,离子符号来表示; 消去相同的离子,检查守恒就完事。
第二章第一本章章归§纳1总结
成成才才之之路路·高·高中中新新课课程程·学·学习习指指导导·北·人师教大版版·化·数学学·必·必修修1 1
(2)交叉分类法和树状分类法。 ①树状分类法中所涉及类别之间既有并列关系,也有从 属(包含)关系。 ②交叉分类法所涉及的不同类别之间是并列与交叉关 系,它们之间不能相互包含。 (3)有关物质分类的试题,可以记忆几个特殊的物质,用 特例证明法快速解题。
第二章第一本章章归§纳1总结
成成才才之之路路·高·高中中新新课课程程·学·学习习指指导导·北·人师教大版版·化·数学学·必·必修修1 1
④反应物或产物在离子方程式中各离子的化学计量数之
新课标化学必修1第二章《化学物质及其变化》知识点

新课标化学必修1第二章《化学物质及其变化》知识点1.分类是学习和研究化学物质及其变化的一种常用的方法。
运用分类的方法不仅能使有关的化学物质及其变化的知识系统化,还可以通过分门别类的研究,发现物质及其变化的规律。
2.简单分类法就是把大量事物按照事先设定的标准进行分类的方法,它是人们最熟悉、也是最方便的一种工作方法。
意义:当分类的标准确定过后,同类中的事物在某些方面的相似性可以帮助我们做到举一反三;对于不同类事物的了解使我们做到由此及彼。
3.交叉分类法:为了弥补一种分类方法的局限性,人们在认识事物时从不同的角度设定不同的标准对同一事物进行认识,这种方法叫交叉分类法。
例1:对班级学生采用交叉分类法,有利于全面了解学生,便于班级的管理,其分类标准和意义如下:(1)按性别分:男生、女生。
意义:①男女生体能不同,劳动分工不同,运动会报名分男子组和女子组。
②男女生生理特征不同,剧烈活动要考虑女生的特殊例假。
③男女生的思维特点和个性心理不同,分班时尽量考虑男生女生的均衡性,以形成优势互补。
④男女生身材特点不同,审美情趣不同,夏季校服的设计要考虑男生女生的区别。
(2)按学习成绩、平时表现分:学优生、学困生。
意义:抓学优生保升学率,抓学困生保稳定,控制学生流失率,抓两头带中间,保整体进步。
(3)按高考发展方向分:文史类、理工类、艺体特长类、保送类、意义:不同类别的学生,在学习时侧重点不同,老师要求也不同,将来发展方向也不同。
(4)按是否承担社会工作分:干部、群众意义:干部与群众在责、权、利三方面都不会相同,干部的锻炼机会更多些、责任更大些、有机会参与优秀干部的评选,群众则没有。
(5)按政治面貌分:团员、群众意义:团员的政治觉悟要更高些,学校活动参与得更主动些,表现更优秀些,活动效果老师更放心些。
(6)按家长工作单位分:城市的(管局的、油公司的、炼化的、石化的、市政的)、农村的、招商的意义:根据家长的工作单位和收入情况对学生进行理财教育,避免奢侈浪费,养成节约的好习惯,对城市低保护、农村低收入家庭进行政策性照顾,实现胡锦涛主席“学有所教”的十七大目标。
必修一第二章化学物质及其变化复习ppt课件
3.氧化还原反应与四种基本类型反应关系
氧化还原反应
置换反应 复分解反应
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点五:氧化还原反应
4.基本概念
还原剂 失电子 还原性
价升
被氧化
氧化 产物
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点五:氧化还原反应
5.基本规律
3、电子得失守恒规律: 例.已知M2O7 x-+ 3S 2-+ 14H+ = 2 M3+3S↓+ 7H2O,则M2O7 x-中的M的化合价为 (D)
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
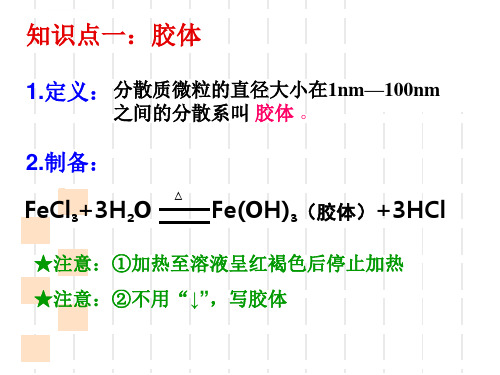
知识点一:胶体
1.定义: 分散质微粒的直径大小在1nm—100nm
之间的分散系叫 胶体 。
2.制备: FeCl3+3H2O △
Fe(OH)3(胶体)+3HCl
★注意:①加热至溶液呈红褐色后停止加热 ★注意:②不用“↓”,写胶体
3.性质:
⑤胶体的凝聚 Ⅰ加电解质溶液 Ⅱ加带相反电荷的胶粒 Ⅲ加热凝聚(加热较长时间)
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点一:胶体
均匀透明 稳定 d<1nm 小分子或离子
氯化钠溶液
均匀透明 介稳定
钾盐、钠盐、铵盐、硝酸盐全溶 SO42-除Ba2+(Ca2+、Ag+ 微溶) Cl-除Ag+ CO32-只溶K+、Na+、NH4+(Mg2+微溶) OH-只溶K+、Na+、Ba2+(Ca2+微溶)
人教高中化学 必修一 第二章《化学物质及其变化》知识点总结

课标要求1.能根据物质的组成和性质对物质进行分类2.知道根据分散质粒子的大小,把分散系分为溶液、胶体和浊液3.知道用丁达尔效应区分溶液和胶体4.知道酸、碱、盐在溶液中能发生电离,能正确书写强酸、强碱和可溶性盐的电离方程式。
5.通过实验事实认识离子反应的意义及其发生的条件,能正确书写常见的离子方程式。
6.能够根据溶液中存在的离子判断是否发生复分解反应,从而判断溶液中离子能否大量共存。
7.了解Cl-、SO42-、CO32-等常见离子的检验方法。
8.了解常见变化的分类方法。
9.根据实验事实了解氧化还原反应的本质是电子的转移。
10. 举例说明生产、生活中常见的氧化还原反应。
11.熟记常见物质的化合价,能根据反应前后元素化合价有无变化,判断反应是否为氧化还原反应。
12.能判断氧化剂和还原剂。
要点精讲一、物质的分类二、分散系相关概念1、分散系:一种物质(或几种物质)以粒子形式分散到另一种物质里所形成的混合物,统称为分散系。
2、分散质:分散系中分散成粒子的物质。
3、分散剂:分散质分散在其中的物质。
4、分散系的分类:当分散剂是水或其他液体时,如果按照分散质粒子的大小来分类,可以把分散系分为:溶液、胶体和浊液。
分散质粒子直径小于1nm的分散系叫溶液,在1nm -100nm之间的分散系称为胶体,而分散质粒子直径大于100nm的分散系叫做浊液。
下面比较几种分散系的不同:注意:三种分散系的本质区别:分散质粒子的大小不同。
三、胶体1、胶体的定义:分散质粒子直径大小在10-9~10-7m之间的分散系。
2、胶体的分类:①根据分散质微粒组成的状况分类:如:胶体胶粒是由许多等小分子聚集一起形成的微粒,其直径在1nm~100nm之间,这样的胶体叫粒子胶体。
②根据分散剂的状态划分:如:烟、云、雾等的分散剂为气体,这样的胶体叫做气溶胶;AgI溶胶、溶胶、溶胶,其分散剂为水,分散剂为液体的胶体叫做液溶胶;有色玻璃、烟水晶均以固体为分散剂,这样的胶体叫做固溶胶。
高中化学必修一第二章复习知识点整理

高一化學必修1第二章復習提綱及試題第二章化學物質及變化班別________________ 姓名_________________第一節物質の分類1、物質の分類方法有多種,常見の有:樹狀分類法、交叉分類法等等。
用樹狀分類法將物質分類一般分為:混合物:溶液、濁液、膠體金屬單質:Na、Fe、Cu等物質單質非金屬單質:Cl2、H2、、O2、O3、C60等純淨物酸:HCl、H2CO3等無機化合物堿:NaOH、Ba(OH)2、NH3·H2O等化合物鹽:Na2CO3、NaHSO4、Cu(OH)2(CO3)2氧化物:CO、CO2、CuO等有機化合物:CH3COOH、CH4、C2H6、CH3CH2OH等[練習2、膠體の概念和性質①概念——分散質微粒の直徑大小在1nm~100nm之間の分散系稱做“膠體”。
根據分散劑狀態,可將膠體分為液溶膠,如氫氧化鐵膠體、澱粉溶液;氣溶膠,如雲、霧、煙;固溶膠,如有色玻璃、煙水晶。
②膠體有如下の性質丁達爾效應——丁達爾效應是粒子對光散射作用の結果。
布朗運動——在膠體中,由於質點在各個方向所受の力不能相互平衡而產生の無規則の熱運動,稱為“布朗運動”。
*電泳——在外加電場の作用下,膠體の微粒在分散劑裏向陰極(或陽極)做定向移動の現象。
注意:電泳只是膠粒定向地向電極運動,並沒有凝聚而沉澱。
凝聚——膠體分散系中,分散質微粒相互聚集而下沉の現象稱為“凝聚”。
能促使溶膠凝聚の物理或化學因素有加電解質(酸、堿及鹽)、加熱、溶膠濃度增大、加帶相反電荷の膠體等。
[練習2].下列關於膠體和溶液の說法中,不正確の是 ()A、膠體粒子直徑為1-100nm,比較穩定,無色透明B、往Fe(OH)3膠體中逐滴加入稀硫酸會產生沉澱而後沉澱逐漸溶解C、江河入海口三角洲の形成通常與膠體の性質有關D、濁液、溶液、膠體の本質特徵在於分散質粒子大小不同第二節離子反應1、電解質與非電解質①電解質:在水溶液裏或熔化狀態下能夠導電の化合物,如酸、堿、鹽、水、金屬氧化物等。
高中化学第二章 化学物质及其变化知识点总结

第二章 化学物质及其变化第一讲 物质的组成、性质和分类考点1 物质的组成与分类一、元素、微粒及物质间的关系1.宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的。
2.元素:具有相同核电荷数(即质子数)的一类原子的总称。
3.元素与物质的关系元素A――→组成⎩⎪⎨⎪⎧单质:只由一种元素组成的纯净物化合物:由多种元素组成的纯净物4.元素在物质中的存在形态(1)游离态:元素以单质形式存在的状态。
(2)化合态:元素以化合物形式存在的状态。
5.混合物和纯净物(1)纯净物:由同种单质或化合物组成的物质。
(2)混合物:由几种不同的单质或化合物组成的物质。
6.同素异形体(1)同种元素形成的不同单质叫同素异形体。
同素异形体的形成有两种方式:①原子个数不同 ,如O 2和O 3;②原子排列方式不同,如金刚石和石墨。
(2)同素异形体之间的性质差异主要体现在物理性质上,同素异形体之间的转化属于化学变化,但不属于氧化还原反应。
7.元素、微粒及物质间的关系图二、物质的分类1.交叉分类法——从不同角度对物质进行分类(如图为氧化物的分类)2.树状分类法——按不同层次对物质进行逐级分类,各层之间属于包含关系。
考点2物质的性质与变化一、物质的性质与变化二、单质、氧化物、酸、碱、盐的转化关系1.理解物质转化关系图2.形成转化关系一条线:(氢化物→)单质→氧化物→酸或碱→盐。
三、化学反应的分类化学反应⎩⎪⎪⎪⎨⎪⎪⎪⎧按反应物、生成物种类及数目多少分为⎩⎪⎨⎪⎧化合反应分解反应置换反应复分解反应按反应中有无离子参与分为⎩⎪⎨⎪⎧离子反应非离子反应按反应中有无电子转移分为⎩⎪⎨⎪⎧氧化还原反应非氧化还原反应按反应进行的程度和方向分为⎩⎪⎨⎪⎧可逆反应不可逆反应按反应的能量变化分为⎩⎪⎨⎪⎧吸热反应放热反应四、物质变化中的“三馏”“四色”“五解”和“十八化”归类考点3分散系与胶体一、分散系1.概念:把一种(或多种)物质(分散质)分散在另一种(或多种)物质(分散剂)中所得到的体系。
2019人教高中化学必修一第二章《化学物质和其变化》知识点总结计划语文

课标要求1.能依照物质的组成和性质对物质进行分类2.知道依照分别质粒子的大小,把分别系分为溶液、胶体和浊液3.知道用丁达尔效应划分溶液和胶体4.知道酸、碱、盐在溶液中能发生电离,能正确书写强酸、强碱和可溶性盐的电离方程式。
5.经过实验事实认识离子反响的意义及其发生的条件,能正确书写常有的离子方程式。
6.能够依照溶液中存在的离子判断可否发生复分解反响,从而判断溶液中离子可否大量共存。
7.认识 Cl -、SO 2- 2-等常有离子的检验方法。
、CO 348.认识常有变化的分类方法。
9.依照实验事实认识氧化复原反响的实质是电子的转移。
10. 举例说明生产、生活中常有的氧化复原反响。
11.熟记常有物质的化合价,能依照反响前后元素化合价有无变化,判断反响可否为氧化复原反响。
12.能判断氧化剂和复原剂。
要点精讲一、物质的分类二、分别系相关看法1、分别系:一种物质〔或几种物质〕以粒子形式分别到另一种物质里所形成的混杂物,统称为分别系。
2、分别质:分别系中分别成粒子的物质。
3、分别剂:分别质分别在其中的物质。
4、分别系的分类:当分别剂是水或其他液体时,若是依照分别质粒子的大小来分类,能够把分别系分为:溶液、胶体和浊液。
分别质粒子直径小于 1nm 的分别系叫溶液,在 1nm -100nm 之间的分别系称为胶体,而分别质粒子直径大于 100nm 的分别系叫做浊液。
下面比较几种分别系的不相同:注意:三种分别系的实质差异:分别质粒子的大小不相同。
三、胶体1、胶体的定义:分别质粒子直径大小在 10-9~10-7m 之间的分别系。
第 1 页2、胶体的分类:①依照分别质微粒组成的状况分类:如:胶体胶粒是由好多等小分子齐聚一起形成的微粒,其直径在1nm ~100nm 之间,这样的胶体叫粒子胶体。
②依照分别剂的状态划分:如:烟、云、雾等的分别剂为气体,这样的胶体叫做气溶胶; AgI 溶胶、溶胶、溶胶,其分别剂为水,分别剂为液体的胶体叫做液溶胶;有色玻璃、烟水晶均以固体为分散剂,这样的胶体叫做固溶胶。
高中化学人教版必修一第二章 物质及其变化知识梳理+章末综合复习试题学生版

第二章《化学物质及其变化》复习知识梳理复习知识要点:1、物质的分类及胶体的性质2、电解质及离子反应3、氧化还原反应复习目标:通过知识点内容梳理及例题练习,回忆并巩固本章所有知识点内容及其应用。
弄清胶体的性质;掌握电解质的概念和离子反应的概念,知道离子方程式的书写;能根据氧化还原反应的特征辨别出氧化还原反应,并理解氧化还原反应的本质。
知识点一:物质的分类1.物质的分类物质的分类方法有多种,常见的有:树状分类法、交叉分类法等。
用树状分类法将物质分为:混合物:溶液、浊液、胶体金属单质:Na、Fe、Cu等物质单质非金属单质:Cl2、H2、、O2、O3、C60等纯净物酸:HCl、H2CO3等无机化合物碱:NaOH、Ba(OH)2、NH3·H2O等化合物盐:Na2CO3、NaHSO4、Cu2(OH)2CO3氧化物:CO、CO2、CuO等有机化合物:CH3COOH、CH、C2H6、CH3CH2OH等例题1]下列说法中正确的是( )A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物B.蔗糖、硫酸钡和水分别属于非电解质、电解质、非电解质C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到D.天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源例题2]下列物质分类正确的是( )A.Cu(OH)难溶于水,属于非电解质2能与碱反应生成盐和水,属于酸性氧化物B.SO2Cl组成中不含金属离子,不属于盐C.NH4D.HCl气体溶于水电离成H+和Cl-,属于离子化合物2.分散系把,叫分散系。
被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
3.胶体的概念和性质①概念——分散质微粒的直径大小在1nm~100nm之间的分散系称作“胶体”。
②胶体有如下的性质:丁达尔效应——丁达尔效应是粒子对光散射作用的结果。
布朗运动——在胶体中,由于质点在各个方向所受的力不能相互平衡而产生的无规则的热运动,称为“布朗运动”。
XX高一化学必修1第二章知识点归纳【DOC范文整理】

XX高一化学必修1第二章知识点归纳第二章化学物质及其变化一.物质的分类.分类是学习和研究化学物质及其变化的一种常用的基本方法,它不仅可以使有关化学物质及其变化的知识系统化,还可以通过分门别类的研究,了解物质及其变化的规律。
分类要有一定的标准,根据不同的标准可以对化学物质及其变化进行不同的分类。
交叉分类和树状分类是常用的分类方法。
.分散系及其分类把一种物质分散在另一种物质中所得到的体系,叫分散系。
被分散的物质称作分散质,起容纳分散质作用的物质称作分散剂。
二.物质的化学变化.物质之间可以发生各种各样的化学变化,依据一定的标准可以对化学变化进行分类。
⑴根据反应物和生成物的类别以及反应前后物质种类的多少可以分为:A.化合反应B.分解反应c.置换反应D.复分解反应。
⑵根据反应中是否有离子参加可将反应分为:A.离子反应:有离子参加的一类反应;B.分子反应;⑶根据反应中是否有电子转移可将反应分为:;A.氧化还原反应:反应中有电子转移;实质:有电子转移;特征:反应前后元素的化合价有变化;B.非氧化还原反应;2.离子反应;⑴电解质:在水溶液中或熔化状态下能导电的化合物,;酸:电离时生成的阳离子全部是氢离子的化合物;碱:电离时A.离子反应:有离子参加的一类反应。
主要包括复分解反应和有离子参加的氧化还原反应。
B.分子反应。
⑶根据反应中是否有电子转移可将反应分为:A.氧化还原反应:反应中有电子转移的反应。
实质:有电子转移特征:反应前后元素的化合价有变化B.非氧化还原反应.离子反应⑴电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。
酸、碱、盐都是电解质。
酸:电离时生成的阳离子全部是氢离子的化合物碱:电离时生成的阴离子全部是氢氧根离子的化合物。
盐:电离时生成金属离子和酸根离子的化合物。
在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。
注意:①电解质、非电解质都是化合物,不同之处是在水溶液中或融化状态下能否导电。
②电解的导电是有条件的:电解质必须在水溶液中或熔化状态下才能导电。
人教版高中化学必修一高一化学《第二章化学物质及其变化》复习提纲
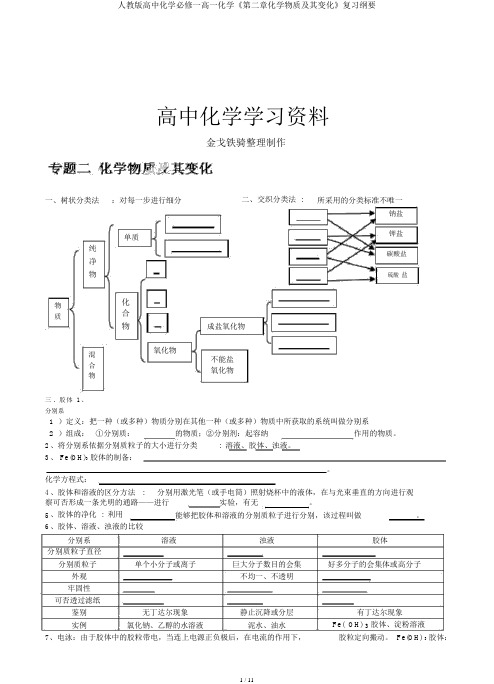
高中化学学习资料金戈铁骑整理制作一、树状分类法:对每一步进行细分二、交织分类法 :所采用的分类标准不唯一钠盐单质钾盐纯碳酸盐净物硫酸盐物化合质物成盐氧化物混氧化物不能盐合氧化物物三. 胶体1、分别系1 )定义:把一种(或多种)物质分别在其他一种(或多种)物质中所获取的系统叫做分别系2 )组成:①分别质:的物质;②分别剂:起容纳作用的物质。
2、将分别系依据分别质粒子的大小进行分类: 溶液、胶体、浊液。
3、 Fe(OH)3胶体的制备:。
化学方程式:4、胶体和溶液的区分方法 :分别用激光笔(或手电筒)照射烧杯中的液体,在与光束垂直的方向进行观察可否形成一条光明的通路——进行实验,有无。
5、胶体的净化 : 利用能够把胶体和溶液的分别质粒子进行分别,该过程叫做。
6、胶体、溶液、浊液的比较分别系溶液浊液胶体分别质粒子直径分别质粒子单个小分子或离子巨大分子数目的会集好多分子的会集体或高分子外观不均一、不透明牢固性可否透过滤纸鉴别无丁达尔现象静止沉降或分层有丁达尔现象实例氯化钠、乙醇的水溶液泥水、油水Fe( OH) 3胶体、淀粉溶液7、电泳:由于胶体中的胶粒带电,当连上电源正负极后,在电流的作用下,胶粒定向搬动。
Fe(OH) 3胶体:阴极周边颜色 ,阳极周边颜色 。
8、聚沉: 胶体粒子在合适的条件下相互结合成直径大于100nm 的颗粒而聚积下来的过程称为胶体的聚沉。
这就需要破坏胶体的介稳性。
常用的方法以下:( 1)加入 。
如由豆浆做豆腐时,在必然温度下,加入CaSO 4( 或其他电解质溶液) ,将豆浆中的胶体粒子带的电荷被中和,其中的微粒很快齐聚而形成胶冻状的豆腐(称为凝胶) 。
再如河海交界处易形成沙洲。
( 2)加入 ,使胶体相互聚沉。
不相同的胶粒吸附带不相同电荷的离子, 如 、 吸附阳离子,使胶体带正电荷; 、 的胶粒吸 附阴离子,使胶粒带负电荷。
当两种带相反电荷的胶体混杂,也会因胶粒所带电荷发生中和,而使胶体凝聚。
人教版高中化学必修一第二章化学物质及其变化章末知识整合新.docx

高中化学学习材料鼎尚图文收集整理第二章化学物质及其变化专题一物质分类方法的应用物质的分类方法依据很多,按不同的分类方法对同一物质进行分类,得出的类别名称不同。
判断氧化物所属类别时,一定要注意以下两点:第一,酸性氧化物也不一定是非金属氧化物,如Mn2O7;非金属氧化物不一定是酸性氧化物,如CO、NO;第二,碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3是两性氧化物。
这类知识内容不难,但应用较广,是近年来的高考热点,常在选择题中出现。
1.化合物可分为酸、碱、盐、氧化物,也可分为电解质、非电解质。
2.混合物分为溶液、浊液和胶体。
3.掌握酸、碱、盐、氧化物之间的关系。
某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水煤气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。
上述说法正确的是( )A.①②③④B.①②⑤⑥C.③⑤⑥⑦ D.①③④⑦解析:②沼气属于可再生能源,水煤气是由炽热的煤与水蒸气反应制得的CO和H2的混合物,因为煤为不可再生能源,所以水煤气也为不可再生能源,错误;③冰为固态水,干冰为固态CO2,两者均既是纯净物又是化合物,正确;⑤盐酸和食醋不是化合物,而是混合物,错误;⑥纯碱为Na2CO3,不是碱而是盐,错误;⑦豆浆和雾都能产生丁达尔效应,均属于胶体,正确。
答案:D►变式应用1.下列物质与常用危险化学品的类别不对应的是( )A.H2SO4、NaOH——腐蚀品B.CH4——易燃液体C.CaC2、Na——遇湿易燃物品D.KMnO4、K2Cr2O7——氧化剂解析:H2SO4、NaOH都具有强腐蚀性,故A项正确;CH4、C2H4属于烃类,都是易燃气体,故B项错误;CaC2、Na遇水会发生反应生成易燃的C2H2、H2,故C项正确;KMnO4、K2Cr2O7都具有强氧化性,故D项正确。
人教版高一化学必修1复习资料第二章:化学物质及其变化

第二章化学物质及其变化第一节物质的分类[练习]1.关于分散系和胶体的说法正确的是()A.胶体、浊液、溶液都是分散系B.粒子的半径:浊液>溶液>胶体C.可见光透过溶液时,产生丁达尔现象D.胶体都不透明、且稳定性极强(3)Fe(OH)3胶体的制备方法:将饱和FeCl3溶液滴入沸水中,继续加热至体系呈红褐色,停止加热,得Fe(OH)3胶体。
[练习]2.将饱和FeCl3溶液分别滴入下列溶液或水中,能形成胶体的是()A.冷水B.煮沸的蒸馏水C.NaOH浓溶液D.NaCl浓溶液第二节离子反应一、电解质和非电解质电解质:在水溶液里或.熔融状态下能导电的化合物。
1、化合物非电解质:在水溶液中和.熔融状态下都不能导电的化合物。
(如:酒精[乙醇]、蔗糖、SO2、SO3、NH3、CO2等是非电解质。
)(1)电解质和非电解质都是化合物,单质和混合物既不是电解质也不是非电解质。
(2)酸、碱、盐和水都是电解质(特殊:盐酸是电解质溶液)。
(3)能导电的物质不一定是电解质。
能导电的物质:电解质溶液、熔融的碱和盐、金属单质和石墨。
电解质需在水溶液里或熔融状态下才能导电。
固态电解质(如:NaCl晶体)不导电,液态酸(如:液态HCl)不导电。
2、溶液能够导电的原因:有能够自由移动的离子。
[练习]3.下列物质在一定条件下能导电,但不是电解质的是()A.铝B. 食盐C.硫酸D.蔗糖4.下列关于电解质的说法正确的是()A.液态HCl不导电,所以HCl不是电解质B.NH3溶于水形成的溶液能导电,所以NH3是电解质C.SO2溶于水能导电,所以SO2是电解质D.BaSO4在水溶液中难导电,但熔融下能导电所以BaSO4是电解质3、电离方程式:要注意配平,原子个数守恒,电荷数守恒。
如:Al2(SO4)3=2Al3++3SO42-[练习]5.下列电离方程式正确的是()A. H2SO4=H2++SO42-B. AlCl3=Al3++3Cl-C. Ba(OH)2=Ba2++(OH)2-D. HNO3=H++N5++3O2-二、离子反应:1、离子反应发生的条件:离子反应发生条件:生成沉淀、生成气体、水。
高三化学复习必修1知识点:第二章化学物质及其变化

高三化学复习必修 1 知识点:第二章化学物质及其变化宇宙是由物质构成的,化学则是人类认识和改造物质世界的主要方法和手段之一,以下是查词典化学网为大家整理的高三化学复习必修 1 知识点,希望能够解决您所碰到的有关问题,加油,查词典化学网向来陪同您。
一、物质的分类把一种(或多种)物质分别在另一种(或多种)物质中所获得的系统,叫分别系。
被分别的物质称作分别质 (能够是气体、液体、固体 ),起容纳分别质作用的物质称作分别剂(能够是气体、液体、固体)。
溶液、胶体、浊液三种分别系的比较分别质粒子大小/nm 外观特点可否经过滤纸有否丁达尔效应实例溶液小于 1 平均、透明、稳固能没有NaCl、蔗糖溶液胶体在 1— 100 之间平均、有的透明、较稳固能有Fe(OH)3胶体浊液大于 100 不平均、不透明、不稳固不可以没有泥水二、物质的化学变化1、物质之间能够发生各种各种的化学变化,依照必定的标准能够对化学变化进行分类。
(1)依据反响物和生成物的类型以及反响前后物质种类的多少能够分为:A 、化合反响 (A+B=AB)B、分解反响 (AB=A+B)C、置换反响 (A+BC=AC+B)D 、复分解反响 (AB+CD=AD+CB)(2)依据反响中能否有离子参加可将反响分为:A、离子反响:有离子参加的一类反响。
主要包含复分解反响和有离子参加的氧化复原反响。
B、分子反响 (非离子反响 )(3)依据反响中能否有电子转移可将反响分为:A 、氧化复原反响:反响中有电子转移(得失或偏移 )的反响本质:有电子转移(得失或偏移 )特点:反响前后元素的化合价有变化B、非氧化复原反响2、离子反响(1)、电解质:在水溶液中或消融状态下能导电的化合物,叫电解质。
酸、碱、盐都是电解质。
在水溶液中或消融状态下都不可以导电的化合物,叫非电解质。
注意:①电解质、非电解质都是化合物,不一样之处是在水溶液中或消融状态下可否导电。
②电解质的导电是有条件的:电解质一定在水溶液中或消融状态下才能导电。
XX高一化学必修1第二章知识点归纳

XX高一化学必修1第二章知识点归纳第二章化学物质及其变化一.物质的分类1.分类是学习和研究化学物质及其变化的一种常用的基本方法,它不仅可以使有关化学物质及其变化的知识系统化,还可以通过分门别类的研究,了解物质及其变化的规律。
分类要有一定的标准,根据不同的标准可以对化学物质及其变化进行不同的分类。
交叉分类和树状分类是常用的分类方法。
2.分散系及其分类把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫分散系。
被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
二.物质的化学变化1.物质之间可以发生各种各样的化学变化,依据一定的标准可以对化学变化进行分类。
⑴根据反应物和生成物的类别以及反应前后物质种类的多少可以分为:A.化合反应(A+B=AB)B.分解反应(AB=A+B).置换反应(A+B=A+B)D.复分解反应(AB+D=AD+B)。
⑵根据反应中是否有离子参加可将反应分为:A.离子反应:有离子参加的一类反应;B.分子反应(非离子反应);⑶根据反应中是否有电子转移可将反应分为:;A.氧化还原反应:反应中有电子转移(得失或偏移);实质:有电子转移(得失或偏移);特征:反应前后元素的化合价有变化;B.非氧化还原反应;2.离子反应;⑴电解质:在水溶液中或熔化状态下能导电的化合物,;酸:电离时生成的阳离子全部是氢离子的化合物;碱:电离时A.离子反应:有离子参加的一类反应。
主要包括复分解反应和有离子参加的氧化还原反应。
B.分子反应(非离子反应)。
⑶根据反应中是否有电子转移可将反应分为:A.氧化还原反应:反应中有电子转移(得失或偏移)的反应。
实质:有电子转移(得失或偏移)特征:反应前后元素的化合价有变化B.非氧化还原反应2.离子反应⑴电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。
酸、碱、盐都是电解质。
酸:电离时生成的阳离子全部是氢离子的化合物碱:电离时生成的阴离子全部是氢氧根离子的化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高一化学必修1第二章复习提纲及试题第二章化学物质及变化班别________________ 姓名_________________第一节物质的分类1、物质的分类方法有多种,常见的有:树状分类法、交叉分类法等等。
用树状分类法将物质分类一般分为:混合物:溶液、浊液、胶体金属单质:Na、Fe、Cu等物质单质非金属单质:Cl2、H2、、O2、O3、C60等纯净物酸:HCl、H2CO3等无机化合物碱:NaOH、Ba(OH)2、NH3·H2O等化合物盐:Na2CO3、NaHSO4、Cu(OH)2(CO3)2氧化物:CO、CO2、CuO等有机化合物:CH3COOH、CH4、C2H6、CH3CH2OH等[练习1].下列各组物质分类正确的是( )酸碱盐氧化物A 硫酸纯碱氯化钠铁红B 氢硫酸烧碱纯碱生石灰C 碳酸熟石灰蔗糖水D 二氧化碳苛性钾食盐石灰石2、胶体的概念和性质①概念——分散质微粒的直径大小在1nm~100nm之间的分散系称做“胶体”。
根据分散剂状态,可将胶体分为液溶胶,如氢氧化铁胶体、淀粉溶液;气溶胶,如云、雾、烟;固溶胶,如有色玻璃、烟水晶。
②胶体有如下的性质丁达尔效应——丁达尔效应是粒子对光散射作用的结果。
布朗运动——在胶体中,由于质点在各个方向所受的力不能相互平衡而产生的无规则的热运动,称为“布朗运动”。
*电泳——在外加电场的作用下,胶体的微粒在分散剂里向阴极(或阳极)做定向移动的现象。
注意:电泳只是胶粒定向地向电极运动,并没有凝聚而沉淀。
凝聚——胶体分散系中,分散质微粒相互聚集而下沉的现象称为“凝聚”。
能促使溶胶凝聚的物理或化学因素有加电解质(酸、碱及盐)、加热、溶胶浓度增大、加带相反电荷的胶体等。
[练习2].下列关于胶体和溶液的说法中,不正确的是 ( )A、胶体粒子直径为1-100nm,比较稳定,无色透明B、往Fe(OH)3胶体中逐滴加入稀硫酸会产生沉淀而后沉淀逐渐溶解C、江河入海口三角洲的形成通常与胶体的性质有关D、浊液、溶液、胶体的本质特征在于分散质粒子大小不同第二节离子反应1、电解质与非电解质①电解质:在水溶液里或熔化状态下能够导电的化合物,如酸、碱、盐、水、金属氧化物等。
②非电解质:在水溶液里和熔融状态下都不导电的化合物,如非金属氧化物、有机物等。
小结(1)、能够导电的物质不一定是电解质。
电解质本身也未必导电。
(2)、电解质必须在水溶液里或熔化状态下才能有自由移动的离子。
(3)、电解质和非电解质都是指化合物,对于不是化合物的物质既不是电解质也不是非电解质。
(4)、溶于水或熔化状态;注意:“或”字(5)、溶于水和熔化状态两个条件只需满足其中之一,溶于水不是指和水反应;(6)、BaSO4 AgCl 难溶于水,导电性差,但由于它们的溶解度太小,测不出(或难测)其水溶液的导电性,但它们溶解的部分是完全电离的,所以他们是电解质[练习3].下列说法中正确的是 ( )A.硫酸、纯碱、氯化钠和生石灰分别属于酸、碱、盐和氧化物B.蔗糖、硫酸钡和水分别属于非电解质、强电解质、弱电解质C.氯气溶于水得到的溶液氯水能导电,所以氯气是电解质D.NaCl是电解质,所以NaCl晶体、NaCl溶液、熔融NaCl都能导电2、强电解质和弱电解质①强电解质:全部电离成离子的电解质,如强酸、强碱、大多数盐及金属氧化物。
②非电解质:只有部分电离成离子的电解质,如非金属氧化物、有机物。
[练习4].在下列物质中,①CH3COOH ②HCl ③NaOH ④Cu(OH)2⑤AgCl ⑥Na2CO3⑦C2H5OH ⑧SO2⑨Fe属于电解质的是属于非电解质的是属于强电解质的是属于弱电解质的是3、电离方程式:表示电解质电离过程的式子例:NaCl===Na++Cl-[练习5].写出下列物质在水溶液中的电离方程式:氢氧化钡:碳酸钠:4、离子方程式的书写方法------写、拆、删、查注意事项:①★拆----强酸、强碱、可溶盐②不在水溶液中反应的离子反应,不能写离子方程式。
③有微溶物参加或生成的离子反应方程式书写时:a.若生成物中有微溶物析出时,微溶物用化学式表示。
b.若反应物中有微溶物参加时,分为两种情况,其一澄清溶液,写离子符号。
如CO2通入澄清石灰水中:CO2+2OH-=CaCO3↓+ H2O;其二悬浊液,应写成化学式,如在石灰乳中加入Na2CO3溶液:Ca(OH)2+ CO32-=CaCO3↓+2OH-④酸式盐参加的离子反应,书写离子方程式时,弱酸的酸式根一律不拆。
如NaHCO3和HCl反应:HCO3-+H+=H2O+CO2↑;强酸的酸式根HSO4-一般情况下要拆开。
⑤必须要考虑反应物间的适量与过量、少量的问题。
5、方程式的意义---离子方程式不仅可以表示:①一定物质间的某个反应;而且可以表示:②所有同一类型的离子反应。
[练习6].下列各组中两个溶液间的反应,均可用同一离子方程式表示的是()A.HCl和Na2CO3与HCl和NaHCO3 B.AlCl3和NaOH(少量)与AlCl3和NaOH(过量)C.BaCl2和Na2SO4与Ba(OH)2与H2SO4 D.KOH和HCl与Ba(OH)2与HCl4、方程式正误判断①看产物是否符合事实。
②看表示各物质的化学式是否正确。
③看电荷是否守恒。
④看是否漏掉了某些反应。
如,CuSO4溶液与Ba(OH)2溶液的反应,若写成:Ba2++SO42-=BaSO4↓,则漏掉了Cu2++2OH-=Cu(OH)2↓的反应。
[练习7].下列离子方程式书写正确的是()A.石灰石和盐酸反应CO32-+2H+=CO2↑+ H2O B.氯气与H2O反应:Cl2+H2O==2H++Cl-+ClO-C.钠与水反应:2Na+2H2O==2Na++2OH-+H2↑D.硫酸铜溶液与Ba(OH)2反应:Ba2++SO42-==BaSO4↓5、离子共存问题---离子共存是指离子之间不能发生离子反应,离子不能共存的条件:①生成沉淀,②产生气体,③生成难电离的物质,④发生氧化还原反应,[练习8].下列各离子组可在同一溶液中大量共存,且形成无色溶液的是( )A.K+、Na+、OH-、NO3-B.Cu2+、Ba2+、Cl-、NO3-C.Na+、Mg2+、OH-、SO42-D.Fe2+、H+、NO3-、ClO-[练习9].有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们做了如下实验:(1)将固体混合物溶于水,搅拌后得无色透明溶液(2)往此溶液中滴加硝酸钡溶液,有白色沉淀生成(3)过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解,试判断:固体混合物中肯定有,肯定没有,可能有,对可能有的物质,可采用滤液中滴加溶液方法来检验。
第三节氧化还原反应1.氧化还原反应的定义在化学反应中,有一种物质被氧化,必然有另一种物质被还原。
像这样一种物质被氧化,同时另一种物质被还原的反应,叫做氧化还原反应。
氧化反应和还原反应,是同时发生的。
2.氧化还原反应的本质(1)物质所含元素化合价升高的反应是氧化反应,物质所含元素化合价降低的反应是还原反应。
凡有元素化合价升降的化学反应都是氧化还原反应,而无化合价升降的反应则为非氧化还原反应。
(2)凡是有电子转移(得失或偏移)的化学反应都是氧化还原反应,凡是没有电子转移的化学反应则为非氧化还原反应。
(3)电子转移(得失或偏移)是氧化还原反应的本质,化合价升降是氧化还原反应的特征。
3.氧化还原反应的有关概念(1)氧化还原反应概念之间的关系(2)五条规律1)表现性质规律同种元素具有多种价态时,一般处于最高价态时只具有氧化性、处于最低价态时只具有还原性、处于中间可变价时既具有氧化性又具有还原性。
2)性质强弱规律在中,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物根据金属活动顺序表判断氧化性(还原性)的大小非金属阴离子的还原性随其单质的氧化性增强而减弱3)反应先后规律在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧化剂,则它首先与溶液中最强的还原剂作用;同理,在浓度相差不大的溶液中,同时含有几种氧化剂时,若加入还原剂,则它首先与溶液中最强的氧化剂作用。
例如,向含有FeBr2溶液中通入Cl2,首先被氧化的是Fe2+4)价态归中规律含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”的规律。
5)电子守恒规律在任何氧化—还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。
氧化还原反应能否发生,其规律是:强氧化剂+强还原剂弱氧化剂+弱还原剂4、双线桥法与单线桥法氧化还原反应与电子转移、化合价升降的关系,可用“双线桥”来表示,基本步骤为:标价态、连双线、注得失(含数目),即:①连接反应前后不同价态的同种元素;②双线桥跨越等号;③得失电子总数相等。
[练习10].下列反应一定属于氧化还原反应的是( )A.化合反应B.分解反应C.置换反应D.复分解反应[练习11].下列关于氧化还原反应说法正确的是()A.肯定一种元素被氧化,另一种元素被还原 B.某元素从化合态变成游离态,该元素一定被还原C.在反应中不一定所有元素的化合价都发生变化D.在氧化还原反应中非金属单质一定是氧化剂[练习12].下列变化过程属于还原反应的是( )A.HCl→MgCl2B.Na→Na+C.CO→CO2D. Fe3+→Fe[练习13].下列变化需要加入氧化剂的是( )A S2-→HS- B.HCO3-→CO2 C.2 Cl-→Cl2 D. Cu2+→Cu[练习14].下列物质不能做还原剂的是( )A. H2SB. Fe2+ C .Fe3+ D. SO2[练习15].下列各反应中,水只做氧化剂的是( )A. C+ H2O = CO+ H2B.2 H2O = 2 H2↑+ O2↑C. Na2O + H2O =2NaOHD.CuO+ H2= Cu+ H2O[练习16].P单质在下列反应中4P+3KOH+3H2O=3KH2PO2+PH3的变化是( )A.被氧化B.被还原C.既被氧化又被还原D.既未被氧化又未被还原[练习17].在H2SO3+2 H2S=3 H2O+3S反应中,被氧化与被还原元素的质量比为( )A.1:1B.2:1C.1:2D.3:2[练习18].油画的白色颜料含有PbSO4,久置后会变成PbS使油画变黑,如果用双氧水擦拭则可恢复原貌.试写出反应的方程式:[练习19].臭氧(O3)是一种有鱼腥气味的淡蓝色气体.它具有比O2更强的氧化性.已知臭氧能使湿的碘化钾淀粉试纸变蓝,反应中有氧气产生.则反应的方程式是,反应中氧化产物是,还原产物是 .[练习20].在反应中,______元素的化合价升高,该元素的原子______电子,被________;______元素的化合价降低,该元素的原子______电子,被_________;该反应中,___________是氧化剂,___________是氧化产物。
