pull-down
pull-down蛋白质鉴定流程

pull-down蛋白质鉴定流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!1. 样品制备:细胞裂解:将细胞培养至适当密度,收集细胞并使用裂解缓冲液裂解细胞,以释放蛋白质。
pull down和免疫共沉淀的区别

百泰派克生物科技
pull down和免疫共沉淀的区别
免疫共沉淀(Co-Immunoprecipitation,Co-IP)可在体外检测两种蛋白质之间特
定相互作用的存在。
Co-IP在非变性条件下裂解细胞,保留了许多细胞内蛋白质相
互作用。
如果蛋白质 X 能与抗体特异结合,那么与蛋白X相互结合的蛋白Y会通
过蛋白X与抗体的特异性识别一起沉淀下来。
通过研究蛋白质 Y,可以确认蛋白质X 和 Y 之间的相互作用。
在Co-IP分析中,诱饵蛋白和猎物蛋白呈天然构象状态,其相互作用发生在体内,受外部影响较少,且不需要克隆和异源表达,只需要选择合适的抗体即可开始实验。
Pull Down是一种利用诱饵蛋白富集与诱饵蛋白相互作用的蛋白质的体外亲和纯化
方法。
免疫共沉淀利用抗体蛋白识别并结合相互作用的蛋白X和Y,而Pull Down
将目标蛋白作为诱饵蛋白直接识别并结合能与其相互作用靶蛋白,具有纯化低丰度蛋白质复合物的能力,通常用于体内外的转录系统。
百泰派克生物科技使用Thermo公司最新推出的Obitrap Fusion Lumos质谱仪结合Nano-LC,提供基于Pull Down和Co-IP的蛋白质相互作用分析服务技术包裹,可
以鉴定两种已知的感兴趣蛋白质可能存在的直接相互作用、寻找可能与目标蛋白存在相互作用关系的未知蛋白,欢迎免费咨询。
蛋白相互作用Pull-Down实验
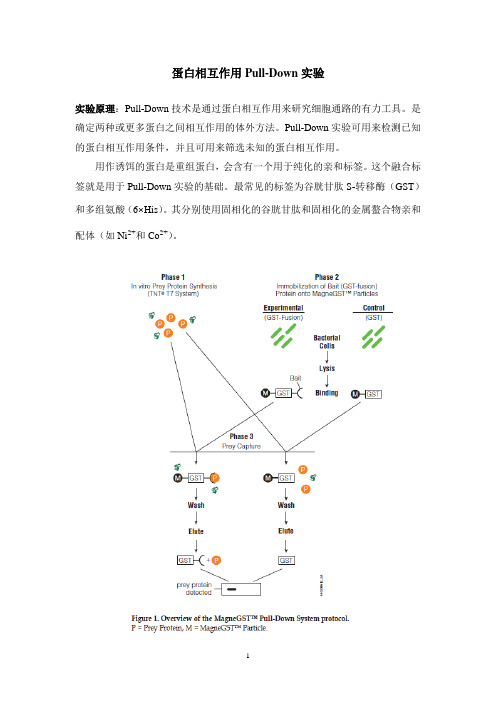
蛋白相互作用Pull-Down实验实验原理:Pull-Down技术是通过蛋白相互作用来研究细胞通路的有力工具。
是确定两种或更多蛋白之间相互作用的体外方法。
Pull-Down实验可用来检测已知的蛋白相互作用条件,并且可用来筛选未知的蛋白相互作用。
用作诱饵的蛋白是重组蛋白,会含有一个用于纯化的亲和标签。
这个融合标签就是用于Pull-Down实验的基础。
最常见的标签为谷胱甘肽S-转移酶(GST)和多组氨酸(6×His)。
其分别使用固相化的谷胱甘肽和固相化的金属螯合物亲和配体(如Ni2+和Co2+)。
实验准备:实验仪器:谷胱甘肽琼脂糖凝胶(镍离子琼脂糖凝胶)、离心机、实验材料:表达的含标签的纯化蛋白、细胞裂解液实验试剂:Binding Buffer/Washing Buffer: 4.2mM Na2HPO4、2mM KH2PO4、140mM NaCl、10mM KClSDS loading Buffer: 50mM Tris-Cl(pH6.8)、2%SDS、0.1%溴酚蓝、10%甘油、10mM DTT裂解缓冲液:20mM Tris-Cl(pH8.0)、200mM NaCl、1mM EDTA(pH8.0)、0.5% Nonidet P-40 使用前加入加入蛋白酶抑制剂。
(蛋白酶抑制剂:2ug/ul抑肽酶(aprotinin)、1ug/ul白胃素(leupeptin)、0.7ug/ml胃酶抑素(pepstatin)、25ug/ml苯甲磺酰氟(PMSF))实验方法:方法一:1、预清除细胞裂解液:将细胞裂解液与50ul的50%谷胱甘肽琼脂糖球珠悬液和25ug GST在4℃混合孵育2h。
离心机12,000g在4℃离心2min。
将上清转移至新的离心管中。
2、探测细胞裂解液两个含等量预清除细胞裂解液及50ul谷胱甘肽琼脂糖球珠的微量离心管。
在一管中加约10ug的GST蛋白,另一管中加约10ug的GST融合探针蛋白。
pull-down方法及蛋白表达纯化

3. Pull-down方法LB培养基成分:Tryptone 10 g/LY east Extract 5 g/LNaCl 10 g/L加入约800 ml的去离子水,充分搅拌溶解,继续滴加去离子水定容至1 L,高温高压灭菌后,冷却至室温。
固体培养基灭菌前加入Agar(15 g/L),含抗生素的LB灭菌后加入1 ml卡那霉素(Kanamycin,100mg/ml)或者1 ml氨苄青霉素后(Ampicillin,100mg/ml)混匀,4℃保存备用。
3.1 诱导融合蛋白方法(1)吸100μl菌液于5ml LB液体培养基中,37℃,230rpm过夜培养。
(2)按1:50的比例转接至20ml LB中,37℃,230rpm培养2-3h至OD600达到0.6-0.8之间。
(3)加IPTG(终浓度1mM)进行诱导。
(4)继续培养1-2h。
(5)将菌液转移至50ml离心管中,4000rpm 离心10min。
(6)弃上清,将离心管倒置在吸水纸上吸干。
(7)按1ml 菌液加50μl PBS溶液的比例悬浮细胞,吸打均匀。
(8)按100:1的比例加入裂解酶(25ml 细胞悬浮液加25μl 裂解酶),混匀室温放置5min(如裂解物太粘稠,可用10μg/ml DNase处理)。
(9)把裂解的细胞悬浮液放入液氮中20s,再将其放入37℃温水中融化,反复10次。
(10)12000rpm 离心10min,吸取上清到另一离心管中。
(11)吸取部分样品中加入2×上样Buffer,混匀,SDS-PAGE电泳。
3.2 带His标签蛋白纯化(康为世纪Ni-Agarose resin for 6×His-tagged proteins)表达载体为pET28a,表达菌株为全式金公司Transetta。
大肠杆菌表达系统,可溶性蛋白的纯化:(1)收集菌体后,将菌体重悬于Binding Buffer,裂解菌体。
(2)将凝胶灌柱,依次用3倍体积的去离子水和8倍体积的Binding Buffer平衡。
蛋白相互作用Pull-Down实验
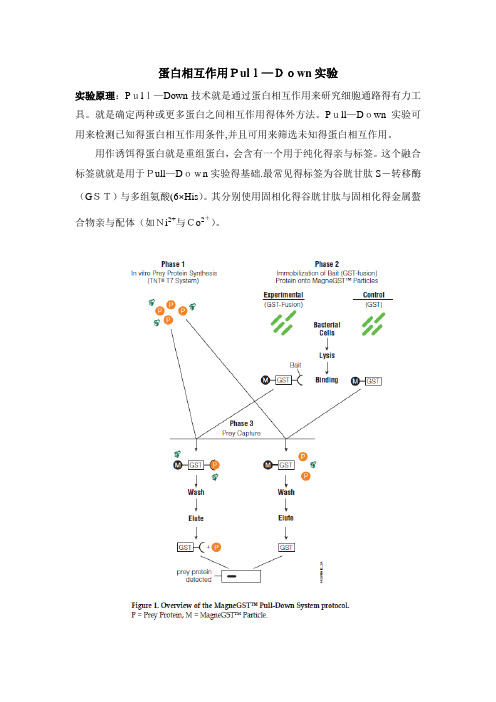
蛋白相互作用Pull—Down实验实验原理:Pull—Down技术就是通过蛋白相互作用来研究细胞通路得有力工具。
就是确定两种或更多蛋白之间相互作用得体外方法。
Pull—Down实验可用来检测已知得蛋白相互作用条件,并且可用来筛选未知得蛋白相互作用。
用作诱饵得蛋白就是重组蛋白,会含有一个用于纯化得亲与标签。
这个融合标签就就是用于Pull—Down实验得基础.最常见得标签为谷胱甘肽S-转移酶(GST)与多组氨酸(6×His)。
其分别使用固相化得谷胱甘肽与固相化得金属螯合物亲与配体(如Ni2+与Co2+)。
实验准备:实验仪器:谷胱甘肽琼脂糖凝胶(镍离子琼脂糖凝胶)、离心机、实验材料:表达得含标签得纯化蛋白、细胞裂解液实验试剂:BindingBuffer/Washing Buffer:4、2mM Na2HPO4、2mM KH2PO4、140mM NaCl、10mM KClSDSloading Buffer:50mMTris—Cl(pH6、8)、2%SDS、0、1%溴酚蓝、10%甘油、10mM DTT裂解缓冲液:20mM Tris-Cl(pH8、0)、200mM NaCl、1mM EDTA(pH8、0)、0、5%Nonidet P-40 使用前加入加入蛋白酶抑制剂.(蛋白酶抑制剂:2ug/ul抑肽酶(aprotinin)、1ug/ul白胃素(leupeptin)、0、7ug/ml胃酶抑素(pepstatin)、25ug/ml苯甲磺酰氟(PMSF))实验方法:方法一:1、预清除细胞裂解液:将细胞裂解液与50ul得50%谷胱甘肽琼脂糖球珠悬液与25ug GST在4℃混合孵育2h。
离心机12,000g在4℃离心2min.将上清转移至新得离心管中.2、探测细胞裂解液两个含等量预清除细胞裂解液及50ul谷胱甘肽琼脂糖球珠得微量离心管.在一管中加约10ug得GST蛋白,另一管中加约10ug得GST融合探针蛋白.两个反应中加入得探针与对照蛋白质得量应该就是等摩尔得.将离心管在4℃翻转混合孵育2h。
pull-down方法步骤汇总

pull-down⽅法步骤汇总GST-Pull down:1) 利⽤纯化好的蛋⽩进⾏GST-Pull down 实验操作。
2) 实验设置2 个组合,第⼀个是实验组(90 µl BP-His +90 µl BRM(689-952aa)-GST),第⼆个是负对照组(90 µl BP-His + 10 µl GST),分别在1.5 ml 的离⼼管中混合均匀。
3) 加⼊1 ml binding buffer,充分混合均匀,冰箱内30 rpm 旋转⾄少2h。
4) 加⼊30 µl GST-Bind TM Resin,冰箱内30 rpm 旋转⾄少2 h。
,100 g 离⼼ 2 min,弃去上清。
6) 加⼊1 ml binding buffer,冰箱内30 rpm 旋转5 min 进⾏洗涤,然后,100 g 离⼼ 2 min,弃去上清。
重复 5 次。
7) 加⼊40 µl 5×SDS-PAGE loading buffer,煮沸5 min,12000 g,离⼼30 sec,吸取上清点样进⾏SDS-PAGE 电泳。
8) 12 %的SDS-PAGE 胶,120 V 电泳90 min。
9) 转膜,使⽤PVDF 膜,使⽤前⽤甲醇浸泡10 min,350 mA 电流转膜2h。
10) ⽤5 %的脱脂⽜奶封闭膜,60 rpm,1 h。
11) 加⼊⼀抗(20 ml 5 %的脱脂⽜奶+5 µl anti-His),60 rpm,1 h。
12) 倒掉⼀抗,加⼊10 ml western blotting wash buffer,60 rpm,10 min,重复3 次。
13) 加⼊⼆抗(20 ml 5 %的脱脂⽜奶+5 µl Goat anti- mouse IgG(H+L) HRP conjugate),60 rpm,1 h。
14) 倒掉⼆抗,加⼊10 ml western blotting wash buffer,60 rpm,10 min,重复3 次。
In vitro pull down

Pull-Down技术是通过蛋白相互作用来研究细胞通路的有力工具。
Pull-Down实验是确定两种或更多蛋白之间相互作用的体外方法。
Pull-Down实验可用来检测已知蛋白的表达和相互作用条件,并且可用来筛选未知的蛋白相互作用。
Pull-Down实验至少需要一种纯化的标签蛋白(诱饵)用来捕获和“pull-down”靶蛋白(猎物)。
Pull-Down vs.免疫沉淀Pull-Down实验是亲和纯化的一种形式,其与免疫沉淀十分类似,不同之处在于使用诱饵蛋白代替了抗体。
在Pull-Down实验中,带有标签的诱饵蛋白被特异结合该标签的固相化亲和配基捕获,产生“次级亲和支持物”,用于纯化与诱饵蛋白相互作用的其他蛋白。
含有固相化诱饵蛋白的次级亲和支持物可以与含有推测猎物蛋白的各种蛋白样品相互孵育。
如果缓冲液及样品条件与靶结合相互作用兼容,且诱饵蛋白在带有标签和被固相化时仍然可以行使功能,那么存在于样品中的猎物蛋白就会结合到亲和支持物上。
如果特异结合相互作用的亲和性足够强,那么非结合的样品成分可以被洗涤掉,进而纯化形式的猎物或诱饵-猎物复合体可被从支持物上洗脱下来。
诱饵蛋白固相化策略1.依赖固相化抗体结合蛋白(例如蛋白A或蛋白G琼脂糖)的免疫沉淀形式显然对pull-down实验不是很有效。
必须使用其他亲和系统固相化诱饵蛋白(例如‘bait the hook’)。
如果有纯化的天然的诱饵蛋白,可将其用生物素进行标记或偶联一些其他小的标签,以适用于现成的亲和树脂。
即用型生物素化试剂及标记试剂盒(见目录第九节,281页),可实现使用链亲和素琼脂糖树脂进行pull-down实验。
2. 如果被用作诱饵的蛋白是重组蛋白,那么其很可能会含有一个用于纯化的亲和标签。
这个融合标签就会成为该诱饵蛋白用于pull-down实验的基础。
最常见的标签为谷胱甘肽S-转移酶(GST)和多组氨酸(6×His),其分别使用固相化的谷胱甘肽和固相化的金属螯合物亲和配体。
pull down蛋白质谱

百泰派克生物科技
pull down蛋白质谱
Pull Down是一种利用体外亲和纯化方法确定两种或多种蛋白质之间的物理相互作
用的方法,既可用于确认由其他研究技术(例如,共免疫沉淀)预测的蛋白质-蛋
白质相互作用的存在,也可作为鉴定以前未知的蛋白质-蛋白质相互作用的初始筛
选测定法。
理解蛋白质结构和功能的第一步是确定哪些蛋白质相互作用,从而确定相关的细胞生理途径。
Pull Down已经成为通过对感兴趣的蛋白质-蛋白质相互作
用研究细胞途径的宝贵工具。
Pull Down将相互作用的蛋白从蛋白混合物中提取出来,需要进一步借助其他技术
进行定性或定量鉴定,Pull Down蛋白质谱就是利用质谱技术对Pull Down拉下的
蛋白进行后续鉴定,以验证预测的蛋白相互作用或发现新的与目的蛋白相互作用的蛋白质。
质谱技术通过分析待测物裂解离子的质荷比实现物质的鉴定,是蛋白质鉴定的强有力技术,且其灵敏度和分辨率以及准确性都具有明显优势,是Pull Down
后进行靶蛋白鉴定的首选技术。
百泰派克生物科技使用Thermo公司最新推出的Obitrap Fusion Lumos质谱仪结合Nano-LC,利用进口的GST pull-down 试剂盒,提供Pull down靶蛋白质谱鉴定一
站式技术服务。
您只需要将您的需求和样品寄给我们,我们会负责项目后续所有事宜,包括样品前处理、pull down、质谱分析、质谱原始数据分析,欢迎免费咨询。
pull-down试验方法(自己总结)

pull-down试验方法(自己总结)pull-down试验方法(自己总结)12、GST蛋白的表达和纯化12、1 GST蛋白的表达(1)将表达GST融合蛋白的质粒转入BL21大肠杆菌菌株中。
(2) 挑单克隆于3ml LA(LB+Amp)培养基中,37℃摇菌过夜,获得种子液。
(3)将种子液稀释于50ml2XYTA(YTG+Amp)培养基中,使起始OD600为0、1。
(4)28℃,220rpm摇菌培养2小时。
(5)加入50μl100mM IPTG,16~27℃摇菌培养1~8小时。
(6)收菌,将菌液倒入大离心管,2管/50ml菌液,4℃5krpmx5min离心,弃上清。
(7)加入10ml PBS/管,重悬细胞,5krpm离心5min,弃上清。
(8) 加入2ml PBS/管,重悬细胞。
转移至5ml离心管。
(9)超声破壁破壁前,在细胞悬液中加20μl10mg/ml PMSF,80μl 蛋白酶抑制剂(100x)。
破壁参数:Frequency:100~200w 60s,pause 20s run40s,5cycles破至菌体由浑浊变为澄清。
加100μl20%TritonX-100,冰上放置30min。
(10)将裂解液分入1、5ml离心管中,4℃离心12krpm10min,取上清。
(11)吸取少量上清,加入蛋白电泳上样缓冲液,在沸水中煮3min。
离心(12krpm,1min),取上清作SDS-PAGE电泳,检测表达情况。
12、2 准备50%GST Sepharose4Bslurry(1)将原75%Glutathione Sepharose4B的slurry弹至混匀。
(2) 取677μl原液/管,3krpm离心5min,弃上清。
(3)加500μl PBS,颠倒混匀,3krpm离心5min,弃上清。
反复5次。
(4)加500μl PBS,颠倒混匀,配成50%Glutathione Sepharose4B 备用。
12、3 GST融合蛋白的纯化(1)在新鲜制备的细胞裂解液上清中加入20μl50%Glutathione Sepharose4B,4℃,摇床上摇,反应30min~60min。
pull down 实验流程

pull down 实验流程英文回答:Pull down is a common phrase used in various contexts, and its meaning can vary depending on the specific situation. In general, it refers to the action of bringing something down or lowering it from a higher position. Letme explain it further with some examples.In a physical sense, pulling down can refer tophysically bringing something down. For example, if youwant to remove a poster from a wall, you would pull it down. Similarly, if you want to demolish a building, you wouldpull it down using heavy machinery or other tools. Another example is when you want to close a window blind, you would pull it down to cover the window.In a metaphorical sense, pulling down can refer to reducing or decreasing something. For instance, if you want to lower the volume of the music playing, you would pulldown the volume knob on the stereo. In a similar vein, if you want to decrease the temperature of a room, you would pull down the thermostat setting. This usage can also be applied to financial or economic situations. For example, if the stock market experiences a downturn, it means that the prices of stocks are being pulled down.Furthermore, pull down can also be used to describe the act of bringing someone's reputation or status down. This can happen through spreading negative rumors or engaging in malicious gossip. For instance, if someone spreads false rumors about a celebrity, they are trying to pull downtheir reputation. Similarly, in a competitive environment, people may try to pull down their rivals by spreading negative information about them.中文回答:"Pull down"(拉下)是一个常用的短语,其含义可以根据具体情况而有所不同。
pull-down试剂盒说明书翻译

Pierce生物素化蛋白互作Pull-Down试剂盒捕获纯化与生物素诱饵蛋白互作的蛋白Pierce生物素(酰化)蛋白互作Pull-Down试剂盒包含使用生物素标记蛋白捕获和纯化与与其互作蛋白的必要成分。
实验者须提供生物素化蛋白作为“诱饵”(见相关产品,生物素化蛋白试剂盒)和表达互作靶标推测蛋白(“猎物”)的细胞。
Pull-Down试剂盒提供剩余所有用品:细胞裂解缓冲液,微型离心机离心柱,链亲和素琼脂糖树脂,优化的结合、洗脱缓冲液及详细的操作步骤。
该试剂盒可使初学者掌握实验方法,而对于有经验的研究者更方便使用。
操作步骤简便易学(图1)。
图1. Thermo Scientific生物素化蛋白相互作用Pull-Down 试剂盒操作步骤概要."Pull-down"除了其抗体功能被一些其他亲和体系所取代外,是一种类似免疫沉淀法(IP)的小规模亲和纯化技术。
在这里,亲和体系是已知且特异的生物素-链亲和素的相互作用。
生物素化蛋白作为“诱饵”捕获推测的连接配体(即“猎物”)。
在一个典型的pull-down实验中,被固定的诱饵蛋白在细胞裂解液中孵育。
经过指定步骤的漂洗后,“反应物”被选择性洗脱以进行凝胶分析或Western印迹。
因为生物素-链亲素和的互作连接亲和度较高,一般情况下猎物蛋白被洗脱掉,而生物素化诱饵蛋白则仍保持固定在链亲和素琼脂糖树脂上,不被洗脱。
图1:图2. 生物素化的胰凝乳蛋白酶(baCT) 经过pull-down从哺乳动物细胞裂解液中捕获到的反应物牛胰胰蛋白酶抑制剂(BPTI)。
图像是用过Pull-Down试剂盒后的洗脱液和对照的Western印迹。
baCT“诱饵”固定连接在链亲和素琼脂糖树脂上。
BPTI“猎物”蛋白表达在哺乳动物细胞裂解液中。
在对BPTI进行洗脱前,baCT“诱饵”蛋白仍连接在树脂上。
经过4-20% Tris-Glycine SDS-PAGE。
转至硝化纤维膜后,样本被baCT诱饵蛋白探测到,再用Streptavidin-HRP (Product # 21124)探测,加入SuperSignal West Dura Chemiluminescent Substrate (Product # 34075),将印迹暴露在CL-XPosure X-ray Film (Product # 34080)下。
Peptide pull down 方案译文

PeptidePull-down方案设计好的备用肽段(C端末尾加几个残基作为连接臂并且末端偶联生物素,)应被色谱纯化至纯度大于80%,等分,冻干,干燥环境下于—80度储存1连接肽段的珠子的制备:(注意,制备的所有步骤都应在冰上或最多4度的环境下进行)1用1mL 磷酸盐缓冲液加0."1%的表面活性剂Triton X-100,冲洗400微升的亲和素珠(离心?(microcentrifuge),500RCF,30s)移去上清液,至少洗三次(洗去表面的保护剂,表面活性剂Triton X-100也促使疏水性的珠子与水相分离,否则无法得到上清液)制备两个400µL的珠子,其中一份不偶联肽段作为只有珠子的对照组。
用装有毛细管凝胶的移液器尖端来取上清液,从而避免移去珠子2使100微克偶联生物素的肽段重新悬浮在400微升磷酸盐缓冲液(PBS)中这些肽段的量足够配400µL偶联肽段的珠子,做20次pull—down,如果珠子有着不同的连接生物素能力,注意将肽段和亲和素比例调整合适3将2中制备好的400微升重新悬浮的肽段加入400微升洗过的珠子中,旋转(rotation),在室温下温育3到5h也可在4度过夜温育4用1 mL PBS +0."1% Triton X-100冲洗连接了肽段的珠子至少三次,来移除未连接上的肽段5将偶联了肽的珠子重新悬浮在400微升磷酸盐缓冲液中来制备50%的悬浮液,在4度下储存若长期储存,加叠氮化钠到浓度为0."1%,4度下至少可储存1个月。
甲基化修饰稳定,磷酸化修饰不稳定2用固定好的肽段从复杂混合物中钓蛋白一些一般原则:1在实验的每一步中都要确保蛋白酶抑制剂的使用,防止蛋白的降解。
2都应在冰上或最多4度的环境下进行。
3必须加未偶联肽的珠子作为阴性对照。
4除HEPES缓冲液外在这次试验中也可使用其他缓冲液5所有肽段平行处理制备蛋白质的复杂混合物1每次实验从108数量级的细胞(问题:细胞培养)中制备新鲜核提取物,采用标准的高盐溶液提取方案总量108数量级的细胞一般来说基本足够了,最好用新鲜核提取物防止蛋白降解,不过提取物可先快冻在液氮中再在-80°C储存,从不同细胞系中提取是很重要的,因为有些蛋白在给定的细胞中表达的不是很好,此外考虑到所感兴趣的组蛋白翻译后修饰所涉及的细胞有丝分裂过程,与修饰同步的,正进行有丝分裂的细胞的核提取物是合适的,一些组蛋白连接的蛋白因子在420mM浓度的盐溶液提取过程中不能被有效提取(比如那些和染色质连接很牢固的,这时就要考虑其他提取组蛋白方法了,比如用DNA水解酶或微球菌核酸酶来使组蛋白溶解)2调整提取物的盐浓度到150毫摩每升:利用KCl盐浓度为150毫摩每升的缓冲液D透析或利用无盐缓冲液buffer D 稀释,调整体积到每毫升108当量细胞,(总蛋白浓度约为2."5µg/µL)向buffer D加入新制的DTT, PMSF,蛋白酶抑制剂是很重要的3添加表面活性剂Triton X-100到提取物中使得Triton X-100浓度为0."1%Triton X-100对防止pull down过程中蛋白的非特异性连接很重要4最大速度(13200RCF)离心15到30min,清除所有沉淀,转移上清液到干净试管中4°C下我们用13200转每分的台式离心机,等待一段时间来确保所有的可见沉淀都被从核提取物中清出,彻底移去所有沉淀是非常重要的,会显著减少非特异性连接的背景水平复杂混合物与珠子的处理5每份将80 µL(50%)的未偶联的珠子溶液(含40µL珠子),离心使成团(500RCF,30s),移除上清液6用500 µL Buffer D(含浓度为150 mM的KCl)将珠子至少洗一次(500 RCF,30s,移去上清液,避免移走珠子)7将制备的核提取物加到洗过的珠子中,在4度下轻轻旋转(rotation)温育30分钟若方便可以增加温育时间,然而预清理时间在超过30分后,我们再没能观察到非特异性连接蛋白背景水平的下降。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. Immobilize the fusion-tagged “bait” from the lysate固定裂解液中带融合标签(fusion tag)的诱饵蛋白-------Agarose bead琼脂糖小球--affinity ligand 亲和配体+Bait protein-containing solution裂解液中诱饵蛋白(带融合标签)
2. wash away unbound protein洗去为结合的诱饵蛋白
--------spin旋转
3. Bind “prey” protein to immobilized “bait” protein
---------琼脂糖小球-亲和配体-结合融合标签的诱饵蛋白+prey protein-containing lysate裂解液中的捕获蛋白
4. wash away unbound protein洗去为结合的捕获蛋白
--------spin旋转
5.Elute protein-protein interaction complex 洗脱相互作用蛋白复合物
-------- 琼脂糖小球-亲和配体-结合融合标签的诱饵蛋白-捕获蛋白-------Elution洗脱-------琼脂糖小球-亲和配体+结合融合标签的诱饵蛋白-捕获蛋白(displaced interacting complex置换相互作用复合物)
6. Analyze protein-protein interaction complex by SDS-PAGE
注:
Affinity ligand(glutathione,Co2+chelate or streptavidin)
Fusion tag(GST,polyHis or Biotin)结合在诱饵蛋白上,作为标记
亲和配体和fusion tag相结合。
