pull-down试验方法(自己总结)
pull down 实验方法

.;.Pull Down实验流程1. 混合两种预测相互作用的蛋白。
(Protein-A-GST & Protein-B-HIS,下面实验用GST 树脂IP,用Western Blot检测HIS;反之亦然。
如果是纯化后的蛋白,需要进行偷袭或者使用超滤离心管为蛋白更换溶液,之后才能继续Pull Down。
)2. 加入1 mL Binding Buffer。
Binding Buffer:50 mM Tris.HCl (pH7.50.)100 mM NaCl0.25% Triton-X 10035 mM β-Me(巯基乙醇)3. 将混合蛋白在4℃条件下旋转结合2-4 h。
4. 加入20-30 μL GST-Bind TM Resin结合2-4 h。
5. 4 ℃,150-200 g 离心2 min,吸弃上清(小心!不要吸弃底部沉淀)。
第一次弃去的上清样品记为Washing- Protein-A/ Protein-B,用于SDS-PAGE电泳时的对照。
6. 加入1 mL Binding Buffer,4 ℃条件下旋转混匀5-10 min,4 ℃,150-200 g 离心2 min,吸弃上清。
7. 重复步骤6,用1 mL Binding Buffer 清洗5-6次。
8. 最后一次清洗后留有20-30 μL 液体,加入适量的Loading Buffer,95℃金属浴5-10 min,150-200 g 离心5 min,样品记为上样跑SDS-PAGE电泳。
电泳样品顺序:Marker,Protein-A-GST,Protein-B-HIS,Washing- Protein-A/ Protein-B,Pull Down- Protein-A/ Protein-B此次电泳的目的,一是初步检测两个蛋白是否互作,二是可以为后面正式实验所需蛋白量提供参考。
用于正式检测两个蛋白是否互作电泳顺序如下:(input,蛋白量为后两者的1/10)Marker,Protein-B-HIS ,GST+ Protein-B-HIS,Protein-A-GST+ Protein-B-HISMarker,Protein-A-GST ,HIS+ Protein-A-GST,Protein-B-HIS+ Protein-B-GST9. 转PVDF膜,350 mA 恒流,2 h 左右。
深入解析pull down实验:从技术原理到生物学意义

深入解析pull down实验:从技术原理到生物学意义蛋白质在细胞内发挥着关键的生物学功能,它们之间的相互作用是细胞内信号传递和调控的基础。
为了揭示蛋白质互作网络,科学家们发展了许多实验技术,其中pull down实验是一种被广泛应用的方法。
本文将从技术原理和生物学意义两个方面,深入解析pull down实验。
1.技术原理:Pull down实验基于亲和层析原理,利用蛋白质之间的特异性相互作用,通过诱捕靶蛋白及其相互作用伙伴,进而对其进行分离和鉴定。
该实验通常包括以下步骤:1.1选择适当的亲和剂:亲和剂是一种具有高亲和力的分子,用于捕获目标蛋白及其互作伙伴。
常见的亲和剂包括抗体、蛋白结构域和配体。
1.2亲和剂的固定:将选择的亲和剂固定在固相支持物上,如琼脂糖糖珠或磁珠。
固定亲和剂的选择应考虑其特异性、亲和力和稳定性。
1.3样品处理:将细胞提取物或组织溶液与亲和剂固相进行孵育,以使目标蛋白及其互作伙伴与亲和剂结合。
1.4洗脱和分析:通过洗脱步骤去除非特异性结合的蛋白质,并将目标蛋白及其互作伙伴从亲和剂上洗脱。
洗脱后的样品可以进行质谱分析、免疫印迹等方法进一步鉴定和定量。
2.生物学意义:Pull down实验在生物学研究中具有重要的意义。
通过该实验,我们可以获得以下信息:2.1互作伙伴的识别:通过pull down实验,我们可以鉴定特定蛋白质的互作伙伴,揭示蛋白质相互作用网络,有助于理解细胞信号传递和调控的机制。
2.2功能分析:通过确定互作伙伴,我们可以推断目标蛋白的功能和调控途径。
例如,某个蛋白质的互作伙伴可能是其底物、调控因子或抑制剂。
2.3蛋白质复合物的研究:pull down实验可用于研究蛋白质复合物的组成和结构。
通过确定复合物成员及其相互作用方式,我们可以深入了解复杂的蛋白质互作网络。
Pull down实验是一项强大的实验技术,用于揭示蛋白质之间的相互作用和功能。
通过该实验,我们可以更好地理解生物体内的分子相互作用机制,并为药物研发和疾病治疗提供重要的基础。
pull-down流程和结果模板

广州辉骏生物科技有限公司
Pull down
一、原理
Pull-down又叫做蛋白质体外结合实验,是在外源条件下检测蛋白质间相互作用的方法。
基本原理:将靶蛋白-GST融合蛋白亲和固化在谷胱甘肽亲和树脂上,充当“诱饵蛋白”,目的蛋白溶液过柱,可从中捕获与之相互作用的结合蛋白,洗脱结合物后通过SDS-PAGE电泳分析,验证两种蛋白间的相互作用或筛选相应的目的蛋白;“诱饵蛋白”一般采用原核表达(也可以通过其他方式)获得,而“捕获蛋白”可以是细胞裂解物、纯化蛋白或表达系统获得的蛋白。
二、实验流程
1、构建带标签的诱饵蛋白原核表达载体(带his或GST标签);
2、载体转化大肠杆菌,表达诱饵蛋白(这一步比较关键,很多蛋白原核表达会形成包涵体,
极大影响后续实验,我们采用自诱导培养基培养细菌,使得包涵体形成的几率大大降低);
3、裂解细菌,裂解液过柱子(特异结合his或GST标签);
4、待测样品裂解,裂解液过柱子,互作蛋白被吸附在柱子;
5、清洗,离心,去除未结合的杂蛋白;
6、洗脱,得到诱饵蛋白及其互作蛋白的复合物;
7、下一步根据实验目的可以去做Western blot或质谱
1)如要验证某个蛋白X与诱饵蛋白互作,则拿上一步的蛋白复合物去孵育X的抗体,做Western blot;
2)如要寻找诱饵蛋白的所存在的可能的互作蛋白,则拿上一步的蛋白复合物去做LC-MS/MS,对照组、实验组的复合物分别做LC-MS/MS;
三、结果
GST:对照;
GST-X:实验;
Y:目的蛋白溶液
图1 pull down验证两个蛋白互作结果
Pull down寻找互作蛋白的结果是两组质谱结果,可参考TAP/MS的结果。
蛋白相互作用Pull-Down实验

蛋白相互作用Pull-Down实验实验原理:Pull-Down技术是通过蛋白相互作用来研究细胞通路的有力工具。
是确定两种或更多蛋白之间相互作用的体外方法。
Pull-Down实验可用来检测已知实验仪器:谷胱甘肽琼脂糖凝胶(镍离子琼脂糖凝胶)、离心机、实验材料:表达的含标签的纯化蛋白、细胞裂解液实验试剂:Binding Buffer/Washing Buffer: 4.2mM Na 2HPO 4、2mM KH 2PO 4、140mM NaCl 、10mM KClSDS loading Buffer: 50mM Tris-Cl(pH6.8)、2%SDS、0.1%溴酚蓝、10%甘油、10mM DTT裂解缓冲液:20mM Tris-Cl(pH8.0)、 200mM NaCl、 1mM EDTA(pH8.0)、3、4、探测细胞裂解液两个含等量预清除细胞裂解液及50ul谷胱甘肽琼脂糖球珠的微量离心管。
在一管中加约10ug的GST蛋白,另一管中加约10ug的GST融合探针蛋白。
两个反应中加入的探针和对照蛋白质的量应该是等摩尔的。
将离心管在4℃翻转混合孵育2h。
最大速度在4℃离心样品2min。
在新的微量离心管中收集上清。
用1ml冰冷的裂解液洗球珠。
在离心机上以最大速度离心1ml。
弃去上清。
4℃孵育结合30min。
2、结合GST融合探针蛋白的谷胱甘肽琼脂糖凝胶球珠与100ul细胞裂解液结合在4℃作用4h。
3、3000rpm在4℃离心5min,除去上清。
4、用洗涤缓冲液重悬谷胱甘肽琼脂糖凝胶球珠,3000rpm在4℃离心5min,除去上清,重复5次。
5、取谷胱甘肽琼脂糖凝胶球珠进行SDS-PAGE电泳分析。
将谷胱甘肽琼脂糖凝胶颠倒混匀后取20ul到1.5ml离心管中,小心去除上清,加250ul Binding Buffer或wash Buffer到凝胶中,混匀。
重复洗3次以上。
平衡好的凝胶用100ul Binding Buffer或wash Buffer重悬。
pulldown实验原理

pulldown实验原理Pulldown实验是一种常用的分子生物学实验技术,用于研究蛋白质与DNA或RNA之间的相互作用。
该实验原理基于核酸的亲和性纯化技术。
在Pulldown实验中,我们需要准备两种重要的试剂:目的蛋白和亲和填料。
目的蛋白是我们想要研究的蛋白质,而亲和填料则是用于显示目的蛋白与核酸相互作用的亲和性表位。
通常,亲和填料有两种类型:固定填料和亲和标记填料。
固定填料是通过共价键结合到固定材料上,如琼脂糖珠。
而亲和标记填料则是具有荧光或放射性同位素等标记,以便于后续的蛋白质分析。
Pulldown实验的步骤如下:1.准备目的蛋白:我们首先需要克隆目的蛋白的基因,并将其表达在适当的表达系统中,如大肠杆菌。
通过分析蛋白质序列,我们可以知道目的蛋白背后的结构和功能。
2.准备亲和填料:根据目的蛋白的特性,选择适当的亲和填料。
例如,如果目的蛋白是DNA结合蛋白,我们可以使用DNA纯化填料,如聚腺酸。
如果目的蛋白是RNA结合蛋白,我们可以使用RNA纯化填料。
3.将目的蛋白和亲和填料结合:将目的蛋白与亲和填料一起孵育,以使它们发生特异性的相互作用。
这可以通过混合目的蛋白和亲和填料,在适当的缓冲液中进行几个小时的孵育来完成。
4.固定亲和复合物:使用试剂将亲和复合物固定在固定剂上,如琼脂糖珠。
这可以通过将珠子加入到反应中,然后对混合物进行旋转和洗涤来完成。
5.洗涤亲和复合物:通过多次洗涤琼脂糖珠,去除非特异性结合的蛋白质和其他杂质。
这可以通过多次旋转珠子和加入适当的洗涤缓冲液来完成。
6. 蛋白质分析:现在我们已经得到了特异性的目的蛋白-亲和填料复合物。
我们可以通过热变性、SDS-、Western blotting等方法对复合物进行分析和检测。
这些分析方法可以帮助我们确定目的蛋白质与DNA或RNA的相互作用。
通过Pulldown实验,我们可以研究蛋白质与DNA或RNA之间的相互作用,从而深入了解生物分子的功能和结构。
蛋白相互作用Pull-Down实验
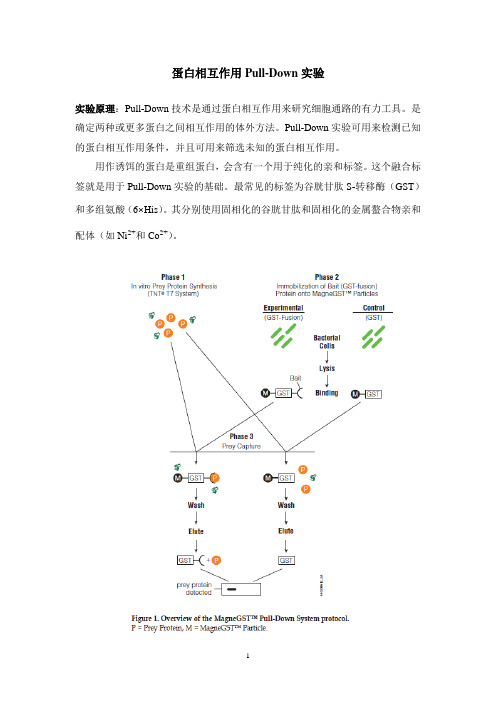
蛋白相互作用Pull-Down实验实验原理:Pull-Down技术是通过蛋白相互作用来研究细胞通路的有力工具。
是确定两种或更多蛋白之间相互作用的体外方法。
Pull-Down实验可用来检测已知的蛋白相互作用条件,并且可用来筛选未知的蛋白相互作用。
用作诱饵的蛋白是重组蛋白,会含有一个用于纯化的亲和标签。
这个融合标签就是用于Pull-Down实验的基础。
最常见的标签为谷胱甘肽S-转移酶(GST)和多组氨酸(6×His)。
其分别使用固相化的谷胱甘肽和固相化的金属螯合物亲和配体(如Ni2+和Co2+)。
实验准备:实验仪器:谷胱甘肽琼脂糖凝胶(镍离子琼脂糖凝胶)、离心机、实验材料:表达的含标签的纯化蛋白、细胞裂解液实验试剂:Binding Buffer/Washing Buffer: 4.2mM Na2HPO4、2mM KH2PO4、140mM NaCl、10mM KClSDS loading Buffer: 50mM Tris-Cl(pH6.8)、2%SDS、0.1%溴酚蓝、10%甘油、10mM DTT裂解缓冲液:20mM Tris-Cl(pH8.0)、200mM NaCl、1mM EDTA(pH8.0)、0.5% Nonidet P-40 使用前加入加入蛋白酶抑制剂。
(蛋白酶抑制剂:2ug/ul抑肽酶(aprotinin)、1ug/ul白胃素(leupeptin)、0.7ug/ml胃酶抑素(pepstatin)、25ug/ml苯甲磺酰氟(PMSF))实验方法:方法一:1、预清除细胞裂解液:将细胞裂解液与50ul的50%谷胱甘肽琼脂糖球珠悬液和25ug GST在4℃混合孵育2h。
离心机12,000g在4℃离心2min。
将上清转移至新的离心管中。
2、探测细胞裂解液两个含等量预清除细胞裂解液及50ul谷胱甘肽琼脂糖球珠的微量离心管。
在一管中加约10ug的GST蛋白,另一管中加约10ug的GST融合探针蛋白。
pulldown实验原理及步骤

pulldown实验原理及步骤一、实验原理pulldown实验是一种常用的实验方法,用于研究蛋白质与DNA的相互作用。
该实验利用特定的蛋白质结合域与DNA结合,通过蛋白质与DNA的特异性相互作用,从而实现对蛋白质-DNA复合物的富集和纯化。
pulldown实验的原理基于亲和层析技术,该技术利用靶蛋白与固定在固相介质上的配体之间的特异性结合,将靶蛋白从混合物中富集出来。
在pulldown实验中,DNA序列通常是作为配体固定在固相介质上,而蛋白质则是靶蛋白。
通过将混合物与固相介质接触,靶蛋白与固相上的DNA结合,而其他非特异性结合的蛋白质则被洗脱掉。
最终,只有与DNA特异性结合的蛋白质被富集下来。
二、实验步骤1. 准备工作a. 合成或克隆目标DNA序列,并将其连接到适当的表达载体上。
b. 在表达载体中插入靶蛋白的编码序列。
c. 通过细菌转化等方法将表达载体导入宿主细胞中。
d. 在宿主细胞中诱导靶蛋白的表达。
2. 细胞裂解a. 收集表达靶蛋白的细胞。
b. 使用裂解缓冲液等方法将细胞裂解,释放细胞内的蛋白质。
c. 使用超声波、高压破碎等方法加强细胞裂解效果。
3. 富集DNA-DNA结合复合物a. 准备含有DNA的固相介质,如磁珠、琼脂糖或硅胶。
b. 将裂解液与固相介质接触,使DNA结合到固相上。
c. 使用洗涤缓冲液洗脱非特异性结合的蛋白质。
4. 分离DNA-DNA结合复合物a. 对固相介质进行洗涤,去除残留的非特异性结合的蛋白质和其他杂质。
b. 使用洗脱缓冲液将特异性结合的蛋白质从固相上洗脱下来。
c. 收集洗脱液中的蛋白质,即为富集得到的DNA-DNA结合复合物。
5. 分析DNA-DNA结合复合物a. 使用SDS-PAGE或Western blot等方法检测富集得到的蛋白质。
b. 使用DNA测序等方法分析富集得到的DNA序列。
通过以上步骤,pulldown实验可以实现对蛋白质-DNA复合物的富集和纯化,从而进一步研究蛋白质与DNA的相互作用。
细胞pulldown实验的详细步骤及详细说明

细胞pulldown实验的详细步骤及详细说明利用重组技术将探针蛋白与GST(Glutathione S transferase)融合,融合蛋白通过GST与固相化在载体上的GTH(Glutathione)亲和结合。
因此,当与融合蛋白有相互作用的蛋白通过层析柱时或与此固相复合物混合时就可被吸附而分离。
GST-pulldown主要包括以下三个部分:①利用基因重组技术构建带有GST标签的原核表达载体;②通过原核表达系统表达带有GST标签的融合蛋白;③利用GST亲和纯化柱进行蛋白纯化获得高纯度的融合蛋白,再利用GST亲和纯化柱进行蛋白间的相互作用检测。
细胞蛋白裂解液,洗脱液:PBS及PBS+1%Triton-100PBS (1L)NaCl: 8gKCl:0.2gNa2HPO4: 1.44gKH2PO4:0.24g加入800ml蒸馏水,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L 即可,高温高压灭菌,4℃保存备用。
PMSF(苯甲基磺酰氟)MW:174.19 工作浓度0.1-1mM,这里使用1mM,储存浓度100mM,将0.174g PMSF溶于10ml无水乙醇混匀即可。
保持于-20℃或者4℃。
(以下流程仅供研究已知原核蛋白A和真核过表达蛋白B相互作用)1、原核融合蛋白A的获得(1)将编码蛋白A与GST的重组质粒化转BL21(DE3)菌株(2)挑取单个克隆到含有5mlLB(+100ug/mlAmp)的10ml试管里,37℃培养过夜(3)将培养菌液转移到含有500ml LB(+100ug/mlAmp)的1L锥形瓶中,37℃,225rpm培养至OD600≈1.0-1.5左右,加入适当浓度的IPTG,在适当温度下培养适当时间(诱导条件需要根据不同的蛋白做调整),6000g,10分钟,4℃离心收集细菌,去尽上清,将菌体至于-20℃放置O/N(4)室温冻融菌体,马上置于冰上,每500ml培养液加入10-20ml细菌裂解液(PBS+1%Triton-100+PMSF),吹打混匀(5)冰上超声破碎,开2秒,停9秒,总40-60分钟。
pull-down方法及蛋白表达纯化

3. Pull-down方法LB培养基成分:Tryptone 10 g/LY east Extract 5 g/LNaCl 10 g/L加入约800 ml的去离子水,充分搅拌溶解,继续滴加去离子水定容至1 L,高温高压灭菌后,冷却至室温。
固体培养基灭菌前加入Agar(15 g/L),含抗生素的LB灭菌后加入1 ml卡那霉素(Kanamycin,100mg/ml)或者1 ml氨苄青霉素后(Ampicillin,100mg/ml)混匀,4℃保存备用。
3.1 诱导融合蛋白方法(1)吸100μl菌液于5ml LB液体培养基中,37℃,230rpm过夜培养。
(2)按1:50的比例转接至20ml LB中,37℃,230rpm培养2-3h至OD600达到0.6-0.8之间。
(3)加IPTG(终浓度1mM)进行诱导。
(4)继续培养1-2h。
(5)将菌液转移至50ml离心管中,4000rpm 离心10min。
(6)弃上清,将离心管倒置在吸水纸上吸干。
(7)按1ml 菌液加50μl PBS溶液的比例悬浮细胞,吸打均匀。
(8)按100:1的比例加入裂解酶(25ml 细胞悬浮液加25μl 裂解酶),混匀室温放置5min(如裂解物太粘稠,可用10μg/ml DNase处理)。
(9)把裂解的细胞悬浮液放入液氮中20s,再将其放入37℃温水中融化,反复10次。
(10)12000rpm 离心10min,吸取上清到另一离心管中。
(11)吸取部分样品中加入2×上样Buffer,混匀,SDS-PAGE电泳。
3.2 带His标签蛋白纯化(康为世纪Ni-Agarose resin for 6×His-tagged proteins)表达载体为pET28a,表达菌株为全式金公司Transetta。
大肠杆菌表达系统,可溶性蛋白的纯化:(1)收集菌体后,将菌体重悬于Binding Buffer,裂解菌体。
(2)将凝胶灌柱,依次用3倍体积的去离子水和8倍体积的Binding Buffer平衡。
蛋白相互作用Pull-Down实验
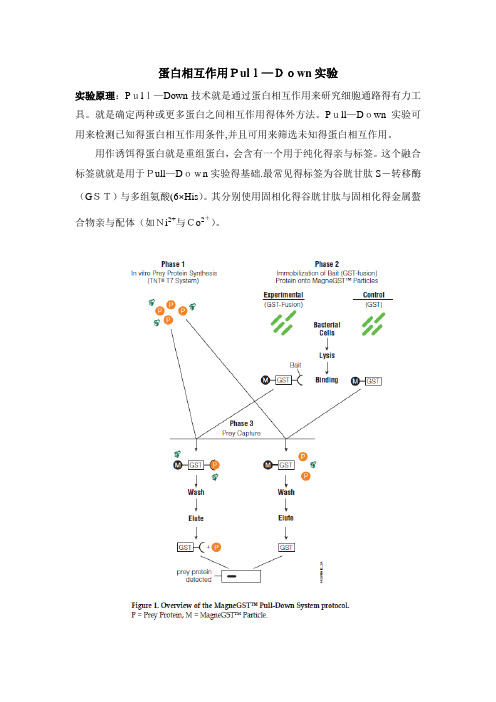
蛋白相互作用Pull—Down实验实验原理:Pull—Down技术就是通过蛋白相互作用来研究细胞通路得有力工具。
就是确定两种或更多蛋白之间相互作用得体外方法。
Pull—Down实验可用来检测已知得蛋白相互作用条件,并且可用来筛选未知得蛋白相互作用。
用作诱饵得蛋白就是重组蛋白,会含有一个用于纯化得亲与标签。
这个融合标签就就是用于Pull—Down实验得基础.最常见得标签为谷胱甘肽S-转移酶(GST)与多组氨酸(6×His)。
其分别使用固相化得谷胱甘肽与固相化得金属螯合物亲与配体(如Ni2+与Co2+)。
实验准备:实验仪器:谷胱甘肽琼脂糖凝胶(镍离子琼脂糖凝胶)、离心机、实验材料:表达得含标签得纯化蛋白、细胞裂解液实验试剂:BindingBuffer/Washing Buffer:4、2mM Na2HPO4、2mM KH2PO4、140mM NaCl、10mM KClSDSloading Buffer:50mMTris—Cl(pH6、8)、2%SDS、0、1%溴酚蓝、10%甘油、10mM DTT裂解缓冲液:20mM Tris-Cl(pH8、0)、200mM NaCl、1mM EDTA(pH8、0)、0、5%Nonidet P-40 使用前加入加入蛋白酶抑制剂.(蛋白酶抑制剂:2ug/ul抑肽酶(aprotinin)、1ug/ul白胃素(leupeptin)、0、7ug/ml胃酶抑素(pepstatin)、25ug/ml苯甲磺酰氟(PMSF))实验方法:方法一:1、预清除细胞裂解液:将细胞裂解液与50ul得50%谷胱甘肽琼脂糖球珠悬液与25ug GST在4℃混合孵育2h。
离心机12,000g在4℃离心2min.将上清转移至新得离心管中.2、探测细胞裂解液两个含等量预清除细胞裂解液及50ul谷胱甘肽琼脂糖球珠得微量离心管.在一管中加约10ug得GST蛋白,另一管中加约10ug得GST融合探针蛋白.两个反应中加入得探针与对照蛋白质得量应该就是等摩尔得.将离心管在4℃翻转混合孵育2h。
pull-down方法步骤汇总

pull-down⽅法步骤汇总GST-Pull down:1) 利⽤纯化好的蛋⽩进⾏GST-Pull down 实验操作。
2) 实验设置2 个组合,第⼀个是实验组(90 µl BP-His +90 µl BRM(689-952aa)-GST),第⼆个是负对照组(90 µl BP-His + 10 µl GST),分别在1.5 ml 的离⼼管中混合均匀。
3) 加⼊1 ml binding buffer,充分混合均匀,冰箱内30 rpm 旋转⾄少2h。
4) 加⼊30 µl GST-Bind TM Resin,冰箱内30 rpm 旋转⾄少2 h。
,100 g 离⼼ 2 min,弃去上清。
6) 加⼊1 ml binding buffer,冰箱内30 rpm 旋转5 min 进⾏洗涤,然后,100 g 离⼼ 2 min,弃去上清。
重复 5 次。
7) 加⼊40 µl 5×SDS-PAGE loading buffer,煮沸5 min,12000 g,离⼼30 sec,吸取上清点样进⾏SDS-PAGE 电泳。
8) 12 %的SDS-PAGE 胶,120 V 电泳90 min。
9) 转膜,使⽤PVDF 膜,使⽤前⽤甲醇浸泡10 min,350 mA 电流转膜2h。
10) ⽤5 %的脱脂⽜奶封闭膜,60 rpm,1 h。
11) 加⼊⼀抗(20 ml 5 %的脱脂⽜奶+5 µl anti-His),60 rpm,1 h。
12) 倒掉⼀抗,加⼊10 ml western blotting wash buffer,60 rpm,10 min,重复3 次。
13) 加⼊⼆抗(20 ml 5 %的脱脂⽜奶+5 µl Goat anti- mouse IgG(H+L) HRP conjugate),60 rpm,1 h。
14) 倒掉⼆抗,加⼊10 ml western blotting wash buffer,60 rpm,10 min,重复3 次。
pull-down试验方法(自己总结)

pull-down试验方法(自己总结)pull-down试验方法(自己总结)12、GST蛋白的表达和纯化12、1 GST蛋白的表达(1)将表达GST融合蛋白的质粒转入BL21大肠杆菌菌株中。
(2) 挑单克隆于3ml LA(LB+Amp)培养基中,37℃摇菌过夜,获得种子液。
(3)将种子液稀释于50ml2XYTA(YTG+Amp)培养基中,使起始OD600为0、1。
(4)28℃,220rpm摇菌培养2小时。
(5)加入50μl100mM IPTG,16~27℃摇菌培养1~8小时。
(6)收菌,将菌液倒入大离心管,2管/50ml菌液,4℃5krpmx5min离心,弃上清。
(7)加入10ml PBS/管,重悬细胞,5krpm离心5min,弃上清。
(8) 加入2ml PBS/管,重悬细胞。
转移至5ml离心管。
(9)超声破壁破壁前,在细胞悬液中加20μl10mg/ml PMSF,80μl 蛋白酶抑制剂(100x)。
破壁参数:Frequency:100~200w 60s,pause 20s run40s,5cycles破至菌体由浑浊变为澄清。
加100μl20%TritonX-100,冰上放置30min。
(10)将裂解液分入1、5ml离心管中,4℃离心12krpm10min,取上清。
(11)吸取少量上清,加入蛋白电泳上样缓冲液,在沸水中煮3min。
离心(12krpm,1min),取上清作SDS-PAGE电泳,检测表达情况。
12、2 准备50%GST Sepharose4Bslurry(1)将原75%Glutathione Sepharose4B的slurry弹至混匀。
(2) 取677μl原液/管,3krpm离心5min,弃上清。
(3)加500μl PBS,颠倒混匀,3krpm离心5min,弃上清。
反复5次。
(4)加500μl PBS,颠倒混匀,配成50%Glutathione Sepharose4B 备用。
12、3 GST融合蛋白的纯化(1)在新鲜制备的细胞裂解液上清中加入20μl50%Glutathione Sepharose4B,4℃,摇床上摇,反应30min~60min。
Pull-down实验和免疫共沉淀

Pull-down实验和免疫共沉淀Pull-down实验及原理Pull down是一种研究蛋白质或RNA与蛋白质相互作用的体外方法,这里主要讲研究蛋白与蛋白互作的pull-down实验。
在Pull-down实验中,首先要利用基因重组技术构建含有亲和标签与诱饵蛋白基因的载体,然后通过表达纯化得到带亲和标签的诱饵蛋白,该诱饵蛋白可固定在某种基质上以吸附细胞裂解液中的能与诱饵蛋白互作的蛋白,之后再通过洗脱即可得到目的蛋白,对目的蛋白进行检测可实现诱饵蛋白与目的蛋白相互作用的分析。
Pull-down实验的基本原理是将一种含亲和标签的蛋白质作为“诱饵蛋白”固定于某种基质上,当细胞或组织裂解液经过该基质时,可与“诱饵蛋白”相互作用的蛋白就会被吸附,而没有被吸附的其他蛋白质则被洗脱液洗脱,被吸附的蛋白可以通过改变洗脱液或洗脱条件而被回收,从而获得能与已知蛋白(即带亲和标签的诱饵蛋白)相互作用的蛋白。
诱饵蛋白上的亲和标签是pull down实验的基础。
常见的诱饵蛋白的亲和标签包括谷胱甘肽S-转移酶(GST)标签和多组氨酸(6×His)标签。
Pull-down实验后可以对获得的互作蛋白进行电泳分析或质谱鉴定等,以确定已知蛋白或发现未知蛋白。
Pull down串联质谱Pull down实验也叫做蛋白质体外结合实验,是一种在体外研究蛋白质与蛋白质相互作用的简单而灵敏的技术。
Pull-down实验,通过带亲和标签的诱饵蛋白可以把细胞或组织裂解液中与诱饵蛋白相互作用的蛋白质拉下来。
串联质谱用于被拉下来的蛋白质的分析鉴定,然后就可以确认与诱饵蛋白互作的蛋白是不是研究者预想的蛋白质,以及得到互作蛋白是什么蛋白等信息。
免疫共沉淀免疫共沉淀(Co-IP)是一种研究天然状态下蛋白质与蛋白质相互作用的技术。
在Co-IP实验中,首先要使用非离子型表面活性剂来裂解细胞或组织样品以更好的保留完整的蛋白质与蛋白质相互作用,然后加入某一蛋白(诱饵蛋白)的专一性抗体,该抗体与诱饵蛋白结合使诱饵蛋白沉淀,同时也可以沉淀与诱饵蛋白相互作用结合在一起的其它蛋白,也就是实现共沉淀,之后通过洗脱即可得蛋白复合物(诱饵蛋白与其互作蛋白的复合物),对产物进行检测可实现互作蛋白的分析。
pull down 实验技术

His蛋白纯化方案1.稀释表达的大肠杆菌(1:100),37摄氏度振荡直至OD 600 = 0.7(用500ml烧瓶,内含125ml培养液)2.加IPTG(0.5mM),振荡4小时3.离心大肠杆菌,3900r,20min,冷冻颗粒4.在冰上使用3ml裂解缓冲液(0.1%Triton)裂解细胞5.在冰上超声处理10秒每次,2次6.离心细胞提取物,13000 r ,4摄氏度离心15分钟(蛋白质在上清液)7.GST-pull down,将200ul细胞提取物加入到5ul GST珠或GST-nsp3珠中8.同时,15ul细胞提取物加入5ul 4x SDS样品缓冲液作为INPUT,剩余在-80摄氏度保存GST-pull down方案1.进行SDS-PAGE凝胶来计算GST蛋白(阴性对照)和GST-nsp3蛋白的体积比(它们应为1:1,GST,25kd)[GST:5ul; nsp3:5ul]2.首先制备80μl对照珠,在冰上(500μl/次)用1×TBS洗涤珠两次3.准备3个管用于GST蛋白(5ul /管)和3个管用于GST完全nsp3蛋白(5ul /管),加入10ul 对照珠,然后加入200ul His标签全长N蛋白,T1和T2蛋白。
4.4摄氏度翻滚1-2小时。
5.4℃800 r离心,去除细胞提取液。
6.在冰上(500μl/次)用GST-裂解缓冲液(0.1%Triton,不含PMSF)冲洗完全抑制剂片剂、溶菌酶和珠子2次。
7.在冰上用500μl冷TBS将珠子洗涤1次,用注射器除去所有上清液,每管加入25μl 1×SDS样品缓冲液,煮沸。
8.SDS-PAGE凝胶,包括INPUT(2ul),GST-TAG pull down(10ul),GST-nsp3 pull down(10ul)。
使用抗His做蛋白质免疫印迹。
裂解缓冲液:1×PBS10%甘油0.1%Triton5mM DTT1mg / ml溶菌酶(50mg / ml储备液,Franzi)1mM PMSF(-20摄氏度,100mM储备液)完全抑制剂片(4摄氏度,1片加500μl PBS,20×储备液)。
PullDown实验具体步骤及详细方法

PullDown实验具体步骤及详细方法实验目的:体外检测蛋白质与蛋白质之间相互作用。
用于验证两个已知蛋白的相互作用,或者筛选与已知蛋白相互作用的未知蛋白。
实验原理:利用重组技术将探针蛋白与GST(Glutathione S transferase)融合,融合蛋白通过GST与固相化在载体上的GTH(Glutathione)亲和结合。
因此,当与融合蛋白有相互作用的蛋白通过层析柱时或与此固相复合物混合时就可被吸附而分离。
试剂:NaCl, KCl,Na2HPO4,KH2PO4,Triton-100,IPTG(Merck分装),PMSF (Amersco),Cocktaier(Merck 539134),Immobilized Glutathione (PIERCE 15160)实验操作程序:材料及试剂探针蛋白与GST融合的原核蛋白,裂解的细胞蛋白,或者组织蛋白提取物细胞蛋白裂解液,洗脱液:PBS及PBS+1%Triton-100PBS (1L)NaCl: 8gKCl: 0.2gNa2HPO4: 1.44gKH2PO4: 0.24g加入800ml蒸馏水,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L 即可,高温高压灭菌!4℃保存备用!PMSF(苯甲基磺酰氟) MW:174.19 工作浓度0.1-1mM,这里使用1mM,储存浓度100mM,将0.174g PMSF溶于10ml无水乙醇混匀即可!保持于-20℃或者4℃(以下流程仅供研究已知原核蛋白A和真核过表达蛋白B相互作用)1:原核融合蛋白A的获得1.1:将编码蛋白A与GST的重组质粒化转BL21(DE3)菌株1.2:挑取单个克隆到含有5mlLB(+100ug/mlAmp)的10ml试管里,37℃培养过夜1.3:将培养菌液转移到含有500ml LB(+100ug/mlAmp)的1L锥形瓶中,37℃,225rpm培养至OD600≈1.0-1.5左右,加入适当浓度的IPTG,在适当温度下培养适当时间(诱导条件需要根据不同的蛋白做调整),6000g,10分钟,4℃离心收集细菌,去尽上清,将菌体至于-20℃放置O/N1.4:室温冻融菌体,马上置于冰上,每500ml培养液加入10-20ml细菌裂解液(PBS+1%Triton-100+PMSF),吹打混匀1.5:冰上超声破碎,开2秒,停9秒,总40-60分钟。
lncRNA研究策略之RNAPullDown实验技术

【实验技巧】 lncRNA研究策略之:RNA Pull Down实验技术lncRNA研究策略之:RNA Pull Down实验技术RNA pull-down是检测 RNA结合蛋白与其靶RNA 之间相互作用的主要实验手段之一。
RNA pull-down 使用体外转录法标记生物素RNA探针,尔后与胞浆蛋白提取液孵育,形成RNA- 蛋白质复合物。
该复合物可与链亲和素标记的磁珠结合,从而与孵育液中的其他成分分别。
复合物洗脱后,经过Western Blot实验检测特定的 RNA 结合蛋白可否与RNA 相互作用。
1) lncRNA 精选:经过 lncRNA 芯片或 RNA测序等方法对多对疾病模型和比较样本组织进行lncRNA表达谱解析;经过生物信息学的方法精选出拥有表达差其他lncRNA ,成立共表达网络,展望lncRNA的靶基因;经过 PCR 或 Northern Blot技术对候选lncRNA 考据,确定其表达差异。
2) lncRNA 确定:经过 5' RACE获得 lncRNA 5'全长, 3' RACE获得 lncRNA3'全长,最后拿到完满的lncRNA 序列。
3) 表达解析:细胞水平表达:在细胞水平进行检测表达差异。
组织分布:检测不同样组织、不同样阶段表达特点。
表达水平动力学变化:比较不同样办理条件下,如药物办理、引诱办理下,表达水平差异。
4)功能研究:功能获得性研究:成立 lncRNA 过表达载体 :原那么上是将全长 lncRNA定向克隆到表达载体上实现 lncRNA 的过表达。
可是有些lncRNA 很大或全长还没有分别,这时将视lncRNA 在基因组上的定位采用不同样的研究策略。
功能缺失性研究:可经过 siRNA 、shRNA 、反义核酸等方法默然lncRNA ,干预 lncRNA后检测其对疾病相关基因表达的影响和对细胞表型如增值、凋亡、侵袭、转移等的影响;采用 RNA pull down、 RNA-RIP(RNA Binding Protein Immunoprecipitation)、ChIRP-seq(Chromatin Isolation by RNA Purification)等方法检测与 lncRNA 结合的 DNA 、RNA 、蛋白质。
pull down 实验方法

Pull Down实验流程1. 混合两种预测相互作用的蛋白。
(Protein-A-GST & Protein-B-HIS,下面实验用GST 树脂IP,用Western Blot检测HIS;反之亦然。
如果是纯化后的蛋白,需要进行偷袭或者使用超滤离心管为蛋白更换溶液,之后才能继续Pull Down。
)2. 加入1 mL Binding Buffer。
Binding Buffer:50 mM Tris.HCl (pH7.50.)100 mM NaCl0.25% Triton-X 10035 mM β-Me(巯基乙醇)3. 将混合蛋白在4℃条件下旋转结合2-4 h。
4. 加入20-30 μL GST-Bind TM Resin结合2-4 h。
5. 4 ℃,150-200 g 离心2 min,吸弃上清(小心!不要吸弃底部沉淀)。
第一次弃去的上清样品记为Washing- Protein-A/ Protein-B,用于SDS-PAGE电泳时的对照。
6. 加入1 mL Binding Buffer,4 ℃条件下旋转混匀5-10 min,4 ℃,150-200 g 离心2 min,吸弃上清。
7. 重复步骤6,用1 mL Binding Buffer 清洗5-6次。
8. 最后一次清洗后留有20-30 μL 液体,加入适量的Loading Buffer,95℃金属浴5-10 min,150-200 g 离心5 min,样品记为上样跑SDS-PAGE电泳。
电泳样品顺序:Marker,Protein-A-GST,Protein-B-HIS,Washing- Protein-A/ Protein-B,Pull Down- Protein-A/ Protein-B此次电泳的目的,一是初步检测两个蛋白是否互作,二是可以为后面正式实验所需蛋白量提供参考。
用于正式检测两个蛋白是否互作电泳顺序如下:(input,蛋白量为后两者的1/10)Marker,Protein-B-HIS ,GST+ Protein-B-HIS,Protein-A-GST+ Protein-B-HISMarker,Protein-A-GST ,HIS+ Protein-A-GST,Protein-B-HIS+ Protein-B-GST9. 转PVDF膜,350 mA 恒流,2 h 左右。
pull-down实验步骤解析

pull-down实验步骤解析嘿,咱今儿就来好好唠唠这 pull-down 实验步骤哈!你想想,这 pull-down 实验就像是一场精心编排的舞蹈。
首先呢,得准备好“舞台”,也就是把咱要研究的蛋白啥的都准备得妥妥当当。
这就好比跳舞得先有合适的场地和舞者呀!然后呢,把带有“钩子”的东西,也就是能和目标蛋白结合的东西放进去,这就像是抛出一个诱人的“诱饵”,等着目标蛋白上钩呢!接下来可就关键啦!让它们在合适的环境里相互作用,就像舞者们在音乐中翩翩起舞,相互呼应。
等它们结合得差不多了,就该把那些没结合上的杂质啥的给清理掉,这就好比把舞台上多余的东西清理掉,让主角们更加突出。
然后呢,把结合上的复合物给分离出来,哇哦,这感觉就像是把最精彩的舞蹈动作给单独拎出来欣赏一样。
这一步可得小心谨慎,不能有一点马虎,不然就前功尽弃啦!再之后,对这些复合物进行分析鉴定,看看咱到底钓到了啥“大鱼”。
这就像是仔细欣赏舞蹈的每个细节,去评判它的好坏优劣。
你说这 pull-down 实验是不是很有意思?就像一场神秘的探险,每一步都充满了惊喜和挑战。
要是哪一步没做好,可能就找不到我们想要的答案啦!在做这个实验的时候啊,可千万不能粗心大意。
就好比跳舞时一个小失误可能就会影响整个表演的效果。
每一个环节都得精心对待,从准备试剂到操作过程,都得像呵护宝贝一样小心翼翼。
而且哦,这个实验有时候还需要点耐心呢!就像等待一朵花慢慢开放,不能着急,得慢慢等,慢慢观察。
要是太着急了,可能就会错过一些重要的细节。
咱做实验的人啊,就像是这场舞蹈的编导,要把每个步骤都安排得妥妥当当,才能让实验顺利进行,得出可靠的结果呀!这 pull-down 实验步骤,你可搞清楚了吗?别迷糊哦,要认真对待每一个环节,这样才能在科学的海洋里畅游,找到我们想要的宝藏呢!。
pull down实验原理

pull down实验原理拉使实验是用来测量不同气体中电子的阻力和电位的常见实验。
它涉及一个电路,其中有一个可变电阻,一个保护电阻,一个可变电压的电源和一个探头。
它的目的是测量一定的电压到一个指定的气体里,这个电压上升或是下降来测量电子的阻力。
拉使实验在物理和化学实验室里非常常见,它可以帮助我们了解电子是如何在不同的物质里流动的。
拉使实验由两个基本原理来实现。
第一个原理是在一个不可变的电流密度的情况下,电流的数量取决于电位的大小。
另一个原理就是在一个不可变的电势的情况下,电位的变化会改变电流的数量。
这就是经典的“pull down”实验。
让我们来看看这个实验的实际过程。
首先,我们需要准备一个拉使实验装置。
这里,我们需要一个可变电阻,一个保护电阻,一个可变电压源和一个探头。
我们将电压源连接到可变电阻上,然后将可变电阻连接到探头上。
接下来,我们可以调节电压源来调节可变电阻的电压,以此来确定一个电压的大小来控制电子的流动。
现在我们可以将这个可变电阻放入特定的气体中,来测量电子的阻力。
电子是不同气体中流动的负荷,它们受到电对磁场的影响来运动。
当我们把可变电阻放入气体时,它将会改变它周围的电压情况。
这就是拉使实验的原理:当我们把电压设定到一个指定的电压时,空气里电子将会以一定的阻力穿过此处。
而当我们释放这个电压时,电子将再次以一定的阻力通过。
最后,我们可以用变化的电压对应的阻力来测量不同的气体中的电子的阻力。
由此可见,拉使实验是一个有力的测量电子阻力和它们的电势的工具,它已经被大量的研究者用来研究不同的物质中的电子的运动。
希望通过这个实验,可以更好地了解电子在不同的物质中的运动特性,从而更好地应用它们去各种方面。
细胞pulldown实验的详细步骤及详细说明

细胞pulldown实验的详细步骤及详细说明细胞pulldown实验的详细步骤及详细说明利用重组技术将探针蛋白与GST(Glutathione S transferase)融合,融合蛋白通过GST与固相化在载体上的GTH(Glutathione)亲和结合。
因此,当与融合蛋白有相互作用的蛋白通过层析柱时或与此固相复合物混合时就可被吸附而分离。
GST-pulldown主要包括以下三个部分:①利用基因重组技术构建带有GST标签的原核表达载体;②通过原核表达系统表达带有GST 标签的融合蛋白;③利用GST亲和纯化柱进行蛋白纯化获得高纯度的融合蛋白,再利用GST亲和纯化柱进行蛋白间的相互作用检测。
细胞蛋白裂解液,洗脱液:PBS及PBS+1%Triton-100PBS (1L)NaCl: 8gKCl:0.2gNa2HPO4: 1.44gKH2PO4:0.24g加入800ml蒸馏水,用HCl调节溶液的pH值至7.4,最后加蒸馏水定容至1L 即可,高温高压灭菌,4℃保存备用。
PMSF(苯甲基磺酰氟)MW:174.19 工作浓度0.1-1mM,这里使用1mM,储存浓度100mM,将0.174g PMSF溶于10ml无水乙醇混匀即可。
保持于-20℃或者4℃。
(以下流程仅供研究已知原核蛋白A和真核过表达蛋白B相互作用)1、原核融合蛋白A的获得(1)将编码蛋白A与GST的重组质粒化转BL21(DE3)菌株(2)挑取单个克隆到含有5mlLB(+100ug/mlAmp)的10ml 试管里,37℃培养过夜(3)将培养菌液转移到含有500ml LB(+100ug/mlAmp)的1L锥形瓶中,37℃,225rpm培养至OD600≈1.0-1.5左右,加入适当浓度的IPTG,在适当温度下培养适当时间(诱导条件需要根据不同的蛋白做调整),6000g,10分钟,4℃离心收集细菌,去尽上清,将菌体至于-20℃放置O/N(4)室温冻融菌体,马上置于冰上,每500ml培养液加入10-20ml细菌裂解液(PBS+1%Triton-100+PMSF),吹打混匀(5)冰上超声破碎,开2秒,停9秒,总40-60分钟。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
pull-down试验方法(自己总结)12、GST蛋白的表达和纯化12、1 GST蛋白的表达(1)将表达GST融合蛋白的质粒转入BL21大肠杆菌菌株中。
(2) 挑单克隆于3ml LA(LB+Amp)培养基中,37℃摇菌过夜,获得种子液。
(3)将种子液稀释于50ml2XYTA(YTG+Amp)培养基中,使起始OD600为0、1。
(4)28℃,220rpm摇菌培养2小时。
(5)加入50μl100mM IPTG,16~27℃摇菌培养1~8小时。
(6)收菌,将菌液倒入大离心管,2管/50ml菌液,4℃5krpmx5min离心,弃上清。
(7)加入10ml PBS/管,重悬细胞,5krpm离心5min,弃上清。
(8) 加入2ml PBS/管,重悬细胞。
转移至5ml离心管。
(9)超声破壁破壁前,在细胞悬液中加20μl10mg/ml PMSF,80μl 蛋白酶抑制剂(100x)。
破壁参数:Frequency:100~200w 60s,pause 20s run40s,5cycles破至菌体由浑浊变为澄清。
加100μl20%TritonX-100,冰上放置30min。
(10)将裂解液分入1、5ml离心管中,4℃离心12krpm10min,取上清。
(11)吸取少量上清,加入蛋白电泳上样缓冲液,在沸水中煮3min。
离心(12krpm,1min),取上清作SDS-PAGE电泳,检测表达情况。
12、2 准备50%GST Sepharose4Bslurry(1)将原75%Glutathione Sepharose4B的slurry弹至混匀。
(2) 取677μl原液/管,3krpm离心5min,弃上清。
(3)加500μl PBS,颠倒混匀,3krpm离心5min,弃上清。
反复5次。
(4)加500μl PBS,颠倒混匀,配成50%Glutathione Sepharose4B备用。
12、3 GST融合蛋白的纯化(1)在新鲜制备的细胞裂解液上清中加入20μl50%Glutathione Sepharose4B,4℃,摇床上摇,反应30min~60min。
(2) 3krpm离心5min,弃上清。
该Sepahrose上即结合了GST融合蛋白,(如果仅仅是做纯化效果检测或者蛋白表达量很高,可以只接合一次,如果要结合更多则接着往下做)(3)在管中加入离心后的1、5ml新鲜制备的细胞裂解液的上清,4℃,反应30min~60min。
3krpm离心5min,弃上清。
重复该步骤多次,就可以使Sepahrose上结合6~10ml 裂解液中的GST融合蛋白。
(4)在管中加入预冷的200μl PBS(沿壁加入,小心勿剧烈,以免打断珠子与蛋白的联接),轻晃悬浮珠子,将Sepharose洗涤一次,3krpm离心3min,弃上清。
(5)反复三次(最后一次以小枪吸净珠子表面水膜,其余几次可以中枪吸,尽量吸净但不吸走珠子),即获得结合有GST融合蛋白的Sepharose。
(6)如果用于检测,在Sepharose加入15~20μl1蛋白电泳上样缓冲液,在沸水浴中煮3min。
12krpm离心1min,取上清作SDS-PAGE电泳。
(7)如果用于pull-down测试,参见pull-down 步骤。
14、体外蛋白质结合分析(GST-pull down)(1)将结合有GST融合蛋白的Glutathione Sepharose4B悬浮在500μlNETN缓冲液中加入20~30μl含有其他蛋白的溶液,例如pET发酵的产物,细胞表达的产物等,同时采用结合有GST空蛋白的Glutathione Sepharose4B平行操作作为对照。
(2) 在水平摇床上,4晃动4~8小时。
(3)离心(3、6krpm,2min)。
吸去上清,注意不要扰动底层的Sepharose、(4)加入200μl缓冲液H对Sepharose进行洗涤。
注意加入缓冲液H时要贴壁加,不要直接冲击Sepharose,随后轻柔晃动,使Sepharose重悬即可。
(5)低速离心(3krpm,2min)吸去上清,注意不要扰动底层的Sepharose。
(6)重复步骤的洗涤2~3次。
(7)吸干Sepharose上方的水层后,加入20~30μl1蛋白电泳上样缓冲液,沸水浴4min,冻存于-20℃。
(8)做SDS-PAGE和Western检测另一个蛋白。
GST 试验流程(梗概):(1) Glutathione 琼脂糖珠预处理。
(2) GST融合蛋白挂柱:取适量GST-融合蛋白与10μl已经处理过的beads置于1、5ml离心管中,4℃, 摇床孵育过夜。
(3)孵育过夜的蛋白质与beads的混合液于4℃,500g离心5min,上清收集,观察融合蛋白是否饱和地挂在beads上,用1ml冰冷的细胞裂解缓冲液洗三次beads。
(4)把转染目的基因的细胞(5106)裂解在0、5ml细胞裂解液里(含蛋白酶抑制剂),最大转速4℃离心20min,收集上清液。
(5)将细胞裂解液上清加入beads中,混匀,4℃,摇床3h。
(6)3h后,用冰冷的细胞裂解缓冲液洗三次。
(7)加15μl2SDS上样缓冲液,煮沸5min、(8) SDS-PAGE,Western Blot或质谱仪分析。
(9)对照(GST)同样处理。
13、pET融合蛋白的表达与纯化13、1 pET32a融合蛋白的表达(1)将表达融合蛋白的质粒转入BL21DE3中。
(2)挑单克隆于3ml LA培养基中,37℃摇菌过夜,获得种子液。
(3)将种子液稀释于50ml2YTG中,使起始OD600为0、1。
(4) 28℃,220rpm摇菌培养2小时。
(5)加入50μl100mM的IPTG,22℃摇菌培养6小时。
(6)收菌,将菌液倒入大离心管,2管/50ml菌液,4℃5krpm离心5min,弃上清。
(7)加入10ml Ni-lysis buffer/管,重悬菌体。
5krpm离心5min,弃上清。
(8)加入2ml Nilysis buffer/50ml菌液,vortex重悬菌体。
转移至5ml离心管。
(9)超声破壁破壁前,在细胞悬液中加20μl10mg/ml PMSF,80ul 蛋白酶抑制剂。
破壁参数:Frequency:100~200w,60s pause20s run40s,5cycles破至菌体由浑浊变为澄清。
加100μl20%TritonX100,冰上放置30min。
(10)将裂解液分入1、5ml离心管中,4℃离心12krpm10min,取上清。
(11)吸取少量上清,加入蛋白电泳上样缓冲液,在沸水中煮3min。
离心(12krpm,1min),取上清作SDS-PAGE电泳,检测表达情况。
13、2 pET32a融合蛋白的纯化(1)在新鲜制备的细胞裂解液上清中加入20μl Ni-NTA珠子,4℃,摇床上摇反应30min~60min。
(2)离心3krpm5min,弃上清。
该珠子上即结合了pET32a融合蛋白,(如果仅仅是做纯化效果检测或者蛋白表达量很高,可以只接合一次,如果要结合更多则接着往下做)(3)在管中加入离心后的1、5ml新鲜制备的细胞裂解液的上清,4℃,反应30min~60min。
离心3krpm5min,弃上清。
重复该步骤多次,就可以使珠子上结合6~10ml 裂解液中的pET融合蛋白。
(4)在管中加入预冷的200μl Wash buffer(沿壁加入,小心勿剧烈,以免打断珠子与蛋白的联接),轻晃悬浮珠子,洗涤一次,离心3krpm3min,弃上清。
(5)反复三次(最后一次以小枪吸净珠子表面水膜,其余次可以中枪吸,尽量吸净但不吸走珠子),即获得结合有pET融合蛋白的Ni-NTA。
(6)加入60μl Elution buffer,不必吹打,晃动洗脱蛋白。
离心3krpmx5min,吸净上清,pET融合蛋即在上清中。
(7) 如果用于检测,取1~2μl样品,配成15~20μl1蛋白电泳上样缓冲液,在沸水浴中煮3min。
离心12krpm1min,取上清作SDS-PAGE电泳。
(8)如果用于pull down测试,参见pull down 步骤。
GST pull down与IP之间区别:Co-IP 一般来说是证明两个蛋白的相互作用,但不排除通过第三个蛋白介导的间接相互作用。
GST pull down 一般可用来证明直接的相互作用。
GST pull down也并非都是原核表达来源,真核也可以表达作为饵蛋白GST pull-down实验是一个行之有效的验证酵母双杂交系统的体外试验技术,近年来越来越受到广大学者的青睐。
其基本原理是将靶蛋白-GST融合蛋白亲和固化在谷胱甘肽亲和树脂上,作为与目的蛋白亲和的支撑物,充当一种“诱饵蛋白”,目的蛋白溶液过柱,可从中捕获与之相互作用的“捕获蛋白”(目的蛋白),洗脱结合物后通过SDS-PAGE电泳分析,从而证实两种蛋白间的相互作用或筛选相应的目的蛋白,“诱饵蛋白”和“捕获蛋白”均可通过细胞裂解物、纯化的蛋白、表达系统以及体外转录翻译系统等方法获得。
此方法简单易行,操作方便。
GST:谷胱甘肽巯基转移酶(glutathione S-transferase)GST:体外纯化蛋白,预测有相互作用的蛋白放在一起(EP管中)证明二者是否有直接相互作用。
体外可能相互作用,但在体内不一定相互作用。
IP:体内(细胞内证明)两种蛋白是否相互作用,但二者不一定直接作用,可能通过桥梁作用在一起(间接作用)。
