初中化学中考技巧型计算题
(化学)初中化学化学计算题解题技巧讲解及练习题(含答案)

(化学)初中化学化学计算题解题技巧讲解及练习题(含答案)一、中考化学计算题1.现将100 g溶质质量分数为9.8%的稀硫酸与一定质量的氯化钡溶液恰好完全反应后,过滤得到284.7 g滤液。
计算:(1)生成硫酸钡沉淀的质量。
(2)氯化钡溶液中溶质的质量分数。
【答案】(1)生成硫酸钡沉淀的质量为23.3 g。
(2)氯化钡溶液中溶质的质量分数为10%。
【解析】试题分析:解:设生成硫酸钡沉淀的质量为x,反应的氯化钡的质量为y。
H2SO4质量为:10 0g×9.8%=9.8 gBaCl2 + H2SO4 = BaSO4↓ + 2HCl208 98 233y9.8 g x233/98 =x/9.8x=23.3 g208/98 =y/9.8y=20.8 g(2)氯化钡溶液的质量为:284.7 g+23.3 g-100 g=208 g氯化钡溶液的溶质质量分数为:20.8 g/208 g×100%=10%考点:根据化学方程式的计算溶质的质量分数2.向13.6g碳酸钠和氯化钠的固体混合物滴加稀盐酸,所加稀盐酸质量与生成气体质量的关系如图所示。
计算:(1)固体混合物中碳酸钠的质量。
(2)该稀盐酸中溶质的质量分数。
(3)恰好完全反应时所得的溶液中溶质的质量分数。
(计算结果精确至0.1%)【答案】(1)10.6克(2)10%(3)17.9%【解析】试题分析:设固体混合物中Na2CO3的质量为x,稀盐酸中溶质的质量为y,反应生成NaCl 的质量为z。
Na2CO3+ 2HCl ="=" 2NaCl + H2O + CO2↑106 2×36.5 2×58.5 44x y z 4.4g得x=10.6克稀盐酸中溶质的质量分数为:恰好完全反应时所得的溶液溶质质量分数为:考点:根据化学方程式的计算 物质的质量分数3.将含有杂质(不溶于水)的氯化钡样品12.5g 放入39.6g 水中充分搅拌,完全溶解后过滤。
初中化学化学计算题解题技巧及经典题型及练习题(含答案)及解析

Mg+ 24 2.4g
H2SO4 == 98 x
MgSO4 + H2 120 y
24 = 98 x=9.8g 2.4g x
24 = 120 y=12g 2.4g y
(2)由图可知加入的氢氧化钠的质量为 80g 时才开始形成沉淀; 设参加反应的氢氧化钠的质量为 z;
2NaOH+ 80 z
MgSO4 == 120 12g
(1)利用化学方程式: Mg+H2SO4 ==MgSO4 +H2 ,根据反应的质量比即可计算出参
加反应的硫酸的质量; (2)镁与稀硫酸反应后的溶液中滴加氢氧化钠溶液,一段时间后才产生白色沉淀,说明与 镁反应的稀硫酸是过量的,氢氧化钠先与稀硫酸反应,再与硫酸镁反应生成氢氧化镁沉 淀。由图可知加入的氢氧化钠的质量为 80g 时才开始形成沉淀;根据硫酸镁与氢氧化钠反 应的质量比即可计算出消耗的氢氧化钠的质量; (3)氢氧化钡既能与稀硫酸反应,也能与硫酸镁反应,利用化学方程式,根据硫酸和硫酸 镁的质量即可计算出产生的沉淀的质量。 【详解】 解:(1)设与 2.4g 镁反应的 H2SO4 的质量为 x,生成硫酸镁的质量为 y;
7.为测定 21.2g 某变质氢氧化钠固体中碳酸钠的含量,将其配置成 500mL 溶液,分别取出 50mL 用两种方法进行测定。已知:Na2CO3+BaCl2=BaCO3↓+2NaCl
加入的试剂
测得数据
方法 1 方法 2
足量 BaCl2 溶液 足量稀硫酸
BaCO3 沉淀 1.97g CO2 气体 0.44g
(1)恰好完全反应时,生成沉淀的质量是_____g。 (2)请按上述实验中发生反应的先后顺序写出有关反应的化学方程式:_____;_____。 (3)该工业盐酸中 HCl 的质量分数是多少_____(写出计算过程)? 【答案】2.14g NaOH+HCl═ NaCl+H2O FeCl3+3NaOH═ Fe(OH)3↓+3NaCl 29.2% 【解析】 【详解】 (1)由图可知,完全反应后生成沉淀的质量为 2.14g。 (2)酸首先要和氢氧化钠反应,当酸反应完后,氯化铁才和氢氧化钠反应,故有关反应的 化学方程式为:NaOH+HCl═ NaCl+H2O;FeCl3+3NaOH═ Fe(OH)3↓+3NaCl。 (3)由图可知,与氯化铁反应的氢氧化钠溶液的质量为 172g﹣160g=12g; 设消耗的氢氧化钠的质量为 x。
(化学)初中化学化学计算题技巧(很有用)及练习题含解析

(化学)初中化学化学计算题技巧(很有用)及练习题含解析一、中考化学计算题1.现有一份氧元素质量分数为 89.5%的过氧化氢溶液,加入 MnO2充分反应后,得到液体的质量为 90g(不考虑操作过程中液体的损失),则生成氧气的质量为________________g(精确到小数点后 1 位)。
【答案】 5.2【解析】解法一:设生成氧气的质量为x,过氧化氢溶液的质量为y,根据反应前后氧元素的质量不变可得关系式:①y-90g=x,②y 89.5%=x+90g 100%,x=5.2g,答:生成氧气的质量为5.2g。
解法二:可根据反应前后氢元素的质量不变进行分析解答,则:根据题意过氧化氢溶液的质量=90g 100%(1-89.5%),生成氧气的质量=90g 100%(1-89.5%)-90g=5.2g,答:生成氧气的质量为5.2g。
2.20g含杂质(杂质不溶于水,也不溶于酸)的锌样品,与一定质量的稀硫酸恰好完全反应,所得溶液质量为80.5g,同时生成氢气0.4g。
试计算:(1)样品中锌的质量分数是_____;(2)完全反应后生成溶液中溶质的质量分数是_____;(3)所用稀硫酸的质量分数是_____(计算结果保留到0.01%)。
【答案】65% 40% 28.87%【解析】【分析】样品中的锌能与稀硫酸反应生成硫酸锌和氢气。
【详解】设样品中锌的质量为x;生成的硫酸锌的质量为y;硫酸中溶质的质量为z;2442Zn+H SO=ZnSO+H65981612x z y0.4g65981612===x z y0.4gx=13gy=32.2gz=19.6g(1)样品中锌的质量分数为13g×100%=65% 20g(2)完全反应后生成溶液中溶质的质量分数为32.2g×100%=40% 80.5g(3)所用稀硫酸的质量分数为19.6g×100%28.87% 80.5g+0.4g-13g答:样品中锌的质量分数为65%,完全反应后生成溶液中溶质的质量分数为40%,所用稀硫酸的质量分数为28.87%。
(化学)中考化学初中化学化学计算题技巧(很有用)及练习题
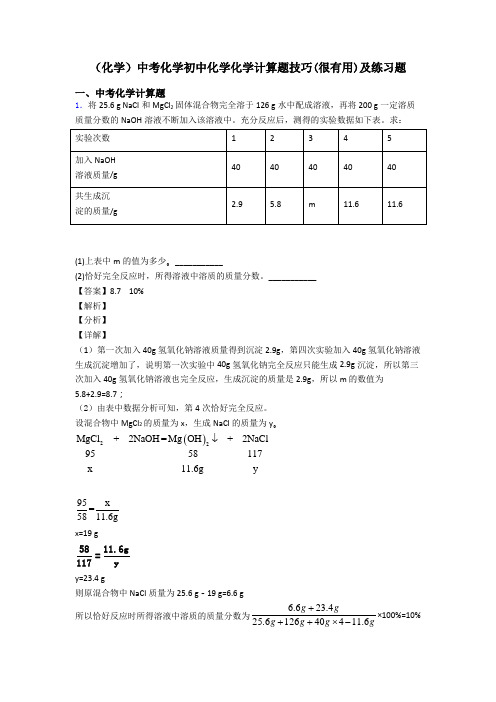
(化学)中考化学初中化学化学计算题技巧(很有用)及练习题一、中考化学计算题1.将25.6 g NaCl 和MgCl 2固体混合物完全溶于126 g 水中配成溶液,再将200 g 一定溶质质量分数的NaOH 溶液不断加入该溶液中。
充分反应后,测得的实验数据如下表。
求:(1)上表中m 的值为多少。
___________(2)恰好完全反应时,所得溶液中溶质的质量分数。
___________ 【答案】8.7 10% 【解析】 【分析】 【详解】(1)第一次加入40g 氢氧化钠溶液质量得到沉淀2.9g ,第四次实验加入40g 氢氧化钠溶液生成沉淀增加了,说明第一次实验中40g 氢氧化钠完全反应只能生成2.9g 沉淀,所以第三次加入40g 氢氧化钠溶液也完全反应,生成沉淀的质量是2.9g ,所以m 的数值为5.8+2.9=8.7;(2)由表中数据分析可知,第4次恰好完全反应。
设混合物中MgCl 2的质量为x ,生成NaCl 的质量为y 。
()22MgC +=+l 2NaOH Mg OH 29558117NaC x yl11.6g↓95x=5811.6gx=19 g5811.6g=117yy=23.4 g则原混合物中NaCl 质量为25.6 g -19 g=6.6 g 所以恰好反应时所得溶液中溶质的质量分数为6.623.425.612640411.6g gg g g g+++⨯-×100%=10%答:恰好完全反应时,所得溶液中溶质质量分数为10%。
2.马英同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如表所示:第1次第2次第3次第4次第5次加入稀盐酸的质量/g2020202020生成气体的总质量/g 1.1 2.2m 4.4 4.4试求:(1)m的值为______g。
(2)12g石灰石样品中碳酸钙的质量是_____。
中考化学初中化学化学计算题技巧(很有用)及练习题

中考化学初中化学化学计算题技巧(很有用)及练习题一、中考化学计算题1.为测定某H2SO4溶液的溶质质量分数,现取200g硫酸溶液置于烧杯中,不断加入一定质量分数的BaCl2溶液,反应过程中杯中溶液的质量与加入BaCl2溶液的质量关系如图所示。
请回答:(1)反应生成沉淀的质量为_____g;在Q点时溶液中的离子为_____(用符号)。
(2)在反应过程中,杯中溶液的pH_____(填“变大”、“不变”或“变小”)。
(3)原硫酸溶液的溶质质量分数是多少_____?【答案】23.3 H+、Cl﹣、Ba2+变大 4.9%【解析】【详解】(1)由图中信息可知,P点时氯化钡和硫酸恰好完全反应,反应前后的质量差即为反应生成沉淀硫酸钡的质量,则生成的硫酸钡的质量是200g+100g﹣276.7g=23.3g,故填23.3;Q点的氯化钡溶液过量,溶液中的溶质为盐酸和氯化钡,在Q点时溶液中的离子为H+、Cl ﹣、Ba2+,故填H+、Cl﹣、Ba2+;(2)反应的过程中硫酸不断被消耗,生成盐酸,随氯化钡溶液的加入,溶剂增加,溶液的酸性不断变弱,所以pH会不断变大,故填变大;(3)设氯化钡质量为x。
2244BaCl+H SO=BaSO+2HCl98233x23.3g98233=x23.3gx=9.8g原硫酸溶液的溶质质量分数为:9.8g200g×100%=4.9%答:硫酸溶液的溶质质量分数为4.9%。
2.将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为40%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)反应时间0 10 20 30 40 5060(s)溶液温度20.5 20.6 20.7 20.8 20.920.8 20.7(℃)(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是_____℃(2)计算稀盐酸中溶质的质量分数_________(精确到0.1%)【答案】20.936.5%【解析】【分析】根据图表可知当反应时间为40秒时,溶液的温度最高,所以当40秒时,反应恰好完全反应。
初三化学化学计算题技巧和方法完整版及练习题含解析

2.为了节约林木资源,近几年兴起了石头纸,石头纸可用沿海水产养殖中产生的大量废弃贝壳制得。某化学兴趣小组同学为了测定某种贝壳中碳酸钙的质量分数,将100g稀盐酸分五次加入盛有12g贝壳的烧杯中,充分反应后测得烧杯内物质的质量如表所示(贝壳中其它物质不与盐酸反应且不溶于水)。请你计算:
第1次
第2次
第3次
第4次
第5次
加入稀盐酸的质量/g
20
20
20
20
20
烧杯内物质的质量/g
30.9
49.8
m
87.6
107.6
(1)贝壳中碳酸钙的质量分数______(精确到0.1%);
(2)稀盐酸与贝壳恰好完全反应后所得溶液中溶质的质量分数_____(精确到0.1%)。
【答案】83.3%10.9%
(1)该反应产生的CO2气体质量为g。
(2)计算反应后所得溶液中溶质质量分数(写出计算过程)
【答案】(1)4.4(2)11.7%
【解析】
试题分析:根据质量守恒定律可以知道:生成二氧化碳的质量为:22.3g+100g+82.1g﹣200.0g=4.4g,
设碳酸钠的质量为x,生成氯化钠的质量为y,
Na2CO3+2HCl═2NaCl+H2O+CO2↑,
(1)m的值为.
(2)当恰好完全反应时,所得溶液的溶质质量分数为3%,求原小苏打样品中NaHCO3与NaCl的质量比.
【答案】(1)4.4.(2)168:3.
【解析】
(1)加入50g稀盐酸时生成2.2g二氧化碳,因此加入100g稀盐酸时生成4.4g二氧化碳,即m的值为4.4.(2)当恰好完全反应时,所得溶液的溶质质量分数为3%,因此溶质氯化钠质量为:200×3%=6g,
(化学)初中化学化学计算题解题技巧(超强)及练习题(含答案)含解析

(化学)初中化学化学计算题解题技巧(超强)及练习题(含答案)含解析一、中考化学计算题1.有一赤铁矿样品(主要成分为Fe2O3),某学校化学兴趣小组为了测得样品中氧化铁的质量分数,进行了如下探究:小明取10 g赤铁矿样品(杂质不溶于水和酸),不断加入稀盐酸到固体的质量不再减少,加入稀盐酸的量如图所示。
求:(1)赤铁矿中氧化铁的质量分数是________________。
(2)计算所使用的稀盐酸的溶质质量分数____________。
【答案】 80% 10%【解析】氧化铁和稀盐酸反应生成易溶于水的氯化铁和水,所以反应中固体质量减少,最终不溶的固体是杂质,所以氧化铁的质量为:10g-2g=8g,设所使用的稀盐酸的溶质质量为x,Fe2O3+6HCl=2FeCl3+3H2O160 2198g x160/8g=219/xx=10.95g所以所使用的稀盐酸的溶质质量分数为:10.95g÷109.5g×100%=10%;答:略点睛:方程式的计算,关键根据化学反应方程式找出相关物质的质量关系,利用反应中物质的质量比不变进行列比例计算,易错点是,由方程式求质量比算数错误,所以这一步要仔细检查。
2.若要生产含杂质4%的生铁100t,需要含氧化铁60%的赤铁矿石的质量是多少________?(要求写出计算过程,计算结果保留小数点后1位)【答案】228.6t【解析】试题分析:含杂质物质的计算要把混合物的质量转化为纯物质的质量,即纯物质质量=含杂质物质质量×纯度,再把纯物质的质量带入化学方程式计算。
最后再把计算出的纯物质质量转换为含杂质物质的质量。
[解]设:需要向炼铁高炉中投入这种铁矿石的质量为xFe2O3+ 3CO2Fe + 3CO2160 11260%x (1-4%)×100 t=x=" 228.6" t答:需要向炼铁高炉中投入这种铁矿石的质量为228.6t。
中考化学初中化学化学计算题解题技巧及经典题型及练习题(含答案)

中考化学初中化学化学计算题解题技巧及经典题型及练习题(含答案)一、中考化学计算题1.某化学兴趣小组的同学在实验室配制溶质质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。
下图表示用该氢氧化钠溶液与10g某稀盐酸发生反应时溶液温度的变化情况。
试计算稀盐酸中溶质的质量分数。
【答案】14.6%【解析】试题分析:由于中和反应放热,故随着反应的进行,溶液的温度逐渐升高,直至反应恰好完全,溶液温度达到最高,故根据图示可判断,当加入氢氧化钠那溶液的质量为20g时,反应恰好完全解:分析图知与10g稀盐酸恰好完全反应的氢氧化钠质量为:20g×8%=1.6g设稀盐酸中溶质的质量为xNaOH+HCl=NaCl+H2O40 36.51.6g x40:1.6g=36.5:xx=1.46g稀盐酸中溶质的质量分数为:1.46g/10g=14.6%答:稀盐酸中溶质的质量分数为14.6%考点:根据化学方程式计算2.某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。
请你计算:(1)若要清洗1000kg的这种石油产品,需要_____kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。
每处理1000kg这种产品,他们可以节约多少经费_____?请你写出具体的计算过程。
工业级的NaOH和Ca(OH)2的最新市场批发价如下表:试剂Ca(OH)2NaOH价格(元/kg) 1.00 6.00(3)请你在图中画出氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线表示,氢氧化钙用实线表示。
_____(请你注明具体的坐标)【答案】40 203元【解析】【详解】1000kg的这种石油产品所含硫酸的质量为1000kg×4.9%=49kg设消耗的氢氧化钠的质量为x,消耗的氢氧化钙的质量为y根据2NaOH+H2SO4=Na2SO4+2H2O和Ca(OH)2+H2SO4=CaSO4+2H2O可得关系式为242 2NaOH H SO Ca(OH)809874x49kg y::809874==x49kg yx=40kgy=37kg每处理1000kg这种产品,他们可以节约经费为6.00元/kg×40kg-1.00元/kg×37kg=203元图中画出用氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线“…”表示,氢氧化钙用实线“一”表示,答:(1)若要清洗1000kg的这种石油产品,需要 40kg的NaOH。
(化学)中考化学化学计算题技巧(很有用)及练习题

(化学)中考化学化学计算题技巧(很有用)及练习题一、中考化学计算题1.某校兴趣小组在实验室中完成制取氧气的实验。
他们取氯酸钾和二氧化锰的混合物共6g 放入大试管中加热,并在同时测定试管中剩余固体物质的质量(如下表),请分析表中数据,完成下列问题:(1)完全反应时,生成氧气的质量为_____g ;(2)原混合物中氯酸钾的质量分数是____________?(计算结果精确到0.1%) 【答案】1.92g 81.7% 【解析】(1)氯酸钾发生分解反应生成氯化钾和氧气,二氧化锰作催化剂,反应前后二氧化锰的质量不变,根据质量守恒定律,生成氧气的质量为:6g-4.08g=1.92g 。
(2)设原混合物中氯酸钾的质量为x 。
2KClO 32MnO Δ2KCl+3O 2↑ 245 96 x 1.92g24596=1.92x g,解得x=4.9g 原混合物中氯酸钾的质量分数是:4.96gg×100%=81.7%点睛:首先根据质量守恒定律求出氧气的质量,然后根据化学方程式找出氧气与氯酸钾的质量关系,利用反应中物质的质量比不变进行列比例式计算,易错点是,由质量比算数错误,所以这一步一定要仔细检查。
2.碳酸钠和碳酸氢钠的固体混合物充分加热至恒重,其质量变化如下图所示。
另取相同质量的该混合物溶于水得到106.6 g 溶液,向该溶液中加入100 g 7.3% 的稀盐酸,恰好完全反应。
(已知:2NaHCO 3ΔNa 2CO 3+CO 2↑+H 2O ,碳酸钠受热不易分解。
)计算:(1)混合物与盐酸反应生成二氧化碳的质量_________。
(2)所得溶液中溶质的质量分数_________。
【答案】6.6g 5.85%【解析】【详解】(1)设混合物中碳酸氢钠的质量为x;碳酸氢钠与盐酸反应生成二氧化碳的质量为y、碳酸钠与盐酸反应生成二氧化碳的质量为z2NaHCO3Na2CO3+CO2↑+H2O2×84 (44 + 18)x 3.1 gx = 8.4gNaHCO3+HCl =NaCl + CO2↑+H2O84 448.4 g yy = 4.4g混合物中碳酸钠的质量为:13.7g -8.4g = 5.3gNa2CO3+2HCl =2NaCl + CO2↑+H2O106 445.3 g zz = 2.2g13.7 g混合物与稀盐酸反应生成二氧化碳的总质量是6.6 g(2)反应后溶液的质量:106.6 g+100 g-6.6 g =200g,根据氯元素守恒,设反应生成氯化钠的质量为mHCl ~ NaCl36.5 58.5100 g× 7.3% mm= 11.7g氯化钠溶液中氯化钠的质量分数=答:(1)混合物与盐酸反应生成二氧化碳的质量为6.6g;(2)与盐酸反应后溶液中氯化钠的质量分数是5.85%。
【化学】初三化学化学计算题技巧和方法完整版及练习题含解析

【化学】初三化学化学计算题技巧和方法完整版及练习题含解析一、中考化学计算题1.某化学兴趣小组在实验室用碳酸钠溶液和熟石灰制取少量氢氧化钠溶液,他们的实验过程和相关数据如图所示。
请计算:(1)实验中生成沉淀的质量为___________。
(2)所得氢氧化钠溶液中溶质的质量分数为___________。
【答案】10 10% 【解析】 【分析】 【详解】(1)实验中生成沉淀的质量=195.6g-185.6g=10g (2)设氢氧化钠的质量为x 。
()2332Ca OH + Na CO CaCO + =1002N 8xaOH010g↓ 10080=10g xx=8g所的溶液的质量=185.6g-105.6g=80g氢氧化钠溶液的溶质质量分数=8g80g×100%=10% 答:(1)实验中生成沉淀的质量为10g ;(2)所得氢氧化钠溶液中溶质的质量分数为10%。
2.20g 含杂质(杂质不溶于水,也不溶于酸)的锌样品,与一定质量的稀硫酸恰好完全反应,所得溶液质量为80.5g ,同时生成氢气0.4g 。
试计算: (1)样品中锌的质量分数是_____;(2)完全反应后生成溶液中溶质的质量分数是_____; (3)所用稀硫酸的质量分数是_____(计算结果保留到0.01%)。
【答案】65% 40% 28.87% 【解析】 【分析】样品中的锌能与稀硫酸反应生成硫酸锌和氢气。
【详解】设样品中锌的质量为x;生成的硫酸锌的质量为y;硫酸中溶质的质量为z;2442Zn+H SO=ZnSO+H65981612x z y0.4g↑65981612===x z y0.4gx=13gy=32.2gz=19.6g(1)样品中锌的质量分数为13g×100%=65% 20g(2)完全反应后生成溶液中溶质的质量分数为32.2g×100%=40% 80.5g(3)所用稀硫酸的质量分数为19.6g×100%28.87% 80.5g+0.4g-13g≈答:样品中锌的质量分数为65%,完全反应后生成溶液中溶质的质量分数为40%,所用稀硫酸的质量分数为28.87%。
初中化学化学计算题解题技巧讲解及练习题(含答案)

(1)根据质量守恒定律,可知生成沉淀的质量为___________________________。
(2)固体混合物中氯化钙的质量是___________?
小提示:2NaOH+ MgSO4→ Na2SO4+ Mg(OH)2↓;
Na2SO4 溶液不与 MgSO4 溶液发生反应。
(1)实验过程中,产生沉淀的质量为
g。
(2)最终所得溶液的溶质质量分数为多少?(写出计算过程)
(3)原固体混合物中钠元素的质量为 g。
106 44 ; x 4.4g
(3)设碳酸钠反应生成氯化钠的质量为 y,反应的氯化氢的质量为 m。
106 44 x=10.6g x 4.4g
117 44 y=11.7g y 4.4g 73 44 m=7.3g m 4.4g
与氢氧化钠反应的氯化氢质量为:200g×7.3%-7.3g=7.3g 则与氢氧化钠反应生成氯化钠的质量也是 11.7g 10%的氯化钠溶液的质量为 11.7g×2÷10%=234g 由 D—E 蒸发水的质量为 295.6g -234g=61.6g (4)设样品中氢氧化钠的质量为 n。
106:111=10.6g:x 106:117=10.6g:y 106:100=10.6g:z
x=11.中钙元素的质量为 11.1g× ×100%=4g
则氯化钠和氯化钙的混合物的质量为 =20g 氯化钠和氯化钙的混合物中氯化钠的质量为 20g﹣11.1g=8.9g
(6)请绘制加入稀盐酸与生成气体质量关系的曲线图____。
中考化学化学计算题技巧和方法完整版及练习题

(2)根据加水稀释时对溶液中溶质的质量不产生影响,由 40g 质量分数为 36.5%的盐酸中
溶质 HCl 的质量与所稀释成溶液的质量分数 10%的比计算出稀释后溶液的质量,稀释前后
溶液的质量差为需要水的质量.
解:设 25g 大理石中碳酸钙的质量为。
CaCO3+ 2HCl = CaCl2+H2O+ CO2↑ 1 分
6.将一定质量的炭粉与铜粉的混合物放在空气中充分加热(铜氧化成氧化铜),冷却后发 现剩余固体的质量与加热前相等.计算原混合物中炭粉与铜粉的质量比. 【答案】1:4 【解析】 【分析】 【详解】 解:碳和铜都被完全氧化后,冷却到室温,发现固体的质量没有变化,说明碳的质量等于 和铜反应的氧气的质量;设铜的质量为 x,参加反应的氧气的质量为 y,
z
z = 2.2g 13.7 g 混合物与稀盐酸反应生成二氧化碳的总质量是 6.6 g (2)反应后溶液的质量:106.6 g+100 g-6.6 g =200g, 根据氯元素守恒,设反应生成氯化钠的质量为 m HCl ~ NaCl 36.5 58.5 100 g× 7.3% m
m= 11.7g 氯化钠溶液中氯化钠的质量分数=
0.6g
(4)合金样品中铜的质量分数是
×100%=20%;
3g
(5)参加反应的镁的质量为 3g−0.6g=2.4g 设可得到氢气的质量为 x
Mg + H2SO4 = MgSO4 + H2
24
2
2.4g
x
24 = 2 2.4g x
x=0.2g 答:若反应过程中产生的气体收集起来,可得到氢气的质量为 0.2g。 【点睛】 观察表格中前四次剩余固体变化情况,每次减少 0.5g,第五次开始,剩余固体质量不再变 化,则反应完全。
(化学)中考化学初中化学化学计算题解题技巧(超强)及练习题(含答案)

(化学)中考化学初中化学化学计算题解题技巧(超强)及练习题(含答案)一、中考化学计算题1.取CaCl2和CaCO3的混合物12.5g于烧杯中,向其中滴加一定溶质质量分数的稀盐酸,请加稀盐酸的质量与产生气体质量的关系如图所示。
求:(1)混合物CaCO3中的质量为_______;(2)稀盐酸中的溶质质量分数为________;(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数为________?(写出计算过程,计算结果精确到0.1%)【答案】10g7.3%12.6%【解析】试题分析:盐酸和碳酸钙反应生成氯化钙、水和二氧化碳,由图可知:二氧化碳的质量为4.4g设碳酸钙的质量为x,稀盐酸中的溶质质量为z,生成氯化钙的质量为y。
CaCO3+2HCl=CaCl2+H2O+CO2↑100 73 111 44x z y 4.4gx=10g z=7.3g y=11.1g(1)混合物CaCO3中的质量为10g;(2)稀盐酸中的溶质质量分数为100%=7.3%;(3)恰好完全反应时,所得不饱和溶液中溶质的质量分数=100%≈12.6%。
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算2.工业上“侯氏”制碱法制得的纯碱产品中常含有少量的氯化钠。
为测定纯碱品中碳酸钠的含量,取23克样品置于大烧杯中,然后在滴加稀盐酸,至两者恰好完全反应共滴加稀盐酸255.8g,生成的气体全部逸出,测得反应后烧杯中的溶液质量为270g,计算:(1)生成二氧化碳的质量为_____。
(2)纯碱样品中碳酸钠的质量分数是_____(计算结果保留0.1%) 【答案】8.8g 92.2% 【解析】 【分析】根据质量守恒定律,参加反应的反应物的总质量等于生成的生成物的总质量,减少的为二氧化碳的质量。
【详解】根据质量守恒定律可得,生成的二氧化碳的质量为23g+255.8g 270g 8.8g ﹣= 设纯碱样品中碳酸钠的质量分数为x2322Na CO +2HCl 2NaCl H O CO 1064423g +x8g=+8.⨯↑10623g x =448.8g⨯ x 92.2%≈答:生成二氧化碳的质量为8.8g ,纯碱样品中碳酸钠的质量分数是92.2%。
(化学)中考化学初中必备化学化学方程式的计算技巧全解及练习题(含答案)

(化学)中考化学初中必备化学化学方程式的计算技巧全解及练习题(含答案)一、中考化学方程式的计算1.在盛有24.3g 硫酸钠和氯化钠组成的固体混合物的烧杯中,加入100g 水使硫酸钠和氯化钠全部溶解。
向其中逐渐滴加溶质质量分数为20%的氯化钡溶液。
生成沉淀的总质量与所滴入氯化钡溶液的质量关系曲线如图Z7-6所示,请根据题意回答问题。
(1)过程中观察到的现象_____。
(2)滴加到B 点时,溶液中的溶质是_____(填化学式)。
(3)当滴加氯化钡溶液至图中A 点时,所得溶液中溶质的质量分数。
_____(结果保留一位小数)【答案】生成白色沉淀,溶液变浑浊; NaCl 和BaCl 2 10.6%【解析】【分析】【详解】(1)硫酸钠和氯化钡生成硫酸钡沉淀和氯化钠,所以会看到有白色沉淀生成,故填:生成白色沉淀,溶液变浑浊;(2)硫酸钠和氯化钡生成硫酸钡沉淀和氯化钠,A 点表示恰好完全反应,此时溶质为氯化钠,B 点表示氯化钡过量,此时溶质为氯化钡和氯化钠,故填:NaCl 和BaCl 2; (3)当滴加氯化钡溶液至图中A 点时,所得溶液中溶质为氯化钠设生成氯化钠质量为x 反应硫酸钠质量为y ,生成沉淀质量为z 。
2244BaCl Na SO BaSO 2NaCl 208142233117104g 20%y z x 208104g 20%208104g 20%208104g 20%===117x 142y 233zx=11.7g y=14.2g z=23.3g+=↓+⨯⨯⨯⨯,,,,反应后氯化钠质量为:11.7g+(24.3g-14.2g)=21.8g ,反应后溶液质量为:24.3g+100g+104g-23.3g=205g,反应后溶液质量分数为;21.8g 100%10.6%205g ⨯≈ 答:溶质质量分数为10.6%2.小明想测量某氧化铜样品中氧化铜的纯度(假设其他成分不和酸反应,也不溶于水),进行如下实验:将5g 粉碎后的样品加入烧杯中再加入98g 5%的稀硫酸恰好完全反应。
(化学)中考化学化学计算题的技巧及练习题及练习题(含答案)

(化学)中考化学化学计算题的技巧及练习题及练习题(含答案)一、中考化学计算题1.向盛有193.8g硫酸铜溶液的烧杯中,逐滴加入质量分数为8%的氧氧化钠溶液,反应过程中生成沉淀的质量与所用氧氧化钠溶液的质量关系如图所示。
(化学方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4),请计算:(1)恰好完全反应时生成沉淀的质量。
(2)恰好完全反应时溶液中溶质的质量分数。
【答案】9.8g 5%【解析】利用化学方程式,根据反应的质量比即可计算出生成的沉淀的质量和生成的硫酸钠的质量。
解:设生成氧氧化铜的质量为x,生成硫酸钠的质量为y。
CuSO4+ 2NaOH=Cu(OH)2↓+Na2SO480 98 142100g×8% x y=x=9.8g=y=14.2g溶液溶质质量分数为×100%=5%答:恰好完全反应时生成沉淀的质量为9.8g,所得溶液中溶质的质量分数为5%。
2.为测定某大理石样品中碳酸钙(杂质不溶于水也不参与反应)的质量分数,某小组的同学进行了如下实验(水和氯化氢的挥发忽略不计):取12.5g样品研碎放入烧杯中,每次加入20.8 g稀盐酸后并用电子天平称量,记录实验数据如下。
加入稀盐酸次数12345烧杯及所称物质总质量/g72.291.9111.6131.3152.1请计算:⑴大理石样品中碳酸钙的质量分数;____________⑵恰好完全反应时烧杯内溶液的溶质质量分数。
_____________【答案】80% 12.5%【解析】【详解】分析表中数据可知,前四次加入盐酸后,共产生二氧化碳:1.1g×4=4.4g 设大理石中CaCO3的质量为x,完全反应时,生成CaCl2的质量为y3222CaCO+2HCl=CaCl+H O+CO10011144x y 4.4g↑10011144==x y 4.4g解得x=10g y=11.1g大理石样品中碳酸钙的质量分数:10100%12.5gg⨯=80%恰好完全反应时烧杯内溶液的溶质质量分数11.1100% 1020.84 4.4gg g g⨯+⨯-=12.5%答:(1)大理石样品中碳酸钙的质量分数为80%;(2)恰好完全反应时烧杯内溶液的溶质质量分数为12.5%。
