高考理综化学非选择题专项训练
届高考理综非选择题专练

2013届高三理综·非选择题练习第Ⅱ卷(非选择题部分)【东北三省三校联考】三、非选择题:包括必考题和选考题两部分。
第22题~第32题为必考题,每个试卷考生都必须做答。
第33题~第40题为选考题,考生根据要求做答。
(一)必考题(11题,共129分)22.(5分)一个同学在研究小球自由落体运动时,用频闪照相连续记录下小球的位置如图所示。
已知闪光周期为301s ,测得x 1=7.68cm ,x 3=12.00cm ,用上述数据通过计算可得小球运动的加速度约为_______m/s 2,图中x 2约为________cm 。
(结果保留3位有效数字)23.(10分)研究性学习小组围绕一个量程为30mA 的电流计展开探究。
(1)为测量该电流计的内阻,同学甲设计了如图(a )所示电路。
图中电源电箱阻值调到20Ω时,电流计恰好满偏; 将电阻箱阻值调到95Ω时,电流计指针指在如图(b )所示位置,则电流计的读数为mA 。
由以上数据可得电流计的内阻R g =Ω。
(2)同学乙将甲设计的电路稍作改变,在电流计两端接上两个表笔,如图(c )所示,设计出一个简易的欧姆表,并将表盘的电流刻度转换为电阻刻度:闭合开关,将两表笔断开,调节电阻箱,使指针指在“30mA”处,此处刻度应标阻值为Ω(填“0”或“∞”);再保持电阻箱阻值不变,在两表笔间接不同阻值的已知电阻找出对应的电流刻度。
则“10mA”处对应表笔间电阻阻值为Ω。
(3)若该欧姆表使用一段时间后,电池内阻变大不能忽略,电动势不变,但将两表笔断开,调节电阻箱指针仍能满偏,按正确使用方法再进行测量,其测量结果与原结果相比将_________(填“变大”、“变小”或“不变”)。
24.(14分)一物块以一定的初速度沿斜面向上滑,利用速度传感器可以在计算机屏幕上得到其速度大小....随时间变化的关系图像如图所示,求: (1)物块向上滑行的最大距离S ;(2)斜面的倾角θ及物块与斜面间的动摩擦因数μ。
通用高考化学总复习非选择题系列练题6

A.98%的浓硫酸 B.70%的硫酸 C.10%的稀硫酸
(2)打开分液漏斗旋塞,发现其中的液体不能流下,应采取的操作是__________________________。
(3)关闭K1、K3,打开K2。一段时间后E 中有Na2S2O5晶体析出,装置E 中发生反应的化学方程式为__________________________。
2.呼吸面具中Na2O2可吸收CO2放出O2,若用超氧化钾(KO2)代替Na2O2也可起到同样的作用。
(1)写出KO2与CO2的反应方程式________________________________.
(2)lkgNa2O2和lkgKO2,分别和CO2反应,生成的O2体积比(同温同压下)为__________。
(3)1mol CO2分别与足量的Na2O2、KO2反应生成的O2的物质的量分别为0.5mol和1.5mol,所以在同温同压下它们生成氧气的体积比为1∶3 。
(4)由以上数据可知,选用KO2作为补氧剂更合适,理由是用KO2释放氧气的效率更高。
3.焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂(易被氧化),某研究性学习小组为了制备少量Na2S2O5,并探究SO2 的某些性质,设计下图所示装置(夹持装置已略去)。请回答下列问题:
①量取98%的浓H2SO4__________________mL,应选用___________mL量筒。
②选取_____________mL的容量瓶,洗涤,检查是否漏液,将稀释并__________________后的H2SO4沿玻璃棒转移到 Nhomakorabea容量瓶中。
③用少量蒸馏水洗涤小烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中。
高考理综化学非选择题专项训练

高考化学大题专项训练一、基本理论综合类试题(一)热化学、化学反应速率与化学平衡相结合的基本理论综合题1、乙醇是重要有机化工原料,可由乙烯气相直接水合法或间接水合法生产。
回答下列问题:(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C 2H 5OSO 3H),再水解生成乙醇。
写出相应反应的化学方程式____________________________________。
(2)已知:甲醇脱水反应 2CH 3OH(g)=CH 3OCH 3(g)+H 2O(g) △H 1= -23.9kJ/mol 甲醇制烯烃反应2CH 3OH(g)=C 2H 4(g)+2H 2O(g) △H 2= -29.1kJ/mol 乙醇异构化反应 C 2H 5OH(g)=CH 3OCH 3(g) △H 2= +50.7kJ/mol 则乙烯气相直接水合反应C 2H 4(g)+H 2O(g)= C 2H 5OH(g)的△H=_____kJ/mol 。
与间接水合法相比,气相直接水合法的优点是___________。
(3)如图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n O H 2:n 42H C =1:1)①列式计算乙烯水合制乙醇反应在图中A 点的平衡常数Kp=____ __ _(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强(p 1、p 2、p 3、p 4)的大小关系为__________,理由是_____________。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度为290℃、压强为6.9Mpa ,n O H 2:n 42H C =0.6:1。
乙烯的转化率为5%,若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有___________、___________。
2、化合物AX 3和单质X 2在一定条件下反应可生成化合物AX 5。
浙江省2019~2020年高中化学非选择题专题汇编(有机推断大题)
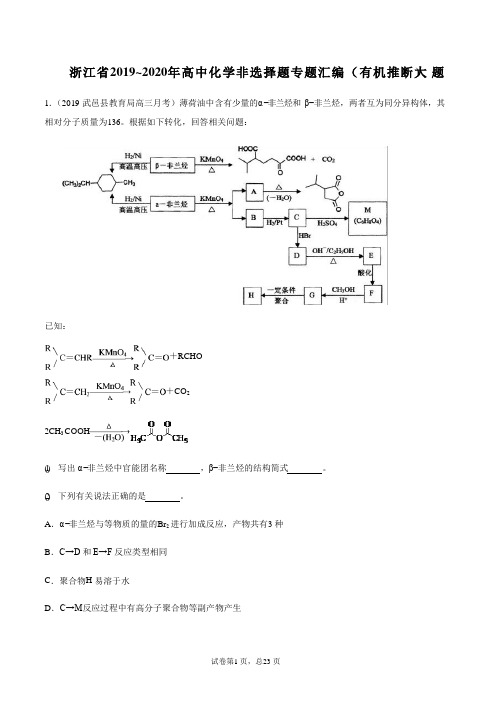
浙江省2019~2020年高中化学非选择题专题汇编( 有机推断大) 题1.(2019·武邑县教育局高三月考)薄荷油中含有少量的α −非兰烃和 β−非兰烃,两者互为同分异构体,其相对分子质量为136。
根据如下转化,回答相关问题:已知:(1) 写出 α −非兰烃中官能团名称,β−非兰烃的结构简式 。
(2) 下列有关说法正确的是。
A .α −非兰烃与等物质的量的Br 2 进行加成反应,产物共有3 种B .C→D 和E→F 反应类型相同C .聚合物H 易溶于水D .C→M 反应过程中有高分子聚合物等副产物产生+RCHO+CO 22CH 3 COOH(3)写出F→G的化学方程式。
(4)写出符合下列条件的A 的同分异构体。
①含有4 个-CH3 ;②1 mol 此同分异构体在碱性条件下水解需2 mol NaOH。
2.(2019·浙江高三)依折麦布是目前唯一的胆固醇吸收抑制剂,合成它的一种重要中间体M 的结构如图所示。
某兴趣小组以甲苯和戊二酸酐为原料,设计了以下合成路线,部分条件和产物已略去。
(5) 以甲苯和丙烯为基本原料合成(用流程图表示,其他无机试剂任选)。
已知:①②③请回答:(1)物质K 的结构简式为。
(2)下列说法正确的是。
A.由甲苯制B 需用Fe 作催化剂B.物质H 水解后产物的最简单同系物为乙酸C.反应①②③ 均为取代反应D.1mol物质K 最多能与2mol NaOH反应(3)写出反应②的化学方程式:。
(4)写出同时符合下列条件的G 的所有同分异构体的结构简式:。
①分子中含有3 个苯环;②能发生银镜反应;③酸性条件下能发生水解反应;④1H−NMR谱显示分子中含有6 种氢原子。
(5) 设计以苯和乙烯为原料制备另一种医药中间体二苯甲酮( ) 的合成路线:。
( 用流程图表示,无机试剂任选) 3.(2018·浙江镇海中学高三)化合物物G是一种用于合成γ- 分泌调节剂的药物中间体,其合成路线流程图如下:请回答:(1) B的结构简式为。
2020版新高考化学三轮复习非选择题专项练(三)(含解析)

非选择题专项练(三)(建议用时:40分钟)1.硼铁混合精矿含有硼镁石[MgBO2(OH)]、磁铁矿(Fe3O4)、磁黄铁矿(Fe x S)、晶质铀矿(UO2)等,以该矿为原料制备MgSO4·H2O 和硼酸(H3BO3)的工艺流程如下:已知:UO2+2在pH为4~5的溶液中生成UO2(OH)2沉淀。
回答下列问题:(1)“酸浸”时,MgBO2(OH)与硫酸反应的化学方程式为__________________________________________________________ ______________,NaClO3可将UO2转化为UO错误!,反应的离子方程式为______________________________________________________ __________________。
(2)“除铁净化"需要加入________(填一种试剂的化学式)调节溶液pH至4~5,滤渣的成分是________。
(3)“蒸发浓缩”时,加入固体MgCl2的作用是___________________________________________________________________________________ __________________。
(4)“酸浸”时少量铁精矿(Fe3O4、Fe x S)因形成“腐蚀电池”而溶解,反应生成Fe2+和硫单质,写出负极反应式:______________________________________________________ __________________.(5)某工厂用m1 kg硼铁混合精矿(含B为11%)制备H3BO3,最终得到产品m2 kg,产率为________。
2.某化学兴趣小组测定硫铁矿(主要成分为FeS2)矿样中硫元素的质量分数,进行如下实验:将m1 g样品放入如图所示装置C中,打开K1关闭K2,从a处不断通入空气,高温煅烧石英管中的样品。
通用版高考化学总复习非选择题系列练题

非选择题系列练题(16)1.(1)配制稀硫酸时,先将浓硫酸加入烧杯中,后倒入蒸馏水(______)(2)称取2.0 g NaOH固体,可先在托盘上各放一张滤纸,然后在右盘上添加2 g砝码,左盘上添加NaOH固体(_______)(3)按照下图操作,配制一定浓度的NaCl溶液(_____)(4)按照下图操作,配制0.10 mol·L-1 NaOH溶液(______)(5)配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏高(_______)(6)配制溶液(_______)(7)因为Ca(OH)2能制成澄清石灰水,所以可配制2.0 mol·L-1的Ca(OH)2溶液(_____)(8)配制0.100 0 mol·L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流(_______)(9)用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小(________)(10)用固体NaCl配制0.5 mol·L-1的溶液,所用的仪器有:烧杯、玻璃棒、胶头滴管、容量瓶(_______)【答案】错错错错对错错对错错【解析】(1)配制稀硫酸时,应先倒入蒸馏水,然后将浓硫酸沿器壁注入烧杯中,故(×);(2)因NaOH易潮解,称量时应NaOH放在烧杯中称量,故(×);(3)配制一定浓度的NaCl溶液,定容进视线应与液面的最低处水平,故(×);(4)NaOH应在烧杯中溶解、冷却后转移到容量瓶中,故(×);(5)配制溶液定容时,俯视容量瓶刻度,溶液的体积偏小,会使溶液浓度偏高,故(√);(6)定容时液面的最低处与刻度线相切,故(×);(10)用固体NaCl配制溶液,需要用到托盘天平称量固体,缺少托盘天平,故(×)。
点睛:要学会配制一定物质的量浓度溶液的常见误差分析的基本方法:紧抓c=分析,如:用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中,用量筒量取液体药品,量筒不必洗涤,因为量筒中的残留液是量筒的自然残留液,在制造仪器时已经将该部分的体积扣除,若洗涤并将洗涤液转移到容量瓶中,导致n偏大,所配溶液浓度偏高;再如:配制氢氧化钠溶液时,将称量好的氢氧化钠固体放入小烧杯中溶解,未冷却立即转移到容量瓶中并定容,容量瓶上所标示的使用温度一般为室温,绝大多数物质在溶解或稀释过程中常伴有热效应,使溶液温度升高或降低,从而影响溶液体积的准确度,氢氧化钠固体溶于水放热,定容后冷却至室温,溶液体积缩小,低于刻度线,导致V偏小,浓度偏大,若是溶解过程中吸热的物质,则溶液浓度偏小等。
高三理科综合能力测试化学练习题

理科综合能力测试化学练习题一、选择题(在下列各题的四个选项中,只有一个选项是符合题目要求的)1.人的胃液是一种强酸性液体,pH 在09~1.5之间,氢氧化铝是一种胃液过多的胃药的主要成份。
目前这种胃药已不常用,其主要原因是( ) A.长期摄入铝元素不利于人体健康 B.它不能中和胃液 C.它不易溶于胃液 D.它的疗效太差 2.科学家发现铂的两种化合物 a: b:化学式相同,但具有不同的性质;a 有抗癌性而b 没有。
下列关于a 和b 的叙述中正确的是( )A.a 和b 的化学式相同,所以是同一种物质B.a 和b 的结构不同,所以是同分异构体C.a 和b 中N 、Pt 、Cl 原子的空间构型是平面正四边形D.a 和b 中N 、Pt 、Cl 原子的空间构型是四面体3.由2个C 原子、1个O 原子、1个N 原子和若干个H 原子组成的有机化合物,H 的原子数最多为( ) A.5个 B.6个 C.7个 D.8个4.将3.9g 镁铝合金,投入到12500-⋅L mol mL 的盐酸中,金属完全溶解,再加入14-⋅L mol 的NaOH 溶液,若要生成的沉淀最多,加入的这种NaOH 溶液的体积是( ) A.125mL B.200mL C.250mL D.560mL5.A 、B 、C 为三种气体,把a molA 和b molB 充入一密闭容器中,发生反应,达到平衡时,若它们的物质的量满足n (A )+n (B )=n (C ),则A 的转化率为( )A.%1005⨯+b a B.%1005)(2⨯+b b a C.%1005)(2⨯+b a D.%1005⨯+ab a6.等质量的2SO 和2O 混合,在一定条件下反应,当达到平衡时,2SO 与2O 的转化率,前者与后者的关系是( ) A.大于 B.小于 C.等于 D.无法确定7.诺贝尔化学奖颁发给美国的威廉·诺尔斯、巴里·夏普莱斯和日本的野依良治三位科学家,以表彰他们在“手性催化反应”研究领域所作出的贡献。
2021届高中毕业班化学非选择题分类专项训练06(含参考答案)

23.(15 分)已知A 、B 、C 、D 为中学化学常见的单质或化合物。
请根据下图和各小题信息, 回答下列问题。
(1)当A 为淡黄色固体,则:① A 与水反应的化学反应方程式为② 若F 为常见的温室气体,则往含有1.0 mol B 的溶液中通入0.8 mol F 后,生成C 的物质的量为 mol ;(2)当A 为有色气体,则:① 若F 为常见金属,则B 的稀溶液与过量..F 反应的离子方程式为,E 物质的化学式是② 若C 为二氧化碳,则F 溶液呈 性(填“酸”或“碱”或“中”),试用离子方程式解释(3) 当A 是有特殊香味的无色油状液体有机物,则:① 若B 、E 的相对分子质量相同,B 在一定条件下可经多步氧化最终转化为D ,则A 的化学式为② 若B 的溶液常用作医用消毒剂,则写出B 与D 在一定条件下反应的化学方程式24.(15分)某学习小组模拟工业上由铝矾土(含Al 2O 3和少量的SiO 2及铁的氧化物)制备金属铝的方法,设计了实验室用铝矾土制备金属铝的方案,主要流程如下图所示:氢氧化物开始沉淀pH 沉淀完全pH 开始溶解pH 溶解完全pH Fe(OH)32.3 4.1 14 - Al(OH)33.3 5.2 7.8 10.8(1) 为了加快铝矾土的酸溶速率,除了反应过程不断搅拌外,还可采取的措施有(至少二条)。
(2) 加入H 2O 2时,发生反应的离子方程式为 。
要检 验Fe 2+是否反应完全应选择的试剂是 。
(供选试剂:KMnO 4溶液、KSCN 溶液、NaOH 溶液、H 2O 2溶液)。
加入NaOH 调节滤液A 的pH 在 范围。
(3) 流程中有多次过滤,需制作一个简单的过滤器,所需的用品有(4) 电解Al 2O 3时阳极生成的O 2全部与石墨反应转化为CO 2和CO 。
相关反应的热化学方程式如下:C(s ,石墨)+ O 2(g)=CO 2(g) △H =-393.5 kJ·mol -1△ 电解 Al 铝矾土过滤1 滤液A NaOH 过滤2 滤液B CO 2 过滤3 Al(OH)3 Al 2O 32C(s,石墨)+ O2(g)=2CO(g) △H=-221.0 kJ·mol-1若CO2和CO的体积比为1︰1,当阴极得到27g铝时,若阳极生成的气体用作燃料能放出热量kJ。
高三化学非选择题组合提速练四套题及详案

高三化学非选择题组合提速练非选择题提速练(一)(本练包括5小题,共60分,建议用时60分钟)1.(12分)硫酸亚铁在空气中易被氧化,与硫酸铵反应生成硫酸亚铁铵[化学式为FeSO4·(NH4)2SO4·6H2O]后就不易被氧化。
模拟工业制备硫酸亚铁铵晶体的实验装置如下图所示。
请回答下列问题:(1)仪器a的名称是________。
(2)铁屑中常含有Fe2O3、FeS等杂质,则装置C的作用是________,装置B中发生反应的离子方程式可能是________(填序号)。
A.Fe+2H+===Fe2++H2↑B.Fe2O3+6H+===2Fe3++3H2OC.2Fe3++S2-===2Fe2++S↓D.2Fe3++Fe===3Fe2+(3)按上图连接好装置,经检验气密性良好后加入相应的药品,打开K1、K2,关闭K3,装置B中有气体产生,该气体的作用是________________________。
反应一段时间后,打开K3,关闭K1和K2。
装置B中的溶液会流入装置A,其原因是____________________________________________。
(4)按上图所示装置制备硫酸亚铁铵晶体的安全隐患是________________________________________________________________________ ________________________________________________________________________。
(5)根据相关物质的溶解度判断,从装置A中分离出硫酸亚铁铵晶体,需采用的操作有________、________、洗涤、干燥。
三种盐的溶解度(单位为g/100 g H2O)温度/℃FeSO4(NH4)2SO4FeSO4·(NH4)2SO4·6H2O10 20.0 73 17.220 26.5 75.4 21.630 32.9 78 28.1(1)SO2分子的VSEPR模型名称是__________________________。
高考化学复习非选择题专项训练6.docx

高中化学学习材料非选择题专项训练六图表数据型1.一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下:(1)过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为。
(2)过程Ⅱ中加入稀硫酸酸化后,再加入Na2S2O3溶液浸出钴。
则浸出含钴物质的化学反应方程式为(产物中只有一种酸根)。
在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请分析不用盐酸浸出钴的主要原因:。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式:。
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程Ⅳ中起的作用是。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是(填序号)。
A.c(Na+)=2c(C)B.c(Na+)>c(C)>c(HC)C.c(OH-)>c(HC)>c(H+)D.c(OH-)-c(H+)=c(HC)+2c(H2CO3)(6)CoO溶于盐酸可得粉红色的CoCl2溶液。
CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。
下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是。
2.硝酸锶[Sr(NO3)2]常作为制备焰火、信号弹的原料。
实验室以生产碳酸锶工厂的废渣(含SrCO3 38.40%,SrO 12.62%,CaCO3 38.27%,BaCO3 2.54%,MgCO3 1.88%,其他不溶于硝酸的杂质6.29%)为原料制备硝酸锶粗品的部分实验过程如下:温度/℃物质0 20 30 45 60 80Sr(NO3)228.240.74747.248.349.2Ca(NO3)2·4H2O 102 129 152 230 300 358(1)废渣粉碎的目的是。
高考化学总复习非选择题系列练题20

非选择题系列练题(20)1.常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、NH、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO、SO、CO,已知:①五种盐均溶于水,水溶液均为无色②D的焰色反应呈黄色③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀请回答下列问题:(1)五种盐中,一定没有的阳离子是________;(2)这五种盐分别是(写分子式)A_________________ B________________ C_________________D_________________ E________________(3)若要检验B中所含的阳离子,正确的实验方法是_________________________________ 【答案】 Fe3+ Cu2+ BaCl2 (NH4)2SO4 AgNO3 Na2CO3 Al2(SO4)3加入浓碱液并加热,用湿润的红色石蕊试纸检验产生的气体,试纸变红色【解析】本题主要考查离子反应。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀,所以C是硝酸银。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失,所以E是铝盐。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀,所以B是(NH4)2SO4,E是Al2(SO4)3。
(1)五种盐中,一定没有的阳离子是Cu2+、Fe3+;(2)这五种盐分别是A:BaCl2、B:(NH4)2SO4、C:AgNO3、D:Na2CO3、E:Al2(SO4)3;(3)若要检验B中所含的阳离子NH4+,正确的实验方法是:加入浓碱液并加热,用湿润的红色石蕊试纸检验产生的气体,试纸变红色。
高考冲刺之理综化学非选择题精粹

28.(16分)为测定碳酸钙样品(含杂质二氧化硅)的纯度,某兴趣小组的同学设计了如下几个实验方案:方案I:①称取碳酸钙样品m g ②用c1mol/L盐酸V1mL(过量)溶解样品③取溶解后的溶液体积的十分之一,用c2 mol·L-1NaOH溶液滴定,恰用去V2mL。
方案Ⅱ:①称取碳酸钙样品mg②高温煅烧直至质量不再改变,冷却后称量,剩余固体质量为m1 g。
方案Ⅲ:①称取碳酸钙样品mg ②加入足量c1mol·L-1盐酸V1mL(过量)溶解样品③过滤取出滤液④在滤液中加入过量c3mol·L-1 Na2CO3溶液V3mL ⑤将步骤④中的沉淀滤出、洗涤、干燥、称重为m2g。
根据以上实验方案,回答以下问题:(1)方案I中碳酸钙纯度计算公式为________________________。
(2)方案II中高温锻烧样品应在(填写仪器名称)中进行;为保证实验的准确性,整个实验过程中至少要称量次。
(3)方案Ⅲ中不需要的数据是(填选项编号)。
A.c3、V3B.c1、V l C.m2D.m(4)方案Ⅲ中为了减少实验误差,必要的操作是_____ (填选项编号)。
A .精确测定Na 2CO 3体积V 3mLB .精确配制Na 2CO 3溶液浓度c 3mol /LC .将步骤⑧所得沉淀洗涤,洗液并入④中(5)方案IV :称取碳酸钙样品mg ,按下图装置进行实验,根据实验原理,在图中方框内补充必要的仪器,并注明所用试剂名称。
28.(16分)(1)11221020cV c V m100%(4分,其它合理答案同样给分)(2)坩埚 四(各2分) (3)AB (2分0(4)C (2分) (5)(共4分,仪器2分,药品2分)饱和NaHCO 3溶液 29.(16分)相对分子质量为92的某芳香烃X 是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产、合成路线、反应条件略去)。
其中A 是一氯代物,H 是一种功能高分子,链节组成为C 7H 5NO 。
高三第二学期理科综合(化学)能力测试

高三第二学期理科综合〔化学〕水平测试〔附答案〕可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32Cl:35.5 K:39 Fe:56 Cu:64 Zn:65 Br:80 Ag:108 I:127 Ba:1375.将以下各组括号内的少量杂质除去的操作正确的选项是A.FeCl2溶液(FeCl3):加足量的铁粉,振荡、过滤B.乙醇(水):加浓H2SO4蒸馏C.O2〔H2、H2O〕:通过浓硫酸洗气,再通过灼热的CuO 粉末D.氢氧化铁胶体(氯化钠溶液):过滤6.以下实验能到达测量要求的是A.用托盘天平称取35.20g NaClB.用10mL量筒量取8.50mL盐酸C.用25ml滴定管量取15.80ml溶液D.用pH试纸测得溶液pH值为4.27. 在N2+ 3H22NH3的体系中,保持容器中压强和温度不变,充入氩气,那么以下表达正确的选项是A.由于压强不变,所以平衡不移动B.由于体积增大,所以N2、H2、NH3的浓度均减小,正逆反响速率均减小,平衡不移动C.由于体积增大,相当于减小压强,平衡向体积增大的方向移动,即平衡向逆反响方向移动D.由于参加氩气不参与反响,因此正逆反响速率均不变,平衡不移动8.以下反响的离子方程式,书写正确的选项是A.用铂电极电解CuSO4溶液:Cu2++2H2O Cu+O2↑+4H+电解B.明矾溶液中参加过量氨水:Al3++4NH3·H2O AlO2-+4NH4++2H2OC.碳酸氢钙溶液中参加少量NaOH溶液:Ca2++2HCO3-+2OH CaCO3↓+CO32-+2H2OD.乙酸溶液中参加碳酸氢铵:CH3COOH + HCO3CH3COO-+CO2↑+H2O9.A、B、C、D、E五种短周期元素.A、B、C位于同一周期相邻位置,A和C的原子序数之比为3∶4,A、B、C分别与D形成的化合物分子中都含有10个电子.E的原子结构示意图中从内到外各层的电子数之比为1∶4∶1.那么以下表达中正确的选项是A.A和C形成的某种化合物能与E的单质在一定条件下发生置换反响B.实验室制备B、D两种元素形成的化合物发生的反响属于氧化复原反响C.由A、C原子和B、D原子分别构成的分子都是..极性分子D.由A、B、C、D四种元素组成的化合物中不可能含有离子键10.以下说法可以实现的是:①酸性氧化物均能与碱发生反响;②盐溶液与弱酸反响可以生成强酸;③发生复分解反响,但产物既没有水生成,也没有沉淀和气体生成;④两种酸溶液充分反响后,所得溶液呈中性;⑤有单质参加反响,但该反响不是氧化复原反响A.②③④⑤B.①③④⑤C.①②③⑤D.①②③④⑤11.以下4组溶液,不用试剂也能鉴别开来的是①AgNO3溶液、稀氨水②NaAlO2溶液和盐酸③NaHCO3、NaHSO4、Ba(NO3)2、NH4Cl ④NaNO3、FeCl3、NaCl、AgNO3A.只有①B.①②C.①②③D.全部12.由氧化铜和氧化铁的混合物ag,参加2mol·L-1的硫酸溶液50mL,恰好完全溶解,假设将a g的该混合物在H2中加热充分反响,冷却后剩余固体质量为A.1.6a gB.〔a-1.6〕gC.(a-3.2) gD.无法计算第二卷〔非选择题共180分〕25.此题包括两小题〔共22分〕І.05年8月20日辽宁沈阳某化工厂装有24吨有机液化气原料槽车发生泄漏,该液化气在空气中远超过爆炸极限,十分危急,经消防人员屡次努力终于排除险情.该液化气含碳85.7﹪,含氢14.3﹪,该气体是相同条件下氢气密度的21倍,可使溴水褪色.⑴该气体的结构简式为:__________ ___, 名称为:__________________.(2)分别写出该液化气通入溴水及发生燃烧的化学方程式:____________________________________ ,________________________________ ___.Ⅱ.A、B、C、D、E、F、G、H均为含有苯环的有机物.B与FeCl3溶液混合没有颜色变化,F、H除苯环外还有一个含氧的六元环〔与苯环共用2个碳原子〕.它们之间的转化关系如下:〔1〕化合物A含有的官能团是.〔2〕B、F的结构简式分别为、.〔3〕物质D不可能具有的性质是〔填写字母〕.A.使溴水褪色B.使酸性KMnO4溶液褪色C.能与Na2CO3溶液反响D.能发生酯化反响E.能与新制的Cu(OH)2反响F.能使FeCl3溶液变色〔4〕反响⑤的反响类型是.〔5〕写出反响①的化学方程式:.〔6〕写出同时符合以下两项要求的C的两种同分异构体的结构简式①化合物是1,3,5—三取代苯②苯环上的三个取代基中必须含有醇羟基、酚羟基和醛基这三种结构.26.此题包括两小题〔共14分〕І.配平氧化复原反响方程式,答复以下问题.〔1〕NH3 + NO2 →_ N2 + H2O〔2〕氧化产物与复原产物的质量比为.Ⅱ.一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如以下框图所示.其中A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝.试答复以下问题:〔1〕写出以下物质化学式:A:_________________;C:_________________;〔2〕写出E的电子式_____________;F的结构式__________________.〔3〕写出以下反响的离子方程式:①由B生成C:________________________________________________________②A和新制氯水:___________________________________________________.27.此题包括两小题〔共18分〕І.以下有关化学实验的操作或说法中,正确的选项是(填字母代号) .A.实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂B.用pH试纸测定某无色溶液的pH时,用枯燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,再跟标准比色卡比拟C.检验红砖中的氧化铁成分时,向红砖粉末中参加盐酸,放置至充分沉淀后,取上层清液于试管中,滴加KSCN溶液2滴~3滴即可D.制备硫酸亚铁晶体时,向稀硫酸中参加废铁屑至有少量气泡生成时,过滤,然后加热蒸发滤液即可得硫酸亚铁晶体E.在收集氨气的试管口塞一团蘸有稀硫酸的棉花,预防污染空气Ⅱ.“化学多米诺实验〞即利用反响中产生的压力和虹吸作用原理,使假设干化学实验依次发生,整个过程只需要限制第一个反响,就好似多米诺骨牌游戏一样.以下图就是一个“化学多米诺实验〞.:Cu2++4NH3·H2O=[Cu〔NH3〕4]2++4H2O〔该反响产物可作为H2O2分解的催化剂.〕请答复以下问题:〔1〕进行实验前必须进行的操作是;〔2〕B与D两容器中反响速率比拟:B D〔填“>〞、“<〞或“=〞〕,原因是;〔3〕H中的现象是;〔4〕I的作用是〔用离子方程式表示〕;〔5〕A和B之间导管a的作用是;〔6〕在该实验中不涉及的反响类型是〔填编号〕.①分解反响②化合反响③置换反响④复分解反响28.〔6分〕为了确定某水合含+2价铁离子盐的化学式,某同学进行了以下实验:〔1〕将0.784g该盐增强热至质量恒定,得到0.160gFe2O3〔2〕将0.784g该盐溶于水,参加过量的BaCl2溶液,得到0.932gBaSO4〔3〕将0.392g该盐溶于水,参加过量的NaOH溶液后煮沸,释放出的氨气用50.0mL0.10mol·L-1盐酸吸收后,多余的盐酸用30.0mL 0.10mol·L-1NaOH溶液恰好中和.根据以上事实,求该盐的化学式.参考答案Ⅰ卷化学:5.A 6.C 7.C 8.D 9.A 10.D 11.D 12.BⅡ卷25.此题包括两小题〔共22分〕І.〔6分〕⑴该气体的结构简式为:CH2=CHCH3名称为:丙烯、〔2分〕(2)CH2=CHCH3+Br2→CH2Br-CHBrCH3〔2分〕2CH2=CHCH3+9O2→6CO2+6H2O 〔2分〕Ⅱ.〔16分〕〔1〕—CHO、—Br〔2分〕〔2分〕〔2分〕〔3〕F〔1分〕〔4〕消去反响〔1分〕〔2分〕(6) 〔2分〕26.此题包括两小题〔共14分〕І.〔1〕8 NH3 + 6 NO2 = 7N2 + 12 H2O〔2〕氧化产物与复原产物的质量比为4:3 .Ⅱ.〔共10分〕〔1〕〔NH4〕2SO3〔1分〕BaSO4〔1分〕〔2〕〔2分〕〔2分〕〔3〕Ba2++ SO42—= BaSO4↓〔2分〕SO32—+Cl2+H2O = SO42—+2H++2Cl—〔2分〕27.此题包括两小题〔共18分〕І. BCE〔6分〕.Ⅱ.〔前两个空每空1分,后每个2分,共12分〕〔1〕检查装置的气密性〔2〕< D中Zn与CuSO4发生反响覆盖在Zn外表形成原电池,从而使反响速率加快〔3〕有气泡并有乳白色〔浅黄色〕浑浊〔4〕H2S+2OH-=S2-+2H2O〔5〕平衡烧瓶〔B 〕和漏斗〔A 〕的气压,使液体易于流下〔6〕②28.〔6分〕解:,002.056)160.0160112()(2mol mol g g gg Fe n =⋅÷⨯=+ ,004.0233932.0)(124mol mol g g SO n =⋅=-- ,004.0392.0784.010.010)0.300.50()(134mol g L mol L ml ml NH n =⨯⋅⨯⨯-=--+ 1111218004.018004.096002.056784.0)(----⋅⨯⋅-⨯⋅-⨯⋅-=mol g mol mol g mol mol g mol mol g g O H n =.012.0mol6:2:1:2)(:)(:)(:)(22424=-++O H n SO n Fe n NH n故该盐的化学式为:(NH 4)2Fe(SO 4)2·6H 2O。
高考化学复习高考非选择题专项练:物质结构综合题A(17页,含解析).docx

高中化学学习材料温馨提示:此套题为Word版,请按住Ctrl,滑动鼠标滚轴,调节合适的观看比例,答案解析附后。
关闭Word文档返回原板块。
高考非选择题专项练(一)物质结构综合题A【题型特点】物质结构综合题是安徽高考必考的热点试题,能力层面以物质的组成、结构和性质为主考查学生根据已有知识及题目所给的事实和条件,归纳相关信息,对化学问题进行逻辑推理和论证,从而得出正确结论的能力,知识层面考查元素在周期表的位置、电子排布式、化学键、物质的性质(如电负性、第一电离能、金属性、非金属性、熔沸点)等。
物质结构综合题的解答:(1)认真审题,充分利用题目所给信息,不遗漏信息如原子序数递增、前4周期等,准确推出各元素(平时要善于归纳元素的性质、结构等知识)。
(2)答题:根据题目要求结合元素周期表、元素周期律规范答题,如元素的位置可根据电子层数=周期序数,最外层电子数=主族序数解答,电负性或第一电离能的大小或金属性强弱等可根据元素周期律回答。
1.X、Y、Z、W是元素周期表中前四周期原子序数依次增大的四种元素,其相关信息如下表:(1)W位于元素周期表第周期族,其基态原子核外有个未成对电子。
(2)与Z同周期且依次相邻的两种元素的原子与Z比较,三者第一电离能的大小顺序为[用I1(元素符号)表示];Y的氢化物在同族的氢化物中沸点反常,其原因是。
(3)写出W的单质在潮湿的空气中生成绿色锈斑的化学方程式,并标出电子转移的方向和数目: 。
(4)在X、Y与氢三种元素组成的多种分子中,有些分子的核磁共振氢谱显示有三种氢,且数目比为1∶2∶3,写出其中一种分子的名称: 。
X、Y可以形成多种弱酸根离子,写出其中一种离子水解的离子方程式:。
【解析】由题中所给信息可以推出X为碳元素,Y为氧元素,Z为镁元素,W为铜元素。
(2)与Z同周期且依次相邻的两种元素分别为Na和Al,同周期元素第一电离能从左到右有增大的趋势,但当外围电子在能量相等的轨道上形成全空、半满或全满结构时,原子的能量较低,元素的第一电离能较大,故I1(Mg)>I1(Al)>I1(Na)。
2020高考化学非选择题专项训练(含答案)

一必做题1.(2019·惠州模拟)由含碘废水制取碘酸钾的一种工艺如下:(1)写出KIO3在日常生活中的一个重要应用_________________________________________________________________。
(2)检验“含碘废水”中是否含有单质I2的常用试剂是________(填试剂名称)。
(3)通入SO2的目的是将I2还原为I-,该反应的离子方程式为_____________________________________________________。
(4)工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制________”。
(5)“制KI(aq)”时,该温度下水的离子积为K w=1.0×10-13,K sp[Fe(OH)2]=9.0×10-15。
为避免0.9 mol·L-1FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于________。
(6)“制KIO3溶液”反应的离子方程式为______________ _____________________________________________________。
(7)KCl、KIO3的溶解度曲线如图所示。
流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为_______________________________________________________________________。
解析(1)KIO3是日常生活中食用加碘盐的主要添加剂,可以预防碘缺乏病。
(2)因淀粉遇碘变蓝,因此检验“含碘废水”中是否含有单质I2,常用的试剂是淀粉溶液。
(3)通入SO2的目的是将I2还原为I-,二氧化硫被氧化生成硫酸,反应的离子方程式为SO2+I2+2H2O===SO2-4+2I-+4H+(或2SO2+I2+2Cu2++4H2O===2CuI↓+2SO2-4+8H+)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学大题专项训练一、基本理论综合类试题(一)热化学、化学反应速率与化学平衡相结合的基本理论综合题1、乙醇是重要有机化工原料,可由乙烯气相直接水合法或间接水合法生产。
回答下列问题:(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C 2H 5OSO 3H),再水解生成乙醇。
写出相应反应的化学方程式____________________________________。
(2)已知:甲醇脱水反应 2CH 3OH(g)=CH 3OCH 3(g)+H 2O(g) △H 1= -23.9kJ/mol 甲醇制烯烃反应2CH 3OH(g)=C 2H 4(g)+2H 2O(g) △H 2= -29.1kJ/mol 乙醇异构化反应 C 2H 5OH(g)=CH 3OCH 3(g) △H 2= +50.7kJ/mol 则乙烯气相直接水合反应C 2H 4(g)+H 2O(g)= C 2H 5OH(g)的△H=_____kJ/mol 。
与间接水合法相比,气相直接水合法的优点是___________。
(3)如图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n O H 2:n 42H C =1:1)①列式计算乙烯水合制乙醇反应在图中A 点的平衡常数Kp=____ __ _(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②图中压强(p 1、p 2、p 3、p 4)的大小关系为__________,理由是_____________。
③气相直接水合法常采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度为290℃、压强为6.9Mpa ,n O H 2:n 42H C =0.6:1。
乙烯的转化率为5%,若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有___________、___________。
2、化合物AX 3和单质X 2在一定条件下反应可生成化合物AX 5。
回答下列问题: (1)已知AX 3的熔点和沸点分别为-93.6 ℃和76 ℃,AX 5的熔点为167 ℃。
室温时AX 3与气体X 2反应生成lmol AX 5,放出热量123.8 kJ 。
该反应的热化学方程式为 。
(2)反应AX 3(g)+X 2(g)AX 5(g)在容积为10 L 的密闭容器中进行。
起始时AX 3和X 2均为0.2 mol 。
反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
①列式计算实验a 从反应开始至达到平衡时的反应 速率 v(AX 5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX 5)由大到小的次序为 (填实验序号);与实验a 相比,其他两组改变的实验条件及判断依据是:b 、c 。
③用p 0表示开始时总压强,p 表示平衡时总压强,α表示AX 3的平衡转化率,则α的表达式为 ;实验a 和c 的平衡转化率:αa 为 、αc 为 。
3、在容积为1.00L 的容器中,通入一定量的N 2O 4,发生反应N 2O 4(g)2NO 2(g),随温度升高,混合气体的颜色变深。
回答下列问题:(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。
在0~60s 时段,反应速率v(N 2O 4)为 mol·L -1·s -1反应的平衡常数K 1为 。
(2)100℃时达到平衡后,改变反应温度为T ,c(N 2O 4)以0.0020 mol·L -1·s -1的平均速率降低,经10s 又达到平衡。
a:T 100℃(填“大于”“小于”),判断理由是 。
b:列式计算温度T 是反应的平衡常数K 2(3)温度T 时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
(二)氧化还原反应与电化学相结合的基本理论综合题1、次磷酸(H 3PO 2)是一种精细磷化工产品,具有较强的还原性。
回答下列问题: (1)H 3PO 2是一元中强酸。
写出其电离方程式______________。
(2)H 3PO 2及NaH 2PO 2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H 3PO 2中,P 元素的化合价为_____。
②利用H 3PO 2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为_______(填化学式)。
③NaH2PO2为______(填“正盐”或“酸式盐”),其溶液显______(填“弱酸性”、“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。
写出白磷与Ba(OH)2溶液反应的化学方程式-_______________________。
(4)H3PO2也可用电渗法制备,“四室电渗法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)①写出阳极的电极反应式________________。
②分析产品室可得到H3PO2的原因是_____________________。
③早期采用“三室电渗法”制备H3PO2:将“四室电渗法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室和产品室。
其缺点是产品混有______杂质,该杂质产生的原因是_______。
2、二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。
由合成气(组成为H2、CO 和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:甲醇合成反应:(ⅰ)CO(g)+2H2(g)===CH3OH(g)∆H1=-90.1 kJ·mol-1(ⅱ)CO2(g)+3H2(g)===CH3OH(g)+H2O(g)∆H2=-49.0 kJ·mol-1水煤气变换反应:(ⅲ)CO(g)+H2O(g)===CO2(g)+H2(g)∆H3=-41.1 kJ·mol-1二甲醚合成反应:(ⅳ)2CH3OH(g)===CH3OCH3(g)+H2O(g)∆H4=-24.5 kJ·mol-1回答下列问题:(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。
工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是_____________________(以化学方程式表示)。
(2)分析二甲醚合成反应(ⅳ)对于CO转化率的影响_________________。
(3)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为______________________________。
根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响________________________________。
(4)有研究者在催化剂(含Cu-Zn-Al-O和Al2O3)、压强为5.0 MPa的条件下,由H2和CO直接制备二甲醚,结果如图所示。
其中CO转化率随温度升高而降低的原因是______________________。
3、铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeCl x的化学式,可利用离子交换和滴定的方法。
实验中称取0.54g的FeCl x样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。
交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。
计算该样品中氯的物质的量,并求出FeCl x 中x的值:(列出计算过程)(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.1,则该样品中FeCl3的物质的量分数为。
在实验室中,FeCl2可用铁粉和反应制备,FeCl3可用铁粉和反应制备;(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。
FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为,该电池总反应的离子方程式为。
(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kW·h·kg-1)。
若电解质为酸性,二甲醚直接燃料电池的负极反应为________________________,一个二甲醚分子经过电化学氧化,可以产生______个电子的电量;该电池的理论输出电压为 1.20 V,能量密度E=______________________(列式计算。
能量密度=电池输出电能/燃料质量,1 kW·h =3.6×106 J)。
二、元素及其化合物性质与化工流程图类试题1、锂离子电池的应用很广,其正极材料可再生利用。
某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。
充电时,该锂离子电池负极发生的反应为6C+x Li++x e-===Li x C6。
现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
回答下列问题:(1)LiCoO2中,Co元素的化合价为______。
(2)写出“正极碱浸”中发生反应的离子方程式__________________________。
(3)“酸浸”一般在80 ℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式______________________________________;可用盐酸代替H2SO4和H2O2的混合液,但缺点是____________________。
(4)写出“沉钴”过程中发生反应的化学方程式__________________________。
(5)充放电过程中,发生LiCoO2与Li1-x CoO2之间的转化,写出放电时电池反应方程式____________________________。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是_________________。
在整个回收工艺中,可回收到的金属化合物有____________________(填化学式)。
2、难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:K2SO4·MgSO4·2CaSO4·2H2O(s)2Ca2+ + 2K+ + Mg2+ + 4SO42— + 2H2O 为能充分利用钾资源,用饱和Ca(OH) 2溶液浸杂卤石制备硫酸钾,工艺流程如下:Ca(OH)2溶液滤渣母液杂卤石过滤(1)滤渣的主要成分有和以及未溶杂卤石。
