雷迪帕韦杂质
标准品在医药行业中的重要性-利托那韦系列杂质整理
10mg-25mg-50mg-100mg
更多规格请详询
分析验证以及一致性评价
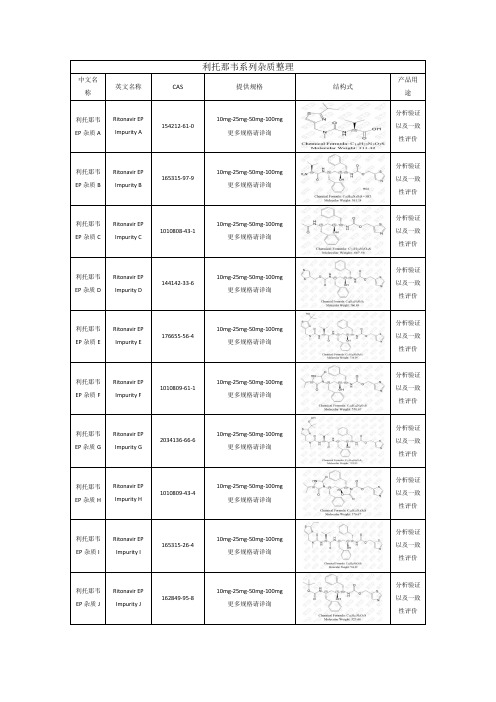
利托那韦EP杂质G
Ritonavir EP Impurity G
2034136-66-6
10mg-25mg-50mg-100mg
更多规格请详询
分析验证以及一致性评价
利托那韦EP杂质H
Ritonavir EP Impurity H
利托那韦系列杂质整理
中文名称
英文名称
CAS
提供规格
结构式
产品用途
利托那韦EP杂质A
Ritonavir EP Impurity A
154212-61-0
10mg-25mg-50mg-100mg
更多பைடு நூலகம்格请详询
分析验证以及一致性评价
利托那韦EP杂质B
Ritonavir EP Impurity B
165315-97-9
256328-82-2
10mg-25mg-50mg-100mg
更多规格请详询
分析验证以及一致性评价
更多利托那韦杂质请详细咨询......
专业提供各种杂质对照品:奥司他韦杂质,克拉维酸钾杂质,利伐沙班杂质,沙库巴曲杂质,帕瑞昔布杂质,拉米地坦杂质等等,并随货提供COA,核磁,质谱,液相等相关图谱。为药物研发单位的第一助手,为其提供专业杂质对照品解决方案。
1010809-43-4
10mg-25mg-50mg-100mg
更多规格请详询
分析验证以及一致性评价
利托那韦EP杂质I
Ritonavir EP Impurity I
165315-26-4
10mg-25mg-50mg-100mg
帕利哌酮相关杂质
0
10mg-25mg-50mg-100mg
>99%
OH
丁丁kfl
0
帕利哌酮杂质10(帕利哌酮USP
RC D)
Paliperidone Impurity 10 (Paliperidon e USP RC D)
761460-08
6
10mg-25mg-50mg-100mg
>99%
CfY■■
1
10mg-25mg-50mg-100mg
>99%
1
口
人:
帕利哌酮杂质40
Paliperidone Impurity 40
152542-03
5
10mg-25mg-50mg-100mg
>99%
7
0
相关杂质整理列表
中文名
英文名
CAS号
规格
纯度
结构式
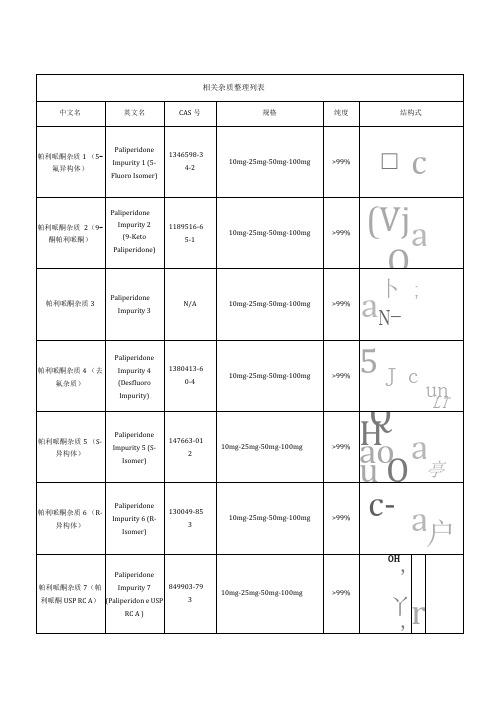
帕利哌酮杂质1(5-氟异构体)
Paliperidone Impurity1 (5-Fluoro Isomer)
1346598-3
4-2
10mg-25mg-50mg-100mg
>99%
□
c
帕利哌酮杂质2(9-酮帕利y 2
>99%
如
HCI
八〜
J/
p
A一
帕利哌酮杂质24
Paliperidone Impurity 24
N/A
10mg-25mg-50mg-100mg
>99%
Hr
:i
J
帕利哌酮杂质25
Paliperidone Impurity 25
N/A
10mg-25mg-50mg-100mg
药物雷迪帕韦(Ledipasvir)合成检索总结报告

药物雷迪帕韦(Ledipasvir)合成检索总结报告
一、雷迪帕韦(Ledipasvir)简介
雷迪帕韦(Ledipasvir)于2014年10月10日在美国上市。
雷迪帕韦(Ledipasvir)是一种病毒复制所需的HCV NS5A蛋白酶抑制剂,适应于基因1型慢性丙肝感染。
雷迪帕韦(Ledipasvir)不良反应:疲乏和头痛。
雷迪帕韦(Ledipasvir)分子结构式如下:
英文名称:Ledipasvir
中文名称:雷迪帕韦
本文主要对雷迪帕韦(Ledipasvir)的合成路线、关键中间体的合成方法及实验操作方法进行了文献检索并作出了总结。
二、雷迪帕韦(Ledipasvir)合成路线一
三、雷迪帕韦(Ledipasvir)合成路线二
四、雷迪帕韦(Ledipasvir)合成路线一检索总结报告(一) 雷迪帕韦(Ledipasvir)中间体2的合成(路线一)
(二) 雷迪帕韦(Ledipasvir )中间体3的合成(路线一)。
巴瑞替尼 杂质谱

巴瑞替尼杂质谱
巴瑞替尼是一种JAK抑制剂,主要用于治疗类风湿性关节炎、严重斑、中重度特应性皮炎以及成人COVID-19重症患者。
其作用机制是通过可逆的选择性抑制JAK1和JAK2。
巴瑞替尼的杂质谱可能包括以下内容:
1. 杂质11:这是北京康派森医药科技有限公司生产的巴瑞克替尼的一种杂质。
该公司专门提供巴瑞克替尼杂质11的定制合成、制备分离、未知杂质鉴定、已知杂质标化等服务。
2. 其他杂质:巴瑞替尼的生产过程中可能产生其他杂质,包括合成过程中的副产物、未反应完全的起始物料、催化剂、溶剂、降解产物等。
为了确保巴瑞替尼的质量和安全性,需要对其进行严格的纯度和杂质分析。
这通常包括以下步骤:
1. 定性分析:使用高效液相色谱法(HPLC)、质谱(MS)、核磁共振(NMR)等技术确定巴瑞替尼及其杂质的化学结构。
2. 定量分析:通过HPLC、紫外可见光谱(UV)等方法测定巴瑞替尼及其杂质的含量。
3. 杂质控制:根据相关法规和指导原则,设定巴瑞替
尼及其杂质的限量标准,以确保药品的质量和安全性。
4. 稳定性研究:评估巴瑞替尼在储存和运输过程中的稳定性,以确定其保质期和储存条件。
以上信息是基于您提供的参考信息和我对巴瑞替尼及其杂质的了解。
如果您需要更详细的信息,建议您咨询专业的药学或分析化学专家。
头孢菌素类仿制药的杂质谱研究共3篇

头孢菌素类仿制药的杂质谱研究共3篇头孢菌素类仿制药的杂质谱研究1头孢菌素类仿制药的杂质谱研究随着国内外药品市场的竞争日益激烈,仿制药的研发和生产已逐渐成为一种重要的药品开发途径。
头孢菌素类仿制药作为一种广泛使用的抗生素,在临床上应用广泛。
然而,在生产过程中可能会产生一些不纯的杂质,这些杂质可能对药物质量和药效产生影响。
因此,对头孢菌素类仿制药的杂质进行研究是非常重要的。
本文结合国内外相关研究,对头孢菌素类仿制药的杂质谱进行研究。
一、头孢菌素类仿制药的杂质头孢菌素类抗生素是一种广泛使用的药物类别,包括头孢菌素、头孢克洛、头孢唑林、头孢西丁等。
这些药物的结构特点为:它们的化学结构中含有3,4-二氧代呋咱环(β内酰胺环),又称为头孢菌素核心结构,具有较广的抗菌谱,对革兰阳性菌和革兰阴性菌均有一定的杀菌作用。
在头孢菌素类抗生素的生产中,可能会产生一些杂质。
常见的杂质有:对羟基苯甲酸酯、苯甲酸、脲酸、头孢西丁胺、3-acetylthioacetone、亚硝基头孢菌素、头孢菌素-S等。
其中,对羟基苯甲酸酯是一种比较常见的持久性有机污染物,因此在头孢菌素类仿制药中受到广泛关注。
二、头孢菌素类仿制药的杂质谱杂质谱对药物质量的控制有着非常重要的作用。
通过对药物中杂质的检测和分析,可以大大提高药品的质量和药效。
在头孢菌素类仿制药的杂质谱中,常用的检测技术包括高效液相色谱(HPLC)、毛细管电泳和质谱分析等。
其中,HPLC检测技术是最为常用的一种,它可以检测出头孢菌素类药物中的多种杂质,如对羟基苯甲酸酯、头孢西丁胺等。
同时,在HPLC检测中,还可以采用紫外检测器和荧光检测器等不同的检测方法。
另外,质谱分析技术也是一种非常有效的检测手段。
通过质谱分析技术,可以准确地分析出药物中的各种杂质,如3-acetylthioacetone、亚硝基头孢菌素等。
常用的质谱技术包括高分辨质谱(HRMS)、电喷雾质谱(ESI-MS)和飞行时间质谱(TOF-MS)等。
雷迪帕韦的合成及其主要中间体的研究进展

雷迪帕韦的合成及其主要中间体的研究进展摘要:雷迪帕韦(Ledipasvir),前身为GS-5885,是由吉利德科学公司开发的一种NS5A蛋白酶抑制剂[1]。
雷迪替韦完成III期临床试验后,用于治疗基因型1丙型肝炎的雷迪帕韦/索非布韦的固定剂量组合的片剂,于2014年2月10日被美国药典收录。
2014年10月10日组合产品雷迪替韦/索非布韦获得美国FDA批准,商品名Harvoni[2]。
雷迪帕韦通过对NS5A 蛋白的抑制作用,从而阻断了病毒RNA的复制[3]。
雷迪替韦拥有六个手性中心,其中处于桥杂环化合物1,3,4位与螺杂环6位上,这将是其合成工作中的重点。本文通过参考大量文献综述了雷迪替韦的合成研究进展及其最新的合成路线,并对其关键步骤——主要的中间体做出了深入的研究。关键词:雷迪帕韦(Ledipasvir),NS5A抑制剂,丙肝,手性,中间体,制备。
1.简介:丙型病毒性肝炎,简称为丙肝,是一种由丙型肝炎病毒(HCV)感染引起的病毒性肝炎,主要经输血、针刺、吸毒等传播。
丙肝的的潜伏期往往是1.5-2个月,经过一段的潜伏期之后,便出现肝炎的常见症状有疲乏、身体无力、食欲减退、部分出现黄疸等症状。
丙肝患者右下腹部感觉不舒服,恶心呕吐,食欲减退。
丙型肝炎发病机理仍未十分清楚,当HCV在肝细胞内复制引起肝细胞结构和功能改变或干扰肝细胞蛋白合成,可造成肝细胞变性坏死,表明HCV直接损害肝脏,导致发病起一定作用。
但多数学者认为细胞免疫病理反应可能起重要作用,发现丙型肝炎与乙型肝炎一样,其组织浸润细胞以CD3+为主,细胞毒T细胞(TC)特异攻击HCV感染的靶细胞,可引起肝细胞损伤。
[4]雷迪帕韦(Ledipasvir),化学名称:GS-5885,英文化学名: Methyl N-[(2S)-1-[(6S)-6-[5-[9,9-Difluoro-7-[2-[(1S,2S,4R)-3-[(2S)-2-(methoxyc arbonylamino)-3-methylbutanoyl]-3-azabicyclo[2.2.1]heptan-2-yl]-3H-benzimidazol -5-yl]fluoren-2-yl]-1H-imidazol-2-yl]-5-azaspiro[2.4]heptan-5-yl]-3-methyl-1-ox obutan-2-yl]carbamate,CAS NO.:1256388-51-8,分子式C49H54F2N8O6,分子量为:889.00,其商品名为:Harvoni (与索非布韦组合)。
一种帕拉米韦杂质B及其制备方法和用途[发明专利]
![一种帕拉米韦杂质B及其制备方法和用途[发明专利]](https://img.taocdn.com/s3/m/47921d02551810a6f4248681.png)
专利名称:一种帕拉米韦杂质B及其制备方法和用途专利类型:发明专利
发明人:王志国,苏明明,王艳锤,董东英,丘忠丽
申请号:CN202011098109.5
申请日:20201014
公开号:CN112279788A
公开日:
20210129
专利内容由知识产权出版社提供
摘要:本发明提供了一种帕拉米韦杂质B及其制备方法和用途,其结构式如(I)所示:帕拉米韦杂质B的制备方法,包括如下步骤:A、帕拉米韦在碱性溶剂条件下反应,所述帕拉米韦与碱性溶剂的重量比为1:10~50,反应温度为10℃至100℃、时间为3h至5h,得到反应液;B、上述反应液用酸调pH =5‑6,减压浓缩后得到帕拉米韦杂质B。
本发明通过对帕拉米韦杂质的研究,本发明获得了一种全新的帕拉米韦的杂质B,通过对其进行质谱测定,其相应分子量为329.40,纯度达到95.0%以上,可作为杂质研究的对照品用于帕拉米韦含量测定,可有效保障帕拉米韦的用药安全。
申请人:天津应天成科技有限公司
地址:300000 天津市滨海新区经济技术开发区洞庭路220号天津国际生物医药联合研究院实验楼N1801-5
国籍:CN
代理机构:北京集智东方知识产权代理有限公司
代理人:吴倩
更多信息请下载全文后查看。
药物中的杂质分析-杂质的来源和分类

---------------------------------------------------------------最新资料推荐------------------------------------------------------ 药物中的杂质分析-杂质的来源和分类药物中的杂质分析- - 杂质的来源和分类为了保证 APIs 及制剂的质量,必须在工艺开发、优化和工艺转化中必须仔细监控杂质。
法规和国际指导原则更加关注原料药中杂质的分离、鉴定和控制。
在本文的第一节,作者以具体实例列举了不同类型杂质和不同来源杂质的情况。
Definitionand sources of impurities 杂质的定义和来源不纯物可定义为目标成分与外来物的混合物或本身劣质的物质。
往往是最终的制备工艺对原料药的成本具有重大影响。
产量、物理特性、化学纯度是 API 生产、制剂处方、制剂生产中需要重点考虑的地方。
作为新药申请的一部分,申请人必须向 FDA 提交原料药和制剂的生产和过程控制。
如果生产批次不符合纯度和杂质质量标准要求,制造商必须进行返工,这不但会消耗原料药和其他资源,还会耽误其他批次原料药的生产,代价很高。
杂质的来源和类型可以通过原料药的生产工艺流程图来进行分析。
杂质的形成与生产工艺的每个阶段相互关联,如图 1 所示。
简而言之,任何影响原料药或成品纯度的物质都被可认为是杂质。
1/ 11杂质有各种来源,通常包括:起始原料(S)、中间体,倒数第二步中间体、副产物、转化产品、相互作用产物,有关物质、降解产物和互变异构体。
Startingmaterial(s) 起始物料图图 1 1 :s APIs 和成品杂质形成路径的示意图监管机构一直期望对用于生产 APIs 的起始物料中的杂质进行控制(1)。
API的起始物料可以是原料、中间体、或用于生产 API 及作为 API 重要结构部分的 API。
API的起始物料通常有确定的化学性质和结构(2)。
帕拉米韦起始物料质量标准

帕拉米韦起始物料质量标准一、外观帕拉米韦起始物料应为白色至浅黄色的结晶性粉末,无可见的杂质或异物。
其外观应无肉眼可见的变化。
二、化学结构帕拉米韦起始物料的化学结构应符合帕拉米韦的标准化学结构,包括所有主要和次要结构元素的存在和相对分子质量。
应使用适当的分析方法进行验证。
三、纯度帕拉米韦起始物料的纯度应符合相关标准。
一般应采用高效液相色谱法(HPLC)或其他适用的分析方法测定其纯度。
纯度应不低于98.0%。
四、杂质含量帕拉米韦起始物料中应不含其他杂质,如有机溶剂、重金属、残留溶剂等。
应采用适当的分析方法进行检测和验证。
五、分子量及分子量分布帕拉米韦起始物料的分子量及分子量分布应符合相关标准。
一般应采用质谱分析(MS)等方法进行检测和验证。
六、溶解度帕拉米韦起始物料的溶解度应符合相关标准。
应采用适当的方法测定其在不同溶剂中的溶解度。
一般情况下,其在0.9%氯化钠溶液或5%葡萄糖溶液中的溶解度应不低于50mg/mL。
七、稳定性帕拉米韦起始物料在适当的储存条件下应保持稳定。
应定期对其稳定性进行检测,包括加速和长期储存试验等,以确认其稳定性。
八、细菌内毒素帕拉米韦起始物料应不含可检测的细菌内毒素。
应采用细菌内毒素检测方法进行检测和验证。
九、病毒灭活帕拉米韦起始物料应经过适当的病毒灭活程序,以确保在使用过程中不会传播病毒。
应采用适当的病毒灭活方法并进行验证。
十、其他相关参数根据需要,可增加其他相关参数,如颗粒度、吸湿性等,以确保帕拉米韦起始物料的正确使用和效果。
这些参数应通过适当的实验进行检测和验证。
FDA 对杂质的看法

全文:美国FDA对原料药杂质的看法第六图书馆美国FDA原料药杂质医药月刊高注质不详1991第六图书馆品(FEBRUARY,19191)USMEFENAMIACIREFEREN—PCDSTANRDUS反铂标准品(UNE1,PJ19)91CESTANDARDP甲灭酸标准品(USM—ARCH1,1991)USDIPLUTEDINTROGLYCERIR—N我们知道,目前在国内尚未普遍收到第3、第4增补版,我们把内容作简要的介绍,希望同行对有关产品的检测要求引起重视,特别是对一些外销的产品更应及时对EFERENCESTANDARDP稀释硝US酸甘油标准品(JUNE1.1991)USPTRANSpLATINREFERENCE照,采取措施,达到标准。
美国FA对原料药杂质的看法D高注质在过去几年里,美国FDA日益重视原料药中出现的杂质及其鉴定和限量,这是有许会有很大差异。
通常每一合成方法是与特定的杂质有关的,所以对现有生产工艺进行改动或者用不同的生产工艺就必须要有相应的多理由的。
理由之一:杂质的鉴定和定量方法的改进和提高使加紧控制成为可能,大多数企业都能利用色谱方法(特别是高压液相色谱方法)把原料药中的杂质分开,而且,具有高度的准确性、精密性、灵敏性和线性。
此外,FDA特别重视药物的安全性,所以对具有致畸、致癌的杂质更为关注。
不论是合成带来的,还是降解产生的,只有少数方法来控制和检测可能会形成的杂质。
这一要求对新化合物和巳收载的药物是同样适用的。
大家知道,法定方法(别是非专一性的特滴定法)能检测不出在新合成方法中产生可的杂质。
实上,国药典在“注意事项事美总(GeeatcsnrlNoie)中巳提到,在考虑产品的杂质时,不能兼顾到每一合成方法可能几个杂质会造成药物的毒副反应,特别是杂质的浓度为百万分之几时更是如比。
然而,也确有几个记录在案的例子,如地昔帕明盐酸盐(DeirmieHyrc1rd)其中spand0h0ie,有一个杂质是有致畸性和致癌性的。
雷帕霉素质量标准

雷帕霉素是一种广谱抗生素,用于治疗多种感染症状。
为确保药品的质量和安全性,制定严格的质量标准非常重要。
下面将详细介绍雷帕霉素的质量标准。
一、药品标准名称及含义药品标准名称:雷帕霉素(Repa)含义:本标准规定了雷帕霉素的质量要求、检查方法、试验规范、包装、标志及说明书等内容。
二、外观特征雷帕霉素为白色或类白色结晶粉末,无臭味或微有刺激性气味。
在水中溶解度较小,易溶于甲醇或乙醇,不溶于二氯甲烷。
三、质量指标1.鉴别取样品1mg,加入1mL的甲醇,摇匀后过滤,取上清液作为测试溶液。
将测试溶液扫描于紫外光谱仪中,波长范围为200nm~400nm,与对照品进行比较。
符合要求即可。
2.含量测定用高效液相色谱法(HPLC)进行含量测定,以雷帕霉素标准品作为对照品。
样品与对照品在同一条件下进行检测,计算出样品中雷帕霉素的含量。
3.外观与颗粒度使用显微镜对样品进行观察,并通过筛分测试来确定颗粒度指标是否符合要求。
4.溶解度将样品加入到不同的试剂中,并对其进行搅拌和加热,最后观察是否能够完全溶解。
5.纯度用气相色谱法(GC)或者高效液相色谱法(HPLC)等方法进行纯度检测,确保不含有任何杂质。
四、包装及标志1.包装:常规采用铝箔袋或塑料瓶,根据实际需要进行包装。
2.标志:药品必须明确标注药品名称、规格、生产厂家、生产批号、生产日期、保质期等信息。
此外,还需标注“仅供医院使用”等相关内容。
五、说明书药品说明书应详细描述药品的成分、性状、适应症、用法、用量、注意事项、不良反应等内容,并严格遵守国家有关规定。
总之,制定严格的雷帕霉素质量标准对保障患者用药安全至关重要。
药品生产企业应严格遵守相关规定,确保产品的质量和安全性,为广大患者提供更好的医疗服务。
帕拉米韦杂质整理总结文档
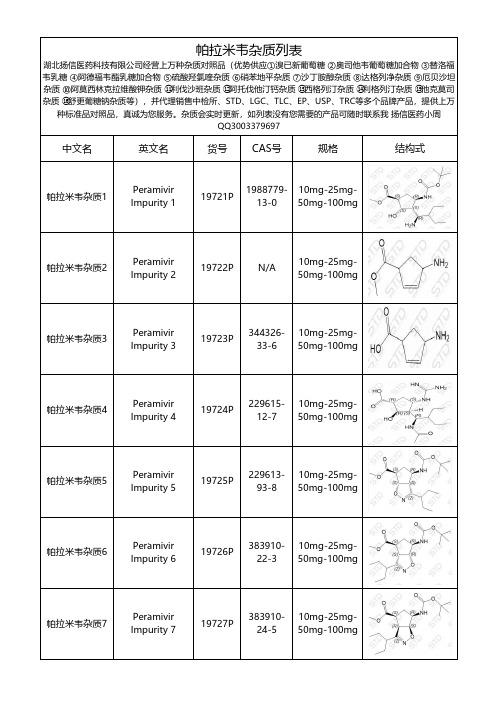
Peramivir Impurity 39
197239P
N/A
10mg-25mg50mg-100mg
帕拉米韦杂质40
Peramivir Impurity 40
197240P
212429637-1
10mg-25mg50mg-100mg
帕拉米韦杂质41
Peramivir Impurity 41
197241P
Peramivir Impurity 2
19722P
N/A
10mg-25mg50mg-100mg
帕拉米韦杂质3
Peramivir Impurity 3
19723P
344326- 10mg-25mg33-6 50mg-100mg
帕拉米韦杂质4
Peramivir Impurity 4
19724P
229615- 10mg-25mg12-7 50mg-100mg
帕拉米韦杂质26
Peramivir Impurity 26
197226P
N/A
10mg-25mg50mg-100mg
帕拉米韦杂质27
Peramivir Impurity 27
197227P
N/A
10mg-25mg50mg-100mg
帕拉米韦杂质28
Peramivir Impurity 28
197228P
Peramivir Impurity 44
197244P
N/A
10mg-25mg50mg-100mg
帕拉米韦杂质45
Peramivir Impurity 45
197245P
N/A
10mg-25mg50mg-100mg
帕拉米韦杂质46
【推荐下载】雷迪帕韦及其关键中间体的合成研究模板范文 (7页)

本文部分内容来自网络,本司不为其真实性负责,如有异议请及时联系,本司将予以删除== 本文为word格式,下载后可编辑修改,推荐下载使用!==雷迪帕韦及其关键中间体的合成研究摘要乙醛酸甲酯与R(+)-α-甲基苄胺缩合、与环戊二烯通过aza-DielsCAlder 反应,产物经氢化、上Boc保护、水解、缩合得到苯并咪唑衍生物,继续与联硼酸频哪醇酯反应得到雷迪帕韦关键中间体:(1R,3S,4S)-3-[6-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)-1H-苯并咪唑-2-基]-2-氮杂双环[2.2.1]庚烷-2-羧酸叔丁酯,总收率40.6%(以乙醛酸甲酯计),关键中间体经过三步反应得到雷迪帕韦丙酮合物,纯度99.7%,ee值达100%。
关键词雷迪帕韦丙型肝炎治疗药物关键中间体合成中图分类号:TQ463.55;R978.7 文献标识码:A 文章编号:1006-1533(201X)09-0065-06An improved synthesis of ledipasvir and its key intermediateZHAO Yuqiu*,SUN Guangxiang(Changzhou Pharmaceutical factory,Changzhou pharmaceutical company,Shanghai Pharmaceuticals Holding Co. Ltd,Changzhou 213018,China)ABSTRACT After the condensation of methyl aldehyde and D(+)-alpha-methylbenzylamine,followed by an aza-DielsAlder reaction with cyclopentadiene,a benzimidazole derivative compound was prepared via hydrogenation,Boc protection,hydrolysis and condensation,followed by reacting with coupling boric acid ester to obtain the key intermediate of (1R,3S,4S)-3-[6-(4,4,5,5-Tetra-methyl-1,3,2-dioxaborolan-2-yl)-1H-benzimidazol-2-yl]-2-azabicyclo[2.2.1]heptane-2-carboxylic acid 1,1-dimethylethyl ester. Ledipasvir could be prepared by using this key intermediate via three steps and its HPLC purity and ee value could reach to 99.9% and 100%,respectively.KEY WORDS ledipasvir;anti-hepatitis C drugs;key intermediate;synthesis雷迪帕韦(ledipasvir)化学名:N-[(2S)-1-[(6S)-6-[5-[9,9-二氟-7-[2-[(1S,2S,4R)-3-[(2S)-2-(甲氧基羰基氨基)-3-甲基丁酰基] -3-氮杂双环[2.2.1]-2-庚基] -3H-苯并咪唑-5基] -2-芴基] -1H -2-咪唑基] -5-氮杂螺烷[2.4]-5-庚基] -3-甲基-1-氧代-2-丁基]氨基甲酸甲酯,是由吉利德科学公司开发,与该公司另一抗丙肝重磅产品Sovaldi(通用名:索非布韦)复方组合,商品名:Harvoni(复方索非布韦/雷迪帕韦),美国FDA于201X年10月10日批准其上市,同年11月21日获欧盟上市许可,是一种全口服,一天一次的片剂,用于治疗基因1型的丙型肝炎感染。
雷迪帕韦

Chiral separation N Boc O OEt
Me-THF,H2O,50 ℃ N LiOH Boc O
OH
US 20130324496
中间体的合成及手性拆分
手性拆分分类:
方法一:手性柱色谱拆分
方法二:化学试剂拆分
方法三:微生物酶拆分
中间体的合成及手性拆分
化学试剂拆分:
收率32%
OH LiOH N Boc O 1 OEt Boc 2 N O 3 OH NH2 2-MeTHF N Boc O OH
雷迪帕韦的合成
F Boc N N N H H Br + F O B O H N H N N Boc
F Pd(OAc)2 ,PPh 3,NaHCO3 ,DME/H2 O Boc N N N H H
F
H N
H N N Boc
HCl/dioxane/DCM; H N O O OH HATU,i-Pr2 NEt,DMF
中间体的合成及手性拆分
主要中间体
O H N H OH
(S)-5-氮杂螺环[2.4]庚烷-6-羧酸
2-溴-7-碘芴
I Br
H HO O N H
(1R,3S,4S)-2-氮杂双环[2.2.1] 庚烷-3-羧酸
中间体的合成及手性拆分
(S)-5-氮杂螺环[2.4]庚烷-6-羧酸的合成
合成路线一:
HO O Et 2 Zn,ClCH2 I N Boc n-heptane/DCM,0℃ MeOC N + Boc MeO O N Boc
US 20130324496
中间体的合成及手性拆分
微生物酶拆分:
收率37.95%
Novozym435,ACN,ph7 N Boc O OEt Phosohate buffer,40 ℃ N Boc O OH + N Boc O 4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
品牌产品名产品信息结构式H&D Ledipasvir CAS No.: 1256388-51-8Molecular Formula:
C49H54F2N8O6
Molecular Weight:
889.02
H&D Ledipasvir-13C2,
d6CAS No.: 1256388-51-8 (non-d)Molecular Formula:C49H48F2N8O6D6
Molecular Weight:
897.04
深圳市恒丰万达医药科技有限公司
雷迪帕韦杂质
TEL:0755-******** QQ:2851922762
深圳市恒丰万达医药科技有限公司:
中文名称:雷迪帕韦杂质A 英文名称:Ledipasvir impuritiy 规格:10-100mgA 中文名称:雷迪帕韦杂质B 英文名称:Ledipasvir impuritiy 规格:10-100mgB 中文名称:雷迪帕韦杂质C 英文名称:Ledipasvir impuritiy 规格:10-100mgC 中文名称:雷迪帕韦杂质D 英文名称:Ledipasvir impuritiy 规格:10-100mgD 中文名称:雷迪帕韦杂质E 英文名称:Ledipasvir impuritiy 规格:10-100mgE 中文名称:雷迪帕韦杂质F 英文名称:Ledipasvir impuritiy 规格:10-100mgF 中文名称:雷迪帕韦杂质G 英文名称:Ledipasvir impuritiy 规格:10-100mgG
纯度:大于98%,用途:供实验室用,备注:COA,HPLC,氢谱,质谱。
H&D Ledipasvir-d6
Possible CAS Number: 1256388-51-8 unlabelled
Mol. Formula:
C49H48D6F2N8O6
Mol. Weight:
895.04。
