药品不良反应报告表(2015版空白表)
药品不良反应登记表格模板

新的□严重□一般□医疗卫生机构□生产企业□经营企业□个人□编码
单位名称:部门:电话:报告日期:年月日
患者姓名:
性别:
男□女□
出生日期:
年月日
民族:
体重(㎏)
联系方式:
家庭药品不良反应/事件:有□无□不详□
既往药品不良反应/事件情况:有□无□不详□
不良反应/事件
名称:
不良反应/事件发生时间:
病历号/门诊号
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
商品名称
通用名称(含剂型,监测期内品种用﹡注明)
生产厂家
批号
用法用量
用药起
止时间
用药原因
怀疑
药品
并用
药品
不良反应/事件的结果:治愈□好转□有后遗症□表现:死亡□直接死因:死亡时间:年月日
原患疾病:
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□表现:
国家药品不良反应监测机构:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
报告人职业(医疗机构):医生□药师□护士□报告人职务职称(企业):报告人签名:
国内有无类似不良反应(包括文献报道):有□无□不详□,国外有无类似不良反应(包括文献报道):有□无□不详□
关联性评价
报告人:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
报告单位:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
省级药品不良反应监测机构:肯定□很可能□可能□可能有关□待评价□无法评价□签名:
药品不良反应工作报告表

药品不良反应 / 事件报告表报告类型:新的□严重□一般□首次报告□跟踪报告□报告来源:医疗机构□药品经营企业□药品生产企业□其他□除非得到允许,报告表中的个人信息将予以保密。
严重药品不良反应/事件是指因使用药品引起以下损害情形之一的反应/事件:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或永久的人体伤残或器官功能的损伤;5)导致住院或住院时间延长6)其他有意义的重要医学事件。
如,尽管事件不会立即危及生命或导致死亡和/或需住院,但为了预防出现任一上述所列情况可能需要进行治疗,通常也被认为是严重的。
关联性评价说明:肯定:用药及反应发生时间顺序合理;停药以后反应停止,或迅速减轻或好转;再次使用,反应再现,并可能加重(即激发试验阳性),同时有文献资料佐证,并已排除原患疾病等其他混杂因素影响。
很可能:无重复用药史,余同“肯定”,或虽然有合并用药,但基本可排除合并用药导致反应发生的可能性。
可能:用药与反应发生时间关系密切,同时有文献资料佐证;但引发ADR/ADE的药品不止一种,或原患疾病病情进展因素不能排除。
可能无关:ADR/ADE与用药时间相关性不密切,反应表现与已知该药的ADR/ADE不吻合,原患疾病发展同样可能有类似的临床表现。
待评价:报表内容填写不齐全,等待补充后再评价,或因果关系难以定论,缺乏文献佐证。
无法评价:报表缺项太多,因果关系难以定论,资料又无法补充。
其他说明合并用药:指发生此药品不良反应/事件时患者除怀疑药品外得其他用药情况,其中也包括患者自行购买的药品或中草药等。
报告的处理所有的报告将会录入数据库,专业人员会分析药品和不良反应之间的关系。
我们会考虑风险是否普遍或严重,然后决定我们是否需要采取行动,例如在药品说明书中加入警示信息,更新药品如何安全使用的信息,如,限制使用剂量或在某些特定人群中限制使用。
极少数情况下,我们会把产品撤市,只有当我们认为产品的风险大于效益时。
药品不良反应报告表

药品不良反响 / 事件报告表报告种类:新的□严重□一般□初次报告□追踪报告□报告根源:医疗机构□药品经营公司□药品生产公司□其余□患者姓名性别:男□女□出诞辰期:年代日民族联系方式:体大病历号 / 门诊号 (kg)或年纪家族药品不良反响 / 事件:有□无□不详□既往药品不良反响 / 事件状况:有□无□不详□既往病史:(如高血压、糖尿病、肝肾疾病等)不良反响 / 事件名称:有关重要状况:怀胎□抽烟□喝酒□药物滥用□放射治疗□其余□不良反响 / 事件发生时间:年代日不良反响 / 事件过程描绘(包含症状、体征、临床查验等)及办理状况(可附页):不良反响 / 事件的结果:治愈□好转□未好转□不详□有后遗症□表现:死亡□直接死因:死亡时间:年代日1.停药或减量后,反响 / 事件能否消逝或减少?是□否□不明□未停药或未减量□2.再次使用可疑药品后能否再次出现相同反响/ 事件?是□否□不明□未再使用□通用名称(含剂型,监商品名称生产厂家批号用法用量测期内品种用 *注明)怀疑药品用药起止时间用药原由合并用药报告人:一定□很可能□可能□可能没关□待评论□没法评论□署名:关系性评价报告单位:一定□很可能□可能□可能没关□待评论□没法评论□署名:姓名:报告人信息电子邮件:联系方式:职业:医生□药师□护士□其余□署名:假如不想您的个人信息共享给生产公司,请打√□电话:报告日期:年代日单位名称:联系人:报告单位信息能否已报告给生产公司□使用单位□经营或入口单位□ 备注除非获得同意,报告表中的个人信息将予以保密。
13严重药品不良反响 / 事件是指因使用药品惹起以下伤害情况之一的反响 / 事件: 1)致使死亡;2)危及生命;3)致癌、致畸、致出生缺点;4)致使明显的或永远的人体伤残或器官功能的伤害;5)致使住院或住院时间延伸6)其余存心义的重要医学事件。
如,只管事件不会立刻危及生命或致使死亡和 / 或需住院,但为了预防出现任一上述所列状况可能需要进行治疗,往常也被以为是严重的。
药品不良反应报告表

不良反应的结果:治愈□ 好转□ 有后遗症□
表现: 死亡□ 直接死因□ 死亡时间: 年 月 日
对原患疾病的影响:不明显□ 病程延长□ 病情加重□ 导致后遗症□ 导致死亡□
关联性评价
省级ADR监测机构:肯定□很可能□可能□不大可能□未评价□无法评价□签名:
国家ADR监测中心:肯定□很可能□可能□不大可能□未评价□无法评价□签名:
药品不良反应报告
企业名称:Байду номын сангаас电话: 报告日期: 年 月 日
患者姓名
性别:
男□女□
出生日期: 年 月 日
民族
体重(kg)
国家药品不良反应:
有□无□不详□
病历号/门诊号
工作单位或住址:
电话:
既往药品不良反应情况:有□无□不详□
原患疾病:
不良反应名称:
不良反应发生时间:
年 月 日
不良反应的表现:
(包括临床检验)
商品名
国际非专利名
生产企业
批号
剂型
进货渠道
生产日期
怀疑引起不良反应的药品
并用药品
曾在国内、外发生的不良反应情况(包括报刊杂志报道情况)
国内:
国外:
其它:
报告人单位: 职务: 报告人签名:
药品不良反应/事件报告表

附表1
制表单位:药械科
药品不良反应/事件报告表
新的□严重□一般□
单位:报告日期:年月日
◇不良反应/事件分析:
1. 用药与不良反应/事件的出现有无合理的时间关系?有□无□
2. 反应是否符合该药已知的不良反应类型?是□否□不明□
3. 停药或减量后,不良反应/事件是否消失或减轻?是□否□不明□未停药或未减量□
4. 再次使用可疑药品后是否再次出现同样不良反应/事件?是□否□不明□未再使用□
5. 不良反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?是□否□不明□
◇严重药品不良反应/事件是指有下列情形之一者:
①引起死亡□
②致畸、致残、致出生缺陷□
③对生命有危险并能够导致人体永久的或显著的伤残□
④对器官功能产生永久损伤□
⑤导致住院或住院时间延长□。
药品不良反应表
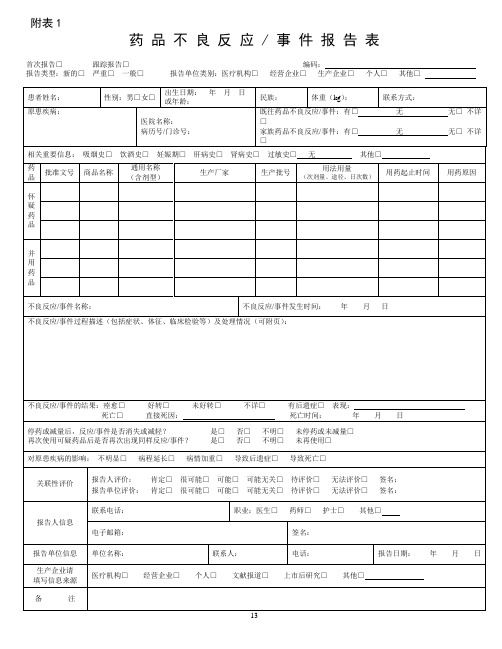
附表1
药品不良反应 / 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
14。
药品不良反应工作报告表

药品不良反应/事件报告表报告类型:新的口严重口一般口首次报告口跟踪报告口报告来源:医疗机构口药品经营企业口药品生产企业口其他口除非得到允许,报告表中的个人信息将予以保密。
严重药品不良反应/事件是指因使用药品引起以下损害情形之一的反应/事件:1)导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或永久的人体伤残或器官功能的损伤;5)导致住院或住院时间延长6)其他有意义的重要医学事件。
如,尽管事件不会立即危及生命或导致死亡和所列情况可能/或需住院,但为了预防出现任一上述需要进行治疗,通常也被认为是严重的。
关联性评价说明:肯定:用药及反应发生时间顺序合理;停药以后反应停止,或迅速减轻或好转;再次使用,反应再现,并可能加重(即激发试验阳性),同时有文献资料佐证,并已排除原患疾病等其他混杂因素影响。
很可能:无重复用药史,余同“肯定” ,或虽然有合并用药,但基本可排除合并用药导致反应发生的可能性。
可能:用药与反应发生时间关系密切,同时有文献资料佐证;但引发ADR/ADE 的药品不止一种,或原患疾病病情进展因素不能排除。
可能无关:ADR/ADE 与用药时间相关性不密切,反应表现与已知该药的ADR/ADE 不吻合,原患疾病发展同样可能有类似的临床表现。
待评价:报表内容填写不齐全,等待补充后再评价,或因果关系难以定论,缺乏文献佐证。
无法评价:报表缺项太多,因果关系难以定论,资料又无法补充。
其他说明合并用药:指发生此药品不良反应/事件时患者除怀疑药品外得其他用药情况,其中也包括患者自行购买的药品或中草药等。
报告的处理所有的报告将会录入数据库,专业人员会分析药品和不良反应之间的关系。
我们会考虑风险是否普遍或严重,然后决定我们是否需要采取行动,例如在药品说明书中加入警示信息,更新药品如何安全使用的信息,如,限制使用剂量或在某些特定人群中限制使用。
极少数情况下,我们会把产品撤市,只有当我们认为产品的风险大于效益时。
药品不良反应上报表空表

药品不良反应上报表空表药品不良反应 / 事件报告表新的□ 严重□一般□ 医疗卫生机构□ 生产企业经营企业□ 个人□ 编码□□□□□□□□□□□□□□□□□□□单位名称:部门:电话:报告日期:年月日◇严重药品不良反应/事件是指有下列情形之一者:① 引起死亡□ ② 致畸、致癌或出生缺陷□ ③ 对生命有危险并能够导致人体永久的或显著的伤残□ ④ 对器官功能产生永久损伤□ ⑤ 导致住院或住院时间延长□◇新的药品不良反应是指:药品说明书中未载明的不良反应◇编码规则:省(自治区、直辖市) 市(地区)县(区)单位年代流水号□□ □□ □□□□□□ □□□□ □□□□□ 注:省(自治区、直辖市)、市(地区)、县(区)编码按中华人民共和国行政区划代码填写。
单位编码第一位如下填写:医疗机构1、军队医院2、计生机构3、生产企业4、经营企业5。
个人报告单位编码一栏填写6000◇ 注:通用名称一栏,首次获准进口5年内的进口品种用*注明国家药品不良反应监测中心江苏省药品不良反应监测中心通信地址:北京市崇文区法华南里11号楼二层通信地址:南京市中山东路448号9楼邮编:100061 邮编:210002 电话:(010)67164979 电话:(025)86646321 传真:(010)67184951 传真:(025)86646334 E – mail :report@ E – mail:jiangsu@新的、严重的药品不良反应/事件病例报告要求药品生产企业报告要求1. 填报《药品不良反应/事件报告表》;2. 产品质量检验报告;3. 药品说明书(进口药品还须报送国外药品说明书);4. 产品注册、再注册时间,是否在监测期内(进口药是否为首次获准进口5年内);5. 产品状态(是否是国家基本药物、国家非处方药、国家医疗保险药品、中药保护品种) ;6. 国内上年度的销售量和销售范围;7. 境外使用情况(包括注册国家、注册时间) ;8. 变更情况(药品成分或处方、质量标准、生产工艺、说明书变更情况); 9. 国内外临床安全性研究及有关文献报道情况;10. 除第1、2项以外,其他项目一年之内如无变更,可以免报。
药品不良反应事件报告表.doc

药品不良反应事件报告表药品不良反应/事件报告表患者姓名性别出生年月年龄民族体重原患疾病病历号/门诊号联系方式家族药品不良反应/事件不详无有既往药品不良反应/事件不详无有相关重要信息吸烟史饮酒史妊娠期肝病史肾病史过敏史其他怀疑用药序批准文号商品名称通用名称生产厂家生产批号用法用量用药起止时间用药原因备用量从剂型给药途径到用量从剂型给药途径到用量从剂型给药途径到并发用药序批准文号商品名称通用名称生产厂家生产批号用法用量用药起止时间用药原因备用量从剂型给药途径到用量从剂型给药途径到用量从剂型给药途径到不良反应/事件名称不良反应/事件发生时间不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况(可附页)不良反应/事件的结果痊愈好转未好转不详有后遗症死亡停药或减量后反应/事件是否消失或减轻是否不明未停药或未减量再次使用可疑药品后是否再次出现同样反应/事件是否不明未再使用对原患疾病的影响不明显病程延长病情加重导致后遗症导致死亡关联性评价报告人肯定很可能可能可能无关待评价无法评价签名报告单位肯定很可能可能可能无关待评价无法评价签名报告人信息联系电话职业医生药师护士其他电子邮件签名备注报告单位信息单位名称联系人电话报告日期血常规检查平均红细胞容积MCV fl 尿素氮BUN mmol/L 血钠Na mmol/L 血红蛋白(Hbg)g/L 血小板计数109/L 尿酸UA umol/L 血氯化物Cl- mmol/L 红细胞(RBC)1012/L 血小板平均容积MPV fl 血脂分析酸碱度PH 白细胞(WBC)109/L 血小板分布宽度PDW 总胆固醇TCH mmol/L 氧分压PO2 mmHg 中性杆状核粒细胞肝功能高密度脂蛋白胆固醇mmol/L 二氧化碳分压mmHg 中性分叶核粒细胞直接胆红素测定umol/L 低密度脂蛋白胆固醇mmol/L 实际碳酸氢盐mmol/L 嗜酸性粒细胞间接胆红素测定umol/L 甘油三酯TG mmol/L 二氧化碳总量mmol/L 嗜碱性粒细胞谷丙转氨酶测定ALT U/L 生命体征全血剩余碱Beb mmol/L 淋巴细胞谷草转氨酶测定AST U/L 体温℃细胞外液剩余碱BEecf mmol/L 单核细胞总蛋白测定TP g/L 心率次标准碳酸氢根SBC mmol/L 网织红细胞百分数白蛋白测定(ALB)g/L 呼吸频率次阴离子间隙AG mmol/L 网织红细胞生成指数总胆红素测定umol/L 血压mmHg 氧饱和度SO2C 红细胞沉降率ESR mm/h 肾功能血气红细胞比容Hct L/L 肌酐Cr umol/L 血钾K mmol/L。
药品不良反应表格

附表1
药品不良反应/ 事件报告表
首次报告□跟踪报告□编码:
报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显著的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
药品不良反应报告表(模板)

药品不良反应/ 事件报告表
严重药品不良反应,是指因使用药品引起以下损害情形之一的反应:
1) 导致死亡;
2)危及生命;
3)致癌、致畸、致出生缺陷;
4)导致显着的或者永久的人体伤残或者器官功能的损伤;
5)导致住院或者住院时间延长;
6)导致其他重要医学事件,如不进行治疗可能出现上述所列情况的。
新的药品不良反应:是指药品说明书中未载明的不良反应。
说明书中已有描述,但不良反应发生的性质、程度、后果或者频率与说明书描述不一致或者更严重的,按照新的药品不良反应处理。
报告时限
新的、严重的药品不良反应应于发现或者获知之日起15日内报告,其中死亡病例须立即报告,其他药品不良反应30日内报告。
有随访信息的,应当及时报告。
其他说明
怀疑药品:是指患者使用的怀疑与不良反应发生有关的药品。
并用药品:指发生此药品不良反应时患者除怀疑药品外的其他用药情况,包括患者自行购买的药品或中草药等。
用法用量:包括每次用药剂量、给药途径、每日给药次数,例如,5mg,口服,每日2次。
报告的处理
所有的报告将会录入数据库,专业人员会分析药品和不良反应/事件之间的关系。
根据药品风险的普遍性或者严重程度,决定是否需要采取相关措施,如在药品说明书中加入警示信息,更新药品如何安全使用的信息等。
在极少数情况下,当认为药品的风险大于效益时,药品也会撤市。
药品不良反应报告表模板
药品不良反应报告表部分项目填报注意事项一、药品不良反应事件名称及描述1.如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,对于皮疹的发生部位、大约形态进行描述;2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;3.如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。
4.如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一哈相关的症状;例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归1、药品不良反应发生以后,主要采取的治疗措施要进行描述。
例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。
具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。
2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归。
有的医疗机构在患者刚刚发生不良反应,采取措施尚未缓解的时候就立即上报,这种是不规范的。
国家规定药品不良反应报告的上报时限。
大家应当按照规定时限完整的对药品不良反应进行上报。
备注:提供一个药品不良反应/事件报告表填写模板(见附表),供大家参考。
附表药品不良反应 / 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□。
