梅毒感染诊断中Tp0259 PCR方法的建立
梅毒抗体(TP)实验操作规程(吉比爱)

1.目的和适用范围:1.1.为保证血液检测的结果正确性,规范实验操作,特制定本操作规程。
1.2.适用于本实验室,全体工作人员都必须严格按照本操作规程进行操作。
2.术语:无。
3.职责:3.1.实验室工作人员都必须严格按照本操作规程进行操作。
3.2.实验室负责人负责最终实验室报告的签发。
4.操作说明4.1.实验原理:本试剂盒应用双抗原夹心酶联免疫法原理检测人血清或血浆中的TP抗体。
用高纯度基因重组TP抗原包被酶标板,待检血清或血浆中的抗TP抗体可与包被抗原反应,再与酶标TP抗原结合,形成抗原-抗体-酶标抗原复合物。
加底物(TMB)显色,在酶标仪上测定后根据吸光值(A值)判定有无TP抗体的存在。
4.2.实验所需设备和材料:酶标读数仪、洗板机、100ul加样器、37℃恒温孵育箱,一次性加样吸头、试剂槽、过程记录单等。
4.3.实验室环境条件:实验检测的室温应保持在18℃-25℃之间。
4.4.实验操作步骤:4.4.1.准本:自2℃-8℃冰箱中取出试剂盒,在室温中平衡30分钟,包被板平衡至室温后才可打开外包装铝箔袋,以防止板条吸收口气中的水蒸气,将20倍浓缩洗涤液用纯化水20稀释后备用。
剩下的试剂及时封存于2℃-8℃冰箱中,以备后用。
4.4.2.设定:将待测样品按序排列设定加样顺序号。
每板试验设空白对照1孔(若用双波长检测,可不设空白对照孔),阴性对照3孔,阳性对照2孔。
4.4.3.加样:将所需数量的板条固定于板架。
除空白对照孔外,在相应孔中加入阴性、阳性对照和待检样本各50微升。
4.4.4.温育第一次:贴上封口胶,置37℃温育60分钟。
4.4.5.洗涤:小心撕去封口胶。
4.4.6.手工洗操作:弃去各孔中液体、拍干。
每孔注满洗液,静置5~10秒后弃尽,洗涤5次,拍干。
4.4.7.洗板机操作:每孔加入350ul洗液,每次洗涤间隔5~10秒,洗涤5次,拍干。
4.4.8.加酶:除空白孔外,每孔加入酶工作液50ul。
梅毒实验室诊断技术及梅毒实验室检测技术规范简介 ppt课件

16
非梅毒螺旋体抗原血清学试验原理
梅毒螺旋体一旦感染人体,宿主迅速对螺旋体表面的 脂质作出免疫应答,在3周-4周产生抗类脂抗原的抗 体(反应素)。抗体主要是IgM和IgG混合抗体。 未经治疗的病人,其血清内的反应素可长期存在。经 正规治疗后,反应素可以逐渐减少至转为阴性。
问题2:临床上非梅毒螺旋体抗原血清学试验为什么有定性和定量两种检 测方法
梅毒螺旋体颗粒凝集试验 (TPPA) 梅毒螺旋体血球凝集试验 (TPHA) 梅毒酶联免疫吸附试验(ELISA) 梅毒免疫层析法-梅毒快速检测 (RT) 荧光螺旋体抗体吸收试验(FTA-ABS) 化学发光免疫分析法(CLIA)
ppt课件 32
TPPA/TPHA
TPPA试验原理与TPHA试验基本相同。TPPA试验
非梅毒螺旋体抗原血清学试验结果判断
RPR
VDRL
滴度:出现凝集 反应的血清最高 稀释倍数。
ppt课件
TRUST
23
非梅毒螺旋体抗原血清学试验临床意义
早期梅毒(一期、二期)经足量规则抗梅毒治疗
后3个月,VDRL试验抗体滴度下降2个稀释度, 6个月下降4个稀释度。
一期梅毒1年后转为阴性 二期梅毒2年后转为阴性。 晚期梅毒 治疗后血清滴度下降缓慢,2年后约
有6 ~ 12个规则的螺旋
基本结构为一原生质的圆柱体, 为两层膜所围绕 行动缓慢而有规律 - 围绕其长轴旋转中前后移动
- 伸缩其圈间之距离而移动
ppt课件 9
概述-传播途径
性接触是主要的传染途径
未经治疗的患者在感染后的1年内最具有传染 性
随着病期的延长,传染性越来越小
Tp0259-PCR

Ab s t r a c t : 0b j e c t i v e To e x p l o r e t h e s i g n i f i c a n c e o f e s t a b l i s h e d Tp 0 2 5 9 一 P CR i n d i a g n o s i n g p r i ma r y s y p h i l i s . To p r o v i d e b a s i s
杨 长顺 , 王三虎 , 周 秀萍 △
( 1 . 怀化 市 第一人 民 医院检验 科 , 湖 南怀化 4 1 8 0 0 0 ; 2湖 南 医药学 院 , 湖 南怀化 4 1 8 0 0 0 )
摘 要 : 目的 建 立 聚合 酶 链 反 应 ( P C R) 方法扩增梅毒螺旋体( Tp ) 0 2 5 9基 因 , 探 讨 其 在 一 期梅 毒诊 断 中的 意 义 , 为 建 立 新 的 梅毒 P C R诊 断 方 法提 供 依 据 。 方 法 从 G e n b a n k获 取 Tp 0 2 5 9 基 因序 列 设 计 引物 , 优 化反应 条件 , 建立 T p 0 2 5 9 一 P C R方法 ; 同 时 通 过 新 构 建 扩 增 方 法 检 测 泌 尿 生 殖 道 感 染 常 见 病 原 微 生物 ; 以建立的 T p 0 2 5 9 一 P C R 方 法检 测 临床 4 2例 确 诊 一 期 梅 毒 患 者 的 分 泌 物, 同时 用 血 清 学方 法 Tp明胶 颗 粒 凝 集 试 验 ( T P P A) 平 行 检 测 待 测 者 血 清 中抗 T p抗 体 。结 果 Tp 0 2 5 9 一 P C R只在扩增 T p时 有
PCR技术在梅毒检测中的应用

低病原体水平 以致不足 以诱 导产生特 异性 I g M和 ( 或) I g G 的情 况 下 _ 3 ] 。现 就 P C R检 测 技 术 在 梅 毒
标本 包括 血 ( 血清 、 全血 ) 、 羊水 、 脑脊液、 皮 损 材 料 ( 分泌物 、 组织 ) 等 。检 测 的 目标 基 因 包 括 T P 4 7 、 T mP A、 T m P B、 4 D等表 面脂 蛋 白以及 p o l A等参 与基 因组复制 酶 的编码 基 因_ 5 ] 。见 表 1 。
D F M方 法之 后 , P C R被 认为是 诊 断梅 毒 常用 的高度 特异、 敏 感 的分子 生物学 方法 , 可用 于检测 早期 梅毒
各临床样 品中微量 T P及对不 同 T P临床株进行基 因分 型[ 4 ] 。 目前实 验 室 诊 断 梅毒 常见 的 P C R技 术
主要有 巢式 P C R、 实 时荧光 定量 P C R( R e a l t i me f l u -
实验 室诊 断 中的现状 进行 综述 。
1 P C R检测技术 类型
美 国疾 病 控 制 与预 防 中 心 ( C D C) 最 近 重 新 确
者血 清学诊 断 为 阴性 的 可疑 梅 毒 、 暗视 野显 微 镜 检
查 为阴性的一期梅毒 , 以及包括伴有艾滋病的梅毒 、 神经梅毒等特殊梅毒。此外 , 巢式 P C R对判断梅毒 患者血液的传染性 、 判定疾病治疗效果 、 研究梅毒的
的血、 脑脊液等标本 时 , 其敏感性仍较低 I 6 ] , 且 由于 其操作繁琐 , 近年已很少用于临床梅毒检测。 1 . 2 巢式 P C R 巢式 P C R是 一 种应 用两 对 特 异
梅毒检测操作规程

梅毒螺旋体抗体检测(乳胶法)作业指导书1.检测目的定性检测人血清或血浆样本中梅毒螺旋体抗体(TP),可作为梅毒感染的辅助诊断。
2.测定原理采用高度特异性的抗体抗原反应原理及乳胶标记免疫层级分析技术,试剂含有预先固定于膜上检测区(T)的梅毒重组抗原盒包被在聚酯膜上的梅毒重组抗原乳胶颗粒。
3.标本要求1试剂适用于检测血清或血浆样本,检测时应使用未溶血的样本。
2.样本应收集于清洁、干燥的容器中,可采用肝素、EDTA或柠檬酸三钠作为抗凝剂。
3.样本收集后应尽可能马上使用,不可再室温长时间存放。
血清血浆样本可在2-8°C冷藏存放一周,长期保存需冷冻于-20℃。
冷藏或冷冻样本应在检测前恢复到室温并充分混均,样本禁止反更冻融。
4.试剂艾博生物医药(杭州)有限公司5.操作步骤5.1使用前将试剂板和血清/血浆标本恢复至室温。
从原包装铝箔袋中取出试剂盒(注意:在扣开铝箔前应先恢复至室温),在1小时内应尽快地使用。
5.2将试剂置于干净平坦的台面上,用吸管吸取血清血浆标本,垂直加入1滴(约25UI)试剂板的加样孔(S)中,然后加入2滴缓冲液。
5.3加样后立刻开始计时等待红色条带的出现,在15分钟时读取测试结果。
20分钟后读取的结果无效。
6.结果判定6.1阳性(+):两条紫红色条带出现。
一条位于检测区(T)内,另一条位于质控区(C)。
6.2阴性(-):近质控区(C)出现一条紫红色条带,在检测区(T)内务紫红色条带出现。
6.3无效(X):质控区(C)未出现紫红色条带,标本不正确操作过程或试剂已变质损坏。
1湎血清/血桨∖υC2滴缓冲液—阳性阴性无效7.质量控制7.1请控制判读时间,测试结果应在测定开始后15-20分钟左右读取,20分钟后读判定无效。
7.2质控区内(C区)一条红色条带的出现是试验结果可靠的前提。
质控内(C)所显现的红色条带是判定标本是否足够,层析过程是否正常的标准,同时也作为试剂的内控标准。
8.注意事项8.1加样过多或过少可能导致结果出现偏差。
免疫PCR法诊断梅毒螺旋体抗原和抗体的方法学研究

【 文献标 识 码】 B
【 文章 编 号】 6 3 7 1 ( 0 2)5( 一 1 6 0 1 7 — 2 0 2 1 0 c)O 1 — 3
S u y o r p n m a p l d m p cf n i e n n i o y b m mu o- t d n t e o e al u i s e i c a tg n a d a tb b y i i n —
【 sr c】 jcieT sal h a d s d h e h ooyt e c T eo e ap ld m p c c a t e n nio y Ab tat 0bet oetbi n t ytet n lg od t t rp n m al u se i ni n a da t b v s u c e i i f g b
两者相 比具有统 计学 意义 ( P<0 5 。 结论 免疫 P R法检测 梅毒螺旋 体具有 高度 的敏感 性和 特异性 , . ) 0 C 但重 复性较差 。 『 关键 词】 疫 P R 法 ; 毒螺 旋体 ; N4 ; 体 免 c 梅 Tp 7 抗
『 图分 类号】 2 . 中 R7 2 1
特 异性 和重 复性 。 方法 选择 2 1 年 我 院梅 毒 血清 学 E IA法 检测 者 1 2 01 LS 5 0例并 梅 毒分 期 ;建 立免 疫 P R法检 测 C 梅 毒螺 旋体 抗 原和 梅毒 螺旋 体抗 体 两种 方法 , 然后 对 梅 毒螺 旋体 血 清学 阳性 标本 1 0倍 系列 稀 释 , 比较免 疫 P R法 C 敏 感性 : 同时 采用 正 常健 康血 清标 本观 察 免疫 P R法 特异 性 ; 后 采集 梅 毒 阳性 血液 分装 成 两 份标 本 , 测 两种 免 C 最 监 疫 P R法试 验批 内和 日间重 复性 。 结 果 1 2 C 0例 患 者 中 , 5 梅毒 患者 16例 。 3 梅毒 患 者 中女 性 占 7 .%(0 /3 )孕 72 1 51 6 ,
RPR、TP、TPPA三种检测梅毒方法学比较及临床意义

RPR、TP、TPPA三种检测梅毒方法学比较及临床意义摘要:目的比较RPR、TP、TPPA检测梅毒的结果及临床意义。
方法以我院于2017年3月-2018年2月收治的42例老年梅毒患者为研究对象。
每例患者各取3份血清样本,分别行RPR检测、TP检测及TPPA检测。
结果RPR检出率78.57%,TP检出率92.86%,TPPA检出率97.62%(P<0.05)。
结论梅毒检测中,TP、TPPA的准确率优于RPR检测。
关键词:RPR;TP;TPPA;梅毒前言:作为一种常见的性传播疾病,梅毒的危害较大,传染性较强[1]。
这种疾病的特征对临床诊断及传播控制提出了较高的要求。
RPR、TP、TPPA在临床梅毒检测中较为常用。
为了对比这三种检测方法的临床价值,本研究将42例患者作为研究对象,现分析如下:1资料与方法1.1一般资料以我院于2017年3月-2018年2月收治的42例老年梅毒患者为研究对象。
其中,男29例,女13例;年龄61-69岁,平均年龄(65.1±1.2)岁。
每例患者各取3份血清样本,以便后续检查。
1.2方法检测仪器选用BIO- RAD MODEL 1575型号酶标洗板机。
RPR检测、TP检测、TPPA检测分别选用RPR试剂盒、TP-ELISA试剂盒及TPPA试剂盒。
检测流程严格按照试剂盒说明书完成。
其中,TP-ELISA检测结果经伯乐-550型号酶标仪进行判断。
如OD值低于Cut-off值,提示梅毒检测阴性;如OD值高于Cut-off值,提示梅毒检测阳性。
1.3观察指标观察患者的诊断结果。
1.4统计学方法统计工具选用SPSS20.0。
P<0.05:差异有统计学意义。
2结果RPR检出率78.57%,TP检出率92.86%,TPPA检出率97.62%,组间差异显著(P<0.05)。
见表1。
3讨论梅毒是一种由苍白(梅毒)螺旋体诱发的慢性性传播疾病。
这种疾病的传播途径包含血液传播、母婴传播及性传播。
梅毒的实验室检查与技术规范

梅毒的实验室检查与技术规范概述梅毒(syphilis)是一种由螺旋体梅毒螺旋体(Treponema pallidum)引起的性传播疾病。
梅毒的及时检测和确诊对于治疗及防止梅毒的传播至关重要。
本文将探讨梅毒的实验室检查方法和相关的技术规范。
实验室检查方法血清学检测血清学检测是梅毒的首选检测方法,常用的血清学检测方法包括非梅毒螺旋体凝集试验(non-treponemal tests)和梅毒螺旋体特异性试验(treponemal tests)。
非梅毒螺旋体凝集试验包括梅毒螺旋体血清检测(VDRL)和荧光梅毒螺旋体抗体吸附试验(FTA-ABS)。
这些试验通过检测抗体反应来判断是否感染梅毒,并可评估感染程度。
梅毒螺旋体特异性试验主要包括T. pallidum颗粒凝集试验(TP-PA)和ELISA试验。
这些试验可以进一步证实梅毒感染,并对阳性样本进行确认。
分子生物学检测分子生物学检测方法可以直接检测梅毒螺旋体的基因组或其特异性基因片段。
常见的分子生物学检测方法包括聚合酶链式反应(PCR)和DNA杂交试验。
PCR技术可在早期感染时检测到梅毒螺旋体的DNA,具有高度敏感性和特异性。
DNA杂交试验主要用于检测神经梅毒,可检测到T. pallidum在脑脊髓液中的存在。
细菌学检测细菌学检测是直接观察样本中是否存在活动的梅毒螺旋体。
常用的细菌学检测方法有暗视野显微镜检查、苏木精-伊红染色和螺旋体培养。
在显微镜下观察暗视野试验时,活动的梅毒螺旋体会显示出旋转的运动。
苏木精-伊红染色可以染出梅毒螺旋体的形态。
螺旋体培养可以将梅毒螺旋体培养出来,但是需要较长的培养周期,并且并非常规检测方法。
技术规范为确保梅毒实验室检查结果的准确性和可靠性,以下是一些常见的技术规范:1.实验室人员需接受充分的培训,熟悉各项检测方法和技术操作流程,并按照操作规程执行。
2.所有试剂和材料必须符合质量管理规范,并保持良好的保存和标识。
3.实验室必须建立完善的质量控制体系,包括使用标准品进行日常质控、参加外部质控项目以及进行内部质量评估。
梅毒特异性igg、igm抗体分型检测方法的建立与临床应用

梅毒特异性IgG、IgM抗体分型检测方法的建立与临床应用摘要梅毒是一种常见的传播疾病,由梅毒螺旋体感染人体而发生,可累及全身各个器官且临床表现多样,具有极强的侵袭能力,严重危害到人类身体健康,是最为重要的性传播疾病之一[1]。
梅毒感染的病原体—苍白螺旋体(TP)很难在体外培养,因此,很难通过病原微生物培养进行诊断。
梅毒诊断主要依据患者的临床表现和实验室检查结果[2-4],包括以抗心磷脂抗体(反应素)为检测对象的非特异性类脂质抗原检测方法和以梅毒螺旋体抗体为检测对象的特异性检测方法两类。
特异性检测结果只能反应梅毒特异性总抗体的存在情况。
检测结果不能区分所检测抗体的类型,即不能判定是IgG还是IgM类型的抗体,也就不能判断患者是既往感染还是现症感染。
梅毒特异性IgM抗体的直接检测方法需要特殊的商品化试剂盒,操作步骤多,检测时间长,多为批量检测方法,无法在临床大规模应用。
本研究的第一部分:构建含梅毒螺旋体特异性抗原TP47基因片段的重组质粒,诱导表达TP47蛋白并纯化。
将纯化后的TP47蛋白进行免疫印迹(weatern blot,WB)检测,对重组蛋白抗原性进行确认。
结果显示:重组蛋白TP47能与梅毒阳性血清有特异性反应,与正常人梅毒阴性血清、自身免疫性疾病患者混合血清无反应。
本研究的第二部分:设计并制造一个能实现半自动化的亲和层析分离梅毒IgG和IgM抗体的装置,并验证装置的稳定性。
制备亲和柱和脱盐柱,按照实验顺序分别装填入亲和装置中,优化亲和层析及脱盐条件。
结果显示:亲和层析装置稳定性良好,无漏液、无管道污染、无非特异性吸附等问题;优化后亲和柱实验条件,即(1)样本上样液为500ul;(2)亲和柱的平衡液为20mM含5g/l的NaCL PH=7.5的Tris-HCL缓冲液4ml;(3)亲和柱的洗脱液为3M KSCN,洗脱体积为2ml。
此时亲和填料可充分结合特异性梅毒抗体,并且平衡液4ml平衡后可去除非特异性IgG、IgM蛋白的残留;优化后脱盐柱实验条件,即(1)上样液为200ul的亲和柱洗脱液第2管;(2)脱盐柱的平衡液为20mM含5g/l 的NaCL PH=7.5的Tris-HCL缓冲液1ml;(3)脱盐柱的洗脱液为0.2M NaOH,洗脱体积为2ml。
梅毒快速血浆反应素试验标准操作规程

梅毒快速血浆反应素试验标准操作规程1.测定原理:梅毒患者血清中存在着能与VDRL抗原发生凝集反应的反应素,本试剂利用这一原理,将VDRL抗原吸附于活性炭颗粒表面,当待测血清中存在反应素时,即与其发生凝集反应,出现肉眼可见的黑色凝块。
2.试剂盒主要组成:(I)RPR试剂(2)RPR阳性对照(3)RPR阴性对照(4)纸卡(5)专用滴管、针头3.样本要求:血清4.测定步骤(定型试验)4.1分别吸取50ulRPR阳性对照和阴性对照均匀铺加在纸卡的两个圆圈中。
4.2另吸取50ul待测血清均匀铺加在纸卡的另一圆圈中。
4.3用盒中的专用针头、滴管吸取RPR试齐I」,分别垂直滴加1滴于上述血清中。
5.4用RPR旋转仪水平转动纸卡8分钟,100转/分钟,然后3分钟内在光纤充足处判读结果。
5.结果判断5.1阴性反应(一):可见均匀的抗原颗粒而无凝集物。
5.2弱阳性反应(+-++):可见较小的黑色凝集物。
6.3阳性反应(+++-++++):可见中等或较大的黑色凝块,溶液清亮。
7.注意事项7.1实验条件:23-29℃的环境下进行。
6.2待测血清和试剂盒需平衡至检定试验环境后使用,未使用完试剂按贮藏条件保存。
6.3RPR试剂在使用前应充分摇匀。
6.4血清中加入试剂后充分振荡使其混匀。
6.5定性实验呈弱阳性或阳性者必须做定量试验才能了解患者血清中的抗体滴度,具体方法如下:将待测血清用生理盐水作倍比稀释(原血清、1:2、1:4、1:8、1:16、1:32),然后对每个稀释度的血清按定型试验方法再进行测定并判断结果。
6.6定性试验呈弱阳性或阳性反应者,需结合临床进行综合分析判断,同时再做特异性密螺旋体试验加以确诊。
因为本试验是梅毒非特异性反应素试验,麻风患者可出现生物学假阳性反应。
6.7试剂盒中的专用滴管、针头只能用来吸取RPR试剂,不能用来吸取血清或作他用。
6.8本试剂盒应视为有传染性物质,请按传染病实验室检查规程来处理。
TP—ELISA、TPPA及FQ—PCR3种方法用于梅毒螺旋体检测的研究

TP—ELISA、TPPA及FQ—PCR3种方法用于梅毒螺旋体检测的研究目的探究在梅毒螺旋体检测中应用TP-ELISA(酶联免疫吸附法)、TPPA (明胶颗粒凝集法)及FQ-PCR (荧光定量PCR法)3种方法检测的价值。
方法选取2014年1月—2015年6月收治的50例一期梅毒患者的血清标本作为实验组,同时选取50例非梅毒患者血清标本作为对照组,对这2组标本均采用TP-ELISA、TPPA及FQ-PCR 3种方法进行梅毒螺旋体的检测,对比其检测结果的差异性。
结果FQ-PCR在梅毒螺旋体检测中应用,其检测的敏感度(92.00%)明显高于TTPA檢测的敏感度(66.00%)以及TP-ELISA检测的敏感度(68.00%)(P<0.05)。
结论FQ-PCR在梅毒螺旋体检测中应用,具有较高的特异性以及敏感性,应用价值较高。
标签:酶联免疫吸附法;明胶颗粒凝集法;荧光定量PCR法;梅毒螺旋体梅毒主要是由TP(梅毒螺旋体苍白亚种)引起的传染性疾病,患者在疾病早期以皮肤黏膜损伤为主要的临床表现,晚期则会对其中枢神经、心血管、眼部、骨骼等重要的脏器造成损伤,具有较为复杂的病程以及较强的传染性,可通过性以及母婴的方式传播[1-2]。
WHO报道显示,90%以上的梅毒患者发生于发展中国家,在部分地区,梅毒已经是较为常见的性病[3]。
因此,采取有效措施对梅毒患者进行疾病检测以及治疗干预来改善其预后意义重大。
该文主要对梅毒螺旋体检测中应用TP-ELISA(酶联免疫吸附法)、TPPA(明胶颗粒凝集法)及FQ-PCR (荧光定量PCR法)3种方法检测的价值作分析,内容如下文。
1 资料与方法1.1 基本资料选取2014年1月—2015年6月收治的50例一期梅毒患者作为实验组,同时选取50例非梅毒患者作为对照组。
实验组一期梅毒患者中,男女之比为20/30,年龄在17~62岁之间,年龄均值为(29.62±2.10)岁。
对照组患者中,男女之比为25/25,年龄在18~60岁之间,年龄均值为(30.20±2.09)岁。
TP-ELISA联合PCR法在梅毒血清学检验上的应用

TP-ELISA联合PCR法在梅毒血清学检验上的应用摘要:目的:探讨TP-ELISA联合PCR法在梅毒血清学检验上的检测应用效果。
方法:选取我院2012年1月~2014年1月收治的梅毒患者共92例采集患者样本,采用TP-ELISA、PCR以及TRUST,3种方法进行梅毒血清鉴定,对比三种方法的鉴定准确率及特异性。
结果:TP-ELISA、PCR以及TRUST,这三种检测方法对梅毒血清进行检验之后,其中PCR的检测准确率最高,TP-ELISA次之,TRUST准确率最低;在特异性检测方面:PCR与TP-ELISA的检测特异性均为100%,TRUST的特异性最低。
三组结果差异明显,具有统计学意义(P<0.05)。
结论:临床上在进行梅毒血清学的检测时,可以采用TP-ELISA联合PCR法进行梅毒血清的检测,能够显著提升检测准确率及特异性,获得了非常理想的检测效果,值得在临床上大力推广。
关键词:TP-ELISA联合PCR法;梅毒血清学检验;应用The application of TP-ELISA combined with PCR in Syphilis Serological TestAbstract: Objective: To investigate the effect of TP-ELISA combined with PCR inthe detection of Syphilis Serological Test. Methods: a total of 92 syphilis patients were collected in our hospital from January 2012 to January, and cases of syphilis were collected. The TP-ELISA, TRUST and ~2014 were used to identify the 3 kinds of methods, and the accuracy of the three methods was compared. Results: TP-ELISA, TRUST and PCR, the three detection methods of syphilis serum were tested, and the accuracy rate of PCR was the highest, followed by TP-ELISA, the accuracy of TRUST was the lowest. The accuracy rate of TP-ELISA and PCR was 100%, and the specificity of TRUST was the lowest. Conclusion: TP-ELISA combined with PCR can be used in the detection of syphilis in clinic. It can improve the detection accuracy and specificity, and it is highly desirable to be used in clinic.目前对梅毒血清的检测主要有梅毒酶联免疫吸附试验法(TP-ELISA法)、梅毒胶体金法(SYP法)、梅毒螺旋体制动试验法(TPI法)、甲苯胺红不加热血清试验法(TRUST法)等数十种检测方法,在临床检测中应用最为广泛的是TP-ELISA、PCR以及TRUST法,各种检测方法都具有其特殊的价值性,而目前如何将这些检测方法应用到临床梅毒检测中,是此项研究的关键问题。
梅毒螺旋体检测标准操作规程

梅毒螺旋体检测标准操作规程一、目的梅毒螺旋体检测标准操作规程的目的是确保梅毒螺旋体检测的准确性和一致性,以提供可靠的检测结果。
二、范围本操作规程适用于梅毒螺旋体检测实验室的工作人员,包括样本接收、处理、前处理、试剂准备、实验操作、数据记录、结果解读等环节。
三、设备和试剂1. PCR仪:用于梅毒螺旋体检测的PCR分析。
2. 试剂:包括PCR引物和酶切酶。
3. 离心机:用于离心样本和试剂。
4. 试管架和显微镜:用于观察PCR反应结果。
四、标本采集与处理1. 标本采集:按照标准程序采集患者样本,确保标本完整无污染。
2. 标本处理:将采集到的标本进行合适的处理,包括离心、除菌等操作,确保标本的可靠性和稳定性。
五、试剂准备1. PCR引物和酶切酶的制备应按照相关的说明书进行。
2. 所有试剂应储存于适宜的温度和条件下,防止变质和受污染。
六、实验操作1. 样本前处理:按照相关方法,对标本进行前处理,如DNA提取、扩增等。
2. PCR反应:按照PCR反应体系,加入样本、引物和酶切酶,进行PCR反应。
3. PCR程序:设置合适的PCR程序,包括预变性、变性、退火和延伸等步骤,确保PCR 反应的准确性和重复性。
4. PCR反应过程中,严格控制实验室环境,防止污染,避免假阳性或假阴性结果的出现。
七、数据记录与结果解读1. 实验数据应按照规定的格式进行记录,包括样本信息、实验条件、PCR结果等。
2. 结果解读应根据设定的阈值和参考范围进行,确保结果准确可靠。
3. 结果的报告应及时完成,并按照相关规定进行归档和管理。
八、质量控制1. 每个实验过程应设置质量控制样本,用于监控实验的准确性和稳定性。
2. 定期进行校准和验证实验,确保实验仪器和试剂的性能和质量。
九、安全注意事项1. 实验操作过程中,严格遵守实验室的安全操作规程,确保个人和他人的安全。
2. 弃液处理要按照相关规定进行,避免污染和伤害。
十、附则本操作规程的具体实施应参照相关专业标准和法规,并根据实验室的具体情况进行调整和优化。
梅毒检测技术规范(100808)

全国梅毒检测技术规范(试行讨论稿)中国疾病预防控制中心二○一○年八月前言为了加强全国梅毒检测工作的管理,提高检测质量,根据《中华人民共和国传染病防治法》、《中国预防与控制梅毒规划(2010-2020)》的精神,在卫生部及中国疾病预防控制中心的领导下,性病控制中心组织国内相关领域的专家制订了《全国梅毒检测技术规范》(下称"规范")。
本“规范”是基于我国目前梅毒检测工作的需要以及梅毒检测技术的发展,对梅毒检测相关的样品采集、检测方法、检测策略、质量管理等做出具体的规范要求,经上报卫生部并获准由中国疾病预防控制中心下发,适用于全国各级医疗、疾病预防控制、妇幼保健、采供血、出入境检验检疫等提供梅毒检测服务的机构。
本“规范”起草单位:中国疾病预防控制中心性病控制中心本“规范”参加编写单位:中国疾病预防控制中心艾滋病性病预防控制中心、中国疾病预防控制中心妇幼保健中心、广东省皮肤性病控制中心、江苏省疾病预防控制中心、天津疾病预防控制中心、上海市皮肤性病医院本“规范”参加编写及审核人员:尹跃平、王千秋、王宝玺、邢文革、王临红、郑和平、傅更峰傅更锋、顾伟鸣、郑钟洁、龚匡隆、陈祥生。
本《规范》编写工作联系人:魏万慧本《规范》适用于全国所有的梅毒检测实验室。
本《规范》解释权属于中国疾病预防控制中心。
目录第一章梅毒及其病原体第二章样品的采集和处理第三章梅毒血清学检测第四章梅毒体病原学检测第五章梅毒核酸检测第六章实验室生物安全第七章梅毒血清学检测实验室质量管理第一章梅毒及其病原体梅毒是由梅毒苍白螺旋体(Treponema pallidum)引起的一种性传播疾病,可引起神经、心血管等多系统损害,严重影响人群的身体健康。
此外,梅毒亦可通过胎盘传给胎儿,导致自发性流产、死产或先天梅毒等。
20世纪80年代,梅毒在我国重新出现,90年代末以来,全国梅毒报告病例数明显增加,呈快速流行的趋势,已成为我国重要的公共卫生问题。
梅毒螺旋体荧光定量PCR检测方法的建立和初步临床应用

梅毒螺旋体荧光定量PCR检测方法的建立和初步临床应用徐瑾;张顺【期刊名称】《实验与检验医学》【年(卷),期】2005(023)006【摘要】目的建立一种利用MGB-Taqman探针的快速、灵敏、特异、准确定量检测梅毒螺旋体的方法.方法选择梅毒螺旋体的基因组的保守区域,设计合成引物和MGB-Taqman探针,构建质粒标准品pMD18-T-TP,优化定量PCR反应体系,并进行方法学评价.结果1)成功构建了重组质粒pMD18-T-TP.2)建立了利用MGB-Taqman探针的荧光定量PCR方法,其线性范围:101~1010copies/μl;灵敏度:10copies/μl;重复性:批内CV为2.02%,批间CV为2.83%,日间CV为4.23%;特异性:100%.3)初步临床应用证明:该方法比血清学检测方法灵敏度更高,假阳性率低.结论利用MGB-Taqman探针定量检测梅毒螺旋体的方法灵敏度高,特异性高,操作简便,适合临床检验诊断的要求.【总页数】4页(P529-532)【作者】徐瑾;张顺【作者单位】315010,浙江省宁波市第二医院检验科;315010,浙江省宁波市第二医院检验科【正文语种】中文【中图分类】R446.5;R377+1;R392-33【相关文献】1.梅毒螺旋体TpN47基因分析及实时荧光定量PCR检测方法的建立 [J], 王莹;丁肖青;朱胜;楼宏强2.荧光定量PCR检测梅毒螺旋体方法的建立及初步应用 [J], 赵丹;杨小猛;陈倩瑜;欧彩兰;林凌云3.梅毒螺旋体抗体化学发光免疫检测方法的建立及其临床应用 [J], 柳丽娟;戴振贤;卓传尚;谢玉玲;吴玉水4.猪瘟病毒实时荧光定量PCR检测方法的建立及初步应用 [J], 杨峰;陈立强;许信刚;张为民;张琪5.鉴别非洲猪瘟病毒和猪瘟病毒野毒株二重TaqMan MGB实时荧光定量PCR检测方法的建立及初步应用 [J], 王淑娟;柴茂;闫若潜;班付国;王东方;刘影;赵雪丽;谢彩华;王翠;马震原;杨海波因版权原因,仅展示原文概要,查看原文内容请购买。
荧光定量PCR检测梅毒螺旋体方法的建立及初步应用

荧光定量PCR检测梅毒螺旋体方法的建立及初步应用赵丹;杨小猛;陈倩瑜;欧彩兰;林凌云【期刊名称】《检验医学与临床》【年(卷),期】2015(000)003【摘要】Objective To establish a sensitive and specific fluorescent quantitation PCR (FQ‐PCR) by using duplex scorpion primer for rapid detection of treponema pallidum (TP) .Methods Primer and fluorescent probe were designed based on the gene order of TP outer membrane protein Gpd .Quantitative standard preparation of TP was constructed by using gene recombination .Duplex scorpion primer FQ‐PCR for rapid detection of TP was established by optimizing the reaction system and reaction condition .Totally 40 suspected cases were detected by our FQ‐PCR and commercial FQ‐PCR respectively and the difference was analyzed .Results Duplex scorpion primer FQ‐PCR for rapid detection of TP was established successfully .The linear range of the method was 101 -108 copy/mL and the sensitivity was 10 copy/mL ,susceptibility and specificity were 100 .0% .The positive detection rate of the suspected cases by our method was sharply higher than that by commercial FQ‐PCR kit (82 .5% vs 62 .5% ,P<0 .05) .Conclu‐sion Duplex scorpion primer FQ‐PCR for rapid detection of TP was established successfully ,which could be used for early diagnosis and preventive control of TP .%目的:采用二聚体蝎型探针技术建立一种高敏感性和特异性的检测梅毒螺旋体(T P )的荧光定量聚合酶链反应(PCR)方法。
毒螺旋体荧光定量PCR检测方法的建立

毒螺旋体荧光定量PCR检测方法的建立曹守勤;邵峰;詹军【期刊名称】《宁夏医学杂志》【年(卷),期】2016(038)002【摘要】目的建立基于TPN47基因检测血液中梅毒螺旋体的荧光定量PCR检测方法.方法根据梅毒螺旋体TPN47基因的参考序列设计引物和探针,对收集到的200份血液样本进行荧光定量PCR检测,并分析其灵敏性和特异性,同时,对扩增片段进行测序确认.结果荧光定量PCR方法可以扩增到梅毒螺旋体TPN47基因区164 bp长DNA片段,此方法特异性和敏感性都很高;基于TPN47基因的荧光定量PCR方法测定,TPPA阳性血清和TPPA阴性血清的符合率分别为99% (198/200)和98% (196/200).结论以TPN47基因为扩增的荧光定量PCR方法具有灵敏、快速、便宜等优点,适用于梅毒螺旋体临床实验室诊断.【总页数】3页(P149-151)【作者】曹守勤;邵峰;詹军【作者单位】宁夏疾病预防控制中心,宁夏银川750004;宁夏血液中心,宁夏银川750002;宁夏疾病预防控制中心,宁夏银川750004【正文语种】中文【中图分类】R440【相关文献】1.猪瘟兔化弱毒荧光定量PCR检测方法的建立及初步应用 [J], 邓力;张彦明;李维维;杨幼聪;谭晓妮2.梅毒螺旋体荧光定量PCR检测方法的建立和初步临床应用 [J], 徐瑾;张顺3.梅毒螺旋体TpN47基因分析及实时荧光定量PCR检测方法的建立 [J], 王莹;丁肖青;朱胜;楼宏强4.伪狂犬病病毒野毒荧光定量PCR检测方法的建立 [J], 田云;孙彦伟;任裕其;查云峰;王福广;焦颖5.新城疫强毒特异性反转录荧光定量PCR检测方法的建立与应用 [J], 徐敏丽;张琳;于江;逯璐;张玉玉;任素芳;陈智;孙文博;郭立辉;吴家强因版权原因,仅展示原文概要,查看原文内容请购买。
梅毒操作步骤
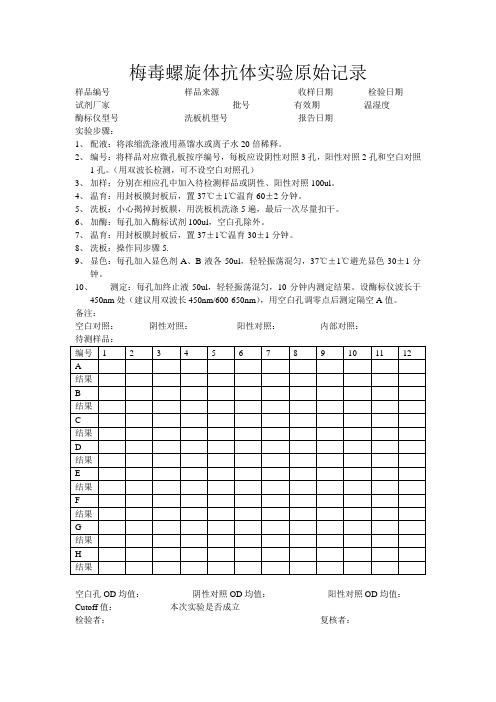
梅毒螺旋体抗体实验原始记录
样品编号样品来源收样日期检验日期
试剂厂家批号有效期温湿度
酶标仪型号洗板机型号报告日期
实验步骤:
1、配液:将浓缩洗涤液用蒸馏水或离子水20倍稀释。
2、编号:将样品对应微孔板按序编号,每板应设阴性对照3孔,阳性对照2孔和空白对照
1孔。
(用双波长检测,可不设空白对照孔)
3、加样:分别在相应孔中加入待检测样品或阴性、阳性对照100ul。
4、温育:用封板膜封板后,置37℃±1℃温育60±2分钟。
5、洗板:小心揭掉封板膜,用洗板机洗涤5遍,最后一次尽量扣干。
6、加酶:每孔加入酶标试剂100ul,空白孔除外。
7、温育:用封板膜封板后,置37±1℃温育30±1分钟。
8、洗板:操作同步骤5.
9、显色:每孔加入显色剂A、B液各50ul,轻轻振荡混匀,37℃±1℃避光显色30±1分
钟。
10、测定:每孔加终止液50ul,轻轻振荡混匀,10分钟内测定结果。
设酶标仪波长于
450nm处(建议用双波长450nm/600-650nm),用空白孔调零点后测定隔空A值。
备注:
空白对照:阴性对照:阳性对照:内部对照:
空白孔OD均值:阴性对照OD均值:阳性对照OD均值:Cutoff值:本次实验是否成立
检验者:复核者:。
