价电子排布式(原子序数顺序)
价电子排布式(原子序数顺序)
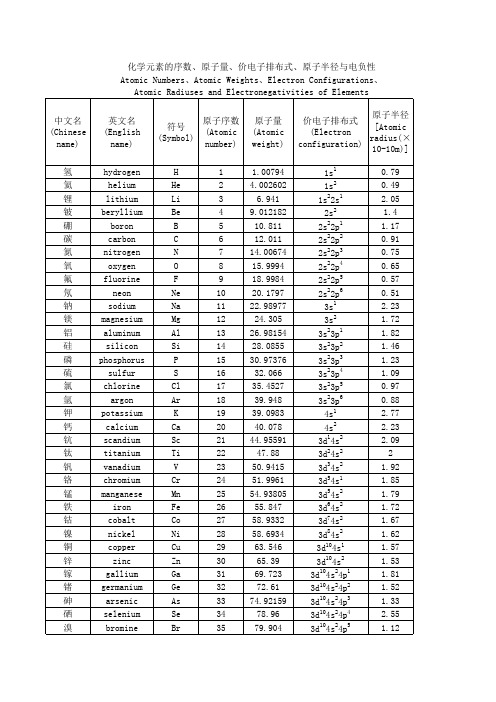
3d104s24p6 5s1 5s2 1 2 4d 5s 2 2 4d 5s 4d45s1 4d55s1 4d55s2 4d75s1 4d85s1 10 4d 4d105s1 4d105s2 4d105s25p1 4d105s25p2 4d105s25p3 4d105s25p4 4d105s25p5 2 6 5s 5p 6s1 6s2 1 2 5d 6s 4f15d16s2 4f36s2 4 2 4f 6s 4f56s2 4f66s2 7 2 4f 6s 4f75d16s2 4f96s2 10 2 4f 5s 4f116s2 12 2 4f 6s 13 2 4f 6s 4f146s2 4f145d16s2 4f145d26s2 4f145d36s2 4 2 5d 6s 14 5 2 5f 5d 6s 4f145d66s2 14 7 2 4f 5d 6s 14 9 1 4f 5d 6s
氪 铷 锶 钇 锆 铌 钼 锝 钌 铑 钯 银 镉 铟 锡 锑 碲 碘 氙 铯 钡 镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥 铪 钽 钨 铼 锇 铱 铂
krypton rubidium strontium yttrium zirconium niobium molybdenum technetium ruthenium rhodium palladium silver cadmium indium tin antimony tellurium iodine xenon cesium barium lanthanum cerium praseodymium neodymium promethium samarium europium gadolinium terbium dysprosium holmium erbium thulium ytterbium lutetium hafnium tantalum tungsten rhenium osmium iridium platinum
价电子排布式(符号顺序)
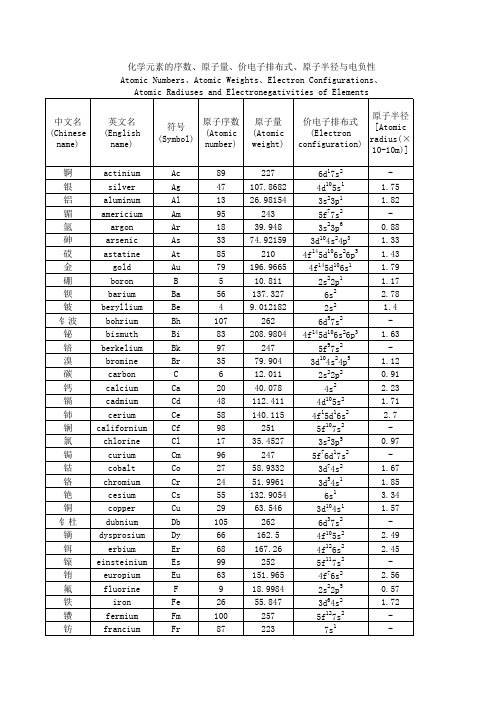
1.81 2.54 1.52 0.79 0.49 2.16 1.76 2.47 1.32 2 1.87 2.77 1.03 2.74 2.05 2.25 1.72 1.79 2.01 0.75 2.23 2.08 2.64 0.51 1.62 0.65 1.92 1.23 1.81 1.79 2.62 1.53 2.67 1.83 -
铷 铼 钅卢 铑 氡 钌 硫 锑 钪 硒 钅喜 硅 钐 锡 锶 钽 铽 锝 碲 钍 钛 铊 铥 铀 钒 钨 氙 钇 镱 锌 锆
பைடு நூலகம்
rubidium rhenium rutherfordium rhodium radon ruthenium sulfur antimony scandium selenium seaborgium silicon samarium tin strontium tantalum terbium technetium tellurium thorium titanium thallium thulium uranium vanadium tungsten xenon yttrium ytterbium zinc zirconium
1.81 1.2 2.01 2.2 1.3 2 1.23 2.66 1.78 2.2 0.82 1.1 0.98 1.27 1.3 1.31 1.55 2.16 3.04 0.93 1.6 1.14 1.91 1.3 1.36 3.44 2.2 2.19 1.5 2.33 2.2 1.13 2 1.13 2.28 1.28 0.9
Rb Re Rf Rh Rn Ru S Sb Sc Se Sg Si Sm Sn Sr Ta Tb Tc Te Th Ti Tl Tm U V W Xe Y Yb Zn Zr
1-36号元素电子排布式

1-36号元素电子排布式化学元素是组成物质的基本单位。
元素的属性不仅受到原子核中质子和中子的影响,电子的排布方式也在很大程度上决定了元素的性质。
为了更好的理解元素的性质以及化学反应过程,学习元素的电子排布式是非常必要的。
本篇文章将介绍1-36号元素的电子排布式。
1. 氢元素(H,原子序数1)氢元素只含有一个电子,因此其电子排布式为1。
2. 氦元素(He,原子序数2)氦元素包含2个电子,因此其电子排布式为1s2。
3. 锂元素(Li,原子序数3)锂元素包含3个电子,其电子排布式为1s2 2s1。
4. 铍元素(Be,原子序数4)铍元素包含4个电子,其电子排布式为1s2 2s2。
5. 碳元素(C,原子序数6)碳元素包含6个电子,其电子排布式为1s2 2s2 2p2。
6. 氮元素(N,原子序数7)氮元素包含7个电子,其电子排布式为1s2 2s2 2p3。
7. 氧元素(O,原子序数8)氧元素包含8个电子,其电子排布式为1s2 2s2 2p4。
8. 氟元素(F,原子序数9)氟元素包含9个电子,其电子排布式为1s2 2s2 2p5。
9. 氖元素(Ne,原子序数10)氖元素包含10个电子,其电子排布式为1s2 2s2 2p6。
10. 钠元素(Na,原子序数11)钠元素包含11个电子,其电子排布式为1s2 2s2 2p6 3s1。
11. 镁元素(Mg,原子序数12)镁元素包含12个电子,其电子排布式为1s2 2s2 2p6 3s2。
12. 铝元素(Al,原子序数13)铝元素包含13个电子,其电子排布式为1s2 2s2 2p6 3s2 3p1。
13. 硅元素(Si,原子序数14)硅元素包含14个电子,其电子排布式为1s2 2s2 2p6 3s2 3p2。
14. 磷元素(P,原子序数15)磷元素包含15个电子,其电子排布式为1s2 2s2 2p6 3s2 3p3。
15. 硫元素(S,原子序数16)硫元素包含16个电子,其电子排布式为1s2 2s2 2p6 3s2 3p4。
基态ti原子的价层电子排布图

基态ti原子的价层电子排布图
钛是一种常见的金属元素,其原子序数为22,原子量为47.867,在自然界中含量较丰富。
钛元素的价层电子排布图是钛原子的基态构型的表述。
以下是ti原子的基态构型和价层电子排布图:钛原子的基态构型为[Ar]3d2 4s2,它具有22个电子,电子排布如下:1s2 2s2 2p6 3s2 3p6 4s2 3d2,此时原子处于低能状态。
从基态Ti原子的价层电子排布图中可以看出,它共有8个价层,从外到内如下:s,p,d,f,s,p,d,f。
s层有2个电子,占外层的总电子数的25%;p层有6个电子,占外层的总电子数的75%;第二层有10个电子,占第二层总电子数的25%;第一层的电子数为8个,占第一层总电子数的100%。
由于Ti原子的价层电子排布图较为复杂,因此,可以运用简化的价层电子排布图来描述Ti原子的价层电子排布结构。
简化版的Ti原子价层电子排布图如下:外层2s2 2p6,内层3s2 3p6 3d2。
也就是说,外层由2个1s电子、2个2s电子和6个2p电子组成;内层由2个3s电子、6个3p电子和2个3d电子组成。
钛原子的价层电子排布图,直观地反映了Ti原子的价层电子结构,即外层由2个1s电子、2个2s电子和6个2p电子组成,内层由2个3s电子、6个3p电子和2个3d电子组成。
Ti原子的价层电子排布结构,可以帮助我们更清晰地了解Ti原子的原子构型,也可以帮助我们理解Ti原子的化学性质。
钛原子的价层电子排布图,不仅可以用于描述Ti原子的价层结
构,还可以用于研究Ti原子在物理和化学中的多种性质。
1-36号元素轨道图
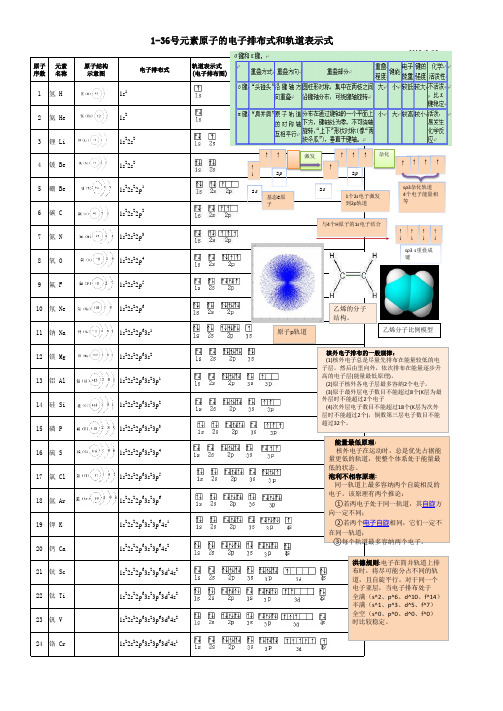
电子亚层,当电子排布处于
全满(s^2、p^6、d^10、f^14) 半满(s^1、p^3、d^5、f^7) 全空(s^0、p^0、d^0、f^0) 时比较稳定。
25 锰 Mn 26 铁 Fe 27 钴 Co 28 镍 Ni 29 铜 Cu 30 锌 Zn
1s22s22p63s23p63d54s2 1s22s22p63s23p63d64s2 1s22s22p63s23p63d74s2 1s22s22p63s23p63d84s2 1s22s22p63s23p63d104s1 1s22s22p63s23p63d104s2
小。电负性的大小可以作为
判断元素金属性和非金属性
强弱的尺度。金属的电负性
一般小于1.8,非金属的电负
性一般大于1.8,而位于非金
属三角区边界的“类金属”
Px S
Py
Pz
的电负性则在1.8左右,他们 既有金属性又有非金属性。
dxy
dxz
dyz
sp 杂化轨道
sp2 杂化轨道
sp3 杂化轨道
sp3d2 杂化轨道
。
。 ,
; ,
能量最低原理: 核外电子在运动时,总是优先占据能 量更低的轨道,使整个体系处于能量最 低的状态。 泡利不相容原理: 同一轨道上最多容纳两个自旋相反的 电子。该原理有两个推论:
①若两电子处于同一轨道,其自旋方 向一定不同;
②若两个电子自旋相同,它们一定不 在同一轨道;
③每个轨道最多容纳两个电子。
洪德规则:电子在简并轨道上排 布时,将尽可能分占不同的轨
⑶ 形成的杂化轨道之间应尽可能地满足最 小排斥原理(化学键间排斥力越小,体系越稳 定),为满足最小排斥原理, 杂化轨道之间的夹 角应达到最大。
价电子轨道排布式

周 期
原 子 序 数
元 素 名 称
元 素 符 号
质 子 数
K
L
电子层 M
1s 2s 2p 3s 3p
3d
4s 4p
N 4d
4f
5硼B
基态电子 排布式
1s2
2s2
2p1
5 基态电子 ↑↓ ↑↓ ↑ 轨道排布 式 1s 2s 2p
基态电子 排布式
1s2
2s2
2p2
6 碳 C 6 基态电子 ↑↓ ↑↓ ↑ ↑ 轨道排布 式 1s 2s 2p
式 1s 2s 2p 3s 3p
3d
4s
基态电子 排布式
1s2
2s2
2p6
3s2
3p6
3d2
4s2
22
钛
Ti
22
基态电子 轨道排布
式
↑↓ ↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓ ↑ 1s 2s 2p 3s 3p
↑
3d
↑↓
4s
4
基态电子 排布式
1s2
2s2
2p6
3s2
3p6
3d3
4s2
23 钒 V 23 基态电子 ↑↓ ↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓ ↑ ↑ ↑
元 素 符 号
质 子 数
K
L
电子层
M
N
1s 2s 2p 3s 3p
3d
4s 4p
4d
4f
基态电子 排布式
1s22s2
2p5
9 氟 F 9 基态电子 ↑↓↑↓↑↓↑↓ ↑ 轨道排布 式 1s 2s 2p
2
基态电子 排布式
1s22s2
2p6
10 氖 Ne 10 基态电子 ↑↓↑↓↑↓↑↓↑↓
价电子排布式
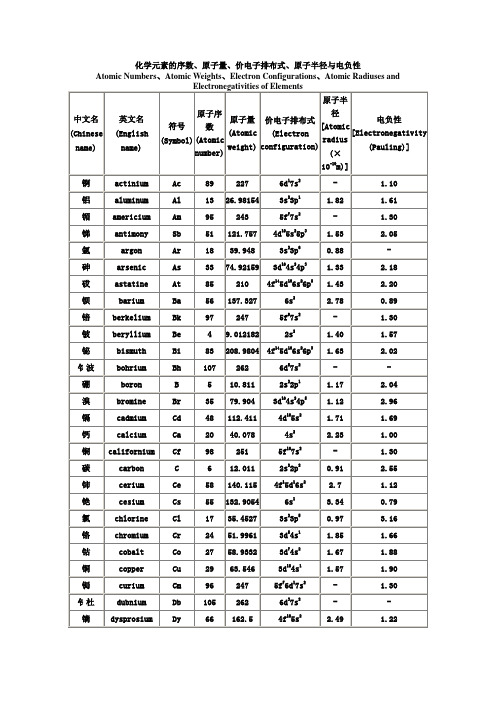
3.34
0.79
氯
chlorine
Cl
17
35.4527
3s23p5
0.97
3.16
铬
chromium
Cr
24
51.9961
3d54s1
1.85
1.66
钴
cobalt
Co
27
58.9332
3d74s2
1.67
1.88
铜
copper
Cu
29
63.546
3d104s1
1.57
1.90
锔
curium
Cm
96
247
5f76d17s2
-
1.30
钅杜
dubnium
Db
105
262
6d37s2
-
-
镝
dysprosium
Dy
66
162.5
4f105s2
2.49
1.22
锿
einsteinium
Es
99
252
5f117s2
-
1.30
铒
erbium
Er
68
167.26
4f126s2
2.45
1.24
铕
europium
Rb
37
85.4678
5s1
2.98
0.82
钌
ruthenium
Ru
44
101.07
4d75s1
1.89
2.20
钅卢
rutherfordium
Rf
104
261
6d27s2
-
-
价电子排布式
3d84s2
1.62
1.91
铌
niobium
Nb
41
92.90638
4d45s1
2.08
1.60
氮
nitrogen
N
7
14.00674
2s22p3
0.75
3.04
锘
nobelium
No
102
259
5f147s2
-
1.30
锇
osmium
Os
76
190.2
4f145d66s2
1.92
2.20
氧
oxygen
O
8
15.9994
2s22p4
0.65
3.44
钯
palladium
Pd
46
106.42
4d10
1.79
2.20
磷
phosphorus
P
15
30.97376
3s23p3
1.23
2.19
铂
platinum
Pt
78
195.08
4f145d96s1
1.83
2.28
钚
plutonium
Pu
94
244
2.45
1.24
铕
europium
Eu
63
151.965
4f76s2
2.56
1.20
镄
fermium
Fm
100
257
5f127s2
-
1.30
氟
fluorine
F
9
18.9984
2s22p5
化学元素的序数原子量价电子排布式原子半径与电负性

化学元素的序数原子量价电子排布式原子半径与电负性化学元素是构成物质的基本单位,每个元素都由具有特定原子序数和原子量的原子组成。
除了这些基本特性外,元素还具有其他特性,如原子的电子排布式、原子半径和电负性。
元素的序数(原子序数)是一个唯一的标识,用于区分不同的化学元素。
它表示一个元素中原子核中的质子数量,通常也表示该元素中的电子数量(由于元素的电中性)。
原子序数通常用字母Z表示。
原子量是一个元素的质量,通常以相对原子质量(原子质量单位)来衡量。
相对原子质量是采用标准碳(碳-12)的质量作为基准,相对于其质量进行比较的。
原子量通常以字母A表示。
价电子排布式指的是一个元素中最外层电子的排布方式。
外层电子决定了元素的化学性质和反应能力。
根据元素的位置和周期表的结构,我们可以确定元素的电子排布式。
例如,氧原子(O)有8个电子,其电子排布式为1s²2s²2p⁴,其中1s²代表了1s轨道上的2个电子,2s²代表了2s 轨道上的2个电子,2p⁴代表了2p轨道上的4个电子。
原子半径是一个元素原子的大小,通常以皮克米(pm)为单位。
原子半径是从原子核到其电子外壳的最外层电子的平均距离。
原子半径通常是根据元素在周期表中的位置和结构来确定的。
一般情况下,原子半径在周期表上从上到下递增,从左到右递减。
电负性是一个元素对电子吸引力的度量。
在共价化合物中,电负性差异决定了化学键的极性。
电负性通常用电负性值来表示,使用的是由极性分子中的与氢(H)结合的元素的实验电负性标度,即Pauling电负性标度。
Pauling电负性标度将氢元素的电负性定义为2.20。
元素的电负性数值通常是周期表上的趋势,从左下到右上递增。
要详细了解不同元素的序数、原子量、价电子排布式、原子半径和电负性,可参考化学相关教科书、周期表以及在线化学资料。
前三十六号元素价层电子排布式

前三十六号元素价层电子排布式
1.氢(H):氢元素只有一个电子,所以其电子排布式为:1s1
2.氦(He):氦元素有两个电子,所以其电子排布式为:1s2
3.锂(Li):锂元素有三个电子,所以其电子排布式为:1s22s1
4.氮(N):氮元素有七个电子,所以其电子排布式为:1s22s22p3
5.氧(O):氧元素有八个电子,所以其电子排布式为:1s22s22p4
6.氟(F):氟元素有九个电子,所以其电子排布式为:1s22s22p5
7.钠(Na):钠元素有十一个电子,所以其电子排布式为:
1s22s22p63s1
8.镁(Mg):镁元素有十二个电子,所以其电子排布式为:
1s22s22p63s2
9.硅(Si):硅元素有十四个电子,所以其电子排布式为:
1s22s22p63s23p2
10.磷(P):磷元素有十五个电子,所以其电子排布式为:
1s22s22p63s23p3
每个元素的电子排布式都可以根据元素的原子序数和轨道规则推导得出。
对于前三十六号元素来说,它们的电子填充遵循的规律是:1s轨道最多容纳2个电子,2s轨道最多容纳2个电子,2p轨道最多容纳6个电子,3s轨道最多容纳2个电子,3p轨道最多容纳6个电子。
基态 co原子的价电子排布式为

基态 co原子的价电子排布式为
Co原子的价电子排布式:
(1)最外层 (3s2 3p6 4s2 3d7 ):元素Co的原子价电子排布式最外层是
3s2 3p6 4s2 3d7,由此可知,Co元素的原子序数共27,据此可以判断出,Co元素的总电子数应为27,而Co元素原子的中子数是27,其原
子数则为27,原子量为58.94,表示元素Co是一种钴系元素,其原子
构造式为[Ar] 3d7 4s2。
(2)中层(5s2 5p6 6s2):上述最外层的组成元素,继而加上三个
5s2 5p6 6s2的价电子后,Co元素的电子数便增加到30。
由此可以知道,Co元素的外层电子可分作3s2 3p6 3d7 4s2和5s2 5p6 6s2两部分,即前
者是它所属元素族所具有的电子,而后者则是它所独有的电子。
(3)最内层(4d7 5p6 6s2):Co元素的原子价电子配置最内层为4d7
5p6 6s2,这就意味着Co元素内层由3d7 4s2 5s2 5p6 6s2六个价电子组成,可以看出内层有三个d轨道,几乎各占2个电子,加一个p轨道,及两个s轨道,总计三个轨道,占用24个电子。
所以,总的电子数为
30个,满足原子的最外层配置的要求。
总结:
Co原子的价电子排布式是:最外层(3s2 3p6 4s2 3d7) 中层(5s2 5p6 6s2)
最内层(4d7 5p6 6s2),此类原子的电子数为30,其原子数也是30,其原子构造式为[Ar] 3d7 4s2 5s2 5p6 6s2。
金的价层电子排布式

金的价层电子排布式金的外围电子层排布:5d10 6s1,核外电子排布:2-8-18-32-18-1 电子层:K-L-M-N-O-P金(Aurum)是一种金属元素,元素符号是Au,原子序数是79。
金的单质(游离态形式)通称黄金,是一种贵金属,很多世纪以来一直被用作货币、保值物及珠宝。
在自然界中,金以单质的形式出现于岩石中的金块或金粒、地下矿脉及冲积层中。
金亦是货币金属之一。
金在室温下为固体,密度高、柔软、光亮、抗腐蚀,是展性最好的金属,延性仅次于铂,是延展性最好的金属之一。
金是一种过渡金属,可形成+3和+1价化合物。
金化学性质不活泼,但可以被氯、氟、王水及氰化物腐蚀。
金能被汞溶解,形成金汞齐;能够溶解银的硝酸不能溶解金。
以上两个性质成为黄金精炼技术的基础,分别称为“加银分金法”(inquartation)及“金银分离法”(parting)。
化学性质金的化学性质稳定。
金常温或加热条件下都不与氧气反应,只有特殊工序才能制造氧化金;只能溶于王水,硒酸,高氯酸,氟王水(氢氟酸与浓硝酸混合物)等腐蚀性(氧化性)较强的物质中;金受热后可以在氟气中燃烧形成三氟化金,反应式为金的化合物:氯化金:AuCl3、氧化金:Au2O3(又称三氧化二金)(易形成络合物)、氢氧化金:Au(OH)3等相对原子质量:196.9665稳定同位素:Au-197所属周期:6所属族:IB外围电子层排布:5d10 6s1核外电子排布:2-8-18-32-18-1电子层:K-L-M-N-O-P常见化合价:+1,+3,0电负性:2.54电离能(kJ/mol):M - M+ 890.1M+ - M2+ 1980M2+ - M3+ 2900M3+ - M4+ 4200M4+ - M5+ 5600M5+ - M6+ 7000M6+ - M7+ 9300M7+ - M8+ 11000M8+ - M9+ 12800描述:赤黄色金属,质软,延展性强,晶体结构:晶胞为面心立方晶胞,每个晶胞含有4个金属原子。
元素周期表价层电子排布

元素周期表价层电子排布元素周期表是化学中最基础的工具之一,它按照元素的原子序数(即核中质子的数量)进行排列,并且将具有相似化学性质的元素放在同一列。
这对于理解元素的特性和化学反应非常重要。
元素的每一行被称为一个周期,而每一列则被称为一个族。
元素周期表的价层电子排布提供了有关元素化学性质的重要信息。
在元素周期表中,原子的核心结构由原子的质子和中子组成,其中质子位于原子核的中心,而中子则围绕核心。
原子的最外层电子称为价层电子,它们对于元素的化学性质和化学反应起着至关重要的作用。
价层电子的排布遵循一定的规则,其中最基本的规则是奥克塞尔规则(Aufbau principle)。
奥克塞尔规则是描述电子排布的一个重要原则,在描述电子排布的过程中,首先需要了解一些基本概念:1.壳层(或能级):原子中电子的主要能级或能层,它们以字母和数字的方式来表示。
在元素周期表中,第一周期元素的壳层为1s,第二周期元素的壳层为2s和2p,以此类推。
2.亚壳层(或亚能级):壳层中的能级细分为不同的亚壳层。
亚壳层用字母s、p、d、f等来表示,对应着有效量子数l=0,1,2,3等。
其中s亚壳层只能容纳2个电子,p亚壳层能容纳6个电子,d亚壳层能容纳10个电子,f亚壳层能容纳14个电子。
3.电子轨道:每个亚壳层可以分为不同的电子轨道,标记为s、p、d、f等。
轨道是描述单个电子可能出现的位置和动量矢量的数学函数。
根据奥克塞尔规则,元素的电子按照能级的顺序填充,每个能级先填充一个轨道,然后再填充另一个轨道,直到填满所有的轨道。
填充顺序按照以下规则进行:1.s轨道:首先填充s轨道。
s轨道只有一个轨道,最多容纳2个电子。
2. p轨道:接下来填充p轨道。
p轨道有3个轨道,分别是px、py和pz,每个轨道最多能容纳2个电子,因此p轨道总共可以容纳6个电子。
3.d轨道:再接下来填充d轨道。
d轨道有5个轨道,每个轨道最多能容纳2个电子,因此d轨道总共可以容纳10个电子。
原子电子排布式(全)
89
Ac [Rn]6d17s2
90
TH [Rs2
92
U [Rn]5f36d17s2
93
Np [Rn]5f46d17s2
94
Pu [Rn]5f67s2
95
Am [Rn]5f77s2
96
cm [Rn]5f76d17s2
23
V [Ar]3d34s2
24
Cr [Ar]3d54s1
106
Sg [Rn]5f146d47s2
107
Bh [Rn]5f146d57s2
108
Hs [Rn]5f146d67s2
109
Mt [Rn]5f146d77s2
110
Ds [Rn]5f146d87s2
111
Rg [Rn]5f146d107s1
112
Cn [Rn]5f146d107s2
说明: 1. 前四周期排布满足学习的排布规则(重点掌握)!
103
Lr [Rn]5f146d17s2
104
Rf [Rn]5f146d27s2
31
Ga [Ar]3d104s24p1
32
Ge [Ar]3d104s24p2
33
As [Ar]3d104s24p3
34
Se [Ar]3d104s24p4
35
Br [Ar]3d104s24p5
36
Kr [Ar]3d104s24p6
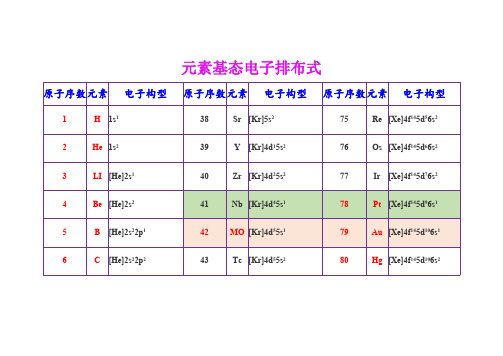
元素基态电子排布式
原子序数元素 电子构型 原子序数元素 电子构型 原子序数元素 电子构型
1
H 1s1
38
Sr [Kr]5s2
75
Re [Xe]4f145d56s2
2
He 1s2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
83.8 85.4678 87.62 88.90585 91.224 92.90638 95.94 98 101.07 102.9055 106.42 107.8682 112.411 114.82 118.71 121.757 127.6 126.9045 134.29 132.9054 137.327 138.9055 140.115 140.9077 144.24 145 150.36 151.965 157.25 158.9253 162.5 164.9303 167.26 168.9342 173.04 174.967 178.49 180.9479 183.85 186.207 190.2 192.22 195.08
Hale Waihona Puke 3d104s24p6 5s1 5s2 1 2 4d 5s 2 2 4d 5s 4d45s1 4d55s1 4d55s2 4d75s1 4d85s1 10 4d 4d105s1 4d105s2 4d105s25p1 4d105s25p2 4d105s25p3 4d105s25p4 4d105s25p5 2 6 5s 5p 6s1 6s2 1 2 5d 6s 4f15d16s2 4f36s2 4 2 4f 6s 4f56s2 4f66s2 7 2 4f 6s 4f75d16s2 4f96s2 10 2 4f 5s 4f116s2 12 2 4f 6s 13 2 4f 6s 4f146s2 4f145d16s2 4f145d26s2 4f145d36s2 4 2 5d 6s 14 5 2 5f 5d 6s 4f145d66s2 14 7 2 4f 5d 6s 14 9 1 4f 5d 6s
Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt
36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78
氪 铷 锶 钇 锆 铌 钼 锝 钌 铑 钯 银 镉 铟 锡 锑 碲 碘 氙 铯 钡 镧 铈 镨 钕 钷 钐 铕 钆 铽 镝 钬 铒 铥 镱 镥 铪 钽 钨 铼 锇 铱 铂
krypton rubidium strontium yttrium zirconium niobium molybdenum technetium ruthenium rhodium palladium silver cadmium indium tin antimony tellurium iodine xenon cesium barium lanthanum cerium praseodymium neodymium promethium samarium europium gadolinium terbium dysprosium holmium erbium thulium ytterbium lutetium hafnium tantalum tungsten rhenium osmium iridium platinum
1.03 2.98 2.45 2.27 2.16 2.08 2.01 1.95 1.89 1.83 1.79 1.75 1.71 2 1.72 1.53 1.42 1.32 1.24 3.34 2.78 2.74 2.7 2.67 2.64 2.62 2.59 2.56 2.54 2.51 2.49 2.47 2.45 2.42 2.4 2.25 2.16 2.09 2.02 1.97 1.92 1.87 1.83
2.54 2 2.04 2.33 2.02 2 2.2 0 0.7 0.9 1.1 1.3 1.5 1.38 1.36 1.28 1.3 1.3 1.3 1.3 1.3 1.3 1.3 1.3 -
金 汞 铊 铅 铋 钋 砹 氡 钫 镭 锕 钍 镤 铀 镎 钚 镅 锔 锫 锎 锿 镄 钔 锘 铹 钅卢 钅杜 钅喜 钅波 钅黑 钅麦
gold mercury thallium lead bismuth polonium astatine radon francium radium actinium thorium protactinium uranium neptunium plutonium americium curium berkelium californium einsteinium fermium mendelevium nobelium lawrencium rutherfordium dubnium seaborgium bohrium hassium meitnerium
1.79 1.76 2.08 1.81 1.63 1.53 1.43 1.34 -
性 ns、 电负性 [Electron egativity (Pauling) ] 2.2 0.98 1.57 2.04 2.55 3.04 3.44 3.98 0.93 1.31 1.61 1.9 2.19 2.58 3.16 0.82 1 1.36 1.54 1.63 1.66 1.55 1.83 1.88 1.91 1.9 1.65 1.81 2.01 2.18 2.55 2.96
4f145d106s1 4f145d106s2 4f145d106s26p1 14 10 2 2 4f 5d 6s 6p 14 10 2 3 4f 5d 6s 6p 4f145d106s26p4 4f145d106s26p5 4f145d106s26p6 7s1 7s2 1 2 6d 7s 6d27s2 5f26d17s2 5f36d17s2 5f46d17s2 5f67s2 5f77s2 5f76d17s2 9 2 5f 7s 5f107s2 5f117s2 12 2 5f 7s 5f137s2 5f147s2 14 1 2 5f 6d 7s 6d27s2 6d37s2 4 2 6d 7s 6d57s2 6d67s2 7 2 6d 7s
Au Hg Tl Pb Bi Po At Rn Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt
79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109
0.82 0.95 1.22 1.33 1.6 2.16 1.9 2.2 2.28 2.2 1.93 1.69 1.78 1.96 2.05 2.1 2.66 0 0.79 0.89 1.1 1.12 1.13 1.14 1.13 1.17 1.2 1.2 1.2 1.22 1.23 1.24 1.25 1.1 1.27 1.3 1.5 2.36 1.9 2.2 2.2 2.28
196.9665 200.59 204.3833 207.2 208.9804 209 210 222 223 226.0254 227 232.0381 213.0359 238.0289 237.0482 244 243 247 247 251 252 257 258 259 260 261 262 263 262 265 266
化学元素的序数、原子量、价电子排布式、原子半径与电负性 Atomic Numbers、Atomic Weights、Electron Configurations、 Atomic Radiuses and Electronegativities of Elements 中文名 (Chinese name) 氢 氦 锂 铍 硼 碳 氮 氧 氟 氖 钠 镁 铝 硅 磷 硫 氯 氩 钾 钙 钪 钛 钒 铬 锰 铁 钴 镍 铜 锌 镓 锗 砷 硒 溴 英文名 (English name) hydrogen helium lithium beryllium boron carbon nitrogen oxygen fluorine neon sodium magnesium aluminum silicon phosphorus sulfur chlorine argon potassium calcium scandium titanium vanadium chromium manganese iron cobalt nickel copper zinc gallium germanium arsenic selenium bromine 原子序数 符号 (Atomic (Symbol) number) H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 原子量 (Atomic weight) 1.00794 4.002602 6.941 9.012182 10.811 12.011 14.00674 15.9994 18.9984 20.1797 22.98977 24.305 26.98154 28.0855 30.97376 32.066 35.4527 39.948 39.0983 40.078 44.95591 47.88 50.9415 51.9961 54.93805 55.847 58.9332 58.6934 63.546 65.39 69.723 72.61 74.92159 78.96 79.904 原子半径 价电子排布式 [Atomic (Electron radius(× configuration) 10-10m)] 1s1 2 1s 1s22s1 2s2 2 1 2s 2p 2s22p2 2s22p3 2s22p4 2s22p5 2 6 2s 2p 3s1 3s2 2 1 3s 3p 2 2 3s 3p 3s23p3 2 4 3s 3p 3s23p5 3s23p6 4s1 4s2 3d14s2 3d24s2 3d34s2 5 1 3d 4s 3d54s2 3d64s2 3d74s2 3d84s2 3d104s1 3d104s2 3d104s24p1 3d104s24p2 3d104s24p3 10 2 4 3d 4s 4p 10 2 5 3d 4s 4p 0.79 0.49 2.05 1.4 1.17 0.91 0.75 0.65 0.57 0.51 2.23 1.72 1.82 1.46 1.23 1.09 0.97 0.88 2.77 2.23 2.09 2 1.92 1.85 1.79 1.72 1.67 1.62 1.57 1.53 1.81 1.52 1.33 2.55 1.12
