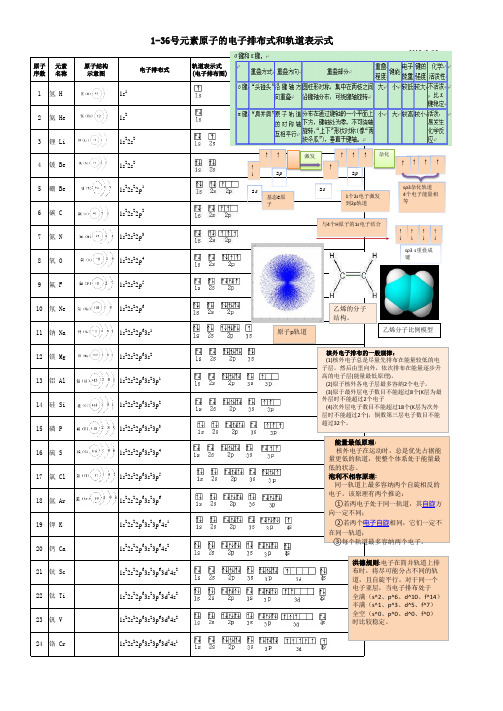
1--36号元素电子排布式与轨道表示式(完美版)
1-36号元素基态原子核外电子排布式

1-36号元素基态原子核外电子排布式元素的基态电子排布是指元素原子核外电子在基态时的分布。
基态是指电子在最低能级时的排布方式。
原子核外电子的排布方式决定了元素的性质和化学反应。
在排布原子核外电子时,需要遵循一些规则:1.泡利不相容原理:每个电子的量子态要不同,即不可能有两个电子具有完全相同的四个量子数。
2.需要按能级填充:电子会先填充能级较低的量子态。
3.每个能级最多填充一定数量的电子:对于s能级,最多填充2个电子;对于p能级,最多填充6个电子;对于d能级,最多填充10个电子;对于f能级,最多填充14个电子。
根据这些规则,我们来看一下1-36号元素基态原子核外电子的排布。
1.氢(H):1s^12.氦(He):1s^23.锂(Li):1s^22s^14.铍(Be):1s^22s^25.硼(B):1s^22s^22p^16.碳(C):1s^22s^22p^27.氮(N):1s^22s^22p^38.氧(O):1s^22s^22p^49.氟(F):1s^22s^22p^510.氖(Ne):1s^22s^22p^611.钠(Na):1s^22s^22p^63s^112.镁(Mg):1s^22s^22p^63s^213.铝(Al):1s^22s^22p^63s^23p^114.硅(Si):1s^22s^22p^63s^23p^215.磷(P):1s^22s^22p^63s^23p^316.硫(S):1s^22s^22p^63s^23p^417.氯(Cl):1s^22s^22p^63s^23p^518.钾(K):1s^22s^22p^63s^23p^64s^119.钙(Ca):1s^22s^22p^63s^23p^64s^220.钪(Sc):1s^22s^22p^63s^23p^64s^23d^121.钛(Ti):1s^22s^22p^63s^23p^64s^23d^222.钒(V):1s^22s^22p^63s^23p^64s^23d^323.铬(Cr):1s^22s^22p^63s^23p^64s^13d^524.锰(Mn):1s^22s^22p^63s^23p^64s^23d^525.铁(Fe):1s^22s^22p^63s^23p^64s^23d^626.钴(Co):1s^22s^22p^63s^23p^64s^23d^727.镍(Ni):1s^22s^22p^63s^23p^64s^23d^828.铜(Cu):1s^22s^22p^63s^23p^64s^13d^1029.锌(Zn):1s^22s^22p^63s^23p^64s^23d^1030.镓(Ga):1s^22s^22p^63s^23p^64s^23d^104p^131.锗(Ge):1s^22s^22p^63s^23p^64s^23d^104p^232.砷(As):1s^22s^22p^63s^23p^64s^23d^104p^333.锑(Sb):1s^22s^22p^63s^23p^64s^23d^104p^434.钸(Te):1s^22s^22p^63s^23p^64s^23d^104p^535.碘(I):1s^22s^22p^63s^23p^64s^23d^104p^65s^24d^105p^536.高锝(Xe):1s^22s^22p^63s^23p^64s^23d^104p^65s^24d^105p^66s^24f^145d^5以上是1-36号元素基态原子核外电子的排布方式。
前三十六号元素价层电子排布式

前三十六号元素价层电子排布式
1.氢(H):氢元素只有一个电子,所以其电子排布式为:1s1
2.氦(He):氦元素有两个电子,所以其电子排布式为:1s2
3.锂(Li):锂元素有三个电子,所以其电子排布式为:1s22s1
4.氮(N):氮元素有七个电子,所以其电子排布式为:1s22s22p3
5.氧(O):氧元素有八个电子,所以其电子排布式为:1s22s22p4
6.氟(F):氟元素有九个电子,所以其电子排布式为:1s22s22p5
7.钠(Na):钠元素有十一个电子,所以其电子排布式为:
1s22s22p63s1
8.镁(Mg):镁元素有十二个电子,所以其电子排布式为:
1s22s22p63s2
9.硅(Si):硅元素有十四个电子,所以其电子排布式为:
1s22s22p63s23p2
10.磷(P):磷元素有十五个电子,所以其电子排布式为:
1s22s22p63s23p3
每个元素的电子排布式都可以根据元素的原子序数和轨道规则推导得出。
对于前三十六号元素来说,它们的电子填充遵循的规律是:1s轨道最多容纳2个电子,2s轨道最多容纳2个电子,2p轨道最多容纳6个电子,3s轨道最多容纳2个电子,3p轨道最多容纳6个电子。
1-36号元素基态原子电子排布式

1-36号元素基态原子电子排布式1到36号元素的基态原子的电子排布式:1、H氢:1s12、He氦:1s23、Li锂:1s2 2s14、Be铍:1s2 2s25、B硼:1s2 2s2 2p17、N氮:1s2 2s2 2p38、O氧:1s2 2s2 2p49、F氟:1s2 2s2 2p510、Ne氖:1s2 2s2 2p611、Na钠:1s2 2s2 2p6 3s112、Mg镁:1s2 2s2 2p6 3s213、Al铝:1s2 2s2 2p6 3s2 3p114、Si硅:1s2 2s2 2p6 3s2 3p215、P磷:1s2 2s2 2p6 3s2 3p316、S硫:1s2 2s2 2p6 3s2 3p417、Cl氯:1s2 2s2 2p6 3s2 3p518、Ar氩:1s2 2s2 2p6 3s2 3p619、K钾:1s2 2s2 2p6 3s2 3p6 4s120、Ca钙:1s2 2s2 2p6 3s2 3p6 4s221、Sc钪:1s2 2s2 2p6 3s2 3p6 3d1 4s222、Ti钛:1s2 2s2 2p6 3s2 3p6 3d2 4s223、V 钒:1s2 2s2 2p6 3s2 3p6 3d3 4s224、Cr铬:1s2 2s2 2p6 3s2 3p6 3d5 4s125、Mn锰:1s2 2s2 2p6 3s2 3p6 3d5 4s226、Fe铁:1s2 2s2 2p6 3s2 3p6 3d6 4s227、Co钴:1s2 2s2 2p6 3s2 3p6 3d7 4s228、Ni镍:1s2 2s2 2p6 3s2 3p6 3d8 4s229、Cu铜:1s2 2s2 2p6 3s2 3p6 3d10 4s130、Zn锌:1s2 2s2 2p6 3s2 3p6 3d10 4s231、Ga镓:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p132、Ge锗:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p233、As砷:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p334、Se硒:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 25、Br溴:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 36、Kr氪:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6电子排布的规则1、构筑原理整个体系的能量越低越好。
1-36号元素电子排布式

1-36号元素电子排布式1号元素氢的电子排布式是:一个外层电子2s1,一个内层电子1s1,总电子数为1个。
2号元素氦的电子排布式是:三个外层电子2s2 2p1,一个内层电子1s2,总电子数为4个。
3号元素锂的电子排布式是:四个外层电子2s2 2p2,一个内层电子1s2,总电子数为7个。
4号元素硼的电子排布式是:五个外层电子2s2 2p3,一个内层电子1s2,总电子数为10个。
5号元素碳的电子排布式是:六个外层电子2s2 2p4,一个内层电子1s2,总电子数为14个。
6号元素氧的电子排布式是:七个外层电子2s2 2p3,一个内层电子1s2,总电子数为16个。
7号元素氟的电子排布式是:八个外层电子2s2 2p5,一个内层电子1s2,总电子数为17个。
8号元素氖的电子排布式是:九个外层电子2s2 2p6,一个内层电子1s2,总电子数为19个。
9号元素氧化氮的电子排布式是:十个外层电子2s2 2p5,一个内层电子1s2,总电子数为20个。
10号元素氧化磷的电子排布式是:十一个外层电子2s2 2p6,一个内层电子1s2,总电子数为22个。
11号元素钠的电子排布式是:十二个外层电子2s2 2p6 3s1,一个内层电子1s2,总电子数为23个。
12号元素镁的电子排布式是:十三个外层电子2s2 2p6 3s2,一个内层电子1s2,总电子数为25个。
13号元素铝的电子排布式是:十四个外层电子2s2 2p6 3s2 3p1,一个内层电子1s2,总电子数为27个。
14号元素硅的电子排布式是:十五个外层电子2s2 2p6 3s2 3p2,一个内层电子1s2,总电子数为28个。
15号元素磷的电子排布式是:十六个外层电子2s2 2p6 3s2 3p3,一个内层电子1s2,总电子数为31个。
16号元素硫的电子排布式是:十七个外层电子2s2 2p6 3s2 3p4,一个内层电子1s2,总电子数为34个。
17号元素氯的电子排布式是:十八个外层电子2s2 2p6 3s2 3p5,一个内层电子1s2,总电子数为36个。
136号元素电子排布图(精排版)

1~36号元素电子排布式依次如下:1、氢H 1s12、氦He 1s23、锂Li 1s2 2s14、铍Be 1s22s25、硼 B 1s2 2s2 2p16、碳 C 1s22s22p27、氮N 1s22s22p38、氧O 1s22s22p49、氟 F 1s22s22p510、氖Ne 1s22s22p611、钠Na 1s22s22p63s112、镁Mg 1s22s22p63s213、铝Al 1s22s22p63s23p114、硅Si 1s22s22p63s23p215、磷P 1s22s22p63s23p316、硫S 1s22s22p63s23p417、氯Cl 1s22s22p63s23p518、氩Ar 1s22s22p63s23p619 钾K 1s22s22p63s23p64s120、钙Ca 1s22s22p63s23p64s221、钪Sc 1s22s22p63s23p63d14s222、钛Ti 1s22s22p63s23p63d24s223、钒V 1s22s22p63s23p63d34s224、铬Cr 1s22s22p63s23p63d54s125、锰Mn 1s22s22p63s23p63d54s226、铁Fe 1s22s22p63s23p63d64s227、钴Co 1s22s22p63s23p63d74s228、镍Ni 1s22s22p63s23p63d84s229、铜Cu 1s22s22p63s23p63d104s130、锌Zn 1s22s22p63s23p63d104s231、镓Ga 1s22s22p63s23p63d104s24p132、锗Ge 1s22s22p63s23p63d104s24p233、砷As 1s22s22p63s23p63d104s24p334、硒Se 1s22s22p63s23p63d104s24p435、溴Br 1s22s22p63s23p63d104s24p536、氪Kr 1s22s22p63s23p63d104s24p6小结:相关规律1、基态原子最外层为1个电子的是第ⅠA族、Cu、Cr2、基态原子最外层为2个电子的是第ⅡA族、He、21号至30号(Cu和Cr除外)3、基态原子只有1个未成对电子的是第ⅠA族、第ⅢA族、第ⅦA族、Cr、Cu4、基态原子只有2个未成对电子的是第ⅣA族、第ⅥA族5、基态原子只有3个未成对电子的是第ⅤA族6、基态原子没有未成对电子的是第ⅡA族、0族7、基态原子未成对电子最多的是Cr(有6个未成对电子)。
1-36号元素轨道图
成键能力越强)sp<sp2<sp3<dsp2<sp3d<sp3d2
杂化轨道的特点: ①、所组成的几个杂化轨道具有相同的能量; ②、形成的杂化轨道数目等于原有的原子轨 道数目;③、杂化轨道的空间伸展方向一定 (亦即,杂化轨道的方向不是任意的,杂化 轨道之间有一定的夹角);④、杂化轨道的 成分:每个杂化轨道的成分之和为1;每个 参加杂化的原子轨道,在所有杂化轨道中的 成分之和为1(单位轨道的贡献)。
能量最低原理: 核外电子在运动时,总是优先占据能 量更低的轨道,使整个体系处于能量最 低的状态。 泡利不相容原理: 同一轨道上最多容纳两个自旋相反的 电子。该原理有两个推论:
①若两电子处于同一轨道,其自旋方 向一定不同;
②若两个电子自旋相同,它们一定不 在同一轨道;
③每个轨道最多容纳两个电子。
洪德规则:电子在简并轨道上排 布时,将尽可能分占不同的轨
原子p轨道
乙烯的分子 结构。
乙烯分子比例模型
核外电子排布的一般规律: (1)核外电子总是尽量先排布在能量较低的电 子层,然后由里向外,依次排布在能量逐步升 高的电子层(能量最低原理)。 (2)原子核外各电子层最多容纳2个电子。 (3)原于最外层电子数目不能超过8个(K层为最 外层时不能超过2个电子 (4)次外层电子数目不能超过18个(K层为次外 层时不能超过2个),倒数第三层电子数目不能 超过32个。
1-36号元素原子的电子排布式和轨道表示式
原子 元素 序数 名称
1~36号元素电子排布式、排布图

矿产资源开发利用方案编写内容要求及审查大纲
矿产资源开发利用方案编写内容要求及《矿产资源开发利用方案》审查大纲一、概述
㈠矿区位置、隶属关系和企业性质。
如为改扩建矿山, 应说明矿山现状、
特点及存在的主要问题。
㈡编制依据
(1简述项目前期工作进展情况及与有关方面对项目的意向性协议情况。
(2 列出开发利用方案编制所依据的主要基础性资料的名称。
如经储量管理部门认定的矿区地质勘探报告、选矿试验报告、加工利用试验报告、工程地质初评资料、矿区水文资料和供水资料等。
对改、扩建矿山应有生产实际资料, 如矿山总平面现状图、矿床开拓系统图、采场现状图和主要采选设备清单等。
二、矿产品需求现状和预测
㈠该矿产在国内需求情况和市场供应情况
1、矿产品现状及加工利用趋向。
2、国内近、远期的需求量及主要销向预测。
㈡产品价格分析
1、国内矿产品价格现状。
2、矿产品价格稳定性及变化趋势。
三、矿产资源概况
㈠矿区总体概况
1、矿区总体规划情况。
2、矿区矿产资源概况。
3、该设计与矿区总体开发的关系。
㈡该设计项目的资源概况
1、矿床地质及构造特征。
2、矿床开采技术条件及水文地质条件。
1-36号元素轨道表达式

原子的电子排布式可以说是每年高考必考的内容,但是考察内容一般都比较基础,只要大家熟记元素周期表中1-36号元素原子的电子排布式即可。
今天我就把它们的电子排布式整理如下:
1、1-9号元素原子的电子排布式
2、10-18号元素原子的电子排布式
3、19-27号元素原子的电子排布式
说明:
(1)根据原子的构造原理,原子核外的电子在充满4s轨道(能级层)后再填充3d轨道(能级层),所以K的电子排布式如上图所示。
(2)根据洪特规则可知,等价轨道在全充满、半充满和全空时最稳定,所以Cr、Mn的电子排布式如上图所示,它们的3d轨道处于半充满状态。
4、28-36号元素原子的电子排布式
说明:根据洪特规则可知,等价轨道在全充满、半充满和全空时最稳定,所以Cu、Zn的电子排布式如上图所示,它们的3d轨道处于全充满状态。
