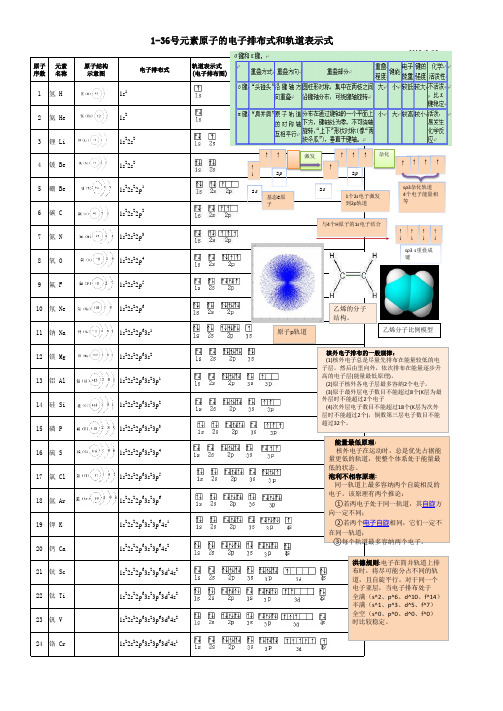
1~36号元素电子排布图
1~36号元素电子排布图(精排版)

.1~36号元素电子排布式依次如下:1、氢H 1s12、氦He 1s23、锂Li 1s2 2s14、铍Be 1s22s25、硼 B 1s2 2s2 2p16、碳 C 1s22s22p27、氮N 1s22s22p38、氧O 1s22s22p49、氟 F 1s22s22p510、氖Ne 1s22s22p611、钠Na 1s22s22p63s112、镁Mg 1s22s22p63s213、铝Al 1s22s22p63s23p114、硅Si 1s22s22p63s23p215、磷P 1s22s22p63s23p316、硫S 1s22s22p63s23p417、氯Cl 1s22s22p63s23p518、氩Ar 1s22s22p63s23p619 钾K 1s22s22p63s23p64s120、钙Ca 1s22s22p63s23p64s221、钪Sc 1s22s22p63s23p63d14s222、钛Ti 1s22s22p63s23p63d24s223、钒V 1s22s22p63s23p63d34s224、铬Cr 1s22s22p63s23p63d54s125、锰Mn 1s22s22p63s23p63d54s226、铁Fe 1s22s22p63s23p63d64s227、钴Co 1s22s22p63s23p63d74s228、镍Ni 1s22s22p63s23p63d84s229、铜Cu 1s22s22p63s23p63d104s130、锌Zn 1s22s22p63s23p63d104s231、镓Ga 1s22s22p63s23p63d104s24p132、锗Ge 1s22s22p63s23p63d104s24p233、砷As 1s22s22p63s23p63d104s24p334、硒Se 1s22s22p63s23p63d104s24p435、溴Br 1s22s22p63s23p63d104s24p536、氪Kr 1s22s22p63s23p63d104s24p6小结:相关规律1、基态原子最外层为1个电子的是第ⅠA族、Cu、Cr2、基态原子最外层为2个电子的是第ⅡA族、He、21号至30号(Cu和Cr除外)3、基态原子只有1个未成对电子的是第ⅠA族、第ⅢA族、第ⅦA族、Cr、Cu4、基态原子只有2个未成对电子的是第ⅣA族、第ⅥA族5、基态原子只有3个未成对电子的是第ⅤA族6、基态原子没有未成对电子的是第ⅡA族、0族7、基态原子未成对电子最多的是Cr(有6个未成对电子)如有侵权请联系告知删除,感谢你们的配合!如有侵权请联系告知删除,感谢你们的配合!。
1、1~36号元素电子排布式、排布图

1、1~36号元素电子排布式、排布图编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(1、1~36号元素电子排布式、排布图)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为1、1~36号元素电子排布式、排布图的全部内容。
【1——36号元素电子排布式】氢:1s1氦:1s2锂:1s22s1铍:1s22s2硼:1s22s22p1碳:1s22s22p2氮:1s22s22p3氧:1s22s22p4氟:1s22s22p5氖:1s22s22p6钠:1s22s22p63s1镁:1s22s22p63s2铝:1s22s22p63s23p1硅:1s22s22p63s23p2磷:1s22s22p63s23p3硫:1s22s22p63s23p4氯:1s22s22p63s23p5氩:1s22s22p63s23p6钾:1s22s22p63s23p64s1钙:1s22s22p63s23p64s2钪:1s22s22p63s23p63d14s2钛:1s22s22p63s23p63d24s2矾:1s22s22p63s23p63d34s2铬:1s22s22p63s23p63d54s1锰:1s22s22p63s23p63d54s2铁:1s22s22p63s23p63d64s2钴:1s22s22p63s23p63d74s2镍:1s22s22p63s23p63d84s2铜:1s22s22p63s23p63d104s1锌:1s22s22p63s23p63d104s2镓:1s22s22p63s23p63d104s24p1锗:1s22s22p63s23p63d104s24p2 砷:1s22s22p63s23p63d104s24p3 硒:1s22s22p63s23p63d104s24p4溴:1s22s22p63s23p63d104s24p5氪:1s22s22p63s23p63d104s24p61——36号元素轨道排布图氢:氦:锂:铍:硼:碳:氮:氧:氟:氖:钠:镁:铝:硅:磷:硫:氯:氩:钾:钙:钪:钛:矾:铬:锰:铁:钴:镍:铜:锌:镓:锗:砷:硒:溴:氪:。
1-36号元素基态原子电子排布式

1-36号元素基态原子电子排布式1到36号元素的基态原子的电子排布式:1、H氢:1s12、He氦:1s23、Li锂:1s2 2s14、Be铍:1s2 2s25、B硼:1s2 2s2 2p17、N氮:1s2 2s2 2p38、O氧:1s2 2s2 2p49、F氟:1s2 2s2 2p510、Ne氖:1s2 2s2 2p611、Na钠:1s2 2s2 2p6 3s112、Mg镁:1s2 2s2 2p6 3s213、Al铝:1s2 2s2 2p6 3s2 3p114、Si硅:1s2 2s2 2p6 3s2 3p215、P磷:1s2 2s2 2p6 3s2 3p316、S硫:1s2 2s2 2p6 3s2 3p417、Cl氯:1s2 2s2 2p6 3s2 3p518、Ar氩:1s2 2s2 2p6 3s2 3p619、K钾:1s2 2s2 2p6 3s2 3p6 4s120、Ca钙:1s2 2s2 2p6 3s2 3p6 4s221、Sc钪:1s2 2s2 2p6 3s2 3p6 3d1 4s222、Ti钛:1s2 2s2 2p6 3s2 3p6 3d2 4s223、V 钒:1s2 2s2 2p6 3s2 3p6 3d3 4s224、Cr铬:1s2 2s2 2p6 3s2 3p6 3d5 4s125、Mn锰:1s2 2s2 2p6 3s2 3p6 3d5 4s226、Fe铁:1s2 2s2 2p6 3s2 3p6 3d6 4s227、Co钴:1s2 2s2 2p6 3s2 3p6 3d7 4s228、Ni镍:1s2 2s2 2p6 3s2 3p6 3d8 4s229、Cu铜:1s2 2s2 2p6 3s2 3p6 3d10 4s130、Zn锌:1s2 2s2 2p6 3s2 3p6 3d10 4s231、Ga镓:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p132、Ge锗:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p233、As砷:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p334、Se硒:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 25、Br溴:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 36、Kr氪:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6电子排布的规则1、构筑原理整个体系的能量越低越好。
1-36号元素价层电子排布式

1-36号元素价层电子排布式原子是由质子、中子和电子组成的,价层电子就是指位于外层能级的电子。
元素的原子结构是通过原子轨道理论来描述的,其中每个原子轨道可以容纳一对电子。
元素的价层电子排布式是指元素的电子在不同的轨道上的分布情况。
在元素周期表中,元素的价层电子排布式可以通过元素的原子序数进行预测。
原子序数表示原子的质子数,也就是元素的核中所含有的质子数。
根据元素的原子序数,可以确定元素的电子配置,即元素的价层电子排布式。
以下是1-36号元素价层电子排布式的详细说明:1.氢(H):氢原子只有一个电子,它在1s轨道上。
2.氦(He):氦原子有两个电子,它们分别在1s轨道上。
3.锂(Li):锂原子有三个电子,其中两个在1s轨道上,另一个在2s轨道上。
4.铍(Be):铍原子有四个电子,两个在1s轨道上,另外两个在2s轨道上。
5.硼(B):硼原子有五个电子,两个在1s轨道上,另外三个在2s和2p轨道上。
6.碳(C):碳原子有六个电子,两个在1s轨道上,另外四个在2s和2p轨道上。
7.氮(N):氮原子有七个电子,两个在1s轨道上,另外五个在2s和2p轨道上。
8.氧(O):氧原子有八个电子,两个在1s轨道上,另外六个在2s 和2p轨道上。
9.氟(F):氟原子有九个电子,两个在1s轨道上,另外七个在2s 和2p轨道上。
10.氖(Ne):氖原子有十个电子,两个在1s轨道上,另外八个在2s和2p轨道上。
依此类推,可以通过元素的原子序数确定元素的电子排布式。
元素的电子排布式对于了解元素的化学行为非常重要,它决定了元素的价电子数和能级结构。
通过电子排布式,可以推测元素的化学性质、反应性和化学键的形成方式。
总结起来,元素的价层电子排布式是通过元素的原子序数来确定的,它描述了元素的电子在不同轨道上的分布情况。
对于了解元素的化学行为和性质非常重要。
1~36号元素电子排布图(精排版)-li电子排布图

1~36号元素电子排布式依次如下: 1、氢H 1s12、氦He 1s23、锂Li 1s2 2s14、铍Be 1s22s25、硼 B 1s2 2s2 2p16、碳 C 1s22s22p27、氮N 1s22s22p38、氧O 1s22s22p49、氟 F 1s22s22p510、氖Ne 1s22s22p611、钠Na 1s22s22p63s112、镁Mg 1s22s22p63s213、铝Al 1s22s22p63s23p114、硅Si 1s22s22p63s23p215、磷P 1s22s22p63s23p316、硫S 1s22s22p63s23p417、氯Cl 1s22s22p63s23p518、氩Ar 1s22s22p63s23p619 钾K 1s22s22p63s23p64s120、钙Ca 1s22s22p63s23p64s221、钪Sc 1s22s22p63s23p63d14s222、钛Ti 1s22s22p63s23p63d24s223、钒V 1s22s22p63s23p63d34s224、铬Cr 1s22s22p63s23p63d54s125、锰Mn 1s22s22p63s23p63d54s226、铁Fe 1s22s22p63s23p63d64s227、钴Co 1s22s22p63s23p63d74s228、镍Ni 1s22s22p63s23p63d84s229、铜Cu 1s22s22p63s23p63d104s130、锌Zn 1s22s22p63s23p63d104s231、镓Ga 1s22s22p63s23p63d104s24p132、锗Ge 1s22s22p63s23p63d104s24p233、砷As 1s22s22p63s23p63d104s24p334、硒Se 1s22s22p63s23p63d104s24p435、溴Br 1s22s22p63s23p63d104s24p536、氪Kr 1s22s22p63s23p63d104s24p6小结:相关规律1、基态原子最外层为1个电子的是第ⅠA族、Cu、Cr2、基态原子最外层为2个电子的是第ⅡA族、He、21号至30号(Cu和Cr除外)3、基态原子只有1个未成对电子的是第ⅠA族、第ⅢA族、第ⅦA族、Cr、Cu4、基态原子只有2个未成对电子的是第ⅣA族、第ⅥA族5、基态原子只有3个未成对电子的是第ⅤA族6、基态原子没有未成对电子的是第ⅡA族、0族7、基态原子未成对电子最多的是Cr(有6个未成对电子)。
1~36号元素电子排布图(精排版)-li电子排布图

1~36号元素电子排布式依次如下: 1、氢H 1s12、氦He 1s23、锂Li 1s2 2s14、铍Be 1s22s25、硼 B 1s2 2s2 2p16、碳 C 1s22s22p27、氮N 1s22s22p38、氧O 1s22s22p49、氟 F 1s22s22p510、氖Ne 1s22s22p611、钠Na 1s22s22p63s112、镁Mg 1s22s22p63s213、铝Al 1s22s22p63s23p114、硅Si 1s22s22p63s23p215、磷P 1s22s22p63s23p316、硫S 1s22s22p63s23p417、氯Cl 1s22s22p63s23p518、氩Ar 1s22s22p63s23p619 钾K 1s22s22p63s23p64s120、钙Ca 1s22s22p63s23p64s221、钪Sc 1s22s22p63s23p63d14s222、钛Ti 1s22s22p63s23p63d24s223、钒V 1s22s22p63s23p63d34s224、铬Cr 1s22s22p63s23p63d54s125、锰Mn 1s22s22p63s23p63d54s226、铁Fe 1s22s22p63s23p63d64s227、钴Co 1s22s22p63s23p63d74s228、镍Ni 1s22s22p63s23p63d84s229、铜Cu 1s22s22p63s23p63d104s130、锌Zn 1s22s22p63s23p63d104s231、镓Ga 1s22s22p63s23p63d104s24p132、锗Ge 1s22s22p63s23p63d104s24p233、砷As 1s22s22p63s23p63d104s24p334、硒Se 1s22s22p63s23p63d104s24p435、溴Br 1s22s22p63s23p63d104s24p536、氪Kr 1s22s22p63s23p63d104s24p6小结:相关规律1、基态原子最外层为1个电子的是第ⅠA族、Cu、Cr2、基态原子最外层为2个电子的是第ⅡA族、He、21号至30号(Cu和Cr除外)3、基态原子只有1个未成对电子的是第ⅠA族、第ⅢA族、第ⅦA族、Cr、Cu4、基态原子只有2个未成对电子的是第ⅣA族、第ⅥA族5、基态原子只有3个未成对电子的是第ⅤA族6、基态原子没有未成对电子的是第ⅡA族、0族7、基态原子未成对电子最多的是Cr(有6个未成对电子)。
1-36号元素轨道图
成键能力越强)sp<sp2<sp3<dsp2<sp3d<sp3d2
杂化轨道的特点: ①、所组成的几个杂化轨道具有相同的能量; ②、形成的杂化轨道数目等于原有的原子轨 道数目;③、杂化轨道的空间伸展方向一定 (亦即,杂化轨道的方向不是任意的,杂化 轨道之间有一定的夹角);④、杂化轨道的 成分:每个杂化轨道的成分之和为1;每个 参加杂化的原子轨道,在所有杂化轨道中的 成分之和为1(单位轨道的贡献)。
能量最低原理: 核外电子在运动时,总是优先占据能 量更低的轨道,使整个体系处于能量最 低的状态。 泡利不相容原理: 同一轨道上最多容纳两个自旋相反的 电子。该原理有两个推论:
①若两电子处于同一轨道,其自旋方 向一定不同;
②若两个电子自旋相同,它们一定不 在同一轨道;
③每个轨道最多容纳两个电子。
洪德规则:电子在简并轨道上排 布时,将尽可能分占不同的轨
原子p轨道
乙烯的分子 结构。
乙烯分子比例模型
核外电子排布的一般规律: (1)核外电子总是尽量先排布在能量较低的电 子层,然后由里向外,依次排布在能量逐步升 高的电子层(能量最低原理)。 (2)原子核外各电子层最多容纳2个电子。 (3)原于最外层电子数目不能超过8个(K层为最 外层时不能超过2个电子 (4)次外层电子数目不能超过18个(K层为次外 层时不能超过2个),倒数第三层电子数目不能 超过32个。
1-36号元素原子的电子排布式和轨道表示式
原子 元素 序数 名称
1到36号元素核外电子排布式

1到36号元素核外电子排布式1.氢元素(H):1s12.氦元素(He):1s23.锂元素(Li):1s22s14.铍元素(Be):1s22s25.硼元素(B):1s22s22p16.碳元素(C):1s22s22p27.氮元素(N):1s22s22p38.氧元素(O):1s22s22p49.氟元素(F):1s22s22p510.氖元素(Ne): 1s22s22p611.钠元素(Na): 1s22s22p63s1 12.镁元素(Mg): 1s22s22p63s2 13.铝元素(Al): 1s22s22p63s23p1 14.硅元素(Si): 1s22s22p63s23p2 15.磷元素(P): 1s22s22p63s23p3 16.硫元素(S): 1s22s22p63s23p4 17.氯元素(Cl): 1s22s22p63s23p5 18.阳元素(Ar): 1s22s22p63s23p6 19.钾元素(K):1s22s22p63s23p64s1 20.钙元素(Ca):1s22s22p63s23p64s2 21.钪元素(Sc):1s22s22p63s23p64s23d1 22.钛元素(Ti):1s22s22p63s23p64s23d2 23.钒元素(V):1s22s22p63s23p64s23d3 24.铬元素(Cr):1s22s22p63s23p64s13d5 25.锰元素(Mn):1s22s22p63s23p64s23d5 26.铁元素(Fe):1s22s22p63s23p64s23d6 27.钴元素(Co):1s22s22p63s23p64s23d7 28.镍元素(Ni):1s22s22p63s23p64s23d829.铜元素(Cu):1s22s22p63s23p64s23d1030.锌元素(Zn):1s22s22p63s23p64s23d1031.镓元素(Ga):1s22s22p63s23p64s23d104p132.锗元素(Ge):1s22s22p63s23p64s23d104p233.砷元素(As):1s22s22p63s23p64s23d104p334.锑元素(Sb):1s22s22p63s23p64s23d104p435.钍元素(Te):1s22s22p63s23p64s23d104p536.氩元素(Kr):1s22s22p63s23p64s23d104p6这是1到36号元素的核外电子排布式,从氢到氩,我们可以看到,电子首先填充到1s轨道,然后是2s轨道,接着是2p轨道,依此类推。
