南农考研专用化学课件
南京农业大学生物化学课件10

一、 酶的概念
Most Enzymes Are Proteins
With the exception of a small group of catalytic RNA molecules, all enzymes are proteins. Their catalytic activity depends on the integrity of their native protein conformation. If an enzyme is denatured or dissociated into its subunits, catalytic activity is usually lost. If an enzyme is broken down into its component amino acids, its catalytic activity is always destroyed. Thus the primary, secondary, tertiary, and quaternary structures of protein enzymes are essential to their catalytic activity.
二、 酶的特性
2. 酶不共同于一般催化剂的特征
❖ 酶对环境条件极为敏感 ❖ 酶活性可以调控
三、酶的专一性的类型
酶催化的专一性(specificity)是指酶对它所催化的 反应及其底物具有的严格的选择性。通常一种酶只能 催化一种或一类化学反应。
由酶对底物选择的严格程度,可将酶的专一性分为多 种类型:
The sweet taste of freshly picked corn (maize) is due to the high level of sugar in the kernels. Storebought corn (several days after picking) is not as sweet, because about 50% of the free sugar is converted to starch within one day of picking. To preserve the sweetness of fresh corn, the husked ears can be immersed in boiling water for a few minutes (“blanched”) then cooled in cold water. Corn processed in this way and stored in a freezer maintains its sweetness. What is the biochemical basis for this procedure?
南京农业大学无机化学第9章 分子结构 ppt课件

18
PPT课件
第一节
第九章
离子构型与结合力的大小为:8e<(9-17)e<18e或 (18+2)e。因此,离子的电子层构型对化合物的性质有 一定的影响。例如碱金属和铜分族,它们最外层只有1 个ns电子,都能形成+1价离子,如K+、Ag+,它们的电 荷相同,半径接近,但K+为8电子构型,而Ag+为18电
rNa 230 133 97pm
rCl 278 97 181pm
目前最常用的离子半径是1927年由鲍林(Pauling) 从核电荷数和屏蔽常数出发推算出的一套数据,半径 计算公式为:
13
PPT课件
第一节
第九章
r cn
Z 式中Z为核电荷数,σ为屏蔽常数,Z-σ为有效核电数,cn为取决 于最外电子层的主量子数n的一个常数。
如果近似地将离子看作球体,两个距离为r,带有
相反电荷Z+和Z-的离子间的吸引势能V吸引为:
V吸引
z z e2
4 0 r
2
PPT课件
第一节
第九章
式中ε0为介电常数,e为1个电子所带电量。相反电荷的 离子之间,除静电引力外,还存在外层电子之间以及
[化学课件]南京农业大学生物化学课件(2)
![[化学课件]南京农业大学生物化学课件(2)](https://img.taocdn.com/s3/m/5b9860fb08a1284ac850438e.png)
一. 氧化磷酸化的机理 重要
目前这两方面都获得了一些实验证据,例如能携 带质子穿过线粒体内膜的物质(如2,4-二硝基苯酚 )可破坏线粒体内膜对质子的透性壁垒,使质子电化 学梯度消失。
另外根据测算,膜间隙的pH较内膜低1.4个单位 ,并且线粒体内膜两侧原有的外正内负跨膜电位升高 。
F1-F0-ATPase复合物
一. 氧化磷酸化的机理
二. 氧化磷酸化的P/O比
P/O(磷氧比):在生物氧化过程中,伴随 ADP磷酸化所消耗的无机磷酸的磷原子数与消 耗的分子氧的氧原子数之比。即每消耗1个氧 原子所产生的ATP的分子数。
测定结果表明:
二. 氧化磷酸化的P/O比
NADH经呼吸链完全氧化时,P/O为 3,即1分子的 NADH通过呼吸链将电子最终传递给O2可产生 3 个ATP;
一. 氧化磷酸化的机理
1941年Fritz Lipmann引入“高能磷酸键 (~P)” 的概念。1949年美国生化学家Eugene Kennedy和 Albert Lehninger发现线粒体含有三羧酸循环和呼吸 链所需要的全部酶系统,并且发现生物氧化与ADP磷 酸化相偶联构成了氧化磷酸化。但是,NADH的氧化 和电子传递过程是如何与ADP磷酸化生成ATP反应偶 联起来一直不清楚。
节Oxidativephosphorylation
一. 氧化磷酸化的机理
?What is oxidative phosphorylation
氧化磷酸化(oxidative phosphorylation) 是指细胞内伴随有机物氧化,利用生物氧化 过程中释放的自由能,促使ADP与无机磷酸 结合生成ATP的过程。
Chemiosmotic hypothesis—key points 电子传递体在线粒体内膜上有着不对称分布,传氢
南京农业大学有机化学专业课考研复习课件有机实验2-+第二章+有机化学实验的基本操作

南京农业⼤学有机化学专业课考研复习课件有机实验2-+第⼆章+有机化学实验的基本操作第⼆章有机化学实验的基本操作2.1 加热与冷却⽅法2.1.1 加热⽅法在实验过程中,为了提⾼反应速度,经常要对反应体系加热。
另外,在分离、提纯化合物以及测定化合物的⼀些物理常数时,也常常需要加热。
实验室常⽤的热源有煤⽓灯、酒精灯、电炉、电热套等。
必须注意,玻璃仪器⼀般不能⽤⽕焰直接加热。
因为剧烈的温度变化和加热不均匀会造成玻璃仪器的损坏。
同时,由于局部过热,还可能引起有机化合物的部分分解。
为了避免直接加热可能带来的弊端,实验室中常常根据具体情况应⽤以下不同的间接加热⽅式。
(1)⽯棉⽹加热把⽯棉⽹放在三脚架或铁圈上,⽤煤⽓灯或酒精灯在下⾯加热,⽯棉⽹上的烧瓶与⽯棉⽹之间应留有空隙,以避免由于局部过热引起化合物分解。
加热低沸点化合物或减压蒸馏时不能⽤这种加热⽅式。
(2)⽔浴当所加热的温度在80℃以下时,可选⽤⽔浴加热。
将容器浸⼊装有⽔的⽔浴中(注意:勿将容器触及⽔浴底部),⼩⼼加热保持所需的温度。
对于像⼄醚等低沸点易燃溶剂,不能⽤明⽕加热,应⽤预先加热好的⽔浴加热。
若需要加热到100℃时,可⽤沸⽔浴或⽔蒸⽓浴。
(3)油浴在100℃~250℃之间加热可选择油浴,在油浴中放⼀⽀温度计,可以通过控制热源来控制油浴温度。
⽤明⽕加热油浴应当⼗分谨慎,避免发⽣油浴燃烧事故。
油浴所能达到的最⾼温度取决于所⽤油的种类。
液体⽯蜡可加热到220℃,温度过⾼不易分解但容易燃烧。
固体⽯蜡也可以加热到220℃,由于它在室温时是固体,所以加热完毕后,应先取出浸在油浴中的容器。
⽢油和邻苯⼆甲酸⼆丁酯适⽤于加热到140℃~150℃,温度过⾼则容易分解。
植物油如菜油、蓖⿇油和花⽣油,可以加热到220℃,常在植物油中加⼊1%的对苯⼆酚等抗氧剂,以增加它们在受热时的稳定性。
硅油和真空泵油在250℃以上仍较稳定,是理想的浴油,但价格较⾼。
(4)砂浴加热温度在⼏百度以上要使⽤砂浴。
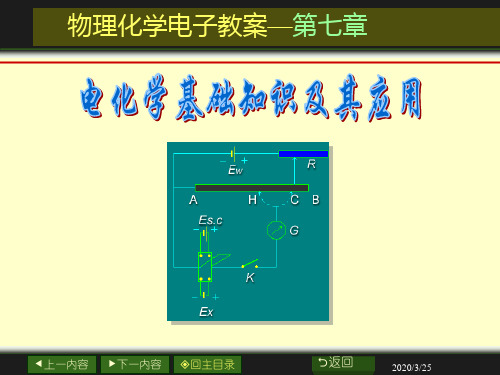
南农 化工原理 07章电化学基础知识及其应用.ppt
上一内容 下一内容 回主目录
返回
2020/3/25
金属-溶液界面电势差
上一内容 下一内容 回主目录
返回
2020/3/25
电池电动势的产生
2.液接电势
用 扩散表示。是由两种不同的电解质溶液间或
同种电解质不同浓度溶液间界面上产生的电势 差。
3.接触电势 当两种不同的金属相接触时,相互逸入的电子数 目不相等,在接触界面上就形成双电层,由此而 产生的电势差称为接触电势。
rGm (1) 2EF
E2
E$
RT F
ln aa
E1 E2
rGm (2) EF rGm (1) 2rGm (2)
E1$
RT 2F
ln K1$
E2$
RT F
ln
K
$ 2
K1$
(
K
$ 2
)2
上一内容 下一内容 回主目录
返回
2020/3/25
(4)电动势与各热力学量
dG SdT Vdp
G T p
物理化学电子教案—第七章
上一内容 下一内容 回主目录
返回
2020/3/25
7-1 可逆电池和电池符号
可逆电池
上一内容 下一内容 回主目录
返回
2020/3/25
电池符号
1. 左边为负极,起氧化作用;右边为正极, 起还原作用。 2.“|”表示相界面,有电势差存在。
3.“||”表示盐桥,使液接电势降到可以忽略不计。
上一内容 下一内容 回主目录
返回
2020/3/25
4.电池的电动势
() Cu' | Zn | ZnSO4 (a1) | CuSO4 | Cu()
E Cu / Zn + + 扩散 + +
南京农业大学考研-生物化学复习课件-糖酵解

二. 糖酵解的过程
EMP的两个阶段 第一阶段 五步反应 磷酸丙糖生成阶段
耗能阶段 第二阶段 五步反应 丙酮酸生成阶段
产能阶段
EMP途径代号式
二. 糖酵解的过程
G G6P F6P FBP
第一阶段 第二阶段
G3P DHAP 1,3-BPG
3PG 2PG PEP Pyr
二. 糖酵解的过程
第一步:葡萄糖的磷酸化
6-磷酸果糖
ATP
ADP
磷酸果糖激酶
H2COPO32CO
HO CH HC OH HC OH H2CO-PO32-
1,6-二磷酸果糖
磷酸果糖激酶(PFK)是EMP途径的关键酶,其活性 大小控制着整个途径的进程。
二. 糖酵解的过程
碳链不变,但两头接上了磷 酸基团,为断裂作好准备。
消耗两个ATP。
第四步:1,6-二磷酸果糖的裂解
第二节 糖酵解
一. 糖酵解的概念
指葡萄糖通过一系列步骤降解成三碳 化合物(丙酮酸)的过程。
糖酵解途径又称EMP途径。 (Embden-Meyerhof-Parnas 途径)
部位:细胞质
二. 糖酵解的过程
葡萄糖(G) EMP 丙酮酸 彻底氧化 CO2+H2O
O2不足
乳酸(动物) 乙醇(微生物) 其它
H2COPO32-
磷酸甘油酸激酶
1,3-二磷酸甘油酸
COOH HC OH H2COPO32-
3-磷酸甘油酸
底物水平磷酸化:高能化学底物直接将磷酸基团ADP, 使ADP磷酸化形成ATP的过程。
糖酵解过程中第一次产生 ATP。
第二阶段
二. 糖酵解的过程
醛氧化称羧酸 NAD+还原成NADH 糖酵解中第一次产生ATP
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
0.0592 [Cu 2 ] E lg 2 [ Zn 2 ]
能斯特方程
电极反应可写成通式:
氧化态+ne ƒ 还原态
T = 298K时
0.0592 c(氧化态) = + lg n c(还原态)
Θ
电对的标准电极电势
相对值
强度性质-其大小反映物质得失电子的倾向,与电极 反应的写法和参与电极反应的物质量无关。
在酸度保持为0.30 mol· L-1的溶液中含有一定数量的 Cd2+ 离子,当通入H2S气体达到饱和时,Cd2+ 离子 能否沉淀完全?已知CdS的KspӨ = 1.40 10-29 。
K (H2 S ) 1.310 , K (H2 S ) 7.110
a1 7 a2 15
3. 在0.10 mol· L-1 ZnCl2 溶液中用H2S饱和(0.10 mol· L-1) 。试计算为防止ZnS沉淀所需的 c(H+)。( 0.96
B. [Cu(NH3)4]2+
D. [Fe(CN)6]3-
3. 在[FeF6]3+ 配离子,中心离子Fe3+采取________
杂化,形成______轨型配合物,空间构型为
_________;在[Fe(CN)6]3-配离子中,中心离子
Fe3+采取________杂化,形成______轨型配合物,
空间构型为__________;[FeF6]3+的稳定性
如果原电池化学反应在非标准态下进行则
r Gm nFE nF ( )
r Gm r Gm RT ln Q
电极电势的应用
1.物质氧化还原性能的比较
2.计算原电池的电动势
3.判断氧化还原反应进行的方向
4.判断氧化还原反应进行快慢的次序
5.计算平衡常数 6.反应实质相同电对的标准电极电势之间的关系
• 已知 Ag
/ Ag
0.799V , AgCl 0.2223 V , / Ag Ag ( NH
3 )2
/ Ag
xV
求反应AgCl=Ag++Cl-的平衡常数既
Ksp ( AgCl )
以及反应Ag++2NH3=Ag(NH3)2+的平衡常数既
K [ Ag ( NH ) f 3 2 ]
7 15 mol· L-1 ) ) Ksp (ZnS 2.931025 , Ka ( H S ) 1.3 10 , K ( H S ) 7.1 10 1 2 a2 2
•
瓷水槽里沉积的红棕色Fe(OH)3常用H2C2O4溶液洗
1.2 10 ) Fe涤除去。计算下列反应的平衡常数。( (OH )3 (s) 3H2C2O4 (aq) [Fe(C2O4 )3 ]3 (aq) 3 H2× O 37 H (aq)
c0 (M) / c K (MY) 10 ,
6
f
c0 (N) / c K (NY) 10 ,
6
f
c0 (M) / c K (MY) c0 (N) / c K (N Y)
f f
10
5
金属指示剂-作用原理、使用条件、选择原则
A. EDTA标准溶液直接配位滴定金属离子,终点颜色为何?
避光、摇晃 酸度适当 测Cl-用荧光黄 测其它阴离子可用曙红
典型问题剖析
1. KspӨ (AgCl) = 1.81010,AgCl在0.001mol· L-1 NaCl 溶液中的溶解度(mol· L-1) ( )
A. 1.81010 C. 0.001 • B. 1.34105 D. 1.8107
8. 先将1L浓度为0.6mol· L-1氨水和1L浓度为0.06 mol· L-1
NiSO4溶液混合,然后再加入1L浓度为0.6 mol· L-1乙
二胺,并使其充分混合。试求反应达到平衡时,
[Ni(NH3)6]2+ 和[Ni(en)3]2+的浓度以及NH3和乙二胺的
浓度比。已知:KΘf([Ni(en)3]2+)= 1.9 × 1018,
化学专题
无机及分析化学部分(中)
第七章-沉淀溶解平衡
知识点
溶度积( K sp )与溶解度(S/mol•L-1)之间的关 系(换算)
AmBn ( s) ƒ mAn+ (aq) nBm- (aq)
溶度积规则-判断沉淀溶解平衡移动的法则 影响沉淀平衡的因素-酸度、氧化/还原剂、配位 剂、其它沉淀剂(多重平衡)
________ [Fe(CN)6]3-的稳定性。
4. 将50 mL 0.20 mol/L AgNO3 溶液和50 mL 6.0 mol/L 氨水溶液混合后,加入0.50 mL 2.0 mol/L KI溶液,问是否有AgI沉淀生成? • 溶液中Cl 的浓度和Ag+ 的浓度均为0.010 mol/L , 问溶液中NH3的初始浓度至少应控制为多少才能 防止AgCl沉淀析出。(0.79 mol· L-1)
(砖红色) Ag+ + SCN- = AgSCN↓ Fe3+ + SCN- = Fe(SCN)2+ Ag+ + X- = AgX↓ 余同上 Ag+
佛尔 哈德 法
铁氨矾
NH4Fe(SO4)2
X-=Cl-、Br-、 I-、SCN-
法扬 司法
吸附 指示剂
Ag+ + X- = AgX↓
X-=Cl-、Br-、 I-、SCN也可测定Ag+
E电池
E电池 Cu 2 / Cu Zn2 / Zn 0.0592 0.0592 2 lg[Cu 2 ]) ( Zn lg[ Zn ]) 2 / Zn 2 2 2 0.0592 [ Cu ] (Cu ) lg 2 / Cu Zn 2 / Zn 2 [ Zn 2 ]
Θ lg K (MY) lg Kf (MY) lg (M) lg (Y) Θ f
Θ lg K (MY) lg Kf (MY) lg Y(H) Θ f
配位滴定曲线及其影响因素
10 pM´
8
6
4
2 0 100 200
滴定百分数
10 pM´ 8 6 4
20
100 滴定百分数
KΘf([Ni(NH3)6]2+)= 9.1 × 107
9. 在pH=4.0的溶液中,用碘量法定量测定Cu2+含
量时,样品中杂质Fe3+干扰,可加入NH4F使生
成[FeF6]3-以掩蔽之。若Fe3+有99.999%已转化为
[FeF6]3-,计算溶液中加入NH4F的总浓度。
(Kfθ(FeF63-)=1.0×1016,Kaθ(HF)=1.8×10-4)
提高配位滴定选择性的方法-酸度控制、掩蔽法、
解蔽法
a)配位滴定允许的最低酸度和最高酸度
b)配位滴定的适宜酸度范围
c)酸效应曲线
典型问题剖析
1. 配位化合物[Co(NH3)4Cl2]Cl的磁矩为0,则中心离
子采取的杂化轨道类型为 ,名称
是
,配位原子是
。
2. 下列配离子中属于逆磁性的是:
A. [Mn(CN)6]4C. [Co(CN)6]3-
5. 某溶液中含有Ca2+和Ba2+,浓度均为0.1 mol·L-1 ,
向溶液中加入Na2SO4固体,问:
• 哪种离子先沉淀?
• 刚有沉淀出现时SO42-的浓度多大?
• 能否用此方法分离Ca2+和Ba2+?
Ksp (BaSO4 ) 1.11010 , Ksp (CaSO4 ) 4.9 105
Zn2+ + 2e - = Zn
2Zn2+ + 4e - = 2Zn Zn = Zn2+ + 2e
= -0.763V
= -0.763V = -0.763V
26
电化学与热力学的关系
如果原电池化学反应在标准态下进行则
r Gm nFE nF ( )
r Gm r Gm RT ln Q
200
单一离子被准确滴定的条件
Θ (MY) 106 c0 (M)/ cΘ Kf
lgc0(M) · K’(MY)≥6.0 当c0(M) = 0.01mol· L-1时:
Θ (MY) 108 Kf
lg KfΘ (MY) 8
多种离子能否被分步准确滴定的条件:
以M和N离子为例,分析各种条件下的滴定反应?
• 等体积混合0.30 mol/L NH3、0.30 mol/L NaCN和
0.030 mol/L AgNO3,计算混合溶液中[Ag(NH3)2]+、
[Ag(CN)2]、NH3、CN 的平衡浓度。
7 21 K [ Ag ( NH ) ] 1.6 10 , K [ Ag ( CN ) ] 1.3 10 f 3 2 f 2
第八章-配位化合物
知识点
配合物的组成和命名 配合物价键理论(内/外轨型)、磁性和空间构型 配位离解平衡及其影响因素 螯合物(稳定性的原因、形成条件)
第八章-配位滴定法
知识点 EDTA的性质及其配合物特点
配合物的条件稳定常数
Θ f
M+Y
垐 噲
MY
Θ lg K (MY) lg Kf (MY) lgα (MY) lgα (M) lgα (Y)
• 已知二甲酚橙在pH值小于6.3时为黄色,而在pH值大于6.3
时为红色, pb2+与二甲酚橙形成配合物为红色,而滴定 pb2+的最高酸度pH=3.2,最低酸度pH=7.2。若选用二甲酚 橙为指示剂,则用EDTA滴定pb2+的适宜酸度范围是( 3.2~7.2 ?;3.2 ~ 6.3?;6.3 ~ 7.2? )
