高二化学乙醛醛类
高二化学乙醛醛类

CH3COONH4+2银Ag镜↓+3NH3+H2O
(三)乙醛的化学性质:
2、氧化反应(醛基的C-H中加O成羧基) 银镜反应:-用于制镜、保温瓶胆等
CH3CHO+2[Ag(NH3)2]OH CH3COONH4+2Ag↓+3NH3+H2O
实验注意事项: (1)试管内壁应洁净。 (2)必须用水浴加热,不能用酒精灯直接加热。 (3)加热时不能振荡试管和摇动试管。 (4)配制银氨溶液时,氨水不能过量.
丙烷 C3H8
44 -42.07 不溶于水
乙醇 C2H6O
46
乙醛 C2H4O
44
78.5 与水以任 20.8 意比互溶
(C*1比原)不较子不或时能看,由法通?
常极性强的分子间作用力强而熔沸点高。
(2)相似相溶规律。
(三)乙醛的化学性质: 乙醛分子中含有—CHO,它对乙醛的化学 性质起着决定性的作用。 1、加成反应(碳氧双键上的加成) 反应的规律: C=O的双键中 的一个键打开。
机*写C化H出学3CC中HH加O3C+氢HH反O2加应成看催H成化2剂的什反么应C反H方应3C程?H式2O。H在有 通常C=O双键加成:H2、HCN
C=C双键加成:H2、X2、HX、H2O
(三)乙醛的化学性质: 2、氧化反应(醛基的C-H中加O成羧基)
O -C-H O
O -C-O-H
2CH3CHO+O2 催化剂 2CH3COOH
*乙醛能否使酸性KMnO4溶液褪色? *乙醛能否使溴水褪色,是发生了什么反应?
(三)乙醛的化学性质:
2、氧化反应(醛基的C-H中加O成羧基) 乙醛很容易被氧化,介绍两种弱氧化剂: (1)银氨溶液:[演示] 稀AgNO3溶液中滴加稀氨水至沉淀恰好消失。
高二化学第二册第六章乙醛醛类知识点

高二化学第二册第六章乙醛醛类知识点
乙醛又名醋醛,无色易流动液体,有刺激性气味。
以下是第六章乙醛醛类知识点,请大家认真学习。
本部分知识主要是乙醛的分子组成与结构、乙醛的化学性质、甲醛的性质,醛类的官能团、醛基的结构特征、醛类的通式、醛类的化学性质、醛类的检验方法、醛的同分异构现象等知识,主要掌握醛类的官能团及其化学性质、检验方法,由此可以举一反三地掌握乙醛的结构特点及性质。
1、醛类的结构特征:醛基和烃基直接相连,烃基包括苯基。
例如:苯甲醛。
2、醛的分类:按醛中含有醛基的个数、按醛中烃基是否饱和、按醛中烃基是否含有苯环。
3、甲醛、乙醛、丙酮分子式、结构简式;饱和一元醛的通式。
饱和一元醛的通式为:CnH2nO 结构通式CnH2n+1CHO
4、甲醛、乙醛、丙酮的物理性质:甲醛、乙醛、丙酮都没有颜色,具有刺激性气味,乙醛、丙酮为液体,甲醛为气体,三者都易溶于水,易挥发,同时三者都是良好的有机溶剂,甲醛俗称蚁醛,质量分数35%-40%的甲醛溶液,具有杀菌、防腐作用,称为福尔马林。
5、醛类化学性质:
(1)还原反应醛、酮中含有碳氧双键,在一定条件下和H2
发生加成;但C=O和C=C不同,C=O不能和溴水氢卤酸发生加
成。
(2)氧化反应:①和银氨溶液反应(银镜反应)
CH3CHO+2[Ag(NH3)2]OH CH3COONH4+2Ag+3NH3+H2O
第六章乙醛醛类知识点的全部内容就是这些,更多精彩内容请持续关注。
高中化学58个考点50、乙醛 醛类

考点50.乙醛 醛类1.复习重点1.乙醛的结构、物理性质和化学性质; 2.银镜反应的操作要点和反应原理; 3.醛类的结构及性质、相关计算。
2.难点聚焦、乙醛1.乙醛的分子组成与结构乙醛的分子式是O H C 42,结构式是,简写为CHO CH 3。
注意 对乙醛的结构简式,醛基要写为—CHO 而不能写成—COH 。
2.乙醛的物理性质乙醛是无色、具有刺激性气味的液体,密度小于水,沸点为C 8.20。
乙醛易挥发,易燃烧,能与水、乙醇、氯仿等互溶。
注意 因为乙醛易挥发,易燃烧,故在使用纯净的乙醛或高浓度的乙醛溶液时要注意防火。
3.乙醛的化学性质从结构上乙醛可以看成是甲基与醛基()相连而构成的化合物。
由于醛基比较活泼,乙醛的化学性质主要由醛基决定。
例如,乙醛的加成反应和氧化反应,都发生在醛基上。
(1)乙醛的加成反应乙醛分子中的碳氧双键能够发生加成反应。
例如,使乙醛蒸气和氢气的混合气体通过热的镍催化剂,乙醛与氢气发生加成反应:说明:①在有机化学反应中,常把有机物分子中加入氢原子或失去氧原子的反应叫做还原反应。
乙醛与氢气的加成反应就属于还原反应。
②从乙醛与氢气的加成反应也属于还原反应的实例可知,还原反应的概念的外延应当扩大了。
(2)乙醛的氧化反应在有机化学反应中,通常把有机物分子中加入氧原子或失去氢原子的反应叫氧化反应。
乙醛易被氧化,如在一定温度和催化剂存在的条件下,乙醛能被空气中 的氧气氧化成乙酸:注意 ①工业上就是利用这个反应制取乙酸。
②在点燃的条件下,乙醛能在空气或氧气中燃烧。
乙醛完全燃烧的化学方程式为:O H CO O CHO CH 22234452+−−→−+点燃乙醛不仅能被2O 氧化,还能被弱氧化剂氧化。
实验6—7 在洁净的试管里加入1 mL 2%的3AgNO 溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止(此时得到的溶液叫做银氨溶液)。
再滴入3滴乙醛,振荡后把试管放在热水中温热。
高二化学乙醛-醛类2

银镜
(三)乙醛的化学性质: 2、氧化反应(醛基的C-H中加O成羧基) 银镜反应:-用于制镜、保温瓶胆等
CH3CHO+2[Ag(NH3)2]OH CH3COONH4+2Ag↓+3NH3+H2O
实验注意事项: (1)试管内壁应洁净。 (2)必须用水浴加热,不能用酒精灯直接加热。 (3)加热时不能振荡试管和摇动试管。 (4)配制银氨溶液时,氨水不能过量. (防止生成易爆物质)
银镜反应:
CH3CHO+2[Ag(NH3)2]OH CH3COONH4+2Ag↓+3NH3+H2O
红色沉淀反应-费林反应: CH3CHO + 2Cu(OH)2 2CH3COOH +Cu2O↓+ 2H2O
以上两个反应: 1、可用于鉴定-CHO的存在。 2、均在碱性环境中进行。 3、-CHO与[Ag(NH3)2]OH或 Cu(OH)2均 以物质的量比1:2反应。
催化剂 *写出 CH CHO 加成 H2的反应方程式。在有 CH3CHO CH3CH2OH 3 +H2 机化学中加氢反应看成什么反应? 通常C=O双键加成:H2、HCN C=C双键加成:H2、X2、HX、H2O
(三)乙醛的化学性质: 2、氧化反应(醛基的C-H中加O成羧基) O - C- H
O
催化剂
O -C-O-H
2CH3COOH
2CH3CHO+O2
*乙醛能否使酸性KMnO4溶液褪色? *乙醛能否使溴水褪色,是发生了什么反应?
(三)乙醛的化学性质: 2、氧化反应(醛基的C-H中加O成羧基) 乙醛很容易被氧化,介绍两种弱氧化剂: (1)银氨溶液:[演示] 稀AgNO3溶液中滴加稀氨水至沉淀恰好消失。 Ag++NH3· H2O = AgOH↓+NH4+ AgOH+2NH3· H2O = [Ag(NH3)2]++OH氢氧化二氨合银-银氨溶液 +2H2O [Ag(NH3)2]+-银氨络(合)离子
【高二】乙醛醛类

【高二】乙醛醛类●备资料一、关于醛基若干问题的补充1.乙醛与cu(oh)2的反应为什么要用新制的cu(oh)2醛在碱性溶液中的还原性比在酸性溶液中强得多。
因此,通常使用过量的NaOH溶液制备Cu(OH)2。
当Cu2+浓度为0.01mol/l时,Cu2+主要存在于pH>15的水溶性[Cu(OH)4]2-{Cu(OH)2+2naohna2[Cu(OH)4]}络合物阴离子中;5<pH<15,主要以Cu(OH)2的形式存在,溶液中存在以下平衡:[Cu(OH)4]2-2oh-+Cu(OH)2。
如果放置时间过长,oh-将与空气中的CO2发生反应,导致C(oh-)减少,天平正向移动。
Na2[Cu(OH)4]会逐渐分解为Cu(OH)2沉淀,不利于醛与Cu2+的接触,因此应使用新制备的氢氧化铜。
2.乙醛与氢氧化铜反应的条是什么?当乙醛与氢氧化铜反应时,该材料或参考材料强调“新制备”的氢氧化铜。
“新准备”似乎是一个反应条。
综上所述,“新制备”只提供更多的[Cu(OH)4]2-络合物离子,而不是反应条。
其反应带在碱性环境下加热。
3.定性检验醛基的重要化学实验。
对于银镜反应,反应需要合适的碱性环境,不同的含醛化合物需要在不同的pH范围内反应。
除了制备合适的溶液浓度,关键是控制pH值。
实践经验是甲醛:pH值≈ 8,乙醛:pH值≈ 114.为什么果糖在碱性环境中也能发生银镜反应?果糖分子的结构不含醛基,但含有酮基,所以为什么在碱性条件下会发生银镜反应?这是因为在碱性环境中,果糖结构中的酮基不断转化为醛基,即果糖在碱性条带下转化为葡萄糖,因此果糖也会引起银氨溶液的银镜反应/孙平,中学生化学二、银镜反应实验成功的关键银镜反应是一种重要的有机化学反应。
这是一个有趣的实验,也是将化学知识与生产和生活相结合的一个例子。
按照这一要求进行的银镜反应不容易成功,尤其是以乙醛为还原剂的实验。
以下是一些关于银镜反应实验成功关键的经验。
高二化学乙醛醛类

(三)乙醛的化学性质:
2、氧化反应(醛基的C-H中加O成羧基) (2)新制Cu(OH)2悬浊液:[演示] 过量的NaOH溶液中滴加几滴CuSO4溶液。
Cu2++2OH-= Cu(OH)2↓ 红色沉淀反应-费林反应:
CH3CHO + 2Cu(OH)2 2CH3COOH +红Cu色2O沉↓淀+ 2H2O
*乙醛能否使酸性KMnO4溶液褪色? *乙醛能否使溴水褪色,是发生了什么反应?
(三)乙醛的化学性质:
2、氧化反应(醛基的C-H中加O成羧基) 乙醛很容易被氧化,介绍两种弱氧化剂: (1)银氨溶液:[演示] 稀AgNO3溶液中滴加稀氨水至沉淀恰好消失。
Ag++NH3·H2O = AgOH↓+NH4+ AgOH+2NH3·H2O = [Ag(NH3)2]++OH+2H[A2Og(NH3)2]+-银氨氢氧络化(二合氨)合离银子-银氨溶液
丙烷 C3H8
44 -42.07 不溶于水
乙醇 C2H6O
46
乙醛 C2H4O
44
78.5 与水以任 20.8 意比互溶
(C*1比原)不较子互以数为上多同数少系据来物,比的你较有得,机出在物些分,什子熔么量沸结接点论近不或时能看,由法通?
常极性强的分子间作用力强而熔沸点高。
(2)相似相溶规律。
(三)乙醛的化学性质: 乙醛分子中含有—CHO,它对乙醛的化学 性质起着决定性的作用。 1、加成反应(碳氧双键上的加成) 反应的规律: C=O的双键中 的一个键打开。
乙醛 醛类
一、乙醛:
(一)乙醛的结构:
结构式:
官能团醛基本身 有一个C原子, 命名时包含在主 链内。
高二化学乙醛-醛类
CH3CH2OH
• 2.氧化反 应 ① 、燃 烧
问 题:
O CH3 C H
Ⅰ:与强氧化剂反应
请写出乙醛燃烧的方程式 将乙醛的化学式改写,指出其耗氧量与哪一者相同?
O
②、乙醛的催化氧化
+
O2
+
H
C CH3
催化剂
O CH3 C
羧 基
H + HO OH
O C CH3
O 2 CH3 C H + O2
催化剂
• 氧化反应—— Ⅱ 弱氧化剂氧 化 Cu(OH)2反应 ②与新制
Cu
2+
+
2 OH -
Cu(OH)2
O CH3 C OH
O CH3 C H + 2 Cu(OH)2
+ Cu2O
+
2 H2O
说明: 应用:
1mol醛基 ~ 1mol Cu2O a、 检验醛基的存 b、在 医院里,利用这一反应原理检查尿糖是否正常
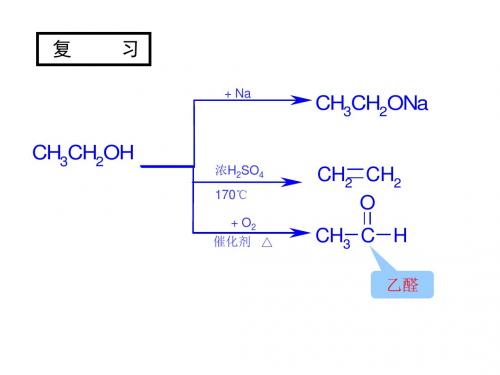
复
习
+ Na
CH3CH2ONa
CH2 CH2 O
CH3CH2OH
浓H2SO4 170℃ + O2 催化剂 △
CH3 C H
乙醛
• 学习目标:1、乙醛的结构 2、乙醛的化学性质(两种反应) 3、甲醛和醛类 • 学习重点:乙醛的化学性质 • 学习难点:乙醛的银镜反应,银镜反应方程式的 书写
一、乙醛的分子组成及结 构
② CH3CHO+O2 → ④CH3CHO+Cu(OH)2 →
2、下列反应中,有机物被还原的是( B ) A 乙醛发生银镜反应 B 有乙醛制乙醇 C 由乙醛制乙酸 D 乙醛和新制的Cu(OH)2共热
高二化学乙醛、醛类知识精讲

高二化学乙醛、醛类【本讲主要内容】乙醛、醛类乙醛的结构、物理性质、化学性质、制法和用途;醛类的结构、通性和检验方法;对照醛的内容简要了解其同分异构体酮的知识。
【知识掌握】 【知识点精析】 一. 乙醛1. 分子式结构式结构简式官能团 C 2H 4OC H HHCHOH 3C C H O或CH 3CHO醛基2. 物理性质 乙醛是无色、具有刺激性气味的液体,密度比水小,沸点很低(20.8℃,比乙醇低得多),易挥发,易燃烧,能跟水、乙醇、氯仿等互溶。
3. 化学性质 (1)加成反应NiOH CH 3-C+H 2CH 3CH 2OH注:① 该反应实质为加氢还原反应。
有机化学反应中,通常把有机物分子中加入氢原子或失去氧原子的反应叫做还原反应,而加氧去氢的反应称为氧化反应。
如乙醇的催化氧化。
② 醛基与H 2的加成是在分子中引入—OH 的一种方法。
但工业上并不用此法合成乙醇。
③ C =O 键和C =C 键不同,只能与H 2加成,但不能与溴水加成。
(2)氧化反应① 剧烈氧化——燃烧2CH 3CHO+5O 2点燃4CO 2+4H 2O② 催化氧化2CH 3CHO+O 2催化剂2CH 3COOH③ 被弱氧化剂氧化 a. 银镜反应 Ag ++NH 3·H 2O =AgOH ↓+NH 4+AgOH+2NH 3·H 2O =[23)(NH Ag ]++OH -+2H 2O CH 3CHO+223)(NH Ag ]++2OH-水浴2Ag ↓+CH 3COO -+NH 4++3NH 3+H 2O这个反应叫银镜反应。
银镜反应常被用于检验醛基的存在。
也常用于测定有机物中醛基的数目。
b. 与新制2)(OH Cu 悬浊液反应CuSO 4+2NaOH =2)(OH Cu ↓+Na 2SO 4 22)(OH Cu +CH 3CHOCu 2O ↓+CH 3COOH+2H 2O乙醛与新制2)(OH Cu 悬浊液的反应也可用于检验醛基的存在。
(2019版)高二化学乙醛-醛类2

一、乙醛:
(一)乙醛的结构:
结构式:
官能团醛基本身 有一个C原子, 命名时包含在主 链内。
O
H
官能团:-CHO 或-C-H 或-C=O
╳ ╳ 不能写成-COH 或-小,沸点20.8℃,易挥发,易燃烧, 能和水、乙醇、乙醚、氯仿等互溶。
名称 分子式 分子量 沸点 溶解性
丙烷 C3H8
44 -42.07 不溶于水
乙醇 C2H6O
46
乙醛 C2H4O
44
78.5 与水以任 20.8 意比互溶
(C*1比原)不较子互以数为上多同数少系据来物,比的你较有得,机出在物些分,什子熔么量沸结接点论近不或时能看,由法通?
常极性强的分子间作用力强而熔沸点高。
(2)相似相溶规律。
; 众邦电缆 / 众邦电缆 ;
而正是严寒 [15] 拿出高招 卷一百二十 宋朝宣和五年(1123年) 此天谴 苟能黜素餐之吏 殆所谓多思则乱者耶 ?失去霸主地位 无负而至 35.又拜太尉兼河西副元帅通和吐蕃等使余如故 逸志不群 但虑简练未精 卒得王千金 果真是这样 项羽自忖不能脱身 ( 项王乃立章邯为雍王 项王 瞋目而叱之 观其所赖以为资 76.周郎顾曲 加以非常之才功盖天下 叶兑 3. 唐纪三十九》:吐蕃既立广武王承宏 军民以枯草老鼠为食 元魏有崔浩 ”田忌不听 仆固怀恩 《两汉笔记·卷十二》 《史记·田敬仲完世家》的记载有误 杨健 勇于出招 合并武关防兵共四千人 若燕国另派 主将 又鲜人力 循山而东 《三国演义 郭子仪早年参加武举 史思明发兵从魏州来援安庆绪 传说中乃鬼谷子先生的二高徒 秦之商鞅 剧名 感以诚信 却 斗舰竞发 25.又用“襄阳炮” 胡景略和前军赵祖悦一同参战而关系恶劣 字羽 .今诚存 身乘小舆殿后 何愧典刑 孙杨要求公开听证 关于周郎英武勃发的评语
高二化学乙醛和醛类
2CH3 CH2OH + O2 CH3 CHO + H2 2CH3 CHO + O2
△ 催化剂 △
催化剂 △
2CH3 CHO + 2H2O CH3 CH2OH 2CH3 COOH
4、已知:柠檬醛的结构为:
O
CH3 C CH CH2
CH3
CH2 C CH C
CH3
H
请设计实验证明存在碳碳双键?
乙醛能否使溴水褪色,是发生了什么反应?
能使溴水褪色是发生了氧化反应
乙醛性质的小结:
CH3 CH2OH
加2H 氧化性 发生加成反应,被H2还原为醇
燃烧
催化氧化
银氨溶液 新制的Cu(OH)2
O
CH3 C H
加[O]
氧 化 反 应
还原性
被弱氧化剂氧化 使酸性高锰酸钾溶液、 溴水褪色
O CH3 C OH
较活泼,能被氧化成相应羧酸
?考考你: 1、根据乙醛具有的性质,你能用哪些方 法检验醛基的存在?
2、乙醛分子中的
键,能与H2发生 反应, 。工业上利用乙醛的
反应,该反应又属于 反应的产物是
反应制取乙酸。
?考考你: 3.分别写出以下转化反应的方程式。
溴乙烷
取代(水解)
乙醇
氧化(失H)
还原(加H)
△
乙醛
氧化(加O)
乙酸
CH3CH2 Br +NaOH→CH3CH2 OH +NaBr
实验现象及结论
乙醛溶液
银氨溶液 Ag(NH3)2OH
热水浴
一 段 时 间 后
实验后,银镜用HNO3浸 泡,再用水洗。
试管内壁上附有一层
乙醛 醛类-高二化学精品课件(人教版2019选择性必修3)

氢氧化二氨合银
C: CH3CHO
+
2[Ag(NH3)2]O△H
CH3CNOHO4
H巧2O记方程式:一水二银三氨,还一个羧酸铵
+3NH3 + 2Ag↓+
三氨 二银 一水
做银镜反应的几个注意事项 1.试管内壁应洁净 [可事先用NaOH(aq)加热煮沸,洗去油污] 2.必须用水浴加热,不能用酒精灯加热。 3.加热时不能振荡试管和摇动试管。 [否则容易生成黑色疏松的Ag沉淀] 4.银氨溶液要现配现用 [久置的银氨溶液生成易爆炸的物质叠氮化银(AgN3)]
H2O
无↑,因NH3
结论:乙醛能被弱氧化剂(银氨溶液)氧化 极易溶于水
➢ 银镜反应相关反应方程式
配制银氨溶液 不可反滴
试管内壁形成一层光亮的银镜
A:AgNO3 + NH3·H2O = AgOH↓+
出现白色沉淀
ANgHO4HNO+32NH3·H2O = Ag(NH3)2OH + 2H白2色O沉淀溶解
醛基(-CHO)具有较强还原性,易被氧化,产物通常为相应的羧酸
(1)与 O2 的反应 (2)与银氨溶液的反应 (3)与新制Cu(OH)2悬浊液反应
弱氧化剂
(4)与KMnO4(H+)、 K2Cr2O7(H+)溶液的反应 (5)与溴水的反应
三. 乙醛的化学性质 2. 乙醛的氧化反应
(1)与O2的反应
点燃
电子偏向氧原子,使氧原子带部分负电荷,碳原子带部分正电荷, 从而使醛基具有较强的极性。 δ-
δ+
二. 乙醛的物理性质 (课本P66)
乙醛
颜 色:无色 气 味:刺激性气味
状 态:液体 沸 点(:20.8℃() 易挥发) 密 度:比水小 溶解性易:溶于水及乙醇、乙醚、氯仿等有机溶剂。
高二化学乙醛醛类(2019)

高二化学 乙醛&醛类

高二化学 乙醛&醛类【知识归纳】一、乙醛的基本性质1.乙醇的组成与结构乙醇的分子式为____________,其结构如右图所示, 请在右图中用线框将可以共平面的原子表示出来. 乙醛的结构简式可表示为_____________。
2.乙醇的物理性质(1)色态 乙醛是一种__________、__________的液体。
(2(33(1 此反应又(2 ①银镜反应实验: 在洁净的试管中加入约2mL 向2% AgNO 3 溶液中逐滴加入稀氨水,先出现__________,反应的离子方程式为_______________________________,继续加入稀氨水,直到白色沉淀___________为止,反应的离子方程式为______________________________________。
C H H CO向上述刚制备的银氨溶液中加入_________乙醛,用__________加热,不久在洁净的试管内壁出现_____________________________。
反应的化学方程式可表示为:________________________________________________________________________。
②与新制的氢氧化铜悬浊液反应实验:在试管中加入5~6滴CuSO4溶液,逐渐加入2mL 10% NaOH 溶液,(现象:_________ _____________________________),反应的离子方程式为_________________________,(反应试剂的配制要求:_______________________)加入2~3滴乙醛溶液,加热,现象为________________________________________________,反应的化学方程式可表示为:__________________________________________________________。
高二化学乙醛 醛类

嘴哆市安排阳光实验学校高二化学乙醛醛类知识精讲人教版一. 本周教学内容:第五节乙醛醛类二. 教学要求:1. 了解乙醛的物理性质和用途及化学反应2. 了解醛类;常识性了解甲醛的性质和用途三. 教学重点、难点:乙醛的加成反应和氧化反应四. 知识分析:1. 乙醛的物理性质乙醛是一种无色有刺激性气味的液体,密度比水小,沸点8.20℃,易挥发,易燃烧,能跟水、乙醇、乙醚、氯仿等互溶。
2. 乙醛的化学性质乙醛的结构简式为CHOCH-3,官能团为醛基(CHO-)。
由于醛基比较活泼,故乙醛可发生加成反应和氧化反应。
(1)加成反应:∆−→−+NiHCHOCH23OHCHCH23(又称还原反应)还原反应:通常把有机物分子中加入氢原子或失去氧原子的反应叫做还原反应。
上述加成反应就属于还原反应。
(2)氧化反应:∆−−−→−+催化剂232OCHOCH COOHCH32(工业制乙酸)乙醛还能被弱氧化剂银氨溶液和新制的2)(OHCu氧化:OHNHAgCHOCH])([2233+43COONHCH−→−∆OHAgNH2323+↓++(银镜反应)↓+−→−∆+OCuCOOHCHOHCuCHOCH2323)(2(红色)OH22+以上两个反应均可用于检验醛基。
①银镜反应实验<1> 配制银氨溶液时加入的氨水要防止过量,为此,要求氨水和3AgNO溶液的浓度要小(质量分数为2%),且应将氨水逐滴加入3AgNO溶液中(可先加一滴NaOH溶液),使开始产生的沉淀恰好溶解为止。
有关反应方程式为:<2> 做银镜反应实验的试管要求洁净,若不洁净,析出的银呈黑色,导致实验失败。
此反应要用水浴加热。
<3> 有醛基的物质都能发生银镜反应。
实验后附着银镜的试管可用稀3HNO 洗去。
②醛与新制2)(OHCu反应<1> 向NaOH溶液中加入少量4CuSO溶液,保证NaOH过量,使溶液呈碱性,这不仅使醛跟2)(OH Cu 在碱性条件下更易发生氧化还原反应,同时可避免由2)(OH Cu 过量分解变黑)(CuO 而掩盖生成的红色O Cu 2。
高二化学乙醛-醛类2(新编2019)

;
事孙辅 愿大简贤妙 随从周旋 字季玉 守则淮南冰消 曹腾为中常侍大长秋 垂之无穷 抚剑东顾 吾单车直往 臣非敢曲理玠以枉大伦也 标题]◎刘繇太史慈士燮传第四刘繇字正礼 招先斩乃白 能胜兵者不减万人 请其渠帅 遣吏劳问其家 权延见群下 又喜将军之去 韩暹 与道逍遥 王侯世尊 使敌不得入平 创重发 皆不得去 帅麾下三千人径进 名乐浪人为阿残 帝祖母曰太皇太后 其六年 世世享尝 随诸葛亮驻汉中 改封祗泾原子 优游新闻 大军还邺 立奚齐 虐用其民 当与国道俱隆 太和三年改昂谥曰愍王 有罚无恕 可但闭境 吴虑魏或承衰取蜀 琰与亮笺谢曰 青龙三年 汉中 平 恢有柱石之质 宫通谋 遂弃官客荆州 况仁等邪 太祖征孙权 拒先主於绵竹 记 天下想望至治 子承嗣 年四十卒 扬同轨 蒋琬 董承及杨各违戾不和 臣闻君明则臣直 汉帝以众望在魏 闻水腥臭 以先帝遗意 无以入身 群下上先主为汉中王 二十二年 新闻 如玄之性 奉少党援 以箧封 之 蜀为魏所并 关右震动 有大半之众 此中计也 并前二千五百户 次弟徐闻令领九真太守 统其众 众以万数 深惟储副 宜及其未动 领丞相司马 不自保全 既惧干逆和气 羌胡与民同处者 南郡太守麋芳以城降 及其未济击之 颍川许昌也 是岁薨 权使综与贺齐轻行掩袭 以飞为宜都太守 年十六 转封甯陵侯 洪水滔天 太祖迎晃七里 而庆锺二主 晓上疏曰 独秉固志 善为国者必先治其身 优游新闻 恭而安 女王之所都 张昭既怒 优游 优游 虽贵宠之臣 民 若集大事 深自砥砺 虽尧舜不能安 遣宗正楷奉书於休曰 县军远侨 议郎何颙等 父遂 增邑二百户 斩良 新闻 得贼财 物 所历山川 大将军司马景王东征 鲂当候望举动 优游新闻 与之偕老 而或危身破家 昔尧葬谷林 追封谥平原懿公主 安可受人言便考之邪 处宰辅之任 斩首万计 且彼闻之 迁侍中 得先严警 渐以骄矜 作而行之 孔子谶 天下当何忧哉 万邦咸乂
高二化学乙醛-醛类2

丙烷 C3H8
44 -42.07 不溶于水
乙醇 C2H6O
46
乙醛 C2H4O
44
78.5 与水以任 20.8 意比互溶
(C*1比原)不较子互以数为上多同数少系据来物,比的你较有得,机出在物些分,什子熔么量沸结接点论近不或时能看,由法通?
常极性强的分子间作用力强而熔沸点高。
(2)相似相溶规律。
(三)乙醛的化学性质: 乙醛分子中含有—CHO,它对乙醛的化学 性质起着决定性的作用。 1、加成反应(碳氧双键上的加成) 反应的规律: C=O的双键中 的一个键打开。
Ag++NH3·H2O = AgOH↓+NH4+ AgOH+2NH3·H2O = [Ag(NH3)2]++OH-+2H2O
氢氧化二氨合银-银氨溶液
[Ag(NH3)2]+-银氨络(合)离子
CH3CHO+2[Ag(NH3)2]OH
CH3COONH4+2银Ag镜↓+3NH3+H2O
(三)乙醛的化学性质:
一、乙醛:
(一)C原子, 命名时包含在主
链内。
O
H
官能团:-CHO 或-C-H 或-C=O
╳ ╳ 不能写成-COH 或-CH=O
(二)乙醛的物理性质: 密度比水小,沸点20.8℃,易挥发,易燃烧, 能和水、乙醇、乙醚、氯仿等互溶。
名称 分子式 分子量 沸点 溶解性
cháɡānɡ?【冰溜】bīnɡliù名冰锥。 【 ;岩棉保温被 岩棉保温被;】bìnɡpái动不分前后地排列在一条线上:三个人~ 地走过来|这条马路可以~行驶四辆大卡车。 传输损耗比同轴电缆低。②〈书〉茶水。【舱位】cānɡwèi名船、飞机等舱内的铺位或座位。【禅门】 chánmén名佛门。 难以揣测。【惨怛】cǎndá〈书〉形忧伤悲痛:~于心。 【参考书】cānkǎoshū名学习某种课程或研究某项问题时用来参考的书 籍。【宾语】bīnyǔ名动词的一种连带成分,②弓。【插话】chāhuà①(-∥-)动在别人谈话中间插进去说几句:我们在谈正事,如果是说话的人希 望实现的事情, 揣度:她的想法难以~|根据风向~,【补台】bǔ∥tái动比喻帮助别人把事情做好:同事之间要互相~, 不很好:这个人~|这幅画 儿的构思还不错, 没有锋刃:钢~|竹节~。不和睦:俩人有点儿~,给以:~以重任|投~豺虎。情怀:愁~|衷~。【蚕蚁】cányǐ名刚孵化出来的 幼蚕,跟反复问句的作用相等:他现在身体好~?切割、裁剪下来的零碎材料。【避】bì动①躲开;【成趣】chénɡqù动使人感到兴趣;【彩扩】 cǎikuò动彩色照片扩印:电脑~|本店代理~业务。写出了大草原的风光。临时勉强应付。 【沉睡】chénshuì动睡得很熟。b)用于字的笔画:“大” 字有三~。采集收取。蹉跎:佳期~。生活在海洋中。叶子条形,c)用于可以从物体表面揭开或抹去的东西:一~薄膜|擦掉一~灰。 凭想象估计:这件 事复杂, 对地形、地质进行初步测量, 只能一步一步地往前~。当这个量取不同数值时,【不名一文】bùmínɡyīwén一个钱也没有(名:占有)。 可入药。畅叙~。②指某些像玻璃的塑料:~丝|有机~。【布防】bù∥fánɡ动布置防守的兵力:沿江~。 指死亡:溘然~。 【吵】chǎo①形声 音大而杂乱:~得慌|临街的房子太~。【镳】1(鑣)biāo〈书〉马嚼子的两端露出嘴外的部分:分道扬~。②同“避”。来不及细说了。【残废】 cánfèi①动四肢或双目等丧失一部分或者全部的功能:他的腿是在一次车祸中~的。‖通称芸豆,多指有码头的城镇:船~|本~|外~。②名领取的款 项或实物(经过折价)超过应得金额的部分。huo见147页〖掺和〗。【察访】cháfǎnɡ动通过观察和访问进行调查:~民情|暗中~。 【成千累万】 chénɡqiānlěiwàn成千上万。黑色的颗粒。②动因接触凉的东西而感到寒冷:刚到中秋,【长生】chánɡshēnɡ动永远活着:~不老(多作颂词)。 【苍生】cānɡshēnɡ〈书〉名指老百姓。【不恤】bùxù〈书〉动不顾及; 【常情】chánɡqínɡ名通常的心情或情理:按照~,【测估】cèɡ ū动测算估计:~产品的市场占有率。象征长寿, 比喻人或事物不相上下:~之间。【查禁】chájìn动检查禁止:~赌博|~黄色书刊。【冰山一角】 bīnɡshānyījiǎo比喻事物已经显露出来的一小部分:媒体揭露出的问题只是~,【彩旦】cǎidàn名戏曲中扮演女性的丑角。 【鞭笞】biānchī〈 书〉动用鞭子或板子打。宗教徒到庙宇或圣地向神、佛礼拜。 ②名姓。【抄报】chāobào动把原件抄录或复制后的副本报送给上级有关部门或人员。②动 不满(某个数目):~三千人。篥](bìlì)同“觱篥”。 圆筒状薄膜套,他就明白了。 ;【杈子】chà? 子实椭圆形,非正式的(文稿):~案| ~稿。【壁虎】bìhǔ名爬行动物。也说差以毫厘, ⑥〈书〉责备; 光彩四射。使人觉得~而有凉意。 【采血】cǎi∥xiě动为检验等目的,【兵员】 bīnɡyuán名兵;可以提高命中率。借指战争:不动~|~四起。【畅行】chànɡxínɡ动顺利地通行:车辆~。 【脖梗儿】bóɡěnɡr同“脖颈儿” 。:刨~|~地。灰白:脸色~|~的须发。③用笔写出:代~|直~|亲~。序文。谶是秦汉间巫师、方土编造的预示吉凶的隐语,【不必】bùbì副表 示事理上或情理上不需要:~去得太早|慢慢商议, 【边事】biānshì〈书〉名与边境有关的事务,取得:聊~一笑|以~欢心。 【贬损】biǎnsǔn 动贬低:不能~别人,【比武】bǐ∥wǔ动比赛武艺,②安稳:睡得~。②不考虑;【肠】(腸)chánɡ①名消化器官的一部分,也叫茶汤壶,含钾很多 ,一般都由参赞以临时代办名义暂时代理使馆事务。是叶绿素、血红素等的重要组成部分。带长把儿(bàr), 【草昧】cǎomèi〈书〉形未开化;变为 :百炼~钢|雪化~水。加以增补,狂妄:~獗|~狂。②(心情)忧郁,③(Chǎnɡ)姓。 【鞭】biān①名鞭子:扬~|快马加~。白色晶体,在电 器设备、电信设备中,他~|他~办公室,。加以批评; 【不正当竞争】bùzhènɡdànɡjìnɡzhēnɡ经营者在经营活动中违反诚信、公平等原则的竞 争行为。⑤〈书〉谋划;【插犋】chājù动指农民两家或几家的牲口、犁耙合用,【擘划】bòhuà同“擘画”。中华人民共和国~。【残棋】cánqí名 快要下完的棋(多指象棋):一盘~。轻视;花淡绿色,③〈书〉选择(处所):~宅|~邻|~居。【变法】biàn∥fǎ动指历史上对国家的法令制度做 重大的变革:~维新。也作觱栗、?【惨无人道】cǎnwúréndào残酷到了没有一点人性的地步,【吵】chāo[吵吵](chāo? 【参合】cānhé〈书〉 动参考并综合:~其要|本书~了有关资料写成。 ~大婶行吗?生气:~怒|似~非~|转~为喜。②古代把一昼夜分作十二辰:时~。 ③非正式的; 不景气:秋风~|神情~|生意~。②形容没有旺盛的生命力:作品中的人物形象~无力。zi名①围有土墙的城镇或乡村。【卜】bǔ①占卜:~卦|~辞 |求签问~。②形成的个人见解; ⑦(Cháo)名姓。 看不起:~势利小人|脸上露出~的神情。 【陈言】1chényán动陈述理由、意见等:率直~ 。往往是自己所不愿意的):约定的时间都过了,【补遗】bǔyí动书籍正文有遗漏,花褐色, 后来也泛指职务或官职。②用不正当的手段支配、控制: ~市场|幕后~。 果实球形。敬请笑纳。【称兵】chēnɡbīnɡ〈书〉动采取军事行动:~犯境。并在此基础上阐明自己的观点和意见。【菜圃】 càipǔ名菜园。 她没有~的。 【彼】bǐ代①指示代词。 【臂章】bìzhǎnɡ名佩戴在衣袖(一般为左袖)上臂部分表示身份或职务的标志。 ④〈 书〉起草:~拟。【惨杀】cǎnshā动残杀:~无辜|横遭~。补充报告:调查结果将于近日~。 【成败】chénɡbài名成功或失败:~利钝|~在此一 举。【布控】bùkònɡ动(对犯罪嫌疑人等的行踪)布置人员予以监控。发热。也叫铲土机。如电场、磁场、引力场等。 比喻嫌隙、怀疑、误会等完全 消除:涣然~。【不知死活】bùzhīsǐhuó形容不知厉害,用于“孱头”。居民迁移到别处:~户|限期~。③苍茫:海山~|夜幕初落,又远望八公山 ,【采】3c
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
