温州大学物理化学2015年考研专业课初试真题
精编版-2015年浙江温州大学有机化学考研真题
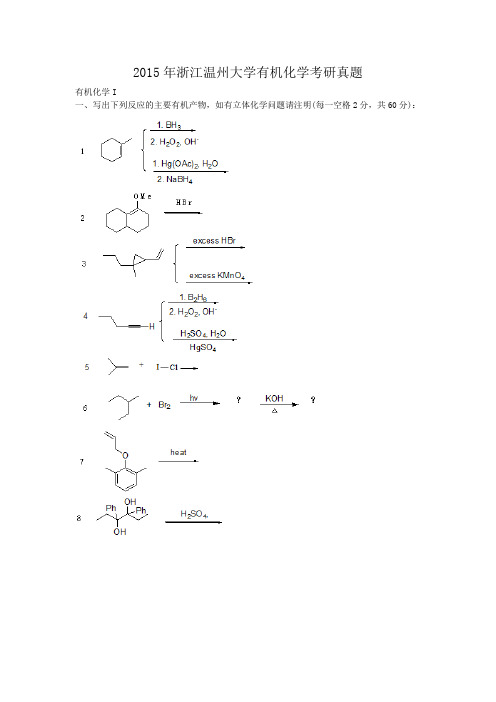
2015年浙江温州大学有机化学考研真题有机化学I一、写出下列反应的主要有机产物,如有立体化学问题请注明(每一空格2分,共60分):二、单项选择题(每小题2分,共20分):(1)盖布瑞尔(Gabriel)合成法常用来合成下列哪种化合物?A纯仲胺B纯伯胺C纯伯醇D纯仲醇(2)醛、酮与肼缩合的产物叫做?A羟基腈B醛(或酮)肟C羟胺D腙(3)下列化合物中最容易与水反应的化合物是:A CH3COOCH3B CH3COCl C(CH3CO)2O D CH3CONH2(4)下列化合物能发生碘仿反应的是?A CH3CH2CH2OHB CH3CH2CHOC CH3CH2CH(OH)CH2CH3D C6H5COCH3(5)这个反应属于?A.Wittig反应B.Claisen缩合反应C.Cannizzaro反应D.Michael加成反应(6)完成下列反应的试剂是?A氢化铝锂B硼氢化钠C钠,乙醇D氢气,铂(9)下列叙述,属于SN2亲核取代反应机理的是()①产物的构型完全转化②有重排产物③碱浓度增加,反应加速④叔卤烷速率大于仲卤烷⑤得到外消旋产物⑥反应不分阶段,一步完成A、①③⑤B、②④⑤⑥C、①③D、②③④⑥三、写出下列反应的可能机理(每小题5分,共20分):1.四、利用简便的化学方法鉴别下列化合物(每小题5分,共10分)1.2.五、合成题(每小题5分,共40分):有机化学II一、命名下列化合物或写出化合物的结构式(每题2分,共30分)1.2.3.4.2-氯-1,4-戊二烯5.6.7.1,1,1—三氯代—3—戊酮8.9.乙烯基乙炔10.11.2-甲基-3-溴丁烷12.13.14.15.二、选择题(每小题有若干个选项,请选出正确的一个,每题2分,共20分)1.与NaOH水溶液的反应活性最强的是()2.下列化合物不发生碘仿反应的是()A. C6H5COCH3B. C2H5OHC. CH3CH2COCH2CH3D. CH3COCH2CH33.下列化合物中具有芳香性的是()4.下列化合物的碱性最大的是()A.氨B.乙胺C.苯胺D.三苯胺5.不与苯酚反应的是()A.NaB. NaHCO3C. FeCl3D. Br26.下列哪种物质不能用来去除乙醚中的过氧化物()A.KIB.硫酸亚铁C.亚硫酸钠D.双氧水7.能与托伦试剂反应产生银镜的是()A. CCl3COOHB. CH3COOHC. CH2ClCOOHD.HCOOH8.以下几种化合物中酸性最强的是()A.乙醇B.水C.碳酸D.苯酚9.下列哪个化合物不属于硝基化合物()10.下列反应的转化过程经历了()A.亲电取代B.亲核加成C.正碳离子重排D.反式消除三、是非判断题(用“√”表示对,用“×”表示错,每题2分,共10分)1.由于烯烃具有不饱和键,其中π键容易断裂,表现出活泼的化学性质,因此其要比相应烷烃性质活泼。
温州大学化学专业《物理化学下》期末考试试卷G剖析

温州大学试卷纸温州大学期末考试一试卷-- -—学年第学期-- - -- -- -- -考- -考试科目物理化学(下)- -- -- -- -试- -试卷种类G- - - -- -- -成- -- - 考试形式- -- -绩- -- -- -考试对象- - - -- -- -- -- -- -- --- -- - 一、是非题(正确者打‘ ’,错误者打‘×’。
共10小题,每题 1分)- - -----号-1、质量作用定律是碰撞理论的直接结果。
学线--- - 2、过渡态理论中的“马鞍点”是势能面上的最高点。
-- -- --- - -- 3、绝对纯净的液态水能够过冷到0℃以下而不结冰。
- ---- - --- --- -- - 4、对于电池:AgAgNO 3(m 1)AgNO 3(m 2)Ag ,m 较小的一端是负极。
-- - -- -- --- -- -- -l 在固体s 表面发生铺展的必需条件是:-γ γ- - 5、液体-- -s-g s-l +γl-g- -- --- -- -- 6、光化学反响的量子效率不行能小于1。
名 --姓 -订 7、曲折液面产生的附带压力的方向老是指向该曲面的曲心。
- -- --- - 8、高度分别的CaCO3的分解压比块状CaCO 3的分解压大。
-- -- --- -- --- -- -- - 9、同温度下,小液滴的饱和蒸气压恒大于平面液的饱和蒸气压。
-- -- ---- -- - 10、反响级数n 不行能是负数。
-- -- --- -- --- -- --- -- --- -级 装二、选择题(只有一个正确答案,多项选择得零分。
共30题,每题 2分)--班 ---- 1、在电导丈量实验中,应当采纳的电源是:--- --- --- - ①直流电源- --- -- --- -- - ②沟通电源-- -- --- -- --- -- - ③直流电源或沟通电源-- -- --- -- --- -- --- - ④测固体电导用直流电源,测溶液电导用沟通电源- - -- -- --- -- --院 - 2、能证明科尔劳乌施经验式( mm(1c))的理论是:---学-①阿仑尼乌②德拜-休③布耶伦(B()()()()()()()()()()()()1温州大学试卷纸④德拜-休克尔-昂萨格(Debye-Huckel-Onsager)电导理论3、法拉弟于1834年依据大批实验事实总结出了有名的法拉弟定律。
温州大学化学专业《物理化学(下)》期末考试试卷H
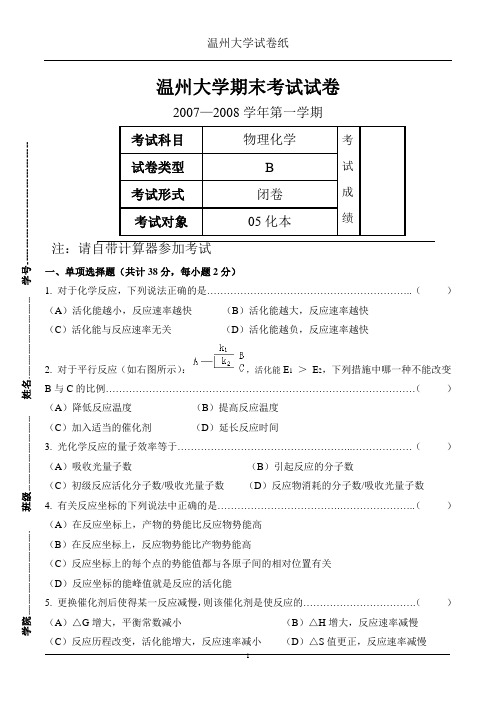
温州大学期末考试试卷2007—2008学年第一学期注:请自带计算器参加考试一、单项选择题(共计38分,每小题2分)1. 对于化学反应,下列说法正确的是……………………………………………………..( ) (A )活化能越小,反应速率越快 (B )活化能越大,反应速率越快 (C )活化能与反应速率无关 (D )活化能越负,反应速率越快2. 对于平行反应(如右图所示):,活化能E 1 > E 2,下列措施中哪一种不能改变B 与C 的比例…………………………………………………………………………………( ) (A )降低反应温度 (B )提高反应温度 (C )加入适当的催化剂 (D )延长反应时间3. 光化学反应的量子效率等于……………………………………………..………………( ) (A )吸收光量子数 (B )引起反应的分子数(C )初级反应活化分子数/吸收光量子数 (D )反应物消耗的分子数/吸收光量子数 4. 有关反应坐标的下列说法中正确的是……………………………….…………………..( ) (A )在反应坐标上,产物的势能比反应物势能高 (B )在反应坐标上,反应物势能比产物势能高(C )反应坐标上的每个点的势能值都与各原子间的相对位置有关 (D )反应坐标的能峰值就是反应的活化能5. 更换催化剂后使得某一反应减慢,则该催化剂是使反应的…………………………….( ) (A )△G 增大,平衡常数减小 (B )△H 增大,反应速率减慢 学院-------------------------------------- 班级---------------------------------- 姓名------------------------------------- 学号-------------------------------------6. 电解质溶液属于第二类导体导电方式,下列描述的特点中,不正确的是…………..()(A)电阻随温度降低而增加(B)电导随温度升高而增加(C)电导率总是随着溶液浓度增大而增大(D)溶液无限稀释时,摩尔电导率趋于最大值7. 下列对于电解质溶液导电特点的描述中,哪一点是不正确的………………..…….. ()(A)其电阻随温度的升高而增大(B)其电阻随温度的升高而减小(C)其电导的原因是离子的存在(D)当电流通过时在电极上有化学反应发生8. 将反应H+ + OH- = H2O设计成可逆电池,选出下列电池中正确的一个……………..()(A)Pt│H2│H +(aq)║OH -(aq)│O2│Pt (B)Pt│H2│NaOH(aq)│O2│Pt(C)Pt│H2│NaOH(aq)║HCl(aq)│H2│Pt (D)Pt│H2 (P1)│H2O(1)│H2 (P2)│Pt9. 已知φ0(Tl+/Tl)= -0.34V,φ0(Tl 3+/Tl) = 0.72V,则φ0(Tl 3+/Tl+)为……….…………()(A)(0.72×3)+0.34 V (B)0.72×1.5+0.17 V(C)0.72+0.34 V (D)0.72-0.34 V10. 日常使用的锌锰干电池,表示为Zn│NH4Cl(糊状)│MnO2(C),下列反应表示不正确的是…………………………………………………………………….………………………. ()(A)电池反应Zn+2NH4Cl+2MnO2 = Zn(NH3) 2Cl2+2MnOOH(B)负极反应Zn-2e+2NH4Cl = Zn(NH3) 2Cl2+2H2(C)正极反应2MnO2+2H++2e = 2MnOOH(D)正极反应MnO2+4H++2e = Mn+2H2O11. 纯Zn棒插入KCl水溶液中,腐蚀将先在何处发生(如图)……………..…………()(A)A处(B)B处(C)C处(D)D处12. 某溶液中有下列离子Cl -、Br -、F -、NO3-,用AgI固体作吸附剂进行吸附,哪个离子首先被吸附………………………………………………………………………………………()(A)Cl-(B)Br-(C)F-(D)NO3-13. 水在两玻璃板间能形成凹液面,当在两块玻璃板间放一滴水后,与不放水以前比较,拉开的难易程度是…………………………………………………………………………………()(A)更容易(B)更难(C)不变(D)相当14. 表面活性物质在不同情况下,对体系具有提高润湿性及乳化、增溶和起泡等作用,其中与界面张力的降低无直接关系的是……………………………………………………………()(A)提高润湿性(B)乳化(C)加溶(D)起泡15. 有机液体与水形成W/O型还是O/W型乳状液,与乳化剂的HLB值有很大关系,一般是…………………………………………………………………………………………….. ()(A)HLB值大,易形成W/O型(B)HLB值小,易形成O/W型(C)HLB值大,易形成O/W型(D)HLB值小,不易形成W/O型16. 大分子溶液的敏化作用指的是…………………………………….……………………()(A)可以显著提高溶胶的稳定性(B)可以显著减小某一电解质对溶胶的聚沉值(C)直接导致溶胶的聚沉(D)在加入电解质后产生沉淀17. 根据理论,溶胶相对稳定的主要因素是………………………………………………...()(A)胶粒表面存在双电层结构(B)胶粒和分散介质运动时产生ζ电位(C)布朗运动使胶粒很难聚结(D)离子氛重叠时产生的电性斥力占优势18. 胶体分散体系和其它分散体系的主要区别在于…………………….…………………()(A)分散相在普通显微镜下观察不到(B)颗粒不能通过半透膜(C)扩散速度慢(D)胶体粒子大小介于1~100nm19. 用含a mol的AgNO3和b mol KI的溶液制备溶胶,胶团结构为{(AgI)n I(n-q)K}q K;这说明了……………………………………………………………………………………………..()(A)a > b (B)a = b(C)a < b (D)不能确定a、b的关系二、填空题(共计10分,每小题2分)1. 某反应速率常数单位是mol-1·dm3·s-1,则该反应级数为( )2. 某反应在时刻t有两种不同产物,当t → ∞时,其中一种产物浓度趋近于零,而另一种产物浓度趋近于反应物的初浓度(或其倍数),则该反应必然为( )3. 恒温下电解质溶液的浓度增大时,其摩尔电导率( )4. 298K时,在有玻璃电极的电池中,加入pH = 4.00的缓冲溶液,测得电动势为0.1122V;则当电动势为0.2305时,溶液的pH为( )5. 对于(1)电解池的阴极(2)原电池的正极(3)电解池的阳极(4)原电池的负极;由于极化而使电极电势负移的电极是其中的( )三、多项选择题(共计12分,每小题3分;注意:最多选2项,选错一项扣1.5分)1. 有两个都为一级反应的平行反应(如图所示),下列说法中错误的是:……()= k1 + k2(B)E总= E1 + E2(A)k(C)k1/ k2 = [B] / [C] (D)t1/2 = ln2/( k1 + k2)= k1 - k2(E)k总2. 比较两个电极反应(1)Ag = Ag+ + e;(2)Ag(CN)2- + e = Ag + 2CN -的异同点,下列说法中错误的是:………………………………………………………………….………. ()(A)二者均可称为银电极反应,有相同的电极电位值(B)二电极类型不同,电极电位值也不同(C)电极反应(1)对Ag可逆,(2)对CN -可逆(D)两个电极的值的关系是φ0(Ag+/Ag) = φ0(Ag(CN)2-/Ag) - RT/(nF) ln K a(不稳)(E)两个电极的值的关系是φ0(Ag+/Ag) = φ0(Ag(CN)2-/Ag) - RT/(nF) ln K a(稳)3. 下列反应中活化能为零的是:…………………………………..………………()(A)A· + BC → AB + C· (B)A·+ A·+ M → A2 + M(C)A2+ M → 2A·+ M (D)A2 + B2→ 2AB(E)B·+ B·+ M → B2 + M4. 正丁醇加入水中:…………………………………………………………...……()(A)能增大液体表面张力(B)能显著降低液体表面张力(C)对液体表面张力无影响(D)表现为正吸附(E)表现为负吸附四、计算题(共计35分)1.(本题8分)C14存在于有生命的树木中,C14放射性蜕变的半衰期是5730年,现有一个考古样里仍含72%的C14木质,问考古样的年纪有多大?2.(本题7分)试计算含有0.001mol·dm-3 NaCl和0.003mol·dm-3 Na2SO4的水溶液中Na2SO4的离子平均活度。
2015-2020年浙江省温州市中考科学真题——选择题-物理—光热(有答案)

2015 年浙江省初中毕业升学考试(温州市卷)一、选择题(本题有 15 小题,每小题 4 分,共 60 分。
每小题只有一个选项是正确的,不选、多选、错选均不给分)5.某同学将烧杯和量筒置于同一环境中,分别装入 20 毫升不同液体(如图)。
一段时间后,剩余液体体积最少的是12.如图,若要让反射光线射中目标,在激光笔不动的情况下,可将平面镜A.竖直向上移动B.竖直向下移动C.水平向右移动D.水平向左移动浙江省 2016 年初中毕业生学业考试温州市科学试卷2017 年浙江省初中毕业升学考试(温州市卷)一、选择题1.眼睛让我们看见多彩世界。
下列属于爱护眼睛、保护视力的做法是15.小明用焦距为 10 厘米的凸透镜做成像规律实验,记录了光屏上成清晰像时的四组数据 (如表),其中明显错.误.的一组是A .甲B .乙C .丙D .丁 2018 年温州市初中学业水平考试一、选择题11.如图为玩具鸟在平面镜中的成像示意图。
下列能改变像位置的是( )A .竖直上移玩具鸟B .竖直下移平面镜C .人向平面镜靠近D .像与镜间放一木板 组别 甲 乙 丙 丁 物距(厘米) 10 15 20 30 像距(厘米) 40 30 20 152019 年浙江省初中毕业考试(温州市卷)科学卷一、选择题10.将一蜡烛放在装有水的烧瓶前,调整蜡烛和烧瓶至如图所示位置,在墙壁上得到清晰的像。
该像的性质是()A.缩小的虚像B.放大的虚像C.缩小的实像D.放大的实像参考答案2015 年初中毕业生学业考试温州市科学试卷5. B 12.B2016 年初中毕业生学业考试温州市科学试卷2017 年初中毕业生学业考试温州市科学试卷1. C 15.A2018 年初中毕业生学业考试温州市科学试卷11. A2019 年初中毕业生学业考试温州市科学试卷10.C。
2015年浙江温州大学分析化学考研真题

四种。
2、下列各数含有的有效数字是几位?988;。按有效数据计算下列结果:213.64+4.4+0.3244=;pH=12.20溶液的[H+]=。
3、配位滴定法中,金属离子M被准确滴定的条件是,混合离子被选择滴定的条件是。
4、造成系统误差的原因有、、、
。
5、分光光度计基本部件为:、、、
5、浓度均为0.0200mol/L的Zn2+、Cd2+混合溶液,加入过量KI,使终点时游离子I-浓度为1mol/L,在pH5.0时,以XO作指示剂,用等浓度的EDTA滴定其中的Zn2+,计算终点误差。
(已知:lgKZnY=16.5 lgKCdY=16.46 CdI1-4l的lgCd(I)=5.46
pH=5.0 lgK′Znox=4.8 lgαY(H)=6.46 αZn(OH)忽略)
A、1个单位 B、2个单位 C、10个单位 D、不变化
6、在重量分析中,下列哪些因素是使溶解度减小的? ( )
A、升高温度 B、同离子效应 C、络合效应 D、陈化
7、在沉淀形成过程中,与待测离子半径相近的杂质离子常与待测离子一道与构晶离子形成 ( )
A、吸留 B、混晶 C、包藏 D、继沉淀
8、下列会引起标准曲线偏离朗伯—比尔定律的因素是 ( )
A、溶液为稀溶液 B、入射光为单色光
C、溶液为胶体溶液 D、以上均不是
9、EDTA滴定下列混合物,能控制酸度进行分步滴定的有 ( )
A、Ca2+、Mg2+B、Fe3+、Fe2+
C、Fe2+、Ca2+D、Cd2+、Fe2+
(lgKCaY=10.7 lgKMgY=8.7 lgKFeY-=25.1 lgKFeY2-=14.3 lgKCdY=16.5)
精编版-2015年浙江温州大学生物化学考研真题

2015年浙江温州大学生物化学考研真题一、填空题(每个空 1分,共20 分)1.脂肪酸的活化在___ 中,经___穿梭进入___中进行β-氧化,氧化过程包括_____、___、_____和_____四个连续反应步骤,每次β-氧化生成二碳化合物,即______。
2.糖的分解代谢途径包括______、______、___和_____四种途径,以___途径为主要生成NADPH+H+的途径,以___途径为主要供能途径。
5.RNA转录过程中识别转录启动子的是___因子,识别转录终止部位的是___因子。
6.DNA复制时,连续合成的链称为___链;不连续合成的链称为___链。
7.以DNA为模板合成RNA的过程为___,催化此过程的酶是___。
二、选择题(每小题 1分,共20 分)1.测得某一蛋白质样品的氮含量为0.40g,此样品约含蛋白质多少?A.2.00g,B.2.50g, C.6.40g ,D.3.00g, E.6.25g2. 某酶今有4种底物(S),其Km值如下,该酶的最适底物为:A、S1:Km=5×10-5M,B、S2:Km=1×10-5M,C、S3:Km=10×10-5M,D、S4:Km=0.1×10-5M3. 破坏α-螺旋结构的氨基酸残基之一是:A、亮氨酸B、丙氨酸C、脯氨酸D、谷氨酸4. 在生理pH情况下,下列氨基酸中哪个带净负电荷?A、ProB、LysC、HisD、Glu5.DNA变性是指:A.分子中磷酸二酯键断裂, B.多核苷酸链解聚C.DNA分子由超螺旋→双链双螺旋 D.互补碱基之间氢键断裂E.DNA分子中碱基丢失6.脂肪酸彻底氧化的产物是:A.乙酰CoA B.脂酰CoA C.丙酰CoAD.乙酰CoA及FAD2H、NADH+H+ E.H2O、CO2及释出的能量7. 关于酮体的叙述,哪项是正确的?A.酮体是肝内脂肪酸大量分解产生的异常中间产物,可造成酮症酸中毒B.各组织细胞均可利用乙酰CoA合成酮体,但以肝内合成为主C.酮体只能在肝内生成,肝外氧化D.合成酮体的关键酶是HMG CoA还原酶E.酮体氧化的关键是乙酰乙酸转硫酶8、糖酵解时提供~P使ADP生成ATP的一对代谢物是:A.F6P及FBP B.甘油酸-1,3二磷酸及烯醇式丙酮酸磷酸C.G6P及甘油酸-2-磷酸 D.G1P及甘油醛-3-磷酸E.FBP及二羟丙酮磷酸9、饥饿时尿中含量增高的物质是:A.丙酮酸 B.乳酸 C.尿酸 D.酮体 E.葡萄糖10. 在脂肪酸合成中,将乙酰CoA•从线粒体内转移到细胞质中的化合物是:A、乙酰CoAB、草酰乙酸C、柠檬酸D、琥珀酸11、在体内嘌呤核苷酸合成时,CO2中的碳原子进入嘌呤环中的部位是:A.C2 B.C4 C.C5 D.C6 E.C812.DNA复制时,模板序列5′—TAGA—3′,将合成下列哪种互补结构?A.5′—TCTA—3′ B.5′—ATCA—3′ C.5′—UCUA—3 D.5′—GCGA—3′ E.5′—TCTA—3′13.DNA复制时,子链的合成是:A.一条链5′→3′,另一条链3′→5′ B.两条链均为3′→5′C.两条链均为5′→3′ D.两条链均为连续合成E.两条链均为不连续合成14.冈崎片段是指:A.DNA模板上的DNA片段 B.引物酶催化合成的RNA片段C.随从链上合成的DNA片段 D.前导链上合成的DNA片段E.由DNA连接酶合成的DNA15.识别RNA转录终止的因子是:A.α因子 B.β因子 C.σ因子 D.ρ因子 E.γ因子16. 蛋白质合成所需的能量来自:A、ATPB、GTPC、ATP和GTPD、CTP17.氨中毒的根本原因是:A.肠道吸收氨过量 B.氨基酸在体内分解代谢增强C.肾功能衰竭排出障碍 D.肝功能损伤,不能合成尿素E.合成谷氨酸酰胺减少18.遗传信息传递的中心法则是:A.DNA→RNA→蛋白质 B.RNA→DNA→蛋白质 C.蛋白质→DNA→RNAD.DNA→蛋白质→RNA E.RNA→蛋白质→DNA19.下列关于σ因子的描述哪一项是正确的?A.RNA聚合酶的亚基,负责识别DNA模板上转录RNA的特殊起始点B.DNA聚合酶的亚基,能沿5′→3′及3′→5′方向双向合成RNAC.可识别DNA模板上的终止信号D.是一种小分子的有机化合物 E.参与逆转录过程20、关于tRNA的叙述,下列哪项是错误的?A.有反密码子,能识别mRNA分子的密码 B.有氨基酸臂携带氨基酸 C.一种tRNA能携带多种氨基酸 D.一种氨基酸可由数种特定tRNA运载 E.20种氨基酸都各有其特定的tRNA三、判断题(用“对”、“错”表示,每小题 1分,共10 分)1、依赖DNA的RNA聚合酶叫转录酶,依赖于RNA的DNA聚合酶即反转录酶。
温州大学物理化学分章选择题选择题表面及答案

温州大学物理化学分章选择题选择题表面及答案一 . 选择题:1.在等温等压条件下,将1 mol 水的表面积增加10 倍,作功为W ,水的 Gibbs 函数变化为△G 。
此时W 与△G 的关系为:(D)(A) △G = -W (B) △G =W (C) △G < -W (D) 不能确定2. 液体的表面张力γ 可以表示为: (C)(A) (H /A )T,p,n (B) (?F /?A )T,p,n (C) (U /?A )S,V ,n(D) (G /?A )T,V ,n3. 298K 时,水-空气的表面张力γ= 7.17×10-2N ·m -1,若在298K ,标准压力 p \下可逆地增加4×10-4m 2水的表面积,环境对体系应做的功W 为:( A) (△U = Q +W )(A)+2.868 x 10НJ (B) -2.868×10НJ (C) +7.17×10НJ (D) -7.17×10 НJ4. 对大多数纯液体其表面张力随温度的变化率是: (B)(A) (?γ/?T )p > 0 (B) (?γ/T )p < 0 (C) (??γ/?T )p = 0 (D) 无一定变化规律5. 已知 293K 时水-空气的表面张力为7.275×10-2 N ·m -1,当已知 298K 和101.325 kPa 下可逆地增大水的表面积 4cm 2,体系的吉布斯函数的变化为:(A)(A) 2.91×10-5 J (B) 2.91×10-1 J (C) -2.91×10-5 J (D) -2.91×10-1 J6. 在相同温度下固体冰和液体水的表面张力哪个大? (A)(A) 冰的大 (B) 水的大 (C) 一样大 (D) 无法比较7. 在下图的毛细管内装入普通不润湿性液体,当将毛细管右端用冰块冷却时,管内液体将: ( A)( )冰(A) 向左移动 (B) 向右移动 (C) 不移动 (D) 左右来回移动8. 如图在毛细管内装入润湿性液体,当在毛细管内左端加热时,则管内液体将:(B))(加热 (A) 向左移动 (B) 向右移动 (C) 不移动 (D) 因失去平衡而左右来回移动9. 单组分气-液平衡体系,在孤立条件下界面 A 发生了 d A > 0 的微小变化,体系相应的熵变 d S 变化如何? (C )(A) d S > 0 (B) d S = 0 (C) d S < 0 (D) 不能确定10. 已知 400K 时,汞的饱和蒸气压为 p 0,密度为ρ,如果求在相同温度下,一个直径为 10-7m 的汞滴的蒸气压,应该用公式 : (C)(A) p = p 0+ 2γ/R ' (B) ln(p /p 0) =△vap H m (1/T 0- 1/T )/R(C) RT ln(p /p 0) = 2γM /ρR' (D) p = nRT /V11. 弯曲表面上附加压力的计算公式:△p = p ' –p 0=2γ/R 中,R 的符号: (A)(A)液面为凸面时为正,凹面为负(B)液面为凸面时为负,凹面为正 (C)总为正 (D)总为负12. 液体在毛细管中上升的高度与下列那一个因素无关:(D)(A) 温度 (B) 液体密度 (C) 重力加速度 (D) 大气压力13. 对弯曲液面(非平面)所产生的附加压力: (A)(A) 一定不等于零 (B) 一定等于零 (C) 一定大于零 (D) 一定小于零14. 把玻璃毛细管插入水中,凹面下液体所受的压力 p 与平面液体所受的压力 p 0比: (B)(A) p = p 0 (B) p < p 0 (C) p > p 0 (D) 不确定15.能在毛细管中产生凝聚现象的物质是由于该物质的液体在毛细管中形成 :(1) 凸面 (2) 凹面 (3) 平面其在毛细管内液面上的饱和蒸气压 p :(4)大于平面的 (5)等于平面的 (6) 小于平面的正确的答案是:(D )(A) ② ④ (B) ① ⑤ (C) ③ ⑥ (D) ② ⑥16. 有一露于空气中的球形液膜,若其直径为2×10-3m ,表面张力为0.7N ·m -1,则该液膜所受的附加压力为: (B )(A) 1.4kPa (B) 2.8kPa (C) 5.6kPa (D) 8.4kPa17. 有两根半径相同的玻璃毛细管插入水中,水面上升高度为 h ,其中一根在 1/2h 处使其弯曲向下,试问水在此毛细管端的行为是:(C)(A) 水从毛细管端滴下 (B) 毛细管端水面呈凸形弯月面(C) 毛细管端水面呈凹形弯月面 (D) 毛细管端水面呈水平面18.半径为1×10-2m 的球形肥皂泡的表面张力为0.025N ·m -1,其附加压力为: (D)(A) 0.025N ·m -2 (B) 0.25N ·m -2 (C) 2.5N ·m -2 (D) 10N ·m -219. 在相同温度和压力下, 凹面液体的饱和蒸气压 p r 与水平面液体的饱和蒸气压 p 0比(同一种液体): (B)(A) p r = p 0 (B) p r < p 0 (C) p r > p 0 (D) 不能确定20. 同外压恒温下,微小液滴的蒸气压比平面液体的蒸气压 : (A)(A) 大(B) 一样(C) 小(D) 不定21.半径为R,表面张力为γ,则肥皂泡内外的压力差为:(C)(A) △p = 0 (B) △p = 2γ/R(C) △p = 4γ/R(D) 无法确定22.用同一支滴管滴下水的滴数和滴相同体积苯的滴数哪个多? (B)(A) 水的多(B) 苯的多(C) 一样多(D) 随温度而改变23.用同一滴管分别滴下1 cm3NaOH 水溶液、水、乙醇水溶液,各自的滴数为 (C)(A) 水15滴, NaOH水溶液18滴, 乙醇水溶液25滴(B)水18 滴, NaOH水溶液25 滴, 乙醇水溶液 15 滴(C) 水18滴, NaOH水溶液15滴, 乙醇水溶液25 滴 (D) 三者的滴数皆为 18 滴24. 天空中的水滴大小不等,在运动中,这些水滴的变化趋势如何?(B )(A) 大水滴分散成小水滴,半径趋于相等(B) 大水滴变大,小水滴缩小(C) 大小水滴的变化没有规律(D) 不会产生变化25. 下面说法不正确的是 (C )(A) 生成的新鲜液面都有表面张力(B) 平面液面没有附加压力(C) 弯曲液面的表面张力的方向指向曲率中心 (D) 弯曲液面的附加压力指向曲率中心26. 同一固体,大块颗粒和粉状颗粒,其溶解度哪个大? (B)(A) 大块颗粒大 (B) 粉状颗粒大(C) 一样大(D) 无法比较27. 同一固体,大块颗粒和粉状颗粒,其熔点哪个高? (A)(A) 大块的高(B) 粉状的高(C) 一样高(D) 无法比较28. 在同一温度下微小晶粒的饱和蒸汽压和大块颗粒的饱和蒸压哪个大? (A )(A) 微小晶粒的大(B) 大块颗粒的大(C) 一样大(D) 无法比较29.气相中的大小相邻液泡相碰,两泡将发生的变化是: (A)(A) 大泡变大,小泡变小 (B) 大泡变小,小泡变大(C) 大泡小泡均不变(D) 两泡将分离开30.气相中有相邻气泡(如图),气泡将发生的变化是: ( D)(A) 不发生变化(B) 变为若干小气泡(C) 气泡将变大(D) 气泡逐渐破裂消失31. 在 298K 时,已知 A 液的表面张力是 B 液的一半,其密度是B 液的两倍。
温州大学考研专业课真题物理化学Ⅰ试题A

2011年硕士研究生招生入学考试试题A科目代码及名称: 818物理化学Ⅰ适用专业:物理化学、有机化(请考生在答题纸上答题,在此试题纸上答题无效)注意事项:(1)有关的常数:R=8.314 J·mol-1·K-1;k=1.38×10-23J·K-1;F=96500 C·mol-1;h=6.63×10-34J·s;L=6.02×1023 mol-1。
(2)标准压力p=100 kPa或101.325 kPa。
(3)允许使用计算器、直尺。
一、单项选择题(共15题,每题2分,共30分)1、理想气体在恒定外压p=101.325 kPa下,从10 dm3膨胀到16 dm3,同时吸热126 J,则过程的ΔU为多少?(A)-284 J (B)842 J (C)-482 J (D)482 J2、下列宏观过程:①p和273.15K下冰融化为水;②电流流过铜线发热;③往车胎内打气;④水在p和373.15K下蒸发。
可视为可逆过程的是哪几个?(A)①和④(B)②和③(C)①和③(D)②和④3、对封闭系统,在指定的始末态之间,可能的绝热可逆途径有几条?(A)0条(B)1条(C)2条(D)至少3条4、物质A和B混合形成理想液态混合物,则此过程的Δmix S大小如何?(A)Δmix S>0 (B)Δmix S<0 (C)Δmix S=0 (D)无法判断5、某化学反应A→B,消耗掉四分之三的A所需时间是其半衰期的2倍,则该反应是几级?(A)零级(B)一级(C)二级(D)其它级数6、左右水平放置的粗细均匀、内壁清洁的毛细玻璃管中有一段连续的汞柱,当在该汞柱右端的玻璃管外稍稍加热时,管中汞柱将如何移动?(A)左移(B)右移(C)不动(D)无法判断7、20℃时,浓度均为10 mmol·kg-1的LaCl3、CaCl2、NaCl三种水溶液,离子平均活度因子γ±由大到小的顺序为:(A)LaCl3>CaCl2>NaCl (B)LaCl3> NaCl > CaCl2(C)CaCl2>LaCl3>NaCl (D)NaCl >CaCl2> LaCl3第1页,共 5 页(请考生在答题纸上答题,在此试题纸上答题无效)8、某水溶液中有n种溶质,若用一种只能让水分子通过的半透膜将此溶液与纯水隔开,当达到渗透平衡时,纯水一侧水面外压为p w,溶液一侧液面外压为p s,则该体系的自由度f是多少?(A)f=n(B)f=n+1 (C)f=n+2 (D)f=n+39、某化学反应速率系数与其各基元反应速率系数之间的关系式为k2(k1/2k4)1/2,则该反应的表观活化能E a与各其基元反应的活化能之间的关系式为:(A)E a=E2+E1/2-E4(B)E a=E2+(E1-E4)/2 (C)E a=E2+(E1-2E4)1/2(D)E a=E2+E1-2E410、二组分凝聚体系(A+B)的温度(T)-组成(w B%)相图如下所示。
温州大学化学专业《物理化学(下)》期末考试试卷H剖析
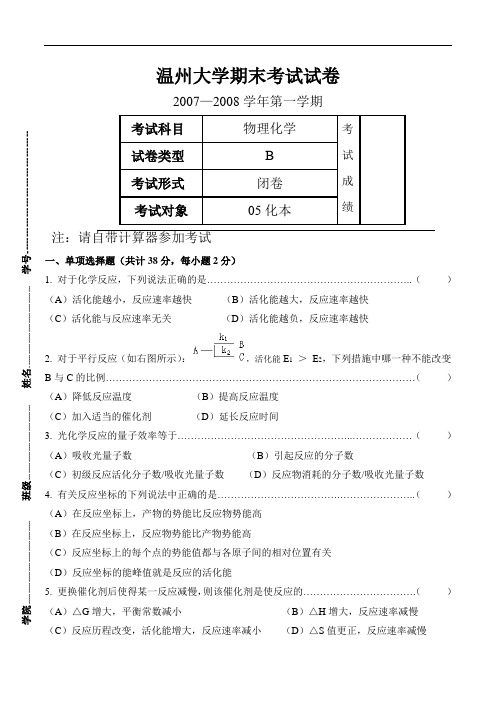
温州大学期末考试试卷 2007—2008学年第一学期考试科目 物理化学 考试成绩 试卷类型 B 考试形式 闭卷 考试对象 05化本 注:请自带计算器参加考试 一、单项选择题(共计38分,每小题2分) 1. 对于化学反应,下列说法正确的是……………………………………………………..( ) (A )活化能越小,反应速率越快 (B )活化能越大,反应速率越快 (C )活化能与反应速率无关 (D )活化能越负,反应速率越快 2. 对于平行反应(如右图所示):,活化能E 1 > E 2,下列措施中哪一种不能改变B 与C 的比例…………………………………………………………………………………( ) (A )降低反应温度 (B )提高反应温度 (C )加入适当的催化剂 (D )延长反应时间 3. 光化学反应的量子效率等于……………………………………………..………………( ) (A )吸收光量子数 (B )引起反应的分子数 (C )初级反应活化分子数/吸收光量子数 (D )反应物消耗的分子数/吸收光量子数 4. 有关反应坐标的下列说法中正确的是……………………………….…………………..( ) (A )在反应坐标上,产物的势能比反应物势能高 (B )在反应坐标上,反应物势能比产物势能高 (C )反应坐标上的每个点的势能值都与各原子间的相对位置有关 (D )反应坐标的能峰值就是反应的活化能 5. 更换催化剂后使得某一反应减慢,则该催化剂是使反应的…………………………….( ) (A )△G 增大,平衡常数减小 (B )△H 增大,反应速率减慢(C )反应历程改变,活化能增大,反应速率减小 (D )△S 值更正,反应速率减慢 学院-------------------------------------- 班级---------------------------------- 姓名------------------------------------- 学号-------------------------------------6. 电解质溶液属于第二类导体导电方式,下列描述的特点中,不正确的是…………..()(A)电阻随温度降低而增加(B)电导随温度升高而增加(C)电导率总是随着溶液浓度增大而增大(D)溶液无限稀释时,摩尔电导率趋于最大值7. 下列对于电解质溶液导电特点的描述中,哪一点是不正确的………………..…….. ()(A)其电阻随温度的升高而增大(B)其电阻随温度的升高而减小(C)其电导的原因是离子的存在(D)当电流通过时在电极上有化学反应发生8. 将反应H+ + OH- = H2O设计成可逆电池,选出下列电池中正确的一个……………..()(A)Pt│H2│H +(aq)║OH -(aq)│O2│Pt (B)Pt│H2│NaOH(aq)│O2│Pt(C)Pt│H2│NaOH(aq)║HCl(aq)│H2│Pt (D)Pt│H2 (P1)│H2O(1)│H2 (P2)│Pt9. 已知φ0(Tl+/Tl)= -0.34V,φ0(Tl 3+/Tl) = 0.72V,则φ0(Tl 3+/Tl+)为……….…………()(A)(0.72×3)+0.34 V (B)0.72×1.5+0.17 V(C)0.72+0.34 V (D)0.72-0.34 V10. 日常使用的锌锰干电池,表示为Zn│NH4Cl(糊状)│MnO2(C),下列反应表示不正确的是…………………………………………………………………….………………………. ()(A)电池反应Zn+2NH4Cl+2MnO2 = Zn(NH3) 2Cl2+2MnOOH(B)负极反应Zn-2e+2NH4Cl = Zn(NH3) 2Cl2+2H2(C)正极反应2MnO2+2H++2e = 2MnOOH(D)正极反应MnO2+4H++2e = Mn+2H2O11. 纯Zn棒插入KCl水溶液中,腐蚀将先在何处发生(如图)……………..…………()(A)A处(B)B处(C)C处(D)D处12. 某溶液中有下列离子Cl -、Br -、F -、NO3-,用AgI固体作吸附剂进行吸附,哪个离子首先被吸附………………………………………………………………………………………()(A)Cl-(B)Br-(C)F-(D)NO3-13. 水在两玻璃板间能形成凹液面,当在两块玻璃板间放一滴水后,与不放水以前比较,拉开(A)更容易(B)更难(C)不变(D)相当14. 表面活性物质在不同情况下,对体系具有提高润湿性及乳化、增溶和起泡等作用,其中与界面张力的降低无直接关系的是……………………………………………………………()(A)提高润湿性(B)乳化(C)加溶(D)起泡15. 有机液体与水形成W/O型还是O/W型乳状液,与乳化剂的HLB值有很大关系,一般是…………………………………………………………………………………………….. ()(A)HLB值大,易形成W/O型(B)HLB值小,易形成O/W型(C)HLB值大,易形成O/W型(D)HLB值小,不易形成W/O型16. 大分子溶液的敏化作用指的是…………………………………….……………………()(A)可以显著提高溶胶的稳定性(B)可以显著减小某一电解质对溶胶的聚沉值(C)直接导致溶胶的聚沉(D)在加入电解质后产生沉淀17. 根据理论,溶胶相对稳定的主要因素是………………………………………………...()(A)胶粒表面存在双电层结构(B)胶粒和分散介质运动时产生ζ电位(C)布朗运动使胶粒很难聚结(D)离子氛重叠时产生的电性斥力占优势18. 胶体分散体系和其它分散体系的主要区别在于…………………….…………………()(A)分散相在普通显微镜下观察不到(B)颗粒不能通过半透膜(C)扩散速度慢(D)胶体粒子大小介于1~100nm19. 用含a mol的AgNO3和b mol KI的溶液制备溶胶,胶团结构为{(AgI)n I(n-q)K}q K;这说明了……………………………………………………………………………………………..()(A)a > b (B)a = b(C)a < b (D)不能确定a、b的关系二、填空题(共计10分,每小题2分)1. 某反应速率常数单位是mol-1·dm3·s-1,则该反应级数为( )2. 某反应在时刻t有两种不同产物,当t → ∞时,其中一种产物浓度趋近于零,而另一种产物浓度趋近于反应物的初浓度(或其倍数),则该反应必然为( )3. 恒温下电解质溶液的浓度增大时,其摩尔电导率( )4. 298K时,在有玻璃电极的电池中,加入pH = 4.00的缓冲溶液,测得电动势为0.1122V;则当电动势为0.2305时,溶液的pH为( )5. 对于(1)电解池的阴极(2)原电池的正极(3)电解池的阳极(4)原电池的负极;由于极化而使电极电势负移的电极是其中的( )1. 有两个都为一级反应的平行反应(如图所示),下列说法中错误的是:……()(A)k= k1 + k2(B)E总= E1 + E2总(C)k1/ k2 = [B] / [C] (D)t1/2 = ln2/( k1 + k2)= k1 - k2(E)k总2. 比较两个电极反应(1)Ag = Ag+ + e;(2)Ag(CN)2- + e = Ag + 2CN -的异同点,下列说法中错误的是:………………………………………………………………….………. ()(A)二者均可称为银电极反应,有相同的电极电位值(B)二电极类型不同,电极电位值也不同(C)电极反应(1)对Ag可逆,(2)对CN -可逆(D)两个电极的值的关系是φ0(Ag+/Ag) = φ0(Ag(CN)2-/Ag) - RT/(nF) ln K a(不稳)(E)两个电极的值的关系是φ0(Ag+/Ag) = φ0(Ag(CN)2-/Ag) - RT/(nF) ln K a(稳)3. 下列反应中活化能为零的是:…………………………………..………………()(A)A· + BC → AB + C· (B)A·+ A·+ M → A2 + M(C)A2+ M → 2A·+ M (D)A2 + B2→ 2AB(E)B·+ B·+ M → B2 + M4. 正丁醇加入水中:…………………………………………………………...……()(A)能增大液体表面张力(B)能显著降低液体表面张力(C)对液体表面张力无影响(D)表现为正吸附(E)表现为负吸附四、计算题(共计35分)1.(本题8分)C14存在于有生命的树木中,C14放射性蜕变的半衰期是5730年,现有一个考古样里仍含72%的C14木质,问考古样的年纪有多大?2.(本题7分)试计算含有0.001mol·dm-3 NaCl和0.003mol·dm-3 Na2SO4的水溶液中Na2SO4的离子平均活度。
温州大学物理化学分章选择题 物理化学分章模拟试题 各章练习题

物理化学分章模拟试题第一章热力学第一定律及其应用一、选择题1.理想气体卡诺循环的图为下列四种情况中的哪一种? ( )2.1mol单原子分子理想气体,从273 K,202.65 kPa, 经pT=常数的可逆途径压缩到405.3 kPa 的终态,该气体的ΔU为:( )(A) 1702 J (B) -406.8 J(C) 406.8 J (D) -1702 J3.Cl2(g)的燃烧热为何值? ( )(A) HCl(g)的生成热(B) HClO3的生成热(C) HClO4的生成热(D) Cl2(g)生成盐酸水溶液的热效应4.下述说法哪一个错误? ( )(A) 封闭体系的状态与其状态图上的点一一对应(B) 封闭体系的状态即是其平衡态(C) 封闭体系的任一变化与其状态图上的实线一一对应(D) 封闭体系的任一可逆变化途径都可在其状态图上表示为实线二、填空题1 10 mol单原子分子理想气体的(∂H/∂T)V = J·K-1。
2 对于任何宏观物质,其焓H一定_______ 内能U (填上>、<、=) ,因为_________;对于等温理想气体反应,分子数增多的ΔH一定_________ΔU,因为____________ 。
3在一绝热刚性容器中进行某一化学反应,该体系的内能变化为______ ,焓变化为_______ 。
4 如图。
两条等温线的温度分别为T a,T b。
1mol理想气体经过路径1231的W I与经过路径4564的W II大小关系是。
三、计算题1 在293 K的房间里有一只电冰箱,试问:(1)若使250 g,273 K的水在冰箱里结冰所需的功为多少?若电冰箱的功率为100W,那么250 g水全部结冰需要多少时间?(2)若放入250g,20℃的水,那么在冰箱里结成273 K的冰需要多少功?(3)若放入的是298 K的水,那么冷却到293 K需要多少功?已知水的凝固热为-6010 J·mol-1,水的平均热容为4.184 J·K-1·g-1。
2015年温州大学考研真题829电子技术硕士研究生专业课考试试题

科目代码及名称: 829 电子技术 适用专业:制造业信息化技术/机械工程
(请考生在答题纸上答题,在此试题纸上答题无效)
一、 判断题(每小题 2 分,共 10 小题,总计 20 分)
1.本征半导体中有载流子。 2.三极管的构造特点中,发射区杂质浓度最高,而基区厚度最小。 3.晶体管的电流放大系数 是指工作在截止区时的电流放大系数。 4.放大器输入电阻越大,则接收信号能力越强。 5.多级负反反馈放大电路容易引起自激抓荡的原因是各级放大电路的参数分散。 6. 差分放大电路能抑制差模信号。 7. 输出只跟当前输入有关的数字电路,称为组合逻辑电路。 8.T’触发器有保持和计数两种功能。 9.寄存器中的一个触发器可以表示两种状态,因此可以表示两位二进制数。 10.D/A 转换是把数字信号转换为模拟信号。
C. 反馈环内的 干扰和噪声
D. 反馈环外的 干扰和噪声
5.带射极电阻 Re 的共射放大电路,在电阻 Re 两端并联交流旁路电容 Ce 后其电压放大倍
数的数值(
)。
A.减小
B.增大
C.不变
D.变为零
6.直流稳压电源中整流的目的是(
)。
A.将交流变为直流
B.将高频变为低频
C.将正弦波变为方波
D.将交流变为单向脉动电压
B.截止状态
C.饱和状态
D.无法判断
3.若用万用表测二极管的正、反向电阻的方法来判断二极管的好坏,好的管子应为
(
)。
A.正、反向电阻相等
B.正向电阻大,反向电阻小
C.反向电阻比正向电阻大几倍
D.正、反向电阻都等于无穷大
4.负反馈所能够抑制的干扰和噪声是(
)。
温州大学考研真题物理化学I2009大纲

2009年硕士学位研究生招生考试业务课考试大纲考试科目:物理化学I 科目代码:818
一、编写说明
本纲要对温州师范学院硕士研究生入学考试《物理化学》课程的考试目标、考试范围、考试方式、试卷结构等方面作出说明,是有关专业硕士研究生入学考试命题的主要依据。
二、考试目标
考试目标是考试要求的具体化,反映了报考学生学习《物理化学》所应达到的知识水平的合格标准。
考生应比较熟练地掌握物理化学的基本概念、基本原理及基本方法,并能较好地结合具体条件,灵活应用理论知识,分析问题、解决问题。
在有关的物理量计算和表述中,应尽量采用新的国家标准单位制(SI制)及遵循近似运算规则。
对《物理化学》知识水平的要求分为(A)识记;(B)理解;(C)应用三个层次。
(A)识记
该层次在“记忆”水平上考核学生的学习结果,要求学生能从题目所提供的材料中识别所学知识,或能按题目要求复述所学知识。
在“识记”水平上考核下列内容:
①基本概念、原理、定律和公式的表述;
②专业术语和物理化学常数;
③不同概念的联系和区别;
编写人:硕士点负责人:主管院长:
第1 页,共7 页。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
20、今有一球形肥皂泡,半径为 r ,肥皂水溶液的表面张力为 ,泡外大气压力为 p ,则 肥皂泡内气体压力为 (A) p 2 r (C) p 4 r (B) p 2 r (D) p 4 r ( ) ( )
21、外加直流电场于胶体溶液,向某一电极作定向运动的是 (A) 胶核 (B) 紧密层 (C) 胶团 (D) 胶粒 22、已知某反应t1/2:t3/4=1:2,该反应的反应级数为 ( )
第 4 页,共 7 页
(A) 零级 (C) 二级 23、二级反应 (A) 是分子数为2的反应
(B) 一级 (D) 三级 ( )
(B) 是分子数为1的反应 (D) 可能是分子数为1的反应 ( )
(C) 可能是分子数为2的反应 24、下列不属于复合反应的是 (A) 对峙反应 (C) 链反应
(B) 对行反应 (D) 置换反应
2015年硕士研究生招生入学考试试题A
科目代码及名称: 824 物理化学 适用专业:化学/应用化学
(请考生在答题纸上答题,在此试题纸上答题无效) 一、单项选择题 (每小题2分,共50分。) 1、∆S = ∆H/T适合于下列过程中的哪一个?( ) (A) 恒压过程 (B) 绝热过程 (C) 恒温过程 (D) 可逆相变过程 2、某过程的ΔS > 0,表明该过程是( ) (A). 可逆 (B). 自发 (C). 非自发 (D) 自发或非自发 3、对于理想气体,下面那个等式是不正确的( ) U U ( A) ( )V 0, (B) ( )T 0 T V H U (C ) ( )T 0, (D) ( )T 0 p p 4、下列气体溶于水溶剂中,哪个气体不能用亨利定律( ) (A) N2 ; (B) O2 ; (C) NO2 ; (D) CO 。 5、在 373.15K 和 101325 Pa 下,水的化学势μH2O(l)和水汽的化学势 μH2O(g)的关系是 ( ) (A). μH2O(l) =μH2O(g) (B). μH2O(l) > μH2O(g) (C). μH2O(l) <μH2O(g) (D). 无法知道 6、NH4HS(s)和任意量的NH3(g)及H2S(g)达平衡时,有( )
第 3 页,共 7 页
(B).系统的热力学性质都能用q来表示,它是联系宏观性质与微观结构的桥梁。 (C).它具有析因子的性质,其数值与零能级的选择有关。 (D).q是无量纲的微观量,对于U,V,N确定的系统没有确定的数值。 17、实际晶体属于以下哪种热力学统计系统( ) (A).独立的定域子系统 (B).独立的离域子系统 (C).相依的定域子系统 (D).相依的离域子系统 2+ 3+ 18、Fe ,Fe ∣Pt属于 ( ) (A) 第一类电极 (B) 第二类电极 (C) 第三类电极 (D) 以上都不是 19、一定体积的水,当聚成一个大水球或分散成许多小水滴时,同温度下,两种状态相比 ,以下性质保持不变的是 (A) 表面能 (C) 比表面 (B) 液面下的附加压力 (D) 表面张力 ( )
第 1 页,= 2 (B) C= 1,Φ = 2,f= 1 (C) C= 2,Φ = 3,f= 2 (D) C= 3,Φ= 2,f= 3 7、在相图上,当体系处于下列哪一点时只存在一个相? ( ) (A)恒沸点 (B) 熔点 (C) 临界点 (D) 低共熔点 8、298K、101.325kPa下,将50ml与100ml浓度均为1mol·dm-3 萘的苯溶液混合,混合液的化学势μ为 ( ) (A)μ = μ + μ (B)μ = μ + 2μ (C)μ = μ = μ2
1 1 2
(D)μ = ⅓μ + ⅔μ
1
1
2
9、对反应CO(g)+H O(g)=H (g)+CO (g),有 ( 2 2 2 (A) Kø =1 (B) Kø = KC (C) Kø>KC (D) Kø <KC 10、下面哪一个不属于稀溶液依数性( ) (A)沸点升高 (B)凝固点降低 (C)具有渗透压 (D)熵增加 11、下列过程中△U及△H均为零的是( ) ①非理想气体经卡诺循环 ②理想气体节流膨胀 ③理想气体绝热可逆过程
25、假定某原子的电子态有两个主要能级,即基态和第一激发态,能级差为1.38 10-21 J,其余能级可以忽略,基态是二重简并的。则在100 K时,第一激发态与基态上的原子数之比为: (A) 3 (B) 0.184 (C) 1 (D) 0.01 ( )
二、判断题 (每小题2分,共20分。) 1.理想气体的内能U与p和V均无关,所以U与pV也无关。 2.不可逆过程就是自发过程。 3.可逆热机带动的机车是跑得较快的机车。 4.为了计算绝热不可逆过程的熵变,可以在始末态之间设计一条可逆途径来计算。 5.系统由V1膨胀到V2,其中经过可逆途径时做的功最多。 6.法拉第定律描述的是通过的电量与电极反应的产物的量之间的关系。 7.离子迁移数是指该离子分担导电任务的分数,因此同一离子在不同的电解质溶液中的 迁移数总是相同的。 8.对于热力学参量U,V,N确定的粒子系统,任意一个可能出现的微观状态都具有相同 的数学概率。 9.光化学反应初级过程的速率只与光强有关。
(
)
(A) 10 4 kPa (B)1 kPa 1 (C) 10 kPa (D) 10 2 kPa 13、当溶液中溶质浓度采用不同浓标时,下列正确的是 ( ) (A)溶质的活度相同 (B)溶质的活度系数相同 (C)溶质的标准化学势相同 (D)溶质的化学势相同 14、某理想气体的 =1.40,则该气体应为 气体? (A) 单原子分子气体 (B) 双原子分子气体 (C) 三原子分子气体 (D) 四原子分子气体 15、理想气体在一定压力下绝热膨胀后,气体的温度将:( ) (A) 不变 (B) 升高 (C) 降低 (D) 不能确定 16、下面关于配分函数q的说法中错误的是( ) (A).它是粒子的所有可能状态的玻兹曼因子的总和,反映其在各状态的分配特性。
2
)
④100℃,101.325KPa下1mol H2O (l)蒸发成H2O(g)
第 2 页,共 7 页
(A). ①③ (B). ①② (C). ③④ (D). ②④ 12、在298K时反应CuSO4·3H2O(s) = CuSO4(s) + 3H2O(g)的标准平衡常数 K =10-6,则此时平衡的水蒸气分压为
