铁铜复习详解
高考化学总复习第六单元铁铜的获取及应用新人教

第六单元 铁、铜获取及应用[学考标准]2+、Fe 3+性质及转化(c)。
一、铁、铜存在与性质1.自然界铁、铜存在形式(1)铁存在⎩⎪⎨⎪⎧化合态:地球上只能以化合态存在,磁铁矿和赤铁矿游离态:只存在于陨铁〔天石〕(2)铜存在⎩⎪⎨⎪⎧化合态:地球上主要以化合态存在,黄铜矿和孔雀石游离态:自然界存在少量单质铜,天然铜2.铁、铜物理性质(1) 铁物理性质:银白色金属,具有良好延展性,是电与热良导体,可以被磁铁吸引。
(2) 铜物理性质:紫红色金属,热与电良导体。
3.工业炼铁反响原理(1)设备:炼铁高炉。
(2)原料:铁矿石、焦炭、空气、石灰石等。
(3)反响原理:在高温下,用CO 把铁从铁矿石中复原出来。
主要反响:①CO(复原剂)生成:C +O 2=====点燃CO 2,C +CO 2=====高温2CO ; ②铁生成:Fe 2O 3+3CO=====高温2Fe +3CO 2; ③炉渣形成:CaCO 3=====高温CaO +CO 2↑,CaO +SiO 2=====高温CaSiO 3。
(4)产品:含碳2%~4.5%为生铁,含碳0.03%~2%为钢。
4.铁、铜化学性质二、Fe2+、Fe3+性质及转化1.Fe2+、Fe3+性质2+、Fe3+转化1.以下铁单质或化合物中,铁元素只有氧化性是( )A.Fe B.FeCl2C.FeCl3D.Fe3O4解析铁元素处于最高价态(+3价)Fe3+只有氧化性,FeCl3符合题意;Fe3O4中含有+2价铁,故C项正确。
答案C2.以下有关铜说法中,不正确是( )A.铜是一种紫红色金属B.铜是热与电良导体C.铜在自然界中主要以单质形式存在D.铜是人类使用最早、应用最广泛金属之一解析铜是一种紫红色金属,是热与电良导体,自然界中主要以化合态形式存在,存在少量天然铜,是人类使用最早、应用最广泛金属之一,故C项错误。
答案C3.以下有关Fe2+与Fe3+表达中,错误是( )A.Fe2+水溶液呈无色B.Fe3+水溶液呈黄色C.Fe2+具有氧化性又有复原性D.配制FeCl2溶液时参加铁粉是为了防止Fe2+被氧化解析Fe2+水溶液呈浅绿色,A项错误。
铁、铜及其化合物知识点
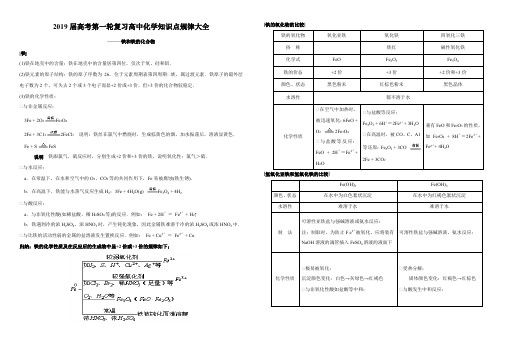
2019届高考第一轮复习高中化学知识点规律大全——铁和铁的化合物[铁](1)铁在地壳中的含量:铁在地壳中的含量居第四位,仅次于氧、硅和铝.(2)铁元素的原子结构:铁的原子序数为26,位于元素周期表第四周期Ⅶ族,属过渡元素.铁原子的最外层电子数为2个,可失去2个或3个电子而显+2价或+3价,但+3价的化合物较稳定.(3)铁的化学性质:Ⅶ与非金属反应:3Fe + 2O2Fe3O42Fe + 3C122FeCl3 说明:铁丝在氯气中燃烧时,生成棕黄色的烟,加水振荡后,溶液显黄色.Fe + S FeS说明铁跟氯气、硫反应时,分别生成+2价和+3价的铁,说明氧化性:氯气>硫.Ⅶ与水反应:a.在常温下,在水和空气中的O2、CO2等的共同作用下,Fe易被腐蚀(铁生锈).b.在高温下,铁能与水蒸气反应生成H2:3Fe + 4H2O(g) Fe3O4 + 4H2Ⅶ与酸反应:a.与非氧化性酸(如稀盐酸、稀H2SO4等)的反应.例如:Fe + 2H+=Fe2++ H2↑b.铁遇到冷的浓H2SO4、浓HNO3时,产生钝化现象,因此金属铁难溶于冷的浓H2SO4或浓HNO3中.Ⅶ与比铁的活动性弱的金属的盐溶液发生置换反应.例如:Fe + Cu2+=Fe2++ Cu归纳:铁的化学性质及在反应后的生成物中显+2价或+3价的规律如下;[铁的氧化物的比较]Ⅶ在空气中加热时,被迅速氧化;6FeO +O22Fe3O4Ⅶ与盐酸等反应:FeO + 2H+=Fe2++H2OⅦ与盐酸等反应:Fe2O3 + 6H+=2Fe3++ 3H2OⅦ在高温时,被CO、C、A1等还原:Fe2O3 + 3CO2Fe + 3CO2[氢氧化亚铁和氢氧化铁的比较][Fe3+和Fe2+的相互转化]例如:2Fe3++ Fe =3Fe2+应用:Ⅶ除去亚铁盐(含Fe2+)溶液中混有的Fe3+;Ⅶ亚铁盐很容易被空气中的O2氧化成铁盐,为防止氧化,可向亚铁盐溶液中加入一定量的铁屑.例如:2Fe2++ Cl2=2Fe3++ 2Cl-应用:氯化铁溶液中混有氯化亚铁时,可向溶液中通入足量氯气或滴加新制的氯水,除去Fe2+离子.Fe2+Fe3+[Fe2+、Fe3+的检验](1)Fe2+的检验方法:Ⅶ含有Fe2+的溶液呈浅绿色;Ⅶ向待检液中滴加NaOH溶液或氨水,产生白色絮状沉淀,露置在空气中一段时间后,沉淀变为灰绿色,最后变为红褐色,说明含Fe2+.Ⅶ向待检液中先滴加KSCN溶液,无变化,再滴加新制的氯水,溶液显红色,说明含Fe2+.有关的离子方程式为:2Fe2++ Cl2 =2Fe3++ 2Cl-Fe3++ 3SCN-=Fe(SCN)3Ⅶ加入K3[Fe(CN)6],若产生特征蓝色沉淀,说明含Fe2+(2)Fe3+的检验方法:Ⅶ含有Fe3+的溶液呈黄色;Ⅶ向待检液中滴加NaOH溶液或氨水,产生红褐色沉淀,说明含Fe3+.Ⅶ向待检液中滴加KSCN溶液,溶液呈血红色,说明含Fe3+.进行铁及其化合物的计算时应注意的事项:(1)铁元素有变价特点,要正确判断产物;(2)铁及其化合物可能参加多个反应,要正确选择反应物及反应的化学方程式;(3)反应中生成的铁化合物又可能与过量的铁反应,因此要仔细分析铁及其化合物在反应中是过量、适量,还是不足量;(4)当根据化学方程式或离子方程式计算时,找出已知量与未知量的关系,列出方程式或方程式组;(5)经常用到差量法、守恒法.2019届高考第一轮复习高中化学知识点规律大全——铜1、单质铜(1)物理性质:铜是硬度较小的紫红色金属,具有良好的延展性、导电性和导热性,广泛应用于电器和电子工业中。
铁铜及其重要化合物高三一轮复习

钢 高碳钢 >0.6%
具有各种不同 的优良性能
合金钢
在碳素钢中加入铬 锰钨镍钼钴硅等
合金元素 7
2 、铜合金:
青铜: 含Cu Sn Pb等——硬而脆,强度大
铜 黄铜: 含Cu Zn——耐腐蚀,耐磨,可塑性强,
合
硬度较小。
金 白铜: 含Ni Zn(少量Mn)——制酒具等
3、铝合金:密度小、强度大
合金的成分不同,其性质也不 相同;如果改变某一合金元素的含 量,合金的性质也会发生改变。
2
金属概述
1.金属晶体的特点: 金属晶体是由金属阳离子和自由电子组成,
其中自由电子并不属于某个固定的金属阳离子, 而可以在整个金属中自由移动
2.金属的性质特点: ①常温下,单质都是固体,汞(Hg)除外; ②大多数金属呈银白色,有金属光泽, 但金(Au)—黄—色,铜(Cu)—红—色,铋(Bi) 微红 色,
可溶性碱与亚铁盐溶液反应 可溶性碱与铁盐溶液反应
制法
Fe2++2OH—= Fe(OH)2↓
Fe3++3OH—= Fe(OH)231↓
专题 Fe(OH)2制备
思考1.制取Fe(OH)2并使之能久存,可采取的操作有: ①加入一些植物油. ②溶解FeSO4配成溶液. ③把蒸馏水加热煮沸并密封冷却.
④加入少量铁屑. ⑤加入少量CCl4, ⑥向FeSO4溶液中滴入足量氨水. ⑦把盛有氨水的滴管伸入FeSO4溶液中后再挤出氨水。
物理性质 白色絮状,不溶于水
红褐色胶状,不溶于水
1.弱碱性2.还原性3.热不稳定性
化学性质
Fe(OH)2+2H+= Fe2++2H2O 4Fe(OH)2+O2+2H2O=4Fe(OH)3
第12讲 铁铜及其化合物(讲义)(解析版)

第12讲 铁铜及其化合物一 铁的位置和物理性质1.铁及其化合物间的主线Fe―→⎩⎪⎨⎪⎧FeO Fe 2O 3Fe 3O 4―→⎩⎨⎧Fe OH2Fe OH 3―→⎩⎨⎧FeSO 4·7H 2OFeCl 32.铁及其化合物间的转化关系3.铁元素的变价 (1)单质铁①生成+2价:铁与S 、H +、Cu 2+、I 2等反应生成+2价。
如:Fe +SFeS 、Fe +Cu 2+===Fe 2++Cu 。
①生成+3价:铁与Cl 2、Br 2等反应生成+3价。
如2Fe +3Cl 2=====点燃2FeCl 3。
①生成+2、+3价:铁与H 2O 、O 2反应生成Fe 3O 4。
3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2。
①铁与HNO 3反应:当Fe 过量生成+2价,3Fe +8H ++2NO -3===3Fe 2++2NO +4H 2O ; 当Fe 不足时生成+3价,Fe +4H ++NO -3===Fe 3++NO +2H 2O 。
(2)铁的化合物:FeO 、Fe 3O 4、Fe 2O 3、Fe(OH)2、Fe(OH)3、Fe 2+、Fe 3+等。
+2价铁具有还原性,与强氧化性物如HNO 3、Cl 2等发生氧化还原反应: 如:3FeO +10HNO 3===3Fe(NO 3)3+NO +5H 2O 。
+3价铁具有氧化性,与强还原性物质, 如:HI 、Fe 、Cu 、I -、S 2-等发生氧化还原反应,如:Fe 2O 3+6HI===2FeI 2+I 2+3H 2O,2Fe 3++Cu===2Fe 2++Cu 2+。
特别强调:①Fe 与一般酸反应生成Fe 2+,与酸的量无关,但Fe 与稀HNO 3反应时最终铁的价态与铁的量有关。
①铁与硫蒸气反应生成的是FeS 而不是Fe 2S 3;铁与碘蒸气反应生成的是FeI 2而不是FeI 3。
4.铁的氧化物特别强调:①FeO 、Fe 3O 4、Fe 2O 3与硝酸反应时均生成Fe 3+。
铁铜的知识点总结

铁铜的知识点总结铁铜是两种重要的金属材料,被广泛应用于工业和生活中。
铁是人类非常早期发现并利用的金属之一,而铜也是早期的重要金属之一。
两种金属都具有独特的性质和用途,本文将对铁铜的相关知识点进行总结。
铁的性质和用途铁是地球上最常见的金属之一,它的原子序数为26,原子量为55.85。
铁的熔点为1538摄氏度,沸点为2862摄氏度。
铁是银白色的金属,在空气中会发生氧化,形成红色的铁氧化物。
铁具有良好的导热性和导电性,同时也是一种磁性材料。
铁是一种重要的结构材料,广泛应用于建筑、桥梁、汽车、船舶等领域。
由于铁的强度和耐腐蚀性能较好,因此也被用于制作锅具、工具和机械零件。
此外,铁还可以通过炼铁、炼钢等工艺加工成各种形状的材料,如钢材、铸铁等,这些材料在工业制造中起着重要的作用。
另外,铁也是人体必需的微量元素之一,对人体的血液循环、氧气运输等起着重要的作用。
因此,人体需要通过食物摄入足够的铁元素来满足生理需求。
铜的性质和用途铜是一种古老的金属,具有良好的导热性和导电性,是广泛应用于电气、电子领域的重要材料。
铜的原子序数为29,原子量为63.55,熔点为1083摄氏度,沸点为2595摄氏度。
铜是一种红色的金属,在空气中会逐渐氧化,形成绿色的铜氧化物。
铜是一种重要的非铁金属,广泛应用于制造电线、电缆、电器、电子元件等产品。
由于铜的导电性和导热性都非常好,因此在电气和电子领域具有重要的地位。
此外,铜也可以用于制作铜管、铜板、铜合金等产品,在建筑、食品加工、化工等领域也有着广泛的应用。
铜也是人体必需的微量元素之一,对人体的生理功能和健康起着重要的作用。
人体需要通过食物摄入足够的铜元素来满足生理需求。
铁铜合金铁铜合金是铁和铜的合金,通常含有铁80%-95%和铜5%-20%的成分。
铁铜合金具有铁和铜的优点,具有较高的强度、硬度和耐腐蚀性能,同时保持了铜的良好的导电性和导热性。
铁铜合金通常用于制造轴承、齿轮、机械零件等产品,具有良好的机械性能和耐磨性能,在汽车、机械、航空航天等领域有着广泛的应用。
高一化学必修一铁和铜知识点

高一化学必修一铁和铜知识点铁和铜是我们生活中常见的金属元素,具有广泛的应用。
本文将介绍高一化学必修一中有关铁和铜的相关知识点。
一、铁的性质和用途1. 铁属于过渡元素,化学符号为Fe,原子序数为26,原子量为55.85。
2. 铁是一种有良好延展性和塑性的金属,具有良好的导电和导热性能。
3. 铁在常温下呈固态,熔点约1535℃,沸点约2750℃。
4. 铁在空气中容易被氧气氧化,形成铁锈。
铁锈主要是由三氧化二铁(Fe2O3)组成。
5. 铁广泛应用于建筑、制造、交通等领域。
例如,用于建筑的钢筋是一种铁制品。
二、铁的加工和提取1. 铁的加工方式有锻造、铸造、冷加工和热加工等。
其中,锻造是通过对金属材料进行打击或挤压,改变其形状和内部结构来实现加工目的。
2. 铁的提取主要有矿石炼铁和废钢炼铁两种方法。
其中,矿石炼铁是从铁矿石中提取铁,而废钢炼铁是通过回收废旧钢材来提取铁。
三、铜的性质和用途1. 铜是一种红色金属,化学符号为Cu,原子序数为29,原子量为63.55。
2. 铜是一种良好的导电金属,具有良好的导热性能。
3. 铜具有优良的延展性和塑性,可以制成各种形状,如线材、片材等。
4. 铜在常温下呈固态,熔点约1083℃,沸点约2595℃。
5. 铜广泛应用于电子、建筑、制造等领域。
例如,电线、电缆中常使用的导线就是铜制品。
四、铜的加工和提取1. 铜的加工方式有冷加工和热加工等。
冷加工是在室温下进行,可以得到高强度和高硬度的铜制品。
热加工是在高温下进行,可以改变铜的形状和内部结构。
2. 铜的提取主要有矿石冶炼和再生冶炼两种方法。
矿石冶炼是从铜矿石中提取铜,再生冶炼是通过回收废旧铜材来提取铜。
五、铁和铜的相似点与差异点1. 相似点:铁和铜都是金属元素,具有良好的导电性和导热性。
两者都可以通过加工方式改变形状和内部结构。
2. 差异点:铁的密度约为7.87 g/cm³,而铜的密度约为8.96g/cm³;铁的熔点和沸点较高,而铜较低;铁在空气中容易氧化生成铁锈,而铜不易氧化。
高考化学知识点讲解详解大全《铁铜及其重要化合物》

高考化学知识点解说详解大全《铁铜及其重要化合物》高考化学知识点解说详解大全《铁铜及其重要化合物》2010 高考高三化学知识点详解大全——《铁、铜及其重要化合物》考点 1 “铁三角”及其应用因为 Fe 是变价元素 , 在反响能够失掉 2 个电子 , 也能够失掉 3 个电子,所以呈不一样的价态。
铁遇弱氧化剂 ( 如 S、H+、Cu2+、I2 等) 时, 铁只好失掉最外层的电子 , 而生成价铁的化合物 , 当碰到强氧化剂 ( 如Cl2 、Br2、 HNO3等) 时, 铁原子能够再失掉次外层上的电子而生成价铁的化合物。
而且价比价稳固。
“铁三角”指的是 Fe、Fe2+、Fe3+三者互相转变的三角关系 , 详细应用有以下几个方面 :1.共存问题(1)Fe2+ 在酸性条件下不可以与强氧化性离子共存 , 如: 等。
不能与发生复分解和双水解反响的离子共存, 如: 等。
(2)Fe3+: 不可以与复原性离子共存, 如 : 等。
不可以与发生复分解和双水解反响的离子共存 , 如: 等; 不可以与 SCN共-存 ; 不可以与苯酚共存。
2.分别与提纯(1)FeCl2( 杂质 FeCl3), 加入或后过滤。
(2)FeCl3( 杂质 FeCl2), 通入或滴加或加入“绿色”氧化剂:。
3.制备物质(1)工业冶炼铁 , 如:Fe3O4+4CO3Fe+4CO2(2)制取氢氧化亚铁实验原理 :实验现象 : 。
要制得白色的Fe(OH)2 积淀 , 要注意以下几点 :①硫酸亚铁溶液不可以含有Fe3+,所以 , 硫酸亚铁溶液应是。
②实验用的氢氧化钠溶液, 溶解亚铁盐的蒸馏水应煮沸, 以。
③实验时, 用长胶头滴管汲取氢氧化钠溶液后, 把滴管插入硫酸亚铁溶液的 , 再轻轻挤胶头滴管的胶头 , 逐滴加入氢氧化钠溶液 , 这时就会析出Fe(OH)2 白色絮状积淀。
[ 例 1](2009 届金湖学第二次质量检测 ) 因为 Fe(OH)2 在空气易被氧化 , 同学们为了察看到白色的 Fe(OH)2 固体想了好多方法。
苏教版铁铜及其化合物知识点

复习课题五 铁、铜的获取及应用知识点整理一、铁、铜的获取1、铁、铜的存在:铁、铜在自然界中主要以 的形式存在于自然界。
常见的有磁铁矿 、赤铁矿 。
铁元素在地壳中的含量为4.65%,我国有丰富的铁矿资源,但品位不高。
常见的铜铁矿有黄铜矿____________、孔雀石 ________等。
2.铁、铜的工业生产(1)高炉炼铁①原理:在高温下,用___________________把铁从铁矿石中还原出来。
②原料:_____________________________________________________________。
③设备: ___________________。
④主要反应:A .还原剂的生成_________________________________________________________。
B .铁矿石的还原_________________________________________________________。
C .炉渣的形成____________________________________________________________。
⑤产品:含碳2%~4.5%的________________,将生铁进一步炼制,就可以得到用途更广泛的________(含碳0.03%~2%)(2)铜的冶炼①工业炼铜 黄铜矿(___________) 粗铜 精铜②生物炼铜:原理:CuS CuSO 4 Cu3. 冶炼金属常用方法(1)加热法——加热金属的氧化物和硫化物,使其分解出金属,例如Ag 2O=2Ag +O 2,适用于冶炼稳定金属。
(2)还原剂法——用还原剂把金属从化合物种还原出来。
常见的还原剂有H 2、CO 、C 、Al 等。
例如:Fe 2O 3+CO ——_________________________________________,WO 3+H 2——___________________________________________,Cr 2O 3+Al ——__________________________________________。
高考化学一轮复习铁铜氯溴碘及其化合物
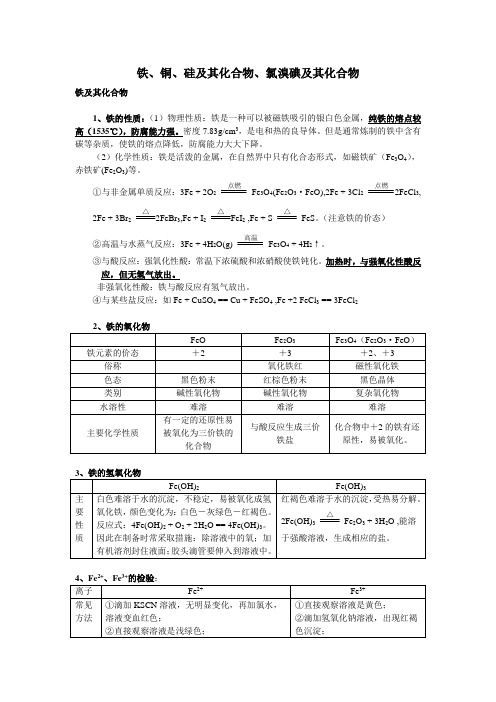
Br2深棕红色液体
橙色
橙红色
橙红色
橙红色
I2紫黑色固体
黄色
紫红色
紫红色
碘酒呈棕色
注: >ρ水>ρ汽油(或苯)
裂解汽油含有C=C,溴水、碘水易与它发生加成反应。
3、化学通性
①与金属反应。注Fe+I2 FeI2(因为氧化性:Fe3+>I2)
②与H2反应。
卤素与H2反应比较表III
离子方程式:Cl2+H2O H++Cl—+HClO
氯水的成分:分子——大量Cl2、H2O、少量HClO;离子——H+、Cl-、ClO-、OH-;
注:氯水中的HClO具有强氧化性,能氧化细菌、色素等,具有漂白性,杀菌消毒,但干燥Cl2不能使有机色素褪色。
(4)与碱反应
Cl2+2NaOH===NaCl+NaClO+H2O
提供的试剂:稀盐酸稀硫酸KSCN溶液KMnO4溶液NaOH溶液碘水
所选试剂为。证明炉渣中含有的实验现象为
。
氯溴碘及其化合物
一、氯气
1、物理性质:黄绿色,刺激性气味,有毒,能溶于水(体积比1︰2),易液化。
2、化学性质
原子结构特点:Cl Cl+e-=Cl-易得1e-,具强氧化性,是活泼的非金属。
(1)与金属反应
从高炉中出来的铁含有2-4.5%的C和其他杂质,性能差,需进一步的炼制得到性能较好的钢。高炉的尾气常含有CO有毒气体,常采取净化后循环使用的方法。
7.[2012·海南化学卷14](9分)在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:I:向废液中投入过量铁屑,充分反应后分离出固体和滤液:
SiO2+2F2==SiF4↑+O2↑,SiO2+4HF==SiF4↑+2H2O
高考化学一轮复习:铁和铜及其化合物知识点总结

1 高考化学一轮复习:铁和铜及其化合物知识点总结一、铁、铜性质二、铁及其化合物的主要反应 ① 氯化铁溶液中加入铁粉(除去氯化亚铁中的氯化铁):2FeCl 3 + Fe == 3FeCl 2 2Fe 3+ + Fe == 3Fe 2+ ② 铁与硫酸铜反应(湿法炼铜):Fe + CuSO 4 == FeSO 4 + Cu Fe + Cu 2+ == Fe 2+ + Cu ③ 氯化亚铁溶液中滴加氯水(除去氯化铁中的氯化亚铁):2FeCl 2 + Cl 2 == 2FeCl 3 2Fe 2+ + Cl 2 == 2Fe 3+ + 2Cl -④ 氢氧化亚铁在空气中变质:4Fe(OH)2 + O 2 + 2H 2O == 4Fe(OH)3 ⑤ 铜与氯化铁反应(用氯化铁腐蚀铜电路板):2FeCl 3 + Cu == 2FeCl 2 + CuCl 2 2Fe 3+ + Cu == 2Fe 2+ + Cu 2+ 三、Fe 2+与Fe 3+的相互转化(1)Fe 2+ → Fe 3+:Fe 2+与强氧化剂(如Cl 2、Br 2、O 2、HNO 3、KMnO 4、浓H 2SO 4、H 2O 2等)反应时,被氧化成Fe 3+:如:2Fe 2+ + Cl 2 == 2Fe 3+ + 2 Cl − 3Fe 2+ + 4H + + NO 3− == 3Fe 3+ + 2H 2O + NO↑(2)Fe 3+ → Fe 2+:Fe 3+与还原剂(如Zn 、Fe 、Cu 、S 2−、I −、H 2S 等)反应时,被还原成Fe 2+:如:Fe + 2Fe 3+ == 3Fe 2+ Cu + 2Fe 3+ == Cu 2+ + 2Fe 2+ 2I − + 2Fe 3+ == I 2 + 2Fe 2+四、Fe 3+(黄色)的检验实验①:向FeCl 3溶液中加入几滴KSCN 溶液,溶液显血红色 Fe 3+ + 3SCN − == Fe(SCN)3(血红色溶液) 实验②:向FeCl 3溶液加入NaOH 溶液,有红褐色沉淀Fe 3+ + 3OH − == Fe(OH)3↓五、Fe 2+(浅绿色)的检验实验①:向FeCl 2溶液加入NaOH 溶液Fe 2+ + 2OH − == Fe(OH)2↓(白色) 4Fe(OH)2 + O 2 + 2H 2O == 4Fe(OH)3(红褐色) 实验②:加入KSCN 溶液,无现象,再加入适量氯水,溶液显血红色。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4Fe(OH)3
加 KSCN 溶液 或
NH4SCN
现象:不变红色,若 现象:变血红色 再通Cl2则变血红色 3+ 2Fe2++Cl
3++2Cl=2Fe 2
Fe3++3SCN-=Fe(SCN)3
Fe +3SCN =Fe(SCN)3
Fe(OH)2的制备
①新制可溶性的Fe2+盐 ②加热煮沸NaOH溶液 ③胶头滴管伸入液面以下 ④液面上加有机保护层(密度小于水)
两支试管中的空气被氢气驱除,外界空气不易进 入试管氧化Fe(OH)2
例3.要证明某溶液中不含Fe3+而可能含有Fe2+。进行实 验操作的顺序有:①加入足量氯水,②加入足量高锰酸 钾溶液,③加入少量硫氰化钾溶液,其中顺序正确的是 C A.①③ B.③② C.③① D.①②③
例 1. 在 FeCl3 溶液中加少量 Na2S 溶液,溶液变浑浊,这时反应的离 子方程式是 2Fe3++S2-==2Fe2++S↓,如果 再继续加入Na2S溶液时,则出现黑 色沉淀,此时反应的离子方程式 是 Fe2++S2-==FeS↓ 。
例2.用下面两种方法可以制得白色的Fe(OH)2沉淀。 方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸 馏水配制的NaOH溶液反应制备。 ( 1 )用硫酸亚铁晶体配制上述 FeSO4 溶液时还需 加入 少量稀H2SO4 。 (2)除去蒸馏水中溶解的O2常采用加热 的方法。 ( 3 )生成白色 Fe(OH)2 沉淀的操作是用长滴管吸 取不含O2的NaOH溶液,插入FeSO4溶液液面下,再 挤出NaOH溶液。这样操作的理由是 。
E.与同浓度的盐酸反应,生铁速度快
F.铁制容器贮可存冷的浓HNO3与浓H2SO4 是因为 铁和冷的浓HNO3与浓H2SO4 不反应。 G. Fe是一种常见的黑色重金属具有多种变价。
H.Fe、Al、Zn、Mg等金属都有磁性。
[练习]:
1、区分还原铁粉和氧化铜粉末的最简单 方法是? 2、下列物质可用铁桶盛装的是: CuSO4 B、 A、 FeCl3
2.铁的物理性质 铁具有银白色金属光泽,纯铁质软, 密度大(7.86g/cm3),
熔沸点高(熔点15350C,沸点是27500C) , 有良好的延展性、导电性和导热性, 有铁磁性,能被磁铁吸引
二、单质铁
化学性质:铁是比较活泼的金属单质,在化学 反应中通常作还原剂,体现比较强的还原性。 纯净的铁有抗腐蚀性。 (1)与非金属反应 3Fe+2O2=Fe3O4 2Fe+3Cl2=2FeCl3 Fe+I2=FeI2 Fe+S=FeS (2)与水反应 3Fe+4H2O(g) =Fe3O4+4H2↑
1mol/ LHNO3 C、 3 0 H SO 1 . 84 g / cm , 98 D、 0 2 4 3、将铁粉撒入下列溶液中充分反应后, 溶液的质量增加但无气体放出的是: HgNO3 2 D、 CuCl2 B、 H 2 SO4 C、 Fe2 SO4 3 A、
二、铁的氧化物:
名 称 氧化亚铁 氧化铁 四氧化三铁 俗 称 铁 红 磁性氧化铁 化学式 FeO Fe2O3 Fe3O4 色 态 黑色 粉末 红棕色粉末 黑色晶体 +2 +3 + 2, + 3 化合价 不 溶 不 溶 水溶性 不 溶 碱性氧化物 类 型 共 与酸 都能与酸反应。如 Fe O 6H 2Fe 3H O
3 2 3 2
与 还 都能被还原。如Fe O 3CO高温 2 Fe 3CO 性 原剂
2 3
2
2、铁的氢氧化物性质比较
化学式 Fe(OH)2
Fe(OH)3
制备:实验拓展
颜 色 状 态 溶解性
稳定性
白色沉淀 难溶于水 很不稳定,易氧化 Fe(OH)2+2H+= Fe2++2H2O
红褐色沉淀 难溶于水 稳定 Fe(OH)3+3H+= Fe3++3H2O
铁单质的性质
Cl2 Br2 HNO3 强氧化剂 Fe O2 、H2O(g) Fe3+ Fe2+、Fe3+ Fe2+
I2 、 S 、H+、CuSO4 弱氧化剂
请写出上述关系的有关反应方程式。
思考讨论1 下列有关铁的说法中正确的是(BCE )
A.Fe位于元素周期表中第四周期ⅧB族
B. Fe的原子结构示意图为: C.生活中的 “增铁酱油”中的铁指的是铁元素 。 D.纯铁熔点比生铁的低,纯铁比生铁易生锈
防止NaOH溶液与空气接触而溶解氧气,将Fe(OH)2氧化
方法二:在如图装置中,用NaOH溶液、 铁屑、稀H2SO4等试剂制备。 (1)在试管Ⅰ里加入的试剂 是 。 铁屑、稀 H2SO4 (2)在试管Ⅱ里加入的试剂是 NaOH 。 (3)为了制得白色Fe(OH)2沉淀,在试 管Ⅰ和Ⅱ中加入试剂,打开止水夹, 检验试管Ⅱ排出的气体纯度,当气体 塞紧塞子后的实验步骤是 。 为纯净的H2时关闭止水夹 (4)这样生成的Fe(OH)2沉淀能较长时 间保持白色,其理由是 。
(3)与水的反应
高温 3Fe +4H2O(气) Fe3O4 +4H2↑ 对比 2Na+2H2O===2NaOH+H2↑ 2Al+6H2O==2Al(OH)3+3H2↑
二、单质铁
(3)与酸反应 Fe+2H+=Fe2++H2↑ Fe+H++NO3-=Fe2++NOX+H2O Fe+H++NO3-=Fe3++NOX+H2O Fe+2H2SO4=FeSO4+SO2+H2O 2Fe+6H2SO4=Fe2(SO4)3+3SO2+6H2O (4)与盐反应 Fe+2Fe3+=3Fe2+ Fe+2Ag+=Fe2++2Ag
10届高三化学一轮复习
目的
掌握Fe、Fe2+、Fe3+的相互转化,并能正 确写出有关的氧化还原反应的离子方程式。 掌握Fe2+、Fe3+的检验方法
掌握铁及其化合物的主要性质,了解其 应用
掌握炼铁和炼钢的原理
一.金属铁 1.在元素周期表中的位置
铁位于第四周期第Ⅷ族,过渡元素 原子结构示意图为
与 反 应 转 )2+O2+2H2O=4 Fe(OH)3
Fe3+和Fe2+的检验:
Fe2+:浅绿色 Fe3+:棕 黄色或黄色 现象:白色沉淀 加 NaOH 灰绿色 红褐色 现象:红褐色沉淀 等碱 Fe2++2OH-=Fe(OH)2↓ Fe3++3OH-=Fe(OH)3↓ 溶液 4Fe(OH) +O +2H O=
