蛋白质的空间结构 ppt课件
合集下载
-蛋白质的三维结构ppt课件
两个肽键衍生而来
目录
影响螺旋构成的要素〔P208,熟习〕
(1) R侧链对α-螺旋的影响
R侧链的大小和带电性决议了能否构成α-螺旋以及 构成的α-螺旋的稳定性。
① 多肽链上延续出现带同种电荷基团的氨基酸残基, (如Lys,或Asp,或Glu),那么由于静电排斥,不能 构成链内氢键,从而不能构成稳定的α-螺旋。如多聚 Lys、多聚Glu。而当这些残基分散存在时,不影响α螺旋稳定。
目录
β-凸起(了解)
β-凸起是一种小片的非反复性构 造,能单独存在,大多数经常作 为反平行β-折叠片中的一种不规 那么情况而存在。 β-凸起可以为是β-折叠股中额外 插入的一个残基,它使得在两个 正常氢键之间、在凸起折叠股上 是两个残基,而另一侧的正常股 上的一个残基。 β-凸起可引起多肽链方向的改动, 但改动的程度不如β-转角。
目录
〔1〕超二级构造〔掌握〕
在蛋白质分子中,由假
αα
设干相邻的二级构造单元组
合在一同,彼此相互作用,
构成有规那么的、在空间上
能识别的二级构造组合体。
几种类型的超二级构造:
ββ
αα;ββ;βαβ;
★超二级构造在构造层
次上高于二级构造,但没有
聚集成具有功能的构造域.
βαβ
目录
〔2〕构造域〔P222,掌握〕 多肽链在二级构造或超二级构造的根底 上构成三级构造的部分折叠区,它是相对 独立的严密球状实体,称为构造域。 *对于那些较小的蛋白质分子或亚基来说, 构造域和三级构造是一个意思,也就是说 这些蛋白质或亚基是单构造域的,如红氧 还蛋白、肌红蛋白等; *对于较大的球状蛋白质或亚基,其三级 构造往往由两个或多个构造域缔合而成也
我国1965年在世界上第一个用化学方法人工合成 的蛋白质就是这种牛胰岛素。
第三章蛋白质第三节蛋白质结构ppt文档

➢ Sanger法。2,4-二硝基氟苯在碱性条件下,能够与肽链N-端 的游离氨基作用,生成二硝基苯衍生物(DNP)。
➢ 在酸性条件下水解,得到黄色DNP-氨基酸。该产物能够用乙 醚抽提分离。不同的DNP-氨基酸可以用色谱法进行鉴定。
4、蛋白质一级结构的测定
N-末端分析: (2)丹磺酰氯法(DNS法):
例如:H.Tyr.Gly.Gly.Phe.Met.OH(甲 硫氨酸型脑啡肽)
(1)用结构式来表示,占空间大; (2)用氨基酸中文名称的字头表示; (3)用氨基酸英文名称的三字符或单字符
表示; (4)二肽,三肽,多肽ຫໍສະໝຸດ 3、蛋白质的氨基酸序列和功能
(1)蛋白质的一级结构决定了高级结构和功能。 (page94图3-11)
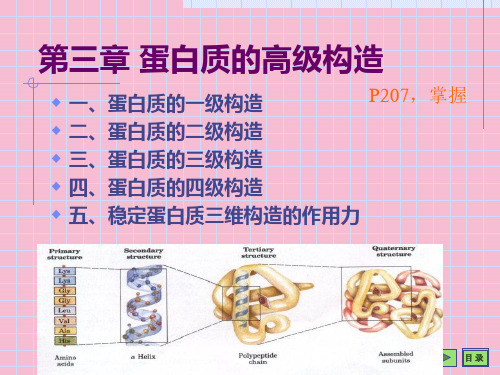
一、蛋白质的一级结构
1、肽的一般概念
链间二硫键
R1
R2
NH CHCONHCHCONHCHCO
CH2
S
S 二硫键
R3
CH2
R4
NH CHCONHCHCONHCHCO
HS CH2 CH COO- NH3+
半胱氨酸
一、蛋白质的一级结构 1、肽的一般概念
链内二硫键
Page92:图3-8
2、肽的命名及表达式
第三章蛋白质第三节蛋白质结构
蛋白质的结构
• 一级结构:肽链中氨基酸的排列顺序; • 二级结构:多肽链本身的折叠方式; • 三级结构:螺旋肽链结构盘绕、折叠成
复杂的空间结构; • 四级结构:蛋白质亚基聚合成大分子蛋
白质的方式; 蛋白质的结构层次:
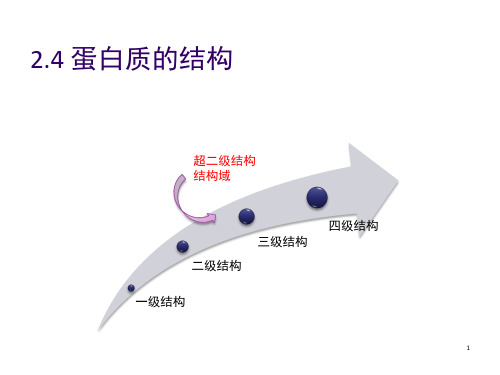
一级结构→二级结构→超二级结构→结构域 →三级结构→四级结构
C-末端分析: (1)肼解法:
多肽与肼在无水条件下加热,C-端氨基酸即从肽链上 解离出来,其余的氨基酸则变成肼化物。肼化物能够与苯 甲醛缩合成不溶于水的物质而与C-端氨基酸分离。
➢ 在酸性条件下水解,得到黄色DNP-氨基酸。该产物能够用乙 醚抽提分离。不同的DNP-氨基酸可以用色谱法进行鉴定。
4、蛋白质一级结构的测定
N-末端分析: (2)丹磺酰氯法(DNS法):
例如:H.Tyr.Gly.Gly.Phe.Met.OH(甲 硫氨酸型脑啡肽)
(1)用结构式来表示,占空间大; (2)用氨基酸中文名称的字头表示; (3)用氨基酸英文名称的三字符或单字符
表示; (4)二肽,三肽,多肽ຫໍສະໝຸດ 3、蛋白质的氨基酸序列和功能
(1)蛋白质的一级结构决定了高级结构和功能。 (page94图3-11)
一、蛋白质的一级结构
1、肽的一般概念
链间二硫键
R1
R2
NH CHCONHCHCONHCHCO
CH2
S
S 二硫键
R3
CH2
R4
NH CHCONHCHCONHCHCO
HS CH2 CH COO- NH3+
半胱氨酸
一、蛋白质的一级结构 1、肽的一般概念
链内二硫键
Page92:图3-8
2、肽的命名及表达式
第三章蛋白质第三节蛋白质结构
蛋白质的结构
• 一级结构:肽链中氨基酸的排列顺序; • 二级结构:多肽链本身的折叠方式; • 三级结构:螺旋肽链结构盘绕、折叠成
复杂的空间结构; • 四级结构:蛋白质亚基聚合成大分子蛋
白质的方式; 蛋白质的结构层次:
一级结构→二级结构→超二级结构→结构域 →三级结构→四级结构
C-末端分析: (1)肼解法:
多肽与肼在无水条件下加热,C-端氨基酸即从肽链上 解离出来,其余的氨基酸则变成肼化物。肼化物能够与苯 甲醛缩合成不溶于水的物质而与C-端氨基酸分离。
《蛋白质的结构》PPT课件

白
上一页 质
一
级
结 下一页 构
的
测
退出
定s s
HcoooH SO3H
SO3H
(2)常用测定方法简介
目录
蛋 D.分析多肽链的N-末端和C-末端。
上一页
白 质
多肽链端基氨基酸分为两类:N-端
一 氨基酸(amino-terminal)和C-端氨基
级 下一页 结
酸。
退出
构 的 测
在肽链氨基酸顺序分析中,最重要 的是N-端氨基酸分析法。
O
O
O
O
NHCHC NHCHC NHCHC NHCHC
R1
R2
R3
R4
水解位点
肽链
谷氨酸蛋白酶: R1=Glu、Asp(磷酸 缓冲液); R1=Glu (磷酸缓冲液或醋酸 缓冲液)
精氨酸蛋白酶: R1=Arg
目录
多 肽 链 上一页 的 选 择 下一页 性 降 解
退出
化学法:可获得较大的肽段
溴化氰(Cyanogen bromide)水解法,它能选择 性地切割由甲硫氨酸的羧基所形成的肽键。
目录
《蛋白质的结构》PPT课件
上一页
下一页 退出
本课件PPT仅供学习使用 本课件PPT仅供学习使用 本课件PPT仅供学习使用
学习完毕请自行删除
目录 上一页 下一页
退出
目录 上一页 下一页
退出
(二)、蛋白质的一级结构(primary structure) (初级结构、肽链结构、化 目录 学结构)
RO H2N CH C
Rn-1O
Rn O
HN CH C HN CH C OH
N-端 氨 基 酸
生物化学蛋白质的三维结构(共44张PPT)

Side view
问题:羊毛衫等羊毛制品在热水中洗涤变长,经枯燥又收缩,而丝制品 经同样处理不收缩,请解释这两种现象。
【解】羊毛纤维多肽链的主要构件单位为连续α-螺旋圈,螺距为0.54nm,在加 热下纤维多肽伸展为 -折叠,相邻R基团之间的距离变为0.7nm,所以变长了; 枯燥后重新由 -折叠转化为α-螺旋,所以收缩了。丝制品是丝心蛋白,为 -折 叠的多肽链,其内含丝氨酸等包装紧密的侧链,比羊毛纤维多肽中的α-螺旋稳 定,所以洗涤枯燥构象根本不变。
假设干β折叠股反平行组合而成,两个β股之间通过一 个发夹链接起来。
六、超二级结构&结构域——结构域:
➢ “结构域〞是在二级结构或超二级结构的根底上形成三级结构的局部折叠区,是相对独立的 紧密球状实体。对那些较小的球状蛋白质分子或亚基来说,结构域和三级结构是一个意思,也 就是说这些蛋白质或亚基是单结构域的如红氧还蛋白等;较大的蛋白质分子或亚基其三级 结构一般含有两个以上的结构域,即多结构域的,其间以柔性的铰链〔hinge〕相连,以便相 对运动。
α-螺旋
肽链像螺旋一样盘曲上升,每3.6个氨基酸残 基螺旋上升一圈,每圈螺旋的高度为0.54nm, 每个氨基酸残基沿轴上升0.15nm,螺旋上升时, 每个残基沿轴旋转100º;
α-螺旋稳定性主要靠氢键来维 持,多肽主链上第n个残基的羰 基和第n+4个残基的酰氨基形成 氢键,环内原子数13,氢键的取 向几乎与轴平行;
肌钙蛋白的两个结构域。
③稳定蛋白质三维结构的作用力——疏水作用和二硫键
➢疏水作用〔hydrophobic interaction):水介质中球状蛋白质的折叠总是倾向与把疏 水残基埋藏在分子的内部,这一现象称为疏水作用,它在稳定蛋白质的三维结构方面 占有突出地位。疏水作用其实并不是疏水基团之间有什么吸引力的缘故,而是疏水基 团或疏水侧链出自避开水的需要而被迫接近。
《蛋白质的结构》PPT课件

36
精选课件ppt
(3) 球状蛋白质分子是紧密的球状或椭球状 实体
(4) 球状蛋白质疏水侧链埋藏在分子内部, 亲水侧链暴露在分子表面
疏水作用力是维持三级结构的主要动力。
(5) 球状蛋白质分子的表面有一个空穴(也称 裂沟、凹槽或口袋)
这种空穴常是结合底物、效应物等配体并 行使生物功能的活性部位。
亚基缔合还可以屏蔽亚基表面 上的疏水残基以避开溶剂水。
41
精选课件ppt
2. 使催化基团汇集在一起
寡聚体的形成可使不同单体亚基的催化基 团汇集在一起以形成完整的催化部位。
42
精选课件ppt
4. 使寡聚蛋白具有别构效应和协同性
多亚基蛋白质一般具有多个结合部位,结合 在蛋白质分子的特定部位上的配体对该分子 的其他部位所产生的影响(如改变亲和力或催 化能力)称为别构效应。
(4)β转角多数都处在蛋白质分子的表面, 在这里改变多肽链方向的阻力比较小。β转 角在球状蛋白质中的含量是相当丰富的, 约占全部残基的四分之一。
21
精选课件ppt
四、无规卷曲(randon coil)
22
精选课件ppt
超二级结构和结构域
23
精选课件ppt
一、超二级结构(super—secondary struture)
-“非极性基团
被极性水分子排 挤相互聚拢”作
用力。
离子键(
或盐键)
精选课件ppt
肽键 二硫键 离子键 氢键 疏水键 范德华力
键能
90kcal/mol
3kcal/mol 1kcal/mol 1kcal/mol 0.1kcal/mol
这四种键能远小于共价键,称次级键
提问:次级键微弱但却是维持蛋白质三级结构中主
《蛋白质结构》PPT课件
构);大的单体蛋白有数个结构域 酶蛋白的活性中心往往
位于结构域之间,有利 于活性中心与底物结合
12
4、蛋白质的三级结构
多肽链在二级结构、超二级结构和结构域等结构 层次的基础上,组装而成的完整结构单元。
三级结构的形成使肽链中所有的原子都达到空间 上的重新排布。
举例:1963年Kendrew等通过鲸肌红蛋白的x-射 线衍射分析,测得了它的空间结构
4
(1)α-螺旋(α-helix)
a-螺旋:是多肽链沿长轴卷曲 而成的有规则的螺旋型构象。
要点 每个螺旋含3.6个AA残基,螺距
0.54nm,螺旋直径0.5nm,每个残 基绕轴旋转100o ; 螺旋体中所有氨基酸残基R侧链 都伸向外侧
5
相邻螺旋间(第n个氨基酸残基C=O的氧与第n+4 个氨基酸残基的-NH氢之间)形成平行于螺旋轴 的氢键,肽链上所有的肽键都参与氢键的形成
20
(三)蛋白质的变性
概念:天然蛋白质受物理或化学因素的影响,分 子内部原有的高度规则性的空间排列发生变化, 致使其原有性质和功能发生部分或全部丧失。
变性的因素及作用机制
因素
作用机制
热
破坏氢键
酸碱
破坏盐键
醇
分子进入肽链间空隙,破坏次级键
ቤተ መጻሕፍቲ ባይዱ
高浓度尿素 破坏氢键
盐酸胍
破坏氢键,使-SH暴露
21
变性后的特征
谷氨酸、丝氨酸 8、请列举氨基酸的化学性质,并简述其应用。
作业:P61 3、4
28
3
2、蛋白质的二级结构
蛋白质的二级结构:蛋白质分子中多肽链本身折叠和 盘绕的方式,它仅涉及肽链中主链的构象,并不涉及 侧链的构象。
蛋白质主链的折叠是由氢键维系的有规则的重复构象 组成
位于结构域之间,有利 于活性中心与底物结合
12
4、蛋白质的三级结构
多肽链在二级结构、超二级结构和结构域等结构 层次的基础上,组装而成的完整结构单元。
三级结构的形成使肽链中所有的原子都达到空间 上的重新排布。
举例:1963年Kendrew等通过鲸肌红蛋白的x-射 线衍射分析,测得了它的空间结构
4
(1)α-螺旋(α-helix)
a-螺旋:是多肽链沿长轴卷曲 而成的有规则的螺旋型构象。
要点 每个螺旋含3.6个AA残基,螺距
0.54nm,螺旋直径0.5nm,每个残 基绕轴旋转100o ; 螺旋体中所有氨基酸残基R侧链 都伸向外侧
5
相邻螺旋间(第n个氨基酸残基C=O的氧与第n+4 个氨基酸残基的-NH氢之间)形成平行于螺旋轴 的氢键,肽链上所有的肽键都参与氢键的形成
20
(三)蛋白质的变性
概念:天然蛋白质受物理或化学因素的影响,分 子内部原有的高度规则性的空间排列发生变化, 致使其原有性质和功能发生部分或全部丧失。
变性的因素及作用机制
因素
作用机制
热
破坏氢键
酸碱
破坏盐键
醇
分子进入肽链间空隙,破坏次级键
ቤተ መጻሕፍቲ ባይዱ
高浓度尿素 破坏氢键
盐酸胍
破坏氢键,使-SH暴露
21
变性后的特征
谷氨酸、丝氨酸 8、请列举氨基酸的化学性质,并简述其应用。
作业:P61 3、4
28
3
2、蛋白质的二级结构
蛋白质的二级结构:蛋白质分子中多肽链本身折叠和 盘绕的方式,它仅涉及肽链中主链的构象,并不涉及 侧链的构象。
蛋白质主链的折叠是由氢键维系的有规则的重复构象 组成
第二章蛋白质化学蛋白质的结构(共67张PPT)

肽键为一平面
相邻的a碳原子呈反式构型
3、肽的命名及结构
• 1、根据所含AA数目:二肽、三肽、四肽等 • 2、根据来源和功能:如,脑啡肽、短杆菌肽S等。 • 3、肽结构:自然界中存在的肽有开链式结构和
环状结构。环状结构中没有游离的氨基末端和 游离的羧基末端,微生物中常见,如,短杆菌 肽S 。
4、多肽链的表达式
〔1〕组成蛋白质的多肽链数目; 2、根据来源和功能:如,脑啡肽、短杆菌肽S等。
2、亚基间呈特定的三维空间排布,依赖次级键维持其结构稳定 .
〔2〕多肽链的氨基酸顺序; 3、蛋白质分子中亚基可相同,也可不相同。
常用的有巯基乙醇(mercaptoethanol) 、巯基乙酸(mercaptoacetic acid) 、二硫苏糖醇(dithiothreitol, DTT)等。 硼氢化锂〔LiBH4〕
2H2O
GSSG
NADP+
GSH复原酶
NADPH+H+
2. 多肽类激素及神经肽
• 体内许多激素属寡肽或多肽
• 神经肽(neuropeptide)
(三)蛋白质一级结构的测定
要求
• 样品必须是均一的。纯度在>97%以上 • 知道蛋白质的相对分子质量
• (1)组成蛋白质的多肽链数目 (2)多肽链的氨基酸种类、数目及排列顺序; (3)多肽链内或链间二硫键的数目和位置。 ★其中最重要的是多肽链的氨基酸顺序,它是蛋白 质高级结构及其生物功能的根底。
化学裂解法
溴化氰法〔CNBr〕:特异性水解对Met羧基形成的 肽键 羟胺法:羟胺专一裂解Asn-Gly的肽键,酸性条件下 裂解Asn-Pro肽键。
酶水解法〔专一性高,水解产率高〕
胰蛋白酶: 胰凝乳蛋白酶〔糜蛋白酶〕: 胃蛋白酶:
第5章蛋白质的三维结构(共105张PPT)

上图:L-Ala残基的拉氏构象图,横坐标为的取 值,纵坐标为 的取值。
32
多肽主链形成三维结构的空间限制
拉氏图不仅对蛋白质的构象研究起到了简化作用,对于 判断所得到的蛋白质结构模型的正误也有意义。 实际得到的许多蛋白质的三维结构证实了拉氏图是根本 正确的。
33
5.4 二级结构:多肽链折叠的规那么方式 Secondary structure :The common regular
• 反平行折叠片较稳定,重复单位为0.7 nm, 即每个氨基酸的长度为0.35nm;
α螺旋的偶极矩
α螺旋相当于在N—末端 积累了局部负电荷,在 C—末端积累了局部正电荷
43
Protein Secondary structure
α螺旋的手性
• 蛋白质中的α螺旋几乎
都是右手的 (除胶原蛋白外)。
44
影响α螺旋形成的因素
• 与它的氨基酸组成和序列有极大的关系:
– 侧链R-基团所带的电荷。如多聚赖氨酸, 不能形成;
多数情况下,这些基团分布在球状蛋白质分子的 外表,与水分子作用形成排列有序的水化层,稳 定蛋白质的构象。
16
5.2.5 二硫键 Disulfide bond
Covalent bond between side chains of two cysteine residues
17
Disulfide bond
Bond Energy (kJ/mol)
13-30 4-8 12-20 12-30 210 376.81
21
5.3 多肽主链折叠的空间限制
5.3.1 肽键和肽平面
多肽主链是由-NH-Cα-CO-相连重复排列 形成的。164
肽基〔peptide
32
多肽主链形成三维结构的空间限制
拉氏图不仅对蛋白质的构象研究起到了简化作用,对于 判断所得到的蛋白质结构模型的正误也有意义。 实际得到的许多蛋白质的三维结构证实了拉氏图是根本 正确的。
33
5.4 二级结构:多肽链折叠的规那么方式 Secondary structure :The common regular
• 反平行折叠片较稳定,重复单位为0.7 nm, 即每个氨基酸的长度为0.35nm;
α螺旋的偶极矩
α螺旋相当于在N—末端 积累了局部负电荷,在 C—末端积累了局部正电荷
43
Protein Secondary structure
α螺旋的手性
• 蛋白质中的α螺旋几乎
都是右手的 (除胶原蛋白外)。
44
影响α螺旋形成的因素
• 与它的氨基酸组成和序列有极大的关系:
– 侧链R-基团所带的电荷。如多聚赖氨酸, 不能形成;
多数情况下,这些基团分布在球状蛋白质分子的 外表,与水分子作用形成排列有序的水化层,稳 定蛋白质的构象。
16
5.2.5 二硫键 Disulfide bond
Covalent bond between side chains of two cysteine residues
17
Disulfide bond
Bond Energy (kJ/mol)
13-30 4-8 12-20 12-30 210 376.81
21
5.3 多肽主链折叠的空间限制
5.3.1 肽键和肽平面
多肽主链是由-NH-Cα-CO-相连重复排列 形成的。164
肽基〔peptide
蛋白质的结构和性质(课件PPT)

Байду номын сангаас
(6)颜色反应
浓硝酸
科学视野 我国现代取得的成就
1965年我国科技工 作者成功合成了具有 生物活性的——结晶 牛胰岛素。这是科学 史上的一大成就,可 以说是科学史上又一 “丰碑”。在认识生 命现象揭开生命奥秘 的伟大历程中,做出 了重要贡献。
这是我国第一头克隆羊
我是阳阳
我
的妈妈
叫
阳 阳 我是由妈妈的耳朵
蛋白质的结构和性质
世 界 第 一 只 克 隆 羊 : 多 利
蛋白质是形成生命和进行生命 活动不可缺少的基础物质。
蛋白质更是现代生命科学研 究的重点和关键。
在奶和奶的制品中
在 豆 类 、 薯 类 、 小 麦 和 谷 类 中
2、蛋白质的结构
一级结构
蛋白质分子中各种氨基酸的连接方式和排列顺序
肽键是蛋白质一级结构的基本结构键。
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。
(6)颜色反应
浓硝酸
科学视野 我国现代取得的成就
1965年我国科技工 作者成功合成了具有 生物活性的——结晶 牛胰岛素。这是科学 史上的一大成就,可 以说是科学史上又一 “丰碑”。在认识生 命现象揭开生命奥秘 的伟大历程中,做出 了重要贡献。
这是我国第一头克隆羊
我是阳阳
我
的妈妈
叫
阳 阳 我是由妈妈的耳朵
蛋白质的结构和性质
世 界 第 一 只 克 隆 羊 : 多 利
蛋白质是形成生命和进行生命 活动不可缺少的基础物质。
蛋白质更是现代生命科学研 究的重点和关键。
在奶和奶的制品中
在 豆 类 、 薯 类 、 小 麦 和 谷 类 中
2、蛋白质的结构
一级结构
蛋白质分子中各种氨基酸的连接方式和排列顺序
肽键是蛋白质一级结构的基本结构键。
18、只要愿意学习,就一定能够学会。——列宁 19、如果学生在学校里学习的结果是使自己什么也不会创造,那他的一生永远是模仿和抄袭。——列夫·托尔斯泰
20、对所学知识内容的兴趣可能成为学习动机。——赞科夫 21、游手好闲地学习,并不比学习游手好闲好。——约翰·贝勒斯 22、读史使人明智,读诗使人灵秀,数学使人周密,自然哲学使人精邃,伦理学使人庄重,逻辑学使人善辩。——培根 23、我们在我们的劳动过程中学习思考,劳动的结果,我们认识了世界的奥妙,于是我们就真正来改变生活了。——高尔基 24、我们要振作精神,下苦功学习。下苦功,三个字,一个叫下,一个叫苦,一个叫功,一定要振作精神,下苦功。——毛泽东 25、我学习了一生,现在我还在学习,而将来,只要我还有精力,我还要学习下去。——别林斯基 13、在寻求真理的长河中,唯有学习,不断地学习,勤奋地学习,有创造性地学习,才能越重山跨峻岭。——华罗庚52、若不给自己设限,则人生中就没有限制你发挥的藩篱。
蛋白质的空间结构精品课件

最新 PPT
37
四、蛋白质的四级结构
由多条多肽链组成的蛋白质,肽链间相互 以非共价键联结成一个活性单位,这种肽链就 称为该蛋白质的亚基。
蛋白质分子中各亚基的空间排布、亚基间 通过非共价键聚合而成的特定构象,称为蛋白 质的四级结构。
亚基之间的结合力主要是氢键和离子键。
最新 PPT
38
血红蛋白(Hb)的四级结构
根据以上结果可知道四肽的顺序: Val·Lys·Trp·Gly或者Val·Arg·Trp·Gly。
最新 PPT
13
二、蛋白质的二级结构
定义 蛋白质分子中某一段肽链的局部空间结
构,即该段肽链主链骨架原子的相对空间位 置,并不涉及氨基酸残基侧链的构象。
蛋白质多肽链本身的折叠盘绕方式。
主要的化学键: 氢键、盐键、疏水键、范德华力
如果是抑制作用则称为负协同效应 (negative cooperativity)
最新 PPT
52
最新 PPT
53
血红素与氧结
合后,铁原子半径
变小,就能进入卟
O2
啉环的小孔中,继
而引起肽链位置的
最新 PPT
8
•胰蛋白酶:水解赖氨酸和精氨酸的羧基 形成的肽键; •糜蛋白酶(胰凝乳蛋白酶):水解芳香 族氨基酸【苯丙氨酸(Phe)、酪氨酸 (Tyr)、色氨酸(Trp)】等氨基酸残 基的羧基形成的肽键。 •胃蛋白酶:专一性较差,主要水解Glu、 Asp或其他氨基酸的侧链。
最新 PPT
9
如测一个九肽
最新 PPT
27
一般由四个连续的氨基酸残基组成, 第一个氨基酸残基与第四个形成氢键。
最新 PPT
28
4、Ω环
Ω环多存在于球状蛋白质分子中,形 状像“Ω”,称为Ω环( Ωloop)。
第5章 蛋白质的三维结构(共37张PPT)

结构域的结构特点:
➢ 结构域是球状蛋白的独立折叠单位;常见的结构域一般 有100-200氨基酸残基。
➢ 结构域之间常常有一段柔性的肽段相连,形成所谓的铰链区,使 结构域之间可以发生相对移动。
➢ 较小的蛋白质分子或亚基往往是单结构域的,结构域即 三级结构,如:红氧还蛋白、核糖核酸酶、肌红蛋白等; 而较大的球状蛋白三级结构往往由多个结构域缔合而成, 如免疫球蛋白等。
3. 影响α螺旋形成的因素: R侧链和pH对α螺旋的影响 ①大的R基〔如Ile〕造成空间阻碍不能形成α螺旋。
② Pro〔吡咯环,不具有酰胺氢,不能形成链内 氢键〕中止α螺旋。
③ 多肽链上连续出现带同种电荷基团的氨基酸 残基,不能形成稳定的α螺旋,如多聚Lys、 多聚Glu。
总之R基较小,且不带电荷的氨基酸利于α螺旋的形 成。如多聚丙氨酸在pH7的水溶液中自发卷曲成α螺 旋。
六.球状蛋白质与三级结构
三级结构(Tertiary Structure) :是指多肽链在二 级结构〔超二级结构及结构域〕的根底上,进 一步地盘绕、折叠成具有特定走向的紧密球状 构象。
结构域可以承担一定的生物学功能,几个结构域 协同作用,可表达出蛋白质的总体功能。例如, 脱氢酶类的多肽主链有两个结构域,一个为结 合NAD+结构域,一个是起催化作用的结构域, 两者组合成脱氢酶的脱氢功能区。
结构域间的裂缝,常是活性部位,也是反响物的 出入口,一般情况下,酶的活性部位常位于结 构域之间。
➢ 丝心蛋白是片层结构,即反平行式β-折叠片以平行的方式堆积成多层结 构。链间主要以氢键连接,层间主要靠范德华力维系。
➢ 丝蛋白的肽链通常是由多个六肽单元重复而成。含大量的Gly、Ala、 Ser,这六肽为:——〔Gly-Ser-Gly-Ala-Gly-Ala〕——n
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
20
例题:一个α螺旋片段含有180个氨基酸残基,该片段中有多 少圈螺旋?计算该α-螺旋片段的轴长。
解答:180/3.6=50圈,50×0.54=27nm,该片段中含有50 圈螺旋,其轴长为27nm。
例题:一个含有78个氨基酸残基的α螺旋的轴长是多少?此多 肽的α螺旋完全伸展m α螺旋每圈螺旋占3.6个氨基酸残基,故该α螺旋圈数为:
蛋白质分子的高级结构
蛋白质分子中的结构层次
一级结构→二级结构→超二级结构→结构域 →三级结构→亚基→ 四级结构
一、蛋白质的一级(共价) 结构
定义 蛋白质的一级结构指多肽链中氨基酸
的排列顺序。
主要的化学键 肽键,有些蛋白质还包括二硫键。
N末端
C末端
牛核糖核酸酶
一级结构是蛋白质空间构象和特异 生物学功能的基础。
1、分析:FDNB即2,4-二硝基氟苯,在弱碱性溶液中可与肽 链N-末端的氨基酸生成黄色的二硝基苯氨基酸(DNP-AA)。 盐酸水解可以打开所有的肽链,使蛋白质或者多肽变为游离 的氨基酸。LiBH4还原羧酸成为醇类,可使C-末端AA还原为相 应的氨基醇。胰蛋白酶可专一性水解由碱性氨基酸(lys,Arg) 羧基端形成的肽键。
解答:
1、是一个N端为Ser的五肽;
2、胰蛋白酶的水解部位是Lys或Arg的羧基端肽键,因为得到
一种N端为Ser的二肽,因此第二位为Lys;
3、经胰蛋白酶水解可得到一种N端为Cys的三肽,所以第三位
为Cys;
4、因为胰糜蛋白酶只水解芳香族氨基酸的羧基端肽键,水解
上述三肽,得到Ala和另一个二肽,所以三肽为:Cys-Phe-
蛋白质的根本差异在于一级结构的不同
2020/11/29
胰岛素的一级结构 6
多肽链中氨基酸序列分析—— 一级结构测定
准备工作:
•样品纯度97%以上; •测定蛋白质的相对分子质量(允许误差10%左右) •测定肽的数目; •测定氨基酸组成
2020/11/29
7
多肽链中氨基酸序列分析
分析已纯化蛋白质的氨基酸残基组成(纯度97%以上) 测定多肽链的氨基末端与羧基末端为何种氨基酸残基
2020/11/29
12
解题: (1)四肽与FDNB反应后,用5.7mol/LHCl水解得到DNPVal,证明N端为Val; (2)LiBH4还原后再水解,水解液中有氨基乙醇,Gly 是氨基乙酸,证明肽的C端为Gly; (3)水解液中有在浓H2SO4条件下能与乙醛酸反应产生 紫红色产物的氨基酸,说明此氨基酸为Trp; (4)根据胰蛋白酶的专一性,得知此肽键-COOH末端是 Lys或者Arg;
2020/11/29
16
(二)蛋白质二级结构的主要形式
• -螺旋 ( -helix ) • -折叠 ( -pleated sheet ) • -转角 ( -turn ) • 无规卷曲 ( random coil )
1、 -螺旋
结构要点:
①从N端为起点,多肽链主链围绕中心轴形成右手螺旋,侧链 伸向螺旋外侧。
Ala
5、整个五肽的顺序为Ser- Lys- Cys-Phe-Ala。
2020/11/29
11
例2: 当一种4肽与FDNB反应后,用5.7mol/L HCl水解得到DNPVal及3种其他氨基酸;当这4肽用胰蛋白酶水解时发现有两种碎 片段,其中一片用LiBH4还原后再进行酸水解,水解液内有氨基 乙醇和一种在有浓硫酸条件下能与已醛酸反应产生紫(红)色产 物的氨基酸.试问这4肽的一级结构是由哪几种氨基酸。 (LiBH4还原羧酸成为醇类,可使C-末端AA还原为相应的氨基 醇。)
(一)酰胺平面
参与形成肽键的4个原子(C、 O、N、H)和与之相连的2个-碳原 子( C1、C2)共处于同一平面上, 形成酰胺平面,或称肽键平面,肽
平 面 , 肽 单 元 。 C1 和 C2 在 平 面 上 所处的位置为反式(trans)构型。
O
肽单元
R
N
C
Cα
ψ
Cα
N
φ
C
R O
它是蛋白质构象的基本结构单位
把肽链水解成片段,分别进行分析 测定各肽段的氨基酸排列顺序,一般采用Edman降解法
一般需用数种水解法,并分析出各肽段中的氨基酸顺序,然 后经过组合排列对比,最终得出完整肽链中氨基酸顺序结果。
2020/11/29
8
•胰蛋白酶:水解赖氨酸和精氨酸的羧基 形成的肽键; •糜蛋白酶(胰凝乳蛋白酶):水解芳香 族氨基酸【苯丙氨酸(Phe)、酪氨酸 (Tyr)、色氨酸(Trp)】等氨基酸残 基的羧基形成的肽键。 •胃蛋白酶:专一性较差,主要水解Glu、 Asp或其他氨基酸的侧链。
2020/11/29
9
如测一个九肽
测得N端氨基酸残基为Thr
又分别测得片段: Ala-Ala-Trp-Gly-Lys
Val-Lys-Ala-Ala-Trp Thr-Asn-Val-Lys
则其氨基酸排列顺序为: Thr-Asn-Val-Lys-Ala-Trp-Gly-lys
2020/11/29
10
例1:某五肽先经酸水解再经碱水解,得到摩尔数相等的五 种氨基酸(Ala、Cys、Lys、Phe和Ser)混合物,用Edman分 析法进行N端分析,获得PHT-Ser;经胰蛋白酶水解可得到 一种N端为Cys的三肽和另一种N端为Ser的二肽;用胰糜蛋白 酶水解上述三肽,得到Ala和另一个二肽。问该五肽的氨基 酸顺序怎样?
根据以上结果可知道四肽的顺序: Val·Lys·Trp·Gly或者Val·Arg·Trp·Gly。
2020/11/29
13
二、蛋白质的二级结构
定义 蛋白质分子中某一段肽链的局部空间结
构,即该段肽链主链骨架原子的相对空间位 置,并不涉及氨基酸残基侧链的构象。
蛋白质多肽链本身的折叠盘绕方式。
主要的化学键: 氢键、盐键、疏水键、范德华力
2020/11/29
18
α-螺旋的结构特点
2020/11/29
多个肽键平面通过α-碳原子旋转,相互之间紧 密盘曲成稳固的右手螺旋。 每个肽键的亚氨氢和第四个肽键的羰基氧形成的 氢键保持螺旋稳定(氢键是稳定α-螺旋的主要 键),氢键与螺旋长轴基本平行。 主链呈螺旋上升,每个氨基酸残基沿轴上升 0.15nm,沿轴旋转1000,每3.6个氨基酸残基上升 一圈,相当于上升高度(螺距)0.54nm,螺旋的直径 约为0.5nm 。
例题:一个α螺旋片段含有180个氨基酸残基,该片段中有多 少圈螺旋?计算该α-螺旋片段的轴长。
解答:180/3.6=50圈,50×0.54=27nm,该片段中含有50 圈螺旋,其轴长为27nm。
例题:一个含有78个氨基酸残基的α螺旋的轴长是多少?此多 肽的α螺旋完全伸展m α螺旋每圈螺旋占3.6个氨基酸残基,故该α螺旋圈数为:
蛋白质分子的高级结构
蛋白质分子中的结构层次
一级结构→二级结构→超二级结构→结构域 →三级结构→亚基→ 四级结构
一、蛋白质的一级(共价) 结构
定义 蛋白质的一级结构指多肽链中氨基酸
的排列顺序。
主要的化学键 肽键,有些蛋白质还包括二硫键。
N末端
C末端
牛核糖核酸酶
一级结构是蛋白质空间构象和特异 生物学功能的基础。
1、分析:FDNB即2,4-二硝基氟苯,在弱碱性溶液中可与肽 链N-末端的氨基酸生成黄色的二硝基苯氨基酸(DNP-AA)。 盐酸水解可以打开所有的肽链,使蛋白质或者多肽变为游离 的氨基酸。LiBH4还原羧酸成为醇类,可使C-末端AA还原为相 应的氨基醇。胰蛋白酶可专一性水解由碱性氨基酸(lys,Arg) 羧基端形成的肽键。
解答:
1、是一个N端为Ser的五肽;
2、胰蛋白酶的水解部位是Lys或Arg的羧基端肽键,因为得到
一种N端为Ser的二肽,因此第二位为Lys;
3、经胰蛋白酶水解可得到一种N端为Cys的三肽,所以第三位
为Cys;
4、因为胰糜蛋白酶只水解芳香族氨基酸的羧基端肽键,水解
上述三肽,得到Ala和另一个二肽,所以三肽为:Cys-Phe-
蛋白质的根本差异在于一级结构的不同
2020/11/29
胰岛素的一级结构 6
多肽链中氨基酸序列分析—— 一级结构测定
准备工作:
•样品纯度97%以上; •测定蛋白质的相对分子质量(允许误差10%左右) •测定肽的数目; •测定氨基酸组成
2020/11/29
7
多肽链中氨基酸序列分析
分析已纯化蛋白质的氨基酸残基组成(纯度97%以上) 测定多肽链的氨基末端与羧基末端为何种氨基酸残基
2020/11/29
12
解题: (1)四肽与FDNB反应后,用5.7mol/LHCl水解得到DNPVal,证明N端为Val; (2)LiBH4还原后再水解,水解液中有氨基乙醇,Gly 是氨基乙酸,证明肽的C端为Gly; (3)水解液中有在浓H2SO4条件下能与乙醛酸反应产生 紫红色产物的氨基酸,说明此氨基酸为Trp; (4)根据胰蛋白酶的专一性,得知此肽键-COOH末端是 Lys或者Arg;
2020/11/29
16
(二)蛋白质二级结构的主要形式
• -螺旋 ( -helix ) • -折叠 ( -pleated sheet ) • -转角 ( -turn ) • 无规卷曲 ( random coil )
1、 -螺旋
结构要点:
①从N端为起点,多肽链主链围绕中心轴形成右手螺旋,侧链 伸向螺旋外侧。
Ala
5、整个五肽的顺序为Ser- Lys- Cys-Phe-Ala。
2020/11/29
11
例2: 当一种4肽与FDNB反应后,用5.7mol/L HCl水解得到DNPVal及3种其他氨基酸;当这4肽用胰蛋白酶水解时发现有两种碎 片段,其中一片用LiBH4还原后再进行酸水解,水解液内有氨基 乙醇和一种在有浓硫酸条件下能与已醛酸反应产生紫(红)色产 物的氨基酸.试问这4肽的一级结构是由哪几种氨基酸。 (LiBH4还原羧酸成为醇类,可使C-末端AA还原为相应的氨基 醇。)
(一)酰胺平面
参与形成肽键的4个原子(C、 O、N、H)和与之相连的2个-碳原 子( C1、C2)共处于同一平面上, 形成酰胺平面,或称肽键平面,肽
平 面 , 肽 单 元 。 C1 和 C2 在 平 面 上 所处的位置为反式(trans)构型。
O
肽单元
R
N
C
Cα
ψ
Cα
N
φ
C
R O
它是蛋白质构象的基本结构单位
把肽链水解成片段,分别进行分析 测定各肽段的氨基酸排列顺序,一般采用Edman降解法
一般需用数种水解法,并分析出各肽段中的氨基酸顺序,然 后经过组合排列对比,最终得出完整肽链中氨基酸顺序结果。
2020/11/29
8
•胰蛋白酶:水解赖氨酸和精氨酸的羧基 形成的肽键; •糜蛋白酶(胰凝乳蛋白酶):水解芳香 族氨基酸【苯丙氨酸(Phe)、酪氨酸 (Tyr)、色氨酸(Trp)】等氨基酸残 基的羧基形成的肽键。 •胃蛋白酶:专一性较差,主要水解Glu、 Asp或其他氨基酸的侧链。
2020/11/29
9
如测一个九肽
测得N端氨基酸残基为Thr
又分别测得片段: Ala-Ala-Trp-Gly-Lys
Val-Lys-Ala-Ala-Trp Thr-Asn-Val-Lys
则其氨基酸排列顺序为: Thr-Asn-Val-Lys-Ala-Trp-Gly-lys
2020/11/29
10
例1:某五肽先经酸水解再经碱水解,得到摩尔数相等的五 种氨基酸(Ala、Cys、Lys、Phe和Ser)混合物,用Edman分 析法进行N端分析,获得PHT-Ser;经胰蛋白酶水解可得到 一种N端为Cys的三肽和另一种N端为Ser的二肽;用胰糜蛋白 酶水解上述三肽,得到Ala和另一个二肽。问该五肽的氨基 酸顺序怎样?
根据以上结果可知道四肽的顺序: Val·Lys·Trp·Gly或者Val·Arg·Trp·Gly。
2020/11/29
13
二、蛋白质的二级结构
定义 蛋白质分子中某一段肽链的局部空间结
构,即该段肽链主链骨架原子的相对空间位 置,并不涉及氨基酸残基侧链的构象。
蛋白质多肽链本身的折叠盘绕方式。
主要的化学键: 氢键、盐键、疏水键、范德华力
2020/11/29
18
α-螺旋的结构特点
2020/11/29
多个肽键平面通过α-碳原子旋转,相互之间紧 密盘曲成稳固的右手螺旋。 每个肽键的亚氨氢和第四个肽键的羰基氧形成的 氢键保持螺旋稳定(氢键是稳定α-螺旋的主要 键),氢键与螺旋长轴基本平行。 主链呈螺旋上升,每个氨基酸残基沿轴上升 0.15nm,沿轴旋转1000,每3.6个氨基酸残基上升 一圈,相当于上升高度(螺距)0.54nm,螺旋的直径 约为0.5nm 。
