2019-2020学年福建省永安市三中2018级高二下学期期中考试理科综合化学试卷及答案
福建省永安市第三中学2019_2020学年高二化学10月月考试题

福建省永安市第三中学2019-2020学年高二化学10月月考试题考试时间:70分钟满分100分一.单选题(每小题2分,共50分)下列有关能量转换的说法正确的是( 1.)A. 原电池是将电能转化为化学能的过程B. 煤燃烧是化学能转化为热能的过程C. 动物体内葡萄糖被氧化成是热能转变成化学能的过程转化为葡萄糖是太阳能转变成热能的过程D. 植物通过光合作用将反应A+B→C((放热)分两步进行:①A+B→X(吸热)②X→C(放热),下列示意图中2.能正确表示总反应过程中能量进变化的是()D. A. C. B.化石燃料仍是目前能源的主体,但已经面临危机,开发新能源是解决能源问题的关键.下3.列能量转换过程,不涉及化学变化的是()A. 利用氢氧燃料电池提供电能B. 利用太阳能分解水制备氢气C. 利用水流驱动涡轮机发电D. 利用植物秸秆为原料生产乙醇燃料盐酸与铁片的反应,采取下列措施:对于300mL 1mol4.?-1-1?L盐酸L盐酸③再加300mL 1mol? -1 L①升高温度②改用100mL 3mol 98%的硫酸④用等量铁粉代替铁片⑤改用100mL)其中能使反应速率加快的是(D. ①②③⑤ A. ①②④B. ①③④ C. ①②③④某一反应物的浓度为1.0mol/L,经过20s后,它的浓度变化了0.2mol/L,在这20s5.内它的反应速率为()A. 0.04 mol/(L?S)B. 0.01mol/LC. 0.02mol/(L?S)D.?S)0.8mol/(L)6.下列有关化学反应速率的说法正确的是(A. 用铝片和硫酸反应制氢气,硫酸浓度越高,反应速率越快 CuSO溶液,可加快反应速率锌和稀硫酸反应制氢气时,加入少量B. 4增大压强、升高温度和使用催化剂均一定使反应速率加快C.D. 在碳酸钙和盐酸反应中,加多些碳酸钙可使反应速率明显如快 7.下列关于化学反应速率和化学反应限度的说法中正确的是() A. 化学反应速率是衡量化学反应进行快慢程度的物理量- 1 -B. 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示C. 当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度,即使条件改变,该限度都不改变D. 平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变在一可变容积的密闭容器中进行反应:C(s)+HO(g)?CO(g)+H(g8.),下列条件的22改变对反应速率几乎无影响的是()A. 增加HO(g)的量B. 增加C(s)的量2C. 将容器的体积缩小一半D. 保持压强不变,充入N,使容器的体积变大2硫代硫酸钠溶液与稀硫酸反应的化学方程式为:NaSO+HSO=Na9.SO+SO↑+S↓+HO,可以244222223通过出现浑浊的快慢来判断反应的快慢程度,下列各组实验中最先出现浑浊的是()NaSO溶液稀HSO 43222实验反应温度/℃-1-1?L)c/V/mL(mol?LV/mL ) c/(mol0.1 20 25 A 5 0.10. 2B0.2520250.10.15C35200.220355D0.2D. DA. AB. BC. C对于反应3Fe(s)+4HO(g)?FeO(s)+4H(10.g)的平衡常数,下列说法正确的是()2243A. K=B. K=C. 增大c(HO)或减小c(H),会使该反应平衡常数减小22D. 改变反应的温度,平衡常数不一定变化反应2SO+O2SO在密闭容器中进行。
福建省永安市第三中学2019_2020学年高二化学下学期期中试题

福建省永安市第三中学2019-2020学年高二化学下学期期中试题(考试时间:90分钟总分:100分)可能用到的相对原子质量:Li-7 O-16一、选择题(每题2分只有一个正确答案共44分)1. 若将15P原子的电子排布式写成1s22s22p63s23p x23p y1,它违背了()A.能量最低原则 B.泡利不相容原理C.洪特规则 D.能量守恒原理2.下列物质熔化时,不破坏化学键的是()A.氯化钠 B.水晶 C.金刚石 D.十七烷3.下列各组表述中,两个微粒不属于同种元素原子的是()A、3p能级有一个空轨道的基态原子和核外电子的排布为1s22s22p63s23p2的原子B、2p能级无空轨道,且有一个未成对电子基态原子和原子的最外层电子排布为2s22p5的原子C、最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子D、M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s24. 某元素质量数52,中子数28,其基态原子未成对电子数为()A.3 B.4 C.5 D.65.下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是()A.6与16 B.11与17 C. 14与8 D.10与196.碱金属和卤素形成的化合物大多数具有的性质是()①高沸点②能溶于水③水溶液能导电④低熔点⑤熔融状态不导电A.①④⑤ B.①②③ C.②③⑤ D.③④⑤7.有关CH2=CH-C≡N分子的说法正确的是( )A.3个键,3个π键B.4个键,3个π键C.6个键,2个π键D.6个键,3个π键8.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )A.半导体材料砷化镓 B.吸氢材料镧镍合金C.透明陶瓷材料硒化锌 D.超导材K3C609.下列化学式能真实表示物质分子组成的是()A.NaOH B.CO2C.C D.SiO210.在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。
福建省永安市第三中学2018-2019学年高二下学期期中考试通用技术试题(解析版)

C.环境适应性D.整体性
【答案】C
【解析】
【详解】
22.日常生活中有很多人工控制和自动控制现象,以下属于人工控制的是()
A.红外感应水龙头的出水控制B.家中空调的温度控制
C.普通汽车的驾驶控制D.冲水马桶水箱的水位控制
【答案】C
23.简易台灯是一个完整的系统。它是由灯泡、灯罩、支撑架、灯座、开关等部件组成。下列选项中,以提高安全性为优化目标的措施是()
15.小王设计了一个学生台灯,要对台灯的性能以及人机关系进行研究,他制作的是()。
A.概念模型B.结构模型C.功能模型D.展示模型
【答案】 C
16.产品说明书 作用一般不包括()
A.让用户了解产品的主要性能B.让用户掌握产品的使用方法C.让用户安全地使用产品D.让用户学会维修产品
【答案】D
17.如图所示的台灯,在测试阶段发现其支撑杆调整到某些角度时,台灯容易翻倒。以下改进措施中合理的是()
20.如图所示的立体图及其主视方向,其对应的左视图是()
A. B. C. D.
【答案】C
【解析】
【详解】
21.飞机在空中飞行时,时常受到大气对流的影响而产生颠簸,当飞机的检测装置接收到这一信号后,经过控制器的调节,能在很短的时间内调整好飞行状态,克服大气对流对飞机飞行的影响,保持平稳飞行。这一事例表现了系统的()。
A.飞檐的结构功能B.斗与拱的连接方式
C.飞檐的象征意义D.斗拱技术施工特点
【答案】C
14.将电线与插座连接的操作环节有:①接电线,②剥电线,③装插座面板,④紧固电线,⑤拆插座.其操作流程正确的是( ).
A.⑤→①→②→①→③B.⑤→②→①→④→③
C.②→①→⑤→①→③D.②→①→④→⑤→③
福建省永安市第三中学2019_2020学年高二英语下学期期中试题

福建省永安市第三中学2019-2020学年高二英语下学期期中试题(考试时间:120分钟试卷满分:150分)第一部分听力(共两节,满分30分)做题时,先将答案标在试卷上。
录音内容结束后,你将有两分钟的时间将试卷上的答案转涂到答题卡上。
第一节 (共5小题;每小题1.5分,满分7.5分)听下面5段对话。
每段对话后有一个小题,从题中所给的A、B、C三个选项中选出最佳选项,并标在试卷的相应位置。
听完每段对话后,你都有10秒钟的时间来回答有关小题和阅读下一小题。
每段对话仅读一遍。
1. How might the weather be this afternoon?A. Sunny.B. Windy.C. Stormy.2. What does the woman recycle?A. Plastic.B. Glass.C. Paper.3. What is probably the man?A. A doctor.B. A professor.C. A hairdresser.4. What does the woman ask the man to do?A. Do some cleaning.B. Have a beach party.C. Look for part-time work.5. Where does the conversation take place?A. At Pepi’s Pizza.B. On the phone.C. At home.第二节(共15小题;每小题1.5分,满分22.5分)听下面5段对话或独白。
每段对话或独白后有几个小题,从题中所给的A、B、C三个选项中选出最佳选项,并标在试卷的相应位置。
听每段对话或独白前,你将有时间阅读各个小题,每小题5秒钟;听完后,各小题将给出5秒钟的作答时间。
每段对话或独白读两遍。
听第6段材料,回答第6、7题。
6. Why does the man like hiking?A. He can get close to nature.B. He can meet wild animals.C. He can make some friends.7. How far will the man walk a day on average?A. 3 miles.B. 10 miles.C. 30 miles.听第7段材料,回答第8至10题。
【精准解析】福建省永安市第三中学2019-2020学年高二下学期期中考试化学试题

永安三中2019-2020学年第二学期高二化学期中测试卷可能用到的相对原子质量:Li-7 O-16一、选择题(每题2分只有一个正确答案共44分)1.若将15P原子的电子排布式写成1s22s22p63s23p x23p y1,它违背了A. 能量最低原则B. 泡利不相容原理C. 洪特规则D. 能量守恒原理【答案】C【解析】【详解】根据洪特规则,电子分布到能量相同的原子轨道时,优先以自旋相同的方式分别占据不同的轨道,15P原子的电子排布式是1s22s22p63s23p x13p y13p z1,写成1s22s22p63s23p x23p y1违背了洪特规则,故选C。
2.下列物质熔化时,不破坏化学键的是( )A. 氯化钠B. 水晶C. 金刚石D. 十七烷【答案】D【解析】【详解】A.氯化钠是离子晶体,熔化时破坏离子键,故A不符合题意;B.水晶为二氧化硅原子晶体,熔化时破坏共价键,故B不符合题意;C.金刚石为原子晶体,熔化时破坏共价键,故C不符合题意;D.十七烷为分子晶体,熔化时破坏分子间作用力,不破坏化学键,故D符合题意,故选:D。
3.下列各组表述中,两个微粒一定不属于同种元素原子的是()A. 3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子B. 2p能级有一个未成对电子的基态原子和原子的价电子排布为2s22p5的原子C. 最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子D. M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子【答案】D【解析】分析:本题考查核外电子的排布规律,侧重于原子结构与元素种类的判断,注重学生的分析能力的考查,注意把握原子核外电子排布特点,难度不大。
详解:A.3p能级有一个空轨道的基态原子,原子3p能级有2个电子,是硅元素,核外电子排布为1s22s22p63s23p2的原子也是硅,是同种原子,故错误;B. 2p能级有一个未成对电子的基态原子,该原子2p能级有5个电子,价电子排布为2s22p5,所以是同一原子,故错误;C. 最外层电子数是核外电子总数的1/5的原子是溴,价电子排布为4s24p5的原子也为溴,故错误;D. M层全充满而N层为4s2的原子为锌,核外电子排布为1s22s22p63s23p63d64s2的原子为铁,不是同种原子,故正确。
福建省永安市第三中学2019-2020学年高二数学下学期期初综合检测试试题【含答案】

22. (本题 12 分)
某班 50 名学生在一次百米测试中,成绩全部介于 13 秒与 18 秒之间,将测试结果按如下
方式分成五组:每一组 13,14) ;第二组 14,15) ……第五组 17,18.下图是按上述分组方
图图
法得到的频率分布直方图.
图图
(I)若成绩大于或等于 14 秒且小于 16 秒
一、选择题: ABDDB ACBCD BA
二、填空题:
3
2sinα-cosα 2tanα-1 3
13. 4 解析: sinα 2cosα = tanα 2 = 4 .
5
5a 5
14. -13 解析:由a<0,得r= 144a2 25a2 =13|a|=-13a,所以sinα= -13a =-13 .
抽到二年级女生的概率是 0.19 .现用分层抽样的方法在全校抽取 64 名学生,则应在三年
级抽取的学生人数为
A.12
B.16
一年级 二年级 三年级
女生 373
x
y
男生 377
370
z
C.18
D. 24
12.如图所示,墙上挂有边长为 a 的正方形木板,它的四个角的空白部分都是以正方形的顶点
a 为圆心,半径为 2 的圆孤,某人向此板投镖,假设每次都能击中木板,且击中木板上每个点
18.(本题 12 分)设集合 P {b,1} , Q {c,1,2} , P Q , 若 b, c {2,3,4,5,6,7,8,9}.
(Ⅰ) 求 b = c 的概率;
(Ⅱ)求方程 x2 bx c 0 有实根的概率.
19.
(本题12分)已知f(x)=2cos 2
-x
cosx-
3 cos2x,x∈R.
福建省永安市第三中学2019-2020学年高二下学期期中考试生物试题

永安三中2019-2020学年第二学期高二生物期中测试卷一、单选题(本大题共50小题,共50.0分)1.下列属于相对性状的是()A. 鸡的毛腿和毛翅B. 猫的白毛和狗的黑毛C. 人的卷发与白发D. 豌豆花的顶生与腋生2.豌豆在自然状态下是纯种的原因是()A. 豌豆具有易于区分的性状B. 豌豆是闭花受粉的植物C. 豌豆生长周期短D. 豌豆繁殖能力强3.孟德尔的遗传规律在哪种生物中不起作用()A. 人类B. 玉米C. 蓝藻D. 大豆4.下列关于孟德尔研究遗传规律获得成功原因的叙述,错误..的是()A. 先分析多对相对性状,后分析一对相对性状B. 科学地设计实验程序,提出假说并进行验证C. 正确地选用豌豆作为实验材料D. 运用统计学方法分析实验结果5.下列表示纯合体的基因型是()A. AaX H X HB. AABbC. AAX H X HD. aaX H X h6.下列各组遗传现象中,属于性状分离的是()A. 高茎豌豆自交后代全是高茎B. 矮茎豌豆自交后代全是矮茎C. 高茎豌豆自交后代有高茎和矮茎D. 矮茎豌豆测交后代全是矮茎7.遗传学两大定律的发现者是()A. 孟德尔B. 达尔文C. 施莱登D. 奥特曼8.下列基因型的个体中,只能产生一种配子的是()A. ddTtB. DDttC. DdTtD. DDTt9.如欲观察细胞减数分裂过程,可选用的材料是()A. 马蛔虫受精卵B. 成熟花粉粒C. 小鼠睾丸D. 叶芽10.在减数分裂过程中,同源染色体的非姐妹染色体的交叉互换发生在()A. 染色体复制时B. 着丝点断裂时C. 同源染色体分离时D. 四分体时期11.与有丝分裂相比,减数分裂过程中染色体变化最显著的特征是()A. 纺锤体的形成B. 着丝点的分裂C. 染色体的复制D. 同源染色体的联会和分离12.下列为某二倍体植物细胞处于不同分裂时期的示意图,其中属于减数第二次分裂后期的是()A. B.C. D.13.小军同学学完“减数分裂和受精作用”一节后,写下了下面四句话,请你帮他判断一下哪句话是正确的()A. 我细胞内的遗传物质一半来自于爸爸,一半来自于妈妈B. 我细胞内的每一对同源染色体都是父母共同提供的C. 我细胞内的每一对同源染色体大小都是相同的D. 我和我弟弟的父母是相同的,所以我们细胞内的遗传物质也是一样的14.肺炎双球菌转化实验证明了()A. DNA是遗传物质B. RNA是遗传物质C. 蛋白质是遗传物质D. 糖类是遗传物质15.下列关于噬菌体侵染细菌实验的相关叙述中,不正确的是()A. 该实验证明了子代噬菌体的各种性状是通过DNA遗传的B. 侵染过程的“合成”阶段,噬菌体以自身的DNA作为模板,而原料、ATP、酶、场所等条件均由细菌提供C. 为确认蛋白质外壳是否注入细菌体内,可用35S标记噬菌体D. 真核生物、原核生物的遗传物质是DNA,病毒的遗传物质是RNA16..赫尔希(A.Hershey)和蔡斯(M.Chase)于1952年所做的噬菌体侵染细菌的著名实验进一步证实了DNA是遗传物质。
2018届福建省永安三中高三考化学试卷及答案

福建省永安三中2018届高三考化学试卷一、选择题(本题包括24小题,每小题2分,共48分)1.以下最接近阿伏伽德罗常数的是()HCO离子数2.(2分)分类是化学学习和研究中的常有用手段,下列分类依据和结论都正确的是()3.(2分)相等物质的量的CO和CO2相比较,下列有关叙述中正确的是()①它们所含的分子数目之比为1:1②它们所含的O原子数目之比为1:2③它们所含的原子总数目之比为2:3④它们所含的C原子数目之比为1:1⑤它们的质量之比为7:11.4.(2分)某溶液中含有S2﹣、HCO3﹣、CO32﹣、CH3COO﹣4种阴离子.若向其中加入足量Na2O2后,溶液中离子数目基本保持不变的是()5.设阿伏伽德罗常数的数值为N A,下列说法正确的是()6.(2分)下列实验装置不能达到实验目的是()BD7.(2分)为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NaClO溶液)消毒,下列说法不正确的是()8.(2分)在Al2(SO4)3、K2SO4和明矾的混和溶液中,如果c(SO42﹣)等于0.2mol/L,当加入等体积的0.2mol/L的KOH 溶液时,生成的沉淀恰好溶解,则原混和液中K+的物质的浓度为()×0.2mol/L=0.05mol/L,由电荷守恒可知溶液中×0.2mol/L=0.05mol/L,9.(2分)烧杯中盛有液态物质A,加入少量固体物质B,B 不溶解.当通入气体C时发现B逐渐溶解直至完全溶解.则A、B、C依次为()10.(2分)下列说法正确的是()①标准状况下,22.4L己烯含有的分子数为N A②标准状况下,22.4L氧气和氮气的混合物含有的分子数约为N A③7.1g氯气与足量的氢氧化钠溶液反应转移的电子数约为0.2N A④1mol氨气中含有的共价键数约为4N A⑤500mL1mol/L的硫酸铝溶液中含有的硫酸根离子数约为1.5N A.=1mol =0.1mol11.(2分)对于反应①KHCO3溶液与石灰水反应;②Na2CO3溶液与稀盐酸反应;③Na与烧碱溶液反应;④Fe与稀硝酸反应;改变反应物用量或浓度,不能用同一个离子方程式表示的是()12. NaCl是一种化工原料,可以制备一系列物质.下列说法正确的是()2FeCl13.(2分)配制100mL 1.0mol/LNa2CO3溶液,下列操作正确的是()14.(2分)(2012•河北模拟)常温下,下列各组离子在指定溶液中一定能大量共存的是()=1×l014的溶液:Ca2+、Na+、ClO﹣、NO3﹣15.(2分)能正确表示下列反应的离子方程式的是()16.水钴矿(含CuO、Co2O3,Fe2O3、MgO等)用硫酸法浸出铜和钴,如图是不同还原剂对元素浸出率的影响(硫酸浓度3mol•L﹣1,温度60℃),下列说法正确的是()17.(2分)MnO2的一些性质或用途如图,下列说法正确的是()18.能在水溶液中大量共存的一组离子是()19.(2分)实验中需用2.0mol•L﹣1的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为()20.(2分)下列叙述符合实验事实的是()21.下列说法不正确的是()22.(2分)下列关于过氧化钠的叙述正确的是()23.(2分)下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是()24.(2分)将紫色石蕊试液滴入NaOH溶液中,溶液变蓝色,再通入氯气,溶液由蓝色先变成红色,最后颜色慢慢退去,其原因是()①氯气有漂白性②氯气与NaOH溶液反应③氯气的水溶液呈酸性④次氯酸有漂白性⑤氯化钠有漂白性.二、非选择题(共52分)25.(7分)Na2O2几乎能与所有常见的气态非金属氧化物在一定条件下反应,如:2Na2O2+2CO2=2Na2CO3+O2,Na2O2+CO=Na2CO3.(1)试分别写出Na2O2与SO2、SO3反应的化学方程式:2Na2O2+2SO2═2Na2SO4,2Na2O2+2SO3═2Na2SO4+O2.(2)通过比较可知,当非金属元素处于最高价态时,与Na2O2反应有O2生成.(3)等物质的量的N2、O2、CO2的混合气体通过Na2O2后,体积变为原体积的(同温同压下),这时混合气体中N2、O2、CO2物质的量之比为 1.75:1.75:1 .=,26.(17分)现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度.(可供选用的反应物只有CaCO3固体、6mol/L盐酸、6mol/L硫酸和蒸馏水)回答下列问题:(1)装置A中液体试剂选用6mol/L盐酸,理由是硫酸和碳酸钙反应生成的硫酸钙是微溶于水的,会覆盖在碳酸钙的表面,使反应不能持续.(2)装置B的作用是除去气体中的HCl .装置C的作用是干燥气体.装置E中碱石灰的作用是吸收装置D中反应剩余的二氧化碳.(3)装置D中发生反应的化学方程式是2Na2O2+2CO2=2Na2CO3+O2,Na2O+CO2=Na2CO3.(4)若开始时测得样品的质量为2.0g,反应结束后测得气体体积为224mL(标准状况),则Na2O2试样的纯度为78% .=27.(18分)某研究性学习小组设计如图装置制取氯气并以氯气为原料进行实验.(1)装置A烧瓶中发生反应的化学方程式为MnO2+4HCl (浓)MnCl2+Cl2↑+2H2O ;(2)装置B中饱和食盐水的作用是除去HCl ,装置C中浓硫酸的作用是吸收水蒸气;(3)实验时,先点燃 A 处的酒精灯,再点燃 D 处酒精灯,写出D中反应的化学方程式2Fe+3Cl2=2FeCl3,写出E中反应的离子方程式Cl2+2OH﹣=Cl﹣+ClO﹣+H2O ;(4)若实验中用12mol•L﹣1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量总是小于0.03mol,试分析可能存在的原因是:①HCl挥发,②浓盐酸变稀不再反应.欲使反应生成Cl2的物质的量最大程度的接近0.03mol,则在装置气密性良好的前提下实验中应采取的措施是慢慢滴加浓盐酸,缓缓加热.(浓)28.(10分)铁单质及其化合物在生活、生产中应用广泛.请回答下列问题:(1)由于氧化性Fe3+>Cu2+,氯化铁溶液常用做印刷电路铜板腐蚀剂,反应的离子方程式是Cu+2Fe3+=2Fe2++Cu2+.(2)硫酸铁可做絮凝剂,常用于净水,其原理是Fe3++3H2O⇌Fe(OH)3+3H+(用离子方程式表示).在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是酸性环境中,氢离子抑制了铁离子的水解,无法生成氢氧化铁胶体.(3)磁铁矿冶炼铁的原理是Fe3O4+4CO=3Fe+4CO2,若有1.5mol Fe3O4参加反应,转移的电子的物质的量是12mol .(4)表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是 B (填字母).。
福建省永安市三中2019_2020学年高二生物下学期期中试题含解析

福建省永安市三中2019-2020学年高二生物下学期期中试题(含解析)一、单选题1.下列属于相对性状的是()A. 鸡的毛腿和毛翅B. 猫的白毛和狗的黑毛C. 人的卷发与白发D. 豌豆花的顶生与腋生【答案】D【解析】【分析】生物的形态结构特征,生理特性和行为方式统称为生物的性状,同种生物同一性状的不同表现称为相对性状。
【详解】A、鸡的毛腿和毛翅不属于鸡的同一性状,A错误;B、猫的白毛和狗的黑毛,不是同一种生物,B错误;C、人的卷发和白发不属于人的同一性状,C错误;D、豌豆花的顶生和腋生是同种生物的同一性状的不同表现类型,属于相对性状,D正确。
故选D。
2.豌豆在自然状态下是纯种的原因是()A. 豌豆具有易于区分的性状B. 豌豆是闭花受粉的植物C. 豌豆生长周期短D. 豌豆繁殖能力强【答案】B【解析】【分析】自花传粉是指两性花的花粉,落到同一朵花的雌蕊柱头上的过程;豌豆的蝶形花冠中,有一对花瓣始终紧紧地包裹着雄蕊和雌蕊,相对性状是指一种生物的同一性状的不同表现类型。
【详解】豌豆是自花传粉植物,而且是严格闭花授粉,在未开放时就已经完成了授粉,避免了外来花粉的干扰,自然状态下一般都是纯种,用豌豆做人工杂交实验,结果既可靠,又容易分析,B正确。
3.三大遗传规律在下列哪种生物中不.起作用A. 人类B. 玉米C. 蓝藻D. 大豆【答案】C【解析】【分析】三大遗传定律包括基因的分离定律、基因的自由组合定律和连锁交换定律。
1、孟德尔遗传定律(基因的分离定律和基因的自由组合定律),发生在减数分裂形成配子的过程中,且都发生在减数第一次分裂后期.孟德尔遗传定律只适用于进行有性生殖的真核生物,包括动物和植物。
2、连锁交换定律:生殖细胞形成过程中,位于同一染色体上的基因是连锁在一起,作为一个单位进行传递,称为连锁律。
在生殖细胞形成时,一对同源染色体上的不同对等位基因之间可以发生交换,称为交换律或互换律,发生在有性生殖的生物中。
福建省永安市第三中学2018届高三9月月考化学试题

永安三中高中部2019届高三期初教学质量检查化学试卷(考试时间90分钟满分100分)注意:1、请将答案填写在答题卡上;2、可能用到的相对原子质量:N-14 Si-28 Cu-643、本卷包括必做和选做两部分,其中化学反应原理部分为必做题,有机化学基础与物质结构与性质为选做题,学生可任选相关试题进行答题。
第一部分:化学反应原理(必做题)一、选择题(每题只有一个正确答案,每题3分,共24分)1.下列利用相关数据作出的推理或判断一定正确的是A.利用焓变数据判断反应能否自发进行 B.利用溶液的pH判断该溶液的酸碱性C.利用平衡常数判断反应进行的程度大小 D.利用反应热数据判断反应速率的大小2.下图所示的装置中,与手机充电的能量转化形式相同的是()A.电解水 B.水力发电C.太阳能热水器 D.干电池3.25℃时,下列关于0.1 mol·L-1的氨水和0.1 mol·L-1的醋酸溶液说法正确的是()A.0.1 mol·L-1的氨水溶液,pH=13B.0.1 mol·L-1的醋酸加水稀释,溶液中c(H+)和c(OH-)都减小C.0.1 mol·L-1的醋酸溶液中:c(OH-)+c(CH3COO-)=c(H+)D.0.1 mol·L-1的氨水与0.1 mol·L-1盐酸溶液等体积混合所得溶液中:c(Cl-)=c(NH4+)>c(H+)=c(OH-)4.关于下列各装置图的叙述中,错误的是:A.装置①用来电解饱和食盐水,c电极产生的气体能使湿润的淀粉KI试纸变蓝B.装置②可用于收集H2、NH3、Cl2、HCl、NO2C.装置③检查乙炔的还原性(实验室是由饱和食盐水与电石制乙炔,产生的混合气体除乙炔外,常含有H3P ,H2S等杂质气体)D.装置④可用于干燥、收集氨气、并吸收多余的氨气5.合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为CO(g)+ H 2O(g)CO2(g) + H2(g) ΔH<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是:A.增加压强 B.降低温度 C.增大CO 的浓度 D.更换催化剂6.铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。
【精准解析】福建省永安市第三中学2019-2020学年高二下学期期初综合检测试化学试题

永安三中2019-2020学年第二学期高二化学期初综合检测试卷可能用到的相对原子质量:H-1 O-16 Na-23 第I 卷(选择题)一、单选题(共16小题,每小题3分,共48分) 1.下列对核外电子运动状态的描述正确的是( )A. 电子的运动与行星的运动相似,围绕原子核在固定的轨道上高速旋转B. 能层数为3时,有3s 、3p 、3d 、3f 四个轨道C. 氢原子中只有一个电子,故只有一个轨道,不能发生跃迁而产生光谱D. 在同一能级上运动的电子,其运动状态肯定不同 【答案】D 【解析】【详解】A .电子运动不是围绕原子核在固定的轨道上高速旋转,只是在某个区域出现的概率大些,故A 错误;B .三能层中没有f 轨道,即能层数为3时,只有3s 、3p 、3d 轨道,故B 错误;C .氢原子有多个轨道,只有一个轨道上有电子,其它轨道为空轨道,故C 错误;D .同一能级上的同一轨道上最多排2个电子,两个电子的自旋方向不同,则其运动状态肯定不同,所以在同一能级上运动的电子,其运动状态肯定不同,故D 正确; 故选D 。
2.以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( ) A. HeB.C.D. 1s 2【答案】C 【解析】【详解】He 是氦元素符号,表示核外有一个电子层且有2个电子,1s 2表示在1s 轨道上有2个电子,表示1s 轨道上有2个电子,且自旋相反,所以电子运动状态描述最详尽的是C ,故答案为C 。
3.以下有关元素性质的说法不正确的是A. 具有下列电子排布式的原子中,①1s 22s 22p 63s 23p 2②1s 22s 22p 3③1s 22s 22p 2④1s 22s 22p 63s 23p 4原子半径最大的是①B. 具有下列最外层电子排布式的原子中,①3s23p1②3s23p2③3s23p3④3s23p4第一电离能最大的是③C. ①Na、K、Rb ②N、O、S ③Si、P、As ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④D. 某元素基态原子的逐级电离能分别为578、1817、2745、11575、14830、18376、23293,当它与氯气反应时可能生成的阳离子是X2+【答案】D【解析】【详解】A、原子依次为①硅,②氮,③碳,④硫,原子半径最大的是①硅,不选A;B、根据同一周期的元素,最外层电子越多,第一电离能越大,第ⅤA族3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,所以③的第一电离能最大,不选B;C、同周期从左到右电负性增大,同主族从上到下电负性减小,所以钠钾铷的电负性依次减小,氮氧硫的电负性中氧的电负性最大,硅磷砷的电负性中最大的是磷,钠磷氯的电负性依次增大,所以不选C;D、根据元素电离能分析,该元素原子核最外层有3个电子,所以其最外层电子在化学反应中容易失去而在化合物中呈现+3价,所以选D。
【精准解析】福建省永安市第三中学2019-2020学年高二下学期期初综合检测试数学试题
bx c
0
的解集为
x
|
1 3
x
2
,则不等式
cx2
bx a
0 的解为
()
A.
x
|
3
x
1
ห้องสมุดไป่ตู้
2
B.
x
x 3 或 x
1
2
-3-
C.
x
|
2
x
1
3
【答案】A
【解析】
【分析】
D.
x
x 2 或 x
1
3
由题意知
ax2
bx
c
0 的两根为
x1
1 3
,
x2
2
,且 a 0 ,将根代入方程从而可得
-1-
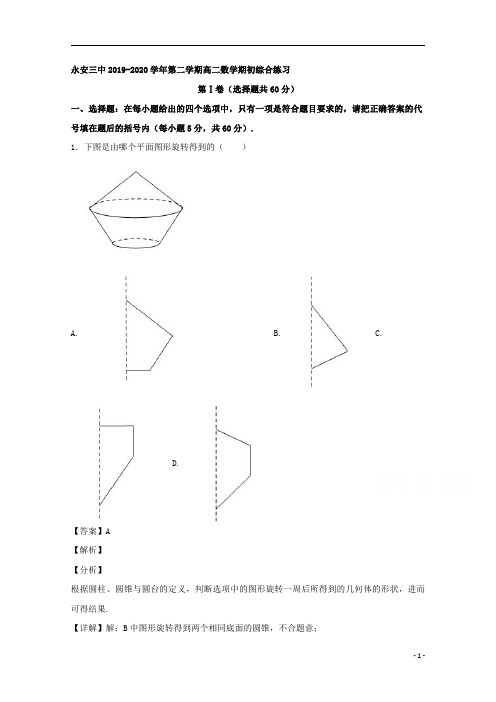
C 中图形旋转得到相同底面的圆柱与圆锥,不合题意;
D 中图形旋转得到两个圆锥与一个圆柱,不合题意;
A 中图形旋转得到一个圆台与一个圆锥,合题意.
故选:A.
【点睛】本题主要考查旋转体的基本定义,考查了空间想象能力,属于基础题.
2. 若实数 a、b 满足 a b 2 ,则 3a 3b 的最小值是( )
-4-
A. 24 cm2 ,12 cm2
B. 15 cm2 ,12 cm2
C. 24 cm2 , 36 cm2
D. 以上都不正确
【答案】A 【解析】 【分析】
根据三视图知:该几何体是一个圆锥,其中底面半径为:r 3,母线为 l 5 ,高为:h 4 ,
代入公式求解. 【详解】由三视图知:该几何体是一个圆锥,如图所示:
其中底面半径为: r 3,母线为 l 5 ,则高为: h 4 所以该几何体的表面积 S rl r 2 24 ,体积为V 1 r2h 12
福建省永安市第三中学2019_2020学年高二化学10月月考试题

福建省永安市第三中学2019-2020学年高二化学10月月考试题考试时间:70分钟满分100分一.单选题(每小题2分,共50分)1.下列有关能量转换的说法正确的是()A. 原电池是将电能转化为化学能的过程B. 煤燃烧是化学能转化为热能的过程C. 动物体内葡萄糖被氧化成是热能转变成化学能的过程D. 植物通过光合作用将转化为葡萄糖是太阳能转变成热能的过程2.反应A+B→C((放热)分两步进行:①A+B→X(吸热)②X→C(放热),下列示意图中能正确表示总反应过程中能量进变化的是()A. B. C. D.3.化石燃料仍是目前能源的主体,但已经面临危机,开发新能源是解决能源问题的关键.下列能量转换过程,不涉及化学变化的是()A. 利用氢氧燃料电池提供电能B. 利用太阳能分解水制备氢气C. 利用水流驱动涡轮机发电D. 利用植物秸秆为原料生产乙醇燃料4.对于300mL 1mol•L-1盐酸与铁片的反应,采取下列措施:①升高温度②改用100mL 3mol•L-1盐酸③再加300mL 1mol•L-1盐酸④用等量铁粉代替铁片⑤改用100mL 98%的硫酸其中能使反应速率加快的是()A. ①②④B. ①③④C. ①②③④D. ①②③⑤5.某一反应物的浓度为1.0mol/L,经过20s后,它的浓度变化了0.2mol/L,在这20s内它的反应速率为()A. 0.04 mol/(L•S)B. 0.01mol/LC. 0.02mol/(L•S)D. 0.8mol/(L•S)6.下列有关化学反应速率的说法正确的是()A. 用铝片和硫酸反应制氢气,硫酸浓度越高,反应速率越快B. 锌和稀硫酸反应制氢气时,加入少量CuSO4溶液,可加快反应速率C. 增大压强、升高温度和使用催化剂均一定使反应速率加快D. 在碳酸钙和盐酸反应中,加多些碳酸钙可使反应速率明显如快7.下列关于化学反应速率和化学反应限度的说法中正确的是()A. 化学反应速率是衡量化学反应进行快慢程度的物理量B. 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示C. 当一个可逆反应达到平衡状态时,这就是这个反应所能达到的限度,即使条件改变,该限度都不改变D. 平衡状态是一种静止的状态,因为反应物和生成物的浓度已经不再改变8.在一可变容积的密闭容器中进行反应:C(s)+H2O(g)⇌CO(g)+H2(g),下列条件的改变对反应速率几乎无影响的是()A. 增加H2O(g)的量B. 增加C(s)的量C. 将容器的体积缩小一半D. 保持压强不变,充入N2,使容器的体积变大9.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,可以通过出现浑浊的快慢来判断反应的快慢程度,下列各组实验中最先出现浑浊的是()10.对于反应3Fe(s)+4H2O(g)⇌Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是()A. K=B. K=C. 增大c(H2O)或减小c(H2),会使该反应平衡常数减小D. 改变反应的温度,平衡常数不一定变化11.反应2SO2+O22SO3在密闭容器中进行。
福建省永安市第三中学2019-2020学年高二下学期期中考试生物试题+Word版含答案

永安三中2019-2020学年第二学期高二生物期中测试卷一、单选题(本大题共50小题,共50.0分)1.下列属于相对性状的是()A. 鸡的毛腿和毛翅B. 猫的白毛和狗的黑毛C. 人的卷发与白发D. 豌豆花的顶生与腋生2.豌豆在自然状态下是纯种的原因是()A. 豌豆具有易于区分的性状B. 豌豆是闭花受粉的植物C. 豌豆生长周期短D. 豌豆繁殖能力强3.孟德尔的遗传规律在哪种生物中不起作用()A. 人类B. 玉米C. 蓝藻D. 大豆4.下列关于孟德尔研究遗传规律获得成功原因的叙述,错误..的是()A. 先分析多对相对性状,后分析一对相对性状B. 科学地设计实验程序,提出假说并进行验证C. 正确地选用豌豆作为实验材料D. 运用统计学方法分析实验结果5.下列表示纯合体的基因型是()A. AaX H X HB. AABbC. AAX H X HD. aaX H X h6.下列各组遗传现象中,属于性状分离的是()A. 高茎豌豆自交后代全是高茎B. 矮茎豌豆自交后代全是矮茎C. 高茎豌豆自交后代有高茎和矮茎D. 矮茎豌豆测交后代全是矮茎7.遗传学两大定律的发现者是()A. 孟德尔B. 达尔文C. 施莱登D. 奥特曼8.下列基因型的个体中,只能产生一种配子的是()A. ddTtB. DDttC. DdTtD. DDTt9.如欲观察细胞减数分裂过程,可选用的材料是()A. 马蛔虫受精卵B. 成熟花粉粒C. 小鼠睾丸D. 叶芽10.在减数分裂过程中,同源染色体的非姐妹染色体的交叉互换发生在()A. 染色体复制时B. 着丝点断裂时C. 同源染色体分离时D. 四分体时期11.与有丝分裂相比,减数分裂过程中染色体变化最显著的特征是()A. 纺锤体的形成B. 着丝点的分裂C. 染色体的复制D. 同源染色体的联会和分离12.下列为某二倍体植物细胞处于不同分裂时期的示意图,其中属于减数第二次分裂后期的是()A. B.C. D.13.小军同学学完“减数分裂和受精作用”一节后,写下了下面四句话,请你帮他判断一下哪句话是正确的()A. 我细胞内的遗传物质一半来自于爸爸,一半来自于妈妈B. 我细胞内的每一对同源染色体都是父母共同提供的C. 我细胞内的每一对同源染色体大小都是相同的D. 我和我弟弟的父母是相同的,所以我们细胞内的遗传物质也是一样的14.肺炎双球菌转化实验证明了()A. DNA是遗传物质B. RNA是遗传物质C. 蛋白质是遗传物质D. 糖类是遗传物质15.下列关于噬菌体侵染细菌实验的相关叙述中,不正确的是()A. 该实验证明了子代噬菌体的各种性状是通过DNA遗传的B. 侵染过程的“合成”阶段,噬菌体以自身的DNA作为模板,而原料、ATP、酶、场所等条件均由细菌提供C. 为确认蛋白质外壳是否注入细菌体内,可用35S标记噬菌体D. 真核生物、原核生物的遗传物质是DNA,病毒的遗传物质是RNA16..赫尔希(A.Hershey)和蔡斯(M.Chase)于1952年所做的噬菌体侵染细菌的著名实验进一步证实了DNA是遗传物质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2019-2020学年福建省永安市三中2018级高二下学期期中考试
理科综合化学试卷
★祝考试顺利★
(含答案)
(考试时间:90分钟总分:100分)
可能用到的相对原子质量:Li-7 O-16
一、选择题(每题2分只有一个正确答案共44分)
P原子的电子排布式写成1s22s22p63s23p x23p y1,它违背了()
1. 若将
15
A.能量最低原则 B.泡利不相容原理
C.洪特规则 D.能量守恒原理
2.下列物质熔化时,不破坏化学键的是()
A.氯化钠 B.水晶 C.金刚石 D.十七烷
3.下列各组表述中,两个微粒不属于同种元素原子的是()
A、3p能级有一个空轨道的基态原子和核外电子的排布为1s22s22p63s23p2的原子
B、2p能级无空轨道,且有一个未成对电子基态原子和原子的最外层电子排布为2s22p5的
原子
C、最外层电子数是核外电子总数的1/5的原子和价电子排布为4s24p5的原子
D、M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2
4. 某元素质量数52,中子数28,其基态原子未成对电子数为()
A.3 B.4 C.5 D.6
5.下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是()
A.6与16 B.11与17 C.14与8 D.10与19
6.碱金属和卤素形成的化合物大多数具有的性质是()
①高沸点②能溶于水③水溶液能导电④低熔点⑤熔融状态不导电
A.①④⑤ B.①②③ C.②③⑤ D.③④⑤
7.有关CH
2
=CH-C≡N分子的说法正确的是( )
A.3个键,3个π键B.4个键,3个π键
C.6个键,2个π键D.6个键,3个π键
8.下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )
A.半导体材料砷化镓 B.吸氢材料镧镍合金
C.透明陶瓷材料硒化锌 D.超导材K
3C 60
9.下列化学式能真实表示物质分子组成的是()
A.NaOH B.CO
2C.C D.SiO
2
10.在硼酸[B(OH)
3
]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。
则分子中B原子杂化轨道的类型及同层分子间的主要作用力分别是 ( )
A.sp,范德华力B.sp2,范德华力
C.sp2,氢键D.sp3,氢键
11.下列配合物的配位数是6的是( )
A.K
2[Co(SCN)
4
] B.Fe(SCN)
3
C.Na
3[AlF
6
] D.[Cu(NH
3
)
4
]Cl
2。
