初中化学重点复习系列5-酸碱盐学习中的12345
九年级化学酸碱盐知识点总结

酸碱盐是化学中非常基础而又重要的知识点,它们在日常生活中无处不在。
以下是对九年级化学酸碱盐知识点的总结:一、酸碱盐的基本概念:1.酸:酸是指能够产生H+离子的物质。
常见的酸有硫酸、盐酸、硝酸等。
2.碱:碱是指能够产生OH-离子的物质。
常见的碱有氢氧化钠、氢氧化钾、氨水等。
3.盐:盐是酸和碱中和生成的物质。
常见的盐有氯化钠、硫酸铜、硝酸铵等。
二、酸碱的性质和酸碱中和反应:1.酸的性质:(1)酸有酸味,能腐蚀金属。
(2)酸能够改变红、蓝、紫色的性质。
(3)酸与碱反应能够生成盐和水。
2.碱的性质:(1)碱有碱味,能使植物脱水和腐蚀动物油脂。
(2)碱能够改变红、蓝、紫色的性质。
(3)碱与酸反应能够生成盐和水。
3.酸碱中和反应:酸和碱反应会产生盐和水。
它们的化学方程式为:酸+碱→盐+水。
例如:硫酸+氢氧化钠→硫酸钠+水三、酸碱指示剂:酸碱指示剂是一种能够通过颜色的变化来判断溶液是酸性、碱性还是中性的物质。
常见的酸碱指示剂有酚酞、酚红、甲基橙等。
四、盐的命名:盐的命名是根据其阳离子和阴离子的名称组合而成的。
一般来说,阳离子写在左边,阴离子写在右边。
例如:氯化钠、硫酸铜、硝酸铵等。
另外,一些过渡金属离子需要注明其氧化态,如二价铁离子是Fe2+。
五、酸碱盐的应用:酸碱盐广泛应用于日常生活和工业生产中:1.酸的应用:(1)酸可用于去除钙、镁等金属离子,软化水质。
(2)酸可用于清洁厕所、洗涤器具等。
2.碱的应用:(1)碱可用于制作肥皂和洗涤剂。
(2)碱可用于中和酸性土壤。
3.盐的应用:(1)食盐是人类生活中必备的调味品。
(2)一些盐可用于制作肥料。
(3)许多金属盐可用于制作染料和颜料等工业产品。
六、酸碱盐的鉴别方法:1.使用酸碱指示剂:通过颜色的变化来判断溶液的酸碱性质。
2.使用pH试纸:pH试纸通过pH颜色变化范围的不同来判断溶液的酸碱性质。
3.酸碱中和反应:通过观察是否产生气体、沉淀等来判断溶液的酸碱性质。
酸碱盐是化学中非常重要的概念,它们在日常生活中有着广泛的应用。
九年级化学酸碱盐知识点归纳

九年级化学酸碱盐知识点归纳一、酸碱盐的基本概念酸:电离时生成的阳离子全部是氢离子的化合物。
如:HCl、H2SO4、HNO3、CH3COOH 等。
碱:电离时生成的阴离子全部是氢氧根离子的化合物。
如:NaOH、KOH、Ca(OH)2、Ba(OH)2、NH3·H2O等。
盐:由金属离子(或铵根离子)和酸根离子组成的化合物。
如:NaCl、Na2CO3、CuSO4、NH4Cl等。
二、酸碱盐的通性酸的通性:使紫色石蕊试液变红,无色酚酞试液不变色。
与活泼金属反应生成盐和氢气。
与金属氧化物反应生成盐和水。
与碱反应生成盐和水。
与盐反应生成新盐和新酸。
碱的通性:使紫色石蕊试液变蓝,无色酚酞试液变红。
与非金属氧化物反应生成盐和水。
与酸反应生成盐和水。
与盐反应生成新盐和新碱。
盐的通性:有些盐能与酸反应生成新盐和新酸。
有些盐能与碱反应生成新盐和新碱。
有些盐能与某些盐反应生成两种新盐。
三、酸碱盐之间的反应酸碱中和反应:酸和碱反应生成盐和水,这类反应属于复分解反应。
如:HCl + NaOH = NaCl + H2O。
盐与酸的反应:生成新盐和新酸。
如:Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑。
盐与碱的反应:生成新盐和新碱。
如:CuSO4 + 2NaOH = Cu(OH)2↓+ Na2SO4。
盐与盐的反应:生成两种新盐。
如:Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl。
四、酸碱盐在生活中的应用酸:用于清洁金属表面、除锈、生产化肥等。
碱:用于中和酸性废水、生产洗涤剂、肥皂等。
盐:用于调味、防腐、生产化学原料等。
五、常见的酸碱指示剂紫色石蕊试液:遇酸变红,遇碱变蓝。
无色酚酞试液:遇酸不变色,遇碱变红。
六、溶液的酸碱度pH值:表示溶液酸碱度的数值,范围为0-14。
pH < 7为酸性,pH = 7为中性,pH > 7为碱性。
酸碱指示剂与pH试纸:用于测定溶液的酸碱度。
七、常见的酸碱盐及其性质盐酸(HCl):无色液体,具有刺激性气味,能与多种物质发生反应。
初三化学酸碱盐知识点(最全整理版)

初三化学酸碱盐知识点(最全整理版)初三化学酸碱盐知识点(最全整理版)化学是一门研究物质的科学,而酸碱盐是化学中的一大重要分支,它们在日常生活中扮演着重要的角色。
本文将为大家整理和介绍初三化学中关于酸碱盐的知识点,以帮助同学们更好地理解和掌握这一内容。
一、酸的基本概念酸是一种能够释放出氢离子(H+)的物质,在水溶液中呈酸性。
常见的酸包括盐酸、硫酸等。
酸的特点是呈酸性导电、与碱反应产生盐和水、与金属反应产生氢气等。
二、碱的基本概念碱是一种能够释放出氢氧根离子(OH-)的物质,在水溶液中呈碱性。
常见的碱包括氢氧化钠、氢氧化钙等。
碱的特点是呈碱性导电、与酸反应产生盐和水。
三、中和反应及酸碱指示剂酸与碱反应生成盐和水的过程被称为中和反应,具体表征为酸、碱溶液混合后呈中性。
酸碱中和反应是化学实验中常用的实验反应之一。
为了判断溶液是酸性、碱性还是中性,常用酸碱指示剂。
常见的酸碱指示剂有酚酞、甲基橙等。
四、酸碱盐的性质和应用1. 酸性、碱性和中性盐:根据酸的性质和碱的性质不同,盐可以分为酸性盐、碱性盐和中性盐。
酸性盐在溶液中会产生酸性物质,碱性盐则会产生碱性物质,而中性盐溶液不呈酸碱性。
2. 盐的酸碱性质:盐溶液的酸碱性质取决于其所属的酸和碱的性质。
例如,氯化钠是一种中性盐,因为它来源于酸性盐盐酸和碱性盐氢氧化钠的中和反应。
3. 盐的应用:盐在生活中有广泛的应用。
例如,食盐是我们日常生活中常用的调味品;硫酸铜可以用作催化剂和杀菌剂;氯化钾可以用作农业肥料等。
五、酸碱中的氢离子和氢氧根离子1. 酸中的氢离子:酸能够释放出氢离子,例如盐酸(HCl)可以释放出氢离子(H+)。
酸性溶液中有较多的氢离子存在。
2. 碱中的氢氧根离子:碱能够释放出氢氧根离子,例如氢氧化钠(NaOH)可以释放出氢氧根离子(OH-)。
碱性溶液中有较多的氢氧根离子存在。
六、酸碱中和反应的化学方程式酸碱中和反应的化学方程式通常遵循如下规律:酸 + 碱→ 盐 + 水例如,盐酸和氢氧化钠的中和反应可以写作:HCl + NaOH → NaCl + H2O七、pH值和酸碱强弱1. pH值:pH值是用来表示溶液酸碱性强弱程度的指标,其取值范围为0-14。
酸碱盐中的12345

“酸碱盐”中的“12345”一.1个原则---交换的原则:酸碱盐所发生的反应几乎都是置换反应或者是复分解反应,不论是置换反应还是复分解反应都是位置的交换。
如:Fe+CuSO4==FeSO4+Cu KOH+HCl=KCl+H20练习:写出下列反应的方程式:(一)、交换的 1.氧化铜和盐酸2.氧化铁和硫酸3.氯化钠和硝酸银4.硫酸钠和氯化钡5.碳酸钠和盐酸6.碳酸钠和石灰水7.石灰水和硫酸铜8.氢氧化钡和硫酸 9.氢氧化钠和碳酸10.氢氧化钠和硫酸铵(氢氧化铵就是氨水,不稳定会分解)(二)、非直接交换1. 氢氧化钙和二氧化碳2.氢氧化钠和二氧化碳3.氢氧化钠和二氧化硫(提示:S02+H20==H2S03亚硫酸)1个规律---成盐的规律:(有酸碱盐参加的)一切反应都生成盐(共有10种成盐的类型)2NaOH+CuO≠Cu(OH)2↓+Na2O 没有盐生成二、两类反应条件(一):置换反应的条件依据:金属活动性顺序表K Ca Na Mg Al Zn Fe Sn Pd (H) Cu Hg Ag Pt Au1:金属+酸的反应条件:氢前金属、非氧化酸(如:不能硝酸、浓硫酸),铁生成亚铁盐下列能否反应?能--写,不能--说Zn+H2SO4= Cu+H2SO4= Fe+2HNO3=2:金属+盐的反应条件:前置后,盐须溶,K Ca Na不能行。
下列能否反应?能---写,不能---说Fe+CuSO4= Cu+ZnSO4=Cu+AgCl= Na+CuSO4=(二):复分解反应的条件双交换,价不变,生成气体、水、沉淀;盐-盐、盐-碱须可溶,弱酸制强不能行。
下列能否反应?能--写,不能---说Fe2O3+6HCl== Ca(OH)2+Na2CO3== NaCl+KOH== BaCO3+Na2SO4== CuSO4+Fe(OH)3== CaCl2+H2CO3==三、三类物质的性质根据成盐规律推出(一)酸:电离出的阳离子都是H+的化合物,能和含金属的物质反应。
初三化学酸碱盐知识点详解 告别迷茫

初三化学酸碱盐知识点详解告别迷茫一、酸碱盐的基本概念酸、碱和盐是化学中重要的概念,它们在日常生活和工业生产中都有广泛的应用。
了解酸碱盐的基本概念对于化学学科的学习至关重要。
1.1 酸的概念酸是指能够产生氢离子(H+)的化合物,常用于酸的化学方程式中。
在水溶液中,酸会将自身的氢离子释放出来,与水中的水分子进行反应,形成氢离子和酸根离子。
1.2 碱的概念碱是指能够产生氢氧根离子(OH-)的化合物,常用于碱的化学方程式中。
在水溶液中,碱会将氢氧根离子释放出来,与水中的氢离子进行反应,形成水和盐。
1.3 盐的概念盐是酸和碱反应产生的化合物。
在酸碱中和反应中,酸的氢离子与碱的氢氧根离子结合形成盐。
盐由阳离子和阴离子组成,可以是无机盐或有机盐。
二、酸碱指示剂的分类与应用2.1 酸碱指示剂的定义酸碱指示剂是一种通过颜色变化来指示物质酸性或碱性的物质。
它是化学实验中常用的测试试剂,能够帮助我们判断物质的酸碱性。
2.2 酸碱指示剂的分类常见的酸碱指示剂包括天青石蓝、甲基橙、酚酞等。
根据它们在酸性和碱性溶液中的颜色变化,可以将酸碱指示剂分为以下几类:2.2.1 酸性指示剂酸性指示剂在酸性溶液中呈现出不同的颜色。
例如,天青石蓝在酸性溶液中呈红色。
2.2.2 中性指示剂中性指示剂在酸性和碱性溶液中呈现出中性的颜色。
例如,酚酞在酸性溶液中呈红色,在碱性溶液中呈黄色。
2.2.3 碱性指示剂碱性指示剂在碱性溶液中呈现出不同的颜色。
例如,甲基橙在碱性溶液中呈黄色。
2.3 酸碱指示剂的应用酸碱指示剂广泛应用于化学实验和工业生产中。
通过观察酸碱指示剂溶液的颜色变化,可以判断物质的酸碱性,并调整实验条件或工艺流程。
三、酸碱中和反应酸碱中和反应是指酸与碱在适当的条件下进行反应,形成盐和水的化学反应。
在这个反应过程中,酸的氢离子和碱的氢氧根离子结合形成盐,同时释放出水。
3.1 酸碱中和反应的化学方程式通常情况下,酸碱中和反应的化学方程式可以表示为:酸 + 碱→ 盐 + 水其中,酸和碱根据具体情况可以是强酸和强碱、强酸和弱碱、弱酸和强碱,或者弱酸和弱碱。
初三化学酸碱盐知识点(最全整理版)

初三化学酸碱盐知识点(最全整理版)酸碱盐是化学中的常见概念,涉及到酸、碱和盐的性质、命名规则以及酸碱中和反应等方面。
以下是初三化学酸碱盐的知识点整理:1. 酸的定义:酸是指能够释放出H+离子的物质,通常呈酸性溶液。
2. 酸的性质:酸有酸味,可以腐蚀金属,可以脱色某些有机物质,可以中和碱。
3. 酸的常见实验室制法:酸可以通过金属与非金属氧化物(如二氧化硫、二氧化碳)反应得到。
4. 碱的定义:碱是指能够释放出OH-离子的物质,通常呈碱性溶液。
5. 碱的性质:碱有苦味和涩味,可以腐蚀皮肤,可以中和酸。
6. 碱的常见实验室制法:碱可以通过金属与水反应得到。
7. 盐的定义:盐是由酸和碱中和反应得到的化合物。
盐的离子由酸中的阳离子和碱中的阴离子组成。
8. 索式和名命名法:化合物的化学式中,金属离子写在前面,非金属离子写在后面。
离子交换时,电荷要平衡。
9. 盐的性质:盐是晶体固体,有盐味,可溶于水,不导电的固体。
其溶液呈中性。
10. 酸碱中和反应:酸和碱反应时,酸中的H+离子和碱中的OH-离子结合形成水,同时生成盐。
酸碱中和反应是发生酸碱中和反应的一种特殊类型。
11. 盐的分类:盐可以分为氯化物、硝酸盐、硫酸盐、碳酸盐和磷酸盐。
12. 盐的应用:盐在生活中广泛应用,如食盐、食品加工、肥料、火药等。
13. 酸碱指示剂:酸碱指示剂能够根据物质的酸碱性质的变化而改变颜色,用于酸碱溶液的鉴定。
14. pH值的概念:pH值是反映溶液酸碱性的指标,pH值越小,表示酸性越强;pH值越大,表示碱性越强;pH值为7时,表示中性。
以上是初三化学酸碱盐的知识点整理,希望对你有帮助!。
初中中考化学“酸碱盐”知识点归纳总结

中考化学“酸碱盐”知识点归纳总结一、组成:1、酸的组成:氢离子+酸根离子2、碱的组成:金属离子+氢氧根离子3、盐的组成:金属离子+酸根离子(铵根离子+酸根离子)4、复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
AB+CD=AD+CB5、稀释浓硫酸的方法:一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里。
6、中和反应:酸跟碱作用生成盐和水的反应叫做中和反应。
二、熟记常见元素和原子团的化合价口诀:(正价)一氢钾钠银,二钙镁钡锌,三铝、四硅、五氮磷。
(负价)负一价:氟、氯、溴、碘;负二价:氧和硫。
(可变正价)一二铜汞,二三铁,二四碳,四六硫。
原子团的化合价:负一价:氢氧根(OH—),硝酸根(NO3—),氯酸根(ClO3—),高锰酸根(MnO4—);负二价:硫酸根(SO42—),碳酸根(CO32—),亚硫酸根(SO32—),锰酸根(MnO42—);负三价:磷酸根(PO43—);正一价:铵根(NH4+)。
三、熟记下列反应方程式:(一)酸的性质(1)与指示剂反应紫色石蕊试液变红色,无色酚酞试液不变色。
(2)酸+碱=盐+水。
(3)酸+某些金属氧化物=盐+水。
(4)酸+活泼金属=盐+氢气。
(5)酸+盐=新盐+新酸。
1、锌跟稀盐酸反应:Zn + 2HCl = ZnCl2 + H2↑有气泡产生,2、锌跟稀硫酸反应:Zn + H2SO4 = ZnSO4 + H2↑锌粒逐渐减少。
3、铁跟稀盐酸反应:Fe + 2HCl = FeCl2 + H2↑有气泡产生,铁逐渐减少4、铁跟稀硫酸反应:Fe + H2SO4 =FeSO4 + H2↑溶液变成浅绿色5、铁锈跟稀盐酸反应:Fe2O3 +6HCl = 2FeCl3 + 3H2O 红色铁锈逐渐消失,6、铁锈跟稀硫酸反应:Fe2O3+ 3 H2SO4 = Fe2(SO4)3 + 3H2O 溶液变成黄色7、氧化铜跟稀盐酸反应:CuO + 2HCl =CuCl2 +H2O 黑色氧化铜逐渐消失,8、氧化铜跟稀硫酸反应:CuO + H2SO4= CuSO4 + H2O 溶液变成蓝色9、氢氧化铜跟稀盐酸反应:Cu(OH)2 + 2HCl = CuCl2 + 2H2O 蓝色沉淀消失10、氢氧化铜跟稀硫酸反应:Cu(OH)2 + H2SO4 = CuSO4 + 2H2O 变成蓝色溶液(二)碱的性质:(1)碱溶液能使紫色石蕊试液变蓝色,无色酚酞试液变红色。
九年级化学酸碱盐知识点总结

九年级化学酸碱盐知识点总结初三化学知识点总结——酸、碱、盐一、酸碱盐的组成与性质酸、碱、盐的组成:酸是由氢元素和酸根组成的化合物,如硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3);碱是由金属元素和氢氧根组成的化合物,如氢氧化钠、氢氧化钙、氨水(NH3·H2O);盐是由金属元素(或铵根)和酸根组成的化合物,如氯化钠、碳酸钠。
酸、碱、盐的水溶液可以导电,原因是溶于水时离解形成自由移动的阴、阳离子。
1.酸1)浓盐酸、浓硫酸的物理性质、特性、用途浓盐酸是无色液体,工业用盐酸为黄色(含Fe)体,有刺激性气味,挥发性强,吸水性脱水性强,特性瓶口有白雾。
浓硫酸是无色粘稠、油状液,无气味,氧化性强,腐蚀性强。
它们的用途包括金属除锈、制造药物、生产化肥、精炼石油、作干燥剂等。
2)酸的通性酸具有通性的原因是酸离解时所生成的阳离子全部是H+。
酸的通性表现为与酸碱指示剂的反应,使紫色石蕊试液变红色,不能使无色酚酞试液变色;金属与酸反应生成盐和氢气;碱性氧化物与酸反应生成盐和水;碱与酸反应生成盐和水;盐与酸反应生成另一种盐和另一种酸(产物符合复分解条件)。
3)三种离子的检验Cl-用AgNO3及HNO3检验;SO4用Ba(NO3)2及HNO3检验;CO32-用HCl及BaCl2检验;用石灰水检验HCl。
2.碱1)氢氧化钠、氢氧化钙的物理性质、用途氢氧化钠是白色粉末,微溶于水;氢氧化钙是颜色白色固体,极易溶于水(溶解状态放热)。
它们的用途包括制造肥皂、制浆造纸、制造玻璃、净化废水等。
2)碱的通性碱具有通性的原因是离解时所生成的阴离子全部是OH-。
碱的通性表现为碱溶液与酸碱指示剂的反应,使紫色石蕊试液变蓝色,使无色酚酞试液变红色;酸性氧化物与碱反应生成盐和水;酸与碱反应生成盐和水;盐与碱反应生成另一种盐和另一种碱(反应物均可溶,产物符合复分解条件)。
需要注意的是,难溶性碱受热易分解,不属于碱的通性。
3.酸性氧化物与碱性氧化物4.中和反应、溶液酸碱度的表示法——pH凡是能够与碱反应生成盐和水的物质被定义为碱性氧化物,而凡是能够与酸反应生成盐和水的物质被定义为酸性氧化物。
中考化学之酸碱盐知识点

中考化学之酸碱盐知识点一、酸、碱、盐的组成酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)碱是由金属元素和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)盐是由金属元素元素(或铵根)和酸根组成的化合物如:氯化钠、碳酸钠酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)二、酸1、浓盐酸、浓硫酸的物理性质、特性、用途2、酸的通性(具有通性的原因:酸离解时所生成的阳离子全部是H+)(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色(2)金属+ 酸→盐+ 氢气(3)碱性氧化物+ 酸→盐+ 水(4)碱+ 酸→盐+ 水(5)盐+ 酸→另一种盐+ 另一种酸(产物符合复分解条件)3、三种离子的检验试剂Cl- AgNO3 及HNO3SO42- ①Ba(NO3)2及HNO3②HCl 及BaCl2CO32- HCl 及石灰水三、碱1、氢氧化钠、氢氧化钙的物理性质、用途2、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH-)(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)酸性氧化物+碱→盐+水(3)酸+碱→盐+水(4)盐+碱→另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)注:①难溶性碱受热易分解(不属于碱的通性)如Cu(OH)2 ΔCuO +H2O2Fe(OH)3 ΔFe2O3+3H2O②常见沉淀:AgCl↓BaSO4↓Cu(OH)2↓ F e(OH)3↓Mg(OH)2↓BaCO3↓CaCO3↓③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
四、酸性氧化物与碱性氧化物五、中和反应溶液酸碱度的表示法--pH1、定义:酸与碱作用生成盐和水的反应2、应用:(1)改变土壤的酸碱性(2)处理工厂的废水(3)用于医药3、溶液酸碱度的表示法--pH(1)(2)pH的测定:最简单的方法是使用pH试纸用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)(3)酸雨:正常雨水的pH约为5.6(因为溶有CO2)pH<5.6的雨水为酸雨酸碱盐性质之酸的通性酸的组成——氢离子+酸根离子(1)跟指示剂反应紫色石蕊试液遇酸变红色无色酚酞试液遇酸不变色(2)酸的PH<7(3)跟(H)前的活泼金属起置换反应酸+ 金属==盐+ 氢气例:2HCl+Fe=FeCl2+H2↑(4)跟碱性氧化物和某些金属氧化物反应酸+ 碱性(金属)氧化物—→盐+水例:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O(5)跟某些盐反应酸+碳酸盐==盐+水酸+盐—→新酸+新盐例:H2SO4+BaCl2=2HCl+BaSO4↓(6)跟碱起中和反应酸+碱—→盐+水例:2HCl+Cu(OH)2=CuCl2+2H2O初中化学酸碱盐的复习及重点题型解析在各省市中考试卷的命题中,无不将酸碱盐的化学性质的考察作为重中之重。
初三化学酸碱盐知识点(最全整理版)

应用广泛的酸、碱、盐一.溶液的酸碱性一、酸性溶液和碱性溶液1.实验:检验溶液的酸碱性实验试样白醋酸果汁稀盐酸纯碱溶液肥皂水石灰水氨水食盐水蔗糖水滴加紫色石蕊试液变红变红变红变蓝变蓝变蓝变蓝紫色紫色滴加无色酚酞试液无色无色无色变红变红变红变红无色无色结论酸性酸性酸性碱性碱性碱性碱性中性中性结论:(1)凡是能使紫色石蕊试液变红的溶液都是酸性..溶液,并且该溶液不能使无色酚酞试液变色;(2)凡是能使紫色石蕊试液变蓝的溶液都是碱性..溶液,并且该溶液能使无色酚酞试液变红;(3)不能使紫色石蕊试液变色,也不能使无色酚酞试液变色的溶液,我们称为中性溶液。
(4)如紫色石蕊试液及无色酚酞等能检验溶液酸碱性的试液,称为酸碱指示剂。
注意:①我们有时候还用蓝色或红色石蕊试纸来检验溶液的酸碱性;②酸性溶液能使蓝色石蕊试纸变红,碱性溶液能使红色石蕊试纸变蓝;③只有可溶性的酸性、碱性物质才能使指示剂变色,变色的是指示剂,而不是该物质。
2.日常生活中常见的酸性物质与碱性物质(1)酸性物质:山楂、柠檬、柑橘、西红柿等;(2)碱性物质:茶叶碱、烟碱等。
3.区分酸溶液和酸性溶液、碱溶液和碱性溶液注意:酸溶液是指酸的水溶液,酸性溶液是指能使紫色石蕊试液变红的溶液,因此酸溶液一定是酸性溶液,而酸性溶液不一定是酸溶液;同样,碱性溶液不一定是碱溶液,碱溶液一定是碱性溶液。
例如:硫酸铜、氯化铵的水溶液显酸性,而不是酸;纯碱、肥皂的水溶液显碱性,但不是碱。
4.补充知识:酸、碱、盐的概念(1)酸:电离时生成的阳离子全部..是氢离子的化合物。
如:HCl、HNO3、H2SO4、H2CO3等。
1HCl==H++Cl-;H2SO4==2H++SO42-;(2)碱:电离时生成的阴离子全部..是氢氧根离子的化合物。
如:NaOH、Ca(OH)2等。
NaOH==Na++OH-;Ca(OH)2==Ca2++2OH-;(3)盐:电离时生成金属离子(或铵根离子)和酸根离子的化合物。
初三酸碱盐知识点归纳总结

初三酸碱盐知识点归纳总结酸碱盐是我们初中化学学习的基础知识之一,它涉及到许多重要的概念和原理。
在初三学习化学的过程中,我们需要对酸碱盐的知识点进行归纳总结,以便更好地理解和记忆。
本文将对初三酸碱盐的知识点进行归纳总结,希望对同学们的学习有所帮助。
一、酸碱盐的基本概念1. 酸:指在水溶液中能产生氢离子(H+)的化合物,其特征为有酸味,能与金属反应产生氢气,能蚀刻金属等。
2. 碱:指在水溶液中能产生氢氧根离子(OH-)的化合物,其特征为有碱味,能与酸中和生成盐和水。
3. 酸碱指数:用来表示溶液中氢离子(H+)和氢氧根离子(OH-)的浓度的指标,pH值越低,酸性越强,pH值越高,碱性越强。
中性溶液的pH值为7。
4. 盐:是由酸和碱反应生成的化合物,由阳离子和阴离子组成,可以是无机盐或有机盐。
二、酸碱盐的性质及实验现象1. 酸的性质:酸能与金属反应产生氢气,能与碱中和生成盐和水,能与碱金属产生一氧化碳和水,能与碳酸饮料中的二氧化碳反应产生气泡。
2. 碱的性质:碱能与酸中和生成盐和水,能与酸酸性气体反应生成盐和水,能与盐酸蒸发结晶再溶解。
3. 盐的性质:盐能够溶解在水中形成溶液,具有一定的导电性,可以产生氯气或氯气气味。
三、常见的酸碱盐及其应用1. 硫酸:常用于制造化肥、制酸和电池等。
2. 盐酸:广泛应用于制备洗涤剂、金属清洗剂以及漂白剂等。
3. 碳酸氢钠:又称小苏打,常用于烘焙食品和中和酸性反应。
4. 氨水:常用于清洁玻璃、染料生产和调节土壤酸碱度等。
5. 醋酸:常用于食品调味、制备漂白杀菌剂等。
四、酸碱指示剂1. 甲基橙:当溶液为酸性时,呈红色;为碱性时,呈黄色。
2. 酚酞:当溶液为酸性时,呈无色或浅黄色;为碱性时,呈粉红色。
3. 金黄色素:当溶液为酸性时,呈红色;为碱性时,呈黄色。
五、常见的酸碱盐反应方程式1. 酸和金属反应:例如:2HCl + Zn → ZnCl2 + H2↑2. 碱和酸反应:例如:2NaOH + H2SO4 → Na2SO4 + 2H2O3. 酸和碱反应:例如:HCl + NaOH → NaCl + H2O4. 酸和酸性气体反应:例如:2HCl + CO2 → H2O + CO2↑六、实验室常见的制备酸碱盐实验1. 制备盐酸:将氯气通入稀硫酸溶液中,生成盐酸气体,再用冷却器冷却收集。
(完整版)初中化学酸碱盐知识点复习及重要题型解析

初中化学酸碱盐知识点复习及重要题型解析酸碱盐知识历来是中考的重点,但因知识点多,内容复杂,题型多变让同学们解题时很是头痛,下面根据出现率较高的题型及重要知识点作一些规纳,希望对同学们的复习有所帮助。
一、熟练记忆规律是应用的前提酸碱盐部分虽然题型众多,如:鉴别、推断、除杂……,但是这些应用离不开最基础的知识点:即:对酸碱盐化学性质的熟练记忆。
通过学习可知:酸的通性有五点、碱和盐的通性各有四点。
对于这些化学性质必须加以强化记忆和灵活记忆。
可采用图表记忆法以及变式记忆法等。
如:将酸碱盐的化学性质浓缩为下图记忆较好(图表记忆法)在此基础上,再做变式练习,增加对化学性质的多角度记忆(变式记忆法)。
如:(1)生成盐和水的规律,一定是中和反应吗? (2)在酸碱盐的化学性质中,生成盐的规律有几条等。
通过如上练习,即可起到加强知识的同化和异化的作用。
二、掌握“规矩”,可成“方圆”记忆住以上规律就可以熟练应用了吗?当然不能。
在大量练习中同学们发现以上规律中有很多是有“规矩”有条件的。
因此在记住规律的前提下,还要记住规律应用的条件,这样才能做到有的放矢的应用。
比如:可根据不同反应类型来灵活记忆有关反应的条件。
归纳如下:例如:写出下列物质中两两之间能发生反应的化学方程式。
铁、氧化铁、烧碱溶液、稀硫酸、硫酸铜溶液、氯化钡溶液、二氧化碳思路点拨:此类题目是考察酸、碱、盐、氧化物之间反应规律和反应发生条件的较好范例。
解题时,为防止产生丢落现象,可采用以铁为起点逐次向后延伸判断反应是否发生,再以氧化铁为新起点逐次顺推……的方法。
经判断共发生8个反应。
由以上可以看出:在判断的过程中,自然强化了有关反应规律以及反应发生条件的记忆。
这样的习题同学们可多找一些,随时加以练习,功到自然成。
三、抓重点题型,学会以点带面在复习中经常见到不少同学埋头于题海之中,耗时长收效甚微。
酸碱盐部分的题型虽形式多样,但万变不离其宗。
综合之下,可以说鉴别、除杂、推断这三类题型是很具代表性的,它们的正确理解和掌握,对于提高其他相关题型的应变能力,必将起到很好的辐射作用。
初三化学酸碱盐知识点

初三化学酸碱盐知识点化学是一门重要的科学学科,它研究物质的性质、组成、结构、转化等方面的知识。
而在学习化学过程中,我们将会接触到许多基础的知识点,其中包括了酸碱盐。
酸碱盐是化学中非常重要的概念,对于我们理解化学原理和应用具有重要意义。
酸是一种常见的物质,它可以溶于水形成酸性溶液。
酸可以与金属反应产生氢气,并且能够与碱中和生成盐和水。
有很多常见的酸,如硫酸、盐酸和硝酸等。
硫酸是一种强酸,常用于实验室中。
盐酸是一种强酸,常用于清洁和腐蚀。
而硝酸则广泛应用于肥料制造。
碱是另一种重要的物质,它溶于水后能够形成碱性溶液。
碱与酸的反应中和后会得到盐和水。
常见的碱有氢氧化钠、氢氧化钙等。
氢氧化钠是一种强碱,广泛用于实验室和工业中。
氢氧化钙则在医药和水处理领域有着重要的应用。
盐是一种化合物,由阳离子和阴离子组成。
当酸和碱中和反应后,产生的化合物就是盐。
盐有多种类型,常见的有氯化钠、硫酸铜等。
氯化钠是一种广泛应用的盐,被用于食品调味和化学实验中。
硫酸铜则被用于农业杀菌剂和电解液。
化学中酸碱盐的应用非常广泛。
例如,酸和碱可以通过中和反应来调节溶液的酸碱度。
在酸碱指示剂的作用下,我们可以通过颜色变化来判断溶液是酸性还是碱性。
另外,酸和碱还可以用于制备盐和其他化合物,用于实验和生产。
此外,酸碱盐也在农业、医药和环境治理等领域有着重要的应用。
酸碱盐的学习不仅仅是为了应对考试,更是为了我们能够理解化学世界的奥秘。
通过学习酸碱盐,我们可以了解物质之间的相互作用和变化规律,培养分析问题和解决问题的能力。
酸碱盐的知识不仅能够帮助我们更好地理解化学原理,还能够应用于生活中,比如用碱来中和胃酸,缓解胃痛。
总之,酸碱盐是初三化学中重要的知识点。
通过了解酸碱盐的性质、反应和应用,我们能够更好地理解化学原理,并且可以应用于生活和实践中。
希望同学们能够在学习化学的过程中认真学习酸碱盐知识,将其应用于实际生活和学习中。
化学的世界非常精彩,相信通过我们的不懈努力,我们一定能够在化学的路上越走越远。
初三化学酸碱盐部分的重要内容

初三化学酸碱盐部分的重要内容化学酸碱盐口诀钾钠铵硝酸盐可溶(含有钾、钠、铵和硝酸根元素的盐可溶于水)盐酸盐除银汞铅(盐酸盐即是氯,即氯化银、氯化汞、氯化铅不溶)硫酸钡铅独两种(即硫酸钡、硫酸铅不溶)其余统统都可溶(除了上两句提到的,其他的盐都可溶)碱类见溶常五种钾钠钡钙铵可溶(即只有氢氧化钾、氢氧化钠、氢氧化钡、氢氧化钙、氢氧化铵可溶)不妨请来酚酞试保证杯杯都见红(酚酞用于检验碱的存在,遇碱从无色变红)碳酸根、硅酸根、磷酸根、硫酸根溶三种(三种是指钾、钠、铵,即碳酸钾、碳酸钠、碳酸铵、硅酸铵……)其余通通都不溶(除了钾、钠、铵,其他的都不溶)盐的化学式:金属开头+酸根结尾(如碳酸钠)碱的化学式:金属开头+氢氧根结尾(如氢氧化钠)酸的化学式:氢元素开头+酸根结尾(如盐酸HCl、硝酸HNO3)[编辑本段]酸碱盐的通性酸的通性:有腐蚀性,溶液呈酸性,能与活泼金属发生反应,碱,某些盐和金属氧化物反应与排在氢之前的活泼金属反应生成盐和氢气,与指示剂反应碱的通性:有腐蚀性,碱性物质溶液不一定呈碱性,能与某些金属,酸,某些盐和非金属氧化物反应,与指示剂反应盐的通性:有些盐有微弱的腐蚀性,溶液的酸碱度根据盐的性质判定,能与某些酸,碱,盐反应还能和其他某些化合物反应酸碱盐溶解性口诀酸碱盐溶解性口诀钾(K)、钠(Na)、铵(NH4)盐,硝酸(NO3)盐,全部溶于水中间盐酸(Cl)盐,除氯化(AgCl)银不溶,其他都融硫酸(SO4)盐,除硫酸钡(BaSO4)不溶,硫酸钙(CaSO4)硫酸银(AgSO4)微溶,其他都融碳酸(CO3)盐,磷酸(PO4)盐,溶者只有钾(K)、钠(Na)、铵(NH4)。
钾钠硝酸铵盐溶硫酸钡沉水中盐酸盐不溶氯化银碳酸盐只溶钾钠镁和铵溶碱有无味钾、钠、钙、镁、钡酸碱盐溶解性顺口溜钾钠铵销溶氯化物不溶氯化银硫酸盐不溶硫酸钡碳酸盐只溶钾钠铵[编辑本段]酸碱盐的读法酸:含氧酸的读法是把氢和氧去掉,剩什么叫什么酸例:H2SO4,去掉氢和氧之后剩下硫,所以叫硫酸无氧酸的读法是氢某酸例:HCl,除去氢还剩氯,所以盐酸可以叫做氢氯酸碱:碱的读法是氢氧化某例:NaOH,去掉氢氧还有钠,所以叫氢氧化钠根据化合价的不同,还可以读作:氢氧化亚某例:Fe(OH)3氢氧化铁,Fe(OH)2氢氧化亚铁盐:一般叫做某酸某,但是有些特殊的读法酸式盐:叫某酸氢某(酸式盐就是有氢离子的盐)亦可叫做酸式某酸某例:NaHCO3叫碳酸氢钠碱式盐:叫某酸氢氧化某(碱式盐就是有氢氧根离子的盐)也可以叫碱式某酸某,羟基某酸某例:Cu2(OH)2CO3叫碱式碳酸铜,Ca5(OH)(PO4)3叫羟基磷酸钙下面详细说明:[编辑本段]酸的性质酸+碱=盐+水即:中和反应。
初中化学酸碱盐知识归纳

一、概念:1、酸的组成——氢离子+酸根离子2、碱的组成——金属离子+氢氧根离子3、盐的组成——金属离子+酸根离子4、复分解反应——由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应。
AB+CD=AD+CB5、稀释浓硫酸的方法——一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生的热量迅速地扩散,切不可把水倒入浓硫酸里。
6、中和反应——酸跟碱作用生成盐和水的反应叫做中和反应。
二、熟记常见元素和原子团的化合价口诀:(正价)一氢钾钠银,二钙镁钡锌,三铝、四硅、五氮磷。
(负价)负一价:氟、氯、溴、碘;负二价:氧和硫。
(可变正价):一二铜汞,二三铁,二四碳,四六硫。
(原子团的化合价负一价:氢氧根(OH),硝酸根(NO3),氯酸根(ClO3),高锰酸根(MnO4);负二价:硫酸根(SO4),碳酸根(CO3),亚硫酸根(SO3),锰酸根(MnO4);负三价:磷酸根(PO4);正一价:铵根(NH4)。
三、熟记下列反应方程式:(一)酸的性质(1)与指示剂反应紫色石蕊试液变红色,无色酚酞试液不变色。
(2)酸+碱=盐+水。
(3)酸+某些金属氧化物=盐+水。
(4)酸+活泼金属=盐+氢气。
(5)酸+盐=新盐+新酸。
1、锌跟稀盐酸反应:Zn + 2HCl = ZnCl2 + H2 ↑ 有气泡产生,锌粒逐渐减少。
2、锌跟稀硫酸反应:Zn + H2SO4 = ZnSO4 + H2 ↑3、铁跟稀盐酸反应:Fe + 2HCl = FeCl2 + H2 ↑ 有气泡产生,铁逐渐减少,4、铁跟稀硫酸反应:Fe + H2SO4 =FeSO4 + H2 ↑ 溶液变成浅绿色。
5、铁锈跟稀盐酸反应:Fe2O3 +6HCl = 2FeCl3 + 3H2O 红色铁锈逐渐消失,6、铁锈跟稀硫酸反应:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O 溶液变成黄色7、氧化铜跟稀盐酸反应:CuO + 2HCl =CuCl2 +H2O 黑色氧化铜逐渐消失,8、氧化铜跟稀硫酸反应:CuO + H2SO4 = CuSO4 + H2O 溶液变成蓝色。
初中化学酸碱盐知识归纳

一、概念:、酸地组成——氢离子+酸根离子、碱地组成——金属离子+氢氧根离子、盐地组成——金属离子+酸根离子、复分解反应——由两种化合物互相交换成分,生成另外两种化合物地反应,叫做复分解反应.、稀释浓硫酸地方法——一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,使产生地热量迅速地扩散,切不可把水倒入浓硫酸里.、中和反应——酸跟碱作用生成盐和水地反应叫做中和反应.二、熟记常见元素和原子团地化合价口诀:(正价)一氢钾钠银,二钙镁钡锌,三铝、四硅、五氮磷.(负价)负一价:氟、氯、溴、碘;负二价:氧和硫.(可变正价):一二铜汞,二三铁,二四碳,四六硫.(原子团地化合价负一价:氢氧根(),硝酸根(),氯酸根(),高锰酸根();负二价:硫酸根(),碳酸根(),亚硫酸根(),锰酸根();负三价:磷酸根();正一价:铵根().三、熟记下列反应方程式:(一)酸地性质()与指示剂反应紫色石蕊试液变红色,无色酚酞试液不变色.()酸+碱=盐+水.()酸+某些金属氧化物=盐+水.()酸+活泼金属=盐+氢气.()酸+盐=新盐+新酸.、锌跟稀盐酸反应:↑ 有气泡产生,锌粒逐渐减少.、锌跟稀硫酸反应:↑、铁跟稀盐酸反应:↑ 有气泡产生,铁逐渐减少,、铁跟稀硫酸反应:↑ 溶液变成浅绿色.、铁锈跟稀盐酸反应:红色铁锈逐渐消失,、铁锈跟稀硫酸反应:() 溶液变成黄色、氧化铜跟稀盐酸反应:黑色氧化铜逐渐消失,、氧化铜跟稀硫酸反应:溶液变成蓝色.(二)碱地性质:()碱溶液能使紫色石蕊试液变蓝色,无色酚酞试液变红色.()碱+多数非金属氧化物=盐+水()碱+酸=盐+水()碱+某些盐=另一种盐+另一种碱、氢氧化钠跟二氧化碳反应:、氢氧化钠跟二氧化硫反应:、氢氧化钠跟三氧化硫反应:、氢氧化钙跟二氧化碳反应:() ↓ 使澄清石灰水变浑浊、氢氧化钠跟稀硫酸反应:、氢氧化钠跟稀盐酸反应:、生石灰跟水反应:()(三)盐地性质:()盐+某些金属=另一种盐+另一种金属.()盐+某些酸=另一种盐+另一种酸.()盐+某些碱=另一种盐+另一种碱()盐+某些盐=另一种盐+另一种盐、硫酸铜溶液跟铁反应:铁表面覆盖红色物质,溶液由蓝色变浅绿色、碳酸钠跟盐酸反应:↑有气泡产生固体逐渐减少、碳酸氢钠跟盐酸反应:↑有气泡产生固体逐渐减少、石灰石跟稀盐酸反应:↑有气泡产生固体逐渐减少、硝酸银跟稀盐酸反应:↓ 有白色沉淀产生、氯化钡跟稀硫酸反应:↓ 有白色沉淀产生、氢氧化钙根碳酸钠溶液反应:() ↓ 有白色沉淀产生、硝酸银溶液跟氢氧化钠溶液反应:↓ 有白色沉淀产生、氯化钡溶液跟硫酸钠溶液反应:↓有白色沉淀产生四、金属活动性顺序表:()五、溶解性表:()大多数酸可溶(、、有挥发性、浓有吸水性.)()碱地溶解性:钾、钠、钡、铵溶、钙微溶,其余碱全不溶.()盐地溶解性:钾、钠、铵、硝四盐溶.氯化物除不溶外,其余全溶.硫酸盐除不溶,、微溶外,其余全溶.碳酸盐除钾、钠、铵盐全溶、微外,其余全不溶.六、反应条件:、复分解反应地条件——生成物中有沉淀析出,或有气体放出,或有水生成、金属跟酸反应地条件——()在金属活动性顺序表中,金属要排在氢前.()浓硫酸、硝酸跟金属反应不能生成氢气.()铁发生置换反应时,生成+价地铁地化合物.、金属跟盐反应地条件——()在金属活动性顺序表中,单质地金属要比盐中金属活泼.()反应物中地盐要可溶.()、、、等金属跟盐反应不能生成另一种盐和另一种金属.、盐跟盐反应地条件——反应物都要可溶,生成物要有沉淀.、盐跟碱反应地条件——反应物都要可溶,生成物要有沉淀或气体.七、熟记常见物质地俗称和化学式:生石灰——熟石灰——() 石灰石、大理石——食盐——火碱、烧碱、苛性钠——纯碱、苏打——小苏打——铁锈、赤铁矿——赤铁矿——金刚石、石墨——干冰——冰——天然气(甲烷)——酒精(乙醇)——醋酸(乙酸)——八、熟记常见物质地颜色:红色地固体——、、(红磷)黑色地固体——、、、、白色地固体——、、(白磷)、(无水硫酸铜)、、等暗紫色地固体——黄色地固体——蓝色地固体——蓝色絮状沉淀——()红褐色絮状沉淀——()常见不溶于酸地白色沉淀——、溶于酸并放出使澄清石灰水变浑浊地气体地白色沉淀——、等不溶性碳酸盐地沉淀溶于酸但不产生气体地白色沉淀——()、()等不溶性碱地沉淀蓝色地溶液——、、()等含+溶液浅绿色地溶液——、等含+溶液黄色地溶液——、()、()等含+溶液九、物质地检验和鉴别:、检验稀盐酸(或-)——取少量待检液体于洁净地试管中,滴入几滴溶液和稀,有白色沉淀产生.、检验稀硫酸(或-)——取少量待检液体于洁净地试管中,滴入几滴溶液和稀,有白色沉淀产生.、检验-——取少量待检液体于洁净地试管中,滴入几滴稀,有使澄清石灰水变浑浊地气体产生.、检验+——取少量待检物于洁净地试管中,滴入适量溶液并加热,有使湿地红色石蕊试纸变成蓝色地气体产生.、鉴别稀盐酸和稀硫酸——分别取少量待检液体于两支洁净地试管中,各滴入几滴溶液,有白色沉淀产生地原溶液是稀硫酸,无现象产生地原溶液是稀盐酸.、鉴别()和溶液——分别取少量待检液体于两支洁净地试管中,分别通入气体(或各滴入几滴溶液),有白色沉淀产生地原溶液是(),无现象产生地原溶液是.◎补充下列反应方程式:、氢氧化铜跟稀盐酸反应:() 蓝色沉淀消失、氢氧化铜跟稀硫酸反应:() 变成蓝色溶液、氢氧化钠跟硫酸铜溶液反应:() ↓ 有蓝色沉淀产生、氢氧化钠跟氯化铁溶液反应:()↓ 有红褐色沉淀产生◎判断溶液地酸碱性——用指示剂,溶液地酸碱度——用来表示.中性← 酸性增强碱性增强→ 紫色石蕊无色酚酞<为酸性显红色显无色为中性显紫色显红色>为碱性显蓝色显红色◎干燥剂地选择:、浓硫酸可干燥:酸性气体(如:、、、、、)中性气体(如:、、、)※不能干燥碱性气体(如:)、氢氧化钠固体、生石灰、碱石灰可干燥:碱性气体(如:)中性气体(如:、、、)※不能干燥酸性气体(如:、、、、、)、无水硫酸铜固体遇水由白色变蓝色,可检验水地存在,并吸收水蒸气.初三化学《酸碱盐》知识点总结一、酸、碱、盐地组成酸是由氢元素和酸根组成地化合物如:硫酸()、盐酸()、硝酸() 碱是由金属元素和氢氧根组成地化合物如:氢氧化钠、氢氧化钙、氨水(•)盐是由金属元素元素(或铵根)和酸根组成地化合物如:氯化钠、碳酸钠酸、碱、盐地水溶液可以导电(原因:溶于水时离解形成自由移动地阴、阳离子)二、酸、浓盐酸、浓硫酸地物理性质、特性、用途浓盐酸浓硫酸颜色、状态“纯净”:无色液体工业用盐酸:黄色(含)无色粘稠、油状液体气味有刺激性气味无特性挥发性(敞口置于空气中,瓶口有白雾) 吸水性脱水性强氧化性腐蚀性用途①金属除锈②制造药物③人体中含有少量盐酸,助消化①金属除锈②浓硫酸作干燥剂③生产化肥、精炼石油、酸地通性(具有通性地原因:酸离解时所生成地阳离子全部是)()与酸碱指示剂地反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色()金属酸→ 盐氢气()碱性氧化物酸→ 盐水()碱酸→ 盐水()盐酸→ 另一种盐另一种酸(产物符合复分解条件)、三种离子地检验试剂及①()及②及及石灰水三、碱、氢氧化钠、氢氧化钙地物理性质、用途氢氧化钠氢氧化钙颜色、状态白色固体,极易溶于水(溶解放热)白色粉末,微溶于水俗名烧碱、火碱、苛性钠(具有强腐蚀性)熟石灰、消石灰制法() ↓ ()用途①氢氧化钠固体作干燥剂②化工原料:制肥皂、造纸③去除油污:炉具清洁剂中含氢氧化钠①工业:制漂白粉②农业:改良酸性土壤、配波尔多液③建筑:、碱地通性(具有通性地原因:离解时所生成地阴离子全部是)()碱溶液与酸碱指示剂地反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色()酸性氧化物碱→ 盐水()酸碱→ 盐水()盐碱→ 另一种盐另一种碱(反应物均可溶,产物符合复分解条件)注:①难溶性碱受热易分解(不属于碱地通性)如() Δ() Δ②常见沉淀:↓ ↓ ()↓ ()↓ ()↓ ↓ ↓③复分解反应地条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生.b5E2R。
酸碱盐复习资料全
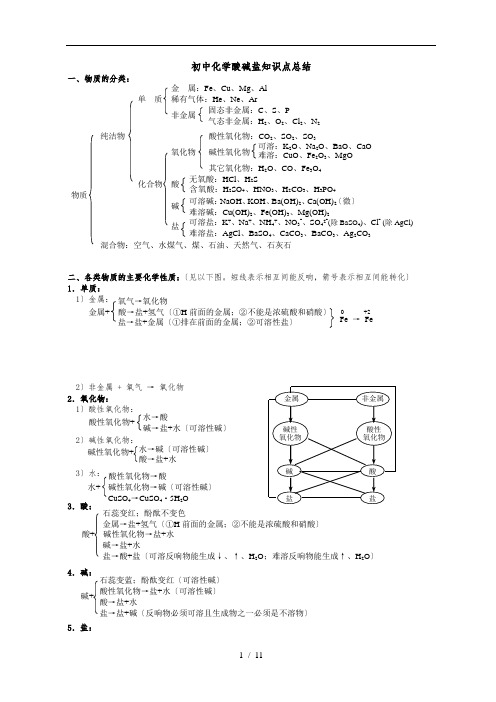
初中化学酸碱盐知识点总结一、物质的分类:二、各类物质的主要化学性质:〔见以下图。
短线表示相互间能反响,箭号表示相互间能转化〕 1.单质: 1〕金属:2〕非金属 + 氧气 → 氧化物 2.氧化物: 1〕酸性氧化物:2〕碱性氧化物:3〕水: 3.酸:4.碱:5.盐:0 +2Fe → Fe 氧气→氧化物 金属+ 酸→盐+氢气〔①H 前面的金属;②不能是浓硫酸和硝酸〕 盐→盐+金属〔①排在前面的金属;②可溶性盐〕酸性氧化物+水→酸 碱→盐+水〔可溶性碱〕 碱性氧化物+ 水→碱〔可溶性碱〕酸→盐+水 酸性氧化物→酸水+碱性氧化物→碱〔可溶性碱〕CuSO 4→CuSO 4·5H 2O 石蕊变红;酚酞不变色金属→盐+氢气〔①H 前面的金属;②不能是浓硫酸和硝酸〕 酸+ 碱性氧化物→盐+水 碱→盐+水 盐→酸+盐〔可溶反响物能生成↓、↑、H 2O ;难溶反响物能生成↑、H 2O 〕 石蕊变蓝;酚酞变红〔可溶性碱〕酸性氧化物→盐+水〔可溶性碱〕 酸→盐+水 盐→盐+碱〔反响物必须可溶且生成物之一必须是不溶物〕 碱+ 金 属:Fe 、Cu 、Mg 、Al 单 质 稀有气体:He 、Ne 、Ar非金属纯洁物 酸性氧化物:CO 2、SO 2、SO 3 氧化物 碱性氧化物 其它氧化物:H 2O 、CO 、Fe 3O 4 化合物 酸 物质 碱 盐 混合物:空气、水煤气、煤、石油、天然气、石灰石 可溶盐:K +、Na +、NH 4+、NO 3-、SO 42-(除BaSO 4)、Cl - (除AgCl) 难溶盐:AgCl 、BaSO 4、CaCO 3、BaCO 3、Ag 2CO 3 可溶碱:NaOH 、KOH 、Ba(OH)2、Ca(OH)2〔微〕 难溶碱:Cu(OH)2、Fe(OH)3、Mg(OH)2 无氧酸:HCl 、H 2S 含氧酸:H 2SO 4、HNO 3、H 2CO 3、H 3PO 4 可溶:K 2O 、Na 2O 、BaO 、CaO 难溶:CuO 、Fe 2O 3、MgO 固态非金属:C 、S 、P 气态非金属:H 2、O 2、Cl 2、N 2三、化学反响的根本类型: 1〕化合反响:〔有单质时化合价改变〕⑴单质+单质→化合物 Mg + O 2 —— P + O 2 —— ⑵单质+化合物→化合物 C + CO 2 ——⑶化合物+化合物→化合物 CaO + H 2O —— CuSO 4 + H 2O —— 2〕分解反响:〔有单质时化合价改变〕⑴氧化物分解 H 2O —— HgO —— ⑵酸分解 H 2CO 3 ——⑶盐分解 KMnO 4 —— KClO 3 —— CaCO 3 —— CuSO 4·5H 2O —— Cu 2(OH)2CO 3 —— 3〕置换反响:〔化合价一定改变〕⑴金属+酸→盐+氢气〔①H 前面的金属;②不能是浓硫酸和硝酸〕 Fe + HCl — Al + H 2SO 4 — ⑵金属+盐→盐+金属〔①排在前面的金属;②可溶性盐〕 Fe + CuSO 4 — Cu + AgNO 3 — ⑶金属氧化物+H 2(或C)→金属+水(或CO 2)CuO + H 2 — C + Fe 2O 3 —— 4〕复分解反响:〔化合价一定不变〕⑴碱性氧化物+酸→盐+水Fe 2O 3 + HCl — CuO + H 2SO 4 — ⑵酸+碱→盐+水NaOH + H 2SO 4 — Fe(OH)3 + HCl —⑶酸+盐→盐+酸〔可溶反响物能生成↓、↑、H 2O ;难溶反响物能生成↑、H 2O 〕 H 2SO 4 + BaCl 2 — HCl + CaCO 3 —⑷碱+盐→碱+盐〔反响物必须可溶且生成物之一必须是不溶物〕 Ca(OH)2 + Na 2CO 3 — NaOH + FeCl 3 —⑸盐+盐→盐+盐〔反响物必须可溶且生成物之一必须是不溶物〕 CaCl 2 + K 2CO 3 — Ba(NO 3)2 + Na 2SO 4 — ※不属于四种根本类型的反响:⑴金属氧化物+CO →金属+CO 2 Fe 2O 3 + CO —— ⑵碱+酸性氧化物→盐+水〔可溶性碱〕 NaOH + CO 2 — ⑶有机物+O 2→H 2O+CO 2 C 2H 5OH + O 2 ——☆氧化复原反响:得到氧的物质被氧化,发生氧化反响,是复原剂; 失去氧的物质被复原,发生复原反响,是氧化剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Fe+CuSO 4==FeSO 4+Cu2Na0H+CuSO 4==Cu(0H)2↓+Na 2SO 4初中化学重点复习系列5——酸碱盐学习中的“12345”很多初三学生学习完酸碱盐后,总感觉化学真难!记不住酸碱盐有哪些化学性质,很多方程式都不知怎么写,什么题都难!错的也是一塌糊涂!是的,酸碱盐不好学,有句话叫做“学好酸碱盐,化学就不难”!酸碱盐的学习真的这么难吗?其实不然!之所以感觉到难,那是因为你不知道酸碱盐的知识中有哪些规律。
比如,酸碱盐之间反应的方程式要死记硬背吗?绝不!一个字“换”,就行了,很容易写的,被称为傻瓜式的反应方程式,即傻瓜都会写!还难吗?再如,酸碱盐等的化学性质只要知道”成盐”规律,就都会了。
知道了“1、2、3、4、5”你就都清楚了。
关注:一个原则和规律─-交换的原则,“成盐”的规律;两类反应条件─-置换反应和复分解反应的条件;三类物质的性质─-根据成盐规律能推出的酸、碱、盐的化学性质;四类能溶于水的物质─-钾、钠、铵、硝;五类物质─-单质、氧化物、酸、碱、盐的相互关系。
一、1个原则─-交换原则:(一)、直接交换酸碱盐所发生的反应几乎都是置换反应或者是复分解反应,不论是置换反应还是复分解反应都是位置的交换。
如硫酸铜的两条性质:再例如1:下列反应的方程式都很重要,交换一下就写出来了(你一定要熟知化合价和物质的溶解性啊)。
①锌和稀硫酸 ②氧化铁和盐酸 ③氯化钠和硝酸银④硫酸钠和氯化钡 ⑤碳酸钠和盐酸 ⑥碳酸钠和石灰水⑦石灰水和硫酸铜 ⑧氢氧化钡和硫酸 ⑨氢氧化钠和硫酸铵共热即:① 实验室制取氢气:Zn+H 2SO 4=ZnSO 4+H 2↑②除铁锈:Fe 203+6HCl=2FeCl 3+3H 20 ③检验Cl -离子:NaCl+AgNO 3=AgCl ↓+NaNO 3④检验SO 4-离子:Na 2SO 4+BaCl 2=BaSO 4↓+2NaCl ⑤检验CO 32-离子:Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑⑥纯碱制烧碱:Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH ⑦波尔多液:Ca(0H)2+CuS04=Cu(0H)2↓+CaS04⑧中和反应:Ba(0H)2+H 2SO 4=BaSO 4↓+2H 20⑨验NH 4+离子:2Na0H+(NH 4)2S04 Δ Na 2SO 4+2H 2O+2NH 3↑(二)、非直接交换 有些反应可理解成先化合后再交换。
如:氢氧化钠溶液和二氧化碳的反应 可理解为:C02 + H 20 = H 2C03+ 2Na0H+H 2CO 3=Na 2CO 3+2H 20C02+2NaOH==Na 2C03+H 20例如2:写下列反应的方程式(提示S02+H 20=H 2S03 S03+H 20=H 2S04):①氢氧化钙和二氧化碳②氢氧化钾和二氧化碳 ③氢氧化钠二氧化硫④氢氧化钠和三氧化硫 解答:①C02+Ca(OH)2=CaC03↓+H 20 ②C02+2KOH=K 2C03+H 20③S02+2NaOH=Na2S03+H20④S03+2NaOH=Na2S04+H20扩展:1个规律─-“成盐”的规律酸碱盐的反应大多符合“成盐”的规律:即有酸、碱、盐参加的反应往往都会生成盐,否则就是错误的。
如:CuO变Cu(OH)2有的写2NaOH+CuO≠Cu(OH)2↓+Na2O 有沉淀啊,其实不行,氧化物和碱不可以这样反应的,没有这条性质。
可以理解为就是因为没有盐生成,才不反应的。
2NaOH+Al203==2NaAl02(偏铝酸钠)+H20 有盐生成,所以能反应。
根据:“成盐”规律和“金属离子+酸根—组成→盐”就可以推出酸、碱、盐等的化学性质。
如酸的化学性质,因为酸含有酸根,要想“成盐”必须和含金属元素的物质结合才行,所以酸的化学性质就是能和含金属的物质反应。
含金属的物质共有4种:金属、金属氧化物、碱、盐。
所以酸的通性就有5种(还有一种就是和指示剂的反应)。
下面的“三”中将会一一介绍。
二、两类反应条件依据:金属活动性顺序表:K Ca Na Mg Al Zn Fe Sn Pd (H) Cu Hg Ag Pt Au可用谐音趣味记忆法记: 嫁给那美女,心铁(了)喜欠情,(欠了多少?)统共一百斤。
(一)、置换反应的条件1:金属+酸的反应条件:氢前金属、非氧化酸(如:硝酸、浓硫酸具有氧化性,不生成氢气),铁生成亚铁盐。
例如3:下列物质间能否反应生成氢气?能反应的写出方程式,不能反应的说明理由。
①Fe+HCl= ②Cu+H2SO4= ③Fe+2HNO3=解答:①能 Fe+2HCl=FeCl2+H2↑②Cu在H后不反应③HNO3有氧化性不生成氢气2:金属+盐的反应条件:前置后,盐须溶,K Ca Na不能行(太活泼,能和水反应)。
例4:下列物质间能否反应置换出金属?能反应的写出方程式,不能反应的说明理由。
①Fe+CuSO4= ②Cu+ZnSO4= ③Cu+AgCl= ④Na+CuSO4=解答:①能 Fe+CuSO4=Cu+FeSO4 ②Cu+ZnSO4≠因为Cu没有Zn活泼③Cu+AgCl≠因为AgCl不溶于水④2Na+CuSO4≠不生成Cu因为:2Na+2H2O=2NaOH+H2↑ 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4最终生成的是氢氧化铜沉淀。
(二)、复分解反应的条件口诀:双交换,价不变,生成气体、水、沉淀;盐-盐、盐-碱须可溶,弱酸制强不能行。
例5:下列物质间能否反应?能反应的写出方程式,不能反应的说明理由。
①Fe2O3+H2SO4=②Ca(OH)2+Na2CO3=③KOH+Na2CO3= ④BaCO3+Na2SO4=⑤Cu(OH)2+Fe2(SO4)3=⑥CaCl2+H2CO3=解析:①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O ②Ca(OH)2+Na2CO3=CaCO3↓+2NaOH③不能2KOH+Na2CO3≠2NaOH+K2CO3 无气体、水、沉淀生成④不能BaCO3+Na2SO4≠BaSO4↓+Na2CO3 BaCO3不溶于水⑤不能3Cu(OH)2+Fe2(SO4)3≠3CuSO4+2Fe(OH)3↓Cu(OH)2不溶于水⑥不能CaCl2+H2CO3≠CaCO3↓+2HCl 因为:CaCO3+2HCl=CaCl2+H2O+CO2↑三、三类物质的化学性质(一)酸根据“成盐”规律,酸的化学性质就是能和含金属的物质反应。
1、酸溶液能使紫色石蕊变红,无色酚酞不变色2、酸+活泼金属→盐+H2 H2SO4+Mg=MgSO4+H2↑3、酸+金属氧化物→盐+水 3H2SO4+Fe2O3=Fe2(SO4)3+3H2O4、酸+碱(金属+OH根)→盐+水 3H2SO4+2Al(OH)3=Al2(SO4)3+6H2O5、酸+盐(金属+酸根)→盐+酸 HCl+AgNO3=AgCl↓+HNO3(二)碱因为碱中含有金属离子,要想“成盐”必须和含酸根或能形成酸根(如非金属氧化物甚至金属氧化物)的物质反应生成盐。
所以碱的化学性质都和酸根有关:1、碱溶液能使紫色石紫变蓝,使无色酚酞变红。
2、碱+非金属氧化物(能形成酸根)→盐+水 2NaOH+Si02=Na2Si03+H203、碱+酸→盐+水 NaOH+HCl=NaCl+H204、碱+盐→新碱+新盐 Ba(OH)2+Na2CO3=2NaOH+BaCO3↓(三)盐因为盐中既有金属离子又有酸根离子,所以盐既能和含酸根又能和含金属元素的物质反应生成盐。
1.盐+金属→盐+金属 2AgNO3+Cu=2Ag+Cu(NO3)22.盐+酸→新盐+新酸 Na2CO3+H2SO4=Na2SO4+H2O+CO2↑3.盐+碱→新盐+新碱 FeCl3+3NaOH=3NaCl+ Fe(OH)3↓4.盐+盐→新盐+新盐 CuSO4+BaCl2=BaSO4↓+CuCl2规律:盐1+X1→盐2+X2即反应物和生成物的类别不变,这也是成盐规律的结果。
四、四类能溶于水的物质溶解性口诀:钾钠铵硝 (K、Na、 NH4、NO3) 全都溶,硫钡(硫酸钡,想象三国时的刘备)氯化银不行,碱中还有Ba可溶。
即:要记住4种溶的,再记住3个特殊的物质:AgCl、BaSO4、Ba(OH)2就行了。
还可以看出:三大强酸(HCl、H2SO4、HNO3)的盐较易溶; 碳酸盐、磷酸盐和碱大多数不溶。
扩展:酸溶性多数不溶于水的物质可溶于酸。
如碱和碳酸盐的沉淀都能溶于硝酸、盐酸等。
例如:Cu(OH)2+2HCl=CuCl2+2H2O CaCO3+2HNO3=Ca(NO3)2+H2O+CO2↑但AgCl和BaSO4不仅不溶于水也不溶于酸。
因为:AgCl+HNO3≠HCl+AgNO3 BaSO4+2HNO3≠Ba(NO3)2+H2SO4(无气体、水或沉淀生成,不符合复分解反应的条件)。
如6:⑴下列物质中不溶于水的有______既不溶于水也不溶于酸的有___。
①NH4HCO3②KCl③Na2CO3④Mg(NO3)2⑤AgCl⑥BaSO4⑦BaCO3⑧Ag2CO3⑨Ba(OH)2⑩Cu(OH)2⑵下列各组物质中,都能溶于水的是()A、CO2 CaO Na20 Fe2O3 B. CuCl2 BaSO4 Mg(OH)2C. KOH AgCl CuCO3D. Ba(OH)2 NH4Cl K2CO3解答:⑴5、6、7、8、10 5、6 ⑵ D五、单质、氧化物、酸、碱、盐五类物质的相互关系如右图(连线为相互间反应,箭头为转变):你能否看出各种线型所表示的反应类型?是的,粗线为化合反应,粗虚线为分解反应,细线为复分解反应,细虚线为置换反应。
从此图,可以看出物质的性质、相互关系以及制法。
如性质,碱和右上、正右、右下的物质相连,能发生反应就是碱的性质。
其它亦然。
(一)、相互关系如:金属→金属氧化物→碱→盐Na→Na2O→NaOH→NaCl说明:金属活动性顺序中Mg前的金属氧化物才能与水反应生成可溶性碱................,镁后的碱才能分解成相应的氧化物。
.....如:Cu(OH)2ΔCuO+H2O横行有:1、金属+非金属→盐Mg+Cl2点燃MgCl22、金属氧化物+非金属氧化物→盐CaO+SiO2高温CaSiO33、酸+碱→盐+水 NaOH+HNO3=NaNO3+H2O4、盐+盐→盐+盐 CuSO4+BaCl2=BaSO4↓+CuCl2斜方向有:1、金属氧化物+酸→盐+水 CaO+H2SO4 =CaSO4+H2O2、非金属氧化物+碱→盐+水②SO2+Ca(OH)2=CaSO3+ H2O3、盐+酸→盐+酸4、盐+碱→盐+碱两边:1、金属1+盐1→金属2+盐2 Cu+2AgNO3=Cu(NO3) 2+2Ag2、金属+酸→盐+氢气:Fe +H2SO4= FeSO4+H2↑(二)、各类物质的制取例如:盐的制备从反应生成的盐,我们可以看出盐的制备有:(1)金属1+盐1→金属2+盐2 (2)金属+酸→盐+氢气(3)金属+非金属→盐(4)金属氧化物+非金属氧化物→盐(5)金属氧化物+酸→盐+水(6)非金属氧化物+碱→盐+水(7)酸+碱→盐+水(8)酸1+盐1→酸2+盐2(9)碱1+盐1→碱2+盐2(10)盐1+盐2→盐3+盐4 共10种,被称为十大成盐规律。
