高中化学竞赛题 格氏试剂
高中化学竞赛试题(10份).pdf

9-2 若把聚乙炔分子看成一维晶体,指出该晶体的结构基元。 9-3 简述该聚乙炔塑料的分子结构特点。 9-4 假设有一种聚乙炔由 9 个乙炔分子聚合而成,聚乙炔分子中碳–碳平均键长为 140pm。若将上述线型聚乙炔分子头尾连接起来,形成一个大环轮烯分子,请画出该分子的 结构。 9-5 如果 3 个乙炔分子聚合,可得到什么物质。并比较与由 9 个乙炔分子聚合而成的 大环轮烯分子在结构上有什么共同之处。
第 4 题(12 分)据《中国制药》报道,化合物 F 是用于制备抗“非典”药品(盐酸祛
炎痛)的中间产物,其合成路线为:
(A)
CH3
Cl2 hv ①
D
浓硫酸+浓硝酸
③
水浴/加热 ② B
④
C (E)
5-3 下面的研究有助于进一步揭示疏水效应和疏水作用的本质。芳香化合物在水中的
溶解度其实也不是很小,这取决于相互间的氢键作用,该氢键是因为什么而产生?
_________;Na+,K+ 等阳离子能与有些芳香化合物很好的互溶取决于
。
第 6 题(10 分)今有一金属卤化物 A,在水溶液中完全电离,生成一种阴离子和一种
学海无涯
5-1 有关相似相溶原则可以用热力学自由能的降低来理解。(△G<0;△G=△H-T △S,式中ΔH是焓变,代表降低体系的能量因素;ΔS是体系熵增的因素。在常温下(25° C),非极性溶质溶于水焓的变化(△H)通常较小,有时甚至是负的,似乎是有利于溶解的; 但实际上溶解度不大!请分析原因。
5-2 疏水基团之间的相互作用通常被认为是没有方向性的,但是最近对剑桥晶体结构 数据库(CSD)和蛋白质晶体结构数据库(PDB)的研究发现,疏水作用是有方向倾向性的。 请分析富电子的吲哚芳环与苯环、缺电子的恶唑环与苯环的可能接触方式,画出示意图。
格氏试剂化学结构式

格氏试剂化学结构式格氏试剂(Grignard reagent)是由法国化学家弗朗索瓦·奥古斯特·维克多·格氏(François Auguste Victor Grignard)于1900年发现的一类强碱性有机金属物质。
格氏试剂的化学结构式一般为RMgX,其中R代表有机基团,X代表卤素原子,如氯(Cl)、溴(Br)或碘(I)。
它们通常以聚异丙基醚作为溶剂。
格氏试剂的制备一般通过镁与卤化有机物发生反应而得到。
反应通常在干燥的无氧环境中进行,以避免格氏试剂与水或氧气反应。
制备格氏试剂的过程可以用如下反应方程式表示:RMgX+Mg→R2Mg格氏试剂的化学性质非常活泼。
它们具有很强的亲电性,可以与许多电子不足或电子丰富的化合物发生反应。
格氏试剂常被用作有机合成中的重要试剂,可以用于合成醇、酮、醛和胺等化合物。
此外,格氏试剂还能与各种无定形碳氢化合物发生加成反应。
格氏试剂与酮或醛反应时,生成的是次级醇,而与醛反应则生成主要醇。
格氏试剂的反应机理中,有机金属物质(RMg)的亲核性起到关键作用。
有机金属物质中的金属碳键具有极低的电负性,因此可以很容易地攻击其他化合物中的亲电性中心,形成C-C键或C-X键。
格氏试剂的亲电性中心通常是相连的烃基碳原子上的处于负离子态的负电荷。
这种化学键的生成使得格氏试剂可以与其他化合物发生加成、取代和消除等一系列反应。
还有一种常见的格氏试剂是锂格氏试剂(lithium Grignard reagent)。
它与标准格氏试剂的区别在于,锂格氏试剂的金属基团由锂代替镁。
锂格氏试剂比标准格氏试剂更易制备,且反应速度更快。
它在合成一些特定化合物时具有一定的优势。
总之,格氏试剂的化学结构式为RMgX,其中R代表有机基团,X代表卤素原子。
格氏试剂在有机合成中发挥着重要的作用,其活泼的亲电性使它们能够与各种化合物发生反应,合成出多种有机化合物。
格氏试剂

中学化学竞赛试题资源库——格氏试剂A 组1.卤代烃(RX )与镁于室温下在干燥乙醚中反应,生成卤化烃基镁(RMgX ):RX +Mg RMgX这种产物叫“Grignard Reagent ”(格氏试剂)。
格氏试剂很活泼,能与许多物质发生反应。
与具有活性氢的化合物(HY )作用,生成相应的烃:RMgX +HY →RH +(Y =-OH 、-OR 、-X 、-NH 2、NHR 、-C ≡CH 等)它还能与具有羰基结构的化合物(醛、酮等)发生加成反应,产物水解成醇:基于V.Grignard 的这一巨大贡献,他曾获1912年诺贝尔化学奖。
2,3-二溴-3-乙基戊烷()是一个孪二卤代烷。
试以3-戊醇和乙醛为原料,通过利用格氏试剂合成之。
2.已知RX +Mg −−−→−无水乙醚RMgX2RMgX +R ’COOR ’’−−−→−无水乙醚−−−→−+H O H 、2请用乙炔为基本原料合成3-甲基-3-戊醇。
所用到的有机原料均由乙炔合成,无机原料自选。
B 组3.写出下列反应的方程式,并画出产物A ~H 的结构式。
4.卤代烃和金属镁在乙醚中反应生成烷基卤代镁(RMgX ),称为格林试剂,它是重要的有机合成试剂,可与羰基化合物反应制醇。
氧化 卤代烃(RX )与镁于室温下在干燥乙醚中反应,生成卤化烃基镁(RMgX ):RX +Mg RMgX这种产物叫“Grignard Reagent ”(格氏试剂)。
格氏试剂很活泼,能与许多物质发生反应。
与具有活性氢的化合物(HY )作用,生成相应的烃:RMgX +HY →RH +(Y =-OH 、-OR 、-X 、-NH 2、NHR 、-C ≡CH 等)它还能与具有羰基结构的化合物(醛、酮等)发生加成反应,产物水解成醇:基于V.Grignard 的这一巨大贡献,他曾获1912年诺贝尔化学奖。
现有乙烯和必要的无机原料合成3-甲基-3-戊醇,合成路线如下:请写出A ~H 物质的结构简式:5.已知①卤代烃RX (或-Br )可以和金属反应生成烃基金属有机化合物。
2020届高三化学选修五大题周练——格氏试剂在有机推断的运用【精编14题】

2020届届届届届届届届届届届届——届届届届届届届届届届届届届届届14届届1.格林尼亚试剂简称“格氏试剂”,是有机卤化物与金属镁在无水乙醚或四氢呋喃(THF)中反应制得,在有机合成中用途广泛。
反应原理如下:由A()合成I ()的流程图:注:NBS为溴化试剂,在一定条件下能与烯烃作用得到溴代烯烃。
(1)物质A的名称为______;由A 生成B 的反应类型是______。
(2)写出由A制备的化学方程式______。
(3)四氢呋喃是一种优良的溶剂,可由呋喃()加氢得到,则四氢呋喃的结构简式为______。
(4)写出由G生成H的化学方程式______。
(5)写出符合下列要求的Ⅰ的同分异构体的结构简式______ (写出一种即可,同一碳上不能连接2个羟基)。
①芳香族化合物②二元醇③分子中有5种化学环境的H(6)参照上述信息,以A和A制得的环已酮()为原料合成:______。
2.化合物A是分子式为C7H8O2的五元环状化合物,核磁共振氢谱有四组峰,且其峰面积之比为3∶1∶2∶2,有如图所示的转化:已知:①含羰基的化合物均能与格氏试剂发生如下反应:②两个羟基连在同一碳原子上极不稳定,易脱水:根据以上信息,回答下列问题:(1)写出化合物D中官能团的名称________。
(2)写出化合物B、F的结构简式________、________。
(3)A→B的反应类型是________。
(4)①写出D与CH4O反应的化学方程式_______________________________②写出F→G的化学方程式________________________________________。
(5)A的属于芳香族化合物的同分异构体有________种,写出符合下列条件的A的一种同分异构体W的结构简式________。
(不考虑立体异构)①含有两个取代基②苯环上的一氯代物只有两种③1mol W能与足量金属钠反应生成1mol H23.酯类化合物与格氏试剂(RMgX,X=Cl、Br、I)的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。
高中化学竞赛模拟试题(附答案)

全国化学初赛复习题 4综合训练命题人:竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
●允许使用非编程计算器以及直尺等文具。
第一题(17分)Cr及其化合物在现今工业上十分常用,Cr占地壳蹭的丰度为0.0083%,主要来源是铬铁矿、铬铅矿。
最初Cr的提炼是用铬铁矿与焦炭共热生产的。
1.写出铬铁矿、铬铅矿的化学式,写出铬铁矿与焦炭共热的反应方程式。
其水溶液可有三种不同的颜色,分2.Cr常见的价态为+3和+6,常见的Cr(Ⅲ)化合物为CrCl3别为紫色、蓝绿色和绿色,请分别画出这三种不同颜色的Cr(Ⅲ)化合物阳离子的立体结构。
指出Cr的杂化方式3.常见的Cr(Ⅵ)化合物是重铬酸钾,是由铬铁矿与碳酸钠混合在空气中煅烧后用水浸取过滤,然后加适量硫酸后加入氯化钾即可制得,写出涉及的反应方程式。
加热至冒烟来实现,写出反应方程式4.在钢铁分析中为排除Cr的干扰可加入NaCl和HClO4第二题(10分)(CN)2被称为拟卤素,其性质与卤素单质既有相似点,也有一些不同。
它可以由含有同一种元素的两种化合物一同制取得到。
1.写出制取(CN)2的反应方程式。
2.(CN)2不稳定,它在水溶液中有2种水解方式,其中一种是生成HCN与HOCN。
请分别写出(CN)2的两种水解反应的方程式。
3.HCN在加热时与O2反应,反应比为8:3,写出该反应方程式。
4.液态的HCN不稳定,易聚合。
其中,三聚体中包含有2种不同环境的C,2种不同环境的H与2种不同环境的N;而四聚体中H只有1种环境,C,N则各有2种不同环境。
试画出两种聚合体的结构,并分别标明它们中所具有的对称元素。
第三题(14分)SmCo5是一种典型的AB5型金属化合物,可作为磁性材料,其结构如下其中大球为Sm,小球为Co。
高中化学竞赛初赛模拟试卷 (3)

2008高中化学竞赛初赛模拟试卷(31第一题(7分以前不少的书上都把氢氧化亚锡写成 Sn(OH2,其实它是不存在的,真实存在的是水合氧化锡(Ⅱ 3SnO ·H 2O 。
经 X 射线结构测定,证明它是含有 Sn 6O 8的原子簇化合物, Sn 6O 8原子簇之间的排列由氢桥连接起来。
1. H 4Sn 6O 8是可以由氯化亚锡水解得到的一种原子簇合物。
请画出它的结构图。
2.写出 H 4Sn 6O 8分别与①过量 NaOH 、②浓盐酸、③硝酸反应的化学方程式。
第二题(5分血红蛋白中的血红朊是人体血红蛋白质载氧体,中心体为亚铁,载氧示意图如下:左边是基本构架的主体,枝节删去。
1.血红蛋白为什么能作为 O 2的载体?2. 当有 CO 与 O 2共存时, 只要有少量的 CO 就会出现中毒, CO 超过 5%就会有生命之忧。
运用结构观点加以说明。
3.其实你每时每刻呼吸进的主体气体是 N 2,为什么 N 2不占据 O 2的位置?4.亚铁化合物在空气中不稳定,易被氧化。
在人体内载氧体中的亚铁是直接与 O 2结合, 运送到各细胞组织中去,需要氧时在特定酶作用下,氧化解析。
没有氧化酶的参与,血红蛋白中的亚铁是不会被氧化的。
请你提出合理的解释。
第三题(6分近年来有一种高强度、可调温的复合材料, 它是用石墨化纤维与其他高聚物复合制成的,石墨化纤工业纤维组成式如右图:1.写出构成石墨化纤维的各种元素的简单原子个数比;2.某化工厂用两种简单化合物合成石墨化纤维,已知最后两步反应为高温环化和脱氢,脱氢率 2/3,失重率 1.90%。
请设计合成路线,写出反应物和中间产物。
第四题(7分分子式为 C 15H 15NO 的化合物 A ,不溶于水、稀盐酸和稀氢氧化钠溶液。
A 与氢氧化钠溶液一起回流时慢慢溶解,同时有油状物浮于液面,用水蒸气蒸馏法将油状产物蒸出。
B 能溶于盐酸, 与对甲苯磺酰氯作用, 生成不溶于碱的沉淀。
把去掉B 以后的溶液酸化, 析出化合物 C 。
高中化学竞赛,大学化学自招,卤代烃专题训练
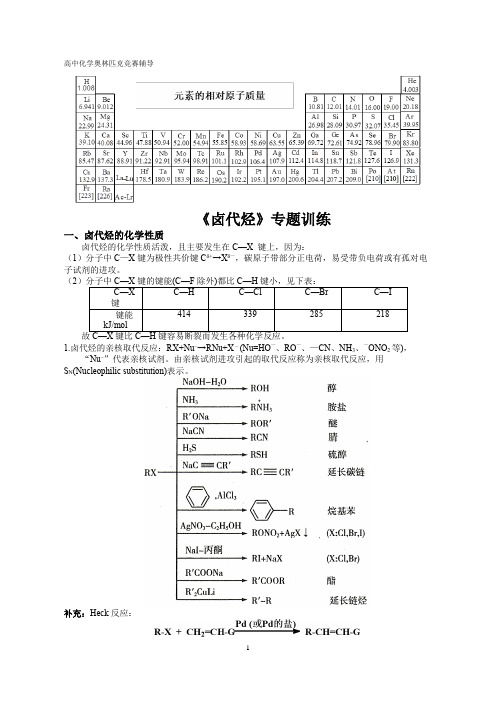
高中化学奥林匹克竞赛辅导《卤代烃》专题训练一、卤代烃的化学性质卤代烃的化学性质活泼,且主要发生在C—X 键上,因为:(1)分子中C—X键为极性共价键Cδ+→Xδ—,碳原子带部分正电荷,易受带负电荷或有孤对电子试剂的进攻。
(21.卤代烃的亲核取代反应:RX+Nu–→RNu+X – (Nu=HO—、RO—、—CN、NH3、—ONO2等),“Nu–”代表亲核试剂。
由亲核试剂进攻引起的取代反应称为亲核取代反应,用S N(Nucleophilic substitution)表示。
补充:Heck反应:2.卤代烃的消除反应:从分子中脱去一个简单小分子生成不饱和键的反应称为消除反应,用E(Elimination)表示。
卤代烃与NaOH(或KOH)的醇溶液作用时,脱去卤素与β碳原子上的氢原子而生成烯烃。
(1)消除反应的活性:3°RX>2°RX>1°RX。
(2)2°RX、3°RX脱卤化氢时,遵守扎依采夫(Saytzerff)规则(“氢少去氢”),即主要产物是生成双键碳上连接烃基最多的烯烃。
消除反应与取代反应在大多数情况下是同时进行的,互为竞争反应,哪种产物占优则与反应物结构和反应的条件有关。
一般来说,强碱、高温、弱极性溶剂有利于消去反应,所以卤代烃的消除反应在醇溶液中进行,而水解在水溶液中进行。
醇在卤代烃的消除反应中是作溶剂使用的。
因为卤代烃不溶于水,加入醇后,卤代烃能够溶解在乙醇中,同时碱也能溶解在醇中,这样就没有有机—无机两相液面了,消除反应速率会加快很多。
3.卤代烃与金属的反应:卤代烃能与某些金属发生反应,生成有机金属化合物(金属原子直接与碳原子相连接的化合物)。
(1)与金属镁的反应:格氏试剂的结构还不完全清楚,一般用RMgX表示。
乙醚的作用是与格氏试剂络合成稳定的溶剂化物,既是溶剂,又是稳定化剂,苯、四氢呋喃(THF)和其他醚类也可作为溶剂。
Cδ—←Mgδ+键是极性很强的键,C的电负性为2.5,Mg的电负性为1.2,所以格氏试剂非常活泼,能发生多种化学反应,如与含活泼氢的化合物反应:格氏试剂遇水分解,制备和使用格氏试剂时须用无水溶剂和干燥容器,达到无水无氧的环境。
高中化学竞赛题有机合成

中学化学竞赛试题资源库——有机合成A 组1.6-羰基庚酸是合成某些高分子材料和药物的重要中间体。
某试验室以溴代甲基环己烷为原料合成6-羰基庚酸。
请用合成反应流程图表示出最合理的合成方案(注明反应条件)提示:①合成过程中无机试剂任选,②如有须要,可以利用试卷中出现过的信息,③合成反应流程图表示方法示例如下:2.已知①卤代烃(或-)可以和金属反应生成烃基金属有机化合物。
后者又能和含羰基化合物反应生成醇:+()−−−→−OH C 252−−→−OCH 22−−−→−+H O H /22 ②有机酸和3反应可以得到羧酸的衍生物酰卤:③苯在3催化下能和卤代烃作用生成烃基苯:有机物A 、B 分子式均为C H O ,和钠反应放出氢气并均可经上述反应合成,但却又不能从羰基化合物干脆加氢还原得到。
A和硫酸并热可得到C和C’,而B得到D和D’。
C、D分子中全部碳原子均可共处于同一平面上,而C’和D’却不行。
请以最基础的石油产品(乙烯、丙烯、丙烷、苯等)并任选无机试剂为原料依下列路途合成B,并给出A、C’、D 的结构简式及下述指定结构简式。
合成B的路途:3.由指定原料及其他必要的无机及有机试剂会成下列化合物:(1)由丙烯合成甘油。
(2)由丙酮合成叔丁醇。
(3)由1-戊醇合成2-戊炔。
(4)由乙炔合成3222223(5)由322合成4.已知苯磺酸在稀硫酸中可以水解而除去磺酸基:又知苯酚和浓硫酸易发生磺化反应:请用化学方程式表示苯、水、溴、铁、浓硫酸及烧碱等为原料,合成的过程。
5.以2=2和H 218O 为原料,自选必要的其他无机试剂合成3--18O -C 2H 5,用化学方程式表示实现上述合成最志向的反应步骤。
6.已知甲烷高温下裂解反应的产物随温度不同而不同。
有好用价值的是以下两个反应:4−−−−→−-C o 15001000+2H 2 24−−→−〉C o15002H 2+3H 2试以自然气为唯一有机原料合成乙酸甲酯,写出方程式。
格式反应习题详解

中学化学竞赛试题资源库——格氏试剂1.强烈的亲核性质Grignard试剂可与物质中的活泼氢(如水、乙醇的羟基氢、乙炔的末端氢)反应,生成相应的烃基.如:X-Mg-CH2CH3 + H2O → CH3CH3X-Mg-CH2CH3 + CH3CH2OH → CH3CH3X-Mg-CH2CH3 + HC≡CH → CH3CH32. 与CO2或O2的反应格氏试剂可以与二氧化碳或氧气发生亲核加成反应生成增加一个碳的羧酸或同碳数的过氧化合物.格氏试剂与二氧化碳的加成反应在有机合成中也有着重要的意义,不仅通过生成新的 C-C 键实现了碳链的增长,而且恰到好处地实现了增加一个碳原子并引入羧基官能团,是制备增加一个碳原子的羧酸的最常用方法之一.3. 活泼卤代烃格氏试剂与活泼卤代烃之间的偶联反应此反应实现的是由活泼的卤代烃制备的格氏试剂同活泼卤代烃基之间的偶连,比如由苄基卤、烯丙基卤或三级卤代烷制备的格氏试剂.此反应在某种程度上说可以看作是对Wurtz反应和Wurtz-Fittig反应以及乌尔曼反应的互补,因为这几个反应只能实现不活泼的烃基的偶连,而由格氏试剂实现的偶连反应不仅引入了活泼基团,而且由于它的特殊结构还可以实现不同的烃基之间的偶连.由卤代烃的烃基通过偶连反应制备各种烃类,这些反应类型对于合成中碳链的增长有着非常重要的意义,要灵活掌握.4、与醛酮加成成醇这也许是格氏试剂在合成上最重要的性质之一.此类反应是格氏试剂的显负价的碳原子显示了良好的亲核性,对缺电子的醛酮的羰基碳原子进行亲核加成,而显正电的镁离子加成到羰基氧原子上,生成—C—C—O—Mg—X的结构,再经过酸催化下的水解去掉镁的部分,生成醇的结构和镁的卤化物和氢氧化物.此类反应可以用来合成各种醇类,也是有机合成中合成醇类的最常用的方法.在做复杂的醇类的反合成分析时,要清楚地意识到醇羟基的α碳原子就是原来醛酮分子中的羰基碳,醇羟基的一个β碳原子可能就是原来格氏试剂中显负价的官能碳,而α碳原子和这个β碳原子之间的单键就是通过这个亲核加成反应新形成的.通常格氏试剂与醛类发生亲核加成反应生成二级醇;格氏试剂与酮类发生亲核加成反应生成三级醇;只有格氏试剂与甲醛发生亲核加成反应才会生成一级醇,而且这也是制备增加一个碳的醇的常用方法.另外,格氏试剂与环氧乙烷加成,可得到增加2个碳原子的一级醇.格氏反应格氏试剂Grignard reagent 一种金属有机化合物,通式RMgX(R代表烃基,X代表卤素)。
2004年全国高中学生化学竞赛决赛理论试题

2004年全国高中学生化学竞赛决赛理论试题及答案第一题(6分)选取表1中的合适物质的字母代号(A~H)填人相应标题(①一⑧)后的括号中(单选),并按要求填空。
表1 字母所代表的物质①()不是平面分子,其衍生物用作高能燃料。
②()存在两种异构体,其中一种异构体的结构为。
③()具有线型结构,Lewis结构式中每个键的键级为2.0。
④()是无色的,平面分子,它的一种等电子体是。
⑤()既有酸性,又有碱性,可作制冷剂。
⑥()既有酸性,又有碱性;既是氧化剂,又是还原剂,主要做剂。
⑦()是顺磁性分子。
⑧()水溶液会分解生成N20,反应式为。
第二题(6分)图1是元素的△f G m/F一Z图,它是以元素的不同氧化态Z与对应物种的△f G m/F 在热力学标准态pH =0或pH == 14的对画图。
图中任何两种物种联线的斜率在数值上等于相应电对的标准电极电势ψA或ψB,A、B分别表示pH=0(实线)和pH=14(虚线)。
上图中各物种的△f G m/F的数值如表2所示。
表2 各物质的△f G m/F⒈用上表提供的数据计算:ψA(IO3-/I-) ψB(IO3-/I-) ψA(ClO4-/HClO2)⒉由上述信息回答:对同一氧化态的卤素,其含氧酸的氧化能力是大于、等于还是小于其含氧酸盐的氧化性。
⒊溴在自然界中主要存在于海水中,每吨海水约含0.14 kg溴。
Br2的沸点为58.78℃;溴在水中的溶解度3.58 g/100 g H20(20℃)。
利用本题的信息说明如何从海水中提取Br2,写出相应的化学方程式,并用方框图表达流程。
第三题(6分)过氧乙酸是一种广谱消毒剂,可用过氧化氢与乙酸反应制取,调节乙酸和过氧化氢的浓度可得到不同浓度的过氧乙酸。
过氧乙酸含量的分析方法如下:准确称取0.5027 g过氧乙酸试样,置于预先盛有40 mLH20、5 mol 3 mol/LH2SO4溶液和2~3滴1 mol/L MnSO4溶液并已冷却至5℃的碘量瓶中,摇匀,用0.02366 mol/L KMnO4标准溶液滴定至溶液呈浅粉色(30 s不退色),消耗了12.49 mL;随即加人10 mL 20%KI溶液和2~3滴(NH4)2 MoO4溶液(起催化作用并减轻溶液的颜色),轻轻摇匀,加塞,在暗处放置5 min ~10 min,用0.1018 mol/LNa2S2O3标准溶液滴定,接近终点时加人3 mL 0.5%淀粉指示剂,继续滴定至蓝色消失,并保持30s不重新显色,为终点,消耗了Na2S2O3 23.61 mL。
格式反应习题详解

中学化学竞赛试题资源库——格氏试剂1.强烈的亲核性质Grignard试剂可与物质中的活泼氢(如水、乙醇的羟基氢、乙炔的末端氢)反应,生成相应的烃基.如:X-Mg-CH2CH3 + H2O → CH3CH3X-Mg-CH2CH3 + CH3CH2OH → CH3CH3X-Mg-CH2CH3 + HC≡CH → CH3CH32. 与CO2或O2的反应格氏试剂可以与二氧化碳或氧气发生亲核加成反应生成增加一个碳的羧酸或同碳数的过氧化合物.格氏试剂与二氧化碳的加成反应在有机合成中也有着重要的意义,不仅通过生成新的 C-C 键实现了碳链的增长,而且恰到好处地实现了增加一个碳原子并引入羧基官能团,是制备增加一个碳原子的羧酸的最常用方法之一.3. 活泼卤代烃格氏试剂与活泼卤代烃之间的偶联反应此反应实现的是由活泼的卤代烃制备的格氏试剂同活泼卤代烃基之间的偶连,比如由苄基卤、烯丙基卤或三级卤代烷制备的格氏试剂.此反应在某种程度上说可以看作是对Wurtz反应和Wurtz-Fittig反应以及乌尔曼反应的互补,因为这几个反应只能实现不活泼的烃基的偶连,而由格氏试剂实现的偶连反应不仅引入了活泼基团,而且由于它的特殊结构还可以实现不同的烃基之间的偶连.由卤代烃的烃基通过偶连反应制备各种烃类,这些反应类型对于合成中碳链的增长有着非常重要的意义,要灵活掌握.4、与醛酮加成成醇这也许是格氏试剂在合成上最重要的性质之一.此类反应是格氏试剂的显负价的碳原子显示了良好的亲核性,对缺电子的醛酮的羰基碳原子进行亲核加成,而显正电的镁离子加成1中学综合学科网第 1 页共 19 页到羰基氧原子上,生成—C—C—O—Mg—X的结构,再经过酸催化下的水解去掉镁的部分,生成醇的结构和镁的卤化物和氢氧化物.此类反应可以用来合成各种醇类,也是有机合成中合成醇类的最常用的方法.在做复杂的醇类的反合成分析时,要清楚地意识到醇羟基的α碳原子就是原来醛酮分子中的羰基碳,醇羟基的一个β碳原子可能就是原来格氏试剂中显负价的官能碳,而α碳原子和这个β碳原子之间的单键就是通过这个亲核加成反应新形成的.通常格氏试剂与醛类发生亲核加成反应生成二级醇;格氏试剂与酮类发生亲核加成反应生成三级醇;只有格氏试剂与甲醛发生亲核加成反应才会生成一级醇,而且这也是制备增加一个碳的醇的常用方法.另外,格氏试剂与环氧乙烷加成,可得到增加2个碳原子的一级醇.格氏反应格氏试剂 Grignard reagent 一种金属有机化合物,通式RMgX(R代表烃基,X代表卤素)。
历年化学竞赛国家决赛题目-第26届全国高中学生理论试题

两种水笼(图4.2)构成,每个水笼中心均包含一个A分子(视为球形),X射线衍射表明该
晶体属立方晶系,晶胞中心为对称中心,体对角线为3次旋转轴。已知其中两个A的分数
坐标分别为0,0,0和0,1/2,1/4。写出该晶胞所有A的分数坐标及相应水笼的类型;不考虑氢
原子,写
出该晶体的点阵类型(须写出简要的分析过程)。
XI属正交晶系,晶胞参数a = 450.19 pm,b = 779.78 pm,c = 732.80
pm,计算该晶胞中水分子的个数。
4-3 冰-Ic是一种亚稳态,在-
80℃由水蒸汽凝结而成,属立方晶系,晶体内所有氢键键长均相等,晶胞参数a = 635.80
pm。计算氢键键长并给出该晶体的点阵类型(不考虑氢原子,须写出简要的分析过程)。
),它们的键角从大到小顺序为:_________________________________。
1-2 铋的高价化合物具有很强的氧化性,酸性介质中可用NaBiO3氧化Mn(II) 得到 Mn(VII)以鉴定锰。写出该反应的离子反应方程式.
1-3 卤氧化铋作为一类新型光化学催化剂,具有较高的催化活性和稳定性,近几年备
第4页,共8页
3-6 用表3-2中所给数据和3-5的计算结果分別解释温度对反应(1)的影响。 3-7 己知在一定温度下反应方向会发生变化,请计算反应的转向温度。
第4题(15分)冰有十六种晶型。冰中每个水分子与周围4个水分子形成氢键,氢键键长
可表示为通过氢键相连接的两个氧原子的核间距。
4-1 自然界中最常见的冰是冰-Ih,属六方晶系(图4.1),晶胞参数a = b = 449.75 pm,c =
第5页,共8页
五角十二面体 十四面体 图4.1( 为O原子)
2004年全国高中学生化学竞赛决赛(冬令营)理论试题及答案

2004年全国高中学生化学竞赛决赛理论试题及答案第一题(6分)选取表1中的合适物质的字母代号(A~H)填人相应标题(①一⑧)后的括号中(单选),并按要求填空。
②()存在两种异构体,其中一种异构体的结构为。
③()具有线型结构,Lewis结构式中每个键的键级为2.0。
④()是无色的,平面分子,它的一种等电子体是。
⑤()既有酸性,又有碱性,可作制冷剂。
⑥()既有酸性,又有碱性;既是氧化剂,又是还原剂,主要做剂。
⑦()是顺磁性分子。
⑧()水溶液会分解生成N20,反应式为。
第二题(6分)图1是元素的△f G m/F一Z图,它是以元素的不同氧化态Z与对应物种的△f G m/F在热力学标准态pH =0或pH == 14的对画图。
图中任何两种物种联线的斜率在数值上等于相应电对的标准电极电势ψA或ψB,A、B分别表示pH=0(实线)和pH=14(虚线)。
上图中各物种的△f G m/F的数值如表2所示。
表2 各物质的△f G m/F⒈用上表提供的数据计算:ψA(IO3-/I-) ψB(IO3-/I-) ψA(ClO4-/HClO2)⒉由上述信息回答:对同一氧化态的卤素,其含氧酸的氧化能力是大于、等于还是小于其含氧酸盐的氧化性。
⒊溴在自然界中主要存在于海水中,每吨海水约含0.14 kg溴。
Br2的沸点为58.78℃;溴在水中的溶解度3.58 g/100 g H20(20℃)。
利用本题的信息说明如何从海水中提取Br2,写出相应的化学方程式,并用方框图表达流程。
第三题(6分)过氧乙酸是一种广谱消毒剂,可用过氧化氢与乙酸反应制取,调节乙酸和过氧化氢的浓度可得到不同浓度的过氧乙酸。
过氧乙酸含量的分析方法如下:准确称取0.5027 g过氧乙酸试样,置于预先盛有40 mLH20、5 mol 3 mol/LH2SO4溶液和2~3滴1 mol/L MnSO4溶液并已冷却至5℃的碘量瓶中,摇匀,用0.02366 mol/L KMnO4标准溶液滴定至溶液呈浅粉色(30 s不退色),消耗了12.49 mL;随即加人10 mL 20%KI溶液和2~3滴(NH4)2 MoO4溶液(起催化作用并减轻溶液的颜色),轻轻摇匀,加塞,在暗处放置5 min ~10 min,用0.1018mol/LNa2S2O3标准溶液滴定,接近终点时加人3 mL 0.5%淀粉指示剂,继续滴定至蓝色消失,并保持30s不重新显色,为终点,消耗了Na2S2O3 23.61 mL。
高中化学竞赛题--有机合成(完整资料).doc

【最新整理,下载后即可编辑】中学化学竞赛试题资源库——有机合成A 组 1.6-羰基庚酸是合成某些高分子材料和药物的重要中间体。
某实验室以溴代甲基环己烷为原料合成6-羰基庚酸。
请用合成反应流程图表示出最合理的合成方案(注明反应条件)提示:①合成过程中无机试剂任选,②如有需要,可以利用试卷中出现过的信息,③合成反应流程图表示方法示例如下:2.已知①卤代烃(或-Br )可以和金属反应生成烃基金属有机化合物。
后者又能与含羰基化合物反应生成醇:RBr +Mg ()−−−→−O H C 252RMgBr −−→−O CH 2RCH 2OMgBr −−−→−+H O H /2RCH 2OH ②有机酸和PCl 3反应可以得到羧酸的衍生物酰卤:③苯在AlCl 3催化下能与卤代烃作用生成烃基苯:有机物A 、B 分子式均为C 10H 14O ,与钠反应放出氢气并均可经上述反应合成,但却又不能从羰基化合物直接加氢还原得到。
A 与硫酸并热可得到C 和C ’,而B 得到D 和D’。
C 、D 分子中所有碳原子均可共处于同一平面上,而C’和D’却不可。
请以最基础的石油产品(乙烯、丙烯、丙烷、苯等)并任选无机试剂为原料依下列路线合成B ,并给出A 、C ’、D 的结构简式及下述指定结构简式。
合成B 的路线:3.由指定原料及其他必要的无机及有机试剂会成下列化合物:(1)由丙烯合成甘油。
(2)由丙酮合成叔丁醇。
(3)由1-戊醇合成2-戊炔。
(4)由乙炔合成CH 3CH 2CH 2CH 2CH 2CH 2CH 3。
(5)由CH 3CH 2CH 2CHO 合成4.已知苯磺酸在稀硫酸中可以水解而除去磺酸基:又知苯酚与浓硫酸易发生磺化反应:请用化学方程式表示苯、水、溴、铁、浓硫酸及烧碱等为原料,合成的过程。
5.以CH 2=CH 2和H 218O 为原料,自选必要的其他无机试剂合成CH 3--18O -C 2H 5,用化学方程式表示实现上述合成最理想的反应步骤。
高中化学竞赛 格氏试剂和格氏反应

格氏试剂和格氏反应卤烃在无水乙醚中与镁作用生成有机金属镁化合物。
这一产物叫做格利雅试剂,简称格氏试剂。
格氏试剂是一个极性分子:R—Mg X,R可以进行亲核取代反应。
格氏试剂的结构一般以RMgX 表示。
NMR谱中显示出格氏试剂为双分子化合物,它的真实结构可能是:生成格氏试剂的难易与卤烃的结构及卤素的种类有关。
就反应性和产率来说,一级卤烃>二级卤烃>三级卤烃;RI>RBr>RCl。
例如:由于碘代烷最贵,而氯代烷的反应性最差,所以,实验室中常采用反应性居中的溴代烷来合成格氏试剂。
单质碘对反应有催化作用,因此常常加入少量碘来促进反应。
烯丙基型及苄基型卤烃非常活泼,很易生成格氏试剂。
生成的格氏试剂又与未作用的卤烃偶合。
因此,在合成此类格氏试剂时,要严格控制反应在较低温度下进行。
乙烯型卤烃和卤素直接连在芳环上的芳香卤烃在无水乙醚中不能与镁形成格氏试剂。
改变溶剂如采用四氢呋喃作为溶剂可以顺利进行反应。
例如:据认为,这是由于环醚中氧比直链醚中的氧更为暴露在外,容易和镁配合而加速反应。
格氏试剂非常活泼,可以和空气中的氧、水、二氧化碳发生反应。
因此,在制备时,除保持试剂的干燥外,还应隔绝空气。
格氏试剂是有机合成中非常重要的试剂之一。
制得的格氏试剂不需分享即可直接用于有机合成。
利用格氏试剂合成烃、醇、醛、酮、羧酸等一系列有机化合物的这些反应称格利雅反应,简称格氏反应。
①与活泼氢的反应。
格氏试剂遇水、醇、羧酸、氨、胺等具有“活泼”氢的化合物都生成烷烃。
例如:本反应可用于活泼氢的定量反应。
通过测定生成的烷烃体积,可计算出每分子有机物所含的活泼氢数目,称为活泼氢测定法。
②与活泼卤代烷反应。
格氏试剂与烯丙型、苄基型卤烃偶合生成烃类。
格氏试剂与烯丙基型卤烃的偶合反应是合成末端烯烃的一种方法。
三级卤烃也可反应,但产量较低。
③与金属卤化物的反应。
格氏试剂与还原电位低于镁的金属卤化物作用,格氏试剂中的烃基取代了金属卤化物中的卤素,生成新的有机金属化合物,这是合成有机金属化合物的一种重要方法。
高中化学竞赛题--格氏试剂

中学化学竞赛试题资源库——格氏试剂A 组1.卤代烃(RX )与镁于室温下在干燥乙醚中反应,生成卤化烃基镁(RMgX ):RX +Mg RMgX这种产物叫“Grignard Reagent ”(格氏试剂)。
格氏试剂很活泼,能与许多物质发生反应。
与具有活性氢的化合物(HY )作用,生成相应的烃:RMgX +HY →RH +(Y =-OH 、-OR 、-X 、-NH 2、NHR 、-C ≡CH 等)它还能与具有羰基结构的化合物(醛、酮等)发生加成反应,产物水解成醇:基于V.Grignard 的这一巨大贡献,他曾获1912年诺贝尔化学奖。
2,3-二溴-3-乙基戊烷()是一个孪二卤代烷。
试以3-戊醇和乙醛为原料,通过利用格氏试剂合成之。
2.已知卤代烃与金属镁反应生成“格林试剂”,如:R -X +Mg −−−→乙醚RMgX (格林试剂)。
利用格林试剂与羰基化合物(醛、酮)等的反应可以合成醇类,如:(1)现欲合成化合物,用格林试剂与相应的醛或酮加成,一共有____种方法,试写出所用格林试剂与相应醛或酮的结构简式。
(2)试以苯、溴、乙烯、镁、水、空气等为主要原料,辅以必要的催化剂,合成化合物-CH(OH)CH 3,写出有关反应的化学方程式并注明反应条件。
3.已知RX +Mg −−−→−无水乙醚RMgX2RMgX +R ’COOR ’’−−−→−无水乙醚−−−→−+H O H 、2请用乙炔为基本原料合成3-甲基-3-戊醇。
所用到的有机原料均由乙炔合成,无机原料自选。
氧化 B 组4.写出下列反应的方程式,并画出产物A ~H 的结构式。
5.卤代烃和金属镁在乙醚中反应生成烷基卤代镁(RMgX ),称为格林试剂,它是重要的有机合成试剂,可与羰基化合物反应制醇。
现有乙烯和必要的无机原料合成3-甲基-3-戊醇,合成路线如下:请写出A ~H 物质的结构简式:6.已知①卤代烃RX (或-Br )可以和金属反应生成烃基金属有机化合物。
鲁科版高中化学选修五第3章第1节第1课时学业分层测评16
高中化学学习材料金戈铁骑整理制作学业分层测评(十六)(建议用时:45分钟)[学业达标]1.结构为的有机物可以通过不同的反应得到下列四种物质:生成这四种有机物的反应类型依次为()A.酯化、加成、取代、缩聚B.取代、酯化、消去、缩聚C.取代、加成、消去、加聚D.取代、酯化、加成、加聚【解析】【答案】 B2.格林尼亚试剂简称“格氏试剂”,它是卤代烃与金属镁在无水乙醚中作用得到的,如CH 3CH 2Br +Mg ――→乙醚CH 3CH 2MgBr ,它可与羰基发生加成反应,其中的“-MgBr ”部分加到羰基的氧上,所得产物经水解可得醇。
今欲通过上述反应合成2-丙醇,选用的有机原料正确的一组是( )A .氯乙烷和甲醛B .氯乙烷和丙醛C .一氯甲烷和丙酮D .一氯甲烷和乙醛【解析】 氯乙烷先发生反应CH 3CH 2Cl +Mg ――→乙醚CH 3CH 2MgCl ,然后再与甲醛发生反应水解后生成1-丙醇;氯乙烷和丙醛发生上述一系列反应后会生成3-戊醇;一氯甲烷和丙酮发生上述一系列反应后会生成2-甲基-2-丙醇;一氯甲烷和乙醛发生上述一系列反应后会生成2-丙醇。
【答案】 D3.如果以乙烯为原料,经过两步反应制得乙二醇,则这两步反应的类型依次是( )A .加成反应、取代反应B .加成反应、消去反应C .取代反应、消去反应D .取代反应、加成反应【答案】 A4.由CH3CH2CH2OH制备,所发生的化学反应至少有:①取代反应;②消去反应;③加聚反应;④酯化反应;⑤还原反应;⑥水解反应中的()A.①④B.②③C.②③⑤D.②④【答案】 B5.某羧酸的衍生物A,其分子式为C6H12O2,实验表明A和NaOH溶液共热生成B和C,B和盐酸反应生成有机物D,C在铜作催化剂和加热条件下氧化为E,其中D、E都不能发生银镜反应,由此判断A的可能结构简式有() A.2种B.3种C.4种D.6种【解析】A是酯,D是酸,C是醇,E是酮。
COBP·中国化学奥林匹克竞赛(初赛)模拟试题30-01

COBP·中国化学奥林匹克竞赛(初赛)模拟试题30-01COBP·中国化学奥林匹克竞赛(初赛)模拟试题(30-01)命题人:晋·Resazurin元素周期表第1题(8分)写出下列反应的化学方程式1-1 令氧气小心地与钠的液氨溶液反应,得到极少量钠的某种不稳定氧化物。
1-2 正丁基锂与丙炔在正己烷溶剂中加热回流反应得到锂的某种碳化物。
1-3 碘硅烷(SiH3I)与苯基氯化镁发生取代反应。
1-4高氯酰氟在液氨中发生溶剂解反应,生成两种盐。
第2题(10分)2-1 将氯气通入强碱性的过氧化氢溶液,在暗处可以看到明显的红光。
写出反应方程式,解释红光的产生。
2-2 硫氰酸汞的热分解实验被称为“法老之蛇”实验,曾经被用于烟花,但由于产物有毒而逐渐被淘汰。
已知该分解反应产生四种产物,其中一种可以用于溶解白磷,另一种是空气的主要成分。
(1)将分解后得到的固体残渣A溶于王水后过滤,稀释所得溶液并加入过量碱溶液得到橙黄色固体B。
收集硫氰酸汞分解所得的气体混合物,冷凝后将剩余气体通入过量氢氧化钾溶液,生成剧毒的盐C和毒性较小的盐D。
向C的溶液中加入硫代硫酸钾后得到盐E。
用浓硝酸溶解固体B并结晶得到盐F,F加入E的溶液可以重新得回硫氰酸汞。
写出A~F各化合物的化学式。
(2)写出硫氰酸汞热分解的化学方程式。
第3题(14分)锂和钠可以形成一系列通式为Li x Na6-x N2(x=1~5)的混合氮化物。
随着x数值不同,晶体的结构也各不相同。
3-1 混合氮化物Li2NaN的结构可以看作是六方晶系的α-Li3N (右上图)中的一个锂原子被钠原子取代得到。
已知该晶体中锂的配位数为3。
(图中大球代表N,小球代表Li)(1)画出Li2NaN的一个晶胞,指出钠的配位数。
(2)α-Li3N可以导电。
假设将离子看作硬球,且在Li3N中Li离子恰好能通过N3-之间的缝隙,试通过计算说明Li2NaN能否导电。
已知Li3N晶胞参数:a=364.8pm,c=387.5pm,r(Li+)=76pm,r(Na+)=102pm,NaN晶胞参数:a=365pm,c=460pm。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中学化学竞赛试题资源库——格氏试剂
A 组
1.卤代烃(RX )与镁于室温下在干燥乙醚中反应,生成卤化烃基镁(RMgX ):
RX +Mg RMgX
这种产物叫“Grignard Reagent ”(格氏试剂)。
格氏试剂很活泼,能与许多物质发生反应。
与具有活性氢的化合物(HY )作用,生成相应的烃:
RMgX +HY →RH +
(Y =-OH 、-OR 、-X 、-NH 2、NHR 、-C ≡CH 等)
它还能与具有羰基结构的化合物(醛、酮等)发生加成反应,产物水解成醇:
基于V.Grignard 的这一巨大贡献,他曾获1912年诺贝尔化学奖。
2,3-二溴-3-乙基戊烷(
)是一个孪二卤代烷。
试以3-戊醇
和乙醛为原料,通过利用格氏试剂合成之。
2.已知卤代烃与金属镁反应生成“格林试剂”,如:R -X +Mg −−
−→乙醚RMgX (格林试剂)。
利用格林试剂与羰基化合物(醛、酮)等的反应可以合成醇类,如:
(1)现欲合成化合物,用格林试剂与相应的醛或酮加成,一共有____种方法,试写出所用格林试剂与相应醛或酮的结构简式。
(2)试以苯、溴、乙烯、镁、水、空气等为主要原料,辅以必要的催化剂,合成化合物-CH(OH)CH 3,写出有关反应的化学方程式并注明反应条件。
3.已知RX +Mg −−−→−无水乙醚RMgX
2RMgX +R ’COOR ’’−−−→−无水乙醚−−−→−+H O H 、2
请用乙炔为基本原料合成3-甲基-3-戊醇。
所用到的有机原料均由乙炔合成,无机原料自选。
B 催化剂
C
NaOH
A D Mg E
HBr CH 2=CH 2 H G F 3-甲基-3-戊醇 水解 D 氧化 水解
B 组
4.写出下列反应的方程式,并画出产物A ~H 的结构式。
5.卤代烃和金属镁在乙醚中反应生成烷基卤代镁(RMgX ),称为格林试剂,它是重要的有机合成试剂,可与羰基化合物反应制醇。
现有乙烯和必要的无机原料合成3-甲基-3-戊醇,合成路线如下:
请写出A ~H 物质的结构简式:
6.已知①卤代烃RX (或-Br )可以和金属反应生成烃基金属有机化合物。
后者又能与含羰基化合物反应生成醇:
RBr +Mg −−−→−O H C 252)(RMgBr −−→−O CH 2RCH 2OMgBr −−−→−+H O H /2RCH 2OH
②有机酸和PCl 3反应可以得到羧酸的衍生物酰卤:R --OH −−→−3
PCl R --Cl ③苯在AlCl 3催化下能与卤代烃作用生成烃基苯:+RCl −−→−3AlCl -R 有机物A 、B 分子式均为C 10H 14O ,与钠反应放出氢气并均可经上述反应合成,但却
又不能从羰基化合物直接加氢还原得到。
A 与硫酸共热可得到C 和C ’,而B 得到D 和D ’。
C 、
D 分子中所有碳原子均可共处于同一平面上,而C ’和D ’却不行。
请以最基础的石油产品(乙烯、丙烯、丙烷、苯等)并任选无机试剂为原料依下列路线合成B ,并给出A 、C ’、D 的结构简式及下述指定结构简式合成B 的路线。
7.完成下列反应中括号内的反应条件或产物(D 为氢的同位素):
8.Grianard 试剂是一种常用的有机合成试剂,通常可用卤代烃来制备,例如:
CH 3I +Mg =CH 3MgI
Grignard 试剂可以与许多有机物反应,例如,它和羰基(=O )发生加成反应。
反应中,它的组成中的烃基加到羰基的碳原子上而卤镁基的镁原子加到氧原子上,反应产物再经水解,氧原子上的卤镁基就会被水中的羟基取代而生成醇。
甲醇经多步反应,其中包括Grigflgnd 试剂的反应,就可以得到叙丁醇(CH 3)3COH ,全部反应过程,除甲醇及其反应产物外不需要添加任何其他有机试剂(使用的有机溶剂不计)。
试按反应步骤逐步写出由甲醇合成叔丁醇的所有反应式(反应箭头左右分别写反应物和有机产物,添加的试剂写在箭头上面,使用的有机溶剂不作要求)。
C 组
9.羰基化合物A (C 6H 12O )和格氏试剂B 反应,然后水解,则生成化合物C ,化合物C 与浓H 2SO 4共热,形成异构化的烃类化合物D (C 7H 14)的混合物,试写出A 的结构简式,并且它能使D 的异构体最多(虽然所得量相差很大),同时写出C 的可能结构和D 的异构体的数目。
10.化合物A 和B 是著名的香料:
A B
其中A 可按下列路线合成:
(1)写出C →H 的结构简式
(2)以甲苯、丙烯及必要的无机试剂为原料合成B 。
11.卤代烷可以跟金属镁反应得到有机合成很有用的格氏试剂。
RX +Mg −−
−→−无水乙醚
RMgX (R 一烃基) 黏稠液体(格氏试剂)
格氏试剂可以跟醛酮的羰基起加成反应,羰基加在碳基碳原子上,得到的镁盐水解后生成相应的醇。
(1)某化合物A的分子式为C10H14O,具有水果香型,它由下列合成路线(下图)制得,请填写方框中化合物的结构式。
(2)设计一个合理路线,实现由正丙醇制备正丁醇,写出各步反应的条件和产物。
(3)制备3-甲基-3-己醇可以选用3种不同的格氏试剂和3种不同的醛或酮作反应物,试写出这3对反应物。
参考答案(D6) 1 CH 3CHO +H 2→CH 3CH 2OH CH 3CH 2OH +HBr →CH 3CH 2Br +H 2O
CH 3CH 2Br +Mg −−→−乙醚CH 3CH 2MgBr CH 3CH 2
CH 2CH 3+O 2→CH 3CH 2CH 2CH 3 CH 3CH 2CH 2CH 3+CH 3CH 2MgBr ()()−−−−−→−+H O H /212
乙醚;(CH 3CH 2)3COH (CH 3CH 2)3COH −−
−→−42SO
H 浓(CH 3CH 2)2C =CHCH 3 (CH 3CH 2)2C =CHCH 3+Br 2→(CH 3CH 2)2CBrCHBrCH 3
2 (1)3种 CH 3MgBr 和-COCH 2CH
3 -MgBr 和CH 3COCH 2CH 3 CH 3CH 2MgBr 和-COCH 3
(2)+Br 2−−→−3FeBr -Br +HBr -Br +Mg −−→−乙醚-MgBr
2CH 2=CH 2+O 2−−−−−→−催化剂。
加热加压2CH 3CHO
-MgBr +CH 3CHO →-CH(OMgBr)CH 3
-CH(OMgBr)CH 3+H 2O →-CH(OH)CH 3
3 CH ≡CH −−→−+2Hg CH 3CHO −−→−+2Mn CH 3COOH (A )
CH ≡CH −−→−Pd H /2CH 2=CH 2−−−→−+
H O H 、2CH 3CH 2OH (B ) CH 3COOH +CH 3CH 2OH −→−+
H CH 3COOC 2H 5(C ) CH 2=CH 2−−→−HCl CH 3CH 2Cl (D )−−−−→−、无水乙醚Mg CH 3CH 2NgCl (E )
2CH 3CH 2NgCl +CH 3COOC 2H 5−−−→−无水乙醚−−−→−+
H O H 、23-甲基-3-戊醇 4
5 A :BrCH 2CH 3 B :CH 3CH 2OH C :CH 3CHO D :CH 3CH 2MgBr
E :CH 3CH 2CH(CH 3)OMgBr
F :CH 3--CH 2-CH 3
G :C
H 3──CH 2CH 3 H :
6 A : C ’: D :
7
8 CH 3OH []−→−
O CH 2O CH 3OOH −→−
CH 3I −→−Mg CH 3MgI −−→−O CH 2CH 3CH 2OMgI −−−→−+H O H 、2 CH 3CH 2OH []−→−O CH 3CHO −−−→−MgI CH 3(CH 3)2CHOMgI −−−→−+
H O H 、2(CH 3)2CHOH []−→−O (CH 3)2CO −−−→−MgI CH 3(CH 3)3COMgI −−
−→−+H O H 、2(CH 3)3COH 9 3-己酮 5种
10 (1)C :-Br D :
-MgBr E :-CH 2CH 2OH F :-CH 2CH 2Br G :-CH 2CH 2MgBr H :
(2)CH 3CH =CH 2+H 2O −−−−→
−442/HgSO SO H −→−][O -CH 3+Cl 2−→−hv -CH 2Cl −−−−→−无水乙醚/Mg
-CH 2MgCl −−−−−−−→−+H O H COCH CH /21233);) B
11 (1)
(2)
(3)CH 3MgX 和CH 3CH 2CH 2CH 2CH 3 CH 3CH 2MgX 和CH 3CH 2CH 2CH 3
CH 3CH 2CH 2MgX 和CH 3CH 2CH 3。
