高三题型专练题型二 物质的量 阿伏伽德罗常数
高三化学二轮复习专题——阿伏加德罗常数

B )。
题型分析
11
【解析】常温常压下,124 g P4的物质的量是1 mol,由于白磷是正四面 体结构,因此所含P—P键数目为6NA,A项错误;铁离子在溶液中发生水解 ,所以100 mL 1 mol·L-1FeCl3溶液中所含Fe3+的数目小于0.1NA,B项错误;1 mol甲烷或乙烯分子中均含有4 mol氢原子,标准状况下,11.2 L甲烷和乙 烯混合物的物质的量是0.5 mol,其中含氢原子数目为2NA,C项正确;反应 2SO2+O2 2SO3是可逆反应,因此密闭容器中,2 mol SO2和1 mol O2催化反 应后分子总数大于2NA,D项错误。
学生对物质世界的微观认识。
【真题示范】
B
题型分析
4
题型分析 5
4 L NH3的物质的量为1 mol,含有的电子数为10NA;B项,浓HNO3与铜生成NO2的反应为Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O,1 mol的 Cu完全反应转移2 mol电子,正确;C项,N不水解,1 L 0.
单一纯净物直接计算;因同位素而造
(√)
成 D2O的组摩成尔的质物量质不)分同别的计物算质(如H2O、
(√)
立志是事业的大门,工作是登门入室的旅程。
关键能力
16
并谁非不神 向仙前才看能,命角烧谁陶就题度器会,面有临志许的多人困总难可。以学得精手艺。 举例
强行者有志。
判断 正误
注意事项
三人鸟军生不可 志 展夺气翅帅立膀也,难,所高匹贵飞夫功。不业可昌夺。志①原也子28。数g乙为烯2N和A 环丁烷(C4H8)的混合气体中含有的碳
④1 mol Na与足量O2反应,转移的电子数为NA。
物质的量及其阿伏伽德罗常数
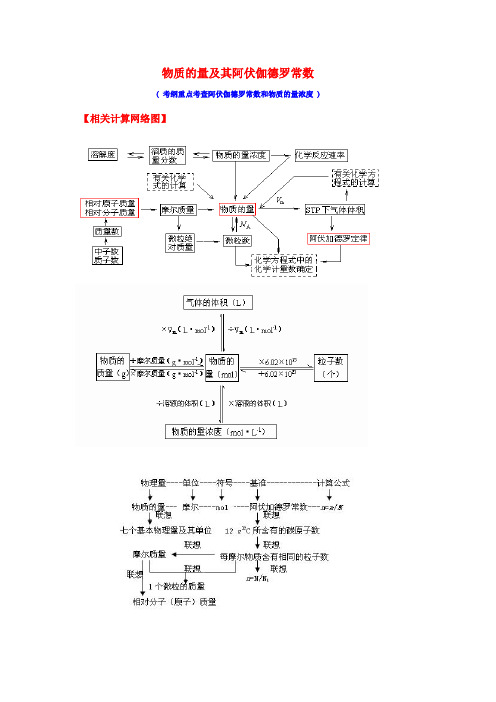
物质的量及其阿伏伽德罗常数( 考纲重点考查阿伏伽德罗常数和物质的量浓度 )【相关计算网络图】【知识点梳理】一、物质的量:1﹑物质的量(n):表示物质含指定粒子多少的物理量注:专有名词,表示微观粒子单位:摩尔(mol),简称为摩规定0.012kg12C中所含碳原子数为1mol阿伏加德罗常数N A =6.02×1023mol-1计算公式:n=N/ N A2﹑摩尔质量(M):单位物质的量的物质所具有的质量单位:g/mol 或 g﹒mol-1计算公式:M=m/n二、阿伏伽德罗常数(一)阿伏加德罗定律(1)在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子(2)注意:①使用范围:气体;②使用条件:同温、同压、同体积;③特例:气体摩尔体积(3)推论:用n表示物质的量,V表示体积,P表示压强,M表示摩尔质量(式量),ρ表示密度。
(注意语言表达)①同温同压:V1/V2 = n1/n2 = N1/N2②同温同体积:P1/P2 = n1/n2 = N1/N2③同温同压:ρ1/ρ2 = M1/M2④同温同压同质量:V1/V2 = M1/M2⑤同温同压同体积:m1/m2 = M1/M2(二)阿伏伽德罗常数的考查方式1,考查物质的状态考查气体摩尔体积时,常用在标准状况下非气态的物质来迷惑考生,如H2O、SO3、CCl4、苯、辛烷等,要清醒地看到气体摩尔体积适用的对象是气体,对非气态物质不适用。
因此,要掌握常见物质的状态,在常见有机物中C≤4的烃、CH3Cl、甲醛为气态,其它一般为非气体。
2,考查气体摩尔体积应用条件气体摩尔体积适用于0℃、1.01×105Pa,而在许多考题中常给出非标准状况如:常温常压;在25℃、1.01×105Pa时等,要注意气体摩尔体积适用的条件。
另外,要明确物质的质量或物质的量与状态无关,因此,这时的判断不涉及22.4L/mol。
“如常温常压下,1 mol 氦气含有的核外电子数为2N A”这句话是正确的。
阿伏伽德罗常数专题练习

题型二阿伏加德罗常数应用题组一(限时12分钟)一.设N A为阿伏加德罗常数的数值。
下列说法正确的是( )可逆反应1.标准状况下22.4 L氯气通入足量水中反应,转移的电子数为N A特殊物质2.乙烯和氮气组成的28 g混合气体中含有N A个分子特殊物质3.1 mol Na2O2中阳离子和阴离子数均为2N A缺少数据4.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1N A特殊反应5.在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4N A物质水解6.1 L 1 mol·L-1 NH4NO3溶液中氮原子数小于2N A化学键 7.常温常压下,11.2 g乙烯中含有共用电子对数目为2.4N A状态 8.标准状况下,22.4 L CCl4中所含有的分子数为N A化学键 9.常温常压下,0.1 mol C8H18所含有的共价键数目为2.5N A特殊物质10.0.1 mol过氧化钠固体中含有的阴离子数目为0.2N A状态 11.在标准状况下,2.24 L三氧化硫中所含氧原子数为0.3N A特殊反应12.0.1 mol氯气与热的氢氧化钠溶液反应时转移电子数为0.1N A特殊物质13.7.8 g Na2O2中含有的阴离子数目为0.2N A状态 14.标准状况下,2.24 L CHCl3的分子数为0.1N A水解 15.1 L 0.1 mol·L-1 Al2(SO4)3溶液中Al3+的数目为0.2N A特殊物质16.9.2 g NO2和N2O4的混合气体中含有的氮原子数为0.2N A特殊反应17.1 mol O2与金属钠反应,O2不一定得到4N A个电子状态 18.标准状况下,a L CH4和a L C6H14中所含分子数均为aN A/22.4特殊反应19.常温常压下,1 mol氯气与足量的金属镁反应,转移2N A个电子特殊物质20.在20 ℃、1.01×105 Pa时,2.8 g C2H4和CO的混合气体含气体分子数等于0.1N A缺少数据21.0.1 mol·L-1 Mg(NO3)2溶液中含有0.2N A个NO-3电子、中字数22.8 g CH4中含有10N A个电子前提条件 23.常温常压下,22.4 L O3中含有3N A个氧原子24.28 g C2H4中含有2N A个碳原子7.14C是碳的一种同位素,N A为阿伏加德罗常数,下列说法不正确的是( )①1 mol 14CH4分子中所含中子数为8N A②7 g 14C原子形成的石墨中所含质子数为3N A③17 g甲基(—14CH3)所含电子数为8N A④常温常压下,22.4 L 14CO2的分子数为N AA.①② B.①③ C.①②③ D.③④8.用N A表示阿伏加德罗常数的值。
高考化学三轮复习考前选择专项训练—阿伏伽德罗常数

2021年高考化学学科考前大练习--阿伏伽德罗常数1.设N A 是阿伏加德罗常数的值。
下列说法正确的是( ) A .500mL2mol·L -1FeCl 3溶液中Fe 3+数为N A B .1L1mol·L -1乙醇溶液中O —H 键的键数为N AC .电解法精炼铜,阴极析出1molCu 时,阳极失去的电子数等于2N AD .在标准状况下,2.24LNH 3通入水中制成氨水,NH 4+数等于0.1N A 2.设N A 为阿伏加德罗常数的值,下列说法正确的是( ) A .CH 4和C 2H 4混合气体2.24L ,含有的C -H 数目为0.4N A B .常温下,1LpH =13的Ba (OH )2溶液中含有的OH -的数目0.2N A C .1molFe 3O 4被完全还原为Fe 2+转移的电子数为2N A D .100mL1mol •L -1AlCl 3溶液中所含Al 3+的数目为0.1N A 3.设N A 是阿伏加德罗常数的值。
下列说法正确的是 A .10gH 218O 与D 216O 的混合物中所含中子数目均为5N A B .物质的量相同的CH 4和P 4的共价键数之比为1:1C .标准状况下,1molH 2和1mo1F 2混合后,所含气体的体积约为44.8LD .常温常压下,0.5molFe 和足量浓硝酸混合,转移电子数为1.5N A 4.A N 是阿伏加德罗常数的值。
下列说法错误的是( )A .2.24L (标准状况)氨气分子中所含共价键数目为A 0.3NB .0.1mol 氯气与足量铁反应转移的电子数为A 0.3NC .3.2g 氧气和臭氧的混合气体中原子数为A 0.2ND .1LpH 2=的34H PO 溶液中H +数目为A 0.01N 5.设N A 为阿伏加德罗常数的值。
下列说法正确的是 A .60 g SiO 2中含有硅氧键个数为2N A B .1 mol Cl 2参加反应转移电子数一定为2N AC .2 L pH=3的醋酸与足量的锌反应,产生H 2分子数为10-3N AD .室温下,1 L 0.01 mol·L -1的NaHSO 4溶液中,水电离出的H +数目约为10-12N A 6.已知N A 是阿伏加德罗常数的值,下列说法不正确...的是( ) A .1 mol 甲酸钠中含有共用电子对的数目为4N A B .D 218O 和T 2O 的混合物1.1 g ,含有的质子数为0.5N AC .0.1molCH 3COOC 2H 5与稀硫酸充分反应,生成CH 3COOH 的分子数目为0.1N AD .用电解粗铜的方法精炼铜,当阴极析出32 g 铜,电路中通过的电子数为N A 7.设A N 为阿伏加德罗常数的值,下列说法正确的是A .12g 4NaHSO 晶体中阴离子所带电荷数为0.2A NB .0.1mol /L 的盐酸中,含H +的数目为0.1A NC .标准状况下,2.24L 2NO 所含电子数目为23A ND .0.1mol 羟基(—OH )中所含电子数目0.9A N8.设N A 代表阿伏加德罗常数(N A )的数值,下列说法正确的是( ) A .1 mol 硫酸氢钾固体中阴离子所带电荷数为 2N AB .Na 2O 2 和 CO 2 反应,生成 0.1molO 2,转移的电子数为 0.2 N AC .1mol·L -1(NH 4)2SO 4溶液中,含有NH 4+的数目小于2N AD .常温下,将2.7g 铝片投入过量浓硫酸中充分反应转移电子数为 0.3 N A 9.A N 为阿伏加德罗常数的值,下列说法正确的是( ) A .31L1mol /LCH COOH 溶液中含有A N 个3CH COOH 分子 B .标准状况下,11.2L 臭氧所含质子数为A 8NC .0.2molNO 与20.1molO 在密闭容器中充分反应后,容器中含有的氧原子数为A 0.4ND .标准状况下,42.24LCCl 中含有的C Cl -键数为A 0.4N 10.设N A 为阿伏加德罗常数的值。
高考化学题型专讲阿伏伽德罗常数

高考化学题型专讲阿伏加德罗常数与物质的量考纲要求1、了解物质的量的单位——摩尔(mol)、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗常数的含义。
2、了解分子、原子、离子等概念的含义。
了解原子团的定义。
3、熟记并正确书写常见元素的名称、符号、离子符号。
4、熟悉常见元素的化合价。
能根据化合价正确书写化学式(分子式),或根据化学式判断化合价。
5、了解原子结构示意图、分子式、结构式和结构简式的表示方法。
6、了解相对原子质量、相对分子质量的定义,并能进行有关计算。
7、了解配制一定溶质质量分数、物质的量浓度溶液的方法。
8、了解元素、核素和同位素的含义。
9、了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
10、了解原子核外电子排布。
11、了解化学键的定义。
了解离子键、共价键的形成。
题型特点这类题型是高考热点,几乎每年必考。
解题时不仅要求基本概念明确,而且知识覆盖面大,要求学生思维严密,审题细心。
解题策略解答时,要注意相似概念的区分,对物质的微观结构要认识清楚。
本题型常见的陷阱设置有:(1)物质状态。
考查气体摩尔体积时,常与在标况下非气态物质结合,如乙醇、碳原子数大于5的烷烃、水等。
而对于气体则常给出非标准状况,如常温常压等。
(2)物质结构。
考查一定量物质中所含微粒(分子、原子、质子、中子、电子、共价键等)数,常涉及稀有气体等单原子分子、氯气、氧气等双原子分子及D2O等特殊物质,化学键的数目则常有P4、Si、CH4等物质。
(3)氧化还原反应。
考查制定氧化还原反应时,常涉及氧化剂、还原剂、被氧化、被还原、转移电子数等问题,常见的一些特殊反应是重点,如Na2O2与水的反应等。
(4)弱电解质的电离和盐的水解。
考查电解质溶液中粒子数目及浓度大小时,常涉及弱电解质的电离和盐的水解,如FeCl3溶液中Fe3+的数目等。
(5)其他情况。
如不定体系,NO2与N2O4的混合气体,可逆反应的电子转移及反应热等。
高考化学 专题03 阿伏加德罗常数、物质的量、气体摩尔体积和阿伏加德罗定律热点题型和提分秘籍(含解析)

专题03 阿伏加德罗常数、物质的量、气体摩尔体积和阿伏加德罗定律热点题型和提分秘【高频考点解读】1.以物质的量为核心考查物质微粒数目、摩尔质量、气体体积等之间的相互换算。
2.以阿伏加德罗常数为载体的概念辨析与简单计算。
3.气体摩尔体积的使用条件及在化学计算中的应用。
4.溶质的质量、溶液的体积、溶质的质量分数与物质的量浓度之间的换算。
5.一定物质的量浓度溶液的配制方法及误差分析。
【热点题型】题型一考查阿伏加德罗常数的应用例1、N A表示阿伏加德罗常数的值,下列说法正确的是( )A.标准状况下,22.4 L二氯甲烷的分子数约为N A个B.盛有SO2的密闭容器中含有N A个氧原子,则SO2的物质的量为0.5 molC.17.6 g丙烷中所含的极性共价键为4N A个D.电解精炼铜时,若阴极得到电子数为2N A个,则阳极质量减少64 g【提分秘籍】在解答该类题目时,首先要认真审题,特别注意试题中一些关键性的字、词,留心有无“陷阱”。
同时还要注意以下细微的知识点:1.注意外界条件和物质状态(1)若题目给出的是物质的体积,则要注意外界条件和物质的状态,如:水在标准状况下为液态或固态;SO3在标准状况下为固态;标准状况下,碳原子数大于4的烃为液态或固态。
(2)若题目给出的是物质的质量或物质的量,则微粒数与外界条件无关。
2.明确物质的组成和结构(1)特殊物质的原子个数、电子个数,如Ne、O3等。
(2)特殊物质的摩尔质量,如D2O、18O2等。
(3)一些物质中的化学键数目,如SiO2、CH4、CO2等。
3.注意氧化还原反应中的微粒考查指定物质参加氧化还原反应时,常设置氧化还原反应中氧化剂、还原剂、氧化产物、还原产物、被氧化、被还原、电子转移(得失)数目方面的陷阱。
如Na2O2与H2O的反应,Cl2与NaOH溶液的反应,电解AgNO3溶液等。
4.弱电解质的电离或盐类的水解考查电解质溶液中粒子数目及粒子浓度大小关系时,常涉及弱电解质的电离平衡及盐类的水解平衡。
高中化学物质的量 阿伏伽德罗常数练习题(含答案)

高中化学物质的量阿伏伽德罗常数练习题学校:___________姓名:___________班级:___________考号:___________说明:1、本试卷包括第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
满分100分。
考试时间90分钟。
2、考生请将第Ⅰ卷选择题的正确选项填在答题框内,第Ⅱ卷直接答在试卷上。
考试结束后,只收第Ⅱ卷第Ⅰ卷(选择题)一.单选题(每题3分,共60分)1.如果a g某气体中含有该气体的分子数为b,则c g该气体在标准状况下的体积是(各选项中N A为阿伏加德罗常数)()A.B.C.D.2.下列叙述正确的是()A.NaCl的摩尔质量是58.5gB.1mol NaCl的质量是58.5g•mol-1C.58.5g NaCl所含Na+和Cl-共1molD.含1mol NaCl的溶液中约含有6.02×1023个Cl-3.摩尔是以下哪一个物理量的单位()A.摩尔质量B.物质的量C.质量D.物质的量浓度4.下列溶液中,与100mL0.5mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是()A.200mL0.25mol/L CaCl2溶液B.200mL0.25mol/L HCl溶液C.50mL1mol/L NaCl溶液D.100mL0.5mol/L MgCl2溶液5.有一空瓶的质量为W1g,该瓶充入空气后质量为W2g,相同条件下,充入某单质气体,其质量为W3g,则此单质气体的摩尔质量为()A.B.C./mol D.g/mol6.标准状况下,VLHCl气体溶解在amL水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为cmol/L,下列表达正确的是()A.溶质的质量分数ω=*100%B.溶质的物质的量浓度c=C.溶液的密度ρ=D.取题中所述溶液10mL,再加入等体积水后,所得溶液的质量分数等于0.5ω7.在标准状况下,与12gH2的体积相等的O2的()A.质量为12g B.物质的量为6molC.体积为22.4L D.物质的量是12mol8.下列说法正确的是()A.Na和NaCl灼烧时,它们的焰色反应分别是黄色和无色B.在2Al+2H2O+2NaOH=2NaAlO2+3H2#中,氧化剂是H2O和NaOHC.H2和Cl2只有在点燃条件下才可以反应D.在标准状况下,1mol H2和O2混合气体,所占的体积约是22.4L9.500m L1mol•L-1某溶液中,所含溶质的质量为20g,则该溶质的摩尔质量为()A.20g•mol-1B.30g•mol-1C.40g•mol-1D.60g•mol-110.物理量是量度物理属性或描述物体运动状态及其变化过程的量.下列名词中,哪个名词不属于物理量()A.长度B.质量C.摩尔D.时间11.N A代表阿伏加德罗常数,下列说法正确的是()A.在同温同压下,相同体积的任何气体单质所含的原子数相等B.2g氢气所含原子数为N AC.在常温常压下,11.2LN2所含原子数为N AD.17gNH3所含电子数为10N A12.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与2.24LO2(标准状况)混合后通入水中,气体恰好完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入100molNaOH溶液至Cu2+恰好沉淀完全,所用NaOH溶液的浓度是()mol •L-1.A.1B.2C.3D.413.设N A为阿伏加德罗常数的值.下列说法正确的是()A.0.1mol溴苯中含有双键的数目为0.3N AB.0.1mol/L醋酸溶液中含有醋酸分子的数目为0.1N AC.5.6g Fe与足量的水蒸气完全反应,转移电子的数目为0.2N AD.标准状况下,11.2L由H2和CO组成的混合气体中含有分子的数目为0.5N A14.下列所得溶液的物质的量浓度等于0.1mol•L-1的是()A.将0.1mol氨充分溶解在1L水中B.将10g质量分数为98%的硫酸与990g水混合C.将8g三氧化硫溶于水并配成1L溶液D.将0.1mol氧化钠溶于水并配成1L溶液15.下列溶液中,跟100mL0.5mol/L NaCl溶液所含的Cl-物质的量浓度相同的是()A.100mL0.5mol/L MgCl2溶液B.200mL0.25mol/L AlCl3溶液C.50mL1mol/L NaCl溶液D.25mL0.5mol/L HCl溶液16.在0.5L溶液里含有0.1mol NaCl和0.2mol MgCl2,则此溶液中氯离子的物质的量浓度是()A.1mol•L-1B.0.5mol•L-1C.0.3mol•L-1D.0.6mol•L-117.与30mL1mol/L的MgCl2溶液中Cl-浓度相同的是()A.150mL0.2mol/LFeCl2溶液B.90mL2mol/LNaCl溶液C.60mL1mol/LAlCl3溶液D.30mL0.5mol/LCaCl2溶液18.同温同压下,A容器中H2和B容器中NH3所含氢原子数相等,则两个容器的体积比是()A.3:2B.1:3C.2:3D.1:219.下列有关概念的说法正确的是()A.阿伏伽德罗常数就是6.02×1023mol-1B.摩尔质量就是1mol物质的质量C.物质的量是衡量物质所含一定数目微观粒子集合体的物理量D.物质的量的单位--摩尔只适用于微观粒子分子、原子和离子20.标准状况下,将V L A气体(摩尔质量为Mg/mol)溶于0.1L水(密度1g/cm3)中,所得溶液的密度为dg/mL,则此溶液的物质的量浓度(mol/L)为()A.B.C.D.二.填空题(每题2分,共14分)21.物质的量的单位是______,1mol任何粒子的粒子数叫做阿伏加德罗常数,符号为N A,N A约等于______mol-1.22.从一个关系量的单位,我们可以得出该量的计算公式,如:从摩尔质量的单位:g•mol-1,可得出分子应当是质量、分母应当是物质的量,因此摩尔质量的计算公式为M=m/n,以此类推,物质的量浓度单位是______,其计算公式c=______;由微粒个数与物质的量的关系推出阿佛加德罗常数的公式N A=______;气体摩尔体积的单位是______,其计算公式是V m=______.23.(1)下列各物质中①0.5mol氨气;②标准状况下33.6L氦气;③18.0g水,所含原子个数由大到小的顺序为______.(2)常温常压下,同体积的CO、CO2分子个数比______,氧原子个数比______,质量之比______,电子数之比______.24.标准状况下,气体的摩尔体积都是22.4L______(判断对错)25.NH3的摩尔质量为______g/mol,lmol NH3的质量为______g.26.判断下列说法是否正确.(1)从1L1mol•L-1的NaCl溶液中取出100mL溶液,其物质的量浓度为0.01mol•L-1.______(2)将80g NaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol•L-1.______(3)1L1mol•L-1的NaCl溶液和1L1mol•L-1的蔗糖溶液,所含溶质的物质的量相等.______(4)1mol•L-1Na2SO4溶液中含有Na+2N A(N A表示阿伏加德罗常数)______(5)用浓硫酸配制时要洗涤量取浓硫酸后的量筒2-3次并将洗涤液转移到容量瓶中.______(6)配制一定物质的量浓度的溶液时,所用容量瓶未干燥则导致所配溶液浓度偏低.______(7)用浓硫酸配制时要洗涤量取浓硫酸后的量筒2-3次并将洗涤液转移到容量瓶中.______.27.下列溶液中,c(Cl-)的从大到小的顺序为______(用字母填写)A.20mL0.5mol/L AlCl3溶液B.30mL1mol/L KCl溶液C.7.5mL2mol/L MgCl2溶液D.10mL3mol/L NaCl溶液.三.简答题(共26分)28.(9分)(1)在500mL0.2mol/L Na2SO4中含有Na+数目约为______个,从中取出10mL,取出的Na2SO4溶液物质的量浓度为______mol/L,其中SO42-的物质的量为______mol,若将这10mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为______mol/L.(2)现有标准状况下V L某气体,它由双原子分子构成,它的摩尔质量为M g•mol-l.若阿伏加德罗常数用N A表示,则:①该气体所含原子总数为______个.②该气体完全溶于1L水后(不与水反应),所得溶液的密度为d g/cm3,其溶质的物质的量浓度为______mol/L.29.(9分)常温下,在27.5g水中溶解12.5g CuSO4•5H2O,恰好达到饱和,该溶液密度为1.21g/cm3.求:(1)该溶液中阴阳离子的总物质的量;(2)该溶液中CuSO4的物质的量浓度;(3)取出20.0mL该溶液,配成浓度为1.00mol/L的稀溶液,则稀释后溶液的体积是多少毫升?(计算结果保留3位有效数字)30.(8分)把11.2升(标准状况下)HCl气体溶于水,配制成250mL的溶液,计算:(要求有过程)(1)该溶液中HCl的物质的量浓度.(2)若将该溶液与足量的锌反应,在标准状况下能生成氢气多少升?参考答案一.单选题(共__小题)1.如果a g某气体中含有该气体的分子数为b,则c g该气体在标准状况下的体积是(各选项中N A为阿伏加德罗常数)()A.B.C.D.答案:A解析:解:由n=可知,同种的气体的质量与分子数成正比,ag某气体中含有的分子数为b,则cg该气体的分子数为,由N=n×N A可知,气体的物质的量为,则在标准状况下占有的体积应为L,故选A.2.下列叙述正确的是()A.NaCl的摩尔质量是58.5gB.1mol NaCl的质量是58.5g•mol-1C.58.5g NaCl所含Na+和Cl-共1molD.含1mol NaCl的溶液中约含有6.02×1023个Cl-答案:D解析:解:A、NaCl的摩尔质量是58.5 g/mol,故A错误;B、1 mol NaCl的质量是58.5 g,故B错误;C、58.5 g NaCl物质的量为1mol,所含Na+和Cl-各1mol,故2mol,故C错误;D、含1 mol NaCl的溶液中含有Cl-物质的量为1mol,约含有6.02×1023个Cl-;故D正确;故选D.3.摩尔是以下哪一个物理量的单位()A.摩尔质量B.物质的量C.质量D.物质的量浓度答案:B解析:解:A、摩尔质量是单位物质的量的物质所含有的质量,单位是g/mol或Kg/mol,故A错.B、物质的量表示含有一定数目粒子的集体,是七个基本物理量之一,单位是mol,故B正确.C、质量:物体含有物质的多少叫质量.质量不随物体形状、状态、空间位置的改变而改变,是物质的基本属性,通常用m表示.在国际单位制中质量的单位是千克,即kg,故C错.D、物质的量浓度:以单位体积溶液里所含溶质的物质的量来表示溶液组成的物理量,叫做溶质的物质的量浓度,单位是mol/L或mol/m3,故D错.故选B.4.下列溶液中,与100mL0.5mol/L NaCl溶液所含的Cl-的物质的量浓度相同的是()A.200mL0.25mol/L CaCl2溶液B.200mL0.25mol/L HCl溶液C.50mL1mol/L NaCl溶液D.100mL0.5mol/L MgCl2溶液答案:A解析:解:100ml 0.5mol/L NaCl中Cl-物质的量浓度为0.5mol/L,A.200 mL 0.25mol/L CaCl2溶液溶液中氯离子的物质的量浓度0.25 mol/L×2=0.5mol/L,故A 正确;B.200 mL 0.25mol/L HCl溶液溶液中氯离子的物质的量浓度为0.25 mol/L,故B错误;C.50 mL 1mol/L NaCl溶液溶液中氯离子的物质的量浓度为1mol/,故C错误;D.100 mL 0.5mol/L MgCl2溶液溶液中氯离子的物质的量浓度为0.5 mol/L×2=1mol/L,故D 错误.故选A.5.有一空瓶的质量为W1g,该瓶充入空气后质量为W2g,相同条件下,充入某单质气体,其质量为W3g,则此单质气体的摩尔质量为()A.B.C./mol D.g/mol答案:C解析:解:有一空瓶的质量为W1g,向该瓶充入空气后的质量为W2g,则空气质量为(W2-W1)g,空气的物质的量为=mol,相同条件下体积之比等于物质的量之比,所以该气体的物质的量为mol,相同条件下充入该气体,其质量为W3g,则该气体质量为(W3-W1)g.所以该气体的摩尔质量为=g/mol.故选:C.6.标准状况下,VLHCl气体溶解在amL水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为cmol/L,下列表达正确的是()A.溶质的质量分数ω=*100%B.溶质的物质的量浓度c=C.溶液的密度ρ=D.取题中所述溶液10mL,再加入等体积水后,所得溶液的质量分数等于0.5ω答案:C解析:解:A.溶质的质量分数ω==×100%,故A错误;B.该氯化氢溶液的物质的量浓度为:c==,故B错误;C.VLHCl气体的物质的量为=mol,HCl质量为mol×36.5g/mol=g,amL水中(水的密度近似为1g/mL)的质量为amL×1g/mL=ag,故溶液质量为(+a)g,溶液体积为=L,溶质的质量分数ω==×100%,所以溶液的密度为ρ=,故C正确;D.水的密度比盐酸的密度小,相等体积的盐酸与水,水的质量小,等体积混合后溶液的质量小于原盐酸的2倍,溶液中氯化氢的质量相同,等体积混合所得溶液溶质的质量分数大于0.5w,故D错误;故选C.7.在标准状况下,与12gH2的体积相等的O2的()A.质量为12g B.物质的量为6molC.体积为22.4L D.物质的量是12mol答案:B解析:解:标准状况下V m=22.4L/mol,n(H2)==6mol,则在标准状况下,与12gH2的体积相等的O2的量为6mol,则A.n(O2)=6mol,m(O2)=6mol×32g/mol=192g,故A错误;B.根据V=n•V m可知,同温同压下,相同物质的量的气体的体积相同,在标准状况下,与12g H2的体积相等的O2的物质的量为6mol,故B正确;C.n(O2)=6mol,则V(O2)=6mol×22.4L/mol=134.4L,故C错误;D.标准状况下,氢气与氧气的体积相同,则物质的量相同,即n(O2)=n(H2)=6mol,故D错误.故选:B.8.下列说法正确的是()A.Na和NaCl灼烧时,它们的焰色反应分别是黄色和无色B.在2Al+2H2O+2NaOH=2NaAlO2+3H2#中,氧化剂是H2O和NaOHC.H2和Cl2只有在点燃条件下才可以反应D.在标准状况下,1mol H2和O2混合气体,所占的体积约是22.4L答案:D解析:解:A、Na和NaCl灼烧时,它们的焰色反应均为黄色,故A错误;B、Al与氢氧化钠溶液反应实际为:2Al+2NaOH+6H2O=2NaAlO2+3H2↑+4H2O,2Al6H2O,因此氧化剂是H2O,故B错误;C、H2和Cl2在光照条件下也可发生反应生成HCl,故C错误;D、标准状况下,体积摩尔体积为22.4L/mol,1mol H2和O2混合气体,所占的体积V=1 mol ×22.4L/mol=22.4L,故D正确;故选D.9.500m L1mol•L-1某溶液中,所含溶质的质量为20g,则该溶质的摩尔质量为()A.20g•mol-1B.30g•mol-1C.40g•mol-1D.60g•mol-1答案:C解析:解:500m L1mol•L-1某溶液中,溶质的物质的量n=1mol•L-1×0.5L=0.5mol,又知所含溶质的质量为20g,则该溶质的摩尔质量M===40g•mol-1,故选C.10.物理量是量度物理属性或描述物体运动状态及其变化过程的量.下列名词中,哪个名词不属于物理量()A.长度B.质量C.摩尔D.时间答案:C解析:解:A、时间是物理量,故A正确.B、质量是物理量,故正确C、摩尔是物质的量的单位不是物理量,故错.D、时间是物理量,故正确故选:C11.N A代表阿伏加德罗常数,下列说法正确的是()A.在同温同压下,相同体积的任何气体单质所含的原子数相等B.2g氢气所含原子数为N AC.在常温常压下,11.2LN2所含原子数为N AD.17gNH3所含电子数为10N A答案:D解析:解:A、同温同压下,相同体积的任何气体都具有相同的分子数,但分子中的原子数可能不同,如氧气、臭氧等,故A错误;B、氢气的物质的量为=1mol,则原子数为1mol×2×N A=2N A,故B错误;C、在常温常压下,Vm≠22.4L/mol,则Vm未知,无法计算,故C错误;D、氨气的物质的量为=1mol,电子数为1mol×(7+1×3)×N A=10N A,故D正确;故选D.12.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与2.24LO2(标准状况)混合后通入水中,气体恰好完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入100molNaOH溶液至Cu2+恰好沉淀完全,所用NaOH溶液的浓度是()mol •L-1.A.1B.2C.3D.4答案:D解析:解:2.24O2的物质的量为=0.1mol,NO2、N2O4、NO的混合气体与2.24L O2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸,根据电子转移守恒,Cu提供的电子物质的量等于氧气获得电子的物质的量,故Cu2+的物质的量==0.2mol,Cu2+恰好与氢氧根离子恰好反应生成Cu(OH)2,故n(NaOH)=2n(Cu2+)=0.2mol×2=0.4mol,故需要氢氧化钠溶液的体积为=4mol/L,故选D.13.设N A为阿伏加德罗常数的值.下列说法正确的是()A.0.1mol溴苯中含有双键的数目为0.3N AB.0.1mol/L醋酸溶液中含有醋酸分子的数目为0.1N AC.5.6g Fe与足量的水蒸气完全反应,转移电子的数目为0.2N AD.标准状况下,11.2L由H2和CO组成的混合气体中含有分子的数目为0.5N A答案:D解析:解:A.苯环中的碳碳键为一种独特键,所以溴苯中不存在碳碳双键,故A错误;B.没有告诉醋酸溶液的体积,无法计算溶液中含有醋酸的物质的量及数目,故B错误;C.5.6g铁的物质的量为0.1mol,铁与水蒸气反应生成四氧化三铁,四氧化三铁中铁元素的平均化合价为+,则0.1mol铁完全反应失去电子不是0.2mol,故C错误;D.标况下11.2L由H2和CO组成的混合气体的物质的量为0.5mol,0.5mol混合气体中含有分子的数目为0.5N A,故D正确;故选D.14.下列所得溶液的物质的量浓度等于0.1mol•L-1的是()A.将0.1mol氨充分溶解在1L水中B.将10g质量分数为98%的硫酸与990g水混合C.将8g三氧化硫溶于水并配成1L溶液D.将0.1mol氧化钠溶于水并配成1L溶液答案:C解:A、将0.1mol氨气充分溶解在1L水中,溶液体积不是1L,所以浓度不是0.1mol•L-1,故A错误;B、将10g质量分数为98%的硫酸与990g水混合,所得溶液中含有硫酸9.8g,物质的量为0.1mol,溶液质量为1000g,但是硫酸溶液的密度大于1g/mL,溶液的体积小于1L,所以溶液的物质的量浓度大于0.1mol/L,故B错误;C、8g三氧化硫物质的量为:=0.1mol,溶于水并配成1L溶液,溶液浓度为0.1mol/L,故C正确;D、0.1mol氧化钾与水反应生成了0.2mol氢氧化钾,配成1L溶液后的浓度为0.2mol/L,故D错误;故选C.15.下列溶液中,跟100mL0.5mol/L NaCl溶液所含的Cl-物质的量浓度相同的是()A.100mL0.5mol/L MgCl2溶液B.200mL0.25mol/L AlCl3溶液C.50mL1mol/L NaCl溶液D.25mL0.5mol/L HCl溶液答案:D解析:解:100mL 0.5mol/L NaCl溶液中Cl-物质的量浓度为0.5mol/L×1=0.5mol/LA、100 mL 0.5 mol/L MgCl2溶液中Cl-物质的量浓度为0.5mol/L×2=1mol/L,故A错误;B、200 mL 0.25 mol/L AlCl3溶液中Cl-物质的量浓度为0.25mol/L×3=0.75mol/L,故B错误;C、50 mL 1mol/L NaCl溶液中Cl-物质的量浓度为1mol/L×1=1mol/L,故C错误;D、25 mL 0.5 mol/L HCl溶液中Cl-物质的量浓度为0.5 mol/L×1=0.5mol/L,故D正确;故选:D.16.在0.5L溶液里含有0.1mol NaCl和0.2mol MgCl2,则此溶液中氯离子的物质的量浓度是()A.1mol•L-1B.0.5mol•L-1C.0.3mol•L-1D.0.6mol•L-1解析:解:0.1mol NaCl中含有0.1mol氯离子,0.2mol MgCl2中含有0.4mol氯离子,则此溶液中氯离子的物质的量浓度是=1 mol•L-1,故选:A.17.与30mL1mol/L的MgCl2溶液中Cl-浓度相同的是()A.150mL0.2mol/LFeCl2溶液B.90mL2mol/LNaCl溶液C.60mL1mol/LAlCl3溶液D.30mL0.5mol/LCaCl2溶液答案:B解析:解:1mol/L的MgCl2溶液中Cl-浓度为2mol/L,A、150mL0.2mol/L FeCl2溶液中Cl-浓度为:0.2mol/L×2=0.4mol/L,故A错误;B、90mL2mol/L NaCl溶液中Cl-浓度为:2mol/L×1=2mol/L,故B正确;C、60mL1mol/LAlCl3溶液中Cl-浓度为:1mol/L×3=3mol/L,故C错误;D、30mL0.5mol/L CaCl2溶液中Cl-浓度为:0.5mol/L×2=1mol/L,故D错误;故选B.18.同温同压下,A容器中H2和B容器中NH3所含氢原子数相等,则两个容器的体积比是()A.3:2B.1:3C.2:3D.1:2答案:A解析:解:在相同条件下,气体的V m相等,根据分子中含有的H原子个数可知分子数之比为3:2,由n=n==可知,气体的分子数之比等于体积之比,则体积比为3:2,故选A.19.下列有关概念的说法正确的是()A.阿伏伽德罗常数就是6.02×1023mol-1B.摩尔质量就是1mol物质的质量C.物质的量是衡量物质所含一定数目微观粒子集合体的物理量D.物质的量的单位--摩尔只适用于微观粒子分子、原子和离子答案:C解析:解:A.6.02×1023mol-1为阿伏加德罗常数近似值,故A错误;B.1 mol物质的质量的单位为g,而该物质的摩尔质量的单位为g/mol,二者单位不同,故B错误;C.物质的量是一个物理量,它表示含有一定数目粒子的集体,故C正确;D.摩尔可适用于微观粒子包括:原子、分子、离子、电子、质子、中子等,故D错误.故选C.20.标准状况下,将V L A气体(摩尔质量为Mg/mol)溶于0.1L水(密度1g/cm3)中,所得溶液的密度为dg/mL,则此溶液的物质的量浓度(mol/L)为()A.B.C.D.答案:B解析:解:标准状况下,气体的物质的量为=mol,该气体的质量为:mol×M g•mol-1=g,0.1L水的质量为:100mL×1g/mL=100g,则溶液的质量为:g+100g,所以该溶液的体积为:=L,则该溶液的物质的量浓度为:c===mol/L,故选B.二.填空题(共__小题)21.物质的量的单位是______,1mol任何粒子的粒子数叫做阿伏加德罗常数,符号为N A,N A约等于______mol-1.答案:mol6.02×1023解析:解:摩尔是物质的量的单位,1mol任何粒子的粒子数叫做阿伏加德罗常数.通常使用6.02×1023mol-1这个近似值,故答案为:mol;6.02×1023.22.从一个关系量的单位,我们可以得出该量的计算公式,如:从摩尔质量的单位:g•mol-1,可得出分子应当是质量、分母应当是物质的量,因此摩尔质量的计算公式为M=m/n,以此类推,物质的量浓度单位是______,其计算公式c=______;由微粒个数与物质的量的关系推出阿佛加德罗常数的公式N A=______;气体摩尔体积的单位是______,其计算公式是V m=______.答案:mol•L-1L•mol-1解析:解:根据物质的量浓度单位为mol•L-1,可得出分子应当是物质的量、分母应当是体积,因此物质的量浓度的计算公式为c=;阿佛加德罗常数的单位为mol-1,可得出分子应当是个数、分母应当是物质的量,因此物质的量浓度的计算公式为N A=;气体摩尔体积的单位是L•mol-1,可得出分子应当是体积、分母应当是物质的量,因此物质的量浓度的计算公式为V m=;故答案为:mol•L-1;;;L•mol-1;.23.(1)下列各物质中①0.5mol氨气;②标准状况下33.6L氦气;③18.0g水,所含原子个数由大到小的顺序为______.(2)常温常压下,同体积的CO、CO2分子个数比______,氧原子个数比______,质量之比______,电子数之比______.答案:③①②1:11:27:117:11解析:解:(1)0.5mol氨气含有的原子数=0.5mol×N A×4=2N A,标准状况下33.6L氦气含有的原子数=N A×1=1.5N A,18.0g水含有的原子数==3N A,所以所含原子个数由大到小的顺序为③①②,故答案为:③①②;(2)同温同压下,同体积的气体所含分子数相等,且其物质的量相等,所以同体积的CO、CO2分子个数比1:1,一个一氧化碳分子中含有1个氧原子,一个二氧化碳分子中含有2个氧原子,所以氧原子个数之比是1:2,一氧化碳的摩尔质量是28g/mol,二氧化碳的摩尔质量是44g/mol,所以一氧化碳和二氧化碳的质量之比是28:44=7:11,一个一氧化碳分子中14,二氧化碳分子中含有22,所以含有电子数之比是14:22=7:11;故答案为:1:1;1:2;7:11;7:11.24.标准状况下,气体的摩尔体积都是22.4L______(判断对错)答案:×解:标准状况下,1mol气体的体积为22.4L,气体的摩尔体积是22.4L/mol,故答案为:×.25.NH3的摩尔质量为______g/mol,lmol NH3的质量为______g.答案:1717解析:解:氨气的化学式为:NH3;相对分子质量为:14+1×3=17,摩尔质量在数值上和相对分子质量相等,单位为g/mol,所以摩尔质量是17g/mol;lmol NH3的质量m=n×M=lmol×17g/mol=17g,故答案为:17;17.26.判断下列说法是否正确.(1)从1L1mol•L-1的NaCl溶液中取出100mL溶液,其物质的量浓度为0.01mol•L-1.______(2)将80g NaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol•L-1.______(3)1L1mol•L-1的NaCl溶液和1L1mol•L-1的蔗糖溶液,所含溶质的物质的量相等.______(4)1mol•L-1Na2SO4溶液中含有Na+2N A(N A表示阿伏加德罗常数)______(5)用浓硫酸配制时要洗涤量取浓硫酸后的量筒2-3次并将洗涤液转移到容量瓶中.______(6)配制一定物质的量浓度的溶液时,所用容量瓶未干燥则导致所配溶液浓度偏低.______(7)用浓硫酸配制时要洗涤量取浓硫酸后的量筒2-3次并将洗涤液转移到容量瓶中.______.答案:××√××××解:(1)从1L 1mol•L-1的NaCl溶液中取出100mL溶液,其物质的量浓度不变;(2)将80g NaOH溶于1L水中,溶液的体积大于1L,所得溶液中NaOH的物质的量浓度小于2mol•L-1;(3)1L 1mol•L-1的NaCl溶液和1L 1mol•L-1的蔗糖溶液,所含溶质的物质的量都为1mol;(4)没有溶液的体积,无法求1mol•L-1Na2SO4溶液中含有得Na+;(5)用浓硫酸配制稀硫酸,不需要洗涤量筒;(6)配制一定物质的量浓度的溶液时,所用容量瓶未干燥不会造成误差;(7)用浓硫酸配制稀硫酸,不需要洗涤量筒;故答案为:(1)×(2)×(3)√(4)×(5)×(6)×(7)×.27.下列溶液中,c(Cl-)的从大到小的顺序为______(用字母填写)A.20mL0.5mol/L AlCl3溶液B.30mL1mol/L KCl溶液C.7.5mL2mol/L MgCl2溶液D.10mL3mol/L NaCl溶液.答案:C>D>A>B解析:解:A、20mL0.5mol/L AlCl3溶液中氯离子的浓度为0.5mol/L×3=1.5mol/L;B、30mL1mol/L KCl溶液中氯离子的浓度为1mol/L×1=1mol/L;C、7.5mL2mol/L MgCl2溶液中氯离子的浓度为2mol/L×2=4mol/L;D、10mL3mol/L NaCl溶液中氯离子的浓度为3mol/L;所以溶液中Cl-浓度由大到小的顺序是C>D>A>B,故答案为:C>D>A>B.三.简答题(共__小题)28.(1)在500mL0.2mol/L Na2SO4中含有Na+数目约为______个,从中取出10mL,取出的Na2SO4溶液物质的量浓度为______mol/L,其中SO42-的物质的量为______mol,若将这10mL 溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为______mol/L.(2)现有标准状况下V L某气体,它由双原子分子构成,它的摩尔质量为M g•mol-l.若阿伏加德罗常数用N A表示,则:①该气体所含原子总数为______个.②该气体完全溶于1L水后(不与水反应),所得溶液的密度为d g/cm3,其溶质的物质的量浓度为______mol/L.答案:解:(1)在0.5L0.2mol/L Na2SO4中含有Na+的物质的量为0.5L×0.2mol/L=0.2mol,含有0.2N A 个钠离子;从中取出10mL,取出的Na2SO4溶液物质的量浓度不变,仍为0.2mol/L,其中SO42-的物质的量为:0.2mol/L×0.01L=0.002mol;若将这10mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为0.2mol/L××2=0.04mol/L,故答案为:0.2N A;0.2;0.002;0.04;(2)①标况下VL该气体的物质的量为:n==mol,该气体为双原子分子,含有原子的物质的量为:mol×2=mol,含有的原子数为:N=×N A=,故答案为:;②mol该气体的质量为:m=nM=M g•mol-l×mol=g,气体溶于1L水中,所带溶液的质量为:1000g+=g,形成溶液的质量分数为:=,该溶液的物质的量浓度为:c==mol/L=mol/L,故答案为:mol/L.29.常温下,在27.5g水中溶解12.5g CuSO4•5H2O,恰好达到饱和,该溶液密度为1.21g/cm3.求:(1)该溶液中阴阳离子的总物质的量;(2)该溶液中CuSO4的物质的量浓度;(3)取出20.0mL该溶液,配成浓度为1.00mol/L的稀溶液,则稀释后溶液的体积是多少毫升?(计算结果保留3位有效数字)答案:解:(1)12.5g CuSO4•5H2O的物质的量为:=0.05mol,电离产生的Cu2+和SO42-均为0.050mol,故阴阳离子的总物质的量为0.050mol+0.050mol=0.1mol,答:阴阳离子的总物质的量为0.1mol;(2)溶液的体积为:=0.0331L,故CuSO4的物质的量浓度为:=1.51mol/L,答:CuSO4的物质的量浓度为1.51mol/L;(3)取出溶液中含溶质硫酸铜的物质的量为:1.51mol/L×0.02L=0.0302mol,故稀释后溶液的体积为:=0.0302L=30.2mL,答:稀释后溶液的体积是30.2mL.30.把11.2升(标准状况下)HCl气体溶于水,配制成250mL的溶液,计算:(要求有过程)(1)该溶液中HCl的物质的量浓度.(2)若将该溶液与足量的锌反应,在标准状况下能生成氢气多少升?答案:解:(1)n==0.5mol,C==答:该溶液中HCl的物质的量浓度为2mol/L.(2)盐酸和锌反应生成氢气,设生成标况下H2的体积为x,根据氢原子守恒得氯化氢与氢气之间的关系式为2HCl----H2↑2mol22.4L0.5mol x所以x=5.6L答:若将该溶液与足量的锌反应,在标准状况下能生成氢气5.6L.下能生成氢气5.6L.。
(完整word版)高一物质的量、阿伏伽德罗常数练习题及答案(3).docx

物质的量练习题1.下列叙述中,正确的是()A. 12g 碳所含的原子数就是阿伏加德罗常数B.阿伏加德罗常数没有单位C.“物质的量”指物质的质量D.摩尔表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒2.下列说法正确的是()A.1 molH 2的质量是 1 gB.1 mol HCl的质量是- 1 36.5 g · molC.Cl 2的摩尔质量等于它的相对分子质量D. 硫酸根离子的摩尔质量是 96 g · mol -13.下列说法错误的是()A.1 mol 氢B.1 mol OC.1 mol二氧化碳D.1 mol 水4.下列各组物质中,含原子数最多的是()A. 0.4 mol NH 3B.4℃时 5.4 mL 水C. 10 g 氖气D. 6.02 × 1023 个硫酸分子5.铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯。
如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1mg。
那么一个铅笔字含有的碳原子数约为()A. 2.5 × 1019个B. 2.5 × 1022个C. 5× 1019个D. 5 × 1022个6.下列说法错误的是()A.6.02 × 1023是阿伏加德罗常数的近似值B.1 mol12C 的质量是 12 gC. 含有阿伏加德罗常数个粒子的物质就是 1 molD.1 mol O 2含有 6.02 ×1023个氧原子7.下列物质里含氢原子数最多的是()A. 1 mol H 2B. 0.5molNH3C. 6.02 × 1023个的 CH 分子 D . 0.3molH 3PO448. 0.1 mol NaHCO 3中含有()A. 0.2 mol Na+ B . 0.05 mol CO32C. 6.02 × 1023个 OD . 0.1 mol H 9. 1g O 2和 1g O3相比,下列表述正确的是()A.所含分子数相同B.所含原子数相同C.所含原子数不同D. 1g O3中所含分子数较多10. 2.16 g X O 中含有 0.1 molO ,则 X 的相对原子质量为()25A.21.6B.28C.14D.3111.某气体物质质量为 6.4 g ,含有 6.02 × 1022个分子,则该气体的相对分子质量为(A. 64B. 32C.96D. 3212.如果 1g 水中含有 n 个氢原子,则阿伏加德罗常数是()A. 1/n mol- 1B. 9n mol -1C. 2n mol -1D. n mol-113.① 1molH O约含个 H O;22②1molO 约含个 e- ;③2molH+约含个 H+;④ 3 × 6.02 × 1023个电子的物质的量是mol e- ;⑤1.204 × 1024个水分子的物质的量为mol。
2020年高考最新模拟专题汇编 考点02 物质的量与阿伏加德罗常数

考点02 物质的量与阿伏加德罗常数1.(2020·湖湘名校高三线上自主联合检测)设阿伏加德罗常数的数值为N A,下列说法正确的是( ) A.1L 1 mol·L-1的NaHCO3溶液中含有的离子数为3N AB.22.4 L的CO2与过量Na2O2充分反应转移的电子数为N AC.常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3N AD.常温常压下,14g由N2与CO组成的混合气体含有的原子数目为N A【答案】D【解析】A项,HCO3-不能完全电离,部分发生水解,因此1L、1 mol·L-1的NaHCO3溶液中含有的离子数小于3N A,故A错误;B项,未注明气体的状况,无法确定气体的物质的量,故B错误;C项,铝片遇到冷的浓硫酸会钝化,铝失去的电子数小于0.3N A,故C错误;D项,氮气和一氧化碳的摩尔质量都是28g/mol,都是双原子分子,14g由N2与CO组成的混合气体的物质的量为:14g28g/mol=0.5mol,含有1mol原子,含有的原子数目为N A,故D正确;故选D。
2.(2020·长沙一中长郡中学师大附中雅礼中学高三四校(线上)联考)设N A为阿伏加德罗常数的值,下列说法正确的是( )A.14.0gFe发生吸氧腐蚀生成Fe2O3·xH2O,电极反应转移的电子数为0.5N AB.标准状况下,11.2LH2S溶于水,溶液中含硫粒子的数目大于0.5N AC.常温下,0.5LpH=14Ba(OH)2溶液中Ba2+的数目为0.5N AD.分子式为C2H6O的某种有机物4.6g,含有C-H键的数目一定为0.5N A【答案】A【解析】A项,14.0gFe的物质的量为,Fe发生吸氧腐蚀的负极反应式为Fe-2e-= Fe2+,则电极反应转移的电子数为0.25mol×2N A=0.5N A,A项正确;B项,标况下,H2S为气体,11.2 LH2S气体为0.5mol,H2S溶于水,电离产生HS-和S2-,根据S元素守恒可知,含硫微粒共0.5N A,B项错误;C项,常温下,pH=14的Ba(OH)2溶液中氢氧根离子的浓度为1mol/L,则Ba2+的浓度为0.5mol/L,则Ba2+的数目为0.5mol/L×0.5L N A=0.25N A,C项错误;D项,C2H6O的摩尔质量为46g/mol,4.6gC2H6O的物质的量为0.1mol,分子式为C2H6O的有机物,可能为CH3CH2OH,也可能为CH3OCH3,则含有C-H键的数目可能为0.5N A,也可能0.6N A,D项错误;故选A。
2019年高三化学二轮复习题型专练02阿伏加德罗常数含解析 4 (2)

题型专练02 阿伏加德罗常数1. 设N A为阿伏加德罗常数的值, 下列叙述正确的是A.标准状况下, 2.24LH2O和H2O2混合物中所含氢原子数为0.2N AB.0.1 mol·L-1的CH3COONa溶液中含有CH3COO-数小于0.1N AC.23gC2H6O含有的共价键数一定为4N AD.化学反应中生成1molO2, 转移的电子数一定为4N A【答案】C2. 设N A为阿伏加德罗常数的值, 下列叙述正确的是()A.25℃, pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3N AB.标况下, 22.4LNO与11.2LO2混合后气体的分子数小于N AC.标准状况下, 22.4L己烷中共价键数目为19N AD.常温常压下, 将0.1molFe投入足量的浓硝酸中, 转移的电子数为0.3 N A【答案】B【解析】A、25℃, pH=11的Na2CO3溶液中存在离子积常数, c(H+)=10-11mol/L;c(H+)×c(oH-) =10-14 ;由水电离出的[H+]=[OH-]=10-14/10-11==10-3mol/L;溶液体积不知, 由水电离出的氢离子的数目无法计算, 故A错误;B、标准状况下, 22.4LNO和11.2L氧气的物质的量分别为1mol、0.5mol, 由2NO+O2═2NO2, 2NO2⇌N2O4, 则气体的分子总数小于N A个, 故B正确.C、标况下, 己烷为液态, 故C错误;D、铁与足量浓硝酸发生钝化现象, 所以铁不能完全反应, 故D错误。
3. 设N A为阿伏加德罗常数的值, 下列叙述正确的是A.60g二氧化硅晶体中含有N A个SiO2分子B.光照条件下, 16 gCH4 与71g Cl2反应生成的CH3Cl 分子数为N AC.1mol Li 在空气中充分燃烧生成Li2O, 转移电子数为2N AD.标准状况下, 22.4 LNO与NH3的混合气体中所含氮原子数为N A【答案】D【详解】A.二氧化硅是原子晶体, 不是分子, A错误;B.CH4 与Cl2发生反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳、氯化氢五种物质, 因此16gCH4 与71gCl2反应生成的CH3Cl分子数小于N A, B错误;C.1molLi完全反应转移电子数为N A, C错误;D.22.4LNO与NH3的混合气体为1mol,含有含氮原子数为N A, D 正确。
高考选择 阿伏伽德罗专题 (含答案解析)

阿伏伽德罗常数专练1.N A为阿伏加德罗常数的值 ,下列说法正确的是( )A.3.6gD2O中含有的中子数为2N AB.10gC2H4和4gCO组成的混合气体中含有的分子数为0.5N AC.标准状况下,2.24L HF 中含有的分子数为0.1N AD.KIO3与HI溶液反应,生成0.1molI2转移的电子数为0.2N A2.设N A为阿伏加德罗常数的值,下列说法正确的是 ( )A.标准状况下,22.4L盐酸含有N A个HCl分子B.常温常压下,7.8gNa2O2含离子数为0.4N AC.室温下向1LpH=1的醋酸溶液中加水,所得溶液中H+数目大于0.1 N AD.1mol乙酸(忽略挥发损失)与足量的 C2H518OH在浓硫酸作用下加热,充分反应可生成N A个CH3CO18OC2H53.设N A为阿伏加徳罗常数数值,下列有关叙述正确的是()A.将78gNa2O2与过量CO2反应转移的电子数为2N AB.1molN2与4molH2反应生成的NH3分子数为2N AC.标准状况下,2.24LCCl4中所含原子数为0.5N AD.标准状况下,18gD2O中所含电子数为9N A4.设N A表示阿伏伽德罗常数值。
下列说法正确的是()A.标准状况下,11.2L的甲醇所含的氢原子数等于2N AB.常温常压下,Na2O2与H2O反应生成1molO2时,转移电子数是2N AC.25℃时,Ksp(BaSO4)=1×10-10,则 BaSO4饱和溶液中 Ba2+数目为1×10-6N AD.1L 1mol/L AlCl3溶液中含有的Al3+数目为N A5.设N A为阿伏加德罗常数的值。
下列有关叙述正确的是()A.100g质量分数为46%的乙醇水溶液中氧原子数为4N AB.2.24L乙烯分子中共用电子对的数目为0.6N AC.1molCl2通入足量NaOH溶液中,转移电子数为2N AD.pH=1的H2SO4溶液中,含有H+的个数为0.1N A6.阿伏加德罗常数的值为N A。
阿伏伽德罗常数训练(附答案)

注意事项:1.物质的量是一个整体的名词,不能理解为物质的质量或物质的数量。
2.物质的量描述的是微观粒子(分子、原子、离子、原子团、质子、中子、电子等),不能用于宏观物质。
3.使用mol作单位时,应该用微粒符号化学式或者名称,名称需指明粒子种类(分子、原子,不能笼统的指示)。
4.摩尔质量在数值上等于物质的相对分子(原子)质量(Mr),但表示的意义不同,且摩尔质量是有单位的(g/mol),相对分子质量没有单位。
5.气体摩尔体积适用于一切气体,可以使单一气体,也可以是混合气体。
但是只适用于气体,不适用固体、溶液、和纯液体。
6.气体的摩尔体积(Vm)使用时应指明温度、压强,不同温度压强下的Vm是不同的。
如,标准状况(0℃、101kPa)下Vm=22.4L/mol,常温常压(25℃、101kPa)下Vm=24.5L/mol。
7.从一定物质的量浓度的溶液中取出任意体积的溶液,其浓度是相同的(溶液是均一稳定的),只是所含溶质的物质的量不同。
8.描述物质的量浓度的体积是指溶液的体积,而不是溶剂的体积。
9.物质的量浓度相同、体积相同的任何溶液,所含溶质的物质的量相同,但质量不同。
熟记常见物质的状态气体:O2、SO2、Cl2、CO2、CO、H2S等固体:常见的金属、SO3、S等液体:H2O,以及常见的有机物苯、CCl4等状态!!!标况!!!特殊!!!单位!!!阿伏伽德罗常数专题1、标准状况下,5.6 L NO和5.6 L O2混合后的分子总数为0.5 N A2、58.5 g氯化钠固体中含有N A个氯化钠分子3、在1 L 0.1 mol/L碳酸钠溶液中阴离总数大于0.1 N A(√)4、分子总数为N A的NO2和CO2混合气体中含有的氧原子数为2N A(√)5、常温常压下,92g的NO2和N2O4混合气体含有的原子数为6 N A(√)6、常温常压下,22.4L氯气与足量镁粉充分反应,转移电子数为2 N A7、标准状况下,14g氮气含有的核外电子数为5 N A8、标准状况下,22.4 L任意比的H2和Cl2混合气体中含有的分子总数为N A(√)9、标准状况下,铝跟NaOH溶液反应生成1 mol氢气时,转移的电子数为N A10、18 g H2O中含有的质子数为10 NA(√)11、46 g NO2和N2O4混合气体含有的原子总数为6 NA(√)12、1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子(√)13、1 mol硫酸钾中阴离子所带电荷数为NA14、标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移电子数为NA(√)15、将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+16、标准状况下,2.24L H2O含有的分子数等于0.1NA17、常温下,100 mL 1 mol/L Na2CO3溶液中阴离子总数大于0.1 NA(√)18、分子数为NA的CO、C2H4混合气体体积约为22.4L,质量为28 g19、1 mol Fe与足量的稀HNO3反应,转移2nA个电子20、1 L 0.1 mol/L NaHCO3溶液中含有0.1 nA个HCO3-21、常温常压下,22.4 L的NO2和CO2混合气体含有2NA个O原子22、标准状况下,33.6 L氟化氢中含有氟离子的数目为1.5 NA23、常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA(√)24、50 mL 18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子数为0.46 NA25、某密闭容器盛有0.1 molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6 NA26、1.00 molNaCl中含有NA个NaCl分子27、1.00 molNaCl中,所有Na+的最外层电子数为8NA(√)28、欲配制1.00 L 1.00 mol/L的NaCl溶液,可将58.5 gNaCl溶于1.00 L水中29、电解58.5 g熔融的NaCl,能产生22.4 LCl2, 23.0 g金属钠30、24g镁的原子最外层电子数为NA31、1L0.1mol·L-1乙酸溶液中H+数为0.1NA32、1mol甲烷分子所含质子数为10NA(√)33、标准状况下,22.4L乙醇的分子数为NA34、25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA35、标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA36、KMnO4分解生成1mol O2转移的电子数37、0.1mol F-中含有质子数38、46g NO2中的氧原子数39、1L 0.5mol/L1 Na2SO4溶液中的Na+离子数(√)40、标准状况下,含1molHCl和氢氟酸的混合物的体积约为22.4 L41、28g铁在硫蒸气气中完全反应失去电子数为1.5NA42、常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA(√)43、标准状况下,11.2 L的SO3所含分子数为0.5NA44、8g硫在氧气中完全燃烧生成的气体产物含原子数为NA45、标准状况下,22.4L NO与11.2L O2混合所得气体的分子数一定小于NA(√)46、3.2g Cu在硫蒸气中完全燃烧,转移的电子数为0.1NA。
2020届高考化学二轮复习第二部分题型2物质的量阿伏加德罗常数测试(含解析)

题型2 物质的量 阿伏加德罗常数阿伏加德罗常数的正误判断1.N A 为阿伏加德罗常数的值。
下列说法正确的是( )A .1 mol 甲醇分子中含有的共价键数为4N AB .25 ℃时,1.0 L pH =13的Ba(OH)2溶液中含有的OH -数目为0.2N AC .加热条件下,20 mL 10 mol·L -1浓硝酸与足量铜反应转移电子数为0.1N AD .7.8 g 由Na 2S 和Na 2O 2组成的混合物中含有阴离子的数目为0.1N A解析:由甲醇的结构式可知,1 mol 甲醇分子中含有的共价键数为5N A ,A 项错误;25 ℃时,1.0 L pH =13的Ba(OH)2 溶液中含有的OH -数目为0.1N A ,B 项错误;足量铜与浓硝酸发生反应:Cu +4HNO 3(浓)=====△Cu(NO 3)2+2NO 2↑+2H 2O ,随着反应进行,HNO 3不断被消耗,铜与稀硝酸发生反应:3Cu +8HNO 3(稀)=====△3Cu(NO 3)2+2NO ↑+4H 2O ,参加反应的HNO 3为20×10-3 L ×10 mol·L -1=0.2 mol ,消耗的铜的物质的量在0.05 mol ~0.075 mol 之间,则转移的电子数在0.1N A ~0.15N A 之间,C 项错误;Na 2S 和Na 2O 2的摩尔质量均为78 g·mol -1,故7.8 g 由Na 2S 和Na 2O 2组成的混合物中两者的物质的量之和为0.1 mol ,含有的阴离子数目为0.1N A ,D 项正确。
答案:D2.N A 为阿伏加德罗常数的值。
下列说法正确的是( )A .1 L pH =1的溶液中含有的H +数目为N AB .常温常压下,22.4 L CH 4含有的分子数为N AC .1 mol Na 2O 2固体中含有的离子总数为3N AD .1 mol·L -1 NaCl 溶液中含有的Cl -数目为N A解析: pH =1的溶液中c (H +)=0.1 mol·L -1,故1 L 该溶液中含有的H +数目为0.1N A ,A 项错误;常温常压下,不能用标准状况下的气体摩尔体积进行计算,B 项错误;1 mol Na 2O 2固体中含有2 mol Na +、1 mol O 2-2,含有的离子总数为3N A ,C 项正确;未给出1 mol· L -1 NaCl 溶液的体积,无法计算该溶液中含有的Cl -数目,D 项错误。
2025版高考化学一轮总复习第2章物质的量第6讲物质的量阿伏加德罗常数提能训练

第6讲物质的量阿伏加德罗常数一、选择题:本题共10小题,每小题只有一个选项符合题目要求。
1.(2024·广东佛山检测)设N A为阿伏加德罗常数的值。
下列说法正确的是( B ) A.25 ℃,1.01×105 Pa时,11.2 L O2中所含原子数目为N AB.通常条件下,14 g 14 6C中所含质子数目为6N AC.0.5 mol·L-1的FeCl3溶液中,含有Cl-的数目为1.5N AD.标准状况下,11.2 L水中含有氢原子的数目为N A[解析]25 ℃,1.01×105 Pa时,气体摩尔体积大于22.4 L·mol-1,11.2 L O2的物质的量小于0.5 mol,所含原子数目小于N A,故A错误;通常条件下,14 g 146C中含有质子数目为14 g14 g·mol-1×6N A mol-1=6N A,故B正确;没有明确溶液体积,不能计算0.5 mol·L-1的FeCl3溶液中所含Cl-数目,故C错误;标准状况下水是液体,11.2 L水的物质的量不是0.5 mol,故D错误。
2.(2024·山东济南阶段练)设N A为阿伏加德罗常数的值。
下列有关叙述正确的是( D ) A.标准状况下,2.24 L三氧化硫中所含原子数目为0.4N AB.100 g溶质质量分数为17%的H2O2水溶液中极性键数目为N AC.常温常压下,8.4 g碳酸氢钠中所含离子数目为0.3N AD.标准状况下,20 g的D2O中所含质子数目和中子数目均为10N A[解析]标准状况下三氧化硫不是气体,2.24 L三氧化硫的物质的量无法计算,故A 错误;100 g溶质质量分数为17%的H2O2溶液中,水和过氧化氢中都含有极性键,所以极性键数目大于N A,故B错误;碳酸氢钠由钠离子和碳酸氢根离子构成,8.4 g碳酸氢钠中所含离子数目为8.4 g84 g·mol-1×2×N A mol-1=0.2N A,故C错误;1个D2O分子中含有10个质子、10个中子,标准状况下,20 g的D2O中所含质子数目为20 g20 g·mol-1×10×N A mol-1=10N A,中子数目为20 g20 g·mol-1×10×N A mol-1=10N A,故D正确。
2022高中化学总复习 3物质的量阿数伏加德罗常数练习

物质的量 阿伏加德罗常数1. N A 代表阿伏加德罗常数。
下列说法中,不正确的是( )A .标准状况下,NO 和 O 2各11.2 L 混合,所得混合气体的分子总数为 N AB .25℃时, L oC 30H 62 分子中含有共价键的数目为 91 N AD .2.8g 乙烯与丙烯的混合物中含碳原子的数目为2. 设N A 表示阿伏加德罗常数,下列叙述中正确的是 :( )A .常温常压下,11.2 L 氧气所含的原子数为N AB .1.8 g 的NH 4+中含有的电子数为N AC .常温常压下,22.4L O 3含有的氧原子数为3N AD .常温常压下1 mo NO 2气体与水反应生成N A 个 3NO 离子3. 阿伏加德罗常数约为×1023mo -1,下列叙述中正确的是( )A .0.5g C 3H 4中含有共用电子对的数目为××1023B .3.0 g 淀粉和葡萄糖混合物中共含碳原子数为××10234. C .25℃时2.24L6.72L30g16g2.3 g28.6g1.6g2.24L1023o -1。
下列叙述中正确的是( )A .1.7g 的羟基(-OH )中含有的电子数为×1023B .在标准状况下,2.24L 三氧化硫中所含分子数为×1023C . mL 16 mo/L 浓硫酸与足量铜反应,生成SO 2的分子数为×1022D .2.4g 金属镁变为镁离子时失去的电子数为2××1022 5. 阿伏加德罗常数为N A ,下列说法中正确的是( )A .1.0L mo ·L -1NaAO 2溶液中含有的氧原子数为2N AB .在标准状况下,0.1mo 的CC 4中含有C —C 键的数目为C .31 g 22.4 L 3g25℃1L o 甲基中所含电子数为10 N A C 、在标准状况下,22.4L 以任意比混合的H 2S 与SO 2混合气体中所含气体分子数必小于N AD 、在标准状况下,含m moHC 的浓盐酸与足量MnO 2反应可生成 个氯气分子6. 设N A 为阿伏加德罗常数。
高考试卷试题复习物质的量及阿伏加德罗常数

定额市鞍钢阳光实验学校物质的量及阿伏加德罗常数1、摩尔是A.物质的数量单位B.表示物质的质量单位C.表示物质的量的单位D.既是物质的数量单位又是物质的质量单位2、下列叙述错误的是A.1 mol任何物质都含有约6.02×1023个原子B.0.012 kg12C 含有约6.02×1023个碳原子C.在使用摩尔表示物质的量的单位时,应用化学式指明粒子的种类D.物质的量是国际单位制中七个基本物理量之一3、下面叙述正确的是( )A.同质量的H2与Cl2相比,H2的分子数多 B. 0.5mol氢的质量是0.5gC.摩尔是用来衡量微观粒子多少的一种物理量D. 0.1molH2SO4含有氢原子数的精确值为1.204×1023 E.H2SO4的摩尔质量为98g4、下列叙述中错误的是A.H2SO4的摩尔质量是98 B.2 mol NO和2 mol NO2含原子数相同C.等质量的O2和O3中所含氧原子个数相同D.等物质的量的CO和CO2中所含碳原子数相等5、1 g O2和1 g O3中A.所含分子数相同 B.所含分子数不同C.所含原子数相同 D.1 g O3中所含分子数较多6、某元素1个原子的质量为ag,1 个12C原子质量为bg,则该元素的这种原子的相对原子质量在数值上等于: A.12a/b B. a/b C.12b/a D.a·N A7、相同质量的SO2和SO3它们之间的关系是A.所含硫原子的物质的量之比为1:1 B.氧原子的物质的量之比为3:2C.氧元素的质量比为5:6 D.硫元素的质量比为5:48、如果2 g甲烷含有x个分子,那么22 gCO2中所含分子数是A.x B.4x C.0.5x D.3x9、与8g SO3中氧原子数相同的是()A.9.8g H2SO4 B.0.1molCO2C.6.4g SO2 D.0.3mol CO10、等物质的量的钠、镁、铝与足量稀H2SO4反应生成的氢气的物质的量之比是A.1:1:1 B.1:2:3 C.3:2:1 D.6:3:211、在一定条件下,16g A恰好能跟20g B完全反应,生成C和4.5g D;若在相同条件下,将8g A和15g B反应时,则生成D和0.125mol C。
物质的量与阿伏伽德罗常数的应用练习题

一、物质的量与阿伏伽德罗常数的应用练习题一、物质的量定义1、万能公式的关系2、阿伏伽德罗常数(N A)的应用气体的体积(三态、气体标况)电子数、化学键、电子转移、弱电解质旳电离、盐旳水解)4、浓度配制(仪器、操作步骤、注事项)【例】阿伏伽德罗常数(N A)题型:1、由质量(m)、气体体积(V)、物质的量浓度(c)、物质的量(n)求粒子数(N)⑴常温常压下,22.4LO2所含的原子数为2N A()⑵1LpH=13的Ba(OH)2溶液中含有OH-数为0.2N A ()⑶1mol OH—中所含电子数为9N A()⑷1molC2H6含有共价键数为7N A ()2、由混合物的质量(m)、混合气体体积(V)求粒子数(N)⑸常温常压下,3.2g O2和O3的混合气体所含氧原子数为0.2N A ()⑹标准状况下,4.48L乙烯、丙烯的混合气体中含有的氢原子数为0.4N A()3、由物质的质量(m)、气体体积(V)求反应中转移的电子数(N)⑺标准状况下,2.24LCl2与氢氧化钠完全反应转移电子0.2N A ()⑻0.1mol Fe与0.1mol Cl2完全反应,转移电子0.3N A()⑼7.8克Na2O2与CO2完全反应,转移电子0.2N A ()⑽ 5.6g Fe投入到足量稀硝酸中,充分反应后转移电子总数为0.2N A()练习1、由质量(m)、气体体积(V)、物质的量浓度(c)、物质的量(n)求粒子数(N):1、常温常压下,22.4LO2所含的原子数为2N A2、标准状况下,8g SO3所含原子数为0.4N A3、常温常压下,1mol氦气所含原子数为N A4、标态下,11.2L三氧化硫中所含的氧原子数等于1.5N A5、标准状况下,22.4L苯完全燃烧生成CO2分子数为8N A6、常温常压下,3.2g O3所含的氧原子数为0.2N A7、常温常压下,18g H2O所含分子数为N A8、常温常压下,4.4g CO2分子中含有0.2N A个O原子9、1mol/LNaCl溶液含有N A 个Na+10、28.6g Na2CO3·10H2O含有的结晶水分子数为N A11、1mol/LNaCl溶液中,所含Na+数为N A12、18g D2O所含的电子数为10N A13、1mol —OH中所含电子数为9N A14、1molCH3+所含的电子数为8N A15、7.8gNa2O2固体中的阴离子数等于0.4N A16、1molC3H8含有共价键总数为10N A2、由混合物的质量(m)、混合气体体积(V)求粒子数(N)17、常温常压下,3.2g O2和O3的混合气体所含氧原子数为0.2N A18、标准状况下,4.48L乙烯、丙烯的混合气体中含有的碳原子数为0.6N A19、2gNO2和44g N2O4的混合气体所含原子数为3N A20、(较难)在标准状况下,22. 4L NO与11.2L O2混合后气体分子数为N A3、由物质的质量(m)、气体体积(V)求反应中转移的电子数(N)21、标准状况下,2.24L Cl2完全溶于水转移电子数为0.1N A22、标准状况下,2.24LCl2与氢氧化钠完全反应转移电子0.2N A23、5.6g Fe与足量的Cl2完全反应,转移电子0.2N A24、7.1g Cl2完全反应,转移电子一定是0.2N A25、7.8克Na2O2与CO2完全反应,转移电子0.2N A26、3.4g H2O2完全分解转移电子0.2N A27、标准状况下,6.72LNO2与H2O完全反应转移电子0.2N A28、2.3g Na在足量的O2中完全燃烧,转移电子0.2N A29、过量的Fe粉加入稀硝酸中,当有5.6gFe粉溶解时,转移的电子数为0.3N A30、5.6gFe投入到足量稀硝酸中,充分反应后转移电子总数为0.2N A4、考虑电离平衡、水解平衡、化学平衡对粒子数的影响31、1mol/LCH3COOH溶液中,所含CH3COO—小于N A32、1L0.1mol•L-1的氨水含有0.1n A个OH―33、1L1mol/LNH4Cl溶液中,所含NH4+数为N A34、1L1mol/L饱和FeCl3溶液滴入沸水中完全水解生成Fe(OH)3胶粒N A个35、1L 0.1 mol·L-1 Al2(SO4)3溶液中SO42—总数为0.3N A36、1L 1mol/L NH4NO3溶液中,所含NH4+的总数为N A37、8gNH4NO3固体中,所含NH4+的总数为0.1N A38、0.2molSO2和0.1molO2混合,一定条件下在密闭容器中反应,充分反应后SO3的分子数小于0.2N A5、考虑反应过程中溶液浓度变化对反应的影响(三大浓酸)39、0.1L 18mol/L的浓硫酸与足量铜片在加热条件下反应,能产生SO2分子数0.9N A40、足量的MnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1N A。
【高考复习】高考化学复习阿伏伽德罗常数专题练习(带答案)

【高考复习】高考化学复习阿伏伽德罗常数专题练习(带答案)阿伏加德罗常量旧称阿伏伽德罗常数,为热学常量,符号na。
以下是阿伏伽德罗常数专题练习,请考生注意做题质量。
1.(2022年广东省)设定为阿伏伽德罗常数的值。
下面的说法是正确的a.16g中含有4个c-h键b、 1mol溶液含有c.1molcu和足量稀硝酸反应产生个no分子d、在正常温度和压力下,22.4l含有分子2.(广东)设na为阿伏伽德罗常数的数值,下列说法正确的是a、在室温下,23gno2含有钠氧原子b.1l0.1moll-1的氨水含有0.1na个oh―c、在常温常压下,22.4 LCCL 4含有NaCl 4分子d.1molfe2+与足量的h2o2溶液反应,转移2na个电子3.(广东)设na为阿伏伽德罗常数的值。
下面的说法是正确的a.常温下,4gch4含na个ch共价键b、 1mol Fe与足够稀的HNO 3反应以转移2Na电子c.1l0.1mol/lnahco3溶液中含有0.1na个hco3d、在常温常压下,22.4l的no 2和CO 2混合气体中含有2Na O原子4.(广东)设na为阿伏加德罗常数的数值,下列说法正确的是a、在常温常压下,8go2含有4na电子b.1l0.1moll-1的氨水中有na个nh4+c、在标准条件下,22.4l盐酸含有盐酸钠分子d.1molna被完全氧化生成na2o2,失去个2na电子5.(广东)将Na设为阿伏伽德罗常数的值,以下陈述是正确的()a.1mol甲苯含有6na个c-h键b、 18gh 2O含有10个钠质子c.标准状况下,22.4l氨水含有na个nh3分子d、将56g铁片放入足够浓的硫酸中,形成Na SO 2分子.设a为阿伏加德罗常数的数值,下列说法正确的是().1l0。
1mol-1含有0.1A+b.常温常压下,1gh2o含有a个电子c、 1 mol Cu与足量Na D反应。
在室温和压力下,1 mol CO含有亚硝酸根.设a为阿伏加德罗常数的数值,下列说法正确的是()a、 3 MolNO 2与水充分反应并传递电子b.常温常压下,18gh2o含有3a个原子c、 1l0。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
题型二物质的量阿伏伽德罗常数高考真题1.(2016课标Ⅰ)设N A为阿伏加德罗常数值。
下列有关叙述正确的是( )A.14g乙烯和丙烯混合气体中的氢原子数为2N AB.1 mol N2与4 mol H2反应生成的NH3分子数为2N AC.1molFe溶于过量硝酸,电子转移数为2N AD.标准状况下,2.24 L CCl4含有的共价键数为0.4N A 【答案】A2.(2015课标Ⅰ)N A为阿伏伽德罗常数的值。
下列说法正确的是( )A.18gD2O和18gH2O中含有的质子数均为10N AB.2L0.5mol/L亚硫酸溶液中含有的H+两种数为2N AC.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2N AD.密闭容器中2molNO与1molO2充分反应,产物的分子数为2N A【答案】C3.(2015课标Ⅱ)N A代表阿伏加德罗常数的值。
下列叙述正确的是( )A.60g丙醇中存在的共价键总数为10N AB.1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1N AC.钠在空气中燃烧可生成多种氧化物。
23g钠充分燃烧时转移电子数为1N AD.235g核互23592U发生裂变反应:23592U+1n9038Sr+13654U+101n,净产生的中子(1n)数为10N A【答案】C4.(2014大纲卷)N A表示阿伏加德罗常数,下列叙述正确的是( )A.lmol FeI2与足量氯气反应时转移的电子数为2N AB.2L0.5 mol • L-1硫酸钾溶液中阴离子所带电荷数为N AC.1mol Na2O2固体中含离子总数为4N AD.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6 N A【答案】D模拟训练1.设N A为阿伏加德罗常数,下列叙述中正确的是( )A.标准状况下,11.2L苯中含有C﹣H键的数目为3N AB.常温下,1.0LpH=13的Ba(OH)2溶液中含有的OH﹣数目为0.1N AC.常温下,56g铁片投入足量浓H2SO4中生成N A个SO2分子D.电解饱和食盐水,阳极产生22.4L气体时,电路中通过的电子数目为2N A 【答案】B题型二物质的量阿伏伽德罗常数2.设N A为阿伏伽德罗常数的值.下列说法正确的是( )A.5NH4NO3△2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75N AB.室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣数目为0.1N AC.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2N AD.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3 N A【答案】A3.用N A表示阿伏加德罗常数的值,下列叙述中正确的是( )A.78g 苯含有C=C双键的数目为3N AB.常室温下,1LpH=13的Ba(OH)溶液中,溶液中的OH﹣离子数目为0.2N AC.0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2N AD.含2molH2SO4的浓硫酸与足量铜片在加热条件下反应,产生N A个SO2气体分子【答案】C4.设N A为阿伏加德罗常数的值,下列叙述中正确的是( )A.N A个Fe(OH)3胶体粒子的质量为107gB.标准状况下,1L液态水中含有的H+数目为10﹣7N AC.14g分子式为C n H2n的链烃中含有的碳碳双键的数目为N A/nD.1 mol冰醋酸和l mo1乙醇经酯化反应可生成H2O分子数为N A【答案】C5.设N A为阿伏加德罗常数的值,下列叙述正确的是( )A.1mol18O中含有的中子数为9N AB.常温下,32g含有少量臭氧的氧气中含有的氧原子数为2N AC.若1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为N AD.78g过氧化钠固体中所含阴、阳离子总数为4N A【答案】B6.设N A为阿伏加德罗常数值.下列有关叙述正确的是( )A.14g乙烯和丙烯混合气体中的氢原子数为2N AB.1molN2与4molH2反应生成的NH3分子数为2N AC.1molFe溶于过量硝酸,电子转移数为2N AD.标准状况下,2.24 LCCl4含有的共价键数为0.4N A 【答案】A7.设N A为阿伏伽德罗常数的值.下列叙述正确的是( )A.1mol Fe溶于过量稀硝酸,电子转移数为2N AB.标准状况下,2.24L CCl4含有分子的数目为0.1N AC.46g NO2和N2O4混合气体中含有原子总数为3N AD.1L 0.1mol/L的NaHCO3溶液中,HCO3﹣、CO32﹣离子数之和为0.1N A【答案】C8.设N A表示阿伏加德罗常数的值,下列说法中正确的( )①17.6 g丙烷中所含的共价键数为4N A个②常温下,21 g C3H6和C4H8的混合物中含有的碳原子数为1.5N A③电解饱和食盐水,当阴极产生2.24 L H2时,转移的电子数为0.2N A④2 g D216O中含有的质子数、中子数、电子数均为N A⑤常温下,1.0 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1N A⑥将100 mL0.1 mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01N AA.①②④B.①③⑥C.④⑤⑥D.①⑥【答案】A9.设N A表示阿伏加德罗常数,下列叙述正确的是( )A.电解饱和食盐水时,当溶液pH由7变为13,电路中转移的电子数为0.1N AB.标准状况下,35.5 g 氯气与足量红热的铁充分反应得到的电子数一定为N AC.标准状况下,2.24 L HF中含有的原子数为0.2N AD.在密闭容器中加入0.5 moL N2和1.5 moL H2,充分反应后容器中的N﹣H键数为3N A【答案】B10.设N A表示阿伏加德罗常数的值,下列有关叙述正确的有( )①标准状况下,20g重水(D2O)中含有的电子数为10N A②0.5molFe2+被足量的 H2O2 溶液氧化,转移0.5N A个电子③将2molNO和1molO2混合后,体系中的分子总数为3N A④乙烯和环丙烷组成的42g混合气体中氢原子的个数为6N A⑤2 mol•L﹣1碳酸钠溶液中Na+的数目是2N A⑥10LpH=1 的硫酸溶液中含有的H+数为2N A⑦22.4L的 N2的共用电子对数为3N A⑧将0.1mol氯化铁溶于1L水中,所得溶液含有 N A0.1个 Fe3+.A.①④⑥B.②③④C.①②④D.①②④⑧【答案】C11.设N A为阿伏加德罗常数的值,下列叙述正确的是( )A.1L 0.1 mol/L NaHCO3溶液中含有HCO3-数目为0.1N AB.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为N AC.50mL18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46N AD.1molFe与足量稀HNO3反应,转移电子数目为2N A【答案】B题型二物质的量阿伏伽德罗常数12.N A为阿伏伽德罗常数的值,下列叙述正确的为( )A.将二氧化碳通过过氧化钠使其增重ag 反应中转移电子数为B.1mol Cl2通入水中,则n(HClO)+n(Cl﹣)+n(ClO﹣)=2N AC.常温常压下,3克含甲醛的冰醋酸中含有的原子总数为0.4N AD.2.24升的甲烷中含有的C﹣H键数为0.4N A【答案】C13.N A代表阿伏加德罗常数的值。
下列说法正确的是( )A.C2H4和C3H6的混合物的质量为ag,所含碳氢键数目为a N A/7B.标准状况下,2.24 L2H35Cl中所含中子数为1.8N AC.50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3N AD.1L0.lmol·L-1的NaHCO3溶液中HCO3-和CO32-的离子数之和为0.1N A【答案】A14. N A为阿伏加德罗常数的值。
下列说法中,正确的是( )A.17 g甲基(-14CH3)所含电子数为10N AB.标准状况下,0.56L丙烷中含有共价键的数目为0.2N AC.在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3molCl2转移的电子数为5N AD.0.1mol9038Sr原子中含中子数为3.8N A【答案】C15.设N A为阿伏加德罗常数的值。
下列说法正确的是( )A.一定条件下,将1 mol N2和3 mol H2混合发生反应,转移的电子总数为6N AB.1 L 0.1 mol·L-1的Na2CO3溶液中阴离子的总数大于0.1N AC.向FeI2溶液中通入适量Cl2,当有2 mol Fe2+被氧化时,消耗Cl2的分子数为N AD.1 mol-CH3中所含的电子总数为10N A【答案】B16.设N A为阿伏加德罗常数,下列叙述中正确的是( )A.1L 1mol/L的盐酸溶液中,所含氯化氢分子数为N AB.标准状况下22.4 L H2中含中子数为2N AC.1L 1mol/L醋酸溶液中离子总数为2N AD.1molMg与足量O2或N2反应生成MgO或Mg3N2均失去2N A个电子【答案】D17.设N A代表阿伏加德罗常数,下列说法正确的是( )A.标准状况下,22.4L乙醇所含的分子数必定为N AB.1 mol NO2与足量的水反应,转移的电子数为2N AC.0.1molFe粉与足量水蒸气反应生成的H2分子数为0.15N AD.在常温常压下32g氧气所含的原子数目为2N A【答案】D18.用N A表示阿伏加德罗常数的值。
下列判断正确的是( )A.常温常压下,16 g O3所含的氧原子数目为N AB.1mol·L-1CaCl2溶液中含有的Cl-数目为2N AC.5.6gFe与足量盐酸反应失去的电子数目为0.3N AD.标准状况下,22.4 L苯含有的分子数目为N A 【答案】A19.设N A为阿伏加德罗常数的值,下列说法正确的是( )A.标准状况下,2.24L丁烷中C—C键数目为0.4N AB.0.1mol葡萄糖分子中官能团数目为0.6N AC.28g N2和NO组成的混合物中分子数目可能为0.9N AD.1L pH =13的NaOH溶液中,Na+数目为0.1N A 【答案】B20.若N A表示阿佛加德罗常数,下列说法正确的是( )A.14g氮气中含有7N A个电子B.1 mol Cl2作为氧化剂得到的电子数为N AC.标准状况下,2.24 L的CCl4中含有的C—Cl键数为0.4N AD.常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4N A【答案】AD21.设N A为阿伏加德罗常数的值,下列叙述正确的是( )A.1mol18O中含有的中子数为9N AB.常温下,32g含有少量臭氧的氧气中含有的氧原子数为2N AC.若1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为N AD.78g过氧化钠固体中所含阴、阳离子总数为4N A【答案】B22.设N A为阿伏加德罗常数的值,下列说法正确的是( )A.0.01 mol·L-1氯水中,Cl2、Cl-和ClO-三粒子数目之和大于0.01N AB.氢氧燃料电池正极消耗22.4 L气体时,负极消耗的气体分子数目为2N AC.0.1mol Cu与足量的浓硫酸完全反应后,溶液中Cu2+数目为0.1N AD.2.0gD2O中含有的质子数、电子数均为N A 【答案】D23.N A代表阿伏加德罗常数,以下叙述正确的是( )A.标准状况下,5.6 L CO2与足量Na2O2反应转移的电子数为0.5 N AB.足量Cu和含4 mol HNO3的浓硝酸反应可生成2 N A个NO2分子C.2.0g H218O与D2O的混合物中所含中子数为N AD.在pH=13 的NaOH 溶液中,OH的数目为0.1 N A 【答案】C24.N A为阿伏伽德罗常数的值。
