19金属通论
北京师范大学、华中师范大学、南京师范大学无机化学教研室《无机化学》(第4版)(下册)-第19章 金属

第19章 金属通论19.1 复习笔记一、概述1.金属元素概念金属元素是指那些价层电子数较少,在化学反应中较易丢失电子的元素。
2.金属的分类常见金属分类如图19-1所示。
图19-1 常见金属分类示意图二、金属的提炼1.金属的提炼金属的提炼是指从自然界索取金属单质的过程。
一般,金属的提炼分为矿石的富集、冶炼和精炼三个过程。
2.金属还原过程的热力学(1)一般,金属氧化物越稳定,的负值越大,金属越难被还原。
(2)自由能-温度图①将氧化物的生成自由能对温度作图,这种图称为自由能-温度图,又称埃林汉姆图;②从自由能-温度图中可获得某些金属氧化物分解的适宜温度,寻找适宜的还原剂。
3.工业上冶炼金属的一般方法根据金属的存在形式、金属还原过程的热力学及其它诸多因素,工业上冶炼金属的方法主要有热分解法、热还原法、电解法和氧化法。
(1)热分解法热分解法适用于、辰砂等少数不活泼金属化合物:(2)热还原法热还原法是最常见的从矿石提取金属的方法。
由于所用的还原剂不同,可分为碳热还原法、氢热还原法和金属热还原法。
①碳热还原法碳热还原法是指用C 或CO 做还原剂的冶炼金属的方法:由于大多数碳酸盐在高温下易发生热分解生成氧化物,制备过程:对硫化物,先将矿石在空气中煅烧使之转化为氧化物,再用碳还原:碳热还原法的缺点是制得的金属中往往含有碳和碳化物,得不到较纯的金属。
②氢热还原法氢热还原法主要用于制备少量的纯金属:③金属热还原法(金属置换法)金属热还原法是指用一种金属做还原剂把另一种金属从其化合物中还原出来的方法。
如:用铝做还原剂制取其它金属的方法称为铝热法:(3)电解法电解法主要用于从化合物中制取活泼金属,通常是电解其熔融盐:(4)氧化法氧化法是指使用氧化剂制取金属单质的方法,如金银的提取。
4.金属的精炼常用的金属精炼方法有:电解精炼、气相精炼和区域熔炼。
(1)电解精炼电解精炼是指电解时将不纯的金属做成电解槽的阳极,薄片纯金属做成阴极,通过电解在阴极上得到纯金属的方法。
Chapter19金属通论
6
55 Cs
铯
56 Ba 57-71 72 Hf 73 Ta 74 W 75Re 76 Os 77 Ir 78 Pt 79 Au 80 Hg 81 Tl 82 Pb 83 Bi 84 Po 85 At 86 Rn
石钡的La-类Lu 型铪 和钽经钨济效铼果锇等有铱 关铂。金金属汞的铊提炼铅方铋法与钋 它砹们氡
导体的电阻为零,也就是电流在超导体中通过时没有 任何损失。
18
超导材料大致可分为纯金属、合金和化合物三类。 超导材料可以制成大功率超导发电机、磁流发电机、超
导储能器、超导电缆、超导磁悬浮列车等。
4、金属的延展性:金属有延性,可以抽成细丝。例 如最细的白金丝直径为1/5000mm。金属又有展性, 可以压成薄片,例如最薄的金箔,可达1/10000mm 厚。 5、金属的密度:锂、钠、钾比水轻,锇、铁等比水 重。 6、金属的硬度:一般较大,但它们之间有很大差别。 有的坚硬,如铬、钨等;有些软,可用小刀切割如钠、 钾等。
✓ 轻有色金属:一般指密度在4.5g/cm3以下的 有色金属,如:铝、镁、钠、钾、钙、锶、钡。
✓ 重有色金属:一般指密度在4.5g/cm3以上的 有色金属,其中有铜、镍、铅、锌、钴、锡、 汞、锡等。
2
✓ 贵金属:这类金属包括金、银和铂族元素,由 于它们稳定、含量少、开采和提取困难、价格 贵,因而得名贵金属。
IIA
IIIA IVA VA VIA VIIA 氦
2
3 Li
锂
适4 Be宜,电解是最强的氧化还原手段。5 B
铍
硼
6C
碳
7N
氮
8O
氧
9F
氟
10 Ne
氖
3
11 Na
无机化学

第13章氢和稀有气体1.用VSEPR理论判断XeF2、XeF4、XeF6、XeOF6、ClF3的空间构型。
通式为AXnEm m+n的数目为价层电子对数M=(A的族价-X的化合价*X的个数+/-离子电荷相应是电子数)/2物质通式m m+n 空间结构XeF2AX n Em 3 5 直线型XeF4AX n Em 2 6 平面四方形XeF6AX n Em 1 7 变形八面体XeOF6AX n Em 1 6 四方锥ClF3AX n Em 2 5 平面三角形第14章卤素1. 根据电势图计算在298K时,Br2在碱性水溶液中歧化为Br-和BrO3-的反应平衡常数。
2通Cl2于消石灰中,可得漂白粉,而在漂白粉溶液中加入盐酸可产生Cl2,试用电极电势说明这两个现象。
.第16章氮磷砷1.如何除去N2中少量NH3和NH3中的水气?将含有少量NH3的N2气体通入水中。
就可除去NH3,将含有少量H2O的NH3通入CaCl2中,就可除去其中少量的H2O。
2.如何除去NO中微量的NO2和N2O中少量的NO?将含有少量NO2的NO气体通入热水中3NO2+H2O=2HNO3+NO这样就可除去其中的气体。
将N2O和少量的NO气体通入水中。
就可除去其中少量的NO。
3.给下列物质按碱性减弱顺序排序,并给予解释:NH3 N2H4 NH3OH PH3 AsH3答:NH3是所有气态氢化物中唯一显碱性的物质,按N—P—AS 顺序,其气态氢化物的碱性依次减弱,酸性依次增强,故碱性NH3>PH3>ASH3,而同一种元素的氢化物,化合价越低,碱性越强,故NH3>N2H4>NH2OH ,综上可知碱性顺序为NH3>N2H4>NH3OH(碱性)>PH3(酸性)>AsH3 (酸性)4.为了测定铵态氮肥中的含氮量,称取固体样品0.2471g,加过量NaOH溶液并进行蒸馏,用50.00mL 0.01050mol/L HCl吸收蒸出的氨气,然后用0.1022mol/L NaOH溶液滴定吸收液中剩余的HCl,滴定中消耗了11.69mL NaOH溶液,试计算肥料中氮的百分含量。
19章 金属通论

19-4-2 金属固溶体(金属固态溶液) 19金属固溶体(金属固态溶液) 金属固溶体:一种均匀的组织,又称固态溶液.固溶体中被 溶解的金属(溶质)可以有限或无限地溶于基体金属(溶剂) 的晶格中.根据溶质原子在晶体中所处的位置分类:置换固 溶体,间隙固溶体和缺位固溶体.
19-4-3 金属化合物(金属互化物) 19金属化合物(金属互化物) 当两种金属元素的电负性, 当两种金属元素的电负性,电子构型和原子半径差别较大 时,则易形成金属化合物,又称金属互化物. 则易形成金属化合物,又称金属互化物. "正常价"化合物:如Mg2Pb,组成固定,化学键介于离 正常价"化合物:如Mg Pb,组成固定, 子键和共价键之间. 子键和共价键之间. 电子化合物:大多数的金属化合物,组成可变, 电子化合物:大多数的金属化合物,组成可变,以金属键 结合, 结合,特征是化合物中价电子数与原子数之比 有一定值. 有一定值. 合金材料与组成它的金属性质有较大差别. 合金材料与组成它的金属性质有较大差别.是重要的功能 材料和结构材料. 材料和结构材料.
三,区域熔炼
将要提纯的物质放进一个装有移动式加热线圈的套管内,强热 熔化一段小区域,形成熔融带.将线圈沿管路缓慢移动,熔融 带随之移动,由于混合物的熔点总比纯物质地,因此杂质缓慢 汇集在熔融带,随线圈移动转移到末端,即可除去,经多次区 域熔炼,可得到杂质含量低于10-12的超纯金属.
19-3 金属的物理性质和化学性质 1919-3-1 金属的物理性质 19-
19-2 金属的提炼 19金属提炼分三个过程:矿石的富集,冶炼,精炼 金属提炼分三个过程:矿石的富集,冶炼, 19-2-1 金属还原过程的热力学 19埃林汉姆图:氧化物自由能埃林汉姆图:氧化物自由能-温度图 ΔG=ΔHΔG=ΔH-TΔS 假定ΔH和ΔS为定值,ΔG对温度作 假定ΔH和ΔS为定值,ΔG对温度作 图便得一直线. 斜率发生变化,是由于一定温度下 发生的相变.
无机化学课件——金属通论

第十六章金属通论第一节概述§1-1 地壳的组成大气圈Atmosphere 0.03%水圈Hydrophere 6.91%岩石圈(16Km)以下Lithosphere 93.06%/index.php这是一个美国高端金属材料公司的网站主页上的“MSDS‘s”是它的产品数据库大气层-结构大气层地题图大气是指包围在地球表面并随地球旋转的空气层。
它不仅是维持生物因中生命所必需的,而且参与地球表面的各种过程,如水循环、化学和物理风化、陆地上和海洋中的光合作用及腐败作用等,各种波动、流动和海洋化学也都与大气活动有关。
地表大气平均压力为1个大气压,相当于每平方厘米地球表面包围1034g空气。
地球总表面积为510100934平方公里,所以大气总质量约为5.2×1015吨,相当于地球质量的10-6倍。
大气随高度的增加而逐渐稀薄,50%的质量集中在30km以下的范围内。
高度100km以上,空气的质量仅是整个大气圈质量的百万分之一。
按气温垂直分布对大气分层(热分层),可以分为以下几层:对流层对流层是大气的最低层,其厚度随纬度和季节而变化。
在赤道附近为16-18km;在中纬度地区为l0-12km,两极附近为8-9km。
夏季较厚,冬季较薄。
这一层的显著特点:—是气温随高度升高而递减,大约每上升100 m,温度降低0.6。
C。
内于贴近地面的空气受地面发射出来的热量的影响而膨胀上升,上面冷空气下降,故在垂直方向上形成强烈的对流,对流层也正是因此而得名;二是密度大,大气总质量的3/4以上集中在此层。
在对流层中,因受地表的影响不同,又可分为两层。
在l-2km以下,受地表的机械、热力作用强烈,通称摩擦层,或边界层,亦称低层大气,排人大气的污染物绝大部分活动在此层。
在1-2公里以上,受地表影响变小,称为自由大气层,主要天气过程如雨、雪、雹的形成均出现在此层。
对流层和人类的关系最密切。
平流层穿越大气层从对流层顶到约50km的大气层为平流层。
10常见金属元素

第二节 碱金属
钠和钾的化学性质: (一)与非金属反应
4Na + O2 453k-473k 2Na2O
2Na2O +O2 573k-673k 2Na2O2
燃烧
2Na + O2
Na2O2
第二节 碱金属
(二)与水反应
2Na + 2H2O
2K +2H2O
2NaOH + H2↑
2KOH + H2↑
第二节 碱金属
第一节 金属通论
由于金属晶体结构相同,且都有自由电子存 在,使金属具有很多共同的物理性质,具有 特殊的金属光泽,不透明,具有良好的导电 性和导热性,有延展性,密度、硬度较大, 熔点较高等
第一节 金属通论
金属在工业、农业、国防、科技等行业应 用广泛。同时,有些金属在构建人体生理 功能上起着重要作用,如血红蛋白中铁(II) 具输送的作用;而锌、锰等金属元素则是 构成生化反应常用生物酶必不可少的成分; 铬(III)在胰岛素参与糖代谢的过程中起 重要的协调作用等。
第三节 碱土金属
第三节 碱土金属
第一节 金属通论
研究证明一切金属都具有晶体结构。在金属 晶体的晶格结点上排列着金属原子和带正电 荷的金属阳离子,金属原子易失电子变为阳 离子,并重新捕获电子,电子就这样在原子 和离子间不停地进行交换,活动范围广,使 金属原子和离子之间存在自由运动的电子, 这些自由电子不属于某个原子所独有,而属 于金属原子所共有。
第一节 金属通论
(三)与盐反应 活泼金属可以三把不活泼的金属从盐溶液 中置换出来。如铜能和硫酸锌溶液反应: Cu + Zn2+ === Cu2++ Z、钾都具有银白色金属光泽,焰色反应时, 钠为黄色,钾为紫色(隔蓝色钴玻璃)。它们 的密度比水小,可浮在水面上。硬度也小, 可用刀切割,新切开的金属表面呈银白色, 钠、钾均具有良好的导电性。钠、钾熔沸点 较低。
无机化学第二章答案

无机化学第二章答案【篇一:大学无机化学第二章(原子结构)试题及答案】txt>本章总目标:1:了解核外电子运动的特殊性,会看波函数和电子云的图形2:能够运用轨道填充顺序图,按照核外电子排布原理,写出若干元素的电子构型。
3:掌握各类元素电子构型的特征4:了解电离势,电负性等概念的意义和它们与原子结构的关系。
各小节目标:第一节:近代原子结构理论的确立学会讨论氢原子的玻尔行星模型e?第二节:微观粒子运动的特殊性1:掌握微观粒子具有波粒二象性(??2:学习运用不确定原理(?x??p?第三节:核外电子运动状态的描述1:初步理解量子力学对核外电子运动状态的描述方法——处于定态的核外电子在核外空间的概率密度分布(即电子云)。
2:掌握描述核外电子的运动状态——能层、能级、轨道和自旋以及4个量子数。
3:掌握核外电子可能状态数的推算。
第四节:核外电子的排布1:了解影响轨道能量的因素及多电子原子的能级图。
2;掌握核外电子排布的三个原则:1能量最低原则——多电子原子在基态时,核外电子尽可能分布到能量最低○的院子轨道。
2pauli原则——在同一原子中没有四个量子数完全相同的电子,或者说是在○同一个原子中没有运动状态完全相同的电子。
3hund原则——电子分布到能量简并的原子轨道时,优先以自旋相同的方式○hh)。
?pmv13.6ev。
n2h)。
2?m分别占据不同的轨道。
3:学会利用电子排布的三原则进行第五节:元素周期表认识元素的周期、元素的族和元素的分区,会看元素周期表。
第六节:元素基本性质的周期性掌握元素基本性质的四个概念及周期性变化1从左向右,随着核电荷的增加,原子核对外层电子的吸引1:原子半径——○2随着核外电子数的增加,电子间的相互斥力力也增加,使原子半径逐渐减小;○也增强,使得原子半径增加。
但是,由于增加的电子不足以完全屏蔽增加的核电荷,因此从左向右有效核电荷逐渐增加,原子半径逐渐减小。
2:电离能——从左向右随着核电荷数的增多和原子半径的减小,原子核对外层电子的引力增大,电离能呈递增趋势。
无机化学练习题(含答案)

无机化学练习题(含答案)第1章原子结构与元素周期系1-1试讨论,为什么有的元素的相对原子质量(原子量)的有效数字的位数多达9位,而有的元素的相对原子质量(原子量)的有效数字却少至3~4位?1-2Br2分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解离需要吸收的最低能量子的波长与频率。
1-3氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?1-4周期系中哪一个元素的电负性最大?哪一个元素的电负性最小?周期系从左到右和从上到下元素的电负性变化呈现什么规律?为什么?1-5什么叫惰性电子对效应?它对元素的性质有何影响?1-6当氢原子的一个电子从第二能级层跃迁至第一能级层时发射出光子的波长是121.6nm;当电子从第三能级层跃迁至第二能级层时,发射出光子的波长是656.3nm。
问哪一个光子的能量大?1-7有A,B,C,D四种元素。
其中A为第四周期元素,与D可形成1:1和1:2原子比的化合物。
B为第四周期d区元素,最高氧化数为7。
C和B是同周期元素,具有相同的最高氧化数。
D为所有元素中电负性第二大元素。
给出四种元素的元素符号,并按电负性由大到小排列之。
1-8有A,B,C,D,E,F元素,试按下列条件推断各元素在周期表中的位置、元素符号,给出各元系的价电子构型。
(1)A,B,C为同一周期活泼金属元素,原子半径满足A>B>C,已知C有3个电子层。
(2)D,E为非金属元素,与氢结合生成HD和HE。
室温下D的单质为液体,E的单质为固体。
(3)F为金属元素,它有4个电子层并且有6个单电子。
第2章分子结构2-1键可由-、-p和p-p原子轨道“头碰头”重叠构建而成,试讨论LiH(气态分子)、HCl、Cl2分子里的键分别属于哪一种?2-2NF3和NH3的偶极矩相差很大,试从它们的组成和结构的差异分析原因。
2-3一氧化碳分子与酮的羰基(>C=O)相比,键能较小,键长较小,偶极矩则小得多,且方向相反,试从结构角度作出解释。
化学专业函授(业余)本科教学大纲目录.doc

感谢你的观看感谢你的观看化学专业函授(业余)本科教学大纲目录《无机化学选论》教学大纲1《无机化学实验》教学大纲10《有机化学选论》教学大纲12《有机化学实验》教学大纲21《分析化学选论》教学大纲23《分析化学实验》教学大纲31《仪器分析》教学大纲 33《物理化学选论》教学大纲39《仪器分析化学实验》教学大纲49 《物理化学实验》教学大纲51《结构化学》教学大纲 53《化工基础》教学大纲 59《化学教学论》教学大纲63《高等无机化学》教学大纲69《高等有机化学》教学大纲71《配位化学》教学大纲 75《环境化学》教学大纲 80《无机化学选论》教学大纲一、课程类别专业必修课二、教学目的无机化学是化学专业一门重要的基础课,除完成本门课程的教学任务外,还为本专业其它后续课程提供必要的化学基本原理和基础。
本课程主要内容包括物质结构基础、化学热力学和化学动力学基础、化学平衡、水溶液化学原理、电化学基础、配合物、元素化学等。
通过本课程的学习,让学生掌握基础化学及近代物质结构等化学原理,并应用化学原理理解化学基础知识,解决有关的化学元素的结构、性质等问题,具有对化学规律和问题进行理论分析的思维方法和综合分析能力。
三、开课对象化学专业函授本科四、学时分配总学时:180 其中面授:45学时自学:135学时五、教学内容与基本要求、教学的重点和难点第一章原子结构与元素周期系(面授3学时、自学9学时)教学内容:1.1道尔顿原子论1.2相对原子质量1.3原子的起源和演化1.4原子结构的波尔行星模型1.5氢原子结构(核外电子运动)的量子力学模型1.6基态原子电子组态(电子排布)1.7元素周期系1.8元素周期性教学任务:初步理解量子力学对核外电子运动状态的描述;初步理解核外电子的运动状态;掌握核外电子可能状态数的推算;掌握各类元素电子构型的特征;掌握电离能、电负性等概念的意义和它们与原子结构的关系。
教学重点和难点:核外电子运动状态的描述;核外电子可能状态数的推算;各类元素电子构型的特征;电离能、电负性等与原子结构的关系。
第十九章金属通论19-1在化学史上金银汞铜铁等重金属发现

第十九章金属通论19-1 在化学史上,金、银、汞、铜、铁等重金属发现最早,轻金属则发现最迟,如钾、钠、钙等,直到19世纪才被发现,这是什么原因?答:重金属不活泼,多以游离态存在或其化合态易被提取,钾、钠、钙等轻金属性质活泼,大多以化合态存在而且它们的提取和分离都比较困难。
19-2 举例说明金属在自然界的存在形态。
答:游离态:少数性质极不活泼的金属如Au、Ag、Hg、Pt系金属等单质及化合物形式:性质稍活泼元素,如Fe,有各种铁矿石,也有陨石;第一主族和Mg:性质活泼,大都以卤化物溶解在海水和湖水中;第二主族:多以碳酸盐、硫酸盐、磷酸盐及硅酸盐等难溶性化合物形式存在;过渡元素:多以氧化物及硫化物形式存在;p区元素:亲硫元素,常以难溶的硫化物形式存在。
19-3 为什么铜的导电性随温度的升高而减小,硅的导电性随温度的升高而增大?汞的导电性在低于4.2K时有什么变化?答:金属导体温度升高,离子振动加剧,阻碍自由电子定向流动,电阻增大;半导体材料温度升高,跃迁到导带的电子数增多,电导率提高;汞在4.2K时电阻突然消失,呈现超导状态。
19-4 哪些金属为稀有金属?它们与普通金属之间是如何划分的?答:稀有金属是指在地壳中含量少或分布稀散,提取困难的有色金属。
轻稀有金属:锂、铷、铯、铍;分散性稀有金属:镓、铟、铊;高熔点稀有金属:钛、镐、锆、铪、钒、铌、钽、钼、钨;铂系金属:钌、铑、钯、锇、铱、铂;稀土金属:钪、钇、镧及镧系;放射性稀有金属:钫、镭、锝、钋、砹、锕及锕系。
19-5 试各举一例能用下列方法精炼的金属。
(1)电解法(2)羰化法(3)碘化物法答:(1)电解法: 2NaCl(熔融)==2Na+Cl2(2)羰化法:Ni(含杂质)+CO=(高压)=Ni(CO)4Ni(CO)4 (513-593k)-Ni(99.998%纯)+4CO(323--523K)-TiI4(3)碘化物法:Ti(不纯)+2I2TiI4 =(1673K, W丝) Ti + 2I219-6 同一周期从左到右,同一主族从上到下,金属的熔点、密度、硬度、原子半径、电离能和升华能等物理性质是如何变化的?试说明之。
无机化学内容及要求

第一篇物质结构基础第一章原子结构和元素周期系第二章分子结构第三章晶体结构第四章配合物第二篇化学热力学与化学动力学基础第五章化学热力学基础第六章化学平衡常数第三篇水溶液化学原理第九章酸碱平衡第十章沉淀平衡第十一章电化学基础第十二章配位平衡第四篇元素化学(一)非金属第十三章氢和稀有气体第十四章卤素第十五章氧族元素第十六章氮磷砷第十七章碳硅硼第十八章非金属元素小结第五篇元素化学(二)金属第二十一章p区金属第二十二章ds 区金属第二十三章 d 区金属(一)第四周期d区金属要求绪论教学基本要求:理解化学研究的对象、内容、目的和方法。
了解化学发展的现状。
掌握学习化学的正确方法。
第一篇物质结构基础第1章原子结构与元素周期系教学基本要求:初步了解原子能级、波粒二象性、原子轨道(波函数)和电子云等原子核外电子运动的近代概念。
熟悉四个量子数对核外电子运动状态的描述。
熟悉s、p、d原子轨道的形状和伸展方向。
掌握原子核外电子排布的一般规律和各区元素原子层结构的特征。
会从原子半径、电子层构型和有效核电荷来了解元素的性质。
熟悉电离能、电子亲合能、电负性及主要氧化值的周期性变化。
1.本章第1、2、3节讨论原子、元素、核素、同位素、同位素丰度、相对原子质量等基本概念。
其中相对原子质量(原子量)是最重要的,其余都是阅读材料。
2.本张第4节讨论氢原子的玻尔行星模型,基本要求是建立定态、激发态、量子数和电子跃迁4个概念,其他内容不作为教学要求。
3.第5节是本章第1个重点。
基本要求是初步理解量子力学对核外电子运动状态的描述方法;初步理解核外电子的运动状态;掌握核外电子可能状态的推算。
本节小字部分为阅读材料。
4.第6节是本章第2个重点。
基本要求是掌握确定基态原子电子组态的构造原理,在给定原子序数时能写出基态原子的电子组态;掌握多电子原子核外电子状态的基本规律,特别是能量最低原理。
本节小字内容不作教学要求。
5.第7、8节是本章最后1个重点。
简明无机化学第二版答案

简明无机化学第二版答案【篇一:《无机化学》习题解析和答案】》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,2002年8月第4版。
2、参考书《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,1992年5月第3版。
《无机化学》邵学俊等编,武汉大学出版社,2003年4月第2版。
《无机化学》武汉大学、吉林大学等校编,高等教育出版社,1994年4月第3版。
《无机化学例题与习题》徐家宁等编,高等教育出版社,2000年7月第1版。
《无机化学习题精解》竺际舜主编,科学出版社,2001年9月第1版《无机化学》电子教案绪论(2学时)第一章原子结构和元素周期系(8学时)第二章分子结构(8学时)第三章晶体结构(4学时)第四章配合物(4学时)第五章化学热力学基础(8学时)第六章化学平衡常数(4学时)第七章化学动力学基础(6学时)第八章水溶液(4学时)第九章酸碱平衡(6学时)第十章沉淀溶解平衡(4学时)第十一章电化学基础(8学时)第十二章配位平衡(4学时)第十三章氢和稀有气体(2学时)第十四章卤素(6学时)第十五章氧族元素(5学时)第十六章氮、磷、砷(5学时)第十七章碳、硅、硼(6学时)第十八章非金属元素小结(4学时)第十九章金属通论(2学时)第二十章 s区元素(4学时)第二十一章 p区金属(4学时)第二十二章 ds区元素(6学时)第二十三章 d区元素(一)第四周期d区元素(6学时)第二十四章 d区元素(二)第五、六周期d区金属(4学时)第二十五章核化学(2学时)1 .化学的研究对象什么是化学?● 化学是研究物质的组成、结构、性质与变化的一门自然科学。
(太宽泛)● 化学研究的是化学物质 (chemicals) 。
● 化学研究分子的组成、结构、性质与变化。
● 化学是研究分子层次以及以超分子为代表的分子以上层次的化学物质的组成、结构、性质和变化的科学。
● 化学是一门研究分子和超分子层次的化学物种的组成、结构、性质和变化的自然科学。
2013年浙江师范大学无机化学(906)考试大纲

第1页,共8页浙江师范大学浙江师范大学硕士研究生入学硕士研究生入学硕士研究生入学考试考试考试初试初试初试科目科目科目考 试 大 纲科目代码科目代码、、名称名称:: 906无机化学适用专业适用专业:: 420106学科教学学科教学((化学)、045117科学与技术教育科学与技术教育一、考试形式与试卷结构(一)试卷试卷满分满分满分及考试时间及考试时间本试卷满分为150分,考试时间为180分钟。
(二)答题方式答题方式答题方式为闭卷、笔试。
试卷由试题和答题纸组成;答案必须写在答题纸相应的位置上;答题纸一般由考点提供。
(三)试卷题型结构试卷题型结构选择题:15小题,每小题3分,共45分完成并配平反应方程式:5小题,每小题4分,共20分简答题:共5小题,每小题10分,共50分制备题:共1小题,共15分计算题:共1小题,共20分二、考查目标考查目标((复习要求复习要求))全日制攻读教育硕士专业学位研究生入学考试《无机化学》科目考试,要求考生系统掌握无机化学中重要的基本概念和基础知识,掌握元素周期律、原子和分子结构、化学反应速率、化学平衡、化学热力学、电解质溶液、氧化还原反应和配位化学等基本理论,并用这些理论来解释无机化学中的实际问题,具有理论分析、科学思维和化学计算的能力。
掌握重要元素的单质及其化合物结构、性质、制备及用途,并用无机化学的相关理论进行解释。
三、考查范围考查范围或或考试内容概要第一篇 物质结构基础第1章 原子结构与元素周期系1.道尔顿原子论2.相对原子质量(原子量)3.原子的起源和演化4.原子结构的玻尔行星模型5.氢原子结构(核外电子运动)的量子力学模型6.基态原子电子组态(电子排布)7.元素周期系8.元素周期性第2章分子结构1.路易斯结构式2.单键、双键和叁键—σ键和π键—价键理论(一)3.价层电子互斥模型(VSEPR)4.杂化轨道理论—价键理论(二)5.共轭大π键6.等电子体原理7.分子轨道理论8.共价分子的性质9.分子间力10.分子对称性第3章晶体结构1.晶体2.晶胞3.金属晶体4.离子晶体5.分子晶体与原子晶体第4章配合物1.配合物的基本概念2.配合物的异构现象与立体结构3.配合物的价键理论第二篇化学热力学与化学动力学基础第5章化学热力学基础1.化学热力学的研究对象2.基本概念3.化学热力学的四个重要状态函数4.化学热力学的应用第6章化学平衡常数1.化学平衡状态第2页,共8页2.平衡常数3.浓度对化学平衡的影响4.压力对化学平衡的影响5.温度对化学平衡的影响第7章化学动力学基础1.化学反应速率2.浓度对化学反应速率的影响3.温度对化学反应速率的影响及阿仑尼乌斯公式4.反应历程5.碰撞理论和过渡态理论6.催化剂对反应速率的影响第三篇水溶液化学原理第8章水溶液1.溶液的浓度和溶解度2.非电解质稀溶液通性3.电解质溶液第9章酸碱平衡1.酸碱质子理论2.水的离子积和pH3.酸碱盐溶液中的电离平衡4.水溶液化学平衡的计算5.缓冲溶液6.酸碱指示剂第10章沉淀平衡1.溶度积原理2.沉淀与溶解第11章电化学基础1.氧化还原反应2.原电池3.实用电池4.有关电解的几个问题第12章配位平衡第3页,共8页1.配合物的稳定常数2.影响配合物在溶液中的稳定性的因素3.配合物的性质第四篇 元素化学(一)非金篇第13章 氢和稀有气体1.氢2.稀有气第14章 卤素1.卤素的通性2.卤素单质3.氟氯溴碘的化合物4.砹的化学第15章 氧族元素1.氧族元素的通性2.氧及其化合物3.硫及其化合物4.硒和碲第16章 氮磷砷1.元素的基本性质2.氮和氮的化合物3.磷及其化合物4.砷第17章 碳硅硼1.通性2.碳3.硅4.硼5.碳化物、硅化物和硼化物第18章 非金属元素小结1.非金属元素的结构和性质2.分子型氢化物3.含氧酸4.非金属含氧酸的某些性质第4页,共8页5.p区元素的次级周期性第五篇 元素化学(二)金属第19章金属通论1.概述2.金属的提炼3.金属的物理性质和化学性质4.合金第20章s区元素1.碱金属和碱土金属的通性2.碱金属和碱土金属的单质3.碱金属和碱土金属的化合物第21章p区金属1.p区金属概论2.铝镓分族3.锗分族4.锑和铋第22章ds区元素1.铜族元素2.锌族元素第23章d区金属(一)第四周期d区金属1.引言2.第一过渡系元素的基本性质3.钪4.钛5.钒6.铬7.锰8.铁、钴、镍参考教材或主要参考书:参考教材或主要参考书无机化学(上、下册,第四版),北京师范大学、南京师范大学、华中师范大学编,高等教育出版社,2002年版四、样卷第5页,共8页一、选择题选择题(共15小题,每小题3分,共45分)1.下列分子或离子与BF3互为等电子体,并具有相似结构的一种是()A.NO3-B.NF3C.气态AlCl3D.SO22.A与B发生反应,当A浓度为原来2倍时,反应速度增加为4倍,当B浓度增加为原来2倍时,反应速度增加为2倍,此反应的反应级数为()A.1级B.2级C.3级D.4级3.有两个平行反应A →B和A →C,如果要提高B的产率,降低C的产率,最好的办法是()A.增加A的浓度B.增加C的浓度C.控制反应温度D.选择某种催化剂4.最近意大利科学家用普通的氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子,并用质谱仪探测到了它存在的证据。
《无机化学》题库(含答案)

2.波函数和原子轨道二者之间的关系是…………………………………………(C) A.波函数是函数式,原子轨道是电子轨迹; B.波函数和原子轨道是同义词; C.只有轨道波函数与原子轨道才是同义的; D.以上三种说法都不对. 3.多电子原子的原子轨道能级顺序随着原子序数的增加………………………(D) A.轨道能量逐渐降低,但能级顺序不变; B.轨道能量基本不变,但能级顺序改变; C.轨道能量逐渐增加,能级顺序不变; D.轨道能量逐渐降低,能级顺序也会改变. 4.周期表中各周期元素数目是由什么决定的……………………………………(C) A.2n2(n 为主量子数); B.相应能级组中所含轨道总数; C.相应能级组中所含电子总数 D. n + 0.7 规则 5.下列电子构型中,电离能最低的是……………………………………………(A) A.ns2np3 B.ns2np4 C.ns2np5 D.ns2np6 6.下列元素中,第一电离能最大的是……………………………………………(B) A.B B.C C.Al D.Si 7.原子光谱中存在着不连续的线谱,证明了……………………………………(B) A.在原子中仅有某些电子能够被激发 B. 一个原子中的电子只可能有某些特定的能量状态 C.原子发射的光,在性质上不同于普通的白光 D.白光是由许许多多单色光组成. 8.原子轨道中"填充"电子时必须遵循能量最低原理,这里的能量主要是指……(C) A.亲合能 B.电能 C.势能 D.动能 9.下列哪一原子的原子轨道能量与角量子数无关? ……………………………(D) A.Na B.Ne C.F D.H 10.下列哪一种元素性质的周期规律最不明显…………………………………(A) A.电子亲合能 B.电负性 C.电离能 D.原子体积
大学无机化学复习题
分析化学 第19章 金属通论

教学时数: 教学时数:
2 学时
教学内容: 教学内容
第一节 概述 第二节 金属的提炼 第三节 金属的物理性质和化学性质
第四节 合金 教学方法: 教学方法
讲授法和讨论法
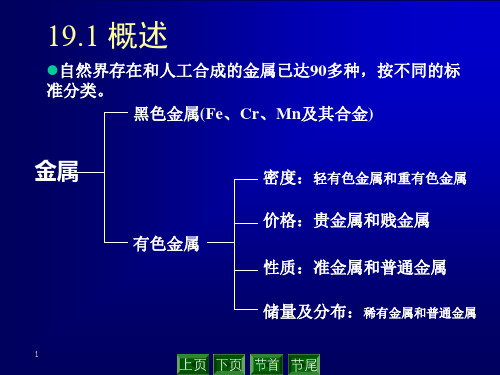
19.1概述 19.1概述
一、元素分类 元素109种,金属84种,准金属8种,非金属17种。 二、金属分类 1. (1) 黑色金属 铁、锰和铭以及它们的合金(主指钢铁—C合金) (2) 有色金属 除铁、铬、锰元素外的所有金属 2.有色金属(按密度、价格、地壳中的存储是分布情况分) 轻有色金属:密度<4.5以下的有色金属,Na, mg, H, Ca, Sr , Ba 等 重有色金属:密度>4.5的有色Ca,Ni,Pb, Ln,Co,Sn, Sb,Hg, Cd,Bi等 贵金属: Ag,Au和铝族元素(Pt,Ir,Os,Ru,Pd,Rh) 准金属: Si,Ge,Se,Te,Po,As,Sb,B 稀有金属: 含量少,分散,发现较晚,难从原料中提取或在工业上制 备和应用较晚的金属。 Li,Rb,Cs,Be,W,Mo,Ta,Nb,Ti,Hf,V,Re,Ga,In,Tl,Ge和希土元 素和人造超铀元素金属元素RE
一 、电解精炼 Cr,Au,Pb,Al,Zn等 二 、气相精炼法 1) 直接蒸馏法:Mg,Hg,Zn,Sn等 2)气相析出法:金属化合物的蒸气热分解或还原而由气相析出金属的 方法。(气相热分解法、气相还原法) 碳化法 Ni(CO)4=Ni+4CO 碘化物热分解法(提取少量Zr,Hf,Be,B,Si,Ti,W) Ti(不纯)+ I 323 ~ 523kTiI 1673K Ti + I
自由电子的存在和紧密堆积的结构使金属具有许多共同 的性质。 的性质。如: 1、金属光泽:当光线投射到金属表面上时,自由电子吸 、金属光泽:当光线投射到金属表面上时, 收所有频率的光,然后很快放出各种频率的光 全反射),绝大多数 然后很快放出各种频率的光(全反射 收所有频率的光 然后很快放出各种频率的光 全反射 绝大多数 金属呈现钢灰色以至银白色光泽。 金属呈现钢灰色以至银白色光泽。 此外,金显黄色,铜显赤红色,铋为淡红色,铯为淡黄色, 此外,金显黄色,铜显赤红色,铋为淡红色,铯为淡黄色, 铅是灰蓝色,这是因为它们较易吸收某一些频率的光之故。 铅是灰蓝色,这是因为它们较易吸收某一些频率的光之故。 金属光泽只有在其为晶体时才能表现出来, 金属光泽只有在其为晶体时才能表现出来,粉末状金属一 般都呈暗灰色或黑色(漫散射 漫散射)。 般都呈暗灰色或黑色 漫散射 。 许多金属在光的照射下能放出电子(光电效应 光电效应)。 许多金属在光的照射下能放出电子 光电效应 。另一些在 加热到高温时能放出电子(热电现象 热电现象)。 加热到高温时能放出电子 热电现象 。
贵州师范大学836无机化学大纲

《无机化学》研究生入学考试大纲科目代码:836一、考查总目标《无机化学》主要考察学生对无机化学基础理论和元素化学基本知识掌握情况。
基础理论包括物质结构基础(原子结构和元素周期律、分子结构、晶体结构和配合物结构)、化学热力学与化学动力学基础(化学热力学、化学平衡、化学动力学)和水溶液化学原理(酸碱平衡、沉淀平衡、氧化还原平衡和配位平衡)。
元素化学包括主族元素、过渡元素及其化合物的存在、制备、性质和应用。
要求考生系统掌握无机化学的基本知识、基础理论和基本方法,并能运用相关理论和方法分析、解决实际问题。
二、考试形式与试卷结构(一)试卷成绩及考试时间本试卷满分150分,考试时间为180分钟。
(二)答题方式答题方式为闭卷、笔试。
(三)试卷内容结构物质结构基础:约35分化学热力学与化学动力学基础:约25分水溶液化学原理:约35分主族元素:约30分过渡元素:约25分(四)试卷题型结构选择题:每小题2 分,共50分填空题:每空2 分,约35分简答题:约35分完成并配平反应方程式:10分计算题:20 分三、考查范围(一)考查目标1、掌握元素周期律,化学热力学,近代物质结构,化学平衡以及基础电化学等基本原理;并具有对一般无机化学问题进行理论分析和计算的能力,2、熟悉常见元素及其化合物的性质。
培养学生运用无机化学原理去掌握有关无机化学中元素和化合物的基本知识,并能从微观和宏观相结合来阐述元素及其化合物的性质,熟悉离子的分离和鉴定。
(二)考核要求第一章原子结构和元素周期系1.掌握原子、分子、元素、核素、同位素、原子质量、平均原子质量、分子量、式量等基本概念。
2.了解电子等微观粒子运动的特殊性;掌握波函数、电子云、原子轨道、电子层的概念,会看波函数与电子云图形,重点掌握描述电子运动状态的四个量子数的物理意义、取值规律和合理组合。
3.根据电子排布三原则和鲍林原子轨道近似能级图,掌握原子核外电子排布规律(特殊情况除外),能书写一般元素的原子核外电子排布式和价电子构型,并根据电子排布式判断元素在周期表中的位置及有关性质。
Chapter19 金属通论

1919-1 1919-2 1919-3 1919-4
金属通论
概述 金属的提炼 金属的物理性质和化学性质 合金
19-1 19-
概
述
金属
黑色金属( 黑色金属(铁,锰,铬及其合金) 铬及其合金) 按密度分: 按密度分:轻有色金属和重有色金属 有色金属(除铁,锰铬及其合 有色金属(除铁, 按价格分:贵金属和贱金属 按价格分: 按性质分: 金以外的所有金属 ) 按性质分:准金属和普通金属 按储量及分布等分: 按储量及分布等分:稀有金属和普通 金属
ZnCO3 ZnO + C
ZnO +Leabharlann CO2△Zn + CO
2PbS + 3O2
△
2PbO+ 2SO2 +
PbO + C Pb + CO ②氢热还原法 GeO2 + 2H2 Ge + 2H2O WO3 + 3H2 W + 3H2O 金属热还原法(金属置换法) ③金属热还原法(金属置换法) KCl + Na NaCl + K↑ 2RbCl + Ca CaCl2 + 2Rb↑ 2CsAlO2 + Mg MgAl2O4 + 2Cs↑ 铝热法: 铝热法: Cr2O3 + 2Al Al2O3 + 2Cr ⊿rGθ=-622.9KJ/mol
1919-2
一.金属还原过程的热力学
金属的提炼
二.工业上冶炼金属的一般方法 1.热分解法 1.热分解法
△
2HgO
△
2Hg + O2 4Ag + O2
△
2AgO HgS +O2
Hg + SO2
2.热还原法 2.热还原法 ①碳热还原法 SnO2 + 2C Fe2O3 + 3CO
△
Sn + 2CO 2Fe + 3CO2
二.金属的化学性质 金属的化学性质
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
相变,如熔化、气化、相转变等,必将引起熵的改变,此时 直线的斜率发生变化,如图上最下两条Ca、Mg的线就是如
此,这是由于Ca、Mg的熔化所引起熵的变化所致。 ② 在艾林罕姆图上, 一个氧化物的生成自由能负值越大, 则金属-氧化物的线在图中的位置就越靠下。相反,氧化物 生成自由能值负值越小,则其金属-氧化物线在图上的位置 就越靠上。这就是说,根据图上各种线的位置的高低就可判 断出这些氧化物稳定性的相对大小.显然金属-氧化物的线位 置越低,氧化物越稳定。
无机化学
④氢还原法 在艾林罕姆图中H2 -H2O线(左图中 的 红 线 ) 的 位 置 较 高 , 由 H2 生 成 H2O 的 △Gθ 不太负,位于H2 -H2O线上方的M -MO线也不是很多,由于△Gθ比H2O低 的氧化物显然用H2 不能将其还原,而且 ,H2-H2O线斜率为正,与M-MO的线 相交的可能性也不大。说明 H2并不是一
无机化学
④对大多数金属氧化物的生成来说,如2M +O2 == 2MO,由于消耗氧气的反应是熵减少 的反应,因而直线有正的斜率,但对反应2C+ O2 == 2CO来说,气体分子数增加,是熵增的 反应,故C-CO线有负的斜率。这样,C-CO 线将与许多金属-金属氧化物线会在某一温度 时相交,这意味着在低于该温度时,CO不如金 属氧化物稳定;但在高于该温度时,CO的稳定 性大于该金属氧化物的稳定性,因而在高于该温 度时, C可以将该金属从其氧化物中还原出来。
Lu Lr
57 La 58
镧 铈 锕 钍
镨
Pr
60 Nd 61 Pm 62 Sm 63 Eu 64 Gd 65
钕 钷
92
钐 铕 钆 镅 锔
Tb Bk
铽 镝
98
66 Dy 67 Ho 68
钬
铒 铥 钔
镱 镥
89 Ac 90 Th 91
镤
Pa
铀 镎 钚
U
93 Np 94 Pu 95Am
96 Cm 97
锫 锎
无机化学
②C还原法 在较低温度时由C生成CO的标准生成自 由能不是太负,但由于C-CO线是负斜率(且 斜率负值较大)线,因而增加了与金属-氧化 物线相交的可能性 ,即很多金属氧化物都可 在高温下被 C 还原, 这在冶金上有十分重要 的意义。以C为还原剂,在低于1000K产物是 CO2,高于1000K生成物则为CO。 CO也是一种还原剂(CO→CO2),由艾林 罕姆图可见,与C相比,在大约1000K以下 CO还原能力比C强,大于1000K则是C的还 原能力比CO强。因为在1000K以上,C的线 已位于CO线之下。 ③活泼金属还原法 位于艾林罕姆图中下方的金属氧化物具有很低的标准生成 自由能,这些金属可从上方的氧化物中将金属还原出来,常用 的金属还原剂有Mg、Al、Na、Ca等
无机化学
根据艾林罕姆图可以选择金属氧化物还原方法,亦即在本章开 始时介绍的金属提取的一般方法的依据。
①氧化物热分解法 位于艾林罕姆图上端的Ag- Ag2O 和 Hg - HgO 线 , 在 273K 时 位 于 △ Gθ = 0 线 的 下 方 , 即 在 273K时,这些氧化物的标准生成 自由能是负值。但温度升高,如 升到673K以上,这时两条线均越 过△Gθ =0的线,即在673K时, △Gθ>0。这一变化意味着Ag2O、 HgO在温度升高时会自动分解。 所以对这些不活泼的金属氧化物 就可以采用氧化物的热分解法来 获得金属。
无机化学
举C还原Al2O3为例来说明这个问 题。从左图可以发现,在低于2100K 温度时,C-CO线位于Al-Al2O3 线 之上,表明Al2O3的生成自由能比CO 要负,所以在低于2100K时,C不能 用作Al2O3 的还原剂。但当温度超过 2100K时CO的生成自由能比Al2O3 的 要负,即C在大于2100K时能从Al2O3 中夺取氧而使Al2O3还原。 再看C还原SiO2 的温度范围。在 低温,如273K时,CO的生成自由能 大于SiO2的生成自由能,所以在此温 度下,C不能还原SiO2 ;但当温度约 在1673K时两线相交,超过此温度时 CO的生成自由能低于SiO2 的生成自 由能,故在T>1673K时,C还原SiO2 的还原反应可以发生。
IIIA IVA 5 B 6 C
VA 7 N
15
VIA VIIA 8 O 9 F
氦
18
He
10 Ne
硼
13
碳
14
氮 氧 磷 硫
51
氟
17
氖
Ar
Na K
Al Ga
4 钾 钙 钪 钛 钒 铬 锰 铁 钴 镍 铜 锌 镓 锗 砷 硒 溴 氪
37 55
IIIB IVB VB VIB VIIB Sc 22 Ti 23 V 24 Cr 25 Mn Y
Cf
99 Es
100 Fm 101Md 102 No 103
锿 镄
锘 铹
无机化学
二、金属的分类
目前已经发现的金属元素90多种。
黑色金属:Fe、Mn、Cr及其合金
分类 有色金属:除Fe、Mn、Cr及其合金以外的所有金属
按密度分:轻有色金属、重有色金属;
有色 金属
按价格分:贵金属、贱金属;
按性质分:准金属和普通金属; 按储量及分布分:稀有金属和普通金属。
成自由能来确定。
氧化物的生成自由能越负,则氧化物越稳定, 金属也就越难被还原。
无机化学
埃林汉姆在1944年首先将氧化物的标准生成自由能对 温度作图(以后又对硫化物、氯化物、氟化物等作类似 的图形),称为自由能-温度图。
原理:用消耗1molO2生成氧化物过程的标准ΔrG对 T做图。根据ΔrG=ΔrH-TΔrS,ΔrH、ΔrS随T变化 不大,假定ΔrH、ΔrS为定值,则ΔrG对T作图便可得 到一条直线,图中ΔrH是截距,-ΔrS为斜率。这种 图在冶金学上具有特别重要的意义。 ①判断哪种氧化物更稳定 ②比较还原剂的强弱 ③估计还原反应进行的温度条件 ④选择还原方法
分散性稀有金属: Ga、In、Tl
高熔点稀有金属:Ti、Zr、Hf、V、Nb、Ta、Mo、W 铂系金属,稀土金属:Sc、Y、La及Ln
放射性稀有金属:Fr、Ra、Tc、Po、At、Ac及An
无机化学
三、存在形式
存在形式的特点: 不活泼的Au、Ag、Pt等以游离态形式存在; 活泼的以化合态;卤化物易溶,所以海水里较多; 难溶的矿藏多。 海水中含大量金属(80多种元素、60多种金属)
1、热分解法 氢后面的金属 例2Ag2O △ Ag+O2↑ 2HgO △ 2Hg+O2
2、热还原法 根据金属活泼性,选择合适的还原剂 ①用焦碳作还原剂:
ZnO + C → Zn+CO
氧化矿、碳酸盐、硫化矿都可用此法。 优点:还原剂价廉易得。 缺点:易造成合金、含碳量高。
无机化学
②用氢气作还原剂: 制取少量不含碳的纯金属和某些稀有金属 例:WO3+3H2=W+3H2O
Cs
56 Ba 57 71 72
Mo 43
Tc
44 Ru 45
Pd
Sn
Sb
52
Te
I
Xe
Hf 73 Ta 74 W 75 Re 76 Os 77 Ir 78 Pt 79 Au 80 Hg 81 Tl 82 Pb 83 Bi 84 Po 85 At 86 Rn Lu 铯 钡 La- 铪 钽 钨 铼 锇 铱 铂 金 汞 铊 铅 铋 钋 砹 氡
第19章 金属通论
青铜四羊方尊
无机化学
教学目的:
1. 了解金属的物理性质
2. 了解金属的化学性质及冶炼方法。
教学重点:金属的化学性质、冶炼 教学难点:金属的化学性质
无机化学
一、元素分类:
1 氢
3 11
§1 概 述
2
IA 1 H
2 锂 铍 3 钠 镁
19
IIA Li 4 Be
12 Mg 20 Ca 21
111 112
7 钫 镭 镧系 锕系
103 104 Rf 105 Db 106 Sg 107 Bh 108 Hs 109 Mt 110 87 Fr 88 Ra 89-
Ac-Lr
钅 钅 钅 钅 钅 钅 Uun Uuu Uub 卢 杜 喜 波 黑 麦
Ce
59
114
Er
69Tm
116
70 Yb 71
118
3、熔盐电解法 较活泼的Al前面的金属适宜用此法 例: NaC1 电解 Na+1/2C12
K Ca Na Mg Al 电解是最强的氧化还原手段. 优点:产品纯、易进行; 缺点:耗电量大,成本高。 4、氧化法 例:
无机化学
使用氧化剂制取金属单质 Au、Ag用氰化法提取。
三、金属还原过程的热力学
前面讨论的各种方法,主要是根据ε 值金属活 动顺序图来选择冶炼方法。现在从热力学的角度, 应用自由能变△Gθ可以判断某一金属从其化合物中 还原出来的难易,以及如何选择还原剂等问题。 金属氧化物越稳定,则还原成金属就越困难。 还原金属氧化物的难易程度,可通过比较它们的生
③用比较活泼的金属作还原剂 例:Cr2O3+2A1 → 2Cr+A12O3 TiC14+2Mg → Ti+2MgC12 注意选择标准: a.还原力强 b.容易处理 c.不与产品金属形成合金 d.可以得到高纯度金属 e.其它产物易和生成金属分离 f.成本低 通常用的是Al、Ca、Mg、Na等。
无机化学
无机化学
③如若一个还原反应能够发生,必须是艾林罕姆 图上位于下面的金属与位于上面的金属氧化物之间 相互作用的结果。反之,位于上面的金属与位于下 面的金属氧化物之间的反应将不发生。 这表明位于下面的金属还原性强。 根据这个原则,从艾林罕姆图可以排列出常见还 原剂在1073K的相对强弱次序: Ca>Mg>A1>Ti>Si>Mn>Na…… 同理, 常见氧化剂在1073K的强弱次序: HgO>Ag2O>Fe2O3>Cu2O>NiO>Fe3O4>CoO
