第七章 金属通论
金属概论 ppt

(2)热还原法:中等活泼金属 4、下列反应原理不符合工业冶炼金属实际情况的是( )
温度的影响
2、了解常见金属及其重要化合物的主要性质和应用
(3)优良的延性(Pt)、展性(Au) (1)等体积、等浓度时,放出H2由多到少的顺序是
3、随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( )
KCuC+(aFeNCa1l3M)—g—A金;l ZMn属gF+e N光SHn4PC泽bl—(H—:) Cu大Hg多Ag 银Pt A白u 色,除Cu(紫红)、Au(金黄)
Os)、硬度(碱金属;
还 1、原了剂解:常焦见注碳金、属意一的氧活:化动碳顺很、序氢多气、金活泼属金属整Al等块时的颜色与粉末状不同(如:Fe、Ag)
两性金属如Al、Zn
(5)与氧化物作用 Mg + CO2 铝热反应:Al+
Fe2O3 MnO2 Cr2O3 V2O5
(6)金属离子放电顺序:逆金属活动顺序
(7)与有机物:含-OH: 羧酸、酚、醇 焰色反应: Na K
四、Байду номын сангаас炼方法(必修2:p88-89)
存在形式:大多以化合态,Au、Ag主要游离态
(1)电解法:活泼金属 Na、Mg、Al
Fe + CuSO4 == FeSO4 + Cu (湿法炼铜)
五、合金的概念(必修1p64)
由两种以上的金属(或金属跟非金属)熔合而成的具 有金属特性的物质。
合金具有许多优良的物理、化学或机械性能: 如:合金的硬度一般比它的各成分金属的大(如: Mg合金或铝合金、钢等),多数合金的熔点比它 的各成分金属的低(便于锻造)
3、了解合金的概念及其重要应用。
《金属通论》课件

04
金属的冶炼与加工
金属的冶炼
火法冶炼
通过高温熔炼、氧化还原、蒸馏 等方法,将矿石中的金属元素以
液态或气态形式提取出来。
湿法冶炼
利用酸、碱、盐等化学试剂,通过 溶解、沉淀、萃取等方法,将矿石 中的金属元素分离出来。
电化学方法
利用电解原理,将矿石中的金属元 素在电极上还原或氧化成金属单质 的过程。
金属的焊接与切割
钎焊
采用比母材熔点低的金属材料作为钎料,将母材和钎料加热到高于钎料熔点但低于母材熔点的温度, 利用液态钎料润湿母材和填充接头间隙并与母材相互扩散实现连接。
火焰切割
利用燃气与氧气混合燃烧产生的热能将金属切割成所需形状和尺寸。
金属的焊接与切割
激光切割
利用高能激光束照射金属表面,使局 部金属迅速熔化或汽化,同时用高速 气流将熔化或汽化的金属吹走,实现 切割。
日常生活中的应用
餐具
金属餐具如不锈钢刀叉、勺子等在日常餐饮中广泛应用,具有美 观、耐用和易于清洗的特点。
家居用品
金属在家庭用品中也有广泛应用,如金属晾衣架、金属储物架等 ,具有结实、美观和易于安装的特点。
电子产品
金属在日常生活中常见的电子产品中也有广泛应用,如手机、电 脑等电子设备的机身和内部结构件。
01
02
03
金属的热膨胀
金属受热时,体积会膨胀 ,这是因为金属内部的原 子或分子的运动速度会增 加。
金属的热传导
金属具有良好的热传导性 ,热量可以迅速地从一个 部分传导到另一个部分。
金属的热容
金属的热容是指金属在温 度升高或降低时吸收或释 放热量的能力。
金属的电学性质
金属的导电性
金属是电的良导体,因为金属内部的自由电子可以在 电场的作用下流动。
《金属元素通论》课件

维持生理功能
人体内的一些金属元素如铁、铜 、锌、钴等是维持正常生理功能 所必需的,缺乏或过量都会影响 人体健康。
治疗疾病
一些金属元素如铂、钯、铑等在 医学上用于治疗癌症等疾病,通 过与癌细胞结合或影响细胞代谢 等方式发挥抗癌作用。
PART 04
金属元素的提取与冶炼
金属元素的提取方法
物理提取法
利用金属元素与其他物质在物理 性质上的差异,如密度、导电性 等,进行分离。如浮选法、电磁
金属元素在古代医学中也有广泛 应用,如金、银、铜等元素被用 于制作医疗器械和药品,治疗各
种疾病。
金属元素在现代工业中的应用
金属元素在现代工业中发挥着至关重 要的作用,如钢铁、铝、铜等金属材 料被广泛应用于建筑、机械、电子等 领域。
金属元素在航空航天工业中也有广泛 应用,如钛、铝、钢等金属材料被用 于制造飞机和火箭等航空航天器。
金属元素在新能源领域的应用也将越来越广泛,如利用金属元素制备新型电池材料 、太阳能电池等,以提高能源利用效率和减少环境污染。
2023-2026
END
THANKS
感谢观看
KEEP VIEW
REPORTING
金属元素性质
总结词
金属元素的性质包括物理性质和化学性质,其中物理性质包括颜色、光泽、硬度 、密度等,化学性质包括氧化还原性、配位性等。
详细描述
金属元素的物理性质是其最基本和直观的特性,如颜色、光泽、硬度、密度等。 而化学性质则是金属元素与其他物质相互作用时表现出的性质,如氧化还原性、 配位性等。这些性质决定了金属元素在生产和生活中的应用范围和价值。
金属元素在工业生产中的应用
制造合金
金属元素是许多合金的主要成分,如 钢铁、铝合金、铜合金等,用于制造 各种工业设备和产品。
[化学]奥赛辅导 金属通论
![[化学]奥赛辅导 金属通论](https://img.taocdn.com/s3/m/4b2e284569eae009581bec20.png)
金属的物理性质
超导材料大致可分为纯金属、合金和化合物三类。 超导材料大致可分为纯金属、合金和化合物三类。 超导材料可以制成大功率超导发电机、 超导材料可以制成大功率超导发电机、磁流发电 超导储能器、超导电缆、超导磁悬浮列车等。 机、超导储能器、超导电缆、超导磁悬浮列车等。 4、金属的延展性:金属有延性,可以抽成细丝。 、金属的延展性:金属有延性,可以抽成细丝。 例如最细的白金丝直径为1/5000mm。金属又有展性, 例如最细的白金丝直径为 。金属又有展性, 可以压成薄片,例如最薄的金箔,可达1/10000mm厚。 可以压成薄片,例如最薄的金箔,可达 厚 5、金属的密度:锂、钠、钾比水轻,锇、铁等 比水轻, 、金属的密度: 比水重。 比水重。 6、金属的硬度:一般较大,但它们之间有很大 、金属的硬度:一般较大, 差别。有的坚硬,如 钨等;有些软,可用小刀切割 差别。有的坚硬 如铬、钨等;有些软 可用小刀切割 如钠、钾等。
金属的化学性质
一、金属与非金属反应 位于金属活动顺序表前面的一些金属很与氧化合 形成氧化物, 钾的氧化很快, 铯会发生自燃。 形成氧化物,钠、钾的氧化很快,铷、铯会发生自燃。 位于金属活动顺序表后面的一些金属,如铜、 位于金属活动顺序表后面的一些金属,如铜、汞 等必须在加热情况下才能与氧化合,而银、 等必须在加热情况下才能与氧化合,而银、金即使在 炽热的情况下也很难与氧等非金属化合。 炽热的情况下也很难与氧等非金属化合。 如铝、铬形成致密的氧化膜, 如铝、铬形成致密的氧化膜,防止金属继续被氧 即钝化。 化,即钝化。 在空气中铁表面生成的氧化物结构疏松,因此, 在空气中铁表面生成的氧化物结构疏松,因此, 铁在空气中易被腐蚀。 铁在空气中易被腐蚀。
金属通论
概 述 金 属 的 物 理 性 质 金 属 的 化 学 性 质 金 属 的 提 炼 艾 林 汉 图 合 金 本 章 要 求 作 业
【冶金精品文档】金属通论

•19.2 金属的提 炼金属的提炼-从自然界索取金属单质的过程。
•金属的提炼过程-矿石的富集、冶炼和精炼。 •矿石富集方法-手选、水选、磁选和浮选。 •金属的冶炼方法-干法和湿法两大类。 •金属的精炼-粗金属根据纯度要求再进行的精制。
19.2.1 金属还原过程的热力学
从图中可以看出, 凡rG为负值区域内 的所有金属都能自动 被氧气氧化,凡在这 个区域以上的金属则 不能。由图可知约在 773K以上Hg就不被 氧所氧化,而HgO只 需稍微加热,超过773K 就可以分解得到金属。
✓ 贵金属:这类金属包括金、银和铂族元素,由 于它们稳定、含量少、开采和提取困难、价格 贵,因而得名贵金属。
✓ 准金属:半导体,一般指硅、硒、碲、砷、硼 。
✓ 稀有金属:自然界中含量很少,分布稀散、发 现较晚,难以从原料中提取的或在工业上制备 和应用较晚的金属。如:锂、铷、铯、钨、锗 、稀土元素和人造超铀元素等。
三、电解法 排在铝前面的几种活泼金属,不能用一般还原剂使
它们从化合物中还原出来。这些金属用电解法制取最 适宜,电解是最强的氧化还原手段。
电解法有水溶液电解和熔盐电解法两种。活泼的金 属如铝、镁、钙、钠等用熔融化合物电解法制备。
一种金属采用什么提炼方法与它们的化学性质、矿 石的类型和经济效果等有关。金属的提炼方法与它们 在周期表中的位置大致关系见表。
有色金属是指除去铁、铬、锰之外的所有金属 。有色金属大致上按其密度、价格、在地壳中 的储量和分布情况、被人们发现以及使用的早 晚等分为五大类:
✓ 轻有色金属:一般指密度在4.5g/cm3以下的 有色金属,如:铝、镁、钠、钾、钙、锶、钡 。
✓ 重有色金属:一般指密度在4.5g/cm3以上的 有色金属,其中有铜、镍、铅、锌、钴、锡、 汞、锡等。
金属

(2)金属特性 钨的熔点最高——做灯泡的灯丝 银的导电性最好——电子工业 铜的导电性好——做导线(价格低) 铂、金:延展性好
C+O2
点燃
CO2
如“百炼成钢”、“千锤百 炼”
4、钛合金 性能: a、优异的耐腐蚀性 b、熔点高、密度小 c、易于加工、机械性能 好 d、与人体有很好的“相容性”(人造 骨) (3)用途: 火箭、航天飞机、人造卫星、人造骨、 导弹、船舶、化工、喷气发动机等
练习1钛和钛合金是21世纪的重要金属材料, 它们具有优良的性能,如熔点高,密度小, 可塑性好,机械性能好,抗腐蚀能力强, 钛合金与人体很好的“相容性”。根据它 们的主要性能,不合实际的用途是( C ) A.用于核潜艇设备的制造 B.用于制造航天设备 C.用来做保险丝 D.可用来制造人造骨
(1)金属与金属:如黄铜(Cu—Zn)、 青铜(Cu—Sn)
(2)金属与非金属:如硅钢(Fe—Si)、
生铁(Fe—C)
合金比组成它的成分金属:
硬度大、熔点低、抗腐蚀性 强!
3、铁合金
生铁
区别
钢
含碳量不同
含碳量 性能
2%-4.3%
0.03%-2%
钢比生铁的弹性好、韧性强、 可塑性强、耐腐蚀性强。
生铁炼钢的目的 ——降低生铁里的含碳量
资料——金属之最
1、地壳中含量最高的金属元素? O Si Al Fe Ca
2、人体含量最高的金属元素?Ca 5、熔点最低的金属? Li
二、合金——在金属中加入某些金属 或非金属熔合而成的具有金属特性的 物质。 注意: 合金是混合物
金属学原理复习资料

金属学原理复习资料第一章金属的晶体结构1、什么是金属学?答:研究金属与合金的成分、组织、性能以及三者之间的关系及其变化规律的学科。
2、金属与非金属的本质区别是?答:金属是具有正的电阻温度系数的物质,其电阻随温度的升高而增加;非金属是具有负的电阻温度系数的物质。
3、为什么原子总是自发的趋于紧密排列?答:最密排列时结构最稳定,能量最低。
4、晶体的特性有哪些?答: (1)具有一定的熔点(2)具有固定外形(3)具有各向异性5、常见3种典型晶体结构。
原子数原子半径配位数致密度滑移面滑移方向滑移面系数Bcc280.68{110}<111>12 Fcc4120.74{111}<110>12Hcp6120.74{0001}36、什么是多晶性转变或同素异构转变?答:当外部条件(温度、压强)改变时,金属内部由一种晶体结构转变成另一种晶体结构的转变。
7、纯铁的同素异构转变:δ-Fe —(1394℃) →?-Fe —(912℃) →ɑ-Fe8、常见晶体缺陷有哪些?答:(1)点缺陷:空位、间隙原子、置换原子。
(2)线缺陷:刃型位错、螺旋位错。
(3)面缺陷:晶体表面、内界面(晶界、亚晶界、孪晶界、堆垛层错、相界)。
9、什么是柏氏矢量?答:用来表示位错的性质,和表示位错的晶格畸变的大小和方向,从而使人们研究位错时摆脱位错区域原子具体排列细节的约束的一个矢量。
10、什么是堆垛层错?答:晶面堆垛顺序发生局部差错而产生的一种晶体面缺陷。
11、相界有哪几类?答:共格界面、半共格界面、非共格界面。
12、什么是共格界面?答:指界面上的原子同时位于两相晶格的结点上,为两种晶格所共有。
13、刃型位错的柏氏矢量与其位错线相垂直,这是刃型位错的一个重要特征。
14、螺型位错的柏氏矢量与其位错线相平行,这是螺型位错的重要特征。
15、不含位错的晶须,不易塑性变形,因而强度很高;而工业纯铁中含有位错,易于塑性变形,所以强度很低。
《金属工艺学第七章》PPT课件

第七章 铸造成形
3、铸造的特点(重点)
优
点 适于做复杂外形,特别是 复杂内腔的毛坯。
缺 点 工艺过程比较复杂,一些工艺
过程还难以控制。
适应性强,重量,壁厚, 形状,材料种类几乎不受 限制。
成本低,原材料来源广泛, 价格低廉,一般不需要昂 贵的设备。
第七章 铸造成形
第七章 铸造成形
2.影响因素 1)铸件的凝固方式
温度 温度
逐层凝固 糊状凝固 中间凝固
a bc
液相线
S
液相线 固相线
成分
固
表层
液
中心
固
表层
液
中心 表层 中心
凝固区
第七章 铸造成形
2) 影响因素
a)主要取决于合金成分。
a2
a1
300
共晶成分的合金(纯金属除外),流动性 好。
温度(℃)
c)铸型材料
铸型排气: ↓,流动阻力↑ ,流动性越差。 铸型的导热性: ↑,液态金属温度↓,流动性越差 铸型温度: ↑,液态金属与铸型的温差↓,流动性越差
第七章 铸造成形
二、合金的收缩性 收缩的阶段 收缩的影响因素 缩孔与缩松 铸造应力、变形与裂纹
第七章 铸造成形
1.合金的收缩经历三个阶段:
液态收缩:T浇 — T液 凝固收缩:T液 — T固 固态收缩:T固 — T室
脆性金属和合金(如铸铁 等),铸造是唯一可行的 工艺。
铸件内部组织的均匀性、致密性一 般较差。
铸件易出现缺陷(缩孔、缩松、气 孔、砂眼、夹砂、裂纹等),产品 质量不够稳定。
铸件力学性能比同类材料的塑性成 形件低.
常见重要元素及其化合物—S区重要的元素及其化合物(医用化学课件)

在同周期元素中,碱金属的原子半径最大,而核电荷
最小。由于内层电子的屏蔽作用较强,故这些元素很容易 失去最外层的一个s电子,从而使碱金属的第一电离势在同 周期元素中为最低。因此,碱金属是同周期元素中金属性 最强的元素。 M - e - → M+ 极强的还原性
二、碱金属
(二)钠、钾的物理性质和化学性质 1. 钠、钾都是银白色金属,有一定导电性和导热性,熔
Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 砹氡
注:人体必需宏量元素,人体必需微量元素,__为有害元素
一、卤族元素
非 金 属 性 逐 渐 减 弱
一、卤族元素
(一)概述
ⅦA: F Cl Br I At (X) ns 2np5
卤素的基本性质
焰色反应 钠和钾发生焰色反应时,钠为黄色,钾为紫色(隔蓝色钴玻璃观察)。
二、碱金属
2.在隔绝空气的条件下,钠、钾均可与水反应,生成氢氧化 物并放出氢气。
2Na + H2O = NaOH+H2↑
二、碱金属
(三)钠和钾的重要化合物
与水反应 2Na2O2 + 2H2O
4NaOH + O2
Na2O2 + H2SO4(稀) 过氧化物 与稀硫酸反应
金属单质都能形成晶体结构,金属呈电中性。
一、金属通论
(二)金属的物理性质和化学性质
物理 性质
化学 性质
具有特殊金属光泽、不透明 银导电性最好。
具有良好的导电性、导热性 铂延性最好。
密度和硬度较大
金展性最好
具有延展性 熔点较高
锇密度最大 (2248g/cm3)。 铬硬度最大。 钨熔点最高,汞熔点最
高三化学金属通论及碱金属.doc
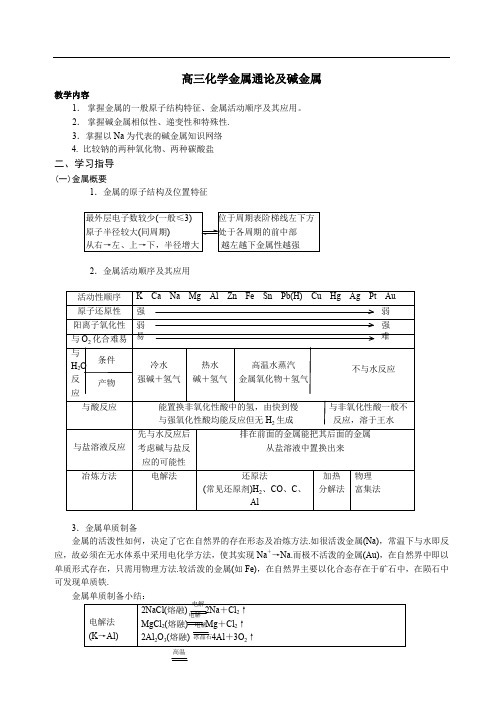
高三化学金属通论及碱金属教学内容1.掌握金属的一般原子结构特征、金属活动顺序及其应用。
2.掌握碱金属相似性、递变性和特殊性.3.掌握以Na为代表的碱金属知识网络4. 比较钠的两种氧化物、两种碳酸盐二、学习指导(一)金属概要1.金属的原子结构及位置特征最外层电子数较少(一般≤3) 位于周期表阶梯线左下方原子半径较大(同周期) 处于各周期的前中部从右→左、上→下,半径增大越左越下金属性越强2.金属活动顺序及其应用3.金属单质制备金属的活泼性如何,决定了它在自然界的存在形态及冶炼方法.如很活泼金属(Na),常温下与水即反应,故必须在无水体系中采用电化学方法,使其实现Na+→Na.而极不活泼的金属(Au),在自然界中即以单质形式存在,只需用物理方法.较活泼的金属(如Fe),在自然界主要以化合态存在于矿石中,在陨石中可发现单质铁.金属单质制备小结:高温注意 Na +KCl K +NaCl由于沸点:Na >K ,符合勒沙特列原理。
(二)Na 为中心的知识网络HClNa 2S Na 2O Na 2O 2 NaCl NaH Na NaOH Na 2CO 3 NaHCO 3C 6H 5OHC 2H 5ONa K C 6H 5ONa CH 3COONa (三)碱金属的相似性、递变性被空气O 2氧化 与H 2O 反应3Li 11Na 19K 37Rb 55Cs区分碱金属投入水中产生现象的异同:现象: Li Na K Ru 、Cs共同点 浮、熔、游、气、 红(酚酞) 沉不同点: 不熔 熔 火球、轻微爆炸 立即燃烧 甚至爆炸逐渐消失 很快消失 800℃ 金 金 熔 密 较慢 较缓慢 子 属 属 沸 度 很快 剧烈性 键 点 递 递 减 降 增 剧烈 剧烈 增 弱 低 自燃 爆炸燃烧 伴随碱性渐 增 C 2H 5O H H 2CO 2 Ca(OH)2 SO 2O 2HClKCl 碱石灰 △ CH 3COO H 点燃 ρ石蜡<ρLi <ρ煤油<ρO H 2ρ煤油<ρNa <ρO H 2ρ煤油<ρK <ρNa <ρO H 2 ρ煤油<ρO H 2< ρRb <ρCs 剧烈 剧烈(五)比较碳酸钠和碳酸氢钠三、典型例析:例1.试分析下列问题思考1.为什么Li与H2O反应比Na与H2O反应缓慢得多?思考2.碱金属均可保存在煤油中吗?解析1:一方面Li的活泼性弱于Na,另一方面是因为生成的LiOH微溶于水,覆盖在Li表面,使Li与H2O的接触面减小,反应速率降低.值得一提的是:根据周期表中对角线相似规则,Li与Mg的化合物性质有相似性如Mg(OH)2 MgCO3 MgF2 难或微溶于水LiOH Li2CO3 LiF (水溶性相似)解析2:选择合适的保护液,必须符合以下条件:①不能与待保护的物质发生化学反应.如乙醇能与Na等反应,故不能用醇、酸类等有机物.②密度比待保护的物质密度小.只有让待保护物沉降在保护液下,才能起到不与空气接触的目的(即液封).否则,浮在液面上,照常与空气接触,故Li不能用煤油保存.,应用石蜡油。
无机化学《金属通论》教案

无机化学《金属通论》教案[ 教学要求]1 .从金属结构的角度认识金属的共性。
2 .了解金属冶炼的方法及现状,掌握埃林汉姆图的意义及使用方法。
3 .了解合金的基本知识。
[ 教学重点]1 .从金属结构的角度认识金属的共性。
2 .金属氧化物的埃林汉姆图的意义及使用方法。
[ 教学难点]金属的共性与其结构的关系。
[ 教学时数] 2 学时[ 主要内容]1 .金属的分类及存在。
2 .金属氧化物的埃林汉姆图,工业上冶炼金属的一般方法。
3 .金属的物理和化学通性。
4 .合金。
[ 教学内容]19-1 概述到目前为止,已知元素有109 种,其中金属约有87 种,效金属 5 种,非金属17 种。
其中有12 种元素是用人工方法合成的。
金属通常可分为黑色金属与有色金属两人类,黑色金属包括铁、锰和铬及它们的合金,主要是铁碳合金( 钢铁) ,有色金属是指除去铁、铬、锰之外的所有金属。
有色金属大致上按其密度、价格、在地壳中的储量及分布情况、被人们发现和使用的早晚等分为五大类:1 .轻有色金属:一般指密度在4.5g/cm3以下的有色金属,包括铝、镁、钠、钾、钙、锶、钡。
这类金属的共同特点是:密度小(0.53 — 4.5g/cm3 ) ,化学性质活泼,与氧、硫、碳和卤素的化合物都相当稳定。
2 .重有色金属:一般指密度在4.5 g/cm3以上的有色金属,共中有铜、镍、铅、锌、钴、锡、锑、汞、镉、铋等。
3 .贵金属:这类金属包括金、银和铂族元素( 铂、铱、俄、钌、钯、铑) ,由于它们对氧和其它试剂的稳定性,而且在地壳中含量少,开采和提取比较困难故价格比一般金属贵,因而得名贵金属。
它们的特点是密度大(10.4 — 22.48 g/cm3 ) ;熔点高(1189 — 3273K) ;化学性质稳定。
4 .准金属:一般指硅、铭、硒、砷、硼,其物理化学性质介于金属与非金属之间,如脆,是电和热的不良导体。
5 .希有金属:通常是指在自然界中含量很少,分布稀散、发现较晚,难以从原料中提取的或在工业上制备及应用较晚的金属。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
① ②
773K时 (②-①)得
θ
MnO + C === Mn + CO
1773K时 (②-①)得
ΔrG
1 θ 1 Δ r G (Δ r G θ Δ G ) 160 kJ mol 2 r 1 2
MnO + C === Mn + CO
1 1 (Δ r G θ Δ G ) 15 kJ mol 2 r 2
例如铋的熔点为544K,镉的熔点为594K,铋镉合 金的最低熔化温度是413K,这个温度称为最低共熔温度 而组成对应于这一温度的合金称为低共熔混合物。
二、金属固溶体
固熔体具有一种均匀的组织。它是合金组成 物在固态下彼此相互溶解而形成的晶体,称为固 溶体(固态溶液),分为置换固溶体、间充固溶 体和缺位固溶体。
7.1 概述 一、金属元素的位置和价电子结构特点 s区 (IA, IIA)金属 p区 (IIIA –VIA)金属 d区 (IIIB-VIII)金属 ds区 (IB-IIB)金属 f区 (镧系,锕系)金属 ns1-2 ns2np1-4 (n-1)d1-9ns1-2 (n-1)d10ns1-2 (n-2)f0-14(n-1)d0-2ns2
○ ○ ○ ○ ○ ○ ○ ○
纯金属
○ ○ ○ ○ ○ ○ ○ ○
置换固溶体
○ ○ ○ ○ ○
缺位固溶体
间隙固溶体
纯金属和各种固溶体示意图
金属化合物
当两种金属元素的电负性、电子构型和原子 半径差别较大时则易形成金属化合物,又称金属 互化物。 有组成固定的“正常价”化合物和组成可变的 电子化合物,它们的结构不同于单一金属。在正 常价化合物中的化学键介于离子键和共价键之间。 大多数金属化合物是电子化合物,它们以金 属键结合,其特征是化合物中价电子数与原子数 之比有一定值。 返回
氧化法,如金银的提取。
三 、金属的精炼 1. 电解精炼: 粗金属锭—电解阳极 纯金属薄片--- 电解阴极 Au, Ag, Cu, Sn, Pb, Zn
2. 气相精炼
3. 区域熔炼
7.3 合金
一、 低共熔混合物(低共熔合金)
在熔化状态时金属可以相互溶解或相互混合 形成合金,金属与某些非金属也可以形成合金, 故合金可认为是具有金属特性的多种元素的混合 物,它的熔点总比任一纯金属的熔点要低。
19-4 已知773K时, 2Mn + O2 === 2MnO 2C + O2 === 2CO; 1773K时,
1 G 510 kJ mol 2Mn + O2 === 2MnO; r
r G 670 kJ mol 1
r G 350 kJ mol 1
金属元素的氧化态 1.可变氧化态 s区 : 无 p区: 不连续变化 d区: 连续变化 ds区: 特殊
2. 金属元素氧化态变化规律 P 区金属: 从上至下, 低氧化态趋于稳定 d 区金属: 从上至下, 高氧化态趋于稳定
Cr--- Mo--- W 高氧化态稳定
Ge---Sn---Pb 低氧化态稳定
二、 金属的分类
选择哪一种金属做还原剂,除rG来判断外还要注意下几方面情况: (1) 还原力强; (2) 容易处理; (3) 不和产品金属生成合金; (4) 可以得到高纯度的金属; (6) 成本尽可能低,等等。 (5) 其它产物容易和生成金属分离;
3.电解法 制备活泼金属 2 NaCl (l) === 2 Na + Cl2 4. 氧化法 使用氧化剂制取金属单质的方法称为
2C + O2 === 2CO;
r G 540 kJ mol 1
试计算在773K和1773K时反应: MnO(s) + C(s) === Mn(s) + CO(g)
G 的 r ,说明用C(s)还原MnO(s)应在高温
还是低温条件下进行?
解:
2Mn + O2 === 2MnO 2C + O2 === 2CO
<0,而反应物生成物均为
气态,随温度升高而无相变发生,故斜率一 直为正且保持不变。
⑤ 该反应的
r S <0,开始时斜率为
正,但当T>1387.15K时,PbS熔化,
r S >0,图象斜率变为负,
当T >2013.15K时, Pb气化,
r S <0图象斜率又变为正。
(2) 提取HgS中的Hg: 可以用C为还原剂,T>900K, 或 用H2为还原剂, T>300K; 提取Bi2S3中的Bi: 可用C为还原剂,T>1000K, 或用H2为还原剂,T>773K; 提取PbS中的Pb: 可用C为还原剂,T>2800K。
金属氧化物越稳定,氧化 物的生成自由能越负的, 而金属就越难被还原。
从图中所得信息: 1.任何一类化合物中哪些金属化合物稳定。 稳定性高的化合物ΔrGo负值大, ΔrGo-T直线位 于图的下方,稳定性低的化合物ΔrGo负值小, ΔrGo-T直线位于图的上方. 2. 可以找出某些金属化合物分解的适宜温度。 3.寻找适宜的还原剂。 一种化合物能被位于其下面的那些金属或其它 还原剂所还原.
用C或 CO做还原剂 氧化物 SnO2 + 2C == Sn + 2CO Cu2O + C 碳酸盐矿 ZnCO3 ZnO + C == 2 Cu + CO Fe2O3 + CO == 2Fe + 3CO2 ZnO + CO2 Zn + CO
硫化物矿 2PbS + 3O2 == 2PbO + 2S(1) ① 在273K~319.45K时,该反应的 r <0,
图象斜率为正,当T>319.45K时,CS2发 生相变,由液相变为气相, r S >0,斜率 变 为负值。 ② 该反应的 r S <0,图象斜率为正值,当 T>717.824K时,Hg,S相继由液相变为气 相,此时,体系的熵变比原来的更小,即
黑色金属(铁,锰,铬及其合金) 金属 有色金属 轻有色金属和重有色金属 贵金属和贱金属 准金属和普通金属 稀有金属和普通金属
有色金属大致上按其密度、价格、在地壳中的储量和分布情况、被人们发现以及使用的早晚等分为几类
7.2 金属的提炼
一、金属还原过程的热力学 (自由能—温度图, 埃林汉姆图)
艾林汉在1944年首先用消耗1molO2 生成氧化物过程的标准自由能变对温 度作图。 由: rG=rH-TrS
第七章 金属通论
本章要求: 1. 从金属结构的角度认识金属的共性; 2. 了解金属冶炼的方法; 3. 掌握埃林汉姆(Ellingham)图的意义及 使用方法; 4. 了解合金的基本知识。
元素周期表
Ⅰ A (1) Ⅱ A (2) Ⅲ BⅣ B Ⅴ B Ⅵ BⅦ B (3) (4) (5) (6) (7) ⅧB (8) (9) Ⅰ B Ⅱ B (10) (11) (12) VIIIA Ⅲ A Ⅳ A Ⅴ AⅥ A Ⅶ A (18) (13) (14) (15) (16) (17)
由(①-②)得: NiO + CO === Ni + CO2
1 -1 r G (Δ r G θ G ) -42 kJ mol 1 r 2 2
对照图19-1在该温度下不能用CO还原NiO制取Ni.
19-3 下图是几种金属硫化物的埃林汉姆图。 (1)请解释图中各条线形状变化的意义; (2)据图,若从硫化物中提取金属,适宜 的还原剂和温度条件各如何? (1)C + S == CS2 (2)Hg + S === HgS (3)Bi + S === Bi2S3 (4)H2 + S === H2S (5)Pb + S === PbS
二、金属的冶炼方法
冶炼---工业上的还原过程,即把金属从化合物中的还原成单质。
1.热分解法
不活泼金属的化合物, 标准 生成自由能负值小, 易分解。 2 HgO 2Ag2O HgS + O2 2 Hg +O2 4Ag + O2 Hg + SO2
辰砂 HgS
2. 热还原法 从矿石提取金属最常见的方法 (1) 碳热还原法
解:可查得如下物质的熔、沸点:
数 据 项目 α 385.9 3925. 15 熔点/K ~ 3910. 15 5 β 392.1 5 γ 393.1 5 5100. 15 717.8 24 629.5 8 2013. 15 1833. 15±5 319.4 5 856.6 5 (升华) 958.1 5 (分解) 212.4 5 14 234.2 8 600.6 52 544.4 5 164.5 5 187.6 5 单 质 C S H2 Hg Pb Bi CS2 HgS Bi2S3 H2S
19-2 已知在973K时, 2CO + O2 == 2CO2; ΔrGθ= -398 kJ·mol-1 2Ni + O2 == 2NiO; ΔrGθ= -314 kJ·mol-1 试计算该温度下CO + NiO == Ni + CO2的ΔrGθ 值,并对照图19-1氧化态的自由能—温度图,说明 在该温度下能否用CO还原NiO制取Ni。 解: 2CO + O2 === 2 CO2 2 Ni + O2 === 2 NiO ① ②
PbO + C (2) 氢热还原法
制备少量纯金属
Pb + CO
WO3 + 3 H2 == W + 3H2O
(3) 金属热还原法(金属置换法)
常用Na, Mg, Ca, Al做还原剂, 铝是最常用的还原剂即铝热法。
TiCl4+4Na==Ti+4NaCl TiCl4+2Mg==Ti+2MgCl2 Cr2O3 + 2Al == 2Cr + Al2O3
