吸光光度法(全加黑)ppt
合集下载
第九章 吸光光度法

发生相互作用。 假定只有在稀溶液(c<10-2mol/L)时才基本符合。 当溶液浓度c >10 -2 mol/L 时,吸光质点间可能发 生缔合等相互作用,直接影响了对光的吸收。 故:朗伯—比耳定律只适用于稀溶液。 溶液中存在着离解、聚合、互变异构、配合物的 形成等化学平衡时。使吸光质点的浓度发生变化 ,影响吸光度。
度的乘积成正比。 朗伯——比耳定律不仅适用于有色溶液,也适 用于其它均匀、非散射的吸光物质(包括液体、气 体和固体),是各类吸光光度法的定量依据。
A bc
式中,A:吸光度,描述溶液对光的吸收程度; b:液层厚度(光程长度),通常以cm为单位; c:溶液的摩尔浓度,单位mol· -1; L
无线电波 11000m
光谱名称 波长范围 X射线 0.1—10nm 远紫外光 10—200nm
跃迁类型
辐射源
分ห้องสมุดไป่ตู้方法 X射线光谱法
真空紫外光 度法
K和L层电子 X射线管 中层电子 氢灯 氢灯 钨灯
碳化硅热棒
近紫外光 200—400nm 价电子 可见光 400—750nm 价电子
近红外光 0.75—2.5μ m 分子振动 中红外光 2.5— 分子振动 5.0μ m
A总 lg(I01 I02 ) /(I01 10
1bc
I02 10
2bc
)
讨论: A总 lg(I0 I0 ) /(I0 10
1 2 1
1bc
I02 10
2bc
)
(1) 1= 2 = 则: A总 =lg(Io/It)= bc
(2) 若 2≠ 1 ;A与C则不成直线关系。 2与 1
I0 A lg I t A Kbc
吸光光度法-原理介绍PPT

2、摩尔吸光系数ε的讨论
(1)吸收物质在一定波长和溶剂条件下的特征常数; (2)不随浓度c 和光程长度b 的改变而改变。在温度和波 长等条件一定时,ε 仅与吸收物质本身的性质有关,与待测
物浓度无关;
(3)可作为定性鉴定的参数; (4)同一吸收物质在不同波长下的ε值是不同的。在最大吸 收波长λmax处的摩尔吸光系数,常以εmax表示。εmax表明了该 吸收物质最大限度的吸光能力,也反映了光度法测定该物质
1.显色剂用量
吸光度A与显色剂用量CR 的关系会出现如图所示的几种 情况。选择曲线变化平坦处。
2.反应体系的酸度
在相同实验条件下,分别测定不同pH值条件 下显色溶液的吸光度。选择曲线中吸光度较大且 恒定的平坦区所对应的pH范围。
3.显色时间与温度
实验确定
4.溶剂
一般尽量采用水相测定,
三、共存离子干扰的消除
(4)不同浓度的同一种物质,在某一定波长下吸光度 A 有差异,在λmax处吸光度A 的差异最大。此特性 可作为物质定量分析的依据。 (5)在λmax处吸光度随浓度变化的幅度最大,所以 测定最灵敏。吸收曲线是定量分析中选择入射光波 长的重要依据。
二、光的吸收定律 1.朗伯—比耳定律
•
布格(Bouguer)和朗伯(Lambert)先后于1729年和
应控制A:0.2~0.8之间。控制方法:
吸收曲线的讨论:
(1)同一种物质对不 同波长光的吸光度不 同。吸光度最大处对 应的波长称为最大吸 收波长λmax (2)不同浓度的同一种物质,其吸收曲线形状相似 λmax不变。而对于不同物质,它们的吸收曲线形状和 λmax则不同。(动画)
吸收曲线的讨论:
(3)吸收曲线可以提供物质的 结构信息,并作为物质定性 分析的依据之一。
武汉大学无机及分析化学ppt (吸光光度法)

选择性
2 测定浓度控制
控制浓度 吸光度A:0.2~0.8
减少测量误差
3 参比溶液选择
仪器调零 消除吸收池壁和溶液对入射光的反射 扣除干扰
试剂空白 试样空白 褪色空白
4 标准曲线制作
理论基础:朗伯-比尔定律
相同条件下 测定不同浓度标准溶液的吸光度A A~c 作图
A
0 .3 5
0 .3 0
0 .2 5
0 .2 0
0 .1 5
0 .1 0
0 .0 5
0 .0 0
0
1
2
3
4
5
6
7
8
c o n c e n tra tio n
12.6 吸光光度法的误差
对朗伯-比尔定律的偏移 非单色光引起的偏移 物理化学因素:非均匀介质及化学反应 吸光度测量的误差
显M 色+ n反L应= 体M系Ln中显的色副反反应应影响 *其它离子可能与显色剂反应:M´ + nL = M´Ln,消耗显色剂; *L受酸效应影响,有L-、HL+等形态存在;被测离子有络合效应
e 表示物质的浓度为1mol/L,液层厚度为1cm时溶液的吸光度。单位:
(L•mol-1 •cm-1)
桑德尔(sandell)灵敏度: S 当仪器检测吸光度为0.001时,单位截面积光程内所能检测到
的吸光物质的最低含量。 单位:mg/cm2
S=M/e
推导:根据定义0.001=εbc 故 bc =0.001/ε (1) c为浓度,单位为mol/1000cm3,b为cm, bc表示单位截面积光程内的摩尔数,即 mol/1000cm2,如果bc乘以被测物质的分子量M,则得单位截面积光程内被测物质的量, 即桑德尔灵敏度S。 S=(bc/1000)×M×106 = bcM × 103(μg·cm-2),将(1)的bc=0.001/ε代入,S=
第9章吸光光度法(2)。

60nm
二、 显色条件的选择
吸光光度法是测定待测物质的吸光度或显色 反应平衡后溶液的吸光度,因此为了得到准确的 结果,必须控制适当的条件,使显色反应完全和 稳定。
显色条件包括: 溶液酸度,显色剂用量,显 色时间,显色温度,有机络合物的稳定性及共存 离子的干扰等。
1、溶液酸度(pH值及缓冲溶液)
在相同条件下测的试液的吸光度, 从工作曲线上就可查到试液的浓 度, 该方法称为工作曲线法。 注意什么? a. 标准溶液浓度必须在线性范围内,即符合A= bc
b. 试液的吸光度必须在标准曲线范围内,即A1≤ Ax ≤An
五、光度分析法的误差(准确度)
对朗伯-比尔定律的偏离
在实际分析中,常会发现标准曲线发生弯曲,尤其当溶液
2.有机显色剂
有机显色剂分子中含有某些含不饱和键的基 团如偶氮基、对醌基和羰基等生色团( chromophoric group)和含孤对电子的基团如氨 基 、 羟 基 和 卤 代 基 等 助 色 团 ( auxochrome group)。
生色团:-N=N-,-N=O,
O
C=S,-N
(共轭双键)πe
为避免铁的干扰,可以选择波 长 520 nm进行测定,虽然而测镍的 灵敏度有所降低,但酒石酸铁不干 扰镍的测定。
二、参比溶液的选择
为什么要使用参比溶液? 目的:扣除非待测组分(吸收池和各种试剂)对光的吸收, 使测得的的吸光度真正反映待测物对光的吸收。
测定时,采用两个材质、厚度相同的比色皿进行测量,其中 一个作为参比池,装入参比溶液,调节仪器使透过参比池的吸光 度为零。则测得待测溶液的吸光度为:
显色剂的用量来消除干扰。 g. 采用预先分离的方法。
三、三元配合物在光度分析中的应用特性简介(自学)
吸光光度法 PPT

为透射比或透光度,用T表示溶液的透射 比愈大,表示它对光的吸收愈小;相反,透 射比愈小,表示它对光的吸收愈大。
T It I0
朗伯(Lambert J H)与比尔(Beer A)分别于 1760与1852年研究了光的吸收与溶液层的厚 度及溶液浓度的定量关系,二者结合称为朗伯比尔定律,也称为光的吸收定律。
光栅(grating)是依照光的衍射与干涉原理将复 合光色散为不同波长的单色光,然后再让所需波 长的光通过狭缝照射到吸收池上。它的分辨率 比棱镜大,可用的波长范围也较宽。
3、吸收系统——比色皿或吸收池
用于盛放试液的容器。它是由无色透明、耐腐 蚀、化学性质相同、厚度相等的玻璃制成的,按 其厚度分为0、5cm,lcm,2cm,3cm与5cm。
• 偏离朗伯-比尔定律的原
因主要是仪器或溶液的实际
条件与朗伯—比尔定律所要
求的理想条件不一致。
1、物理因素
(1)非单色光引起的偏离
* 朗伯-比尔定律只适用于单色光,但由于单色器
色散能力的限制与出口狭缝需要保持一定的宽度, 因此目前各种分光光度计得到的入射光实际上都 是具有某一波段的复合光。由于物质对不同波长 光的吸收程度的不同,因而导致对朗伯-比尔定ຫໍສະໝຸດ * 分子吸收光谱 -带状光谱
molecular absorption spectrum →由电子能级跃迁而产生吸收光谱[能量差
在1~20(eV)],为紫外及可见分光光度法。
UV/Vis Spectrophotometry →由分子振动能级(能量差约0、05~l eV)与
转动能级(能量差小于0、05 eV)的跃迁而 产生的吸收光谱,为红外吸收光谱。用于 分子结构的研究。
B 络合:显色剂与金属离子生成的是多级络合物,且各 级络合物对光的吸收性质不同,例如在Fe(Ⅲ) 与 SCN-的络合物中,Fe(SCN)3颜色最深,Fe(SCN)2+颜 色最浅,故SCN-浓度越大,溶液颜色越深,即吸光度 越大。
T It I0
朗伯(Lambert J H)与比尔(Beer A)分别于 1760与1852年研究了光的吸收与溶液层的厚 度及溶液浓度的定量关系,二者结合称为朗伯比尔定律,也称为光的吸收定律。
光栅(grating)是依照光的衍射与干涉原理将复 合光色散为不同波长的单色光,然后再让所需波 长的光通过狭缝照射到吸收池上。它的分辨率 比棱镜大,可用的波长范围也较宽。
3、吸收系统——比色皿或吸收池
用于盛放试液的容器。它是由无色透明、耐腐 蚀、化学性质相同、厚度相等的玻璃制成的,按 其厚度分为0、5cm,lcm,2cm,3cm与5cm。
• 偏离朗伯-比尔定律的原
因主要是仪器或溶液的实际
条件与朗伯—比尔定律所要
求的理想条件不一致。
1、物理因素
(1)非单色光引起的偏离
* 朗伯-比尔定律只适用于单色光,但由于单色器
色散能力的限制与出口狭缝需要保持一定的宽度, 因此目前各种分光光度计得到的入射光实际上都 是具有某一波段的复合光。由于物质对不同波长 光的吸收程度的不同,因而导致对朗伯-比尔定ຫໍສະໝຸດ * 分子吸收光谱 -带状光谱
molecular absorption spectrum →由电子能级跃迁而产生吸收光谱[能量差
在1~20(eV)],为紫外及可见分光光度法。
UV/Vis Spectrophotometry →由分子振动能级(能量差约0、05~l eV)与
转动能级(能量差小于0、05 eV)的跃迁而 产生的吸收光谱,为红外吸收光谱。用于 分子结构的研究。
B 络合:显色剂与金属离子生成的是多级络合物,且各 级络合物对光的吸收性质不同,例如在Fe(Ⅲ) 与 SCN-的络合物中,Fe(SCN)3颜色最深,Fe(SCN)2+颜 色最浅,故SCN-浓度越大,溶液颜色越深,即吸光度 越大。
第七章 吸光光度法

• 注:
摩尔吸光系数− ε 摩尔吸光系数−反映灵敏度的指标
•
molar absorptivity
显色条件的确定(实验确定 二.显色条件的确定 实验确定 显色条件的确定 实验确定)
• (一)绘制吸收光谱A-λ曲线 绘制吸收光谱A • 确定λ 作为入射光波长. 确定λmax作为入射光波长. • (二)显色剂用量 达到吸光度A值最大且稳定的a,b a,b间任 达到吸光度A值最大且稳定的a,b间任 选一点. 曲线确定最佳用量. 选一点.做A-VR曲线确定最佳用量. (三)酸度 pH太高,M水解 太高,M水解; pH太高,M水解; pH太低,R发生酸效应 太低,R发生酸效应. pH太低,R发生酸效应. pH曲线确定最佳酸度范围 曲线确定最佳酸度范围. 做A-pH曲线确定最佳酸度范围.
∴选择显色的最佳条件依据: 选择显色的最佳条件依据
• 在提高灵敏度和选择性前提条件下, 在提高灵敏度和选择性前提条件下, 吸光度达最大且平稳所对应的pH、 VR, 吸光度达最大且平稳所对应的 、 温度t( 、 时间t(min)和溶剂的种类 温度 ℃)、 时间 和溶剂的种类 和溶剂量. 和溶剂量.
§7-5 吸光度测量条件的选择
作用:调仪器吸光度为零. 作用:调仪器吸光度为零.(或T=100%) T=100% 100 可抵消非显色物对光的吸收, 可抵消非显色物对光的吸收 , 突出显色 化合物MR对光的吸收. MR对光的吸收 化合物MR对光的吸收. 溶剂空白—溶剂或去离子水作空白 溶剂或去离子水作空白. 溶剂空白 溶剂或去离子水作空白. 试剂空白—除被测不加外 其余试剂均加. 除被测不加外, 试剂空白 除被测不加外,其余试剂均加.
标准曲线绘制如下: 标准曲线绘制如下
0
分析化学第九章吸光光度法

3. 分光光度计及其基本部件:
光源-单色器-比色皿(吸收池)-检测器-显
(1)光源 : 钨丝灯:可见、红外 400-1000nm氢灯或 氘灯:紫外 160-350nm (2)单色器: a.滤光片:有机玻璃片或薄膜,利用颜色互补原理。 b.棱镜:根据物质的折射率与光的波长有关。玻璃 棱镜:可见,石英棱镜:紫 外、可见。 c.光栅:在玻璃片或金属片上刻划均匀的线,1200 条/mm, 衍射、干涉原理。
吸收光谱有原子吸收光谱和分子吸收光谱 单色 单一波长的光 光 光 复合光 由不同波长的光组合而成的光
两种不同颜色的单色光按一定的强度比 光的互补 例混合得到白光,那么就称这两种单色 光为互补色光
光的互补示意图
KMnO4溶液的 吸收曲线 (cKMnO4:a<b<c <d)
分子、原子、离子具有不连续的量子化能级,仅 能吸收当照射光子的能量hv与被照射粒子的 E激 - E基 =(hv)n因为不同物质微粒的结构不同, 共有不同的量子化能级,其能量差也不相同,因此 对光的吸收具有选择性。若固定某一溶液的浓度 C 和液层厚度 b ,测量不同 λ下的 A ,以吸光 度 A 对吸收波长λ 作图,就得到-吸收曲线, 即吸收光谱。 初步定性分析:不同物质吸收曲线的形状与最大 吸收波长不同。 定量分析:不同 C 的同一物质在吸收峰附近的 A 随 C ↑而增大,吸收曲线是吸光光度法中选择测 定波长的主要依据。
3.温度:通过实验确定温度范围,通常在室温下 进行。 4.溶剂:一般螯合物在有机溶剂中溶解度大,提高 显色反应的灵敏度。如Cu(SCN)42-在水中大 部分离 解,几乎无色;在丙酮中呈蓝色。
5.显色时间:通过实验找出适宜的显色时间。
6.干扰组分:共存组分与显色剂生成有色络合物, 正干扰;生成无色络合物,负干扰。 干扰的消除:
第10章 吸光光度法

普朗克方程将电磁辐射的波动性和微粒性联系在一起。
E h c h
h -普朗克(Planck)常数 6.63×10-34J·s
c -真空中光速 2.99792458×108m/s~3.0 ×108m/s
-波长,单位:m,cm,mm, m,nm,Å
1 m=10-6m, 1nm=10-9m, 1Å=10-10m
用不同波长的单色光照射溶液,测其吸光度,以A对λ作
图,得吸收曲线,即吸收光谱。
10
第
不同物质吸收曲线的形状,λmax位置不同。
章
——定性分析
吸 光
最大吸收波长(λmax)—吸光度A最大处对应的波长。
光
度
法
第
10
章
同一物质在同一波长下吸光度A随着浓度的增
吸
大而增大 。
光
光
——定量分析
度
法
❖ 物质的分子结构与吸收光谱的关系
E
E2
E1
h
hc
不同物质分子因结
构不同而能级不同,故
各能级间的能级差也不
相同,因而选择吸收的
性质反映了分子内部结
第
构的差异。
章 吸 光 光 度 法
10
10.1.3 光吸收的基本定律—朗伯-比尔定律
入射光
I0
It
透射光
b
透射比(透光度) T It I0
第
吸光度
A lg I0 lg 1 lg T
章
② 吸光物质为均匀非散射体系;
吸 光
③ 吸光质点之间无相互作用(稀溶液) ;
光 度
④ 辐射与物质之间的作用仅限于光吸收过程。
吸光光度法

It 透光度定义: T I0
T 取值为0.0 % ~ 100.0 % 全部吸收 全部透射 T = 0.0 % T = 100.0 % A=∞ A= 0.00
吸光度:A=lg (I0 / It )=lg(1/T)
全部吸收
全部透射
朗伯定律(1760年):光吸收与溶液层厚度成正比 比尔定律(1852年):光吸收与溶液浓度成正比
2.介质不均匀引起的偏离 胶体,悬浮、乳浊等对光产生散射,使实测
吸光度增加,导致线性关系上弯曲
3.化学反应引起的偏离 离解、缔合、异构等 如:Cr2O72-+H2O-=2HCrO4-=2H++2CrO42PAR的偶氮-醌腙式
4 显色反应的干扰及其消除方法
1)优化显色反应条件,控制溶液的酸度 2)加入隐蔽剂 3)改变价态 4)选择适当波长 5)选择合适参比溶液
2)单色器
将光源发射的复合光分解成单色光并可从中选出一任 波长单色光的光学系统。
①入射狭缝:光源的光由此进入单色器;
②准光装置:透镜或返射镜使入射光成为平行光束; ③色散元件:将复合光分解成单色光;棱镜或光栅; ④聚焦装置:透镜或 凹面反射镜,将分光
后所得单色光聚焦至
出射狭缝; ⑤出射狭缝。
16
单色器
棱镜:依据不同波长光通过棱镜时折射率不同
800
λ1
白光
600
500
λ2
入射狭缝 准直透镜 棱镜 聚焦透镜 出射狭缝
400
17
光栅:在镀铝的玻璃表面刻有数量很大的等宽度
等间距条痕(600、1200、2400条/mm )。 原理: 利用光通过光栅时
平面透 射光栅 透 镜
光屏
M1
发生衍射和干涉现象而 分光.
第十三章 吸光光度法

Ax cx cs As
二、多组分的测定
对于含有多种被测组分的试液,如果吸光 物质之间没有相互作用,且服从 Lambert-Beer 定律,此时系统的吸光度等于各组分的吸光度 之和。 吸收光谱通常有以下两种情况。 (1)吸收峰互不重叠: (2)吸收峰重叠:
吸收峰不重叠
吸收峰重叠
A( 2)
其中,A:吸光度,T:透光率,
κ :摩尔吸收系数,d:溶液厚度,cB:溶液摩尔浓度
1 A lg κ T
•
d • cB
注意:平行单色光
均相介质 无发射、散射或光化学反应
摩尔吸收系数κ的讨论
κ 表示物质的浓度为1mol/L,液层厚度为1dm时溶
液在某一波长下的吸光度(单位:dm2 •mol-1)
def
I0 lg I
T def
A 与 T 的关系为:
I I0
A =-lgT
2、朗伯-比尔定律
朗伯定律(1760年): 光吸收与溶液层厚度成正比 比尔定律(1852年): 光吸收与溶液浓度成正比
当一束平行单色光垂直照射到样品溶液时,溶 液的吸光度与溶液的浓度及光程(溶液的厚度) 成正比关系--朗伯比尔定律(光吸收定律) 数学表达:
第十三章 吸光光度法
第一节 第二节 第三节 第四节 第五节 吸光光度法的基本原理 光吸收的基本定律 吸光光度法分析条件的选择 分光光度计 吸光光度法的测定方法
本章重点
吸收曲线 朗伯-比尔定律
根据物质对光吸收的波长的不同,吸光 光度法主要可分为:
☺比色法 ☺可见吸光光度法(400~750nm) ☺紫外吸光光度法(10~400nm) ☺红外光谱法(760~1×106nm )
KMnO4 的吸收曲线
吸光光度法

第30讲 30讲
第十章 吸光光度法
第1讲
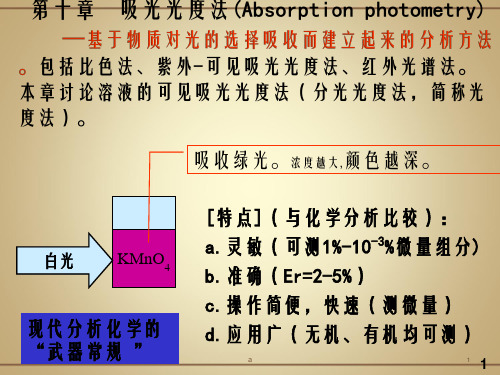
第十章 吸光光度法
吸光光度法( 吸光光度法 ( Absorption Photometry) 是一 ) 种基于物质对光的选择性吸收而建立起来的一种 分析方法。包括可见吸光光度法、紫外-可见吸光 分析方法 。 包括可见吸光光度法 、 紫外 可见吸光 光度法和红外光谱法等。 光度法和红外光谱法等。 吸光光度法同滴定分析 重量分析法相比,有以下一些特点: 法、重量分析法相比,有以下一些特点: (一)灵敏度高 吸光光度法测定物质的浓度下 一 灵敏度高 最低浓度)一般可达 的微量组分。 限 (最低浓度 一般可达 最低浓度 一般可达1-10-3%的微量组分 。 对固 的微量组分 体试样一般可测到10 体试样一般可测到 -4%。如果对被测组分事先加 。 以富集,灵敏度还可以提高1-2个数量级 个数量级。 以富集,灵敏度还可以提高 个数量级。
第30讲 30讲第十章 吸光度法第1讲在分光光度测定中, 在分光光度测定中,盛溶液的比色皿都是采用相 同质且的光学玻璃制成的, 同质且的光学玻璃制成的,反射光的强度基本上是不 变的(一般约为入射光强度的 一般约为入射光强度的4% 其影响可以互相抵消 其影响可以互相抵消, 变的 一般约为入射光强度的 %)其影响可以互相抵消, 于是可以简化为 I0=It+Ia 纯水对于可见光的吸收极微, 纯水对于可见光的吸收极微,故有色液对光的吸 收完全是由溶液中的有色质点造成的。 收完全是由溶液中的有色质点造成的。 当入射光的强度I 一定时,如果I 越大, 就越小, 当入射光的强度 0一定时, 如果 a越大 , It就越小 , 即透过光的强度越小, 即透过光的强度越小,表明有色溶液对光的吸收程度 就越大。 就越大。 实践证明,有色溶液对光的吸收程度, 实践证明,有色溶液对光的吸收程度,与该溶液 的浓度、液层的厚度以及入射光的强度等因素有关。 的浓度、液层的厚度以及入射光的强度等因素有关。 如果保持入射光的强度不变, 如果保持入射光的强度不变,则光吸收程度与溶液的 浓度和液层的厚度有关。 浓度和液层的厚度有关。
第十章 吸光光度法
第1讲
第十章 吸光光度法
吸光光度法( 吸光光度法 ( Absorption Photometry) 是一 ) 种基于物质对光的选择性吸收而建立起来的一种 分析方法。包括可见吸光光度法、紫外-可见吸光 分析方法 。 包括可见吸光光度法 、 紫外 可见吸光 光度法和红外光谱法等。 光度法和红外光谱法等。 吸光光度法同滴定分析 重量分析法相比,有以下一些特点: 法、重量分析法相比,有以下一些特点: (一)灵敏度高 吸光光度法测定物质的浓度下 一 灵敏度高 最低浓度)一般可达 的微量组分。 限 (最低浓度 一般可达 最低浓度 一般可达1-10-3%的微量组分 。 对固 的微量组分 体试样一般可测到10 体试样一般可测到 -4%。如果对被测组分事先加 。 以富集,灵敏度还可以提高1-2个数量级 个数量级。 以富集,灵敏度还可以提高 个数量级。
第30讲 30讲第十章 吸光度法第1讲在分光光度测定中, 在分光光度测定中,盛溶液的比色皿都是采用相 同质且的光学玻璃制成的, 同质且的光学玻璃制成的,反射光的强度基本上是不 变的(一般约为入射光强度的 一般约为入射光强度的4% 其影响可以互相抵消 其影响可以互相抵消, 变的 一般约为入射光强度的 %)其影响可以互相抵消, 于是可以简化为 I0=It+Ia 纯水对于可见光的吸收极微, 纯水对于可见光的吸收极微,故有色液对光的吸 收完全是由溶液中的有色质点造成的。 收完全是由溶液中的有色质点造成的。 当入射光的强度I 一定时,如果I 越大, 就越小, 当入射光的强度 0一定时, 如果 a越大 , It就越小 , 即透过光的强度越小, 即透过光的强度越小,表明有色溶液对光的吸收程度 就越大。 就越大。 实践证明,有色溶液对光的吸收程度, 实践证明,有色溶液对光的吸收程度,与该溶液 的浓度、液层的厚度以及入射光的强度等因素有关。 的浓度、液层的厚度以及入射光的强度等因素有关。 如果保持入射光的强度不变, 如果保持入射光的强度不变,则光吸收程度与溶液的 浓度和液层的厚度有关。 浓度和液层的厚度有关。
吸光光度法

非单色光引起的偏离
设入射光仅由 l1 和 l2 两种波长组成,两波长下比尔定 律都是适用的:
l1: l2:
A'
lg
I0' I1
e1bc
A''
——电磁辐射,是一种以极大的速度通过空间,不需要以任
何物质作为传播媒介的能量。
——电磁辐射具有波动性和微粒性。
波动性:波的传播以及反射、衍射、干涉、折射和散射现象
微粒性:光电效应、compton效应说明辐射能量是量子化
的,能量的最小单位是光子。
光子的能量E=hν=hc/λ
电磁波谱表
光谱名称 X射线
ε = Ma = 55.85 ×190
=1.1 ×104 L·mol-1·cm-1
吸光度的加和性
在某一波长,溶液中的多种物质对该波长的光产生 吸收,那么溶液的总吸光度等于溶液中各个吸光物质的 吸光度之和。
A1 = e1bc1 A2 = e2bc2 A = e1bc1+ e2bc2
根据吸光度的加和性可以进行多组分的测定以及某些化 学反应平衡常数的测定。
3、通过理论证明: 分子,原子或离子具有不连续的最子化能级(如图)。
M + h
M*
E h hc l
物质对光的选择性吸收
不同的物质粒子由于结构不同,具有不同的量子化 能级,其能量差也不同,吸收光的波长也不同,这就构 成了物质对光的选择性吸收基础。
物质对光的选择性吸收在实际工作中的应用
低灵敏度
P240
例:铁的质量浓度为(Fe2+)=5.0 ×10-4 g·L-1的溶液,
与1,10邻二氮菲反应。生成橙红色的配合物,最大 吸收波长工业基础508 nm。比色皿厚度为2 cm时, 测得上述显色溶液的A=0.19,计算1,10邻二氮菲亚 铁比色法对铁的a及ε 。
十二章节吸光光度法

子组成) 互补色光:如果把适当颜色的两种单色光按
一定的强度比例混合,也可以得到白光,这 两种单色光就叫做互补色光 。如绿光和紫 光互补,蓝光和黄光互补。
互补色光:如绿光和紫光互补,蓝光和黄光 互补。
绿
黄
青(蓝绿)
橙
青蓝(绿蓝)
红
蓝
紫
表12-2* 物质的颜色与吸收光颜色的互补关系
武汉大学(四版)*
错。 ε改变,εmax 不变。
例12–3 有一浓度为1.0μg • mL–1的Fe2+溶液,以邻二 氮菲显色后,用分光光度计测定,比色皿厚度为 2.0cm,在波长510nm处测得吸光度A=0.380,计算 该显色反应的吸光系数a和摩尔吸光系数ε。
解:已知 b=2.0cm A=0.380 铁的摩尔质量M=55.85 g • mol–1
吸光光度法的特点: (1)灵敏度高; (2)准确度高; (3)操作简便 快速; (4)应用广泛。
二、物质对光的选择性吸收
1、物质的颜色是由于物质对不同波长的光具有选择 性吸收而产生的。
物质对光产生选择性吸收的原因 分子、原子或离子具有不连续的量子化能级。
只有照射光中光子的能量hν与被照射物质粒子的基 态和激发态能量之差△E相等的那部分色光才会被物 质或其溶液所吸收。不同的物质微粒由于结构不同
光而呈现蓝色
光的互补:蓝 黄
用不同波长的单色光照射,测吸光度— 吸收曲线
与最大吸收波长 max;
3、光吸收曲线
用不同波长的单色光照射某一物质测定吸光度, 以波长为横坐标,以吸光度为纵坐标,绘制曲线, 描述物质对不同波长光的吸收能力。
吸收曲线
17
吸收曲线的讨论:
(1)同一种物质对不同波长光的吸光度不同。吸 光度最大处对应的波长称为最大吸收波长λmax
一定的强度比例混合,也可以得到白光,这 两种单色光就叫做互补色光 。如绿光和紫 光互补,蓝光和黄光互补。
互补色光:如绿光和紫光互补,蓝光和黄光 互补。
绿
黄
青(蓝绿)
橙
青蓝(绿蓝)
红
蓝
紫
表12-2* 物质的颜色与吸收光颜色的互补关系
武汉大学(四版)*
错。 ε改变,εmax 不变。
例12–3 有一浓度为1.0μg • mL–1的Fe2+溶液,以邻二 氮菲显色后,用分光光度计测定,比色皿厚度为 2.0cm,在波长510nm处测得吸光度A=0.380,计算 该显色反应的吸光系数a和摩尔吸光系数ε。
解:已知 b=2.0cm A=0.380 铁的摩尔质量M=55.85 g • mol–1
吸光光度法的特点: (1)灵敏度高; (2)准确度高; (3)操作简便 快速; (4)应用广泛。
二、物质对光的选择性吸收
1、物质的颜色是由于物质对不同波长的光具有选择 性吸收而产生的。
物质对光产生选择性吸收的原因 分子、原子或离子具有不连续的量子化能级。
只有照射光中光子的能量hν与被照射物质粒子的基 态和激发态能量之差△E相等的那部分色光才会被物 质或其溶液所吸收。不同的物质微粒由于结构不同
光而呈现蓝色
光的互补:蓝 黄
用不同波长的单色光照射,测吸光度— 吸收曲线
与最大吸收波长 max;
3、光吸收曲线
用不同波长的单色光照射某一物质测定吸光度, 以波长为横坐标,以吸光度为纵坐标,绘制曲线, 描述物质对不同波长光的吸收能力。
吸收曲线
17
吸收曲线的讨论:
(1)同一种物质对不同波长光的吸光度不同。吸 光度最大处对应的波长称为最大吸收波长λmax
吸光光度法ppt课件

方法分类和比较
测定下限 相对误差
比色分析法
10-5 ~ 10-6 mol·L-1 5% ~ 10%
分光光度法
10-5 ~ 10-8 mol·L-1 2% ~ 5%
适用于分析半微量和微量的物质 5
一. 概述 方法的评价
快速、简便 显色
比色
灵敏度高:浓度下限达10-5~10-8 mol·L-1
准确度高:相对误差通常为2~5%,
稀溶液 入射光为单色光
20
二 . 吸光光度法的基本原理
4. 吸光度测定方法
步骤
(1) 配制一组浓度系
仪器测量
列的标准溶液(ci)
一组相应的吸 光度值(Ai)
制图(ci 为横坐标,
A
Ai 为纵坐标)
工作曲线
·
Ax
·· ·
仪器测量
(2) 配制样品
Ax
相同条件
·
查图得出cx
cx
c
21
二 . 吸光光度法的基本原理
(2) 选择性好
(3) 有色物组成恒定,化学性质稳定
(4) 显色剂在测定波长处无明显吸收
对比度=λmax有色物 -λmax显色剂>60nm
42
四、显色反应和显色条件的选择
3.影响显色反应的因素
M +R
MR
(1) 显色剂用量 根据吸光度A与显色剂浓度cR的关系来确定
cR选择——引起A变化最小处的cR(即曲线平坦处43 )
吸光光度法
刘海燕
一. 概述
1. 方法原理
2. 方法分类和比较 3. 方法评价
二.吸光光度法原理
1. 物质对光的选择性吸收
2. 光的吸收定律
(1) Lambert-Beer定律
吸光光度法PPT课件
光谱示意
完全吸收
复合光
表观现象示意
完全透过
吸收黄色光
光作用于物质时,物质吸收了可见光,而显示出特征
的W颜hy色? ?。? 物质呈现的颜色与光有着密切的关系,物质呈 现何种颜色,与光的组成和物质本身的结构有关。
a
66
物质的电子结构不同,所能吸收光的波长也不同,这就构成了物质对光的选择吸 收基础。
物质选择性地吸收白光中某种颜色的光,物质就会呈现其互补色光的颜色。
a
19 19
二、 光电比色法 A
1.方法:(滤光片获取单色光)
C
通过滤光片得一窄 范围的光(几十nm)
光电比色计结构示意图
2.特点:准确度较高(消除人眼的主观因素)
选择性较好(滤光片、参比液可消除干扰)
a
20
三、分光光度法
1.方法:同上。不同点:光栅或棱镜获取单色光 2.特点: 单色光纯度高(可精选某一波长,准)
✓选择测,可避开干扰的吸收 ✓增加显色剂用量,将干扰灌饱
✓分离
a
28
二、仪器测量误差
偏离A=bC
光度分析法的误差除了来源于朗伯-比耳定律的偏
离以外,仪器测量不准确也是导致误差的原因。
任何光度计都有一定的测量误差。这些误差可能来
源于光源不稳定、实验条件的偶然变动、读数不准确等
。
P286页图10-5:
桑德尔灵敏度:当光度仪器的检测极限为A=0.001
时,单位截面积光程内所能检出的吸光物质的最低质量
。ug/cm2
SM
a
13 13
例 : 用 双 硫 腙 比 色 法 测 定 镉 , 已 知 含 Cd2+浓 度 为 140μ g/L,
比 色 皿 厚 度 为 2cm, 在 λ = 520 nm处 测 得 透 光 率 为 60.3%,
完全吸收
复合光
表观现象示意
完全透过
吸收黄色光
光作用于物质时,物质吸收了可见光,而显示出特征
的W颜hy色? ?。? 物质呈现的颜色与光有着密切的关系,物质呈 现何种颜色,与光的组成和物质本身的结构有关。
a
66
物质的电子结构不同,所能吸收光的波长也不同,这就构成了物质对光的选择吸 收基础。
物质选择性地吸收白光中某种颜色的光,物质就会呈现其互补色光的颜色。
a
19 19
二、 光电比色法 A
1.方法:(滤光片获取单色光)
C
通过滤光片得一窄 范围的光(几十nm)
光电比色计结构示意图
2.特点:准确度较高(消除人眼的主观因素)
选择性较好(滤光片、参比液可消除干扰)
a
20
三、分光光度法
1.方法:同上。不同点:光栅或棱镜获取单色光 2.特点: 单色光纯度高(可精选某一波长,准)
✓选择测,可避开干扰的吸收 ✓增加显色剂用量,将干扰灌饱
✓分离
a
28
二、仪器测量误差
偏离A=bC
光度分析法的误差除了来源于朗伯-比耳定律的偏
离以外,仪器测量不准确也是导致误差的原因。
任何光度计都有一定的测量误差。这些误差可能来
源于光源不稳定、实验条件的偶然变动、读数不准确等
。
P286页图10-5:
桑德尔灵敏度:当光度仪器的检测极限为A=0.001
时,单位截面积光程内所能检出的吸光物质的最低质量
。ug/cm2
SM
a
13 13
例 : 用 双 硫 腙 比 色 法 测 定 镉 , 已 知 含 Cd2+浓 度 为 140μ g/L,
比 色 皿 厚 度 为 2cm, 在 λ = 520 nm处 测 得 透 光 率 为 60.3%,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
当b单位用cm,c单位用g/L时,a单位为L •g-1 •cm-1
吸光系数a
当b单位用cm,c单位用mol/L时,a单位为L•mol-1 •cm-1 此时特称为摩尔吸光系数,用κ表示。
四、工作曲线 配一系列标准溶液c1、c2、c3、c4……,在λmax下测得 A1、A2、A3、A4……,以A为纵坐标,C为横坐标作图。
(λmax 根据吸收光谱曲线测得,且Io,b和吸光物质均一定)
A Ax
c1 c2 c3 cx c4 C 只要在相同条件下,测得试样溶液的吸光度Ax,从吸 收光谱曲线上可以查出对应的Cx,最后算出被测物含量。
五、光度分析计算示例
A 例7-1 用磺基水杨酸比色法测定铁的 0.60 含量加入标准铁溶液及有关试剂后,在 50mL容量瓶中稀释至刻度,测得下列数据:
比例常数
db
b (cm) 如果特制x,y为统一规格,则k’• 6.02×1020 • x •y =k(常数)
透过光It db为无限的薄层 I为在db中吸收光 的强度
(吸光系数a=k/2.303) dI为在db中吸收 It dI b It k It 光强度的变化 kc db, ln kbc 或 lg bc abc Io I 0 Io Io 2.303 It Io It 令 T(透光度), 则有 lg lg lg T A (吸光度) It Io Io 即A lg T abc
2. 由透过光颜色(即吸收光的互补色)决定。
• 例如硫酸铜溶液因吸收了白光中的黄色光而呈 兰色。 • 例如高锰酸钾溶液因吸收了白光中的绿色光而 呈紫色。 • 有时晚霞天空呈 红色是因为大气层 吸收了白色阳光中 的青光,而进入我 们眼睛的透过光所 以呈红色。 • 黑色、白色、灰色是对白光中的各种色光进行 全吸收、全不吸收和均匀吸收的结果。可归属 于三种极端颜色。
近 红 微 红 红 外 外 线 线 波 750
无 线 电 波
可见光(范围无严格界限)
电磁波谱图
┄
┄
λ/nm
(2)互补色光
将两种适当的色光按一 定强度比例混合后,也可以 成为白光。这两种色光称为 互补色光。 互补色光图 红 紫 橙
例如: 是由各种色光按一定比例 混合而成的混合光。
白光
兰
黄
青兰
绿
青
若将互补色光图中对角线 上的两种色光按一定比例混合, 也可以形成白光。如红与青、 黄与兰、绿与紫等。不在对角 线上的两种色光,无论按任何 比例混合都不可能形成白光。
∴ -dI/I=kCdb
2. 吸收定律意义 当一束单色光平行照射并通过均匀的、非散射的吸 光物质的溶液时,溶液的吸光度A与溶液浓度C和液层厚 度b的乘积成正比。这一关系称为朗伯-比尔定律。 当c不变,而b改变时:A=acb=k1b(郎伯定律) 当b不变,而c改变时:A=acb=k2c(比尔定律) • 朗伯-比尔定律使用条件: (1)入射光为单色光 (2)一般为低浓度溶液 (3)入射光强度Io不变 (4)吸光物质不变
=0.026%
不同浓度KMnO4溶液的吸收曲线
λmax=525nm 最大吸收波长
三、光的吸收定律
1. 公式推导(碰撞理论) -dI∝NI
表示光强减弱 物质分子数
若溶液浓度为C(mol/L), 则N=C×6.02×1023 •-dI=k’NI=k’• 6.02×1020 • x •y • C • db • I
标准铁溶液浓度( μg • mL-1 ) 2.0 4.0 6.0 8.0 10.0
A 0.097 0.200 0.304 0.408
0.40
12.0
0.20
0.510 0.613
在相同条件下测得试样溶液的吸光度 为0.413,求试样溶液中铁的含量(以mg • L-1表示)。 解:以吸光度A为纵坐标,标准铁溶 液浓度为横坐标作图(见右图)。 从曲线上可查得吸光度为0.413 时的浓 度为8.2 μg • mL-1,即8.2 mg• mL-1
第十四章 吸光光度法
• • • • • 一、光的本质与颜色 二、吸收光谱曲线 三、光的吸收定律 四、工作曲线 五、光度分析计算示例
台职院生化系 奚立民副教授
第七章 吸光光度法
根据物质对一定波长光线的吸收程度以确定物质含量的分析方法
一、光的本质与颜色
1.
C 光的本质 E=hν= h
粒子性 (1)可见光的颜色与波长
二、吸收光谱曲线
• 吸收光谱曲线的主要特点 (1)λmax与浓度C无关。曲 线形状随吸光物质的分子 结构不同而不同,利用这 一特点可用来进行定性分 析。 (2)A与C有关。其中A为吸 光度,随浓度C增大而增大, 利用这一特点可用来进行 定量分析。
吸光光度法主要用于定量分 析,哪么如何根据A与C的关系 来进行定量分析呢
0
2.0 4.0 6.0 8.0 10.0 12.0
ρ Fe / μg • mL-1
磺基水杨酸铁工作曲线
例7-2 用磺基水杨酸法测定某矿样中铁含量,工作曲线 数据同例7-1,称取矿样0.3866g,分解后移入100mL容量瓶, 吸取5.0mL试液置于50mL容量瓶中,在与工作曲线相同条件 下显色,测得溶液的吸光度A=0.250,求矿样中铁的质量分数。 解:由工作曲线查得吸光度为0.250 时含铁量为5.0 μg • mL-1 ,由于试样是在与 工作曲线相同条件下显色测定,即5.0mL 试样中含铁5.0 μg ,则0.3866g矿样中铁 的质量分数为: 1 100 mL 6 5.0 g 10 g g 5.0mL 100 % Fe 0.3866 g
光色 紫 波长(nm) 400~450
光具有波粒二象性,λ越大,E越低。 即长波能量大 ,短波能量小。 波动性
X
┄
γ
兰
绿兰 兰绿 绿 黄 橙 红
450~480
480~490 490~500 500~580 580~600 600~650 650~750
射 射 线 线
紫 外 线
近 紫 紫 外 线 400
吸光系数a
当b单位用cm,c单位用mol/L时,a单位为L•mol-1 •cm-1 此时特称为摩尔吸光系数,用κ表示。
四、工作曲线 配一系列标准溶液c1、c2、c3、c4……,在λmax下测得 A1、A2、A3、A4……,以A为纵坐标,C为横坐标作图。
(λmax 根据吸收光谱曲线测得,且Io,b和吸光物质均一定)
A Ax
c1 c2 c3 cx c4 C 只要在相同条件下,测得试样溶液的吸光度Ax,从吸 收光谱曲线上可以查出对应的Cx,最后算出被测物含量。
五、光度分析计算示例
A 例7-1 用磺基水杨酸比色法测定铁的 0.60 含量加入标准铁溶液及有关试剂后,在 50mL容量瓶中稀释至刻度,测得下列数据:
比例常数
db
b (cm) 如果特制x,y为统一规格,则k’• 6.02×1020 • x •y =k(常数)
透过光It db为无限的薄层 I为在db中吸收光 的强度
(吸光系数a=k/2.303) dI为在db中吸收 It dI b It k It 光强度的变化 kc db, ln kbc 或 lg bc abc Io I 0 Io Io 2.303 It Io It 令 T(透光度), 则有 lg lg lg T A (吸光度) It Io Io 即A lg T abc
2. 由透过光颜色(即吸收光的互补色)决定。
• 例如硫酸铜溶液因吸收了白光中的黄色光而呈 兰色。 • 例如高锰酸钾溶液因吸收了白光中的绿色光而 呈紫色。 • 有时晚霞天空呈 红色是因为大气层 吸收了白色阳光中 的青光,而进入我 们眼睛的透过光所 以呈红色。 • 黑色、白色、灰色是对白光中的各种色光进行 全吸收、全不吸收和均匀吸收的结果。可归属 于三种极端颜色。
近 红 微 红 红 外 外 线 线 波 750
无 线 电 波
可见光(范围无严格界限)
电磁波谱图
┄
┄
λ/nm
(2)互补色光
将两种适当的色光按一 定强度比例混合后,也可以 成为白光。这两种色光称为 互补色光。 互补色光图 红 紫 橙
例如: 是由各种色光按一定比例 混合而成的混合光。
白光
兰
黄
青兰
绿
青
若将互补色光图中对角线 上的两种色光按一定比例混合, 也可以形成白光。如红与青、 黄与兰、绿与紫等。不在对角 线上的两种色光,无论按任何 比例混合都不可能形成白光。
∴ -dI/I=kCdb
2. 吸收定律意义 当一束单色光平行照射并通过均匀的、非散射的吸 光物质的溶液时,溶液的吸光度A与溶液浓度C和液层厚 度b的乘积成正比。这一关系称为朗伯-比尔定律。 当c不变,而b改变时:A=acb=k1b(郎伯定律) 当b不变,而c改变时:A=acb=k2c(比尔定律) • 朗伯-比尔定律使用条件: (1)入射光为单色光 (2)一般为低浓度溶液 (3)入射光强度Io不变 (4)吸光物质不变
=0.026%
不同浓度KMnO4溶液的吸收曲线
λmax=525nm 最大吸收波长
三、光的吸收定律
1. 公式推导(碰撞理论) -dI∝NI
表示光强减弱 物质分子数
若溶液浓度为C(mol/L), 则N=C×6.02×1023 •-dI=k’NI=k’• 6.02×1020 • x •y • C • db • I
标准铁溶液浓度( μg • mL-1 ) 2.0 4.0 6.0 8.0 10.0
A 0.097 0.200 0.304 0.408
0.40
12.0
0.20
0.510 0.613
在相同条件下测得试样溶液的吸光度 为0.413,求试样溶液中铁的含量(以mg • L-1表示)。 解:以吸光度A为纵坐标,标准铁溶 液浓度为横坐标作图(见右图)。 从曲线上可查得吸光度为0.413 时的浓 度为8.2 μg • mL-1,即8.2 mg• mL-1
第十四章 吸光光度法
• • • • • 一、光的本质与颜色 二、吸收光谱曲线 三、光的吸收定律 四、工作曲线 五、光度分析计算示例
台职院生化系 奚立民副教授
第七章 吸光光度法
根据物质对一定波长光线的吸收程度以确定物质含量的分析方法
一、光的本质与颜色
1.
C 光的本质 E=hν= h
粒子性 (1)可见光的颜色与波长
二、吸收光谱曲线
• 吸收光谱曲线的主要特点 (1)λmax与浓度C无关。曲 线形状随吸光物质的分子 结构不同而不同,利用这 一特点可用来进行定性分 析。 (2)A与C有关。其中A为吸 光度,随浓度C增大而增大, 利用这一特点可用来进行 定量分析。
吸光光度法主要用于定量分 析,哪么如何根据A与C的关系 来进行定量分析呢
0
2.0 4.0 6.0 8.0 10.0 12.0
ρ Fe / μg • mL-1
磺基水杨酸铁工作曲线
例7-2 用磺基水杨酸法测定某矿样中铁含量,工作曲线 数据同例7-1,称取矿样0.3866g,分解后移入100mL容量瓶, 吸取5.0mL试液置于50mL容量瓶中,在与工作曲线相同条件 下显色,测得溶液的吸光度A=0.250,求矿样中铁的质量分数。 解:由工作曲线查得吸光度为0.250 时含铁量为5.0 μg • mL-1 ,由于试样是在与 工作曲线相同条件下显色测定,即5.0mL 试样中含铁5.0 μg ,则0.3866g矿样中铁 的质量分数为: 1 100 mL 6 5.0 g 10 g g 5.0mL 100 % Fe 0.3866 g
光色 紫 波长(nm) 400~450
光具有波粒二象性,λ越大,E越低。 即长波能量大 ,短波能量小。 波动性
X
┄
γ
兰
绿兰 兰绿 绿 黄 橙 红
450~480
480~490 490~500 500~580 580~600 600~650 650~750
射 射 线 线
紫 外 线
近 紫 紫 外 线 400
