【重点推荐】人教版高中化学必修一秋化学同步测试:1.2化学计量在实验中的应用(三,无答案)
人教版高中化学 必修一 第一章 第二节 化学计量在实验中的应用 同步测试卷 含答案与解析

人教版高中化学必修一第一章第二节化学计量在实验中的应用同步测试卷满分100分一、选择题(本题包括12小题,每小题5分,共60分)1.下列说法中正确的是( )A.1 mol任何物质都含有6.02×1023个原子B.阿伏加德罗常数就是1 mol粒子数的集体,0.012 kg 12C中含有约6.02×1023个12CC.摩尔是一个基本的物理量D.1 mol水中含有2 mol氢和1 mol氧答案:B解析:构成物质的粒子有原子、分子、离子、电子等,物质不都是由原子构成的,分子同样可构成物质,如1 mol O2中含6.02×1023个O2,但含2×6.02×1023个O,A项错误;根据规定,1 mol粒子集合体所含的粒子数与0.012 kg 12C中所含的碳原子数相同,即为阿伏加德罗常数个,近似为6.02×1023,B项正确,物质的量是基本物理量,摩尔是它的单位,C项错误;在使用“摩尔”作为物质的量的单位时,必须指明粒子的种类,选项中表示水的组成时,应为 1 mol水中含有2 mol 氢原子和1 mol氧原子,D项错误。
2.(双选)下列说法正确的是( )A.硫酸的摩尔质量是98 gB.18 g水的物质的量为1 molC.O2的摩尔质量(单位是g·mol-1)在数值上等于其相对分子质量D.1 mol CO的质量为28 g·mol-1答案:BC解析:A项错误,摩尔质量的单位是g·mol-1;B项中,n(H2O)=18 g18 g·mol-1=1 mol,该项正确;D项中1 mol CO的质量是N A个CO分子的总质量,其单位应是“g”,而不是“g·mol-1”,该项错误。
故正确答案为B、C两项。
3.设阿伏加德罗常数为6.02×1023 mol-1,下列说法中正确的是( )A.1.8 g水所含的氧原子数目为0.3×6.02×1023B.2 g氢气所含原子数目为6.02×1023C.10 g氖气所含原子数目为6.02×1023D.17 g氨气所含电子数目为10×6.02×1023答案:D解析:A项中,1个水分子所含的氧原子数为1,1.8 g水所含的氧原子数目为1.8 g18 g·mol-1×1×6.02×1023mol-1=0.1×6.02×1023;B项中,2 g氢气所含原子数目为2 g2 g·mol-1×2×6.02×1023mol-1=2×6.02×1023;C项中,10 g氖气所含原子数目为10 g20 g·mol-1×6.02×1023mol-1=0.5×6.02×1023;D项中,17 g氨气所含电子数目为17 g17 g·mol-1×10×6.02×1023 mol-1=10×6.02×1023。
人教版高中化学必修一《1.2化学计量在实验中的应用》同步监测.docx

高中化学学习材料唐玲出品第一章从实验走进化学《第二节化学计量在实验中的应用》同步监测时间:30分钟班级学号姓名题目难度:基础○;运用◎;综合●一、基本计算:○1.下列对于“摩尔”的理解正确的是()A.摩尔是表示物质粒子数量的单位B.物质的量可理解为物质的质量C.国际上规定,0.012 kg碳原子所含有的碳原子数目为1摩尔D.物质的量适用于分子、原子、离子等微观粒子○2.下列有关阿佛加德罗常数(N A)的说法错误的是()A.32克O2所含的原子数目为N AB.0.5molH2O含有的原子数目为1.5N AC.1molH2O含有的H2O分子数目为N AD.0 5N A个氯气分子的物质的量是0.5mol○3.下列说法正确的是()A.摩尔质量就等于物质的式量B.摩尔质量就物质式量的 6.02×1023倍C.HNO3的摩尔质量是63g D.硫酸和磷酸的摩尔质量相等○4.下列有关气体摩尔体积的描述中正确的是()A.单位物质的量的气体所占的体积就是气体摩尔体积B.通常状况下的气体摩尔体积约为22.4LC.标准状况下的气体摩尔体积约为22.4LD.相同物质的量的气体摩尔体积也相同◎5.同温同压下,相同质量的下列气体所占体积最大的是()A.O2 B.H2 C.CO D.CO2◎6.含相同分子数的H2O和NH3具有相同的()A. 体积B. 原子个数 C.质量 D.物质的量◎7.1克N2含有N个分子,则阿伏加德罗常数是()A.14N B.N/14 C.28N D.N/28◎8.下列说法中正确的是()A.某物质含有阿伏加德罗常数个微粒,该物质在标准状况下体积为22.4 LB.在常温常压下,8 g O2中含有3.01×1023个O原子C.氧气和氢气的密度比为16:1D.只有在标准状况下,1 mol气体所占的体积才是22.4 L◎9.0.8g物质含有3.01×1022个分子,则1mol该物质的质量是()A.8g B.19g C.64g D.16g◎10.下列说法中不正确的是()A.标准状况下,1molCO和CO2混合气体的体积为22.4LB.同温同压下,相同体积的气体含有气体分子的数目相同C.标准状况下,物质的量相同的气体,其体积大小相等D.标准状况下,22.4LH2和11.2LO2点燃完全反应,恢复到标准状况时有22.4LH2O◎11.现有相同质量的二氧化硫和三氧化硫,下列关系正确的是()A.含氧原子个数比为2:3 B.含硫元素质量比为5:4C.含氧元素质量比为5:6 D.含硫原子个数比为1:1◎12.5molCO2的质量是;在标准状况下所占的体积约为;所含的分子数目约为;所含氧原子的数目约为。
新人教版高中化学必修1《化学计量在实验中的应用》word同步测试题二

第二节化学计量在实验中的应用(第三课时)同步习题〖基础达标〗1.容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的()A.②④⑥ B③⑤⑥ C.①②④ D.①③⑤2.将VLHCl气体(STP)溶于水制得1000mL盐酸溶液,则该盐酸的物质的量浓度为( )A.V/22400mol/L B.1000V/22.4mol/LC.V/22.4mol/L D.V/11.2mol/L3.下列溶液中的氯离子数目与50 mL 1 mol·L-1的AlCl3溶液中氯离子数目相等的是( )A.150 mL 1 mol·L-1的NaCl B.75 mL 2 mol·L-1的NH4ClC.150 mL 3 mol·L-1的KCl D.75 mL 2 mol·L-1的CaCl24.某10% NaOH溶液,加热蒸发掉100g水后得到80mL20%的溶液,则该20% NaOH溶液的物质的量浓度为( )A.6.25mol/L B.12.5mol/L C.7mol/L D.7.5mol/L5.实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )A.950mL,111.2g B.500mL,117gC.1000mL,117g D.任意规格,111.2g6.要配制物质的量浓度约为2mol·L-1 NaOH溶液100mL,下面的操作正确的是()A.称取8g NaOH固体,放入250mL烧杯中,用100mL量筒量取100mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解B.称取8g NaOH固体,放入100mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100mLC.称取8g NaOH固体,放入100mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀D.用100mL量筒量取40mL 5mol·L-1NaOH溶液,倒入250mL烧杯中,再用同一量筒取60mL蒸馏水,不断搅拌下,慢慢倒入烧杯中7、在100ml水溶液里有5.85gNaCl和11.1gCaCl2,该溶液中c(Cl-)为()A. 1mol/LB. 2mol/LC. 3 mol/LD. 4mol/L8、将4gNaOH溶解在10ml水中,再稀释成1L,从中取出10ml,这10ml溶液的物质的量浓度是( )A.1mol.L-1B.0.1mol.L-1C.0.001mol.L-1D.10mol.L-19、0.5L1mol/LFeCl3溶液与0.2L1mol/LKCl溶液中的Cl-的数目之比为()A、1:3B、3:1C、5:2D、15:210、将30mL0.5mol/LNaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为()A、0.03mol/LB、0.3mol/LC、0.05mol/LD、0.04mol/11、(1)用18mol/L的硫酸配制100mL 1.0mol/L硫酸,若实验仪器有A.100mL量筒B.托盘天平C.玻璃棒D.50mL容量瓶E.10mL量筒F.胶头滴管G.50mL烧杯H.100mL容量瓶实验时应选用仪器的先后顺序是(填入编号) .(2)在容量瓶的使用方法中,下列操作不正确的是(填写标号).A.使用容量瓶前检查它是否漏水.B.容量瓶用蒸馏水洗净后,再用待配溶液润洗.C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm~3cm处,用滴管滴加蒸馏水到标线.D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线2cm~3cm处,用滴管滴加蒸馏水到标线.E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次.解析:(1)用18mol/LH2SO4配制1.0mol/LH2SO4,实际是稀释问题的计算及物质的量浓度溶液配制实验操作.根据稀释定律c1V1=c2V2可计算18mol/L浓H2SO4的体积,V1=c2V2/c1=1.0mol/L×100mL(18mol/L)=5.6mL.该体积的液体用10mL量筒量取比用100mL量筒量取误差要小,故应选E,不能选A.答案为:G、E、C、H、F或E、G、C、H、F.(2)主要涉及的是容量瓶的使用方法.用待配溶液润洗容量瓶,这样会使内壁附着溶质,导致所配溶液浓度偏大,B不正确;若在容量瓶中进行溶解或稀释,由于热效应会使溶液的体积和容量瓶的容量发生改变,所配溶液浓度有误差,C、D不正确.答案为B、C、D.答案:(1)G、E、C、H、F或E、G、C、H、F. (2)B、C、D.【能力提升】1.300mL 某浓度的NaOH 溶液中含有60g 溶质。
高一上化学必修1练习1.2 化学计量在实验中的应用(人教版).doc

-上学期高一化学必修1同步练习化学计量在实验中的应用【典型例题】[例1] 下列有关摩尔质量的说法正确的是( )A. 水的摩尔质量是18gB. 2mol 水的摩尔质量是1mol 水摩尔质量的2倍C. 任何物质的摩尔质量都等于它的式量D. 水的摩尔质量是氢气摩尔质量的9倍答案:D解析:准确掌握有关摩尔质量的相关概念。
[例2] 下列说法不正确的是( )A. 64g 氧气中含氧分子数为2N AB. 1.7g OH 中所含的电子数为N AC. 49g 硫酸中所含氧原子数为2N AD. 58.5g 氯化钠中所含的离子数为N A答案:D解析:要把物质的量的概念和微观粒子有机的结合起来。
[例3] 下列有关摩尔的使用正确的是( )A. 1mol O 的质量为16g ·mol -1B. 0.5mol He 约含有6.02×1023个电子C. 2H 既表示2个氢原子又表示2mol 氢原子D. 每摩尔物质均含有6.02×1023个原子答案:B解析:对于单位和各种粒子间的关系要把握准确。
[例4] 已知4gRO 32-中核外电子数比质子数多6.02×1022个,则元素R 的相对原子质量为()A. 12B. 27C. 32D. 80答案:C解析:把摩尔和粒子及相对原子质量结合,考察综合分析能力。
[例5] 某溶液中n (K +)=n (Na +)=n (Cl -)=2n (SO 42-),则该溶液可能是( )A. KCl 与Na 2SO 4的混合液B. NaCl 与K 2SO 4的混合液C. NaCl 、KCl 、Na 2SO 4的混合液D. Na 2SO 4、K 2SO 4、KCl 的混合液答案:AB解析:把握各物质中各种离子的摩尔比及混合后的关系。
[例6] 在标准状况下,称量一个充满Cl2的容器质量为74.6g,若改充氮气,其质量为66g,则容器的容积为()A. 11.2LB. 5.6LC. 4.48LD. 2.24L答案:C解析:从该题理解气体体积的特点和与摩尔的换算。
人教版高中一年级化学:1.2“化学计量在实验中的应用”达标检测练习题(含答案与解析)

人教版高中一年级化学:1.2“化学计量在实验中的应用”达标检测练习题一、选择题1.配置250mL0.5mol/L的NaCl溶液,有下列仪器:①托盘天平、②量筒、③烧杯、④玻璃棒、⑤漏斗、⑥500mL容量瓶、⑦药匙、⑧250mL容量瓶、⑨胶头滴管、⑩坩埚,需要用到的仪器有()A. ①③④⑦⑧⑨B. ①④⑦⑧⑨⑩C. ①③④⑥⑨⑩D. ①②④⑤⑧⑨2.实验室欲配制1.00mol/L的NaCl溶液80mL。
下列说法正确的是()A. 选用100mL容量瓶,并用蒸馏水洗净后烘干B. 用托盘天平称取5.9g NaCl固体倒入容量瓶中溶解C. 定容时俯视刻度线会导致所配溶液浓度偏高D. 摇匀、静置后发现凹液面低于刻度线1~2mm,用胶头滴管加水至与刻度线相平即可3.已知NaH和H2O反应生成H2和NaOH,反应中1mol NaH()A. 得到1 mol e﹣B. 失去1 mol e﹣C. 失去2 mol e﹣D. 没有电子得失4.将20 mL 0.5 mol/L Al2(SO4)3溶液加水稀释到500 mL,稀释后溶液中SO42﹣浓度为()A. 0.01 mol/LB. 0.02 mol/LC. 0.03mol/LD. 0.06mol/L5.相同物质的量的各种固体或液体的体积并不相同,其主要原因是()A. 粒子大小不同B. 粒子质量不同C. 粒子间距离不同D. 粒子间作用力不同6.用N A表示阿伏伽德罗常数的值.下列叙述正确的是()A. 标准状况下,22.4 L NO与11.2 L O2充分反应后得到的气体分子数为N AB. 3.6 g重水中含有的中子数为2N AC. 一定条件下,6.4 g铜与过量的硫酸反应,转移电子数目为0.2N AD. 常温下,1 L 1 mol•L﹣1的CH3COOH溶液中,所含溶质分子数小于N A7.在下列各组物质中,分子数一定相同的是()A. 0.2mol H2和4.48L HCl气体B. 标准状况下1mol O2和22.4L H2OC. 2g 氦气和标准状况下11.2L CO2D. 4L CO和4L CO28.用98%的浓硫酸(ρ=1.84g•mL﹣1)配制1mol•L﹣1的稀硫酸100mL,按配制溶液时仪器的选用顺序排列,选择正确的是()①玻璃棒②胶头滴管③100mL容量瓶④托盘天平⑤50mL烧杯⑥10mL量筒⑦100mL量筒.A. ⑥⑤③②①B. ⑦⑤③①②C. ④⑤③②①⑨D. ⑥⑤①③②9.N A代表阿伏加德罗常数的值,下列有关叙述不正确的是()A. 在熔融状态下,1 mol Na2O2完全电离出的离子数目为3 N AB. 将CO2通过Na2O2使固体质量增加mg,反应中转移的电子数C. 在标准状况下,22.4LCH4与18 gH2O所含有的电子数均为10N AD. 含1mol Cl﹣的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH数为N A10.下列说法正确的是()A. 6.02×1023个碳原子的质量为1 gB. 钠原子的摩尔质量为23 gC. HCl的摩尔质量等于6.02×1023个HCl分子的质量D. Na2O2的摩尔质量为78 g/mol11.假设与猜想是科学探究的先导和价值所在.下列假设引导下的探究肯定没有意义的()A. 探究SO2和Na2O2反应可能有Na2SO4生成B. 探究浓硫酸与铜在一定条件下反应产生的黑色物质可能是CuOC. 探究Na与水的反应可能有O2生成D. 探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致12.下列图示与对应的叙述不相符的是()A. 如图表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液B. 如图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化C. 如图表示0.1000mol•L﹣1 NaOH溶液滴定20.00mL 0.1000mol•L﹣1醋酸溶液得到的滴定曲线D. 如图表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是增大压强13.研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式.以下用于研究有机物的方法中正确的是()A. 重结晶法一般适用于被提纯的有机物在溶剂中的溶解度受温度影响较大的混合物的分离B. 对有机物分子红外光谱图的研究有助于确定有机物相对分子质量C. 燃烧法是确定有机物分子官能团的有效方法D. 质谱法通常用于分析确定有机物分子的元素组成14.下列关于物质的量的叙述中,正确的是()。
2019-2020学年高中化学人教版必修一同步练习:第1章 第2节 化学计量在实验中的应用(2) Word版含答案.doc
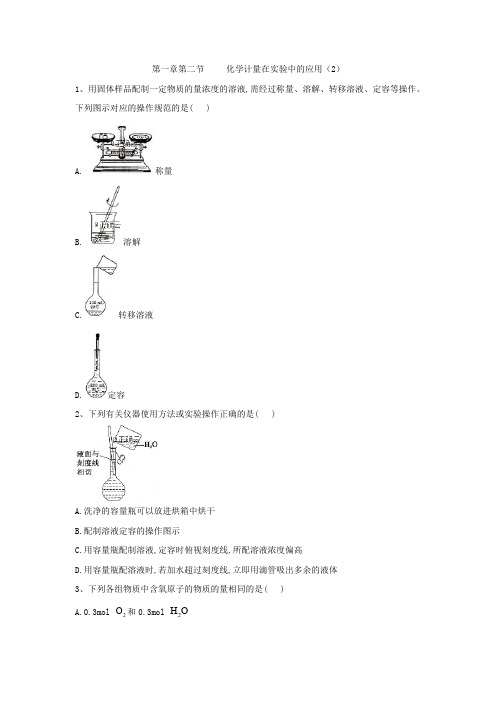
第一章第二节 化学计量在实验中的应用(2)1、用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。
下列图示对应的操作规范的是( )A. 称量B. 溶解C.转移溶液D.定容2、下列有关仪器使用方法或实验操作正确的是( )A.洗净的容量瓶可以放进烘箱中烘干B.配制溶液定容的操作图示C.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏高D.用容量瓶配溶液时,若加水超过刻度线,立即用滴管吸出多余的液体3、下列各组物质中含氧原子的物质的量相同的是( )A.0.3mol 2O 和0.3mol 2H OB.0.1mol 24H SO 和3.6g 2H OC.0.1mol 42MgSO 7H O ⋅和0.1mol 122211C H OD.226.0210⨯个2CO 和0.1mol 4KMnO4、100mL 0.30-1mol L ⋅ 24Na SO 溶液和50mL 0.20-1243mol L Al (SO )⋅溶液混合后,在相同温度下溶液中2-4SO 的物质的量浓度为( )A.0.02-1mol L ⋅B.0.25-1mol L ⋅C.0.40-1mol L ⋅D.0.50-1mol L ⋅5、L V 243Fe (SO )溶液中含3+Fe m g 则溶液中2-4SO 的物质的量浓度为( ) A.-156mol L m V ⋅ B.-13mol L 56m V ⋅ C.-1mol L 56m V ⋅ D.-13mol L 112mV ⋅6、将5-1mol L ⋅的盐酸10mL 稀释到200mL,从中取出5mL,这5mL 溶液的物质的量浓度为( )A.0.5-1mol L ⋅B.0.25-1mol L ⋅C.0.1-1mol L ⋅D.1-1mol L ⋅7、用NaOH 固体配制1.01mol L -⋅的NaOH 溶液220mL,下列说法正确的是( )A.首先称取NaOH 固体8.8gB.定容时仰视刻度线会使所配制的溶液浓度偏高C.定容后,将容量瓶振荡均匀,静置时发现液面低于刻度线,于是又加少量水至刻度线D.容量瓶中原有少量蒸馏水没有影响8、向60mL 24Na SO 溶液中加入2BaCl 溶液,有关数据见下表:下列有关说法不正确的是( )A.混合前,2BaCl 溶液的物质的量浓度为0.10-1mol L ⋅B.混合前,24Na SO 溶液的物质的量浓度为0.15-1mol L ⋅C.3号实验中沉淀的质量x 为1.398gD.完全沉淀60mL 24Na SO 溶液消耗2BaCl 溶液的体积为80mL9、某学生配制了100mL 1-1mol L ⋅的硫酸溶液。
化学:1.2《化学计量在实验中的应用》同步测试(新人教版必修1)1

化学:1.2《化学计量在实验中的应用》同步测试(新人教版必修1)可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24AL:27 S:32 CL:35。
5 Ca:40第I卷(选择题共48分)一、选择题(本题共16小题,每小题3分,共48分。
每小题只有一个选项符合题意)1、下图为一张已部分缺损的体检报告单,其中表示第14项高密度脂蛋白胆固醇的物理量是35—55g/L 20—301.6 1。
5—2。
510 乳酸脱氢酶161 U/L 114—24011 磷酸肌酸激酶56 U/L 25—20012 甘油三酯0。
52 mmol/L 0—1。
7113 总胆固醇4。
27 mmol/L 3。
6—5。
1814 高密度脂蛋白胆固醇1。
57 mmol/L 1。
0—1。
615 低密度脂蛋白胆固醇1。
40 mmol/L 0—3。
3616 葡萄糖4。
94 mmol/L 3。
61—6。
11送检日期:2008—05—16 报告日期:2008—05—17A、质量分数B、物质的量C、摩尔质量D、物质的量浓度2、以下是几种常用基本物理量的名称与符号的对应关系,其中不正确的是A、物质的量——molB、质量——mC、时间——tD、电流——I3、下列物质中,摩尔质量最大的是A、10 ml H2OB、0。
8 mol H2SO4C、54 g ALD、1g CaCO34、10 g 20%的NaOH溶液与100 ml 20%的NaOH溶液的浓度相比较A、前者大B、后者大C、相同D、无法比较5、质量相同的N2和CO,下列物理量不一定相同的是A、物质的量B、分子个数C、原子个数D、气体体积6、决定一定量气体体积大小的主要因素是A、气体分子的大小B、气体分子的质量C、气体分子间距离的大小D、气体分子的组成7、常温下,四个容积为20 L的容积中分别装有质量相同的下列气体,产生的压强最大的是A、H2B、HCLC、SO2D、CO28、将50 ml 0。
高一化学必修1:1.2化学计量在实验中的应用同步测试

人教版2020-2021学年高一化学必修1:1.2化学计量在实验中的应用同步测试学校:___________姓名:___________班级:___________考号:___________一、单选题1.0.5 mol Na2CO3中所含的Na+数约为()A.3.01×1023B.6.02×1023C.0.5 D.12.下列各组数据中,前者刚好是后者两倍的是()A.2mol水的摩尔质量和1mol水的摩尔质量B.200mL1mol/L氯化钙溶液中c(Cl-)和100mL2mol/L氯化钾溶液中c(Cl-)C.32g二氧化硫中氧原子数和标准状况下11.2L一氧化碳中氧原子数D.20%NaOH溶液中NaOH的物质的量浓度和10%NaOH溶液中NaOH的物质的量浓度3.用N A表示阿伏加德罗常数的值,下列叙述正确的是(A.常温常压下,含有N A个氮原子的氮气体积约为11.2LB.标准状况下,64gSO2中含有的原子数为3N AC.在常温常压下,11.2L Cl2含有的分子数为0.5N AD.标准状况下,11.2L H2O 含有的分子数为0.5N A4.N A代表阿伏加德罗常数的值,下列叙述正确的是()A.常温常压下,2.24L氯气与水反应,转移的电子数为0.2N AB.钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1N AC.18gD2O和18gH2O中含有的质子数均为10N AD.标准状况下,11.2L三氧化硫所含分子数为0.5N A5.用N A表示阿伏加德罗常数的值,下列说法正确的是( )A.1 mol N2所含有的原子数为N AB.标准状况下,16 g NH3中含有的分子数为N AC.标准状况下,22.4 L氯化氢所含的原子数为N AD.500 mL 1.0 mol·L-1硫酸钠溶液中所含的钠离子数为N A6.下列溶液中,H+的物质的量浓度为1mol/L的是()A.将1 mol HCl溶于1 L水中得到的溶液B.将1 mol SO3溶于1 L水中得到的溶液C.将1 mol H2SO4溶于水制成的体积1 L的溶液D.将0.5 mol SO3溶于水制成的体积1 L的溶液7.下列说法中正确的是()A.1molOH﹣的质量为17g•mol﹣1B.0.5mol H2所占体积约为11.2LC.等质量的金刚石和晶体硅所含原子个数之比为7:3D.1mol NaCl固体溶于0.5L水中,所得溶液的物质的量浓度为2mol•L﹣18.在三个密闭容器中分别充入He、H2、N2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是()A.p(He)>p(H2)>p(N2)B.p(H2)>p(He)>p(N2)C.p(H2)>p(N2)>p(He)D.p(N2)>p(He)>p(H2)9.实验室中需要配制0.1mol/L的CuSO4溶液960ml,以下操作正确的是()A.称取15.36 g CuSO4,加入1000 mL水B.称取24.0 g CuSO4·5H2O,配成1000 mL溶液C.称取16.0 g CuSO4,加入1000 mL水D.称取25 g CuSO4·5H2O,配成1000 mL溶液二、计算题10.某三原子分子构成的气体,其摩尔质量为M g/mol,该气体质量为m g,阿伏加德罗常数为N A,则:(1)该气体在标准状况下的体积为________ L.(2)该气体在标准状况下的密度为________ g/L.(3)该气体所含原子总数为________个.(4)该气体的一个分子的质量为________g.(5)该气体完全溶于水形成V L溶液(不考虑反应),所得溶液的物质的量浓度为________mol/L11.在标准状况下,1mol 任何气体体积为22.4L.那么在标准状况下,700L NH3的物质的量为________mol,全部溶解在1L水中,所得溶液的质量分数为________,如果该氨水的密度为0.85g•cm﹣3,则氨水的体积为________L,物质的量浓度为________12.24.5g硫酸中所含的氧原子数目为________,48g的氧气在标准状况下的体积是________.三、实验题13.配制100mL0.20mol/L KCl溶液时,某学生用托盘天平将准确称量的1.49gKCl固体放入烧杯中,加入约40mL蒸馏水,用玻璃棒搅拌使其溶解.将溶液由烧杯倒入100mL 容量瓶中,然后往容量瓶中小心地加入蒸馏水,直至液面接近刻度2cm~3cm处.改用胶头滴管加蒸馏水,使液面达到刻度线.把容量瓶盖紧再振荡摇匀该生操作中的错误是________、________、________.14.某学生用已准确称量的2.000g烧碱固体配制一定物质的量浓度的溶液500mL.实验室提供以下仪器:①100mL烧杯②100mL量筒③1000mL容量瓶④500mL容量瓶⑤玻璃棒⑥托盘天平(带砝码).请回答下列问题:(1)配制时,必须使用的仪器有________(填代号),还缺少的仪器是________(填仪器名称);(2)配制时正确的操作顺序是(字母表示,每个操作只用一次)________;A.用少量水洗涤烧杯2﹣3次,洗涤液均注入容量瓶,振荡B.在盛有NaOH固体的烧杯中加入适量水溶解C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中D.将容量瓶盖紧,反复上下颠倒,摇匀E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切F.继续往容量瓶内小心加水,直到液面接近刻度1﹣2cm处(3)实验中两次用到玻璃棒,其作用分别是:先用于________,后用于________(4)若出现如下情况,其中将引起所配溶液浓度偏高的是________;(填下列编号)①容量瓶实验前用蒸馏水洗干净,但未烘干②定容观察液面时俯视③配制过程中遗漏了(2)中步骤A(5)计算:该烧碱溶液的物质的量浓度为________15.某学校实验室从化学试剂商店买回18.4mol•L﹣1的硫酸.现用该浓硫酸配制100mL 1mol•L﹣1的稀硫酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.请回答下列问题:(1)配制稀硫酸时,上述仪器中不需要使用的有________(选填序号),还缺少的仪器有________(写仪器名称).(2)配制100mL 1mol•L﹣1的稀硫酸需要用量筒量取上述浓硫酸的________mL(保留一位小数).(3)实验中造成所配溶液浓度偏高的原因可能是_____.A.容量瓶中原来含有少量蒸馏水B.未经冷却,立即转移至容量瓶并洗涤烧杯,定容C.烧杯没有洗涤D.向容量瓶中加水定容时眼睛一直仰视刻度线.16.某化学实验室需要0.2mol·L-1的NaOH溶液500mL和0.5mol·L-1的硫酸溶液450mL。
人教版化学必修一 第一章 第二节 化学计量在实验中的应用 同步训练 含答案和解析

人教版化学必修一第一章第二节化学计量在实验中的应用同步训练时间:30分钟满分100分一、选择题(本题包括10小题,每小题5分,共50分)1.四种因素:①温度和压强②所含微粒数③微粒本身大小④微粒间的距离,其中对气态物质体积有显著影响的是( )A.②③④ B.②④C.①③④ D.①②④答案:D解析:气态物质微粒之间的距离要比微粒本身的直径大很多倍,故微粒本身的大小对气态物质体积无显著影响。
2.同温同压下,两种气体的体积不同,其主要原因是( )A.气体的分子大小不同B.气体分子间的平均距离不同C.气体的物质的量不同D.气体的性质不同答案:C解析:同温同压下,气体分子间的平均距离相同,两种气体的体积不同,其主要原因只能是气体的物质的量不同。
3.下列说法正确的是( )A.同温、同压下,相同质量的气体都占有相同的体积B.同温、同压下,相同体积的气体都含有相同数目的分子C.在标准状况下,1 mol任何物质的体积均约是22.4 LD.1 mol某气体的体积约为22.4 L,该气体所处的状况一定是标准状况答案:B解析:同温、同压下,质量相同的不同气体的物质的量不一定相同,所以不一定占有相同的体积,故A项错误;同温、同压下,气体摩尔体积是定值,由n=NN A =VVm知,气体体积相同时分子数目(N)也相同,故B项正确;水在标准状况下不是气体,1 mol水的体积不是22.4 L,故C项错误;1 mol某气体若处于高温、高压或低温、低压的情况下,气体体积也可能约为22.4 L,故D项错误。
4.有一种气体的质量是14.2 g,体积是4.48 L(标准状况),该气体的摩尔质量是( )A.28.4 B.28.4 g·mo l-1C.71 D.71 g·mol-1答案:D解析:气体的物质的量:n=4.48 L22.4 L·mol-1=0.2 mol,M=mn=14.2 g0.2 mol=71g·mol-1。
2019-2020学年高中化学必修1《1.2化学计量在实验中的应用》同步测试卷及答案解析

2019-2020学年高中化学必修1《1.2化学计量在实验中的应用》同步测试卷一.选择题(共14小题)1.将Na单质的性质与Fe单质的性质放在一起进行研究,分析其异同点,这种研究方法是()A.观察法B.实验法C.分类法D.比较法2.设N A为阿伏加德罗常数的值。
下列有关叙述正确的是()A.1L0.1mol•L﹣1NH4Cl溶液中,NH4+的数目为0.1N AB.23g钠在空气中完全燃烧生成Na2O和Na2O2的混合物,转移电子数为N AC.将含1molFeCl3的饱和溶液制成胶体,其中含Fe(OH)3胶体粒子数一定为N A D.标准状况下,2.24 L CCl4含有的共价键数为0.4N A3.下列名词中,属于基本物理量的是()A.速度B.千克C.摩尔D.时间4.下列说法正确的是()A.摩尔是七个基本物理量之一,符号为molB.摩尔质量在数值上等于该物质的相对分子质量或相对原子质量C.1 mol任何物质都含有6.02×1023个分子D.同温同压下,所有气体的摩尔体积都是22.4 L/mol5.气体的体积主要由以下什么因素决定的:①气体分子的直径②气体物质的量的多少③气体分子间的平均距离④气体分子的相对分子质量()A.①②B.①③C.②③D.②④6.下列叙述中正确的是()A.1mol的O2和CO2含有的原子数相等B.SO42﹣的摩尔质量是96g•mol﹣1C.阿伏加德罗常数恰好为6.02×1023 mol﹣1D.1mol CO2的质量为44g•mol﹣17.在一定的温度和压强下,1L X气体与1L Y气体反应后生成1L水蒸气和1L氮气,则X、Y分别是()A.H2、N2O B.H2、N2O3C.H2、N2O4D.H2、NO2第1 页共27 页。
人教版高中化学必修一《1.2化学计量在实验中的应用》练习2.docx

高中化学学习材料唐玲出品2012.3班别_____________ 姓名_____________ 学号_____________ 成绩______________一、单项选择题(把答案填在后面的答题框)1.下列说法中错误的是A. 0.3 mol H2SO4B. 1 mol H2OC. 0.5 mol 硫D. 3 mol 氢原子2.用N A表示阿伏加德罗常数,64g SO2含有氧原子数为A. 1N AB. 2N AC. 3N AD. 4N A3. 1 mol MgCl2 中含有A.6.02×1023个MgCl2分子B.6.02×1023个Cl-C.1 mol Mg2+D.1mol Cl- 离子4.摩尔质量最大的化合物是A. CO2B.NaOHC. HClD. Cl25.含有6.02×1022个分子的某物质的质量为2.8g,则该物质的相对分子质量为A.14B.28C.2.8D.2806.空气可近似认为是N2和O2按体积比为4∶1组成的混合气体,则空气的平均相对分子质量约为A.28B.29C.34D.607.标准状态下,2molN2的体积是A.44.8LB.22.4LC.11.2LD.2L8.在相同条件下,与0.5mol由N2和CO组成的混合气具有相同的体积的是A. 1g H2B. 10g O2C. 11g CO2D. 16g CH49. N A表示阿伏加德罗常数,下列说法不正确的是A.H2SO4的摩尔质量与N A个硫酸分子的质量在数值上相等B.N A个氧气分子和N A个氮气分子的质量比为8∶7C.28 g氮气所含原子数目为N AD.在标准状况下,0.5 N A个氯气分子所占的体积为11.2 L10.同温同压下,等质量的O2和SO2的A.氧原子数比为1∶2B.体积比为2∶1C.分子个数比为1∶2D.所含原子个数比为1∶111.下列说法不正确的是A.常温常压下,O.5×6.02×1023个一氧化碳分子所占的体积是11.2 LB.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:lC.32g氧气所含的原子数目为2×6.02×1023D.磷酸的摩尔质量(以g/mol为单位)与6.02×1023个磷酸分子的质量(以g为单位)在数值上相等12. 2molCl2和2molCO2相比较,下列叙述中正确的是A.分子数相等B.原子数相等C.体积相等D.质量相等13.若 m g氢气含 n 个氢分子,则阿伏加德罗常数为A.2nB.n/mC.2n/mD.n14.下列溶液中与50 mL 1 mol·L-1的AlCl3溶液中氯离子浓度相等的是A.150 mL 1 mol·L-1 的NaClB.75 mL 2 mol·L-1 的NH4ClC.150 mL 3 mol·L-1 的KClD.75 mL 2 mol·L-1 的CaCl215.实验室要配制0.5mol/L硫酸溶液500mL,需要用10mol/L的硫酸溶液的体积是A.25B.25LC.25mLD.50mL16.物质的量浓度相同的NaCl 、MgCl2、AlCl3三种溶液,当溶液的体积比为3:2:1时,三种溶液中Cl-的物质的量之比为A. 1:1:1B. 1:2:3C. 3:2:1D. 3:4:317.某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的,你认为其中的原因可能是A.所用NaOH已经潮解B.向容量瓶中加水未到刻度线C.有少量NaOH溶液残留在烧杯里D.用带游码的托盘天平称2.4g NaOH 时误用了“左码右物”方法18.配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的是①定容时观察液面仰视;②定容时观察液面俯视③有少量NaOH溶液残留在烧杯中④容量瓶中原来有少量蒸馏水A.①②B.②③C.①③D.③④19.将5mol·L-1盐酸10mL稀释到200mL,再取出5mL,这5mL溶液的物质的量浓度是A.0.05mol/L B.0.25mol/L C.0.1mol/L D.0.5mol/L20.实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是:A.1000mL,212gB.950mL,543.4gC.任意规格,572gD.500mL,286g二、填空题21. 1.5 mol氧分子中含有个氧分子,mol氧原子,______________个氧原子,质量为_____________ g,标况下体积为_________ L。
人教版高中化学必修一秋化学同步测试:1.2化学计量在实验中的应用(三,无答案).docx

可能用到的相对原子质量:一、选择题(每小题5分,共1、在容量瓶上不作标记的是 ( A .刻度线 C .温度2、下列溶液中,Na +A .10 mL 0.4 mol·L -1 NaOH B .5 mL 0.3 mol·L -1 Na 3PO 4C .10 mL 0.3 mol·L -1 Na 2SO 4D .5 mL 0.5 mol·L -1 NaNO 33、在100 mL 的溶液中溶有A .3 mol/LB C .0.3 mol/LD 4、对1 mol/L 的Na 2SO 4A .溶液中含有1 mol Na 2SO 4 B .1 L 溶液中含有142 g Na 2C .1 mol Na 2SO 4溶于1 L 水D .从1 L 该溶液中取出5、下列溶液中物质的量浓度为A .将40 g NaOH 溶解在1 L 250 mL( )( )( )D .②④⑥0.4 mol/L ,SO 2-4的物质的量D .0.25 mol/L ( )D .1.25 d mol/L 0.2mol/L 30mL 的溶液,恰好反应完全。
则混合溶液中Na+的物质的量浓度为()A.0.1 mol/L B.0.15 mol/L C.0.2 mol/L D.0.25 mol/L 12、将质量分数为a%,物质的量浓度为c1mol·L-1的稀H2SO4蒸发掉一定量的水,使之质量分数变为2a%,此时刻H2SO4的物质的量浓度为c2 mol·L-1,则c1和c2的数值关系是() A.c2=2c1 B.c2>2c1C.c2<2c1 D.无法确定)配制过程的先后顺序为(用字母A~F填写)_______________________________。
)配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、____________________________________)简述如何容量瓶是否漏水__________________________________________________________ _______________________________________________________________________________“2SO4,其操作可分为以下各步:并用玻璃棒不断搅拌处。
人教版高中化学必修一秋化学同步测试:1.2化学计量在实验中的应用(一,无答案)

《必修一》第一章第二节练习卷(一)可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cu 64一、选择题(每小题4分,共48分,答案写在后面的表格中..........)1.下列叙述正确的是()A.1 mol O2的质量为32 g·mol-1B.1 mol物质的质量等于该物质的相对分子质量或相对原子质量C.SO2-4的摩尔质量为96 g·mol-1D.CO2的摩尔质量为44 g2.对于等质量的下列各气体中,含有的分子个数最多的是()A.Cl2 B.H2 C.O2 D.CO3.下列哪种物质所含原子数与0.2 mol H3PO4所含原子数相等()A.0.4 mol H2O B.0.2 mol H2SO4 C.0.8 mol HCl D.0.3 mol HNO3 4.设N A为阿伏加德罗常数的值,下列说法正确的是()A.2 mol水中含有N A个H2O分子B.1 g氢气含有N A个H2分子C.1 mol Fe 与过量稀盐酸反应生成N A个H2分子D.16 g氧气中含有N A个氧分子5.(双选)下列说法中正确的是()A.6.02×1023个12C原子数就是阿伏加德罗常数B.1 mol氧含6.02×1023个O2分子C.1 mol NaCl里含2 mol离子D.1 mol H+中含有的H+数为N A 6.下列有关阿伏加德罗常数(N A)的说法错误的是()A.32 g O2所含的原子数目为N AB.0.5 mol H2O含有的原子数目为1.5N AC.1 mol H2O含有的H2O分子数目为N AD.0.5N A个氯气分子的物质的量是0.5 mol 7.若a g CO2含b个分子,则阿伏加德罗常数的值为()A.ab/28 B.ab/14 C.28/b D.44b/a8.某气体物质的质量为6.4 g,含有6.02×1022个分子,则该气体的相对分子质量是() A.64 B.32 C.96 D.1249.有98 g纯H2SO4和纯H3PO4的混酸,测知其中氧元素的质量分数是65.3%,则混酸中H2SO4和H3PO4的物质的量之比为()A.1︰1 B.3︰1 C.4︰1 D.任意比10.2011年7月中国发射了“天宫一号”太空舱,火箭发射的燃料有很多,偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生巨大能量,可作为航天运载火箭的推动力。
人教版高中化学必修一秋化学同步测试:1.2化学计量在实验中的应用(二,无答案).docx

高中化学学习材料唐玲出品《必修一》第一章第二节练习卷(二)可能用到的相对原子质量:H 1 C 12 N 14 O 16 Ne 20一、选择题(每小题4分,共52分,答案写在后面的表格中..........)1、影响一定数量气体体积大小的主要因素是 ( )A.气体分子的摩尔质量 B.微粒本身的大小C.微粒的质量 D.微粒间的平均距离2、下列说法中错误的是()A.1mol物质在标准状况下的体积不一定为22.4LB.1mol任何气体在标准状况下体积都约为22.4LC.气体摩尔体积约为22.4L•mol-1D.非标准状况下,1mol气体体积也可能约为22.4L3、224 mL某气体在标准状况下的质量为0.32 g,该气体的摩尔质量约为 ( )A.32g·mol—1 B.32 C.64 g·mol-1 D.644、相同温度和压强下,现有CO和CO2两种气体,它们所含氧原子的物质的量均为1 mol,则CO与CO2的体积之比为 ( )A.1︰1 B.1︰2 C.2︰1 D.3︰25、下列叙述中正确的是 ( )①标准状况下,1L HCl和1L H2O的物质的量相同②标准状况下,1 g H2和14 g N2的体积相同③28 g CO的体积为22.4 L④两种物质的物质的量相同,则它们在标准状况下的体积也相同⑤在同温同体积时,气体的物质的量增大,则压强越大⑥同温同压下,气体的密度与气体的相对分子质量成正比A.①②③ B.②⑤⑥ C.②③⑥ D.④⑤⑥6、下列说法正确的是 ( )A.1 L CO一定与1 L N2的质量相等B.质量相同、密度不同的CO与N2所含的原子数目一定相等C.分子数不同的CO2与O2的体积一定不等D.在同温同压下,反应前气体体积之和一定等于反应后气体体积之和7、用N A表示阿伏加德罗常数的值,下列叙述正确的是 ( )A.含有N A个氦原子的氦气在标准状况下的体积约为11.2 LB.25℃,1.01×105 Pa,32 g O2和O3的混合气体所含原子数为2.5N AC.标准状况下,11.2 L H2O含有的原子数为1.5N AD.常温常压下,44 g CO2含有的原子数为3N A8、按体积比为1︰2︰3所组成的N2、O2、CO2的混合气体100 g,在标准状况下的体积为 ( )A.60 L B.30 L C.11.2 L D.112 L9、在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体。
人教版高中化学必修一§1.2.1 化学计量在实验中的应用.docx

高中化学学习材料唐玲出品§1.2.1 化学计量在实验中的应用一.选择题(每题6分,共72分)1.下列对于“摩尔”的理解正确的是()A.摩尔是国际科学界建议采用的一种物理量B.摩尔是物质的量的单位,简称摩,符号为molC.1摩尔任何集体都含有6.02×1023个分子D.1mol氧含6.02×1023个O22.下列说法正确的是()A.摩尔质量就等于物质的相对分子质量或相对原子质量B.摩尔质量就是物质的相对分子质量或相对原子质量的6.02×1023倍C.HNO3的摩尔质量是63gD.H2SO4和H3PO4的摩尔质量相等3.下列说法正确的是()A.1mol H2SO4的质量为98g•mol-1B.SO3的摩尔质量为80g•mol-1C.1molO就是1mol 氧气D.SO2 的摩尔质量与其相对分子质量相等4.下列物质中所含原子数最多的是()A.6.02×1023个CO B.18gH2OC.1molNH3 D.0.5mol N25.某风景区被称为天然氧吧,其原因是空气中的自由电子附着在分子或原子上形成空气负离子,被称为“空气维生素”。
下列关于1mol O2—的说法正确的是()A.摩尔质量为64g B.含16 mol质子C.含有1 mol电子D.最外层有8mol电子6.若某原子的摩尔质量是M g·mol-1,则一个该原子的真实质量是()A .M gB .M 1gC .231002.6⨯M g D .M 231002.6⨯g 7.若1滴水的质量是m g ,则1滴水所含的分子数是( )A .m ×18×6.02×1023B .18m ×6.02×1023 C .6.02×1023D . 18m ×6.02×1023 8.已知1.505×1023个X 气体分子的质量为8 g ,则X 气体的摩尔质量是( ) A .16 g B .32C .64 g •mol -1D .32 g •mol -1 9.如果1 g CO 2中含有m 个氧原子,则阿伏加德罗常数为( )A .mol -1B . 22 m mol -1C . 44 m mol -1D . 11 m mol -110.设N A 为阿伏加德罗常数的值,下列说法错误的是( )A .32克O 2所含的原子数目为N AB .0.5molH 2O 含有的原子数目为1.5N AC .1molH 2O 含有的H 2O 分子数目为N AD .0.5 N A 个氯气分子的物质的量是0.5mol11.下列有关阿伏加德罗常数(N A )的说法不正确的是 ( )A.0.012 kg 12C 所含有的碳原子数为N A 个B.N A 的近似值为6.02×1023C.1 mol H 2O 含有的H 2O 分子数目为N A 个D.N A 个Cl 2的质量为35.5 g12.下列物质中所含的分子数相等的是( )①0.1molCO 2 ②9.8gH 2SO 4 ③1gH 2O ④1.6gO 2A .①②B .②③C .①④D .③④ 二.非选择题(每空2分,共28分)13.1.61 g Na 2SO 4•10H 2O (相对分子质量为322)中含SO 42—的物质的量是_____________;含H 2O 的数目为 。
人教版高中化学必修一1.2《化学计量在实验中的应用》变式练习.docx

高中化学学习材料1.2《化学计量在实验中的应用》变式练习1.若某原子的摩尔质量是M g ·mol -1,则一个该原子的真实质量是( )A .M gB .M1g C .g D .g解析:摩尔质量指的是1摩尔物质的质量,即6.02×1023个粒子的质量,因此一个该原子的真实质量可用g 表示。
答案:C2.若50滴水正好是m mL ,则1滴水所含的分子数是( )A .m ×50×18×6.02×1023B .×6.02×1023C .×6.02×1023D . 解析:由已知,1滴水的体积为mL ,又因为H 2O 的密度为lg ·mol -3,故1滴水的质量即为g ,相当于mol ,所含的分子数为:×6.02×1023,答案选B 。
答案:B3.在标准状况下,若V L 甲烷中含有的氢原子个数为n ,则阿伏加德罗常数可表示为( )A .4.22VnB .V n 4.22C .6.5VnD .Vn 6.5 解析:设阿伏加德罗常数为N ,则依题意,可得:4.22V ×4n =N 故N =V n 6.5,选D 。
答案:D4.有一真空瓶质量为1m ,该瓶充入空气后质量为2m 。
在相同状况下,若改为充入某气体A 时,总质量为3m 。
则A 的相对分子质量是( )A .12m m ×29B .13m m ×29 C .1213m m m m --×29 D .1312m m m m --×29解析:不管在瓶中充入何种气体,在相同状况下,其体积和物质的量均是相等的。
设A 的相对分子质量是χ,则根据2912m m -=χ13m m -,得χ=1213m m m m --×29。
故应选C 。
答案:C5.同温同压下,气体A 与氧气的质量比为1∶2,体积比为1∶4,气体A 的相对分子质量是( )A .16B .17C .44D .64解析:设气体A 的相对分子质量为a ,即A 的摩尔质量为a g ·mol -1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
可能用到的相对原子质量:一、选择题(每小题5分,共1、在容量瓶上不作标记的是 ( A .刻度线 C .温度
2、下列溶液中,Na +
A .10 mL 0.4 mol·L -
1 NaOH B .5 mL 0.3 mol·L -
1 Na 3PO 4C .10 mL 0.3 mol·L -
1 Na 2SO 4D .5 mL 0.5 mol·L -
1 NaNO 33、在100 mL 的溶液中溶有A .3 mol/L
B C .0.3 mol/L
D 4、对1 mol/L 的Na 2SO 4A .溶液中含有1 mol Na 2SO 4 B .1 L 溶液中含有142 g Na 2C .1 mol Na 2SO 4溶于1 L 水
D .从1 L 该溶液中取出5、下列溶液中物质的量浓度为A .将40 g NaOH 溶解在1 L B .将22.4 L HCl 250 mL
( )
( )
( )
D .②④⑥
0.4 mol/L ,SO 2-
4的物质的量
D .0.25 mol/L ( )
D .1.25 d mol/L 0.2mol/L 30mL 的溶液,恰好反应完全。
则混合
A.0.1 mol/L B.0.15 mol/L C.0.2 mol/L D.0.25 mol/L
12、将质量分数为a%,物质的量浓度为c1 mol·L-1的稀H2SO4蒸发掉一定量的水,使之质量分数变为2a%,此时刻H2SO4的物质的量浓度为c2 mol·L-1,则c1和c2的数值关系是() A.c2=2c1 B.c2>2c1
C.c2<2c1 D.无法确定
13
(
(
(
14
()配制过程的先后顺序为(用字母A~F填写)_______________________________。
()配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、____________________________________()简述如何容量瓶是否漏水__________________________________________________________ _______________________________________________________________________________
(
(
“
“
(2
SO4,其操作可分为以下各步:
处。
):
_______________。
水中,得到质量分数为w%的溶液,()。
