金属有机化学2
金属有机化学-2

_ X W C NR2
X W C NR2 _
配体RC不仅可与一个金属形成三重键,也可与三个金属原 子形成三个单键,以此在过渡金属原子簇中形成三重桥基 基团,μ3-alkylidyne。 12.5 金属羰基配合物 过渡金属羰基配合物属所知最早的有机金属化合物 中的一类。它们是合成其它低价金属配合物,特别是原子 簇的常用原料。羰基配体不仅可被许许多多其它配体所取 代,而且未被取代的羰基还能稳定化合物分子
M M
O C M
μ3
M
二重桥联 doubly bridging
三重桥联 triply bridging
CO作为双桥基配体十分常见,特别是在多核原子簇化合物 中;它们几乎总伴随着金属-金属键而出现:
O C M C O C O M O C M M
CO桥常成对出现,并能与非桥联模式处于动态平衡之中。 例如,Co2(CO)8的溶液至少含有两种异构体:
1. DMPE Ta Br Br C H 2. 2Na/Hg P P Ta C H CMe3
CMe3
3. Hexa(t−butoxy)ditungsten在温和的反应条件下,与炔烃 发生金属化反应,也可得到过渡金属炔基配合物:
(t−BuO)3W≡W(t−BuO)3 + RC≡CR
⎯→ ⎯
2 (t−BuO)W≡C−R R = 烷基
12.5.1 1.
制备,结构和性质 金属+CO Ni + 4CO Fe + 5CO
⎯1bar, 25° C→ ⎯⎯ ⎯
Ni(CO)4 ⎯100bar, 150⎯→ Fe(CO)5 ⎯⎯⎯C °
2.
金属盐+还原剂+CO
3 4
H PO VCl3 + 3Na + 6CO ⎯diglyme→[Na(diglyme)2]+[V(CO)6] − ⎯⎯→ ⎯⎯ ⎯
金属有机化学(2)

具有9个低能量的成键分子轨道(6个σ轨道和3 个π轨道)可以填充18个电子。
RuⅡ
FeⅡ Cr0 CoⅢ ReⅤ
4 2
7 8
戴帽八面体 四方反椎
[Mo(CO)4Cl3]- MoⅡ
化合物中比较常见的是四配位和六配位化合物,绝大多数是六 配位化合物,正八面体的高度对称性,使得分子轨道之间的能 量降低,增加了六配位的正八面体络合物的稳定性。
四、络合物的配位数和几何构型
1. 四配位络合物
t1u σ对称 eg π对称 t2g eg t1u a1g
a1g
18电子规则可以预测络合物的结构和稳定性。 RhH(CO)(PPh3)3 NVE=9+1+2+2×3=18 稳定 Co(CO)4 NVE=9+2×4=17 不稳定
Co2(CO)8 HCo(CO)4 NVE=9+2×4+1=18 有一些化合物16电子也稳定:
atomic number)
很早以前,N.V.Sidgwick提出了一个经验规 则: 稳定的过渡金属有机络合物中,金属的电子 数与配位体提供的电子数总和与本周期中的 惰性气体的电子数相同。
例如: Ni(CO)4 Ni 原子序数 28,外围28个电子。 4 个CO 2×4=8 个电子 EAN=36,与惰性气体Kr的电子构型相同。 [Ag(NH3)4]+ Ag 原子序数 47,外围46个电子。 4 个NH3 2×4=8 个电子 EAN=54,与惰性气体Xe的电子构型相同。
金属有机化学简介

1.前言:金属有机化学 金属有机催化剂催化反应举例:
四氯化钛-三乙基铝常压下催化乙烯聚合:
反应历程:
所得聚乙烯具有立体规整性好、密度高 、结晶度 高等特点 。
1.前言:金属有机化学
1.前言:金属有机化学
钌催化剂催化氢转移(还原)反应:
该反应具有高的选择性和反应的产率很高。
1.前言:金属有机化学-发展前沿
2.3新阶段
以下两类典型的钯催化交叉偶联反应:
钯催化交叉偶联反应主要应用于制药工业,据统 计:25%以上的制药业化学合成都涉及此类反应。 并且应经应用于药品大规模生产,如抗炎药萘普 生和哮喘药孟鲁斯特。
2.3新阶段
最受人赞誉的是提供了一种全新的合成方法。
海葵毒素:从海洋生物中提取的毒性物质,有很大药用价 值。分子量巨大,看成有机化学界的“恐龙”。哈弗大学 Kishi研究小组历时8年,将其合成出来。
二茂铁
C.医药领域:如:抗贫血、抗肿瘤、抗菌….. 临羟基苯甲酰二茂铁钠盐、顺-二氨基二氯化铂( cis-DDP)、
D.液晶材料:
含二茂铁基的希夫碱类衍生物
2.2飞速发展阶段(1951-1990)
二茂铁, 是一个典型的金属有机化合物;夹心型结 构; 促进了化学键理论的发展,扩大了配合物的 研究领域。
2.2飞速发展阶段(1951-1990)
2.2飞速发展阶段(1951-1990)
定向聚合技术,不仅使高分子材料的生产上了一 个台阶,也为配位催化作用开辟了广阔的研究领 域,为现代合成材料工业奠定了基础。同时,这 一发现还是高分子科学发展的一个重要里程碑。 K. Ziegler 和G. Natta于1963年获 得诺贝尔奖,以 表彰他们在金属 有机化学方向的 卓越贡献!
有机化学中的金属有机化合物

有机化学中的金属有机化合物金属有机化合物是有机化学领域中的一类重要化合物,其分子结构中含有金属与有机基团的化学键。
金属有机化合物具有独特的性质和广泛的应用,对于研究金属有机化学以及发展金属有机合成方法具有重要意义。
本文将介绍金属有机化合物的定义、合成方法以及其在催化反应和材料科学中的应用。
一、金属有机化合物的定义金属有机化合物是指化合物中含有金属元素(如铁、铜、锌等)和有机基团(如烃基、醇基等)的共价键。
这些化合物通常以配合物的形式存在,其中金属中心与有机基团通过配位键相连。
金属有机化合物可以根据金属元素的性质和配位方式进行分类,如金属卡宾、金属烯烃配合物等。
二、金属有机化合物的合成方法1. 金属有机化合物的合成可以通过直接反应法实现。
直接反应法是指金属与有机底物直接发生反应生成金属有机化合物。
例如,Grignard 试剂与卤化物反应生成金属有机化合物,这是一种常用的合成金属有机化合物的方法。
2. 金属有机化合物的合成也可以通过还原法实现。
还原法是指用还原剂还原金属盐类,使金属离子与有机底物发生反应生成金属有机化合物。
这种方法常用于合成铁、镍等金属有机化合物。
3. 另一种常用的合成金属有机化合物的方法是配体交换法。
配体交换法是通过将金属配合物中的配体与有机配体交换,从而生成金属有机化合物。
这种方法广泛应用于合成含铂、钯等金属的有机化合物。
三、金属有机化合物的应用金属有机化合物在催化反应中具有重要作用。
例如,铁-铍双金属有机化合物可以催化烯烃羰基化反应,得到醛和酮化合物。
铜配合物可用作C-C键的形成催化剂,广泛应用于有机合成领域。
金属有机化合物在材料科学中也具有广泛应用。
例如,金属有机化合物可以用于合成金属有机聚合物,这些聚合物在光电、荧光材料方面具有良好性能。
金属有机化合物还可以用于制备金属有机框架材料(MOF),这种材料在气体吸附、分离等方面具有重要应用价值。
总结金属有机化合物是有机化学中的重要研究对象,对于金属有机化学的发展和应用具有重要意义。
[理学]第三章-金属有机化学-part2
![[理学]第三章-金属有机化学-part2](https://img.taocdn.com/s3/m/7ad8a60054270722192e453610661ed9ad5155a5.png)
2. 分子氮配合物中的化学键
N2与CO是等电子体,分子氮与过渡金属离子(原子) 生成配合物时的成键情况也与一氧化碳相似。
氮原子上的孤对电子进入过渡金属离子(原子)的空 轨道,形成σ配键,同时过渡金属离子(原子)的d电子进 入N2分子的反键π*空轨道,形成反馈π键,构成σ-π双键结 构。
N2比CO不易给出电子(N2的2σg比CO的5σ负),N2的 Lewis碱性较CO弱;同时N2的2πg比CO的2π正,不易接 受电子,因此,N2的π酸性较CO弱,一般认为N2是中等强 度的π-接受体和弱的σ给予体。 【 问 题 】N2 是 π- 配 体 , 在 形 成 分 子 氮 配 合 物 对 金 属 离 子 (原子)有何要求? 【问题】N2与CO配位性谁更强?哪一种更稳定?
N
NO
NO+与CO是等电子体, 键级为3。 NO的键长为115.1 pm, NO+的键长 106.2 pm。
NO 作 配 体 时 是 三 电 子 给 予 体 。 当它跟金属配位时,处于反键*轨道 上的电子先转移到金属原子上.
M+NO → NO++M-
NO+与金属M-的配位方式同CO一 样,即NO+(亚硝酰阳离子)向金属M-提 供一对电子形成配键, 而M-提供d电子 到NO+的反键* 轨道形成反馈配键, 亦即形成-反馈键。
从Raman光谱来看,端配N2配合物伸缩频率为1930 2230cm-1 ,说明NN键被削弱。
如图所示为端配和侧配的N2配合物:
N
110.1
178o N
178.4 P
Cl 218.5Co
216.7 220.2
160 P
H
(a)
Li
Li
Li
Ni
N
Li Li
有机化学中的有机金属化合物与金属有机化学

有机化学中的有机金属化合物与金属有机化学有机金属化合物是由有机分子与金属中心通过金属-有机键相连而形成的化合物。
这类化合物在有机化学和金属有机化学领域中扮演着重要的角色。
本文将针对有机金属化合物的合成方法、性质以及应用进行综述,以便更好地理解有机金属化合物和金属有机化学的相关知识。
一、有机金属化合物的合成方法有机金属化合物的合成方法多样,其中较常见的方法包括:1. 氧化加成法:该方法通过氧化反应在有机分子中引入金属中心。
例如,通过氧化加成法可以将金属卤化物与有机铜试剂反应得到有机金属化合物。
2. 过渡金属催化法:某些过渡金属催化反应可以将无机金属与有机分子进行偶联,生成有机金属化合物。
常用的过渡金属催化法包括钯催化的Suzuki偶联反应和钯催化的Heck偶联反应等。
3. 电化学合成法:电化学合成法通过在电化学条件下,在有机分子中引入金属中心。
这种方法通常通过电化学还原或氧化有机金属前体来实现。
以上只是有机金属化合物合成方法的几个典型例子,实际上还有许多其他方法可以合成有机金属化合物。
二、有机金属化合物的性质有机金属化合物的性质独特而多样,其一般性质和化学性质包括以下几个方面:1. 组成:有机金属化合物的基本组成是有机分子与金属中心的配位结合。
这种结合通常通过金属原子与有机分子中的配体之间的共价键或配位键来实现。
2. 稳定性:有机金属化合物的稳定性受到多种因素的影响,包括金属中心的电荷、配体的性质以及周围环境的条件等。
一些有机金属化合物具有良好的热稳定性,可以在高温条件下应用。
3. 反应性:有机金属化合物通常具有较高的反应活性,可以进行多种有机反应。
其中一些有机金属化合物还可以参与催化反应,发挥催化剂的作用。
有机金属化合物的性质研究为其在有机化学和金属有机化学领域的应用提供了可靠的理论基础。
三、有机金属化合物的应用有机金属化合物在有机合成、催化剂设计以及金属有机框架材料等领域具有广泛的应用。
以下列举了一些有机金属化合物的常见应用:1. 催化剂:许多有机金属化合物具有催化活性,可以参与多种有机合成反应。
有机金属化学(二)05
卡宾(Schrock)配合物(高氧化态) C亲核 卡宾(Schrock)配合物(高氧化态) C亲核 配合物
Carbyne配合物 配合物
Carbyne配合物 配合物
讨论: 讨论:
1. 烯丙基配合物 烯丙基配合物[PdC3H5Cl]2的结构和总价电子计数 的结构和总价电子计数, 金属原子间是否存在M–M键 ? 键 金属原子间是否存在 对比 [Pt(CO)Cl2]2和[Mn(CO)4Cl]2
一. 常见的有机配体和齿合度 常见的有机配体和齿合度
提供M的 提供 的 电子数 1 2 2(4) 2 齿合度 η1 η2 η2 η1 配体 烷基(H, X) 烷基 烯烃(CH2=CH2) 烯烃 炔烃(CH≡CH) ≡ 炔烃
M C
M-L的结Байду номын сангаас 的结构
M
CR3
C
M
C
C
亚烷基(carbene) 亚烷基
M
H H CH4 H H NH3 H H H H H OH2 FH H
2. 等瓣相似
R. Hoffmann, (Nobel Lecture, 1982) “Building Bridges between Inorganic and Organic Chemistry”
Angew. Chemie. Vol 21, 10(1982)711-724
Ti
(深绿色固体 深绿色固体) 深绿色固体
含茂基的弯曲夹心(bent-sandwich )化合物 含茂基的弯曲夹心 化合物
4. 环戊二烯基 羰基化合物 环戊二烯基–羰基化合物
Fe(CO)5+2 C5H6(二聚体 → Fe2(η5–C5H5)2(CO)4 + CO + H2 二聚体) 二聚体 η V(η5–C5H5)2 +CO → V(η5–C5H5)(CO)4 η η
金属有机化学:第五章 膦配体 (2)

金属中心反馈p键向P-C的 s*轨道填充电子,削弱P-C 键,使P-C键变长
注意:同时存在缩短P-C键 长的反效应,P给出孤对电 子到金属,导致P原子周围 孤对与键对电子的排斥作用 减弱,缩短P-C键
• 膦配体的电子性质可以在很大的范围内调节(从“强s电子给 体/弱p电子受体”到“弱s电子给体/强p电子受体”)
128
PBr3
131
PEt3, PPr3, PBu3
PPh2(OMe)
132
PEt2Ph, PMePh2
136
Cy2PCH2CH2PCy2
142
PPh3
145
PPh2(t-Bu)
157
PPh2(C6F5)
158
P(i-Pr)3
160
PBz3
165
PCy3
PPh(t-Bu)2
170
P(O-t-Bu)3
87
PPhH2
P(OCH2)3CR
101
PF3
104
Me2PCH2CH2PMe2
P(OMe)3
107
P(OEt)3
109
P(CH2O)3CR
114
Hale Waihona Puke Et2PCH2CH2PEt2
115
PMe3
118
Ph2PCH2PPh2
121
PMe2CF3
PCl3
124
Ph2PCH2CH2PPh2
125
PPh2H
P(OPh)3
P(C6F5)3
P(O-i-Pr)3 P(OEt)3
P(OMe)3
PPh2Cl PMe2CF3 P(O-2,4-Me-C6H3)3 P(OPh)3 P(OCH2)3CR
金 属 有 机 化 学

金属有机化学1.序言2.主族金属有机化学3.过渡金属有机化学4.稀土金属有机化学5.有机合成中的金属有机化学6.金属有机化学催化反应一、序言1. 定义:金属有机化学是研究含有金属-碳键的化合物的化学,包括合成、结构、反应性质及催化性能等。
其中金属包括硼、硅、砷等类金属。
严格区分:有机金属化合物 M -C金属有机化合物 M -O ,M -N ,M -C金属有机化学是无机化学和有机化学的交叉学科,既可以归属于无机化学,也可以归属于有机化学。
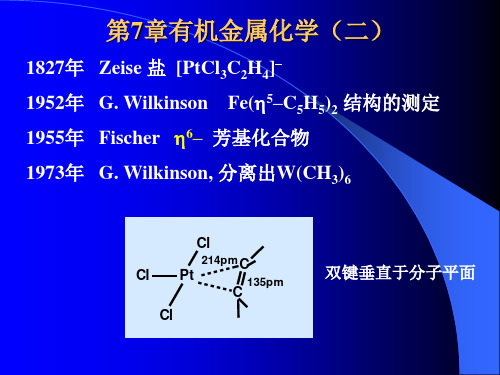
2. 发展史1760年 合成第一个金属有机化合物1827年 合成第一个过渡金属有机化合物(第一个含烯烃的金属有机化合物)Zeise’s 盐,Na[Pt(C 2H 4)Cl 3]1849年 E. Frankland 用氢气作保护气体3C 2H 5I + 3Zn → (C 2H 5)2Zn + C 2H 5ZnI + ZnI 21890年 第一个有工业应用价值的金属有机化合物Ni(CO)4,可用于提纯金属镍。
1901年 格氏试剂的发现,V . Grignard (1912年诺贝尔奖)RX + Mg → RMgX1919年 H. Hein, CrCl 3 + PhMgBr → Ph 2Cr1925年 Fischer-Tropsch 反应的发现,其机理的研究目前仍然是金属有机化学的一个重要研究领域,可能是先生成M -C 或者M =C 。
1938年 O.Roelen 发现氢甲酰化反应(Hydroformylation, oxo process)。
PdCl 2催化乙烯水合生成乙醛。
1938~1945年 Reppe 合成的发展CO + H 2 + CH 2=CH 2 → CH 3CH 2CHO1951年 二茂铁的发现 FeCl 2 + C 5H 5- → Fe(C 5H 5)2,导致烯烃-金属π络合物理论的提出。
1953年 Wittig 反应的发现,利用膦叶立德合成烯烃的方法1955年 Ziegler-Natta 催化剂的发现 MCl 3/AlR 3催化烯烃低压聚合 "Cadet's fuming liquid" [(CH 3)2A s]2O A s 2O 3 + 4CH 3COOK1956年H. C. Brown 硼氢化反应的发现,符合反马可夫尼可夫原则,R 2B 接在最少取代的碳原子上。
《金属有机化学》ppt课件

生物成像技术中应用
2024/1/26
金属有机荧光成像剂
利用金属有机化合物的荧光性质,设计合成具有高亮度、 高稳定性的荧光成像剂,用于生物体内荧光成像。
金属有机核磁共振成像剂
将具有顺磁性的金属有机化合物作为核磁共振成像剂,提 高成像的分辨率和对比度。
金属有机光声成像剂
利用金属有机化合物的光声性质,设计合成具有高吸收系 数和高光热转换效率的光声成像剂,用于生物体内光声成 像。
定义
金属有机化学是研究金属与有机 化合物之间相互作用、反应机理 以及合成应用的一门学科。
发展历程
自19世纪末发现金属有机化合物 以来,金属有机化学经历了漫长 的发展历程,逐渐发展成为一个 独立的学科领域。
4
研究领域及意义
研究领域
金属有机化学的研究领域广泛,包括 金属有机化合物的合成、结构、性质 、反应机理以及应用等方面。
意义
金属有机化学在有机合成、催化、材 料科学、生物医药等领域具有广泛的 应用价值,对推动化学学科的发展具 有重要意义。
2024/1/26
5
与其他学科关系
与无机化学的关系
金属有机化学与无机化学密 切相关,金属有机化合物中 的金属元素通常来自无机化 学领域。
与有机化学的关系
金属有机化学是有机化学的 一个重要分支,研究金属与 有机化合物之间的相互作用 和反应。
实例分析
烯烃的氢化反应中,金属有机催化剂如铂、钯等通过与烯烃形成配位键,降低 反应活化能,促进氢气的加成。
2024/1/26
16
多相催化作用原理及实例分析
多相催化作用原理
催化剂与反应物处于不同相态的催化反应,通常涉及固体催化剂与气体或液体反 应物之间的相互作用。
《金属有机化学》作业参考答案

《金属有机化学》作业参考答案一选择题1、B;2、C;3、B;4、D;5、A;6、A;7、C;8、A;9、C;10、D;11、A;12、D;13、A;14、C;15、A;16、A;17、C;18、B;19、A;20、A;21、B;22、C;23、D;24、B;25、D;26、A;27、A;28、A;29、D;30、A.31、A;32、B;33、A;34、B;35、B; 36、D;37、A;38、A;39、A;40、B;41、D;42、C 43、C 44、A 45、D 46、A 47、D二填空题1.金属;2.聚氯乙烯稳定剂;3.双键; 4.L=(12-n)/2; 5.四腿琴凳式; 6.非键电子;7.茂; 8.聚硅氧烷; 9.光照;10.环戊二烯基钠;11.配体取代法; 12.酰基;13.活性空位; 14.2电子配体; 15.金属一金属键.; 16.d—p一dπ键; 17.福州模型;18.Dewar-Chatt-Duncanson模型; 19.π给予体簇合物;20.金属羰基原子簇; 21.d—p一dπ键;22.歧化反应。
23、有机化学无机化学24、M—C 过渡金属有机化合物非过渡(主族)金属有机化合物25、离子型化合物σ键合的化合物非经典键合的化合物26、RM R2M27、过渡金属环戊二烯基28、Grignard29、离子键化合物、共价键化合物、缺电子化合物30、有机化学无机化学31、金属-碳( M-C )键32、过渡金属环戊二烯基33、σ-π配键34、Ziegler Natta35、MR2 RMX直线36、Grignard 试剂三简答题1.韦德规则的要点:(1)硼烷和碳硼烷呈三角面多面体构型;(2)由多面体顶点全占据是封闭型;空一个顶点的是巢穴型;空两个顶点是网兜型;(3)每一个骨架B有一个H(或其它单键配体)端基连结在它上面,一对电子定域在上面,剩余的b对电子是骨架成键电子;(4)每一个B提供三个原子轨道(AO)给骨架成键,多面体的对称性由这些AO产生的(M+1)个骨架成键分子轨道(MO)决定(M是多面体顶点),即:因此,算出任一硼烷的成键MO数就能知道它的对称性,而成键MO数=骨架成键电子对数b。
金属有机化学2

CH2CH3
CH2CH3
BR3和一氧化碳反应可以在 和一氧化碳反应可以在B-R间插入 : 间插入CO: 间插入
BR3 + CO δ− R2B R R2B C O R RB O CR2 O BCR3 δ+ C O
Al: :
有机铝化合物的反应中,最重要的是与烯烃的反应。 有机铝化合物的反应中,最重要的是与烯烃的反应。主 要发生烯烃插入Al-H和Al-C键的反应: 键的反应: 要发生烯烃插入 和 键的反应
C
C
H
R
C
C
O
有机硼化合物加热后会异构化,在有机合成中可利用: 有机硼化合物加热后会异构化,在有机合成中可利用:
H B
B [O] [O]
B
OH OH
用手性二烷基硼作试剂与烯烃反应,可得到高光学纯度的醇: 用手性二烷基硼作试剂与烯烃反应,可得到高光学纯度的醇:
CH3 CH3CH CHCH3 + R*2BH R*2B C* H HO CH3 C* H
三、主族元素的有机金属化合物
主族金属有机化合物根据其金属-碳键的性质, 主族金属有机化合物根据其金属 碳键的性质,可以分为 碳键的性质 以下几类: 以下几类: 1)离子键 化合物:碱金属 ) 化合物: 2)共价键化合物:IIIA、IVA、VA、VIA族等金属 )共价键化合物: 、 、 、 族等金属 3)形成缺电子化合物:Li、Be、Mg、B、Al等 )形成缺电子化合物: 、 、 、 、 等 4)IIB族元素 、Cd、Hg的化合物一般也看作主族有机金 ) 族元素 族元素Zn、 、 的化合物一般也看作主族有机金 属化合物。 属化合物。
2) 稳定性与反应性 与其它有机化合物的稳定性一样, 与其它有机化合物的稳定性一样,金属有机化合物的 稳定性和反应性之间并无直接关系, 稳定性和反应性之间并无直接关系, 需视反应类型及反应条 件和不同的溶剂体系等各种因素而定. 件和不同的溶剂体系等各种因素而定 但一般规则仍然是稳定性越小,反应性越大; 但一般规则仍然是稳定性越小,反应性越大;稳定性 越大,则反应性越小。 越大,则反应性越小。而金属有机化合物的反应性与金属 原子的氧化态、配位数以及几何构型密切相关。 原子的氧化态、配位数以及几何构型密切相关。
金属有机化学2过渡金属络合物的性质
化合物
CH2=CH2 K[Pt(CH2=CH2)Cl3] [Pt(CH2=CH2)Cl2]2 反式[Pt(C2H4)(NH3)Cl2] 反式[Pt(C2H4)(NH3)Br2] [Pd(C2H4)Cl2]2 K[Pd(C2H4)Cl3] [Ag(C2H4)]+ [(C2H4)Mn(CO)3]+AlCl4[(C2H4)Fe(C5H5)(CO)2]+ [(C2H4)Mo(C5H5)(CO)3]+ [(C2H4)W(C5H5)(CO)3]+
很早以前,N.V.Sidgwick提出了一个经验规则: 稳定的过渡金属有机络合物中,金属的电子数与配位体提供的 电子数总和与本周期中的惰性气体的电子数相同。 例如: Ni(CO)4
Ni 原子序数 28,外围28个电子。 4 个CO 2×4=8 个电子 EAN=36,与惰性气体Kr的电子构型相同。 [Ag(NH3)4]+ Ag 原子序数 47,外围46个电子。 4 个NH3 2×4=8 个电子 EAN=54,与惰性气体Xe的电子构型相同。
这种成键的结果,使烯烃的π轨道中电子云密度 降低,而烯烃的反键轨道π*中电子云密度增加, 意味着烯烃键的削弱,或活化。这可从键长数据 看出,正常的C-C双键键长为1.34Å ,而在烯烃 的过渡金属络合物中,烯烃的键长为1.40-1.47 Å ,说明此双键已具有某些单键的性质,即被活 化了。
烯烃-过渡金属络合物红外光谱数据
M
CO
❖ 实验表明这些络合物C-O键比CO中的C-O键长,红外光谱伸 缩振动频率变小,说明被配位的CO中C-O键被削弱,M-C键 键长要比正常单键短。
V(CO)6- Cr(CO)6 Mn(CO)6+ Fe(CO)5
IR(cm-1)
金属有机化学课件(带目录)

金属有机化学课件一、引言金属有机化学是研究金属与有机物之间的化学键、反应和应用的学科。
它是现代化学的一个重要分支,涉及有机化学、无机化学和物理化学等多个领域。
金属有机化学的研究不仅可以丰富化学的理论体系,还可以为材料科学、催化科学、生命科学等领域提供重要的理论支持和实践应用。
本课件旨在介绍金属有机化学的基本概念、重要反应和应用领域,以帮助学生更好地理解和掌握这一学科。
二、金属有机化学的基本概念1.金属有机化合物金属有机化合物是由金属原子与有机基团通过共价键连接而成的化合物。
金属原子通常与碳、氮、氧、硫等非金属原子形成配位键,形成金属有机配合物。
金属有机化合物具有独特的化学性质和广泛的应用领域。
2.配位键配位键是指金属原子与有机基团之间的共价键。
在金属有机化合物中,金属原子通常提供一个或多个空轨道,而有机基团提供一个或多个孤对电子,它们之间通过共价键相连。
配位键的形成使金属原子能够与多种有机基团形成稳定的化合物。
3.配合物配合物是由中心金属原子和周围的配体通过配位键连接而成的化合物。
配合物通常具有确定的结构和独特的性质,如催化活性、光学活性等。
配合物在材料科学、催化科学和生命科学等领域具有重要应用。
三、金属有机化学的重要反应1.均相催化反应均相催化反应是指在金属有机化合物催化下,反应物和催化剂处于同一相(液相或气相)的催化反应。
均相催化反应具有高效、选择性好和反应条件温和等优点,广泛应用于有机合成、石油化工和环境保护等领域。
2.配位聚合反应配位聚合反应是指在金属有机化合物催化下,通过配位键的形成将单体连接成高分子聚合物的反应。
配位聚合反应具有活性高、选择性可控和产物性能优异等特点,是合成高性能高分子材料的重要方法。
3.金属有机化合物的合成反应金属有机化合物的合成反应包括有机配体的合成、金属有机化合物的合成和金属有机配合物的合成等。
这些合成反应通常涉及有机合成、无机合成和物理方法等多种技术手段,需要根据目标产物的结构和性质进行合理设计。
第五章_金属有机化学-2

5.6 过渡金属有机化合物的基元反应
过渡金属有机化合物的化学性质非常复杂,但随着 人们认识的不断深化,已将众多的过渡金属有机配合物 的化学性质归纳为若干基元反应,它们也构成了配位催 化反应机理的基本框架。按照它们反应的类别,可以分 为若干个基元反应。
30
过渡金属有机化合物的基元反应
25
b) 金属相同 1. R(Et)-M < Me-M < Ph-M < CF3-M
2. 烷 基 - 金 属 配 合 物 中 , 不 同 烷 基 其 稳 定 性 不 同 : 伯碳> 仲碳> 叔碳;
3. 对称性好的金属有机化合物稳定性大于对称性差的金属 有机化合物。 4. 金 属 - 碳 键 中 碳 的 电 负 性 越 强 , 如 杂 化 轨 道 中 S 成 分 越 多 或 碳 上 连 有 提 高 碳 的 电 负 性 的 基 团 , M-C 键 的 稳定性就增加。
烯烃或炔烃可以通过插入金属与氢或金属与碳之间 的键中或取代某个配体而生成新的配位化合物。这是制
备金属-烷基化合物的重要方法之一。
(多两个碳原子)
M-X
+ C
C
M
C
C
X
X通常是H或烷基; M可以是所有的金属,特别是硼、铝、硅和过渡金属。
12
工业上制备烷基铝的主要方法:
Al + 3/2H2 + 3C2H4 Et3Al
N2 Cl
+
-
HgCl HgCl2
Cu
+
COCl
COMn(CO)5 NaMn(CO) 5
- CO
Mn(CO)5
+
20
6. 碳环键合
绝大多数四碳键合的配位体是用四碳键配位体如丁 二烯、 1,3- 环己二烯等与金属有机化合物直接反应,取
《金属有机化学》课件

展望:未来金属有 机化学将在更多领 域发挥重要作用, 如新能源、环保、 生物医药等。
金属有机化学面临的挑战与机遇
挑战:金属有机化学在合成、反应机理、结构分析等方面存在诸多挑战
机遇:金属有机化学在药物研发、材料科学、能源等领域具有广阔的应 用前景
挑战:金属有机化学在环境污染、生物毒性等方面存在潜在的风险
金属有机化合物在新能源 领域的应用研究
金属有机化学在药物合成 中的新进展
金属有机化学在材料科学 中的研究新突破
金属有机化学在理论计算 方面的新发展
金属有机化学的发展趋势与展望
研究方向:新型金 属有机化合物的合 成与性质研究
应用领域:药物化 学、材料科学、生 物技术等领域
研究热点:绿色化 学、生物催化、纳 米材料等
19世纪初,德国化学家Friedrich Wöhler首次合成了金属有机化合物
19世纪末,德国化学家Victor Grignard和法国化学家Paul Sabatier分别发现了Grignard试剂 和Sabatier试剂,为金属有机化学的发展奠定了基础
20世纪初,德国化学家Fritz Haber和Carl Bosch发明了Haber-Bosch过程,实现了大规模合 成氨,推动了金属有机化学的发展
机遇:金属有机化学在绿色化学、生物医学等领域具有重要的研究价值 和应用前景
感谢您的观看
汇报人:PPT
03
金属有机化合物的结构 与性质
金属有机化合物的结构特点
含有金属元素和碳 元素
金属原子与有机基 团通过共价键结合
结构多样,包括单 核、多核、环状等
性质复杂,包括化 学活性、热稳定性 、反应性等
金属有机化合物的物理性质
熔点:金属有机化合物的 熔点通常高于无机化合物
金属有机化学

1953-5年齐格勒(K.Ziegler)发现 TiCl4/Et3Al体系在低压催化乙烯聚合反应。 纳塔(G.Natta)将此体系用于丙烯或二 烯烃聚合催化剂,得到等规聚合物。他 们的工作开创了现代聚烯烃工业的新纪 元,同时有力地推动了金属有机化学的 发展。
宝库。现在人们称镁有机化合物为格林雅试 剂(Grignard Reagent)。镁有机化合物同有机 化合物的反应称为格林雅反应(Grignard Reaction)。为此,1912年他获得诺贝尔化学 奖。这是第一个获诺贝尔奖的金属有机化学 家。
1922年:T.Midgley T.A. Boyd Pd(C2H5)4作为汽 油中的抗震剂。
1891年:L.Mond和M.Berthelot,Fe(CO)5 的合成
Fe + CO 250。C 压
Fe(CO)5
1899年法国化学家巴比尔(P.Barbier)和格林雅 (V. Grignard)在研究锌有机化合物基础上, 发 现了镁有机化合物RMgX并将它用于有机合 成。由于他及以后百余年各国化学家的努力, 形成了用镁有机化合物进行有机合成的巨大
近50年以来,金属有机化学发展极为迅 速,已逐渐成为介于无机化学,有机化 学,结构化学,量子化学,催化科学, 物理有机,高分子化学,立体化学等学 科的内容广泛的边缘学科,成为当前化 学领域的最热门领域和最前沿学科。
1827年:丹麦化学家(药剂师)W.C.Zeise制得了 世界上第一个金属有机化合物,称之为Zeise盐。 当时人们不知道它是什么结构,后来才知道,这 是铂和乙烯的配合物K[Pt(CH2=CH2)Cl3]。这个化 合物长期以来未被人们注意。
金属有机化学 NO.2基元反应

(3) 烯烃的 C-H 键
OR
RuH2L4 + 2 H2C
CH3 COOR
27
28
PPh3
(H3C)2CHCOOR + L
OL Ru
CH3
29
LH H
30 (L = PPh3)
(4) 醛的 C-H 键
RH +
Rh(CO)ClL2 33
RhClL3 +L-L
RhClL2 31
RCHO
RRh(CO)(H)L2Cl
C M
C
Dewar-Chatt-Duncanson Model
表 1 一些烯烃─过渡金属络合物的红外光谱
化合物
CH2=CH2 K[Pt(CH2=CH2)Cl3] [Pt(CH2=CH2)Cl3]2 反式[Pt(C2H4)(NH3)Cl2] 反式[Pt(C2H2)(NH3)Br2] Pd[(C2H4)Cl2]2 K[[[[[A(((CCCC[2gP222H(dHHHC4(444C)2)))WHMFM2H4e()noC(4]C(()+2CCCH2HO2l53H)5])()55C(])C+(OCAO)Ol3)C]2)+]l3-++4
第二讲 基元反应
Elementary Reactions in Organometallic Chemistry
RX + Mg
RMgX
氧 化 加 成 (Oxidative addition)
RMgX +
R1
=O
R2
R1
R1 C
O
R MgX
插 入 反 应 ( Insertion )
非 机 理,乃 是 帮 助 理 解 及 预 测 反 应 产 物
有机合成中的金属有机化学

有机合成中的金属有机化学有机合成是一门研究将无机化合物和有机物相互反应得到新的有机化合物的科学。
而金属有机化学则是有机合成中的一个重要分支,它研究的是金属与有机物的反应机制及应用。
本文将介绍金属有机化学的基本概念、反应类型以及应用方面的研究进展。
一、金属有机化学的基本概念金属有机化学是研究金属与有机物之间形成配合物或者发生有机反应的化学学科。
金属有机化合物由一个或多个金属离子与一个或多个有机基团组成。
在金属有机化学中,金属离子通常承担了配位键的形成,而有机基团则负责提供电子给金属离子。
二、金属有机化学的反应类型1. 氧化加成反应:金属有机化合物可以通过与氧化剂发生氧化加成反应,生成新的有机化合物。
这种反应常见于有机合成中的还原剂或者氧化剂存在的情况下。
2. 过渡金属催化反应:许多金属离子催化的有机反应是有机合成中的重要方法。
过渡金属离子可以通过提供催化剂活化中间体或者参与反应机制中的电子转移来促进有机反应的进行。
3. 金属有机还原反应:金属有机化合物可以通过还原剂将其还原为金属或金属化合物。
这种反应常见于化学还原、电化学还原等领域。
4. 金属有机配位反应:金属有机化合物可以与配体发生配位反应,形成有机金属配合物。
这种反应常见于有机合成中的催化剂设计、催化剂活性的调节等方面。
三、金属有机化学的应用1. 有机合成:金属有机化学在有机合成中扮演着重要的角色。
通过利用金属有机化合物的催化性质,可以进行多种有机物的合成反应,如羰基化反应、氢化反应等。
2. 药物合成:金属有机化学在药物合成中也得到了广泛的应用。
许多药物合成过程中需要金属有机化合物作为催化剂,以促进关键步骤的进行。
3. 材料科学:金属有机化学在材料科学领域的应用也非常重要。
通过调节金属有机化合物的结构和性质,可以合成具有特定功能的材料,如催化剂、光学材料等。
4. 生物学研究:金属有机化学在生物学研究中也占据一席之地。
许多生物活性分子中含有金属离子,并且金属有机化合物也可以用于生物标记、生物成像等方面的研究。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
配位不饱和化合物的反应
许多配位不饱和化合物不像配位饱和的化合物那样 容易通过分离方法得到,往往是成为一种反应的活 性中间体短暂存在,一般只要一形成立刻又形成稳 定的配位饱和化合物,例如:
成物,降低了配位化合物的金属原子的电子密度(即电正性 增加了),这样导致金属和配体的络合强度。例如:
Fe(CO)5 + CF3COOH [HFe(CO)5]+ + C*O [HFe(C*O)(CO)4]+
[HFe(CO)5]+ + CF3COO[HFe(C*O)(CO)4]+ + CO Fe(C*O)(CO)4
k
MLn + L'
MLnL'
[MLnL'] k=
[MLn] [L']
配体的配位和解离的意义
从络合常数 k 来看,k 越大,即配位饱和的化 合物越稳定,难以发生配体的解离情况;如果 k 太小,则此配位化合物不稳定,容易解离成 相应的配体。
[MLnL'] k=
[MLn] [L']
容易形成配位饱和的金属有机化合物在化学 意义上就容易得到并能够从混合物中得到分离;
2
O*C CO O
L CO
OC Mn C CH3
3
OC *CO O
L CO
O*C Mn C CH3
4
OC CO O
*CO
4
1
L
OC
CH3
Mn
OC
CO
2
CO
3
甲基和羰基处于顺式关系才能发生插入反应,有4种途径
如果甲基迁移到羰基上 则1:2:4=1:2:1
L CO
OC Mn *C CH3
1
OC CO O
如果A、B是烷基或芳基时,还原消除反应实际 上就是偶联反应,其中有一个氢则发生氢化反应
R M
R'
R R' + M
(RCH2CH2)M(H)
RCH2CH3 + M
H
Ph3P
Cl
Ir
OC
PPh3
Cl*
- HCl
Ph3P
Cl*
Ir
OC
PPh3
用标记物进行产物分析,得知产物发生得还原消除 反应是顺式消除的。
CO
C*O
CO
OC
Ni CO
OC
CO
反位效应
Cl PPh3 Pd Ph3P X
X : Cl C 6H5 CH 3 H k : 1 30 200 10 4
由于金属和配体成键所用的轨道大多具有方向性,例如 d 轨道 的五个轨道通过线性组合成在空间上就有五个空间方向,当轨 道之间的夹角为零时相互作用最大,所以两个配体互为反式时, 它们之间通过成键轨道的相互作用最大。对于平面四边形配位 物中,配体的离解速率在很大程度上就取决于处于反式位上的 配体的性质,而顺式位置上的配体对其离解速率几乎没有影响。
插入和反插入
插入和反插入是对应的方向相反的反应,即一个不饱 和配体插入到邻近的金属和其他配体之间或者从金属 和配体之间抽出一个不饱和配体,典型通式为:
XMY
L
MXY
分子内插入,空出一个配位
LMXY
X+ L M Y
分子间插入
LMXY
典型的插入反应就是羰基的插入:
R LnM
CO
R LnM
CO
O LnM C R
从反应的结果看,配位化合物中的金属的配位数和 氧化态都发生了变化,氧化态的增加相当于发生了 氧化反应,配体的增加就相当于发生了加成反应。
氧化加成反应的要求
⑴配位化合物中的金属不能达到最高氧化态,否则就不 可能有氧化反应的发生
⑵配体对应的中心原子必须具备有空的配位位置,也就 是配位数不饱和
⑶按照18-16电子规则,加上上面两点,一般有空的 d
OC
CH3
Ni
OC
CO
O OC
Ni C CH3 OC
R LnM
CO
R LnM
CO
O LnM C R
R LnM
CO
O LnM C R
从反应机理和实验结果证实,此反应相当于烷基的迁移
*CO CO L
OC Mn CH3
OC CO
L CO
OC Mn *C CH3
1
OC CO O
L CO
OC Mn C CH3
PPh3
PPh3
DOC Ni COD OPh
酯基上烷氧和酰氧加成
O
MLn
O
O
R C O R'
R C O M R' + R C O M OR'
O CH3COCH2CH CH2 + Ni(COD)2
Ni
+ Ni(OAc)2 + 2COD
O C2H5C O Ph + Ni(COD)2
PR3
O
C2H5C O Ni OPh
②亲电性:HX、X2、RX、RCOOH、ArX、RCOX、RCN、 SnCl2等;
③化学物质加成后,试剂本身并不发生任何分子内 的任何变化,如O2、CS2、SO2、RCH=CHR
金属与H2的氧化加成
金属与H2的氧化加成是一个协同作用,H—H键断 裂的同时产生M—H键,加成是以顺式方式进行:
H
MnLn + H2
O
Pd
RCX
O R C Pd X
O R C Pd X
CO R Pd X
CO R Pd X
Pd + CO + RX
烯烃的插入
R+
R
MLn
LnM
H R CH LnM C H
H
R CH2 CH2 MLn
-夺氢反应
H
H CHR
LnM
CHR2
H LnM
H CR CHR2
H
H CR
LnM
CR2
H LnM
H CR CHR2
-CH3CH2R
H Ln-1M
CHR CH2
-消除的反应过程
配体和外来试剂的反应
此类基元反应指的对象不是金属和配体之间的关系, 而是配体由于各自具有不同的性质(例如亲核性质 等),由于这些配体与金属进行配位后,本身的电 子密度发生了改变,如果烯烃是CO、烯和芳烃等, 则容易被亲核试剂进攻而发生类似与插入或加成反 应。
5-C5Me5)2Ir(PPh3)(H2) + C(CH3)3
5-C5Me5)2Ir(PPh3)(CH2CMe3)H
OPh + Ni(COD)2
PPh3
COD: 1,3-cyclooctadiene
OPh
Ni
+ 2 COD
PPh3
OPh + Ni(COD)2
PPh3
OPh
Ni
+ 2 COD
采用反式加成提高中心金属与卤代烃两个不同配体的 成键程度,至于构型反转尚不能完全证实。
Ph3P
CO
CH3I
Ir
Cl
PPh3
Ph3P I CO Ir
Cl CH3PPh3
还原消除反应
相当于氧化加成反应的逆反应: 通式: M[n+2](A)(B) →M[n] + A—B
消去的两个配体从理论上讲必须是在金属配位化合 物上是体现顺式关系,这样才有利于消除,如果是 反式的对应两个配体发生消除反应,必须进行构型 变化成为有顺式关系才能进行消除反应
M R + R' H
R' H MR
M R' + R H
(5-C5H5)2TaH + ArD Fe(dmpe)2 + PhCHO
(5-C5H5)2TaD+ ArH
H (dmpe)2 Fe
COPh
烷烃的C—H键氧化加成
5-C5Me5)2LuCH3 + *CH4
5-C5Me5)2Lu*CH3 + CH4
容易发生配体解离的金属有机化合物则可以 利用此性质来生成不饱和的配位化合物来进行 有关化学反应。
配体的解离
18电子的配位化合物,发生配体解离,失去一个配 体形成16电子的配位化合物,留下一个配位空位给 新的配体准备新的配位反应。
RCOCo(CO)4
18电子/ Co: 3d74s2
(PPh3)3Ir(CO)(BF3)Cl
单电子氧化加成反应
2 MnLn + A—B 2 MnLn + A—B
LnMn+1Ln(A) + LnMn+1Ln(B) (A)LnMn+1—Mn+1Ln (B)
此类反应比较少见
用于氧化加成的化学物质
作为与金属有机化合物进行氧化加成反应的化学物质, 可以分类为:
①极性和非极性:H2、RH、ArH、RCHO、R3SiH、 R3SnH等;
氧化加成反应
这种反应最早在1959年被Vaska利用配位 不饱和的Ir(I)络合物 IrCl(CO)(PPh3)2 和许多反应物进行氧化反应所发现
L OO Ir
OC X L
L HgCXl Ir
OC Cl L
L R3SHi Ir
OC X L
O2 R3SiH
HgCl2
L
X
Ir
OC
L
H2 CH3I
L HH Ir
d 8 构型配位与离解时的构型变化
对有d 8 构型的过渡金属有机化合物的研究表明,它
