化学竞赛-碱金属与碱土金属
无机化学-碱金属与碱土金属元素单质的制备与性质

Fe盐的催化剂
2M(s) 2NH3(l) 2M 2NH2 H2 (g)
溶剂合电子
18
M- : alkalide; Na- : sodide
钠阴离子
en = ethylenediamine 2 Na (s) + en Na+(en) + Na-(en) NaK(l) + en K+(en) + Na-(en)
10
1. 与水的反应
Akali metal: 2 M(s) + 2 H2O (l) = 2 M+(aq) + 2OH-(aq) + H2(g) Akaline earth metal: M(s) + 2H2O (l) = M2+(aq) + 2OH-(aq) + H2(g)
Li
Na
K
应用:金属钠与
16
碱土金属的反应性
碱土金属活泼性略差,室温下这些金属
镁
表面缓慢生成氧化膜。它们在空气中
与
加热发生反应,生成氧化物和少量氮
二
化物(如:Ca3N2、Mg3N2)。
氧 化
因此在金属熔炼中常用Li、Ca等除去
碳
溶解在熔融金属中的氮气和氧气,在电
反
子工业中常用Ba除去真空管中痕量氮
应
气和氧气,在高温时碱金属和碱土金属
2. DG 的大小则由 D r Gm= D r Hm-T D r Sm 决定. 其中熵变 一般对DG的贡献比较小, DG的大小主要由D r Hm来决 定. D r Hm则要由设计的 Born-Haber 循环来决定. 而循环 中的晶格能值的大小对整个反应能否进行及产物稳定性 关系重大.
3. 晶格能又正比于阴、阳离子电荷的乘积,反比于阴、阳 离子的距离. 这样就要求阴、阳离子具备一定的 “匹配 ” 条件,产生最好的能量效应. 此即所谓的“大-大,小小”规则.
碱金属和碱土金属

碱金属和碱土金属碱金属和碱土金属是元素周期表中的两个重要类别。
它们在化学性质、物理性质和应用方面有很多共同之处,但也有一些显著的差异。
本文将介绍碱金属和碱土金属的基本特点、重要性质及其在实际应用中的作用。
一、碱金属碱金属是周期表中位于第一族,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
这些元素都是非常活泼的金属,具有强烈的还原性。
它们在常温下存在于固态,是银白色的质地柔软金属,能轻松被切割,并且具有低密度和低熔点。
碱金属具有以下一些重要性质:1. 高反应性:碱金属在常温下与水反应产生大量的氢气和碱溶液,释放出巨大的热量。
这种反应非常剧烈,有时可以引起爆炸。
例如,钠在与水接触时会迅速产生白色火焰和剧烈的燃烧。
因此,碱金属的处理需要极高的小心和专业知识。
2. 高电离能:碱金属的外层电子非常容易被剥离,因此具有很低的电离能。
这使得它们可以很容易地丧失电子形成阳离子,并与其他元素形成化合物。
3. 强烈的还原性:碱金属是非常强大的还原剂,能够夺取其他元素的电子,并参与许多重要反应。
例如,钾在与氧气反应时会猛烈燃烧,产生明亮的火焰。
4. 高热导率:碱金属具有极高的热导率,这使得它们在冷却和传热技术方面非常有用。
铯是所有金属中热导率最高的元素。
碱金属在许多领域具有广泛应用。
它们可用于制造合金、金属薄膜、电池、催化剂等。
其中最常见的应用是用作发光剂和制备碱金属离子的闪烁屏幕。
此外,碱金属离子在生物医学领域中也具有重要应用,例如在MRI(核磁共振成像)中作为对比剂。
二、碱土金属碱土金属是元素周期表中位于第二族,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
与碱金属相比,碱土金属的化学性质相对较为稳定,但仍然具有明显的金属性质。
它们在常温下也是固态,但与碱金属不同的是,碱土金属较硬和坚硬。
碱土金属具有以下一些重要性质:1. 抗氧化性:碱土金属相对于碱金属来说较为惰性,不容易与空气中的氧气发生反应。
碱金属和碱土金属习题目录

第17章碱金属和碱土金属习题目录一判断题;二选择题;三填空题;四完成反应方程式;五计算和解释一判断题1 重水是由H和18O组成的水。
()2 氢在自然界中主要以单质形式存在。
()3 由于H2是双原子分子,所以H2比He的扩散速率小。
()4 氢气是最轻的单质,所以它的熔点和沸点在所有单质中最低。
()5 因为氢分子的极化率大于氦分子的极化率,所以氢的熔点比氦高。
()6 常温下H2的化学性质不很活泼,其原因之一是H-H键键能较大。
()7 在HMn(CO)5中,H原子与Mn原子以Mn-H键相结合。
()8 在H[Cr(CO)5]2分子中存在着Cr-H-Cr氢桥键。
()。
9 如果某氢化物的水溶液为碱性,则此氢化物必为离子型氢化物。
()10 碱金属氢化物都具有NaCl型晶体结构。
()11 H-在水溶液中不能存在。
()12 通常,s区元素只有一种稳定的氧化态。
()13 由于s区、p区元素性质活泼,它们都不能以单质的形式存在于自然界。
()14 s区元素在自然界不以单质形式存在。
()15 金属钙保存在煤油中。
()16 由于s区元素单质的密度很小,它们都可以浸在煤油中保存。
()17 碱金属熔点的高低次序为Li>Na>K>Rb>Cs。
()18 碱土金属的E(M2+/M)从Be到Ba依次变大。
()19 N2只能与碱土金属直接作用形成氮化物。
()20 在周期表中,处于对角线位置的元素性质相似,这称为对角线规则。
()21 所有碱金属和碱土金属都能形成稳定的过氧化物。
()22 s区元素形成的化合物大多是离子型化合物。
()23 由于E(Li+/Li)最小,所以锂是金属性最强的元素。
()24 碱土金属氢化物的熔点比同周期碱金属的氢化物熔点高。
()25 碱金属的所有盐类都是无色的。
()26 钠的所有盐全部可溶于水。
()27 所有碱金属的碳酸盐都是易溶于水的。
()28 碱金属的盐类都是可溶性的。
()29 碱金属的氢氧化物皆具有强碱性。
碱金属与碱土金属的区别

碱金属与碱土金属的区别碱金属和碱土金属是化学元素周期表中两个重要的元素家族。
它们在物理性质、化学性质以及在自然界中的分布等方面存在着显著的区别。
本文将详细探讨碱金属和碱土金属的区别。
一、物理性质的区别1. 密度和硬度:碱金属的密度和硬度较低,比较轻盈,容易被切割和压制成各种形状。
而碱土金属的密度和硬度相对较高,比碱金属更坚硬且具有更高的密度。
2. 熔点和沸点:碱金属具有相对较低的熔点和沸点,例如钾的熔点为63.38℃,锂的熔点为180.54℃。
而碱土金属的熔点和沸点相对较高,例如镁的熔点为649℃,钙的熔点为842℃。
3. 导电性:碱金属具有很高的导电性,可以很容易地导电。
碱土金属也具有良好的导电性,但相对于碱金属来说稍逊一筹。
二、化学性质的区别1. 与水反应:碱金属具有与水剧烈反应的性质,生成碱性氢氧化物和氢气。
例如,钠与水反应产生氢气并生成氢氧化钠。
而碱土金属与水反应较为缓慢,生成相应的碱土金属氢氧化物和氢气。
例如,钙与水反应生成氢气并生成氢氧化钙。
2. 氧化性:碱金属具有较强的氧化性,容易损失电子形成正离子。
碱土金属也具有一定的氧化性,但相对于碱金属来说较低。
3. 化合价:碱金属的化合价多为+1,例如钠的氧化状态为+1。
而碱土金属的化合价多为+2,例如镁的氧化状态为+2。
三、自然界中的分布1. 碱金属在自然界中相对较为稀少,主要以盐湖和海水中的含量较高。
其中,氯化钠是最常见的碱金属盐。
2. 碱土金属在自然界中相对较为丰富,分布广泛。
例如,镁和钙广泛存在于岩石、矿石和土壤中。
四、应用领域的区别1. 碱金属应用:碱金属广泛应用于多个领域,包括电池、合金制备、烟火制造、钢铁生产等。
钾化合物还用于肥料的制造。
2. 碱土金属应用:碱土金属在建筑材料、医学、农业等领域中有着重要的应用。
例如,镁合金用于航空和汽车制造,钙化合物可用作水泥生产中的添加剂。
结论总的来说,碱金属和碱土金属在物理性质、化学性质、自然界分布以及应用领域等方面存在显著的区别。
碱金属和碱土金属实验报告

碱金属和碱土金属实验报告本次实验是针对碱金属和碱土金属进行的,在实验中大家通过与这些金属进行反应来了解它们的性质和特点。
本文将从实验前后的准备工作、实验过程、实验结果以及结论四个方面为大家详细介绍这次实验。
实验前准备工作在进行实验前,我们需要对相关知识进行学习,并仔细阅读实验指导书,了解实验原理和步骤,同时进行必要的安全措施,如佩戴手套、护目镜等。
此外,我们还需要准备实验所需的实验器材和试剂,以便进行实验。
实验过程在实验过程中,我们首先进行了碱金属的实验。
我们在实验室里将钾直接投入水中,因为钾与水中的氧气发生反应,会爆炸,所以我们必须将其一个一个的丢入水中,以降低反应的速率,避免产生危险。
在实验中,我们发现钾与水剧烈反应,放出大量氢气,同时燃烧剧烈,并形成碱性溶液。
这充分说明了钾金属的强还原性和活泼性。
接着,我们进行了碱土金属的实验,实验中我们选取了镁、钙、锶、钡等金属作为实验对象。
首先,我们将相应的金属样品分别夹在钳子里,然后点燃它们,这时候,这些金属都会剧烈燃烧,放出许多亮光和热。
这是因为当金属燃烧时,会与空气中的氧气发生化学反应,形成金属氧化物。
此外,镁和钙的燃烧反应十分强烈,而锶和钡的燃烧反应却较为温和,这与其化学性质有关。
实验结果通过实验,我们获得了相关数据和结果。
我们发现钾与水反应时会产生大量的氢气,同时产物为钾氢氧化物、氢氧化钾等。
碱土金属的燃烧反应产生的产物为金属氧化物和氧气。
此外,我们还在实验中观察到了不同金属产生的火焰颜色不同,这是由于各种元素所产生的光谱线的不同。
结论通过这次实验,我们可以得出如下结论。
首先,碱金属具有强还原性和活泼性,能够与水反应并放出大量的氢气;碱土金属一般情况下较为稳定,但在受到热或溶液作用的情况下会燃烧产生光和热;不同金属的燃烧反应产生的产物也不尽相同。
此外,我们还发现不同金属在燃烧反应中所产生的火焰颜色不同,可以用来识别其元素种类。
总之,这次实验对我们了解碱金属和碱土金属的性质和特点有了更加深入和全面的认识,同时也加强了我们对实验安全和操作规范方面的意识。
碱金属碱土金属课件

碱金属和碱土金属的化合物在药物合成中具有重要作用,如锂盐在抑郁症治疗中的应用。
医学成像
某些碱金属和碱土金属的放射性同位素可用作医学成像的示踪剂,如氟-18在正电子发 射断层扫描中的应用。
钾
总结词
中等活跃的碱金属元素
详细描述
钾是碱金属元素中的一种,原子序数为19,原子量为39.098。在标准条件下, 钾是银白色的金属,具有较高的熔点和沸点,与水反应剧烈。
铷
总结词
较为活泼的碱金属元素
详细描述
铷是碱金属元素中的一种,原子序数为37,原子量为85.4678。在标准条件下,铷是银白色的金属, 具有较低的熔点和沸点,与水反应非常剧烈。
碱金属在常温下呈液态的有锂、钠、钾,呈固态的有铯; 碱土金属在常温下都是固态。
熔点与沸点
碱金属的熔点较低,其中钠、钾的熔点在300℃ 01 以下,锂的熔点略高于钠、钾。
碱土金属的熔点较高,如铍、镁、钙的熔点均在 02 1000℃以上。
碱金属的沸点较低,如钠、钾的沸点在800℃左 03 右;而碱土金属的沸点较高,如钙的沸点为
与空气的反 应
碱金属与空气的反 应
碱金属元素暴露在空气中易被氧化, 如钠在空气中会逐渐氧化成氧化钠或 过氧化钠。
碱土金属与空气的反 应
碱土金属元素在空气中也容易被氧化, 如镁在空气中会逐渐氧化成氧化镁。
碱金属和碱土金属的物理性 质
颜色与状态
碱金属单质通常是银白色金属,但铯略带金色;碱土金 属单质则是银白色或灰色。
铯
总结词
最活泼的碱金属元素
详细描述
铯是碱金属元素中的一种,原子序数为55,原子量为 132.90547。在标准条件下,铯是银白色的金属,具有最低 的熔点和沸点,极易与水和氧气反应,甚至在空气中就可以 自燃。
化学竞赛-碱金属与碱土金属

天青石 碳酸锶
重晶石 碳酸钡
锂辉石 LiAlSi2O6 钠长石 NaAlSi3O8 硝石 NaNO3 钾长石 KAlSi3O8 光卤石 KCl· MgCl2 · 6H2O 芒硝 Na2SO4 泻盐 MgSO4 · 7H2O 方解石 CaCO3 石膏 CaSO4 · 2H2O 天青石 SrSO4 重晶石 BaSO4
通常碱土金属的超氧化物很不纯净!
简介:MO2是更加活泼的钾、铷、铯在空气中燃烧的产物,有色,KO2橙黄色, RbO2深棕色, CsO2深黄色
2、与空气中的氧、氮及其它非金属反应:
6M + N2 = 2M3N 3M + N2 = M3N2
镁在氧气中燃烧
SiO2 + Mg =Si + 2MgO TiCl4 + Na = Ti + 4NaCl
3、与化合物作用:
钠、镁、钙高温下能夺取氧或氯,在非水体系,如固相反应和有机体系中,做还原剂。
2NH3 + 2M = 2M(NH2) + H2↑
冷
热
453~473K
573~673K
点燃
Na2O2 + H2SO4==Na2SO4 + H2O2 BaO2 + H2SO4 ==BaSO4↓+ H2O2
实验室制备H2O2
Cr2O3难溶+ 3Na2O2 = 2Na2CrO4易溶+ Na2O
1
MnO + Na2O2 = Na2MnO4 用做分解矿石的熔剂
Li Be Na Mg K Ca Rb Sr Cs Ba
金属活泼性增加
金属活泼性增加
一是因为这些金属熔点高 二是因为氢氧化物溶解度小
碱金属和碱土金属实验报告(一)

碱金属和碱土金属实验报告(一)碱金属和碱土金属实验报告实验目的了解碱金属和碱土金属的性质,并研究它们的物理化学特性。
实验器材•碱金属:钠、钾、锂•碱土金属:镁、钙、锶、钡•水槽•火柴•盖玻片•磁力搅拌器实验步骤1.将每种金属放入盖玻片中,标记好。
2.分别在水槽中将金属放入水中,观察它们的反应现象。
3.在碱金属中选取一种,将其加入盛有酒精的烧杯中,点燃观察其反应。
4.在碱土金属中选取一种,将其加入盛有盐酸的烧杯中,加热观察其反应。
5.在碱土金属中选取一种,将其加入热水中,搅拌观察其反应。
实验结果1.碱金属在水中反应,放出氢气和放热现象;碱土金属在水中不易反应。
2.碱金属燃烧时产生黄色火苗,放出氧化物和放热现象。
3.碱土金属和酸反应,放出氢气和放热现象。
4.碱土金属与热水反应,放出氢气。
实验分析1.碱金属和碱土金属的化学性质不同,碱金属更易于反应,碱土金属更稳定;2.碱金属在空气中极易氧化,因此应保管在密闭条件下;3.碱金属和碱土金属与水反应后生成的氢气常常是很剧烈的,因此应该小心操作,以免引起安全事故。
实验结论通过对碱金属和碱土金属的实验观察和分析,得到以下结论: 1. 碱金属和碱土金属的物理性质和化学性质都有明显的差异; 2. 碱金属的反应性更强,碱土金属的稳定性更好; 3. 人们在使用这些金属时应该小心谨慎,遵循操作规程,以免引发安全事故。
实验思考1.在实验中,为什么不能直接将碱金属和碱土金属放入水中?答:因为碱金属和碱土金属与水反应剧烈,易产生爆炸,导致安全事故,所以实验中需要小心操作,将碱金属和碱土金属分别放入盖玻片中,再将盖玻片放入水中。
2.为什么要将碱金属与酒精反应,而不是直接将其点燃?答:因为碱金属可与空气中的氧气反应生成氧化物,极易燃烧,若将其直接点燃,可能引起不可承受之高温,甚至是爆炸。
所以为了安全起见,要将碱金属先与酒精反应,然后再点燃酒精,观察其反应。
3.为什么碱土金属与热水反应,放出氢气?答:碱土金属与热水反应,会发生置换反应,金属中的离子会与水中的氢氧根离子发生反应,放出氢气,同时生成金属氢氧化物。
碱金属与碱土金属题目

碱金属与碱土金属题目碱金属与碱土金属是化学中常见的两类金属元素。
碱金属包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和铍(Fr),它们位于元素周期表的第一组。
而碱土金属包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra),它们位于元素周期表的第二组。
这两类金属在性质、化学反应、应用等方面有一些共同之处,同时也有一些显著的差异。
首先,碱金属和碱土金属在物理性质上有一定的相似性。
例如,它们都具有较低的电离能和较大的原子半径,因此具有良好的金属导电性和导热性。
此外,它们的密度都相对较低,而且都具有良好的延展性和可塑性。
其次,碱金属和碱土金属在化学性质上也有一些共同点。
碱金属和碱土金属都具有较活泼的金属活性,容易与非金属元素发生反应。
它们与氧气的反应都是剧烈且放热的,形成相应的金属氧化物。
例如,钠与氧气反应生成氧化钠:2Na + O2 -> 2Na2O碱金属和碱土金属也能与酸进行反应,如与盐酸反应生成相应的金属盐和氢气。
另外,它们在水中的反应也有相似之处。
碱金属和碱土金属在水中的反应是剧烈的,生成氢气和相应的碱金属氢氧化物或碱土金属氢氧化物。
例如,钾与水反应生成氢气和氢氧化钾:2K + 2H2O -> 2KOH + H2碱金属和碱土金属还可以与其他金属发生反应,形成金属间化合物。
例如,钠与铜反应生成铜钠合金:2Na + Cu -> Na2Cu此外,碱金属和碱土金属在应用上也有一些相似之处。
由于它们的低密度、良好的导电性和导热性,碱金属和碱土金属在合金制备、电池制造、金属加工等方面有广泛的应用。
另外,碱金属和碱土金属的化合物也具有一定的应用价值。
例如,氢氧化钠是一种重要的化工原料,广泛应用于纸浆、纺织、石油等行业;氧化钙是建筑材料中常用的一种氧化剂;镁合金在航空、汽车等领域具有广泛应用。
综上所述,碱金属和碱土金属在物理性质、化学性质和应用上具有一定的相似性。
高中化学竞赛-碱金属和碱土金属

高中化学奥林匹克竞赛辅导碱金属和碱土金属一、s区元素简介碱金属包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)、钫(Fr,具有放射性)六种元素,位于元素周期表第ⅠA族。
由于钠、钾的氢氧化物是常见的碱,所以本族元素称为碱金属,碱金属元素价电子构型为n s1。
位于元素周期表第Ⅰ A族的铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)、镭(Ra,具有放射性) 称为碱土金属,是因为这些元素的性质介于碱金属和稀土元素之间。
碱土金属的价电子构型为n s2。
第Ⅰ A族和第Ⅰ A的元素同属于元素周期表中的s区。
在化学性质方面,碱金属、碱土金属的单质能与大多数非金属物质反应,如均极易在空气中燃烧。
除了Be、Mg外,都较易与水反应。
s区元素能形成稳定的氢氧化物,这些氢氧化物大多是强碱。
s区元素所形成的化合物大多是离子化合物。
Li和Be的离子半径小,极化作用较强,形成的化合物基本上是共价型的(LiF是离子型化合物),少数Mg的化合物也是共价型的。
在物理性质方面,s区元素单质的主要特点是:轻、软、低熔点。
密度最低的是锂(0.53g/cm3),是最轻的金属,即使密度最大的镭,其密度也小于5g/cm3。
碱金属、碱土金属的硬度除Be和Mg 外也很小,其中碱金属和钙、锶、钡可以用刀切。
二、碱金属元素1.碱金属简介碱金属晶体金属键较弱,熔沸点较低,硬度较小,用小刀即可切割。
由于碱金属阳离子半径较大(Li+除外),电荷低,碱金属阳离子的极化作用一般都比较小,形成的化合物主要是离子化合物。
Li+为2电子构型,半径远小于同族的其他阳离子,因此极化作用较大,锂的化合物具有一定程度的共价特征。
碱金属的性质化学活泼性。
本节将着重以Na和K为代表介绍碱金属的性质。
2.钠及其化合物钠的化学性质很活泼,和其他碱金属和碱土金属元素一样,它在自然界里不能以游离态存在,只能以化合态存在。
自然界中的含钠化合物有食盐(NaCl)、智利硝石(NaNO3)、纯碱(Na2CO3)、冰晶石(Na3AlF6)等。
无机化学-碱金属与碱土金属元素氧化物

6. 臭氧化物的制备
MOH + 2O3 MO3 + MOH H2O + ½ O2 (M = K, Rb, Cs)
M + O3 MO3 in Liquid N2 (M = K, Rb, Cs )
6
2.6.3 氧化物的化学性质
1. 与 H2O 的作用 (生成对应的碱):
稳定性: O2 O2 O22
臭氧化合物 (O3-)
1
碱金属的超氧化物
Rb9O2的结构
2
2.6.2 氧化物的制备
1. 碱金属在空气中燃烧时,只有锂生成普通氧化 物Li2O,钠生成过氧化物Na2O2,钾、铷、铯则 生成超氧化物MO2(M=K,Rb,Cs)。
2Na O2 Na 2O2 K O2 KO 2
熔矿时要使用铁或镍制坩埚,陶瓷、石英坩埚容易被腐蚀 熔融的Na2O2 与棉花、硫粉、铝粉等还原性物质反应爆炸
9
5. 过氧、超氧化物的热不稳定性
MO2 M2O2 + O2 M2O + O2
M2O2 M2O + O2
Li2O2 Li2O + O2
4 MO2 2 M2O + 3 O2
4 NaO2 2 Na2O + 3 O2
M(I)2O + H2O 2MOH2O M(OH)2 (BeO除外)
Na2O2 + 2H2O 2 NaOH + H2O2 BaO2 + 2H2O Ba(OH)2 + H2O2
用作氧化剂、 O2 漂白剂、氧气
发生剂
2KO2 + 2H2O 2 KOH + H2O2 + O2
碱金属和碱土金属

碱金属和碱土金属在化学元素周期表中,碱金属和碱土金属是两个重要的元素类别。
它们在自然界中广泛存在,具有独特的化学和物理性质。
本文将深入探讨碱金属和碱土金属的特点、用途以及对环境和人类健康的影响。
一、碱金属碱金属是指位于元素周期表第1A族的锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和铍(Fr)。
它们通常具有相似的特性,并且在自然界中以化合物形式存在。
碱金属的特点如下:1. 金属性质:碱金属是典型的金属元素,具有良好的导电性和导热性。
2. 电子配置:碱金属的电子配置以ns1的形式出现,其外层只有一个s电子,容易失去这个电子形成带正电荷的离子。
3. 低密度:碱金属的密度相对较低,从锂到铯依次递增。
4. 相对活泼:碱金属对水和空气中的氧气具有很高的反应性,它们能够与水反应产生氢气,并在空气中形成氧化物。
碱金属具有广泛的应用领域。
首先,钠和钾是人体必需的微量元素,对维持正常的生理功能至关重要。
其次,碱金属可以用于制备合金、导热材料、催化剂等。
此外,碱金属化合物还被广泛应用于玻璃工业、电池制造、化学实验等领域。
然而,碱金属也存在一些潜在的危害性。
例如,钠和钾金属与水反应时会放出大量的氢气,可能引发火灾。
此外,过量摄入碱金属离子对人体健康有害,可能导致水电解质平衡失调甚至中毒。
二、碱土金属碱土金属是周期表中第2A族的含钙(Ca)、镁(Mg)、锶(Sr)、钡(Ba)和镭(Ra)的元素。
与碱金属相比,碱土金属的化学性质略微稳定。
以下是碱土金属的主要特点:1. 金属性质:碱土金属也是典型的金属元素,具有较好的导电性和导热性。
2. 电子配置:碱土金属的电子配置为ns2,外层具有两个s电子。
3. 密度:碱土金属的密度相对较高,从镁到钡递增。
4. 反应性:碱土金属相对于碱金属来说较不活泼,但依然能与水和氧气反应,生成相应的化合物。
碱土金属也有广泛的应用。
首先,钙是人体骨骼和牙齿的主要成分之一,对维持骨骼健康至关重要。
碱金属与碱土金属

碱金属与碱土金属碱金属和碱土金属是元素周期表中的两个主要族群,它们具有一些共同的特性,也有一些明显的区别。
本文将详细介绍碱金属和碱土金属的性质以及它们在日常生活和科学领域中的应用。
一、碱金属的性质碱金属是元素周期表第一族的元素,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
它们都是银白色金属,在常温下具有较低的熔点和沸点,且具有较低的密度。
碱金属的金属性质非常活泼,容易与非金属元素反应,例如与水、氧气和卤素等。
这些反应通常都是剧烈的,产生大量的能量和气体。
碱金属的电子结构也具有一定的特点。
它们的原子外层只有一个电子,容易失去此电子形成阳离子。
这种电子结构使碱金属具有良好的导电性和导热性。
此外,碱金属的化合物主要是离子化合物,如氯化钠(NaCl)和氢氧化钾(KOH)等。
碱金属在日常生活中有许多应用。
钠是一种常用的食盐成分,它在食物中起到增强味道的作用。
钾在植物生长中起到重要的作用,是必需的营养元素之一。
锂离子电池是目前最常用的电池类型之一,广泛应用于手机、笔记本电脑等电子设备。
二、碱土金属的性质碱土金属是元素周期表第二族的元素,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
它们在常温下也是银白色金属,具有较高的密度和熔点。
与碱金属相比,碱土金属的反应性更低,但仍然活泼。
碱土金属的电子结构与碱金属类似,外层电子结构为ns2。
与碱金属类似,碱土金属也容易失去外层两个电子形成阳离子。
这种电子结构使得碱土金属具有良好的导电性。
与碱金属不同,碱土金属的氢氧化物和碳酸盐是碱性的。
例如,氢氧化钙(Ca(OH)2)是一种通常用于调节土壤酸碱度的物质。
碱土金属在许多领域中都有重要应用。
镁是一种重要的金属材料,广泛应用于航空、汽车和船舶制造。
钙是构成人体骨骼和牙齿的重要元素,对维持骨骼健康至关重要。
三、碱金属与碱土金属的区别1. 电子结构:碱金属和碱土金属的外层电子结构相似,都是ns1或ns2。
碱金属和碱土金属的性质比较

碱金属和碱土金属的性质比较碱金属和碱土金属都是周期表中位于左侧的元素,它们在化学性质上有一些共同之处,但也存在着一些显著差异。
本文将对碱金属和碱土金属的性质进行比较,展示它们各自的特点。
一、物理性质比较碱金属包括锂、钠、钾、铷、铯和钫,它们都具有较低的密度和较低的熔点。
在室温下,碱金属都是固态,但随着温度的升高,它们会迅速转化为液态。
碱金属具有银白色的外观,柔软易弯曲。
碱金属的导电性和热导率都非常好,是优秀的导体。
碱土金属包括铍、镁、钙、锶、钡和镭,它们的密度和熔点相对较高。
在室温下,碱土金属也都是固态。
和碱金属相比,碱土金属的硬度更高,但仍然具有金属的柔韧性。
碱土金属的导电性和热导率也很好,但稍逊于碱金属。
二、化学性质比较1. 反应性:碱金属和碱土金属都是非常活泼的金属,在空气中容易与氧气反应而氧化。
但碱金属的反应性更为强烈,它们常与空气中的水汽剧烈反应,产生氢气并形成氢氧化物。
2. 反应速率:碱金属的反应速率要比碱土金属快。
碱金属与水反应时放出大量的热量,并产生碱性溶液,这种反应在钠和钾上尤为明显。
碱土金属与水反应也能产生碱性溶液,但反应相对缓慢。
3. 氢氧化物:碱金属与碱土金属都能与水反应生成氢氧化物。
碱金属的氢氧化物溶解度较大,形成强碱性溶液,如氢氧化钠和氢氧化钾。
而碱土金属的氢氧化物溶解度较小,形成弱碱性溶液,如氢氧化钙和氢氧化镁。
4. 卤素反应:碱金属和碱土金属均能与卤素发生反应。
碱金属与卤素的反应剧烈,产生白色晶状盐,如氯化钠和溴化锂。
碱土金属与卤素的反应较为温和,产生白色晶体,如氯化钙和溴化镁。
5. 氧化性:碱金属的氧化性较强,它们能够与许多非金属元素反应,如与氧气反应产生氧化物。
碱土金属的氧化性较碱金属弱,但也具有氧化性,如镁能够与氧气反应生成氧化镁。
三、应用领域比较碱金属和碱土金属具有广泛的应用领域。
碱金属的主要应用包括制备合金、制取金属、制造化学品、生产玻璃和陶瓷等。
碱土金属的应用领域包括制备镁合金、制造火箭燃料、生产荧光体材料和医疗用途等。
无机化学-碱金属与碱土金属元素-盐类化合物
Байду номын сангаас
1-1或2-2型 1-2或2-1型 1-3或3-1型 2-3或3-2型
△Gøs界线kJ•mol-1 22.8
30.8
38.5
45.6
3
(2) 半定量规则:
晶格能
△sG
MX(s) M+(aq) + X- (aq)
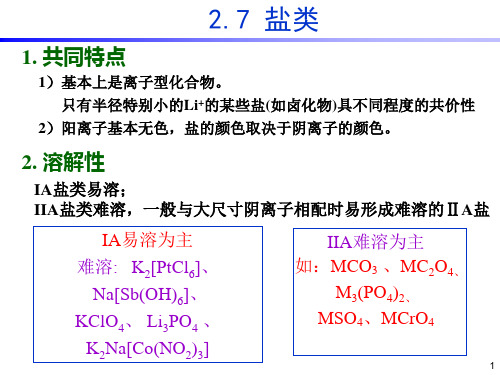
2.7 盐类
1. 共同特点
1)基本上是离子型化合物。 只有半径特别小的Li+的某些盐(如卤化物)具不同程度的共价性
2)阳离子基本无色,盐的颜色取决于阴离子的颜色。
2. 溶解性
IA盐类易溶; IIA盐类难溶,一般与大尺寸阴离子相配时易形成难溶的ⅡA盐
IA易溶为主
难溶: K2[PtCl6]、 Na[Sb(OH)6]、
2
离子晶体盐类溶解性的判断标准
(1) 溶解自由能变: MX(s) = M+(aq) + X- (aq) △sG
以溶解度0.01 mol L-1作为易溶和难溶的“界线”
MX(s) = Mn+(aq) + Xn-(aq) (n=1或2) KSP= [Mn+][Xn-] = (0.01)2 = 1×10-4 则:△Gøs = -RTlnKSP= 22.8 kJ mol-1
法。其基本原理: 先用NH3将食盐水饱和, 然后通入CO2,溶解
度较小的NaHCO3析出:
< 15 oC, 析出
NH3 + NaCl + H2O + CO2 NaHCO3 + NH4Cl
CaCO3 CaO + CO2 NH4Cl + CaO CaCl2 + NH3 + H2O
无机化学第12章--碱金属、碱土金属课件

150.5 109.5 91.5 86.1 79.9 520.1 495.7 418.6 402.9 375.6
△Hh(M)/kJ·mol-1 △H (M) /kJ·mol-1
-514.1 -413.8 -342.8 -321.9 -297.1 163.1 197.3 175.1 165.1 158
ф 0.25 Be(OH)2 0.18 Mg(OH)2 0.15 Ca(OH)2 0.13 Sr(OH)2 0.12 Ba(OH)2
碱金属氢氧化物均为碱性,Be(OH)2为两性, 其它碱土金属氢氧化物为碱性。
12 - 3 盐类 12 - 3 - 1 盐类的共同特点
重要盐类:卤化物、硝酸盐、硫酸盐、碳酸盐
自学指导(二)
1、作者运用哪几种方法去刻画人物的形象?从文 中找出具体句子进行分析。并说说你是如何看待这 两个人物的。 2、从这个故事中你懂得了什么道理?
陈尧咨(善射)
神态 忿然 笑而遣之
卖油翁(善酌)
睨之
语言 动作
汝亦知射乎 吾射不亦精乎 尔安敢轻吾射
笑而遣之
性格: 自矜(骄傲)
对比
无他,但手熟尔 以我酌油知之 我亦无他,惟手熟尔
氧化物热稳定性总的趋势是,同族从上到下依次降 低,熔点也按此顺序降低。
碱土金属离子半径较小,电荷高,其氧化物的晶格能 大,因而其熔点比碱金属氧化物的熔点高得多。
12 - 2 - 2 氢氧化物
1 氢氧化物性质
碱金属和碱土金属的氢氧化物都是白色固体。 Be(OH)2为两性氢氧化物,LiOH和Be(OH)2为中强 碱,其余氢氧化物都是强碱。 碱金属的氢氧化物都易溶于水,在空气中很容易吸潮, 它们溶解于水时放出大量的热。除氢氧化锂的溶解度稍 小外,其余的碱金属氢氧化物在常温下可以形成很浓的 溶液。
◆高中化学竞赛 无机化学课件(s区+B族)

§12.4 碱金属和碱土金属的化合物
12.4.1 氢化物 12.4.2 氧化物 12.4.3 氢氧化物 12.4.4 重要盐类及其性质
12.4.1 氢化物
s区元素的单质(除Be、Mg外)均能与氢 形成离子型氢化物。 1.均为白色晶体, 热稳定性差 LiH NaH KH RbH CsH NaCl -90.4 -57.3 -57.7 -54.3 -49.3 -441
2KNO 3 + 10K 6K 2O + N 2
MCO 3 MO + CO 2 (g) 除BeO外,均能与水化合生成相应的碱。
MⅠ2O + H2O 2MOH (Li Cs剧烈程度)
MⅡO + H2O 2M(OH) 2 (BeO除外) Li 2O + CO 2 Li 2CO 3
2. 过氧化物
§12.2 碱金属和碱土金属概述
碱金属(IA ):ns1 Li, Na, K, Rb, Cs, Fr
碱土金属(IIA ):ns2 Be, Mg, Ca, Sr, Ba, Ra 都是活泼金属。
通性:
1. 易与H2直接化合成MH、MH2离 子型化合物;
如何证明H的化合 价为-1价? 电解熔融态氢化物,
化合物生成焓 △ fHm / kJ·mol-1
化合物生成焓越大(绝对值),放出热量越多,物质的热稳定 性越好。 与高中所学,同主族,从上到下氢化物的稳定性越差一致。
2.还原性强
(E (H2/H- ) = - 2.23V)
⊖越小,还原型物质(H-)的还原能力越强,对应的氧 化剂H2的氧化能力越弱。 H-为强还原剂。
金属性、还原性减弱
§12.3 碱金属和碱土金属的单质
12.3.1 单质的性质 12.3.2 单质的制备和用途
碱金属和碱土金属

碱金属和碱土金属碱金属和碱土金属是元素周期表中两个重要的元素家族,它们在化学性质上有许多相似之处,但也存在一些明显的区别。
本文将探讨碱金属和碱土金属的性质、应用以及对环境和人类健康的影响。
一、碱金属碱金属是位于元素周期表第一族的元素,包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和钫(Fr)。
它们都是银白色的金属,具有低密度、低熔点和极强的金属反应性。
碱金属的化合物通常具有较高的溶解度和离子导电性。
碱金属的主要性质包括:1. 金属反应性:碱金属和非金属元素反应时会释放大量的热量和气体。
2. 氧化性:碱金属在空气中迅速与氧气反应生成氧化物。
3. 电导性:碱金属具有较高的电导率,可用于制备电池和导电材料。
4. 碱性:碱金属的氢氧化物是强碱,可用于中和酸性溶液。
碱金属在生活和工业中具有广泛的应用,如:1. 锂:用于制造锂电池,广泛应用于移动电子设备和电动汽车等领域。
2. 钠:用于制造化学工业中的钠化合物,例如氢氧化钠。
3. 钾:用于制造肥料和玻璃工业中的钾化合物。
4. 铷、铯:主要用于科学研究和高精密仪器。
然而,碱金属也存在一些安全问题。
由于其极强的反应性,碱金属与水接触会产生剧烈的放热反应,甚至可能引发爆炸。
此外,碱金属化合物的放射性同位素(如钫)对人体健康有辐射危害。
二、碱土金属碱土金属是位于元素周期表第二族的元素,包括铍(Be)、镁(Mg)、钙(Ca)、锶(Sr)、钡(Ba)和镭(Ra)。
碱土金属同样是银白色的金属,具有较低的密度和较高的熔点。
碱土金属的化合物也具有高溶解度和离子导电性。
碱土金属的主要特点包括:1. 金属反应性:碱土金属的反应性较碱金属弱,但仍然比大多数金属高。
2. 碱性:碱土金属的氢氧化物是较强的碱。
3. 电导性:碱土金属的导电性较高,可用于制备导电材料。
碱土金属在工业和日常生活中也有重要的应用,例如:1. 镁:用于制造轻量化材料,如航空航天和汽车工业中的合金。
2. 钙:是构成骨骼和牙齿的主要成分,也广泛应用于冶金和建筑工业。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
元素周期表
IA IIA IIIB IVB VB VIB VII B VIIIB IB IIB IIIA IVA VA VIA VII A VIII A
1 2
H
He
Li
Be
B
C
N
O
F
Ne
3 4
5 6 7
Na Mg K Ca Sc
Y La
Al Ti
Zr Hf Rf Nd U
Si Ge
Li
Na
Ca
Sr
Ba
稀有金属:锂,铷,铯,铍
锂的应用:①电解铝,②锂电池,③低温润 滑剂,④空调,⑤玻璃,⑥铝合金纤剂,⑦ 有机合成,⑧医药
铷和铯的应用:①电子技术,②生物技术, ③化工,④能源,⑤新材料,⑥科学研究
二、单质的化学性质-还原性
1、与水反应: M + H2O = MOH + H2↑ M + 2H2O = M(OH)2 + H2↑ Li Ca Sr Ba 反应平稳 Be Mg 常温下在水中稳定 一是因为这些金属熔点高 二是因为氢氧化物溶解度小
金 属 活 泼 性 增 加
Ga
In Tl
Rb Sr Cs Fr
La Ac
Ba
Ra Ac
Ce Th Pr Pa
Er Fm
Tm Md
Yb No
Lu Lr
Bk
本章要求:
1 掌握单质的性质,了解其结构、制备、存在及用途与性质 的关系。 2 掌握其氧化物的类型及重要氧化物的性质及用途。 3 了解其氢氧化物的溶解性和碱性的变化规律。
4 掌握其重要盐类的性质及用途,了解盐类热稳定性、溶
二、碱金属和碱土金属的通性
Li
价电子构型 主要氧化态
Na
3s1 +I
K
4s1 +I
Rb
5s1 +I
Cs
6s1 +I
2s1 +I
离子半径
60 520 7298 1.0
95 496 4562 0.93
133 419 3051 0.82
-2.931
148 403 2633 0.82
-2.925
169 376 2230 0.79
1、与一般的无机配体(X-,OH-,NO3-) 不生成配合物。
第二节 碱金属和碱土金属的单质
一、单质的物理性质和应用
1、金属的光泽 银白色 2、密度小 最轻的金属Li 3、低熔点 4、低硬度 可用刀切割 5、良好的导电性 6、形成液态合金 77.2% K + 22.8% Na mp = 260.7 K,被用做核 反应堆的冷却剂。
解性的变化规律。
Li: lithium Na: sodium K: potassium Ru: rubidium Cs: cesium Fr: francium Be: beryllium Mg: magnesium Ca: calcium Sr: strontium Ba: barium Ra: radium
Sn Pb
P As
Sb Bi
S Se
Te Po
Cl Br
I At
Ar Kr
Xe Rn
V
Nb Ta Db Pm Np
Cr
Mo W Sg Sm Pu
M n
Tc Re Bh Eu Am
Fe
Ru Os Hs Gd Cm
Co
Rh Ir Mt Tb
Ni
Pd Pt Ds
Cu
Ag Au Rg Dy Cf
Zn
Cd Hg Cn Ho Es
-2.923
I1/kJ· mol-1 I2/kJ· mol-1 电负性
Eθ/V
M+(aq)+e=M(s) (上册P257)
-3.045 -2.710
Be 价电子构型 2s2 主要氧化态 +II 离子半径 35 I1/kJ· mol-1 905 I2/kJ· mol-1 1768 I3/kJ· mol-1 14939 1.57 电负性 Eθ A -1.85 Eθ B -2.28
alkali metal (碱金属)
alkali earth metal (碱土金属)
第一节 碱金属和碱土金属的通性
一、元素的存在
元素 丰度% 典型矿物 元素 丰度 典型矿物 Li 2.0×10-3 锂辉石 锂云母 Be 2.6×10-4 绿柱石 Na 2.3 钠长石 海水 Mg 2.3 光卤石 菱镁矿 K 2.1 钾长石 明矾石 Ca 4.1 方解石 石灰石 Rb Cs
M2+水化能 /kJ· mol-1
Mg 3s2 +II 66 742 1450 7658 1.31 -2.38 -2.69 1921
Ca 4s2 +II 99 593 1152 4942 1.00 -2.76 -3.02 1577
Sr 5s2 +II 112 552 1070 4351 0.95 -2.89 -2.99 1443
0.0090 3.0×10-4 铯榴石 硼铯铷矿 Sr 0.037 天青石 碳酸锶 Ba 0.05 重晶石 碳酸钡
锂辉石 钠长石 硝石 钾长石 光卤石 芒硝 泻盐 方解石 石膏 天青石 重晶石
LiAlSi2O6 NaAlSi3O8 NaNO3 KAlSi3O8 KCl·MgCl2 ·6H2O Na2SO4 MgSO4 ·7H2O CaCO3 CaSO4 ·2H2O SrSO4 BaSO4
三、成键特征
1、主要氧化态-离子型化合物 碱金属:+1;碱土金属:+2
2、共价性
气态时碱金属以双原子分子形式存在,Na2,Cs2。
半径较小的Li,Be形成共价性较强的化合物, LiF,BeCl2
四、配位性能(了解) 这两族元素是周期表中最弱的配合物形成体。
2、仅能与螯合剂、大环配体生成稳定的配合物,如 Ca(EDTA)2-
Ba 6s2 +II 134 564 971 0.89 -2.90 -2.97 1305
2494
(一)金属性 1、价电子构型ns1,ns2,核外电子少; 2、电负性 χ< 1.0, 1.6; 3、第一电离能小,从上至下减小,从IA到IIA增加。
4、碱金属的熔点、沸点、硬度都很低,且从上至下 降低;碱土金属的熔点、沸点、硬度均比碱金属高, 导电性低于碱金属。
(二)金属性变化规律 1、 碱金属、碱土金属的金属性从上至下增加; 2、 从IA到IIA金属性降低。
(三)、物理通性
(1) 金属光泽 (2) 金属有电阻,能导电 自由电子的定向运动,产生导电性。 自由电子运动中受核的引力,产生电阻。 (3) 金属有导热性 自由电子运动中与原子核不断碰撞,产 生热能的交换。 (4) 优良的机械加工性能
