2023年安徽高中化学竞赛成绩
关于中国化学会2010年第24届全国高中学生化学竞赛

关于中国化学会2010年第24届全国高中学生化学竞赛(安徽赛区)获奖情况的通报市中学化学教学专业委员会:中国化学会2010年第24届全国高中学生化学竞赛(省级赛区)安徽赛区的竞赛工作已经顺利结束。
本次竞赛共评出一等奖37名(经中国化学会、中国科协审核批准),二等奖429名,三等奖527名,总计获奖人数为993名(获奖同学名单见附件)。
获奖学生的获奖证书将直接寄达各位获奖学生所在学校。
附件:中国化学会2010年第24届全国高中学生化学竞赛(安徽赛区)获奖学生名单安徽省化学会安徽省化学竞赛委员会二○一○年十一月一日附件:中国化学会2010年第24届全国高中学生化学竞赛(安徽赛区)获奖学生名单(说明:每一等级奖项各名次由上向下单列排列,第1列完成转第2列,即第2列首位名次在第1列末位之后,第2列完再至第3列) 一等奖(37名)姓名学校姓名学校姓名学校谢永杰合肥一中尹瑞合肥一中戴伟斌马鞍山二中李彤合肥一中刘开元合肥八中刘同与马鞍山二中姜雨生安师大附中范昌瑞蚌埠二中徐志祥马鞍山二中庞欢芜湖一中胡旭东芜湖一中郝希聪马鞍山二中叶子醒合肥一中方舟合肥一中张天合肥八中赵栋磊合肥一中窦弘治马鞍山二中吴楚齐合肥168中学张文合肥一中薛晓东合肥一中李乐乐合肥一中马赫淮北一中周翃羽安师大附中刘旭波合肥一中邱剑涛马鞍山二中陈梦鹏马鞍山二中尹超芜湖一中吴凡马鞍山二中黄庆国淮北师大附中刘洋铜陵市一中陈筱璇合肥一中桂在岳安师大附中钱万晖马鞍山二中周恺铜陵市一中陈阳铜陵市一中胡焕祥合肥168中学洪伟合肥一中二等奖(429名)姓名学校姓名学校姓名学校汪大卫合肥一中石坚合肥一中姜策蚌埠二中叶少亮六安一中黄杰合肥一中蓝天安师大附中朱彬彬灵璧中学姚承志马鞍山二中陶平冬天长中学邵健为屯溪一中蔡国庆濉溪中学(西校区) 方涛屯溪一中周越安师大附中杨东来阜阳红旗中学罗哲恒安师大附中凌承尧歙县中学潘志翔安庆一中李貌安庆一中李宇合肥168中学王文佳马鞍山二中尹伊人铜陵市一中杨赫合肥一中雷维浩六安一中宛炜屯溪一中李梦尧蚌埠二中鲁传华滁州中学王周合肥168中学吴玉璋安庆一中马鑫安庆一中洪张杰滁州中学黄田斌铜陵市一中马旭合肥八中郑阳和县一中萧静渊安师大附中张仔孝蒙城一中胡东合肥168中学郭睿马鞍山二中孙贤顺和县一中梅开无为中学裴中煜安师大附中李琨屯溪一中宋博亳州一中张小龙圣泉中学周旭晨合肥六中丁志无为中学赵晓明合肥一中蔡志岚广德中学章喆安庆一中陶俊明合肥八中王晨曦和县一中常乐六安一中邵辰合肥一中汪晓鹏屯溪一中桂心伟马鞍山二中吕品磊合肥一中周佑洲阜阳红旗中学吕爽合肥六中尹昊琰广德中学童祖根马鞍山二中韩宇太和一中孙启彰淮北一中方爽爽怀宁中学吕正歙县中学吴现广德中学姚宇航合肥168中学黄博安庆一中何少康安师大附中王艺微合肥168中学宣守民宣城中学孙学良合肥一中谢广觉安师大附中杨磊蚌埠三中伍凌云合肥168中学黄俊怀宁中学束俊杰无为中学洪祥和县一中何易无为中学李晨马鞍山二中陈世聪广德中学彭正昊合肥八中周灿和县一中叶擎宇马鞍山二中陈安马鞍山二中陈首丞马鞍山二中吴皓安师大附中王天翔合肥一中何加强和县一中涂卓恒芜湖一中严然合肥一中禇园安师大附中秦小磊铜陵市一中王光明临泉一中王润泽明光中学马天成合肥八中李磊无为中学徐称称六安一中王玉奉无为一中郭泽昊合肥八中余浩马鞍山二中张绪歌合肥168中学汪昊翔休宁中学陈世藩淮北实验高中朱行宇淮北一中张淼城郊中学卢肖永萧县一职高翟羽佳马鞍山二中刘天乐安庆一中吴奇天长中学丁称安庆一中凌骏屯溪一中何天和县一中夏之杰滁州中学凌静安师大附中张艾琦铜陵市一中刘佳伟六安一中仲雪松天长中学何晨蒙城一中方凌锐南陵中学乔彬合肥168中学吕宋强蒙城一中张鑫合肥一中李俊合肥168中学杨晓文蒙城一中胡尚健马鞍山二中崔智玮芜湖一中胡曙光蒙城一中张寅马鞍山二中袁倩屯溪一中季一玮芜湖一中张灯合肥一中王煜东合肥一中沈豹阜阳红旗中学方涵之合肥六中陈征阜阳一中宋吻吻砀山中学尹哲浩铜陵市一中蔡铭安师大附中张杨和县一中占智强合肥168中学许浒和县一中王礼坤涡阳一中徐东方和县一中汤佳骏马鞍山二中赵俊超蚌埠二中陈鸿安师大附中张禹安师大附中林万清和县一中朱荻安师大附中王奔淮北一中时进当涂一中刘畅阜阳红旗中学阮乐乐安师大附中张珩安师大附中马超群界首一中程可昕铜陵市一中刘建国淮北一中侯思卿天长中学王伟无为中学吴冠军亳州一中刘志远合肥八中周欣合肥八中孙童悦肥东一中李柯合肥六中吴玥淮北实验高中丁宜无为中学汪天仪马鞍山二中江千帆屯溪一中王安无为中学伍冠雄淮北一中邓文轩芜湖一中陈保友天长中学刘茂阜阳红旗中学陆文睿合肥168中学茆松宣城二中李伟合肥一中魏庆华濉溪中学(西校区) 章旭之屯溪一中吴天宇滁州中学刘昊天合肥168中学夏雨薇和县一中杨捷六安一中蒋成堃池州一中张昌源天长中学颜鹏亳州一中茅志祥南陵中学孔雪锋淮南二中孙伟成马鞍山二中林放全椒中学吕玄玄蒙城一中丁志文马鞍山二中王勤铜陵市一中侯深化无为中学王冠军蒙城一中魏天铎马鞍山二中胡坤马鞍山二中程宇豪铜陵市一中刘袁鹏怀宁中学郭俊太和中学王方俊歙县中学胡梦楠屯溪一中章磊铜陵市一中周圆滁州中学胡鸿飞安师大附中李元媛马鞍山二中应晨露肥东一中虞乃鹏天长中学高显马鞍山二中吴曲然科大附中胡京徽无为中学徐丽君太和中学段全林合肥一中张昱芃合肥168中学曹健宇屯溪一中苏杰马鞍山二中魏子庄马鞍山二中胡筱菀马鞍山二中张飞跃蒙城一中黄新锐桐城中学郭锐蒙城一中邢普成无为中学许丹肥东一中吴凯圣泉中学何鎏铜陵市一中肖云无为中学朱天其合肥168中学胡舜华马鞍山二中周边六安一中胡振淮北一中黄玉宇淮北一中卢仁洋天长中学吴健雄和县一中韩衍隽安庆一中余可六安一中吴明歙县中学王天琪淮北一中苏佳敏青阳中学傅万春无为中学沙瑞无为中学李煜滁州中学江峰歙县中学陈仁立无为中学吴昊歙县中学范伟伟太和中学赵钰合肥八中史文博临泉一中葛雷郎溪中学孔晓鸣圣泉中学陈小乐铜陵市一中王国峰蚌埠三中张诚合肥168中学陈浩瀚淮北一中孙志颖合肥八中杨世意铜陵市一中吴筱然宣城二中钱盾马鞍山二中陶娱芜湖一中张磊合肥168中学孟傲男淮北一中刘允鹏淮北一中张乐园蒙城一中张成安师大附中王梓马鞍山二中葛宝梁铜陵市一中王阳阜阳红旗中学胡健飞合肥168中学李元坤阜阳一中吴子健铜陵市一中刘菲菲铜陵市一中赵征蒙城一中李跃蒙城一中杨梦筠蚌埠二中陈爽怀宁中学李扬临泉一中罗翔六安一中徐沈智滁州中学牛梦书淮北一中倪开元科大附中卢瑶铜陵市一中李筱坤和县一中李安然合肥一中林凯马鞍山二中许飞宿州二中俞忠无为中学张兔子南陵中学张绪灵璧一中王振蒙城一中刘坤鹏淮北一中姚宇蒙城一中孙文全安庆一中李尚翼临泉一中毛涛涛铜陵市一中刘成明滁州中学陈磊军合肥168中学周忠承蒙城一中张朝亮六安一中王刚池州一中夏发安庆一中杨斌合肥一中董升南陵中学李奇太和中学魏星原淮北一中黄荣军合肥168中学褚皓明肥东一中朱善璋合肥一中李朋宿城一中尚振华颍上一中王晨宇滁州中学金凡芜湖一中姚学斌濉溪中学(西校区) 文舒肥东一中卞显硕合肥168中学汪彩永和县一中张春雷合肥一中万竹青淮北一中张帆蚌埠二中吴颖合肥168中学王守都马鞍山二中徐璐安师大附中陈凌帆合肥168中学李帮俊马鞍山二中邱长文宣城二中刘涛无为中学袁野滁州中学李惠军当涂一中陈震合肥一中王政灵璧一中王靖志蚌埠二中徐德锋望江二中孙驰太和一中李明明蒙城一中汤云飞亳州一中洪建峰铜陵市一中李璐蒙城一中戴琨合肥八中刘阳肥西中学姜月马鞍山二中赵冠龙合肥168中学贾迪太和一中张伟杰无为中学杨文豪阜阳三中杨一杉蚌埠二中卢泰安安庆一中沈灏合肥一中何鹏望江二中张会会阜阳红旗中学章承伟合肥八中王旭辰铜陵市一中杜燊淮北实验高中陈文俊马鞍山二中汪翔安庆一中戴同利南陵中学彭昊合肥八中林小宝铜陵市一中张桂正蚌埠二中彭亮灵璧一中郑雪阳合肥一中谭文周亳州一中曹天阳合肥一中邵国栋合肥一中朱添子明光中学肖尚铜陵市一中方晟屯溪一中王博铜陵市一中陈飞铜陵市一中孙雅稚铜陵市一中朱舸滁州中学刘泽琛蚌埠二中陈天友合肥八中彭桐睿蚌埠二中桑海龙太和中学冷福成阜阳一中赵强明光中学陈雅清合肥一中周浩然合肥168中学陶鸿宇安师大附中张圣杰淮北一中田仕畅合肥一中王克勤和县一中袁立功合肥一中王燕彬安师大附中李卓卿马鞍山红星中学高翔淮北一中王志杰六安一中贾志强界首一中何帅英南陵中学朱永博合肥一中滕岳安师大附中余洋临泉一中田唐昊淮北一中李宪宇合肥一中丁寒芜湖一中胡勃屯溪一中王玉皖萧县中学马骏淮北一中刘双马鞍山二中房之伟天长中学石云帆和县一中吴亚欣安师大附中李宗浩全椒中学田赛赛蒙城一中姜形形蒙城一中刘豹阜阳红旗中学汪艳铜陵市一中尚云飞太和中学杨开源合肥一中吴丹铜陵市一中魏立翔滁州中学刘彪蒙城一中丁玉琴合肥168中学胡张选池州一中胡仁志芜湖县一中高梓晟淮北一中夏涛和县一中黄林龙圣泉中学李天成合肥八中陈志远滁州中学朱庆明含山中学邵南启合肥八中李振国阜阳一中杨家乐安庆一中张宇滁州中学郭跃合肥168中学白林筱合肥168中学李奇(大) 太和中学王飞和县一中赵庆杭天长中学陆少军合肥八中陕云鹏繁昌一中宋明磊阜阳红旗中学三等奖(527名)姓名学校姓名学校姓名学校薛慕寒淮北一中隆飞广德中学章剑东至三中陆志鹏明光中学曹仕奇太和中学徐陈林铜陵县一中朱成瑞灵璧一中王有望六安一中吴正晗宣城中学姜小雨滁州中学余巨峰东至二中王逸威宁国中学童敢宣城中学王东舒城中学洪伟马鞍山二中王强和县一中张帅帅宿州二中王庆怀宁中学潘康华铜陵市一中吴开明芜湖县一中袁锦民六安一中周海涵马鞍山中加学校袁洋安庆一中李志强涡阳一中曾志成马鞍山二中汪鸣明屯溪一中许经纬桐城中学杨超太和中学褚培松马鞍山二中罗静茹安庆一中庞燕军马鞍山红星中学吴俊杰宣城二中张欣然滁州中学赵越马鞍山二中杨帆巢湖二中张星辰芜湖十二中方志伟合肥六中王在鹏无为中学韩乐和县一中乔鑫亳州一中刘晓东繁昌一中程杨安庆一中杨兵鹏太和一中夏飞含山中学周斯航屯溪一中张如敏来安中学孙超杰太和中学卢海涛池州一中王勇屯溪一中杨彬望江二中操珍繁昌一中梁浩涡阳一中周游萧县中学程忠健含山中学桂宏鸣池州一中严薛峰和县一中李进怀宁中学吴劲哲屯溪一中陈闪闪太和一中刘俊无为中学陆潇波含山中学白盛明安庆一中张阳安庆一中李根灵璧一中杨永斌阜阳红旗中学蓝家健定远中学钱超池州一中牛良涛阜阳红旗中学于扬博科大附中蒲肖肖太和一中张强天长中学耿蒙蒙蒙城一中朱美林宣城二中汤艺铜陵市一中刘长锋蒙城一中孙聪聪宣城二中杨剑南宣城中学王韬全椒中学李亚颍上一中洪沿铜陵市一中刘志强圣泉中学王天威萧县中学夏志峰滁州中学李旭滁州中学周彪寿县一中熊富忠南陵中学徐奇楠定远中学白晔马鞍山二中杨轩歙县中学李妙然广德中学程小强和县一中叶鹏萧县中学戴研明光中学郑启美蒙城一中张聪聪池州一中王云飞南陵中学毛亚詹宣城二中田振灵璧一中丁丽宿城一中陆子泉定远中学张帅蒙城一中陈翔安庆一中朱珺广德中学蒋翊武滁州中学于文君合肥一中乔宝石巢湖二中吴逸君滁州中学马泽冰铜陵市一中李扬肥东一中江云涛科大附中唐旱波来安中学李长友临泉一中阚雯博广德中学仇启明长丰一中刘中原濉溪中学(西校区) 李煜蒙城一中许海波宿州二中汪逸凡马鞍山二中宋剑超太和中学潘峰临泉一中华文伦池州一中李硕存马鞍山二中黄景合肥168中学张彬彬圣泉中学束俊合肥168中学胡鹏萧县中学段昌豪淮南二中缪宏伟无为中学张琦桐城中学韩润泽定远中学马健和县一中甘露安庆一中杨婉如滁州中学周鲁晓冬芜湖一中孙朋含山中学乔治铜陵市一中张华清歙县中学李正秋明光中学庆绪顺含山中学于启成亳州一中方浩铜陵市一中胡广程蒙城一中张诗琪屯溪一中陆权固镇一中赵钰霍邱一中蔡森河淮北一中方俊齐亳州一中昂伟圣泉中学王然铜陵市一中郑颜蒙城一中邵涵屯溪一中姜南滁州中学刘畅蒙城一中侯飞涡阳一中张飞翔宿城一中哈梦可太和中学周文淮北一中许慧迪定远中学李少宇太和中学王亚琪太和中学朱洪渊合肥168中学张煌屯溪一中武彬无为中学沈玉鹏当涂一中黄绍中芜湖一中黄军五河一中赵守俊蒙城一中徐超宣城二中骆晓宇繁昌一中刘芳芳蒙城一中孙超明光中学赵婉如马鞍山二中张泽蚌埠二中卢楠明光中学葛艳芜湖一中吴芳升宣城二中崔茂霍邱一中徐杰圣泉中学刘琦池州一中李雪蚌埠三中朱成龙圣泉中学王冬含山中学吴凡蚌埠二中王浩然铜陵市一中郭腾飞亳州一中张梦成广德中学梁晓波蒙城一中许慧灵歙县中学郏瑞蒙城一中徐耀东屯溪一中关书峰濉溪中学(西校区) 欧长江萧县中学张佳宝蒙城一中杨昳太和中学汪杰青阳中学方健繁昌一中李强望江二中周欣怡铜陵市一中俞中祺屯溪一中吴帅怀宁中学乐越巢湖一中刘源和县一中焦文祥安庆一中陈陈安庆一中倪呈军天长中学胡雄安庆一中余乐蚌埠二中曹耀天蚌埠三中钟磊铜陵市一中王贵和县一中朱家麟淮北一中王扈炜滁州中学谢地五河二中王熠坤安师大附中李亚军定远中学卲子剑来安中学程翔繁昌一中朱炜东至大渡口中学杜盛磊黄山一中王同同舒城中学王明宿城一中许义铜陵县一中王天赐蚌埠三中宋浩然蒙城一中薛寒肥东一中蔡闫宿州三中范玮潜山中学侯明利临泉一中王金南马鞍山二中王也芜湖一中徐超滁州中学杨士杰界首一中谢耀辉淮南二中苑虎阜阳一中赵华夏来安中学侯炜刚肥东一中赵婷婷阜阳一中姜逸伟池州一中孙啸然马鞍山二中朱志文巢湖四中赖雅茹五河一中李广浩宿州二中王玲蒙城一中桂林池州一中单宇蒙城六中陈子飞宿城一中张衡涡阳一中高军南陵中学孟洁太和一中王凯阳合肥一中徐骞滁州中学赵晨曦马鞍山二中王大山太和中学梁雷合肥八中彭美玉泗县新集高中蒋彦浩马鞍山二中赵田无为中学何璟荣合肥六中王嘉伟怀宁中学顾黎明宿城一中周琼和县一中彭醒醒阜阳红旗中学王辉涡阳一中骆传凯来安中学刘一臻滁州中学叶波繁昌一中徐滢安庆一中周吉磊淮北一中朱承浩南陵中学吴萱安庆一中尹晓宇六安一中谢晓博萧县中学方悠安庆一中欧如意萧县中学圣荣超含山中学张鸣长丰一中安忠宝蚌埠三中曹杰歙县中学焦景黄山一中戴培元淮北一中李旭太和一中刘广利辛二中陈松蒙城一中汪轲宣城中学苑赛赛蒙城一中曹路阳蒙城一中石冰安庆一中刘长俊圣泉中学刘慧丰淮北一中陆启乐五河一中吴忧桐城中学王晓琛马鞍山二中王春笛阜阳红旗中学周祺润铜陵市一中占涛安庆二中史自强太和中学林佳伟池州八中马振亳州一中王琬玥滁州中学吴金路淮南一中田竟竞蒙城一中范子健芜湖县一中汤飞池州八中刘雪松襄安中学王春文芜湖县一中梁灿凤台一中吴俊和县一中刘楠宿州二中黄睿东至大渡口中学符建风界首一中崔可临泉一中汪书东东至二中黄斌无为中学许继东肥东一中刘文珏铜陵市一中戴韵秋和县一中周鹏芜湖县二中付加飞明光中学王位安庆一中朱璠马鞍山二中蒋雨晨蚌埠铁中许海雯天长中学方建鹏歙县中学焦睿宁国中学王炳超安庆一中魏云宣城二中韩春春蚌埠二中程晋坤淮北实验高中何乐为芜湖一中周勐蚌埠三中王开元圣泉中学李鹏飞亳州一中叶晨皓泾县中学朱讯南陵中学王曼嫣安庆一中张慧娟铜陵市三中鲁杭宣城中学张存君安庆一中陈春筱炳辉中学杨玲玲濉溪中学(西校区) 李俊全椒中学张大伟固镇一中方真歙县中学潘家秀天长中学顾新强淮北市第十二中学张越池州一中张忠心明光中学李胜杰颍上一中黄雅洁天长中学吴霖东至三中王攀淮北天一中学郎传东含山中学徐啟利宣城二中李政滁州中学李德军蒙城一中吴文成青阳中学刘迟砀山中学苗争濉溪中学(西校区) 巩兵兵宿城一中张凯蒙城一中曹赛赛太和一中席婉琳滁州中学金猛濉溪中学(西校区) 余皖东池州一中吴子强蚌埠二中毛凯莉萧县中学赵子临和县一中钱雪薇宣城中学李乐乐(小)泗县一中郭庆丰淮北一中穆堂杰淮北一中胡志强濉溪二中吴亮青阳中学程亦直屯溪一中支军军怀远一中洪水屯溪一中高阳枞阳中学赵立安安庆二中徐顺利太和中学黄家晟蒙城一中曹灿安庆九中刘经纬肥西中学汪燃岳西中学杨青安庆七中张帅阜阳红旗中学冯俊涛岳西中学严明星安庆十中曹瑞安师大附中牛帅涡阳一中张来龙白云中学陈珺弘合肥一中赵一静亳州一中代芷若蒙城一中柯希玮屯溪一中王文和县二中胡鹏石台中学蔡涛蒙城一中王贤文肥东一中樊开升天城中学陈丰歙县中学陈高伯涵马鞍山二中熊木野寨中学吕豪安师大附中贾全锐寿县一中姚文豪安庆二中苏清亳州一中施根生青阳中学吴文成旌德中学蒋华杰合肥一中江佳健歙县中学吴昭昭临涣中学仲春来五河一中马俊明广德中学吴樾屯溪一中钱晨辉蚌埠二中罗颖溢圣泉中学刘丰艺芜湖一中刘阳光太和一中陈宽郎溪中学黄安琪五河一中程何健合肥168中学匡俊耀蚌埠一中王超仁阜南一中杨倩合肥八中汪争雨凤阳中学张志远蒙城一中谷祥深太和中学吴优合肥一中刘伟光合肥八中唐文芳歙县中学赵卫南陵中学张鑫涡阳四中胡岱青屯溪一中张文祥包集中学潘雁太湖中学王开元安庆一中吴根威歙县中学王子朋涡阳一中陈天彤阜阳三中蒋小超当涂一中夏尚文池州一中查涛怀宁中学秦华强南陵中学吴璠凤阳中学谈桥南陵中学郭弘宇合肥八中陈有鹏宿城一中杨诚无为中学金城含山中学代维含山中学王英刚蒙城一中贾竹冰合肥168中学李浩马鞍山二中王睿和县一中凤维勇舒城中学刘勇涛界首一中吴锋肥东一中邢庭瑜庐江中学朱涛利辛一中郝明明圣泉中学陈龙泉正阳中学高磊池州一中胡建淮南二中张钦蚌埠二中桂海亮池州一中杜颖鹄定远中学洪唯寿县一中黄刚和县一中张航飞枞阳中学张雅雅歙县中学张公涛安庆一中李志伟蒙城一中余春海阜阳红旗中学冀伟安亳州二中阮启元铜陵市一中孟庆卓临泉一中刘凯雯程集中学卢永昌天长中学王珂宿城一中李鑫和县一中吕志铜陵市一中胡东东望江二中孙康康和县一中张众宿城一中李玉火南陵中学张璐蒙城一中江金辉桐城中学张森临泉一中蔡健培南陵一中从兆清太和一中陈楷蚌埠二中吴浩圣泉中学叶帅无为中学司强太和一中董锦春天长中学李仕玮芜湖一中何月霞和县一中张鸣田家炳实验中学李庆涛阜阳红旗中学李智萧县中学汪权彬太湖中学李腾飞和县一中奚韩诚芜湖县一中叶海彬阜阳二中倪绿林宿州二中陈天心无为一中郑毅凡祁门一中李萌阜阳一中陈志刚安庆一中吴泽志宿松中学杜欢圣泉中学王连飞阜阳红旗中学项超霍山中学王跃龙蒙城一中郑家琳合肥六中徐文君固镇二中曹文兵望江二中田伟和县一中戴昕妤涡阳二中苏庆贺萧县中学吴兵明光中学吴春磊淮南14中马世超屯溪一中陈子扬宿城一中徐同同阜阳红旗中学王辉阜阳红旗中学陈一鸣明光中学。
2023年高中化学竞赛初赛模拟试卷胡波竞赛卷

2023高中化学竞赛预赛模拟试卷(39)第一题(2分)235 92U原子吸取一个慢中子后,分裂成13654Xe和9038Sr,写出核反映方程式。
第二题(4分)H2N--NHNH-COCF3可作为增强基团用于释放显影促进剂的成色剂的合成。
1.系统命名法命名该有机物;2.合成该有机物可用对硝基苯肼和另一重要有机原料,写出结构简式,并指出该步合成反映的反映类型;3.本合成工艺中采用高压催化加氢还原硝基,相对用“Fe/盐酸”还原的优点是什么?第三题(7分)1.H2O的沸点(100℃)比HF的沸点(20℃)高,为什么?2.气态氯原子与一个电子结合比气态氟原子与一个电子结合放出更多的能量,为什么?3.Li3V2(PO4)3是一种新型的锂离子正极材料。
其阴离子是由2种多面体组合而成的三维网状结构。
请具体指出其阴离子中各原子的连接形式。
第四题(10分)钾盐A与氧化物B(等物质的量)在熔融状态下反映,生成C和气体D;C极易与水反映,生成沉淀E和溶液F;E干燥易失水生成B;F溶液中通入气体D生成A的溶液;C易被氧化剂氧化为G,G是一种常用的水消毒剂。
1.写出A~G所代表物质的化学式;2.写出与A与B反映具有相似化学原理。
且在教材上出现过的化学方程式;3.选用合适的氧化剂,写出C氧化为G的反映方程式。
第五题(13分)目前工业上通用的铬盐生产工艺是铬铁矿与纯碱及碳酸钙辅料混合、高温焙烧氧化、冷却、水浸、硫酸酸化、结晶除去硫酸钠转化为重铬酸钠产品;然后再进一步加工为其它铬盐产品。
该工艺三废污染严重,污染的同时导致铬资源的浪费。
中科院过程工程研究所研究开发出液相氧化-循环碳氨转化铬盐清洁生产新工艺,反映过程中极易析出产品NaNH4CrO4·2H2O。
1.分两步写出新工艺中的反映方程式。
NaNH4CrO4·2H2O的TG-DTG曲线见右图图。
由图中曲线可以看出NaNH4CrO4·2H2O的热分解分为三步进行:第一步分解温度范围为50~95℃,失重率19.91%(理论18.66%);第二步分解温度范围为100~180℃,总失重率为27.9%(理论25.40%);第三步分解温度范围为215~385℃,总失重率为32.20%(理论32.16%)2.请按失重的理论值,写出两步反映方程式;3.某学生在实验后发现残留固体质量明显小于67.8%。
2023年全国高中学生化学竞赛省级赛区试题

中国化学会2023年国初化竞试题(2023年10月13日9︰00-12︰00 共计3小时)●竞赛时间3小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面前上)放在桌面上,立即起立撤离考场。
●试卷装订成册,不得拆散。
所有解答必须写在站定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
●姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。
●允许使用非编程计算器以及直尺等文具。
第1题(4分)今年5月底6月初,各地报刊纷纷转载了不要将不同品牌洁污剂混合使用的警告。
据报道,在全国各地发生了多起混合洁污剂发生氯气中毒的事件。
根据你的化学知识作出如下判断(这一判断的对的性有待证明):当事人使用的液态洁污剂之一必然含氯,最也许的存在形式是和。
当另一种具有(性质)的液态洁污剂与之混合,也许发生如下反映而产生氯气:第2题(2分)目然界中,碳除了有2种稳定同位素12C和13C外,尚有一种半衰期很长的放射性同位素14C,丰度也十分稳定,如下表所示(注:数据后括号里的数字是最后一位或两位的精确度,14C只提供了大气丰度,地壳中的含量小于表中数据):试问:为什么通常碳的相对原子质量只是其稳定同位素的加权平均值而不将14C也加入取平均值?答:第3题(4分)最近报道在-100℃的低温下合成了化合物X,元素分析得出其分子式为C5H4,红外光谱和核磁共振表白其分子中的氢原子的化学环境没有区别,而碳的化学环境却有2种,并且,分子中既有C-C单键,又有C=C双键。
温度升高将迅速分解。
X的结构式是:第4题(10分)去年报道,在-55℃令XeF4(A)和C6F5BF2(B)化合,得一离子化合物(C),测得Xe的质量分数为31%,阴离子为四氟硼酸根离子,阳离子结构中有B的苯环。
C是首例有机氙(IV)化合物,-20℃以下稳定。
C为强氟化剂和强氧化剂,如与碘反映得到五氟化碘,放出氙,同时得到B。
安徽省示范高中培优联盟2022-2023学年高二下学期联赛化学试题及答案

姓名 座位号(在此卷上答题无效)绝密★启用前安徽省示范高中培优联盟2023年春季联赛(高二)化学本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第Ⅰ卷第1至第5页,第Ⅱ卷第6第10页.全卷满分100分,考试时间75分钟.考生注意事项:1.答题前,务必在试题卷、答题卡规定的地方填写自己的姓名、座位号,并认真核对答题上所粘贴的条形码中姓名、座位号与本人姓名、座位号是否一致.2.答第Ⅰ卷时,每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑.如改动,用橡皮擦干净后,再选涂其他答案标号.3.答第Ⅱ卷时,必须使用0.5毫米的黑色墨水签字笔在答题卡上獉獉獉獉书写,要求字体工整、笔清晰。
必须在题号所指示的答题区域作答,超出答题区域书写的答案无效獉獉獉獉獉獉獉獉獉獉獉獉獉,在试题卷獉獉獉獉、稿纸上答题无效獉獉獉獉獉獉獉。
4.考试结束,务必将试题卷和答题卡一并上交.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27S-32 Cl-35.5 Fe-56 Cu-64 Ag-108 Zn-65第Ⅰ卷(选择题 共46分)一、选择题(本大题共10小题,每小题3分,共30分。
每道题考生都必须做答,在每小题给出四个选项中,只有一项是符合题目要求的。
)1.化学和生活、社会发展息息相关。
下列说法错误的是A.核酸检测时用到的“拭子”由尼龙纤维制成,属于有吸附性的合成有机高分子材料B.“水滴石穿”过程中发生化学变化C.有人称“一带一路”是“现代丝绸之路”,丝绸的主要成分是蛋白质,属于天然高分子化合物D.冬奥会吉祥物“冰墩墩”以聚氯乙烯为原材料,氯乙烯通过缩聚反应可转化为聚氯乙烯2.犖A为阿伏加德罗常数的值,下列说法错误的是A.已知115B+42→ HeR+11H,14gR含有的中子数为8犖AB.0.4mol联氨(N2H4)中含有共价键数目为2犖AC.精炼铜阴极增重6.4g时,阳极生成Cu2+数目为0.1犖AD.常温下1LpH=12的CH3COONa溶液中,H2O电离出的OH-数为0.01犖A3.下列实验操作、现象和结论都正确的是选项实验操作现象结论A向盛有2mL0.1mol·L-1KCl溶液的试管中滴加10滴0.1mol·L-1AgNO3溶液,待生成白色沉淀后,再向其中滴加0.1mol·L-1KI溶液先观察到白色沉淀,后沉淀颜色变为黄色犓sp(AgCl)>犓sp(AgI)B将浓硫酸和无水乙醇加热到170℃,产生的气体通入酸性高锰酸钾溶液中酸性高锰酸钾溶液褪色使酸性高锰酸钾溶液褪色的气体为乙烯C将浓氨水滴到碱石灰上,产生的气体通入湿润的蓝色石蕊试纸上湿润的蓝色石蕊试纸变红氨气溶于水显碱性D将CH3CH2Br与NaOH溶液共热,冷却后,取出上层水溶液,加AgNO3溶液产生淡黄色沉淀CH3CH2Br中存在溴元素A.AB.BC.CD.D4.实验室常用MnO-4标定(NH4)2Fe(SO4)2,同时使MnO-4再生,其反应原理如图所示。
第23届全国高中学生化学竞赛(省级赛区)
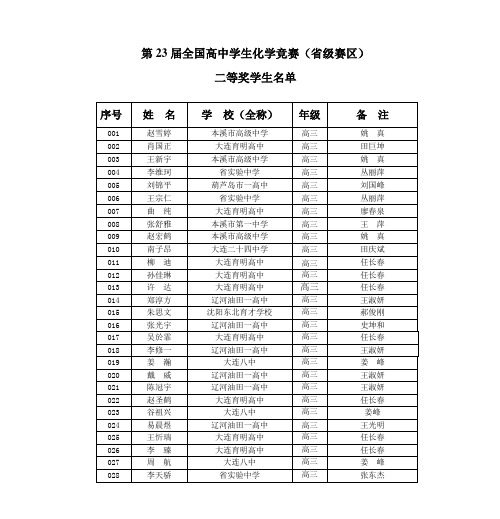
关树伶
226
李鸿霖
丹东二中
高三
侯跃平
227
林晗
大连育明高中
高三
任长春
228
王冀楠
省实验中学
高三
杨宝臣
229
刘正辉
辽阳市一高中
高三
230
张晓宇
葫芦岛市一高中
高三
李继峰
231
徐梦扬
大连二十四中学
高三
田庆斌
232
洪妍
盘锦市高中
高三
孙凤海
233
傅大鹏
阜新市高级中学
李吉库
234
曹英杰
朝阳市凌源二高中
高三
235
丹东二中
高三
侯跃平
290
李弘杨
锦州北镇高中
高三
王辉
291
李达
锦州北镇高中
高三
王辉
292
高原
丹东凤城一中
高三
赵志国
293
宋晓宇
大连二十四中学
高三
田庆斌
294
吴云龙
营口熊岳高级中学
高三
孙少杰
295
雒佳铭
葫芦岛建昌县一高中
高三
王学东
296
高振羽
盘锦市高中
高三
马也
297
姜德辉
抚顺一中
高三
崔雪峰
298
高三
任长春
244
王珏
大连瓦房店高中
高三
吴玉美徐长凤
245
刘宇明
抚顺一中
高三
崔雪峰
246
赵岑
辽河油田一高中
高三
王淑妍
247
2023年高中化学竞赛初赛模拟试卷
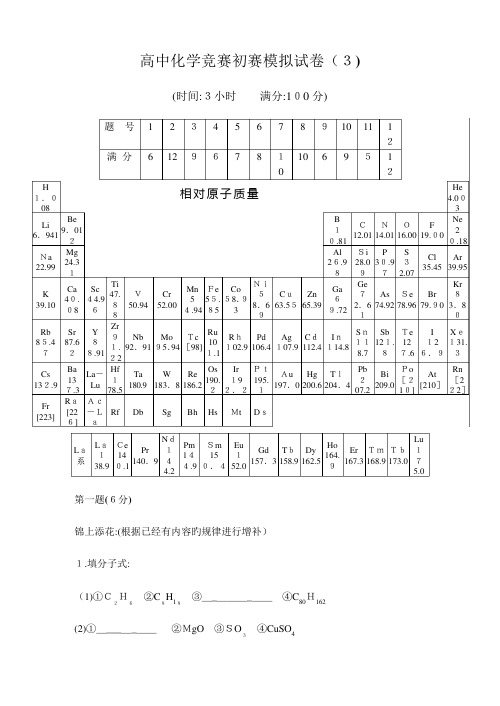
高中化学竞赛初赛模拟试卷(3)(时间:3小时 满分:100分)题 号 1 2 3 4 5 6 7 8 910 11 12满分 6 12 967 8 10 10 6 9 512H 1.008 相对原子质量He4.003Li 6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na 22.99 Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95K 39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.39Ga69.72Ge72.61As74.92Se78.96Br79.90Kr83.80Rb 85.47Sr87.62Y88.91Zr91.22Nb92.91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107.9Cd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs 132.9Ba137.3La-LuHf178.5Ta180.9W183.8Re186.2Os190.2Ir192.2Pt195.1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]Fr [223] Ra[226]Ac-LaRf Db Sg Bh Hs Mt DsLa系La138.9Ce140.1Pr140.9Nd144.2Pm144.9Sm150.4Eu152.0Gd157.3Tb158.9Dy162.5Ho164.9Er167.3Tm168.9Tb173.0Lu175.0 第一题(6分)锦上添花:(根据已经有内容旳规律进行增补)1.填分子式:(1)①C2H6②C8H18③________④C80H162(2)①________ ②MgO ③SO3④CuSO4(3)①Fe 2O 3 ② ③Na 2O 2 ④FeSO 4·7H 2O ⑤CuSO 4·5H 2O ⑥ 2.填化学方程式:①2N a+2H 2O=2NaOH+H 2↑ ②2C+SiO 2=Si+CO ↑③2H 2S+O 2=2S+2H 2O ④____________________________。
第23届全国高中学生化学竞赛决赛

第23届全国高中学生化学竞赛获奖学生名单一等奖姓名学校姓名学校黄超浙江杭州二中金泽鑫杭州二中王昊达河北石家庄市第二中学王汝一江苏南京师范大学附属中学上官湘航湖南长沙市长郡中学诸琪磊浙江杭州二中郭亦堃河南省实验中学周闻宇浙江金华一中张帆河北衡水中学崔知涵辽宁大连二十四中学王波四川绵阳中学何姗珊四川南山中学蒋兴宇湖南长沙市雅礼中学曾灿湖南师大附中张凯冬杭州外国语学校孟赫河北石家庄市第二中学林嘉扬福建厦门第一中学贾上河北石家庄市第二中学周志尧湖北华中师大第一附属中学申鹏翔河南郑州一中黄滕宇四川成都七中尹剑吉林东北师范大学附属中学郑钦珩浙江金华一中黄睿之湖南师大附中龚宗平江苏常熟中学(高二)顾春晖辽宁辽宁省实验中学李卓天津南开中学武振伟北京北京市第四中学高二陈嘉桢郑州市第一中学谢君湖南长沙市雅礼中学曲直河南郑州市第一中学李天祥河北石家庄市第二中学王拓山东莱芜市第一中学纪金朝福建同安第一中学倪兵河南郑州市第一中学唐朝湖南长沙市长郡中学周振鹏天津天津市一中苏泽彬福建泉州第七中学郭子健吉林吉林市第一中学陈曦陕西西安交通大学附中张鑫雨北方交通大学附属中学陈紫萦安徽铜陵市第一中学柳成航江苏省泰州中学杨晋焱山西大学附中郝德昭海南中学徐培迪四川成都七中桂超江西鹰潭市第一中学黄文元福建夏门第一中学樊湖波江西南昌市第二中学林常帆浙江温州中学杜璞安徽蚌埠市第二中学刘帅山东省实验中学黄晶鑫重庆重庆市巴蜀中学徐劲松吉林市第一中学葛睿四川绵阳中学冯煜陕西西安市铁一中学黄山浙江学军中学蒋希奕广西柳州高中李显伟湖北武汉二中二等奖陈风华江苏省启东中学陈添锴广东深圳中学刘宇轩陕西西北工业大学附中孙芮吉林东北师大附中陶船思博黑龙江哈尔滨师大附属中学张骋寰重庆市第一中学毕颖杰上海华东师大第二附属中学何焯林广东中山纪念中学王圣湖北黄冈中学张琦梵河北石家庄市第二中学任天楚山东省实验中学金冲上海市上海中学侯杰瀚广东深圳中学熊世豪上海复旦大学附属中学魏聪睿新疆乌鲁木齐市第一中学何达辽宁大连育明高中顾炜华江苏省海门中学黄志红福建泉州第七中学林特希福建厦门双十中学刘田源山东青岛二中刘濯宇湖南长沙市一中晏佳環陕西西北工业大学附中李旭湖北湖北荆州中学史浩远山西省实验中学张宸豪上海华东师大第二附属中学张翕山西大学附中袁航上海市晋元高级中学李言安徽芜湖市第一中学王昱佳甘肃西北师大附中张博文新疆新疆实验中学余骁鹏湖北华中师大一附中宋润喆天津实验中学刘卢果四川绵阳南山中学谈天宇安徽合肥市第一中学周天航广西师范大学附属外国语学校丁宇迪陕西西安交通大学附中刘晨言天津宝坻一中冯睿黑龙江佳木斯市第一中学徐仁洋重庆重庆市巴蜀中学姜圣芃上海华东师大第二附属中学孔劭凡北京市101中学孙秉毅江西鹰潭市第一中学卢文正广东广州执信中学陈扶犁重庆重庆市南开中学黄晓铨广东华南师范大学附属中学刘天时辽宁东北育才学校刘康陕西西安高新一中邱天江苏金陵中学谭晓丹安徽马鞍山市第二中学严霁阳江西南昌市第二中学张可天广东华南师范大学附属中学石航山西山西大学附中吴超强广东湛江第一中学冯通黑龙江哈尔滨师大附属中学姚天佑山西山西省实验中学王烨欣北京中国人民大学附属中学张楠北京市十一学校杨天鹤北京市十一学校张靖中安徽合肥市第一中学郭文翰山西省实验中学周志豪贵州贵阳一中朱慕梁湖北武汉二中刘子源重庆市第一中学郭子威陕西西安市铁一中学何楠河南开封高中刘熠湖北华中师大一附中童天喆广西广西南宁市第三中学关奥海南师大附中海口中学丁秋涵辽宁大连育明高中莫翊广西柳州高中周勃宇黑龙江哈尔滨师大附属中学李绪文山东寿光现代中学羊博群海南海南中学董斌重庆市第八中学汪琛甘肃兰州一中韩亮甘肃兰州一中王凯天津实验中学三等奖陈城贵州贵阳一中王开平内蒙古包头市第九中学马天翼内蒙古包头市第九中学刘运操云南云南师大附中刘福生江西新余市第四中学李炯昭新疆新疆实验中学刘麟盛甘肃西北师大附中李杨山东东营市胜利一中范畅翔广西南宁市第三中学吕章夏云南云南师大附中王丹阳内蒙古一机集团第一中学徐垣贵州贵阳一中齐翔黑龙江齐齐哈尔实验中学杨睿新疆乌鲁木齐市第八中学程翰黑龙江佳木斯市第一中学余鑫江西宜春中学陈真洋甘肃西北师大附中曾令达云南师大附中邓杰文广西柳州高中杨帆吉林东北师大附中林琳海南文昌中学郑如川内蒙古通辽五中阳东初贵州贵阳一中梁宇杰海南海南中学王浩权云南云南师大附中杨帆内蒙古包头市第九中学薛运吉林东北师大附中崔奋为宁夏银川二中罗梦琪辽宁沈阳二中王之人云南云南师大附中王博宁夏银川一中胡长华夏银川九中朱鑫疆乌鲁木齐市第一中学郑德荣天津南开中学付蜀杰贵州贵阳一中彭钰栋贵州贵阳一中任宇蓉宁夏银川一中王晋内蒙古二机集团第三中学梁根铨澳门坊众学校周驯黄海南华侨中学马文甘肃民勤一中沈雁婷新疆乌鲁木齐市第一中学林锐雄澳門濠江中學陈嘉莹澳門濠江中學余曉喬香港協恩中學呂皓筠香港協恩中學孙文威澳門培正中學李国豪澳門濠江中學廖穎心香港協恩中學林嘉明澳門濠江中學劉芷筠香港協恩中學伍希昕香港協恩中學張詩雅香港協恩中學。
2023全国高中化学竞赛(共10篇)

2023全国高中化学竞赛(共10篇)2023全国高中化学竞赛(一): 全国高中化学竞赛多少分能拿奖我即将参加化学竞赛复赛,请给些建议视试卷难度而定.不知你是哪个省的,不过各省应差不多吧.前年化学竞赛试卷很难,江苏最高分也只有69分,我们学校有个45分的都拿了省一等奖.去年,卷子比较容易,我们省60分以上是一等奖.建议:去年考到了几年没考的化学平衡,而且在10分以上.今年可能仍会考.近几年推断题占卷子的一半以上,希望你相信第一感觉.前年考的配合物有点难,去年的不难,但只要基础扎实,应该可以拿大部份分或全分.有机是送分的.晶体比较难,结构图可放在最后.最后,祝你轻松获奖!【2023全国高中化学竞赛】2023全国高中化学竞赛(二): 求2023高考全国二卷和新课标理综化学答案直接写出2023年普通高等学校招生统一考试理科综合能力测试试题可能用到的相对原子质量:H l C l2 N 14 O 16 Mg 24 S 32 C1 35 5 Fe 56 Cu 64 Zn 65 Br 80一、选择题:本大题共13小题.每小题6分.在每小题给出的四个选顼中,只有一项是符合题目要求的.7.下列叙述中正确的是A.液溴易挥发,在存放液溴的试剂瓶中应加水封B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-D.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+答案:A解析:此题为基础题,B答案在考前多个试题里面都出现过,因为除了氯气外,其它的如臭氧都可以将其氧化得到碘单质.C答案应该是碘单质,D答案不能排除硫酸根的干扰.8.下列说法中正确的是A.医用酒精的浓度通常为95%B.单质硅是将太阳能转变为电能的常用材料C.淀粉、纤维素和油脂都属于天然高分子化合物D.合成纤维和光导纤维都是新型无机非金属材料答案:B答案解析:此题为基础题.A答案应该为75%,C中油脂不为高分子化合物,这个选项也在考前多个试题里出现D答案光导纤维为二氧化硅,合成纤维为有机材料,这个选项多个试题也出现,从前面两个题看来,还是没什么创新,或者考前已经被很多老师抓住题了.9.用NA表示阿伏加德罗常数的值.下列叙述中不正确的是A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NAB.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2 NAC.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6 NAD.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2 NA答案:D解析:此题为基础题,尤其C选项平时学生练习过多次,估计每位参加高考的学生至少做个3-4次.D选项因为是常温常压下,气体的体积与状态有关系.10.分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构)A.5种 B.6种 C.7种 D.8种答案:D解析:此题也为基础题,也没什么新意,首先写出戊烷的同分异构体(3种),然后用羟基取代这些同分异构体就可以得出有3+4+1=8种这样的醇11.已知温度T时水的离子积常数为KW.该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是A.a = bB.混合溶液的pH = 7C.混合溶液中,c(H+) = mol/LD.混合溶液中,c(H+) + c(B-) = c(OH-) + c(A-)答案:C解析:此题为中档题,A答案中a=b,但是无法知道酸与碱是否为强酸、强碱,反应后不一定成中性.B答案PH=7,因为温度不一定为常温25℃,同样也不能说明中性的.C答案也就是C(H+)=C(OH-),溶液当然显中性.D答案是溶液中的电荷守衡,无论酸、碱性一定成立,不能说明溶液就显中性.12.分析下表中各项的排布规律,按此规律排布第26项应为1\x092\x093\x094\x095\x096\x097\x098\x099\x0910C2H4\x09C2H6\x09C2H6O\x09C2H4O2\x09C3H6\x09C3H8\x09C3H8O\x09C3H6O2\x0 9C4H8\x09C4H10A.C7H16 B.C7H14O2 C.C8H18 D.C8H18O答案:C解析:此题为中档题,其实这道题更象是一个简单的数学题,不需要过多的化学知识,不过学生平时估计也碰到过这种找多少项为什么的类似题.有多种做法,比如我们把它分为4循环,26=4ⅹ6+2,也就是说第24项为C7H14O2,接着后面就是第25项为C8H16,这里面要注意的是第一项是从2个碳原子开始的.13.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质.而Z不能形成双原于分子.根据以上叙述,下列说法中正确的是A.上述四种元素的原子半径大小为W Y,Z为稀有气体原子又有增大的趋势,B答案总和应该为1+4+5+8=18C也就是氢与氧既可以生成水,也可以生成双氧水.D答案要注意H,C形成的烃中,如果碳原子很多的时候,形成的烃为液态或固态.总体来说这次选择题还是比较简单的,学生失分都不会很大.26.(14分)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物.(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和漓定的方法.实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换.交换完成后,流出溶液的OH-用0.40 mol/L的盐酸滴定,滴至终点时消耗盐酸25.0 mL.计算该样品中氯的物质的量,并求出FeClx中,x值:———(列出计算过程);(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(C1)=1:2.1,则该洋品中FeCl3的物质的量分数为__________.在实验室中,FeCl2可用铁粉和__________反应制备,FeCl3可用铁粉和__________反应制备;(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为________________;(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________.与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________________,该电池总反应的离子方程式为________________.答案:解析:此题为中档题,前3问这里面就不说了,在计算第一问X值的时候,完全可以把x=2或者x=3代入,这样可以节损时间.第四问也是近几年多次考到的高铁酸钾,有关高铁酸钾的制备与电化学,第四小问考查化学基本功,这里面有很好的区分度,扎实的同学拿满分没问题.第一个方程式多次书写过,第二个方程式,很多同学觉得无法书写,其实首先写大体物质,高铁酸根被还原为Fe3+,然后再写出转移的电子数,根据电荷守衡,因为溶液是碱性的,所以产物只能写成8个OH-,一个Fe3+结合3个OH-生成Fe(OH)3,因为负极反应式为Zn-2e-=Zn2+最后一个方程式只需要综合得失电子守衡就可以得出正确答案.27.(15分)光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.(1)实验室中常用来制备氯气的化学方程式为 Mno2+4Hcl(浓)MnCl2+Cl2↑+2H2O;(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制各CO,已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ/mol、-285.8kJ/mol和-283.0 kJ/mol,则生成1 m3(标准状况)CO所需热量为__________;(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为________________;(4)COCl2的分解反应为COCl2(g) === Cl2(g) + CO(g) △H = +108kJ/mol.反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线来示出):①计算反应在第8 min时的平衡常数K = __________②比较第2 min反应温度T(2)与第8 min反应温度(T8)的高低:T(2)____T(8)(填“”或“=”);③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2) =______mol/L;④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以 (2—3)、 (5—6)、 (l2-13)表示]的大小____________;⑤比较反应物COCl2在5-6 min和15-16 min时平均反应速率的大小: (5-6) > (15-16)(填“”或“=”),原因是_______________.答案:解析:此题中挡题,拿满分较难(不过第四问中的①③的答案确实有待商榷,为什么都要保留到小数点后三位,从题目中能看出来吗)体现在计算麻烦上,第二问其实出题人完全直接说甲烷的燃烧热为890.3kJ/mol,…这样很多同学在计算反应热的时候更容易错.因为反应为CH4+CO2=2CO+2H2 △H=反应物的燃烧热-产物的燃烧热=247.3 KJ/mol,也就是生成2mol CO,需要吸热247.3 KJ,那么要得到1立方米的CO,放热为(1000/22.4)×247.3/2=5.52×103 KJ.第三问要根据电负性分析碳元素化合价的变化,CHCl3碳为+2价,COCl2中碳为+4价,即可写出方程式.第四问,①根据K计算公式即可求出,但是答案为什么只保留三位小数值得商榷,②同时计算T2时的K值很明显小于T8时的K值,说明是升高温度平衡正向移动的原因.③题目说了是不同条件下的平衡状态,那么后面温度就不会改变.根据K值可计算C(COCl2).④因为5-6分钟,CO浓度在改变所以平均反应速率大于其它的,因为处于平衡状态,根据V的计算公式,2-3、12-13的平均反应速率为0.⑤因为5-6分钟时浓度改变大于12-13.28.(14分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:(1)在a中加入15 mL无水苯和少量铁屑.在b中小心加入4.0 mL液态溴.向a中滴入几滴溴,有白色烟雾产生,是因为生成了__________气体.继续滴加至液溴滴完.装置d的作用是____________________________________;(2)液溴滴完后,经过下列步骤分离提纯:①向a中加入10 mL水,然后过滤除去未反应的铁屑;②滤液依次用l0 mL水、8 mL l0%的NaOH溶液、10 mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是______;(3)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必须的是______(填入正确选项前的字母);A重结晶 B过滤 C蒸馏 D萃取(4)在该实验中,a的容积最适合的是______(填入正确选项前的字母).A 25 mLB 50 mLC 250 mLD 509 mL答案:解析:此题为基础题,老师上课讲苯与液溴的实验时,都会讲到大部分,不知命题人出这题是为了什么这道实验题反成了拿高分的试题.这里就不多说了.36.【化学——选修2化学与技术】(15分)由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:(1)在反射炉中,把铜精矿砂和石英砂混合加热到l000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物.该过程中两个主要反应的化学方程式分别是__________、__________,反射炉内生成炉渣的主要成分是__________;(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%.转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼.冰铜中的Cu2S被氧化为Cu2O.生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是__________、__________.(3)粗铜的电解精炼如右图所示.在粗铜的电解过程中,粗铜板应是图中电极_____(填图中的字母);在电极d上发生的电极反应式为____________;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为______.答案:⑴Cu2FeS2+O2 Cu2S+2FeS+SO2 2FeS+3O2 2FeO+2SO2 FeSiO3⑵2Cu2S+3O2 2Cu2O+2SO2 2Cu2O+Cu2S 6Cu+SO2↑⑶ c Cu2++2e-= CuAu、Ag以单质的形式沉积在c(阳极)下方,Fe以Fe2+的形式进入电解液中 37.【化学——选修3物质结构与性质】(15分)VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是______;(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为______;(3)Se原子序数为______,其核外M层电子的排布式为______;(4)H2Se的酸性比H2S__________(填“强”或“弱”).气态SeO3分子的立体构型为______平面三角形,SO32-离子的立体构型为______三角锥形;(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:__________;第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;②H2SeO4比H2SeO3酸性强的原因:______;(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为____________(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________________pm(列式表示).答案:解析:(1)因为S8为环状立体结构,所以为SP3(6)第一问我们常碰到,后面一问要注意四个Zn2+在体内的四个小立方体的中心,不在同一平面上,过b向上面作垂线,构成直角三角形,两边分别为√2/4a 1/4a,即可求出斜边为√3/4a(a 为晶胞边长)38.【化学——选修5有机化学基础】(15分)对羟基苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得.以下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:已知以下信息:①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;②D可与银氪溶液反应生成银镜;③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1:1.回答下列问题:(1)A的化学名称为__________;(2)由B生成C的化学反应方程式为____________________,该反应的类型为______;(3)D的结构简式为____________;(4)F的分子式为__________;(5)G的结构简式为________________;(6)E的同分异构体中含有苯环且能发生银镜反应的共有______种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2:2:1的是________________(写结构简式).答案:解析:此题为基础题,比平时学生接触的有机题简单些,最后一问也在意料之中,同分异构体有两种形式,一种是一个酯基和氯原子(邻、间、对功三种),一种是有一个醛基、羟基、氯原子,3种不同的取代基有10种同分异构体,所以一共13种,考前通过练习,相信很多老师给同学们一起总结过的还有:3个取代基有2个相同的取代基的同分异构体,4个取代基两两相同的同分异构体.2023全国高中化学竞赛(三): (2023•昆明模拟)已知,中学化学常见的一些物质有如下图转化关系(转化关系中的某些产物已略去).其中,物质A、D、G是单质,D的单质在黄绿色气体中燃烧生成的产物溶于水得到E,黑色物质C有磁性是某金属矿物的主要成份,F是混合物,H是极易溶于水的碱性气体.回答下列问题:(1)反应①的化学方程式是3Fe+4H2O(g)高温.黑色物质C有磁性是某金属矿物的主要成份,则C为Fe3O4,H是极易溶于水的碱性气体,则H为NH3.由反应②可知D、G分别为H2、N2中的一种,结合反应①可知,应为Fe与水反应,故A为Fe、B为H2O、D为H2、G为N2,D的单质在黄绿色气体中燃烧生成的产物溶于水得到E,则E为盐酸;Fe3O4与盐酸反应生成混合物F为FeCl2、FeCl3的混溶液,与氨气、氧气反应生成I为Fe (OH)3,则:(1)反应①是Fe与水蒸气反应生成四氧化三铁与氢气,反应方程式为:3Fe+4H2O(g)高温.Fe3O4+4H2,故答案为:3Fe+4H2O(g)高温.Fe3O4+4H2;(3)将饱和FeCl3溶液逐滴滴入沸水中,继续加热至液体变为红褐色为止,可得氢氧化铁胶体,反应的化学方程式为:FeCl3+3H2O △.Fe(OH)3(胶体)+3HCl,故答案为:将饱和FeCl3溶液逐滴滴入沸水中,继续加热至液体变为红褐色为止;FeCl3+3H2O△.Fe(OH)3(胶体)+3HCl;(3)合成氨反应中,氢气(或氮气)的生成速率与消耗速率相等时,反应到达平衡状态,故答案为:氢气(或氮气)的生成速率与消耗速率相等;(4)在一定温度和有催化剂存在的条件下,将1.0molN2和2.5molH2放入500mL密闭容器中,经过20min达到平衡,平衡后NH3的浓度为2.0mol/L,则:N2(g)+3H2(g)⇌2NH3(g)开始(mol/L):2 5 0变化(mol/L):1 3 2平衡(mol/L):1 2 2则用N2表示20min内的平均反应速率=1mol/L20min=0.05mol/(L.min),该温度下,平衡常数k=221×23=0.5,如果保持温度和体积不变,再向容器中同时充入1.5molN2和1.0molNH3,则此时N2的浓度=1mol/L+1.5mol0.5L=4mol/L,1.0molNH3的浓度=2mol/L+1mol0.5L=4mol/L,故浓度商Qc=424×23=0.5,浓度商等于平衡常数,故平衡不移动,故答案为:0.05mol/(L.min);0.5;不移动.2023全国高中化学竞赛(四): (2023•上海模拟)中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是()A.根据同主族元素性质的相似性,推出Tl2O3是两性氧化物B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HC1OA.氧化铝是两性氧化物,Tl与Al同主族,同主族自上而下金属性增强,Tl 的金属性比Al强,Tl2O3可能不是两性氧化物,故A错误;B.氟元素没有正化合价,故B错误;C.溶液酸碱性取决于溶液中氢离子与氢氧根离子浓度的相对...2023全国高中化学竞赛(五): (2023•湖北模拟)已知在下图转化关系(某些转化关系中的产物已略去)中都是中学化学常见的物质,物质A、D、G是单质,F是混合物,磁性黑色物质C是某金属矿物的主要成份,E是一种非氧化性酸,F是混合物,H是极易溶于水的碱性气体.请回答下列问题:(1)写出下列物质的化学式:A、______C、______I______.(2)写出反应①的化学方程式:3Fe+4H2O(g)高温.黑色物质C有磁性是某金属矿物的主要成份,则C为Fe3O4,H是极易溶于水的碱性气体,则H为NH3.由反应②可知D、G分别为H2、N2中的一种,结合反应①可知,应为Fe与水反应,故A为Fe、B为H2O、D为H2、G为N2,D的单质在黄绿色气体中燃烧生成的产物溶于水得到E,则E为盐酸;Fe3O4与盐酸反应生成混合物F为FeCl2、FeCl3的混溶液,与氨气、氧气反应生成I为Fe (OH)3,(1)由上述分析可知,A、C、I分别为Fe、Fe3O4、Fe(OH)3,故答案为:Fe;Fe3O4;Fe(OH)3;(2)反应①是Fe与水蒸气反应生成四氧化三铁与氢气,反应方程式为3Fe+4H2O(g)高温.Fe3O4+4H2,故答案为:3Fe+4H2O(g)高温.Fe3O4+4H2;(3)在一定温度和有催化剂存在的条件下,将1.0molN2和2.5molH2放入500mL密闭容器中,经过20min达到平衡,平衡后NH3的浓度为2.0mol/L,则:N2(g)+3H2(g)⇌2NH3(g)开始(mol/L):2 5 0变化(mol/L):1 3 2平衡(mol/L):1 2 2①用N2表示20min内的平均反应速率为1mol/L20min=0.05mol/(L.min),故答案为:0.05mol/(L.min);②K=221×23=0.5,保持温度不变,再向容器中同时充入1.5 mol G和1 mol H,则此时N2的浓度=1mol/L+1.5mol0.5L=4mol/L,NH3的浓度=2mol/L+1mol0.5L=4mol/L,故浓度幂Qc=424×23=0.5=K,则平衡不移动,D的转化率将不变,H的体积分数不变,仍为21+2+2×100%=40%,故答案为:不变;40%.2023全国高中化学竞赛(六): 试题来源:2023年鲁科版高中化学选修6 3.1 物质组分的检验练习卷(带解析)有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液进行下列实验.实验步骤实验现象①取少量该溶液,加几滴甲基橙溶液变红色②取少量该溶液加热浓缩,加铜片和浓硫酸加热有无色气体产生,气体遇空气可以变成红棕色③取少量该溶液,加BaCl2溶液有白色沉淀生成④取③中上层清液,加AgNO3溶液有白色沉淀生成,且不溶于稀硝酸⑤取少量该溶液,加NaOH溶液有白色沉淀生成,当NaOH过量时沉淀部分溶解由此判断:(1)溶液中肯定存在的离子是________________,溶液中肯定不存在的离子是________________.(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(说明使用试剂的名称,不必写详细操作步骤)是____________________________.为什么5可以判断有镁离子与铝离子【2023全国高中化学竞赛】无色----->无Fe2+①取少量该溶液,加几滴甲基橙溶液变红色---->溶液显酸性,有H+-------->HCO3-不存在②取少量该溶液加热浓缩,加铜片和浓硫酸加热有无色气体产生,气体遇空气可以变成红棕色---->有NO3-,加上H+,所以无I-③取少量该溶液,加BaCl2溶液有白色沉淀生成------->有SO42-、无Ba2+④取③中上层清液,加AgNO3溶液有白色沉淀生成,且不溶于稀硝酸-------->不能判断原溶液是否含有Cl-⑤取少量该溶液,加NaOH溶液有白色沉淀生成,当NaOH过量时沉淀部分溶解------->含有Mg2+、Al3+⑤详细解释:加NaOH溶液有白色沉淀生成,这样的白色沉淀可能有Mg(OH)2,Al(OH)3,当NaOH过量时沉淀部分溶解,则同时含有Mg(OH)2,Al(OH)3.Mg(OH)2不与NaOH反应,仍为沉淀,Al(OH)3可以与NaOH反应生成可溶的NaAlO2.即加NaOH有白色沉淀生成Mg2+ + 2OH- === Mg(OH)2(沉淀) Al3+ + 3OH- = Al(OH)3 (沉淀)当NaOH过量时沉淀部分溶解 Al(OH)3 + OH- === AlO2 - + 2H2O综上所述:肯定存在的离子是Mg2+、Al3+、NO3-、SO42-肯定不存在的离子是Fe2+、Ba2+、I-、HCO3-,不能确定的离子为Cl-.K+焰色反应检验K+;检验Cl-:先加HNO3酸化,再加Ba(NO3)2,使SO42-完全沉淀,再加AgNO3,若有白色沉淀,则有Cl-小结:做这样的离子探究题,建议在原题上进行有效的标注,及时将判定的没有的离子划掉,沟出一定存在的离子,这样没有做处理的就是不能确定的离子.2023全国高中化学竞赛(七): (2023•河南一模)下列A~K是中学化学中的常见物质,其中D、E、K为单质,其余物质为化合物.这些物质具有下列转化关系(省略了水和部分反应物及生成物),除反应②外,其他反应均在水溶液中进行.其中D是工业中最常用的金属.回答:(1)A、H分别为______、______(填化学式)(2)写出反应②的化学方程式3FeO+2Al高温.依据题干信息额转化关系分析,D、E、K为单质,其余物质为化合物.这些物质具有下列转化关系(省略了水和部分反应物及生成物),除反应②外,其他反应均在水溶液中进行.结合转化关系分析判断C+E=D+F,高温反应是置换反应,其中D是工业中最常用的金属,金属发生置换反应,推断D为Fe,反应为铝热反应,E为Al,F为Al2O3,C为铁的氧化物,结合A+D=B分析可知,B为亚铁盐,所以推断C为Fe,O,J为HCl,B为FeCl2,A为FeCl3,K为Cl2,E 为Al,F为Al2O3,和反应得到同种物质应为NaAlO2,判断I为NaOH,NaAlO2和HCL反应量不同可以生成H为Al(OH)3或AlCl3;(1)依据分析可知A为FeCl3,H为Al(OH)3或A1C13;故答案为:FeCl3、Al(OH)3或A1C13;(2)分析判断反应②是铝热反应,氧化亚铁和铝加热反应生成铁和氧化铝,反应的化学方程式3FeO+2Al高温.3Fe+Al2O3;故答案为:3FeO+2Al高温.3Fe+Al2O3;(3)2.7克E为Al,物质的量为0.1mol,与I为NaOH或HCl完全反应生成G为NaAlO2,若G与J为HCl反应生成3.9克不溶物H为Al(OH)3,物质的量=3.9g78g/mol=0.05mol发生反应:2Al+2NaO H+2H2O=2NaAlO2+3H2↑,NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,则消耗J的物质的量为0.05mol;或 NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,Al(OH)3+3HCl=AlCl3+3H2O,NaAlO2+4HCl=AlCl3+NaCl+2H2O,0.1mol 0.1mol 0.1mol 0.05mol 0.15mol则消耗J的物质的量为0.25mol;故答案为:0.05mol或0.25mol;(4)根据公式:气体的摩尔质量=气体摩尔体积×密度可以求出t2℃时无水氯化铝的摩尔质量=70.0L•mol-1×2.g•L-1=186.9g/mol,设无水氯化铝的化学式为(AlCl3)n,则n=186.9133.5=1.4,介于1、2之间,故答案为:A12C16和A1C13;2023全国高中化学竞赛(八): (2023•石家庄模拟)A~H是中学化学常见的物质,它们之间的转化关系如图所示(部分产物已略去).已知B、D是生活中常见的金属单质,G是气体单质,C的焰色反应呈黄色.请回答下列问题:(1)元素B在周期表中的位置是______,C的电子式为______,H的结构式为______.(2)反应①的化学方程式为3Fe+4H2O(g)高温.B、D是生活中常见的金属单质,且B置换出D在高温条件下反应生成,可知为铝热反应,则B为Al,D为Fe,E应为Al2O3,Fe与H在高温下反应,则H应为H2O,A为Fe3O4,G为H2,C的焰色反应呈黄色,含有钠元素,可与铝反应生成氢气,则C为NaOH,F为NaAlO2,(1)B为Al,原子核外有3个电子层,最外层电子数为3,则位于周期表第三周期ⅢA族,C为NaOH,电子式为,H为H2O,结构式为H-O-H,故答案为:第三周期ⅢA族;;H-O-H;(2)反应①为铁和水蒸气在高温条件下的反应,反应的方程式为3Fe+4H2O (g)高温.Fe3O4+4H2,故答案为:3Fe+4H2O(g)高温.Fe3O4+4H2;(3)A为Fe3O4,与盐酸反应的离子方程式为Fe3O4+8H+═2Fe3++Fe2++4H2O,故答案为:Fe3O4+8H+═2Fe3++Fe2++4H2O;(4)F为NaAlO2,为强碱弱酸盐,水解呈碱性,水解的离子方程式为AlO2-+2H2O⇌Al(OH)3+OH-,故答案为:碱性;AlO2-+2H2O⇌Al(OH)3+OH-.2023全国高中化学竞赛(九): SO4表示的化学意义是什么应该是没有这个物质的.SO2为二氧化硫溶于水形成HSO3SO3为三氧化硫溶于水形成H2SO4你问的应该是H2SO4吧这个是硫酸或者其中的SO4 2- 这个是硫酸根离子2023全国高中化学竞赛(十): (2023•吉林二模)X、Y、Z、W都是中学化学中常见物质,其中X、Y、Z均含有同一种元素,在一定条件下相互转化关系如图1(部分生成物已略去).(1)若X、W均为单质,且X为气体,Y的水溶液中滴入KSCN溶液后变红.ⅰ)反应③的离子方程式是______;ⅱ)Y的水溶液显酸性,原因是(用离子方程式表示)______;将Y溶液蒸干、灼烧,得到的固体物质是______.(2)若X为氯碱工业的产品之一,Y为工业上生产普通玻璃的一种原料.Ⅰ、氯碱工业中制备X的化学方程式是2NaCl+2H2O电解.X、Y、Z、W都是中学化学中常见物质,其中X、Y、Z均含有同一种元素,(1)若X、W均为单质,且X为气体,Y的水溶液中滴入KSCN溶液后变红,W为Fe,X为Cl2,Y为FeCl3,Z为FeCl2;ⅰ)反应③的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-;ⅱ)铁离子水解显酸性,水解离子反应为Fe3++3H2O⇌Fe(OH)3+3H+,盐酸易挥发,则Y溶液蒸干得到氢氧化铁,灼烧后得到的固体物质Fe2O3,故答案为:Fe3++3H2O⇌Fe(OH)3+3H+;Fe2O3;(2)若X为氯碱工业的产品之一,Y为工业上生产普通玻璃的一种原料,X 为NaOH,W为CO2,Y为Na2CO3,Z为NaHCO3,I、电解饱和食盐水制备NaOH,该反应为2NaCl+2H2O电解.2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O电解.2NaOH+H2↑+Cl2↑;Ⅱ、ⅰ)Na2CO3跟盐酸的反应是分步进行的:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑,由图象可知生成二氧化碳消耗的HCl的物质的量小于从反应到开始产生二氧化碳阶段消耗的HCl,故W与X反应后溶液中溶质为NaOH、Na2CO3,故答案为:NaOH、Na2CO3;ⅱ)a点溶液中溶质为NaHCO3、NaCl,碳酸氢根离子水解显碱性,则c(H+)<c(OH-),故答案为:c(H+)<c(OH-);ⅲ)由图可知,a点时开始生成气体,故发生反应为:NaHCO3+HCl=NaCl+H2O+CO2↑,至生成二氧化碳体积最大时,该阶段消耗的HCl 的物质的量为0.2mol,由方程式可知产生二氧化碳的物质的量为0.2mol,生成的二氧化碳的物质的量等于开始通入的二氧化碳的物质的量,故开始通入的二。
2023年全国高中学生化学竞赛省级赛区试卷及答案完美WORD版

中国化学会全国高中学生化学竞赛(省级赛区)试题及答案题号 1 2 3 4 5 6 7 8 9 10 总分 满分 15 11 8 9 10 10 9 10 10 8 100 得分 评卷人竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
允许使用非编程计算器以及直尺等文具。
1.008Zr Nb Mo Tc Ru Rh Pd Ag CdIn Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr BaRaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]HeNe Ar KrXe Rn 相对原子质量Rf Db Sg Bh Hs Mt评分通则:1.凡规定计算的,没有计算过程,即使结果对的也不得分。
2023年高中学生化学竞赛安徽赛区初赛试题

2023年全国高中学生化学竞赛(安徽赛区)初赛试题1. 化学作为一门实用性很强旳学科与社会、环境等亲密有关。
下列有关说法中对旳旳是( )A.“低碳经济”重要是指减少对化石能源旳依赖B.光导纤维重要成分是晶体硅C.制作航天服旳聚酯纤维属于有机高分子化合物D.甲型H1N1流感病毒旳蛋白质由C.H 、O 元素构成 2.下列溶液中, 一定能大量共存旳离子组是( )A.pH=1旳溶液中: Na+ 、Mg2+ 、SO42- 、HCO3-B.具有大量Fe3+旳溶液中: Al3+ 、Cu2+ 、Cl- 、SO42-C.加入铝能放出H2旳溶液中: K+ 、NH4+ 、NO3- 、Cl-一、本题包括25小题,每题2分,共50分。
每题有1个或2个选项符合题意,若该题只有1个选项符合题意,多选或错选均不得分。
若该题有2个选项符合D.水电离产生旳c(H+)=10-12mol·L-1旳溶液中: K+ 、Ba2+ 、NO3- 、OH-3. 用NA表达阿伏伽德罗常数, 一下论述对旳旳是()A、1mol甲烷中旳氢原子被氯原子完全取代, 需要氯气分子数为2NAB.1.7g H2O2中具有旳电子数为0.9NAC.2mol旳NO2与水完全反应转移电子数为NA合理旳是( )A 用pH 试纸鉴别NaCl 和NH 4Cl 溶液NH 4+水解使溶液显酸性 B 取少许某溶液, 滴加氯化钡溶液, 生成白色沉淀该溶液中具有SO 42-C 配制氯化铁溶液时加入少许盐酸克制Fe 3+旳水解 D 向AlCl3溶液中加入过量浓氨水, 生成白色沉淀Al(OH)3不溶于碱溶液5. 下列试验装置, 试剂选用或操作对旳旳是( )A B C D 6. 下列离子方程式与所述事实相符且对旳旳是( )A.向NaHCO3溶液中滴加少许澄清石灰水: 2HCO3- + Ca2+ +2OH- = CaCO3↓ + CO32- +2H2OB.Na2S 溶液吸取足量SO2: S2- + 2SO2 + 2H2O = 2HSO3- + H2S ↑C.向2mol ·L-1Fe(NO3)2溶液中滴加少许氢碘酸: 3Fe2+ + NO3- +4H+ = 3Fe3+ + NO ↑ +2H2OD.向CuSO4溶液中滴加过量旳氨水: Cu2+ +2NH3·H2O = Cu(OH)2↓ + 2NH4+FeCl 3溶液铁制品锌片CuSO 4溶液H 2O NO(NO 2)H 2O浓硫酸KSCN 溶液7.已知:2H2S + SO2 = 3S↓ + 2H2O。
第23届全国高中学生化学竞赛获奖名单

第23届全国高中学生化学竞赛获奖名单一、陕西赛区获奖学生(108名)陕西赛区二等奖(37名)邓康(宝鸡中学)陈杰(扶风高中)肖越(宝鸡中学)张元元(凤翔中学)冯佳(扶风高中)李贝贝(宝鸡中学)王文宇(宝鸡中学)容博华(宝鸡中学)弓殷强(宝鸡中学)郑浩(宝鸡中学)李晓亮(蔡家坡高级中学)付乃锋(凤翔中学)车琦(宝鸡中学)豆少妮(扶风高中)谭密(西城高中)赵晨辉(石油中学)刘大伟(石油中学)王伟明(宝鸡中学)石岩(石油中学)王亮亮(陇县第二高级中学)高鹏(石油中学)范尧(宝鸡中学)李家恒(石油中学)牛子路(陕九学校)刘涛(凤翔中学)俱帅(宝鸡中学)田丰(宝鸡中学)白瑞玉(扶风高中)赵剑锋(扶风高中)王越(宝鸡中学)苏英(凤翔中学)李诺(宝鸡中学)袁百川(宝鸡中学)齐永超(石油中学)李奥(宝鸡中学)赵凯(扶风高中)代西超(凤翔中学)陕西赛区三等奖(71名)刘梦莹(宝鸡中学)贺钰昕(宝鸡中学)董悦(虢镇中学)杨耀东(扶风高中)白晓波(凤翔中学)张永锋(凤翔中学)朱景泉(凤翔中学)毕航(扶风高中)杨博(宝鸡中学)李欢(石油中学)张振雷(虢镇中学)李鹏(石油中学)李文星(斗鸡中学)索林博(虢镇中学)张少云(石油中学)隽智辉(扶风高中)梁宁(石油中学)王丹(凤翔中学)淮亚文(扶风高中)郭溢辉(宝鸡中学)赵鹏博(蔡家坡高级中学)魏刚(扶风高中)陈海波(石油中学)陈强(蔡家坡高级中学)张博宇(眉县中学)阳玲(宝鸡中学)毛文涛(虢镇中学)石鹏(虢镇中学)韩博超(虢镇中学)蔡朵朵(蔡家坡高级中学)邓永乐(扶风高中)韩卓凡(岐山高级中学)邢小龙(宝鸡中学)王洋(斗鸡中学)刘美彤(宝鸡中学)宋雄(宝鸡中学)吕晓博(虢镇中学)牛俊妮(扶风高中)钟佳霖(宝鸡中学)杨斌(宝鸡中学)龙敬杰(虢镇中学)丁风(扶风职教中心)王天天(凤翔中学)胡文辉(斗鸡中学)王冕(眉县中学)魏尧(扶风高中)李柏樟(扶风高中)何晶(蔡家坡高级中学)程怡(石油中学)张鹏(扶风高中)程伟(宝鸡中学)钞睿(凤翔中学)李新文(陇县中学)赵元华(蔡家坡高级中学)王建伟(姜谭联中)史泽譞(宝鸡中学)邵天杰(虢镇中学)范琳琳(石油中学)王致远(眉县中学)陈博(西城高中)马伟(眉县中学)白海龙(彪角中学)马强(眉县中学)黄鹏刚(虢镇中学)张晨(宝鸡中学)白浩(岐山高级中学)陈雪婧(宝鸡中学)王虎(麟游中学)梁小辉(石油中学)樊星星(凤翔中学)刘小晨(石油中学)二、陕西赛区优秀组织单位宝鸡市教研室三、陕西赛区团体优秀奖宝鸡中学四、陕西赛区优秀指导教师(14名)王霞(宝鸡中学)彭群(宝鸡中学)孔令波(宝鸡中学)于欣(宝鸡中学)陈奋强(宝鸡中学)程峰(宝鸡中学)卢凯(凤翔中学)程肖萍(石油中学)郑方(石油中学)陈天兴(扶风高中)刘宗强(蔡家坡高级中学)程玲科(陕九学校)刘利锋(西城高中)高育林(陇县第二高级中学)五、陕西赛区优秀组织学校(17所)宝鸡中学石油中学金台高级中学虢镇中学县功高中凤翔中学西街中学岐山高级中学蔡家坡高级中学扶风高中扶风职教中心眉县中学眉县城关中学眉县槐芽中学陇县中学麟游中学陇县第二高级中学六、陕西赛区先进工作者(19名)江萍(金台区教研室)张丽英(渭滨区教研室)赵英(陈仓区教研室)王保义(凤翔县教研室)杨少明(眉县教研室)史荣刚(岐山县教研室)张小明(陇县教研室)王宣忠(宝鸡市教研室)魏星(虢镇中学)蔡娟丽(眉县中学)王广太(眉县城关中学)冯海利(扶风高中)王晓侠(扶风职教中心)张亚红(金台高级中学)晁小莉(法门高中)高海丽(眉县槐芽高中)徐永俭(千阳中学)帖红娟(岐山高级中学)王红丽(麟游中学)七、宝鸡地区学生优胜奖(160名)余晓明(凤翔中学)逯戈(蔡家坡高级中学)强鹏飞(凤翔中学)胡天浩(宝鸡中学)王高强(扶风高中)段亚斌(虢镇中学)蔡向阳(蔡家坡高级中学)叶旺(斗鸡中学)杨辉(扶风高中)李洋(蔡家坡高级中学)王欢(扶风高中)王倩(岐山高级中学)吕昊东(扶风高中)易洋(蔡家坡高级中学)李泽阳(宝鸡中学)张艳康(虢镇中学)董永康(虢镇中学)岳雨强(烽火中学)马晓康(凤翔中学)张鹏(陇县中学)倪文博(千阳中学)梁聪聪(石油中学)郑渊钊(岐山高级中学)王妍(宝鸡中学)艾正杰(西街中学)林潇(蔡家坡高级中学)王龙飞(扶风高中)强刚(眉县中学)白海鹏(凤翔中学)王少鹏(扶风高中)魏涛(凤翔中学)蔡晓倩(蔡家坡高级中学)胡海斌(烽火中学)党少鹏(凤翔中学)樊坤(扶风高中)王羽豪(宝鸡中学)武鹏华(扶风高中)何战峰(眉县槐芽中学)王宜亮(陕九中学)刘婷(石油中学)丁文元(石油中学)高少辉(虢镇中学)王诗雨(凤翔中学)谭璐瑶(虢镇中学)杨超(虢镇中学)谢成(宝鸡中学)雷凯(眉县中学)杨波(姜城中学)唐佩龙(岐山高级中学)刘锦(宝鸡中学)李健(扶风高中)周少瑞(金台高中)梁波(扶风高中)吕臻(扶风高中)王伟(虢镇中学)朱凯勋(扶风高中)严强强(凤翔中学)张凯(扶风职教中心)邹国华(石油中学)董文丰(石油中学)赵向阳(虢镇中学)张栧悠(宝鸡中学)童文武(扶风高中)李涛(渭滨中学)李赞赞(蔡家坡高级中学)赵龙辉(虢镇中学)杜少强(石油中学)李丝雨(宝鸡中学)童伟超(扶风高中)姚明强(县功高中)海靖杰(扶风美阳中学)张辰(千阳中学)杨晓龙(蔡家坡高级中学)杨超(石油中学)李亚辉(石油中学)霍浩辉(扶风高中)杨波(宝鸡中学)王宜明(陕九中学)付伟龙(岐山高中)范帅(虢镇中学)侯家玮(凤翔中学)姚沛文(宝鸡中学)薛磊磊(凤翔中学)牛高阳(凤翔中学)苏佩荣(宝鸡中学)白向海(凤翔中学)郑西龙(凤翔中学)尹云超(陕九学校)杜仁杰(陕九学校)朱雄飞(扶风高中)马顺启(虢镇中学)舒航(眉县槐芽中学)杨鸿起(扶风高中)谢云棣(石油中学)王银辉(扶风绛帐高中)杜武航(宝鸡中学)杨蒙(陕九中学)张志斌(石油中学)梁帆(虢镇中学)张晓锋(凤翔中学)赵凯(扶风高中)姚楠(石油中学)姚乾刘景(烽火中学)刘力(岐山高级中学)王超飞(扶风高中)赛天(斗鸡中学)李欢(眉县槐芽中学)闫玉(虢镇中学)王凤宇(凤翔中学)王维嘉(扶风高中)张轩(石油中学)刘鑫(千阳中学)赵欣(斗鸡中学)师录平(紫荆中学)马云飞(凤翔中学)邹晓博(凤翔中学)淮荣华(扶风高中)李威(渭滨中学)范克敏(蔡家坡高级中学)康沛华(石油中学)齐晓冬(石油中学)高浩雄(西城高中)牛慧子(宝鸡中学)张超(眉县城关中学)王莹(蔡家坡高级中学)汪婷(法门高中)张稼骏(宝鸡中学)张强(凤翔中学)王明强(扶风高中)王莹(石油中学)吕昕(宝鸡中学)闫振飞(虢镇中学)张黎(凤翔中学)麻磊(凤翔中学)王萌(宝鸡中学)吴文刚(眉县槐芽中学)关亚博(西城高中)秦洋(宝鸡中学)左海亮(宝鸡中学)李丹丹(凤翔中学)薛航(扶风高中)宁晨飞(蔡家坡高级中学)徐露(扶风高中)霍青龙(虢镇中学)任明岗(千阳中学)冯亮(宝鸡中学)翟雯(石油中学)刘兴华(虢镇中学)马小鹏(陕九中学)李瑜(凤翔中学)陈勃生(彪角中学)吕宇飞(扶风高中)彭敏(眉县中学)席小东(柳林高级职业中学)高峰(烽火中学)冉峰利(千阳中学)李彦博(虢镇中学)李兵(麟游中学)何娜(姜城中学)徐欢(凤翔中学)。
2023年安徽高中化学竞赛成绩

2023年安徽高中化学竞赛成绩在2023年的安徽高中化学竞赛中,参赛学生的成绩引起了广泛关注。
化学作为一门重要的自然科学学科,对于培养学生的科学素养和实验技能有着重要的作用。
对于这个竞赛的成绩,我们有必要进行深入的分析和了解。
1. 考试成绩概况根据相关统计数据显示,2023年安徽高中化学竞赛的参赛人数达到了历史最高水平,展现出了学生对化学学科的浓厚兴趣和热情。
而参赛学生的成绩也呈现出了多样性和差异性,其中优秀成绩的学生表现出了扎实的化学基础知识和较强的解题能力,而一些学生也暴露出学科理解不够深刻和对实验操作技能的欠缺。
2. 成绩分析与反思针对2023年安徽高中化学竞赛的成绩,我们有必要深入分析其中的原因和影响。
从知识储备和应用能力方面来看,一些学生在学习化学的过程中存在着片面追求应试成绩和缺乏实际操作经验等问题。
这需要我们从教学内容和教学方法上进行反思和改进,更加注重学科知识的深度和广度,促进学生的综合应用能力的提升。
另外,值得关注的是,学生参加化学竞赛的积极性和主动性值得鼓励和肯定,但是我们也需要警惕参赛过程中的过度应试化倾向,应该注重学科的理解和实践能力的培养。
3. 对2023年竞赛成绩的个人理解作为一名教育工作者,我个人认为2023年安徽高中化学竞赛的成绩反映了学生对于化学学科学习的热情和积极性,在这一点上我们应该给予充分的肯定和鼓励。
成绩也揭示了教学中存在的一些问题和不足之处,这需要我们不断完善教学内容和方式,引导学生形成科学的学习方法和态度。
另外,化学竞赛可以帮助学生拓宽视野,提高学科素养和综合应用能力,这也为我们提供了一个改善教学的契机和方向。
总结回顾通过对2023年安徽高中化学竞赛成绩的分析和个人观点的表述,我们可以得出以下结论:竞赛成绩是学生综合素质的体现,需要我们多角度地理解和分析。
成绩既是教学质量的反映,也是教育改革的督促,需要我们坦诚面对和认真对待。
成绩只是学习的开始,我们更应该关注学科素养的培养和学生的综合能力的提升。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2023年安徽高中化学竞赛成绩正式公布!
在本次竞赛中,来自安徽各地的高中生们展现出了优异的化学知识和实践能力,在激烈的角逐中取得了优异的成绩。
以下是本次竞赛的成绩情况:
一、总体情况
1. 参赛人数:本次竞赛共有来自安徽各地的高中生参加,参赛人数达到XXX人。
2. 参赛学校:涵盖了安徽省的大部分高中学校,包括省内重点高中和乡村学校,共计参赛学校XXX所。
3. 竞赛科目:本次竞赛共设置了理论知识考试和实践操作两个科目,分别考察了学生的理论基础和实验技能。
二、成绩排名
1. 理论知识考试成绩:在理论知识考试中,经过激烈角逐,取得前十名的学生分别是:(排名不分先后,尊称学校开头三个字母)
- 张三,某某中学
- 李四,某某高中
- 王五,某某中学
- ...
2. 实践操作成绩:在实践操作环节,经过精密实验和操作,脱颖而出的学生也展现出了优异的实验能力,取得前十名的名次分别是:
- 王五,某某中学
- 刘六,某某高中
- 赵七,某某中学
- ...
三、优秀学校和指导老师
1. 优秀学校:本次竞赛中,参赛学校中涌现出了一批教学质量过硬、学风严谨的优秀学校,其中表现突出的学校包括:
- 某某中学
- 某某高中
- 某某学校
- ...
2. 优秀指导老师:在竞赛中,许多老师为学生们提供了精心的指导和辅导,他们的辛勤付出功不可没。
部分优秀指导老师包括:
- 张老师,某某中学
- 李老师,某某高中
- 王老师,某某学校
- ...
四、奖项设置和颁奖情况
1. 奖项设置:本次竞赛设立了一、二、三等奖以及优秀指导老师奖等多个奖项,以鼓励学生们努力学习化学知识,提高实践能力。
2. 颁奖情况:颁奖典礼将于XX月XX日在省会城市举行,届时将对各项奖项进行公开评选,并对获奖学生和老师进行表彰和颁奖。
五、展望与总结
在本次竞赛中,学生们展现出了扎实的化学知识和过硬的实践能力,不仅为安徽省中学化学教育注入了新的活力,也为未来的化学科研人才培养奠定了坚实的基础。
竞赛也凸显了一批优秀的高中学校和指导老师,他们的辛勤付出功不可没,为学生们的成长提供了坚实的支撑和指导。
希望通过此次竞赛,能够进一步激发学生对化学学科的兴趣,促进学
生们的科学素养和实践能力的提高,为安徽省的高中化学教育培养更多具有创新精神和实践能力的化学人才。
再次对所有参与竞赛的学生、学校和老师表示衷心的祝贺和感谢,期待未来更多精彩的化学竞赛活动!六、对于理论知识考试成绩的分析与思考
就本次竞赛而言,理论知识考试是考察学生对于化学理论知识的掌握情况。
从学生们的整体表现来看,大部分学生对化学基础理论知识的掌握情况良好,对于常见的化学反应、化学方程式的表示以及化学实验操作步骤等方面都表现出了较为扎实的基础。
然而,也有一部分学生在化学理论知识方面表现欠佳,主要原因可能包括学习方法不当、理论基础薄弱等因素。
在今后的化学教育中,应该重视对学生们基础知识的夯实和巩固,同时也要引导学生们培养积极主动的学习态度和方法,以提高他们的理论知识水平。
七、对于实践操作成绩的分析与思考
与理论知识考试相比,实践操作的考核更加强调学生的实验操作能力和实践能力。
在实践操作环节中,学生们需要独立完成一系列的化学实验,并根据实验结果进行分析和结论,这对学生的动手能力和实验方法的选择都提出了一定的挑战。
在本次竞赛中,许多同学表现出了出色的实验技巧和观察能力,他们
能够熟练地操作化学实验仪器,灵活运用实验方法,准确记录实验数据,并且能够通过实验结果进行科学的分析和推理。
这些优秀的实践
能力为我们看到了学生们潜在的科学研究能力和创新能力,他们有望
成为未来的化学科研人才。
然而,也有一些同学在实践操作中存在着一定的不足,如操作失误、
实验数据处理不当等问题。
这些问题可能与平时的实验训练不足以及
对于实验方法的不够熟悉有关。
我们应该重视实验教学的重要性,培
养学生灵活的实验操作技能和科学的实验态度,使他们在实践操作中
能够游刃有余。
八、对于学校和指导老师的表彰
本次竞赛中,成绩出色的学校和指导老师功不可没,他们的辛勤付出
和专业指导对于学生们的成绩提升起到了至关重要的作用。
我们高度
赞扬各学校和老师的教学质量和教学态度,他们不仅培养了一批批优
秀的化学学子,也为本次竞赛的顺利举行和取得优异成绩贡献了力量。
在此,我们发出诚挚的感谢和表彰为本次竞赛付出辛勤劳动的各位老
师和学校,在今后的工作中,我们期待各学校和老师能够再接再厉,
继续为学生们的成长奉献自己的智慧和心血。
九、奖项设置和颁奖典礼
为了鼓励和表彰在竞赛中表现突出的学生、学校和老师,我们对各项
奖项进行了设立,并将于X月X日在省会城市举行颁奖典礼。
届时,
将邀请相关领导和专家学者到场举行颁奖典礼,并对获奖学生和老师
进行公开表彰和颁奖。
颁奖典礼不仅是对于获奖者的表彰,也是对于全省中学化学教育的肯
定和激励。
希望通过颁奖典礼,能够进一步激发学生们对化学学科的
兴趣,促进学生们的科学素养和实践能力的提高,同时也为广大学校
和老师树立榜样和标杆,推动全省中学化学教育的不断进步和发展。
再次对所有参与竞赛的学生、学校和老师表示衷心的祝贺和感谢。
十、展望与总结
通过本次竞赛,我们看到了安徽省中学化学教育的蓬勃发展和辉煌成就。
学生们展现了出色的化学理论知识和实践能力,学校和老师们为
学生成绩突出付出了辛勤努力。
竞赛不仅仅是一场比赛,更是对学校、老师和学生的肯定和激励,也是对中学化学教育质量的检验和鼓励。
在未来,我们期待通过举办更多的化学竞赛和活动,更好地激发学生的学习兴趣和积极性,促进化学教育质量的提高,在新的历史时期迎接更高的挑战和更大的荣耀。
再次对所有参与竞赛的学生、学校和老师表示衷心的祝贺和感谢,期待未来更多精彩的化学竞赛活动!
以上是我对2023年安徽高中化学竞赛成绩发布的整体情况的分析,希望能够带给大家更加全面的了解。
也希望通过对成绩的分析和思考,能够为未来的化学教育和竞赛活动提供一些启发和帮助。
让我们共同期待更多的学生在化学领域获得优异成绩,为科学事业的发展贡献自己的力量!。
