苯胺结构简式
论文:苯胺及其衍生物结构与性质

苯胺及其衍生物的结构与性质摘要:苯胺是苯环上的氢原子被氨基(-NH2)取代而生成的一类重要有机化合物。
氨基决定了苯胺的特征化学性质,包括与它相连的苯环(苯基)受氨基的影响而表现出的一些特征性质。
很多有机化合物都属于路易斯碱,如醇、酯、烯烃等,但是有显著碱性的化合物乃是胺,它可以使石蕊变蓝。
苯胺同时具有碱性和亲核性,但还属于一种弱碱性化合物,其衍生物的性质同样应予以关注。
关键词:苯胺;碱性;供电子基团;吸电子基团;杂化1.引言苯胺是最重要的胺类物质之一,也是重要的化工原料[1]。
在染料工业中是很重要的中间体,可用于制造酸性墨水蓝G、酸性嫩黄等[2];在有机颜料方面有用于制造金光红、大红粉等[3-4];在农药工业中用于生产许多杀虫剂,如除草醚、毒草胺等[5-6];也是生产香料、塑料、清漆等的中间体;并可作为炸药中的稳定剂、汽油中的防爆剂等。
碱性在胺的分离、提纯和鉴定等方面上有着很重要的意义,芳香胺类化合物的碱性强弱比较,是有机化学中常见的一个问题。
由于芳香胺类化合物种类较多,不同的条件下又可产生不同碱性强弱顺序,所以在遇到实际问题时往往感觉难以准确进行判断[7]。
此探究总结出了一些简单的判断新方法,此方法在判别时易于掌握,且不易产生混淆,并且在使用判断的过程中,对芳香胺类化合物的碱性强弱又会有新的理解和认识。
2.苯胺的结构实验证明,胺和氨分子具有棱锥形结构,氮原子为sp3杂化,键角约109°。
在胺分子中,三个sp3轨道分别与氢原子的s轨道或碳原子的杂化轨道重叠形成三个σ键,剩下一对孤电子占据第四个sp3轨道,位于棱锥体的顶端。
而在苯胺中,C—N键键长为0.1400nm,比正常的C—N键(0.1470nm)短,N—H键(0.1000nm)也比NH3中的N—H键(0.1008nm)短;∠HNH为113.9°,HNH平面与苯环平面的二面角为39.4°(图1)。
说明苯胺中氮原子的杂化与酚中氧原子(sp2杂化)的杂化方式不同,属于sp3杂化。
苯胺

1.苯胺aniline苯分子中的一个氢原子为氨基取代而生成的化合物。
分子式C6H5NH2。
是最简单的一级芳香胺。
无色油状液体。
熔点-6.3℃,沸点184℃,相对密度1.02 (20/4℃),相对分子量93.128,加热至370℃分解。
稍溶于水,易溶于乙醇、乙醚等有机溶剂。
暴露于空气中或日光下变为棕色。
可用水蒸气蒸馏,蒸馏时加入少量锌粉以防氧化。
提纯后的苯胺可加入10~15ppm的NaBH4,以防氧化变质。
2.分子结构:苯环上的C原子以sp2杂化轨道成键,N原子以sp3杂化轨道成键。
苯胺苯胺呈碱性,与酸易生成盐。
其氨基上的氢原子可被烃基或酰基取代,生成二级或三级苯胺及酰基苯胺。
当苯胺进行取代反应时,主要生成邻、对位取代产物。
苯胺与亚硝酸反应生成重氮盐,由此盐可制成一系列苯的衍生物和偶氮化合物。
3.工业上主要采用两种方法生产苯胺①由硝基苯经活性铜催化氢化制备,此法可进行连续生产,无污染。
②氯苯和氨在高温和氧化铜催化剂存在下反应得到。
苯胺是重要的化工原料,主要用于医药和橡胶硫化促进剂,也是制造树脂和涂料的原料。
苯胺对血液和神经的毒性非常强烈,可经皮肤吸收或经呼吸道引起中毒。
4.理化特性主要成分:纯品外观与性状:无色或微黄色油状液体,有强烈气味。
pH:熔点(℃):-6.2沸点(℃):184.4相对密度(水=1): 1.02相对蒸气密度(空气=1): 3.22折光率(20℃):1.5863饱和蒸气压(kPa):2.00(77℃)燃烧热(kJ/mol):3389.8临界温度(℃):425.6临界压力(MPa): 5.30辛醇/水分配系数的对数值:0.94闪点(℃):70引燃温度(℃):无资料爆炸上限%(V/V):11.0爆炸下限%(V/V): 1.3溶解性:微溶于水,溶于乙醇、乙醚、苯。
主要用途:用于染料、医药、橡胶、树脂、香料等的合成。
其它理化性质:溶解度:3.6 g/100 mL,20 °C5.稳定性和反应活性稳定性:极易被空气中的氧气氧化。
有机化学

1、常温常压下为气态的有机物:1~4个碳原子的烃,一氯甲烷、新戊烷、甲醛。
2、碳原子较少的醛、醇、羧酸(如甘油、乙醇、乙醛、乙酸)易溶于水;液态烃(如苯、汽油)、卤代烃(溴苯)、硝基化合物(硝基苯)、醚、酯(乙酸乙酯)都难溶于水;苯酚在常温微溶与水,但高于65℃任意比互溶。
3、所有烃、酯、一氯烷烃的密度都小于水;一溴烷烃、多卤代烃、硝基化合物的密度都大于水。
4、能使溴水反应褪色的有机物有:烯烃、炔烃、苯酚、醛、含不饱和碳碳键(碳碳双键、碳碳叁键)的有机物。
能使溴水萃取褪色的有:苯、苯的同系物(甲苯)、CCl4、氯仿、液态烷烃等。
5、能使酸性高锰酸钾溶液褪色的有机物:烯烃、炔烃、苯的同系物、醇类、醛类、含不饱和碳碳键的有机物、酚类(苯酚)。
6、碳原子个数相同时互为同分异构体的不同类物质:烯烃和环烷烃、炔烃和二烯烃、饱和一元醇和醚、饱和一元醛和酮、饱和一元羧酸和酯、芳香醇和酚、硝基化合物和氨基酸。
7、无同分异构体的有机物是:烷烃:CH4、C2H6、C3H8;烯烃:C2H4;炔烃:C2H2;氯代烃:CH3Cl、CH2Cl2、CHCl3、CCl4、C2H5Cl;醇:CH4O;醛:CH2O、C2H4O;酸:CH2O2。
8、属于取代反应范畴的有:卤代、硝化、磺化、酯化、水解、分子间脱水(如:乙醇分子间脱水)等。
9、能与氢气发生加成反应的物质:烯烃、炔烃、苯及其同系物、醛、酮、不饱和羧酸(CH2=CHCOOH)及其酯(CH3CH=CHCOOCH3)、油酸甘油酯等。
10、能发生水解的物质:金属碳化物(CaC2)、卤代烃(CH3CH2Br)、醇钠(CH3CH2ONa)、酚钠(C6H5ONa)、羧酸盐(CH3COONa)、酯类(CH3COOCH2CH3)、二糖(C12H22O11)(蔗糖、麦芽糖、纤维二糖、乳糖)、多糖(淀粉、纤维素)、蛋白质(酶)、油脂(硬脂酸甘油酯、油酸甘油酯)等。
11、能与活泼金属反应置换出氢气的物质:醇、酚、羧酸。
2025届高考化学一轮总复习第9章有机化学基础第50讲羧酸及其衍生物

考向2 酯的结构与性质 例2从中药透骨草中提取一种抗氧化性活性成分结构如下。下列说法正确 的是( B )
A.该有机物分子属于芳香烃 B.苯环上氢原子发生氯代时,一氯代物有5种 C.其酸性水解的产物均可与Na2CO3溶液反应 D.1 mol该物质最多可与4 mol NaOH发生反应
解析 该有机物除含 C、; 该有机物苯环上有 5 种不同化学环境的氢原子,故其一氯代物有 5 种,B 正确;
[对点训练1] 化合物M(如图所示)是一种重要的材料中间体,下列有关化合 物M的说法中正确的是( B )
A.分子中含有三种官能团 B.可与乙醇、乙酸反应 C.所有碳原子一定处于同一平面 D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
解析 该有机化合物中含有碳碳双键、醚键、羟基、羧基4种官能团,A错 误;含有羟基可以和乙酸发生酯化反应,含有羧基可以和乙醇发生酯化反 应,B正确;双键上的碳原子和与该碳原子相连的碳原子处于同一平面,该物 质含有多个双键结构,即有多个平面结构,各平面之间由单键相连,单键可 以旋转,所以所有碳原子不一定处于同一平面,C错误;含有双键可以与溴发 生加成反应,使溴的四氯化碳溶液褪色,双键、羟基可以被酸性高锰酸钾溶 液氧化从而使其褪色,原理不同,D错误。
关键能力•提升
考向1 羧酸的结构与性质 例1(2023·全国乙卷)下列反应得到相同的产物,相关叙述错误的是( C )
①
+
②
+
A.①的反应类型为取代反应
B.反应②是合成酯的方法之一
C.产物分子中所有碳原子共平面 D.产物的化学名称是乙酸异丙酯
解析 本题考查有机化合物转化、有机化合物的命名及原子共面问题。 反应①是酸与醇反应生成酯和水,属于酯化反应,也是取代反应,A正确;反 应②能够生成酯,B正确;产物分子中异丙基的中间碳原子与相连的4个原 子形成四面体结构,所有碳原子不能共平面,C错误;形成这种酯的羧酸为乙 酸,醇为异丙醇,因此,该酯的名称为乙酸异丙酯,D正确。
苯胺的热值-概述说明以及解释

苯胺的热值-概述说明以及解释1.引言1.1 概述概述苯胺是一种重要的有机化合物,具有广泛的应用领域,包括颜料、染料、医药和农药等领域。
其热值是指在常温下燃烧1克苯胺所释放的热量。
苯胺的热值是通过测定其热力学性质来获得的,热值的测定方法可以提供对其能量特性和燃烧性能的理解。
热值的测定结果对于研究苯胺的燃烧过程、化学反应以及设计相关工艺过程具有重要的意义。
本文将对苯胺的热值进行探讨,包括其性质、热值的测定方法以及对测定结果的意义和应用。
通过对苯胺的热值进行深入研究,可以为该化合物的生产、应用和环境影响等方面提供重要的参考信息。
在接下来的章节中,我们将详细介绍苯胺的性质,包括其化学结构、物理性质和化学性质。
然后,我们将介绍苯胺的热值测定方法,包括燃烧热法和量热计法等。
最后,我们将总结苯胺的热值结果,并讨论其在相关领域的应用和意义。
通过本文的阅读,读者将对苯胺的热值有一个全面的了解,并可以进一步探索其在工业生产和科研领域的应用潜力。
1.2 文章结构文章结构部分的内容可以包括以下内容:本文共包括引言、正文和结论三个部分。
下面将对每个部分的内容进行介绍。
引言部分是文章的开端,目的是引起读者的兴趣,概述研究的背景和问题,并明确文章的目的。
首先,我们将概述苯胺这种化合物的基本信息和应用领域。
然后,简要介绍文章的结构,包括正文的主要内容和结论的要点。
最后,明确文章的目的,即探讨苯胺的热值方面的问题,并对其结果进行分析和应用。
正文部分是文章的核心部分,将详细介绍苯胺的性质和热值测定方法。
首先,我们将介绍苯胺的化学性质、物理性质和其他相关特性,包括其分子结构、熔点、沸点、溶解性等。
接着,我们将介绍苯胺热值的测定方法,包括常用的燃烧热量法、热容量法等。
通过详细介绍苯胺热值测定的原理、步骤和仪器设备,以及实验注意事项,我们可以更好地理解苯胺热值的测定过程和结果的可靠性。
结论部分是文章的总结部分,通过总结正文部分的内容,得出苯胺的热值结果,并探讨这些结果的意义和应用。
2021届高考化学大一轮微专题复习:分子结构与性质【解析版】

分子结构与性质1.乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是________、________。
乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是___________________________________________________________ _____,其中与乙二胺形成的化合物稳定性相对较高的是________(填“Mg2+”或“Cu2+”)。
答案sp3sp3乙二胺的两个N提供孤电子对与金属离子形成配位键Cu2+解析乙二胺分子中,1个N原子形成3个单键,还有一个孤电子对,故N原子价层电子对数为4,N原子采取sp3杂化;1个C原子形成4个单键,没有孤电子对,价层电子对数为4,采取sp3杂化。
乙二胺中2个氮原子提供孤电子对与金属镁离子或铜离子形成稳定的配位键,故能形成稳定环状离子。
由于铜离子半径大于镁离子,形成配位键时头碰头重叠程度较大,其与乙二胺形成的化合物较稳定。
2.FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为__________________________________________________,其中Fe的配位数为________。
(3)苯胺()的晶体类型是________。
苯胺与甲苯()的相对分子质量相近,但苯胺的熔点(-5.9 ℃)、沸点(184.4 ℃)分别高于甲苯的熔点(-95.0 ℃)、沸点(110.6 ℃),原因是___________________________________________________________ _____________。
(4)NH4H2PO4中,电负性最高的元素是________;P的________杂化轨道与O的2p轨道形成________键。
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。
高二化学下学期暑假巩固练习10 分子结构与性质

10 分子结构与性质例1.下列各组分子中,中心原子杂化轨道的类型和分子的空间构型均相同的是A.SO3与 BF3B.CH4与NH3C.CO2与NO2D.H2S与CCl4例2.下列对分子性质的解释中,不正确的是A.由酸性FCH2COOH>CH3COOH,可知酸性ClCH2COOH>CH3COOHB.乳酸()分子中含有2个手性碳原子C.碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释D.冰的密度比水小、氨气极易溶于水、邻羟基苯甲醛的沸点低于对羟基苯甲醛都能用氢键来解释1.下列现象与氢键有关的是①NH3的沸点比同族三、四周期元素的氢化物的沸点高②冰的密度比液态水的密度小③乙醇可以和水任意比互溶④水分子高温下也很稳定⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低A.①②③④⑤B.①②③⑤C.①②③④D.①③④⑤2.下列有关物质结构或性质的比较中,正确的是A.熔点:B.键角:C.键的极性:键键键D.热稳定性:3.已知吡咯中的各个原子均在同一平面内,其结构如下图所示。
则下列关于吡咯的说法正确的是A.吡咯的分子式为C4HNB.分子中含10个σ键C.分子中只有极性键D.分子中的大π键可用符号表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键中电子数,则吡咯的大π键应表示为4.下列说法错误的是A.BCl3分子中的4个原子位于同一平面B.1molSCl2分子中,S原子的价层电子对数目为4N AC.乙烯分子中C原子是sp2杂化,C、C之间用未参加杂化的2p轨道形成了π键D.ClO和CO的中心原子杂化类型均为sp3杂化5.下列分子空间结构和其VSEPR模型均一致的是A.NH3、CH4、SO3B.HCHO、HCN、CO2C.BF3、H2O、PCl3D.PCl3、CO2、CCl46.磷酸亚铁锂(LiFePO4)可作锂离子电池的正极材料。
工业上以FeCl3、NH4H2PO4、LiCl和苯胺()等为原料制备磷酸亚铁锂。
本章重点介绍胺的结构

第11章胺本章重点介绍胺的结构、分类和命名;胺的碱性及其影响因素;胺的酰化反应、与亚硝酸反应;重氮化反应;重氮化合物的性质及生源胺的基本概念。
氨(amonia)的烃基取代物称为胺(amine)。
胺及其衍生物是一类重要的有机化合物,这些化合物有的是生命的物质基础,如蛋白质、核酸、胆碱、胆胺、肾上腺素等,对人类的健康起着重要的作用;而有的则严重危害人类健康,如亚硝胺、海洛因、可卡因等;有的则在有机合成中作为特别重要的中间体,如重氮化合物等。
你在学完本章以后,应该能回答以下问题:⒈胺的结构特点是什么?⒉伯、仲、叔胺的化学性质有何异同之处?如何鉴别?⒊试比较胺和酰胺的化学性质。
⒋什么叫作重氮化反应?什么叫作偶联反应吗?⒌胺的碱性强弱取决于哪几种效应?你能举例说明吗?11.1 胺的结构、分类和命名11.1.1胺的结构温习提示:NH3的结构。
氮原子的电子构型是1s22s22p3,最外层有三个未成对电子,占据着3个2p轨道,氨和胺分子中的氮原子为不等性的sp3杂化,其中三个sp3杂化轨道分别与三个氢原子或碳原子,形成三个σ键,氮原子上的另一个sp3杂化轨道被一对孤对电子占据,位于棱锥形的顶端,类似第四个基团。
这样,氨的空间结构与甲烷分子的正四面体结构相类似,氮在四面体的中心。
如图11-1所示。
33H3H3H胺甲胺三甲胺图11-1 胺、甲胺和三甲胺的结构苯胺分子中,氨基的结构虽然与氨的结构相似,但未共用电子对所占杂化轨道的p成分要比氨多。
因此,苯胺氮原子上的未共用电子对所在的轨道与苯环上的p轨道虽不完全平行,但仍可与苯环的π轨道形成一定的共轭。
苯胺分子中氮原子仍稍现棱锥形结构,H-N-H键角113.9°,较氨中H-N-H键角(107.3°)大。
H-N-H平面与苯环平面的夹角为39.4°,如:图11-2 苯胺的结构当氮原子上连接有三个不同的原子或基团时,此氮原子成为手性氮原子,胺分子即为手性分子。
高中化学选择性必修三教案讲义:胺、酰胺(教师版)

胺酰胺1.认识胺的结构和性质及命名;2.认识酰胺的结构特征及主要性质;一、胺1.胺的定义、结构与分类(1)定义:氨分子中的氢原子被烃基取代而形成的一系列的衍生物称为胺。
(2)结构:胺的分子结构与氨气相似,都是三角锥形。
(3)分类:①根据氢原子被烷基取代的数目,可以将胺分为一级胺(伯胺)RNH 2、二级胺(仲胺)R 2NH 和三级胺(叔胺)R 3N 。
一级胺:一个氮原子连接两个氢原子和烃基,如甲胺(CH 3NH 2)、苯胺(C 6H 5NH 2),通式:RNH 2。
二级胺:一个氮原子连接一个氢原子和两个烃基,如二甲胺[(CH 3)2NH ]、吡咯烷(),通式:R 2NH 。
三级胺:一个氮原子连接三个烃基,如三甲胺[(CH 3)3N ]、通式:R 3N 。
②根据胺分子中含有氨基的数目,还可以将胺分为一元胺、二元胺、三元胺等。
③根据胺中的烃基R 的不同,分为为脂肪胺,如乙胺CH 3CH 2NH 2、芳香胺,如苯胺C 6H 5NH 2。
2.胺类化合物的命名普通命名法结构简单的胺常在烃基后直接加“胺”、如CH 3NH 2:甲胺、CH 3NHCH 3:二甲胺、C 6H 5NH 2:苯胺等。
名称书写需注意①表示基团用“氨”;②表示氨的烃类衍生物时用“胺”;③表示胺的盐用“铵”。
伯、仲、叔胺的意义伯、仲、叔胺中分别含有氨基(—NH 2)、亚氨基(—NH—)和次氨基()3.胺的物理性质(1)状态:低级脂肪胺,如甲胺、二甲胺和三甲胺等,在常温下是气体,丙胺以上是液体,十二胺以上为固体。
芳香胺是无色高沸点的液体或低熔点的固体,并有毒性。
(2)溶解性:低级的伯、仲、叔胺都有较好的水溶性,随着碳原子数的增加,胺的水溶性逐渐下降。
4.胺的化学性质:具有碱性(1)电离方程式:RNH2+H 2O RNH +3+OH-(2)胺与酸反应转化为铵①胺具有碱性,可与酸反应生成类似的铵盐。
乙胺与盐酸:CH 3CH 2NH 2+HCl→CH 3CH 2N H +3Cl -。
人教版高中化学选择性必修第3册 第3章 第4节 第2课时 羧酸衍生物——油脂与酰胺

4
一、油脂 1.油脂的形成、结构与分类 (1)形成:日常生活中食用的油脂是由高级脂肪酸 与甘油 形成的 酯,属于酯类化合物。
5
硬脂酸(C17H35COOH)、油酸(C17H33COOH)与甘油(丙三醇)反应 生成油脂的化学方程式分别为_3_C__17_H_3_5_C_O__O_H__+___
6
50
通过肥皂的制备实验,培养学生“实验探究与社会责任”的核心 素养。
51
双基 达标 随 堂 检 测
52
1.下列各组物质,既不互为同系物,又不互为同分异构体的是 ()
A.软脂酸甘油酯和硬脂酸甘油酯 B.甲酸甲酯和乙酸 C.苯甲醇和邻甲基苯酚 D.油酸甘油酯和乙酸甘油酯
53
D [根据同分异构体及同系物的定义可知,A 中两种物质互为 同系物;B 中两种物质互为同分异构体;C 中两种物质互为同分异构 体;D 中油酸甘油酯中含有碳碳双键,乙酸甘油酯中不含碳碳双键, 二者既不互为同系物,也不互为同分异构体。 ]
10
(2)油脂的氢化——油脂的加成反应 ①油脂氢化的定义 不饱和程度较高、熔点较低的 液态油,通过催化加氢可提高饱 和度,转变成 半固态的脂肪,这个过程称为油脂的氢化,也称油脂 的 硬化。 ②应用:制造人造脂肪(硬化油),防止了油脂的氧化变质,便于 储存和运输。
11
③油酸甘油酯氢化反应方程式为
。
,其中
叫做 酰基 ,
(3)常见酰胺的结构简式:
乙酰胺 酰胺
,苯甲酰胺
16
,N,N-二甲基甲
17
(4)酰胺(
)的水解反应方程式
①酸性(HCl 溶液):_R_C__O_N__H_2_+__H__2O__+__H_C__l―__―△__→__R_C__O_O__H_+_____
有机化学认识基团

甲烷CH4的形成 C:2s22p2
2)、杂化轨道理论 激发
2p 2s
杂化
2p 2s
键合
H
CH
H
H
四个sp3轨道
与四个氢轨道重叠
有机化合物中碳原子 C 以三种杂化轨道参与成键: sp3、sp2、sp杂化。中心原子的杂化轨道不同, 分子的空间 构型也不同。
乙烷的生成 sp3
2)、杂化轨道理论
乙烯的生成 p轨道
碱:接受质子的分子或离子
酸碱共轭关系:
酸
H+ + 碱
共轭酸碱对(只差一个质子!):
HCl H Cl
NH4
H NH3
H2O HOH H3O
HH2O
两性电解质(两性物) ——既能给出质子, 又能接受质子的分子或离子, 称为“两性电解质”, 简称“两性物” 。
注意: 1) H+本身既不是酸也不是碱, 它是酸碱之间传递的物质. 2) 酸越强, 其共轭碱越弱; 碱越强, 其共轭酸越弱。
sp2
H C
H
H C
H
2)、杂化轨道理论
离域π键或称共轭体系
p sp
苯分子的形成
乙炔的生成 p
1.09Å
376 kJ/mol
键能与键长比较
835 kJ/mol
420 kJ/mol
444 kJ/mol
611 kJ/mol
552 kJ/mol
1.6 有机化学中的酸和碱
1.6.1 Bronsted (布郎斯特) 酸碱质子理论 定义:酸:给出质子的分子或离子
C H 3 C HC H 2
CH3CHCH2CHCH3
CH3 OH O
CH3
CH2
烃基结构式——精选推荐

烃基结构式AZO-结构式N1(92-67-1) 4-氨基联苯4-Biphenylamine C12H11N 169N2(92-87-5) 联苯胺p-Diaminodiphenyl C12H12N2 184N3(95-69-2) 4-氯邻甲苯胺4-chloro-2-methylBenzenamineC7H8ClN 141N4(91-59-8) 2-萘胺2-Naphthalenamine C10H9N 143N5(97-56-3) 邻氨基偶氮甲苯o-Aminoazotoluene C14H15N3 225N6(99-55-8) 5-硝基-邻甲苯胺2-methyl-5-nitro- Benzenamine C7H8N2O2 C7H8N2O2 152N7(106-47-8) 对氯苯胺1p-Chloroaniline C6H6ClN 127N8(615-05-4) 2,4-二氨基苯甲醚1,3-Benzenediamine C7H10N2O 138N9(101-77-9) 4,4’二氨基二苯甲烷4,4-methylenediAniline C13H14N2 198N10(91-94-1) 3,3’二氯联苯胺3,3-Dichlorobenzidine C12H10Cl2N2 252N11(119-90-4) 3,3’二甲氧基联苯胺3,3-dimethoxyBenzidine C14H16N2O2 244N12(119-93-7) 3,3’二甲基联苯胺3,3-Dimethylbenzidine C14H16N2 212N13(838-88-0) 3,3’二甲基-4,4’二氨基二苯甲烷4,4-Diamino-3,3-dimethyldiphen2ylmethaneC15H18N2 226N14(120-71-8) 2-甲氧基-5-甲基苯胺2-methoxy-5-methyl-Benzenamine C8H11NO 137 4,4’-亚甲基-二-(2-氯苯胺)4,4-methylenebis[2-chloro- ]BenzenamineC13H12Cl2N2266N16(101-80-4) 4,4’二氨基二苯醚4,4-oxybisAnilineC12H12N2O 200N17(1-65-1) 4,4’二氨基二苯硫醚4,4-thiobisAniline C12H12N2S 216N18(95-53-4) 邻甲苯胺o-Toluidine C7H9N 107N19(95-80-7) 2,4-二氨基甲苯2,4-diamineToluene C7H10N2 12232,4,5-三甲H13N 1354-氨基偶氮12H11N3 197 邻氨基苯甲醚H9NO 123 2,4-二甲基苯H11N 121 N24(87-62-7) 2,6-二甲基苯胺2,6-Xylidine C8H11N 121N25(62-53-3) 苯胺AnilineC6H7N 934N26(106-50-3) 1,4-二氨基苯1,4-Benzenediamine C6H8N2 108D10(1719-06-8) 氘代蒽Anthracene-D10- C14D10 1885结构式的确定第3章第2节有机化合物结构的测定第2课时有机化合物结构式的确定【学习目标】1.根据分子式计算有机物的不饱和度2.有机化合物官能团的种类和位置的确定【课前预习】1、测定有机化合物的结构,关键步骤是判定_____________及_____________,进而确定分子中所含有的____________及___________.2、不饱和度的概念:不饱和度又称缺氢指数,即有机物分子中与碳原子数相等的开链烷烃相比较,每减少2个氢原子,则有机物的不饱和度增加1,用Ω表示不饱和度可以为测定分子结构提供是否含双键、三键或碳环等信息【情境导入】【学导结合】【合作探究1】有机化合物分子不饱和度的计算1、若某有机物只有C和H两种元素,总结不饱和度的计算公式?2、请举例说明几种常见官能团的不饱和度?【深化探究】若有机物中有X、O、N原子如何处理?【小结】不饱和度的计算:①烷烃和烷基的不饱和度0,其它烃分子的不饱和度=n(C)+1-;②若有机物为含氧化合物,在进行不饱和度计算时可不考虑氧原子③有机物分子中的卤素原子取代基,可视作氢原子计算④若含氮原子,就在氢原子总数中减去氮原子总数【成功体验】某链烃的化学式为C200H202,已知该分子中三键数与双键数之比是2:1.则其双键数目为:A、50 B、40 C、30 D、20【活动探究2】通过表格,熟记一些官能团的化学检验方法- 1 -【组内合作】常用的定性实验①能发生银镜反应或与新制Cu (OH)2悬浊液反应的:_________________________________ ②与Na钠反应H2的:______________________________________ ③与NaOH 等强碱反应的:_________________________ 有酸性基团的: __________________④与NaHCO3溶液反应产生气体的有机物:_______________________________________ 与Na2CO3溶液反应产生气体的有机物:______________________________________ ⑤能氧化成醛或羧酸的醇______________________能氧化成酮的醇_________________ ⑥能使溴水或Br2的CCl4溶液因反应而褪色:___________________________________ ⑦能使KMnO4(H+)溶液褪色:__________________________________________________ ⑧能发生显色反应的:___________________________________________________ ____ 试一试,你还能列举出那些性质?【总结反思】【课后练兵】1.国际奥委会公布的违禁药物目前有138种.某种兴奋剂的结构为关于它的说法中正确的是A.从结构上看,它属于芳香烃B.它的分子中所有的碳原子共平面C.该物质的分子式为C14H22ClNO2 mol该物质最多能与2 mol氢氧化钠反应2.某芳香族有机物的分子式为C8H8O2,它的分子(除苯环外不含其他环)中不可能有A. 两个羟基 B. 一个醛基 C. 两个醛基D. 一个羧基3、除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的是- 2 -4、2005年,全球发生了禽流感我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构式为:下列有关金丝桃素说法错误的是:..A.分子式为C17H23NO3B.可以发生取代、加成、酯化等反应C.苯环上的一氯取代物有3种D.1 mol金丝桃素最多能和6 mol H2发生加成反应2CHOCH2COOHCH2CH2OH5、某有机物的结构简式为,它在一定条件下可能发生的反应是①加成;②水解;③酯化;④氧化;⑤中和;⑥消去;⑦还原()A.①③④⑤⑥⑦B.①③④⑤⑦C.①③⑤⑥⑦D.②③④⑤⑥6、.分子式为C4H8O3的有机物,在一定条件下具有下列性质:①在浓硫酸作用下,能分别与CH3CH2OH和CH3COOH反应②在浓硫酸作用下也能脱水生成一种只存在一种结构形式,且能使溴水褪色的物质③在浓硫酸存在下,也能生成一种分子式为C4H6O2的无支链环状化合物根据上述性质,确定C4H8O3的结构简式为A . HOCH2COOCH2CH3 B. CH3CH(OH)CH2COOHC . HOCH2CH2CH2COOH D. CH3CH2CH(OH)COOH7.下列10种物质:①苯甲酸②苯酚③乙酸④乙酸乙酯⑤ -羟基乙酸⑥甲醛⑦溴水⑧NaOH溶液⑨钠⑩FeCl3溶液前五种物质中的一种能与后五种物质反应,后五种物质中的一种能与前五种物质反应,这两种物质是()A.③⑧B.②⑧C.②⑦D.⑤⑨8.(06江苏)胡椒粉是植物挥发油中的一种成分关于胡椒粉的下列说法:①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面;③它的部分异构体能发生银镜反应;④1mol该化合物最多可与2molBr2发生反应其中正确的是A.①③B.①②④C.②③D.②③④9.(06河南)茉莉醛具有浓郁的茉莉花香,其结构简式如下所示:- 3 -CHCHOCH2(CH2)3CH3关于茉莉醛的下列叙述错误的是A.在加热和催化剂作用下,能被氢气还原B.能被高锰酸钾酸性溶液氧化C.在一定条件下能与溴发生取代反应D.不能与氢溴酸发生加成反应10、某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢(1)A的结构简式为;(2)A中的碳原子是否都处于同一平面?(填“是”或者“不是”);(3)在下图中,D1 、D2互为同分异构体,E1 、E2互为同分异构体④、⑥的反应类型依次是11.(四川卷29).(16分)下图中A、B、C、D、E、F、G、H均为有机化合物回答下列问题:(1)有机化合物A的相对分子质量小于60,A能发生银镜反应,1molA在催化剂作用下能与3 mol H2反应生成B,则A的结构简式是___________________,由A生成B 的反应类型是;(2)B在浓硫酸中加热可生成C,C在催化剂作用下可聚合生成高分子化合物D,由C生成D的化学方程式是;(3)①芳香化合物E的分子式是C8H8Cl2E的苯环上的一溴取代物只有一种,则E- 4 -的所有可能的结构简式是_______________________________________________②E在NaOH溶液中可转变为F,F用高锰酸钾酸性溶液氧化生成G(C8H6O4)1 mol G与足量的NaHCO3溶液反应可放出L CO2(标准状况),由此确定E的结构简式是__________________________________________________ (4)G和足量的B在浓硫酸催化下加热反应可生成H,则由G和B生成H的化学方程式是___________________________________________________ __________________,该反应的反应类型是__________________________________________12、(6分)某有机物A分子式为CxHyOz,15gA完全燃烧生成22gCO2和9gH2O (1).计算该有机物的实验式(4分)(2)若该有机物的相对分子质量为60,且能发生银镜反应,确定该有机物可能的结构简式:(2分)_______________________ 、__________ ______- 5 -烷烃基础练习题烷烃基础练习题一、选择题1.下列烷烃,常温下呈气态的是( ) A.戊烷B.丁烷C.庚烷D.十二烷2.下列叙述正确的是( )A.分子式相同,各元素含量也相同的物质是同种物质B.通式相同的不同物质一定属于同分异构体C.分子式相同的不同物质一定是同分异构体D.相对分子质量相同的不同物质一定是同分异构体3.下列化学性质中,烷烃不具备的是( )A.可以在空气中燃烧B.可以与Cl2在光照下发生取代反应C.可以与溴水中的溴反应而使溴水褪色D.能使高锰酸钾溶液褪色4.下列有关饱和链烃的叙述正确的是( ) ①都是易燃物②特征反应是取代反应③相邻两个烷烃在分子组成上相差一个甲基A.①②③B.只有①C.①②D.只有③5.下列说法正确的是( )A.凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同分异构体关系B.两种化合物组成元素相同,各元素质量分数也相同,则二者一定是同分异构体C.相对分子质量相同的几种化合物,互称为同分异构体D.组成元素质量分数相同,且相对分子质量也相同不同化合物,互为同分异构体6.天然气、液化石油气(主要成分看作C3H8)燃烧的化学方程式分别是现有一套以天然气为燃料的灶具,改烧液化石油气,应采取的正确措施是( )A.空气和燃气的进气量都减小B.增大空气进入量或减少液化石油气进入量C.两种气体的进入量都增大D.减小空气进入量或增大液化石油气进入量7.下列说法不正确的是( )A.烷烃的同系物可用通式CnH2n+2表示B.同系物的化学性质相似C.同系物的物理性质相同D.同分异构体的化学性质一定不相似8.1mol乙烷在光照条件下,最多可以与多少摩尔Cl2发生取代反应( )A.4 mol B.8 mol C.2 mol D.6 mol9.下列说法正确的是( )A.相对分子质量相同的物质是同种物质B.相对分子质量相同的不同有机物不一定是同分异构体C.具有同一通式的物质属于同分异构体D.分子中含有碳和氢的化合物是烃类10.有一类组成最简单的有机硅化合物叫硅烷,它的分子结构与烷烃相似下列有关说法结构式、实验式等的区别分子式分子式是用元素符号表示物质(单质、化合物)分子的组成及相对分子质量的化学式有些物质确实由分子构成,在分子内原子间以共价键联结,而分子间以范德华力或氢键联结,这些物质就具有分子式如氧分子用O2 表示,氯化氢分子用HCl表示分子式不仅表示了物质的组成,更重要的,它能表示物质的一个分子及其成分、组成(分子中各元素原子的数目、分子量和各成分元素的重量比)所以分子式比最简式的含义广分子式和最简式不同,对化合物来说,它们的分子式是最简式的整数倍,或者说相对分子质量是最简式的整数倍仅当相对分子质量和最简式式量相同时,最简式才和分子式相同,这时最简式就是分子式当分子式相同时,也有可能不是一种物质,它们有可能是同分异构体例如氧的分子式是O2,表示1个氧分子由2个氧原子组成,分子量是又如乙酸的分子式是C2H4O2,表示1个乙酸分子由2个碳原子、4个氢原子和2个氧原子组成,分子量是水分子的分子式为H2O,它表示1个水分子由2个氢原子和1个氧原子组成(图:分子式和结构式)分子式可示出物质的名称、相对分子质量、一个分子中所含元素的原子数目及元素质量比等结构式用元素符号和短线表示化合物(或单质)分子中原子的排列和结合方式的式子.如甲烷的分子结构式可以表示为:H∣H—C—H∣H结构式用—、=、≡分别表示1、2、3对共用电子;用→表示1对配位电子,箭头符号左方是提供孤对电子的一方,右方是具有空轨道、接受电子的一方结构式可以在一定程度上反映真正的分子结构和性质,但不能表示空间构型,如甲烷分子是正四面体,而结构式所示的碳原子和四个氢原子却都在同一平面上确定一个化合物的结构是一件相当艰巨而有意义的工作.测定有机化合物的方法有化学方法和物理方法.化学方法是把分子打成“碎片”,然后再从它们的结构去推测原来分子是如何由“碎片”拼凑起来的.这是人类用宏观的手段以窥测微观的分子世界.50年代前只用化学方法确定结构确实是较困难的.例如,很出名的麻醉药东莨菪碱,是由植物曼陀丹中分离出来的一种生物碱,早在1892年就分离得到,并且确定其分子式为C17H21O4N.但它的结构式直到1951年才肯定下来.按照现在水平来看,这个结构并不太复杂.近年来,应用现代物理方法如X衍射、各种光谱法、核磁共振谱和质谱等,能够准确、迅速地确定有机化合物的结构,大大丰富了鉴定有机化合物的手段,明显地提高了确定结构的水平.分子结构包括了分子的构造、构型和构象.构造是分子中原子成键的顺序和键性.以前叫做结构,根据国际纯粹和应用化学联合会的建议改为“构造”.表示化合物的化学式叫做构造式.由于有机化合物中存在着同分异构现象,因此一个分子式可能代表两种或两种以上具有不同结构的物质.在这种情况下,知道了某一物质的分子式,常常可利用该物质的特殊性质,通过定性或定量实验来确定其结构式.结构式不同而化学式相同不一定是同一种物质,其性质也往往不一样吗比如各种有机物的同分异构体,化学式相同,但是结构式不一样,就显示出性质的差异更不必说相同化学式的不同类物质,比如甲醚和乙醇的分子式均为C2H6O,但其结构不同结构简式(通常只适用于以分子形式存在的纯净物,如有机分子)是把分子中各原子连接方式表示出来的式子将有机物分子结构式中的C-C键和C-H键省略不写所得的一种简式如,丙烷的结构简式为CH3CH2CH3,乙烯为CH2=CH2等最简式最简式又叫实验式,它是仅能表示化合物组成中各元素原子数目的比例的化学式一般用于两种情况:1.无机物中表示在通常情况下,不以单一的真实分子形式存在的化合物的组成如离子化合物无水氯化钙、硫酸钾、氯化钠、氢氧化钠等,通常分别用最简式CaCl2、K2SO4、NaCl、NaOH 表示晶体以原子间的共价键结合形成的物质(原子晶体)也常用最简式表示,如金刚石用C表示,碳化硅用SiC表示等化学式以单个分子形式表示有困难时用最简式表示如红磷的化学式直接表示为P同类单质或有相同元素组成比例的化合物的简写例如白磷P4可简单表示为P(也可以以此表示白磷、红磷等不确定的同素异型体的单质混合物的组成);P4O10简写为P2O5,称为五氧化二磷;硫蒸气中含有S2、S4、S8等分子,统一表示成S2.表示有机化合物的组成在有机物中,由于碳之间可以成键,种类很多,而因为最简式仅表示为组成物质分子中原子的最简整数比,所以不同的化合物可以有相同的最简式例如苯和乙炔的最简式均为CH;单烯烃(通式CnH2n)的最简式都为CH2此外同分异构体的分子式相同,因此最简式也相同应当注意的是,当且仅当最简式和分子式相同时,最简式才表示物质的一个真实分子(表示分子的真实组成及分子量)关于最简式和实验式,虽然一般认为是同义词,但习惯上表达侧重点不同最简式是对于已经确定元素组成物质的化学式,其中各元素原子个数比一般为互质的整数;实验式则无此限制【化学式】用元素符号表示纯净物质组成的式子化学式不仅表示该物质由哪些元素组成,还表示其中各元素原子数目的相对比数,利用化学式还可以计算出式量化学式有实验式(最简式)、分子式、结构式、示性式、电子式等【实验式】又称最简式,是化学式的一种用元素符号表示化合物分子中元素的种类和各元素原子个数的最简整数比的式子在有机化合物中经常会出现不同的化合物具有相同的实验式,例如乙炔(C2H2)和苯(C6H6)的实验式都是CH,甲醛(CH2O)和乙酸(C2H4O2)的实验式都是CH2O 等已知化合物的最简式和分子量,就可以求出它的分子式有些物质的实验式就是它的分子式,如甲醛CH2O和水H2O 等离子化合物晶体通常不是以分子状态存在,在实际应用上就用实验式来表示这类物质中各元素原子数目的比例关系,如NaCl表示氯化钠晶体中钠离子与氧离子数之比是1∶1分子式和结构式的确定考点48有机物分子式和结构式的确定复习重点1.了解确定有机物实验式、分子式的方法,掌握有关有机物分子式确定的计算;2.有机物分子式、结构式的确定方法难点聚焦一、利用有机物燃烧反应的方程式进行计算有关化学方程式3n1点燃烷烃CnH2n+2+O2 nCO2+(n+1)H2O23n点燃烯烃或环烷烃CnH2n+O2 CO2+nH2O2炔烃或二烯烃CnH2n2+(n-1)H2O苯及苯的同系物CnH2n6+(n-3)H2O3n3点燃O2 nCO2+2 3n1点燃O2 nCO2+23n点燃饱和一元醇CnH2n+2O+O2 nCO2+(n+1)H2O23n1点燃饱和一元醛或酮CnH2nO+O2 nCO2+nH2O 2饱和一元羧酸或酯CnH2nO2+nH2O3n2点燃O2 nCO2+23n1点燃饱和二元醇CnH2n+2O2+O2 nCO2+2(n+1)H2O饱和三元醇CnH2n+2O3+(n+1)H2O由上可知,相同碳原子数的烯烃(环烷烃)与一元饱和醇完全燃烧时,耗氧量相同(把3n2点燃O2 nCO2+2CnH2n+2O看成CnH2n·H2O:相同碳原子数的炔烃(二烯烃)与醛(酮)及饱和二元醇完全燃烧时,耗氧量相同(醛:CnH2nO→CnH2n2·H2O 饱和二元醇:CnH2n+2O2→CnH2n2·2H2O);相同碳原子数的羧酸(酯)与三元醇完全燃烧,耗氧量相同(羧酸:CnH2nO2→CnH2n4·2H2O饱和三元醇:CnH2n2O3→CnH2n2·3H2O) 二、通过实验确定乙醇的结构式由于有机化合物中存在着同分异构现象,因此一个分子式可能代表两种或两种以上具有不同结构的物质在这种情况下,知道了某一物质的分子式,常常可利用该物质的特殊性质,通过定性或定量实验来确定其结构式例如:根据乙醇的分子式和各元素的化合价,乙醇分子可能有两种结构:为了确定乙醇究竟是哪一种结构,我们可以利用乙醇跟钠的反应,做下面这样一个实验实验装置如右下图所示在烧瓶里放入几小块钠,从漏斗中缓缓滴入一定物质的量的无水乙醇乙醇跟适量钠完全反应放出的H2把中间瓶子里的水压入量筒通过测量量筒中水的体积(应包括由广口瓶到量筒的导管内的水柱的体积),就可知反应生成的H2的体积讨论2 下面是上述实验的一组数据:根据上述实验所得数据,怎样推断乙醇的结构式是(1),还是(2)呢?由于mol C2H6O与适量Na完全反应可以生成L H2,则molC2H6O与Na反应能生成L H2,即mol H2,也就是1 mol H这就是说在1个C2H6O分子中;只有1个H可以被Na所置换,这说明C2H6O分子里的6个H中,有1个与其他5个是不同的这一事实与(1)式不符,而与(2)式相符合因此,可以推断乙醇的结构式应为(2)式问题与思考1.确定有机物分子式一般有哪几种方法?2.运用“最简式法”确定有机物分子式,需哪些数据?3.如何运用“商余法”确定烃的分子式?问题与思考(提示)1、最简式法;直接法;燃烧通式法;商余法(适用于烃的分子式的求法等2、①有机物各元素的质量分数(或质量比)②标准状况下的有机物蒸气的密度(或相对密度)3、则为烯烃,环烷烃.②若余数=2,则为烷烃.③若余数=-2,则为炔烃.二烯烃④若余数=-6,则为苯的同系物.若分子式不合理,可减去一个C原子,加上12个H原子有机物分子式的确定典型例题例题精讲一、有机物分子式的确定【例1】实验测得某碳氢化合物A中,含碳80%、含氢20%,求该化合物的实验式又测得该化合物的相对分子质量是30,求该化合物的分子式【解】:(1)实验式是表示化合物分子所含各元素的原子数目最简单整数比的式子,求化合物的实验式即是求该化合物分子中各元素原子的数目(N)之比=1∶3 该化合物的实验式是CH3(2)设该化合物分子中含有n个CH3,则:该化合物的分子式是C2H6答:该碳氢化合物的实验式是CH3,分子式是C2H6【例2】某有机物A完全燃烧后,生成mol CO2和,测得该化合物的蒸气与空气的相对密度是,求该化合物的分子式【分析】根据实验,该有机物燃烧的产物只有CO2和H2O,因此,该有机物中一定含有C和H;至于O,由于其可能全部来自于燃烧时空气所提供的氧气,也可能来自于该有机物本身因此,该有机物分子中是否含有O,还需要通过计算反应物中C、H质量之和并与该有机物质量进行比较后,才能作出判断该有机物的相对分子质量,则可以利用实验测出的相对密度来求【解】:(1)求该有机物中组成元素的质量:C: C →CO2 12 44m(C)44g/mol×=H:2H →H2O 2 18 m(H)=m(C)+m(H)=+=<该有机物中C的质量与H的质量之和()小于该有机物的质量(),因此该有机物A中还含有O,其质量为:m (O)=m(A)-m(C)-m(H)=-= (2)求该有机物的相对分子质量:Mr(A)=d×Mr(空气)=×29 =46(3)求该有机物分子中各元素原子的数目:答:该有机物的分子式是C2H6O【例3】某饱和一元醇A,与足量的金属钠反应,生成氢气112mL(标准状况)求该一元醇的分子式【解】:饱和一元醇的通式为CnH2n+1OH,该一元醇的摩尔质量为M(A)=60g/mol该一元醇的相对分子质量是60 根据该一元醇的通式,有下列等式:12n+2n+1+16+1=60 n=3 答:该一元醇的分子式是C3H7OH 二、通过实验确定乙醇的结构式[例4] 某烃含碳氢两元素的质量比为3∶1,该烃对H2的相对密度为8,试确定该烃的分子式.分析:解法一:Mr=2×8=16,M=16g·mol-1,1mol烃中含C、H的物质的量为:所以该烃的分子式为CH4.解法二:烃分子中C、H原子个数比为:最简式为CH4,式量为16.因为Mr=16,故该烃的分子式为CH4.答案:CH4 [例5] 已知第一种气态有机物在标准状况下的密度为/L,第二种气态有机物对空气的相对密度为,第三种气态有机物在标准状况下250mL质量为.求这三种有机物的相对分子质量.分析:计算相对分子质量有三种不同方法1.根据标准状况下气体的密度计算相对分子质量.根据标准状况的气体密度计算气体的摩尔质量,其数值即为相对分子质量.M=×d 如第一种有机物M=×=58 2.根据气体相对密度计算相对分子质量.M=DA×MA用相对密度乘相对气体的相对分子质量.如第二种有机物M=×29=54 3.根据标准状况下,一定质量气体的体积计算相对分子质量.答案:58、54、44[例6] 某气态碳氢化合物中含碳75%,它的密度是同温同压下氢气密度的8倍,求有机物的分子式.分析:计算推断分子式此题有三种方法1.基本方法:先根据测得的气体密度计算气体的摩尔质量,然后计算1mol气态有机物中各元素原子的物质的量,最后确定该气态有机物的分子式.M=8×2=16所以该有机物的分子式为CH42.最简式法:根据已知先求出摩尔质量,再据质量分数求出碳氢原子个数比,然后找到最简式式量与相对分子质量的关系,最后确定分子式.M=8×2=16所以最简式为CH4 其式量=16 设分子式为(CH4)n因为最简式式量=相对分子质量所以分子式就是最简式,即为CH43.商余法:根据碳氢化合物中对其相对分子质量碳、氢原子的影响大小,用碳相对原子质量除以相对分子质量,所得商的整数部分就是烃分子中所含碳原子数的最大值,而余数就是氢原子数的最小值.注意从为CH4[例7] 某烃,完全燃烧生成和,经测定这种烃在标准状况下的密度为/L则其分子式是[ ]A.CH4 B.C3H8 C.C4H10 D.C6H12分析:本题是计算推断分子式的又一种类型,就是利用烃的完全燃烧反应方程式列出比例式求解类型.设烃分子式为CxHy,则有解得x=6 y=12 答案:D.[例题8] 某有机物A完全燃烧后,生成和H2O,测得该化合物的蒸气与空气的相对密度是,求该化合物的分子式.分析:根据实验,该有机物燃烧的产物只有CO2和H2O,因此,该有机物中一定含有C和H;至于O,由于其可能全部来自于燃烧时空气所提供的氧气,也可能来自于该有机物本身.因此,该有机物分子中是否含有O,还需要通过计算反应物中C、H质量之和并与该有机物质量进行比较后,才能作出判断.该有机物的相对分子质量,则可以利用实验测出的相对密度来求.(1)求该有机物中组成元素的质量:C: C ——→CO2 12 44m(C)44g/mol×= H:2H ——→H2O 2 18 m(H)=m(C)+m(H)=+=<该有机物中C的质量与H的质量之和()小于该有机物的质量(),因此该有机物A中还含有O,其质量为:m(O)=m(A)-m(C)-m(H)= = (2)求该有机物的相对分子质量:Mr(A)=d×Mr(空气)=×29 =46(3)求该有机物分子中各元素原子的数目:答案:该有机物的分子式是C2H6O.[例9] 标准状况下,密度为/L的某气态烃,在足量氧气中充分燃烧,反应后的气体先通过无水氯化钙,氯化钙增重;再通过氢氧化钠溶液,溶液增重.通过计算判断此气态烃的分子式,并画出其分子空间结构的示意图.分析:本题是在已知有机物完全燃烧时,涉及的有关物质量关系,判断其分子组成的典型定量计算题.其解法有三种.第一种解法是通过该烃燃烧生成的CO2和H2O的量,即本题中燃烧生成气体经过NaOH溶液和无水氯化钙后,两者增重的量,计算出烃中的C、H元素的质量比,进而求得实验式.再根据题中该气态烃在标准状况下的密度,求得其相对分子质量.最后由实验式和相对分子质量.判断它的分子组成.然而本题所给数据,求得实验式为CH4.依据烃的分子组成中,C原子个数为n时,H原子的最多个数不大于(2n+2)个的规律,即可确定此实验式就是所求的分子式.第二种解法是通过烃的燃烧通式:计算该烃1mol完全燃烧时,生成CO2和H2O物质的。
2023届高考化学专项小练有机化学基础2

有机化学基础(选考)1.(2021届·江苏高三月考)药物瑞德西韦(Remdesivir )对2019年新型冠状病毒(NCP)有明显抑制作用;K 为药物合成的中间体,其合成路线如下:已知:①2SOCl ,催化剂△R-OH R-Cl −−−−−−−→ ②回答下列问题:(1)H 中官能团的名称为_______。
(2)E →F 的反应类型为_______。
(3)由C 生成D 的过程中可能存在的副产物()18146I C H NO P 的结构简式为_______。
(4)X 是A 同分异构体,写出满足下列条件的X 的结构简式:_______。
①含有硝基的芳香族化合物;②既能发生水解反应,又能发生银镜反应;③核磁共振氢谱有四组峰。
(5)设计由苯甲醛为原料制备化合物的合成路线_______ (无机试剂任选)。
【答案】(1)酯基、氨基 (2)加成反应(3)(4)HCOO 22CH NO 或2HCOOCH 2NO(5) HCN 催化剂−−−→3NH −−−→−−−−−→+2H /H OΔ2SOCl −−−−−→ 催化剂Δ−−−−−→【解析】由题中信息可知,A 的结构简式为,B 的结构简式为,B 发生信息1的反应生成C ,则C 的结构简式为,C 与发生取代反应生成D ,D 的结构简式为,E发生信息2的反应生成F,F发生取代反应、水解反应得到G,G的结构简式为,根据G结构简式逆推F的结构简式为HOCH2CN,E的结构简式为HCHO,G和发生酯化反应生成H,H的结构简式为,H与D发生取代反应生成I,I的结构简式为。
(1)H的结构简式为,该结构中含酯基、氨基;(2) E的结构简式为HCHO,与HCNHOCH2CN,属于加成反发生信息1的反应生成F,F的结构简式为HOCH2CN,即HCHO+HCN→催化剂应;(3)C的结构简式为,该结构中有两个Cl,均可与I C H NO P的结构简式为;(4)A 发生取代,则副产物()18146的结构简式为,分子式为C8H7NO4,X是A同分异构体,满足下列条件,①含有硝基的芳香族化合物,即结构中含苯环和硝基;②既能发生水解反应,又能发生银镜反应,可判断甲酸酯;③核磁共振氢谱有四组峰,可判断该结构中有四种H,满足上述条件的X的结构简式为或;(5) 苯甲醛与HCN 发生信息2反应生成,继续与NH 3反应生成,继续在酸性条件下水解生成,继续与SOCl 2发生信息1反应生成,接着2分子生成,合成线路为HCN 催化剂−−−→3NH −−−→−−−−−→+2H /H O Δ2SOCl−−−−−→ 催化剂Δ−−−−−→ 。
有机化学复习题(2012期末考试)答案
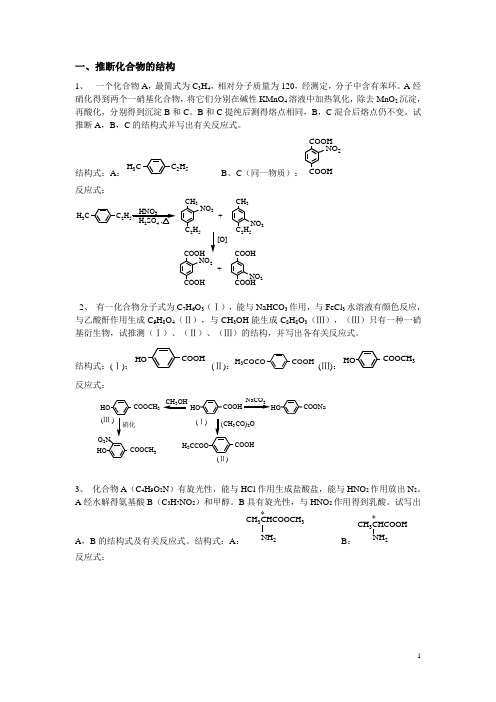
一、推断化合物的结构1、 一个化合物A ,最简式为C 3H 4,相对分子质量为120,经测定,分子中含有苯环。
A 经硝化得到两个一硝基化合物,将它们分别在碱性KMnO 4溶液中加热氧化,除去MnO 2沉淀,再酸化,分别得到沉淀B 和C 。
B 和C 提纯后测得熔点相同,B ,C 混合后熔点仍不变。
试推断A ,B ,C 的结构式并写出有关反应式。
结构式:A :C 2H 5H 3C B 、C (同一物质):COOHNO 2反应式:C 2HH 3CCH 3C 2H 5NO 2+CH 3C 2H 5NO 2[O]COOHCOOHNO 2+COOH COOH NO 22、 有一化合物分子式为C 7H 6O 3(Ⅰ),能与NaHCO 3作用,与FeCl 3水溶液有颜色反应,与乙酸酐作用生成C 9H 8O 4(Ⅱ),与CH 3OH 能生成C 8H 8O 3(Ⅲ),(Ⅲ)只有一种一硝基衍生物,试推测(Ⅰ)、(Ⅱ)、(Ⅲ)的结构,并写出各有关反应式。
结构式:(Ⅰ):COOHHO(Ⅱ):COOHH 3COCO(Ⅲ):COOCH 3HO反应式:HO COOCH 3HOH 3NaCO 3COONaHO CH 3OHCOOCH 3HOO 2N (Ⅰ(Ⅲ )CO)2O(Ⅱ)3、 化合物A (C 4H 9O 2N )有旋光性,能与HCl 作用生成盐酸盐,能与HNO 2作用放出N 2。
A 经水解得氨基酸B (C 3H 7NO 2)和甲醇。
B 具有旋光性,与HNO 2作用得到乳酸。
试写出A ,B 的结构式及有关反应式。
结构式:A : *CH 3CHCOOCH 3NH 2B :*CH 3CHCOOH2反应式:**CH 3CHCOOCH 3NH 2CH 3CHCOOHNH 2HNO 2HNO 2CH 3CHCOOCH 3OH+ N (A)(B)2O /H +CH 3CHCOOH OH CH 3CHCOOCH 3NH 3+Cl -+ CH 3OH(乳酸)+ N **4、 某化合物A 经测定含C 、H 、O 、N 四种元素,A 与NaOH 溶液共煮放出一种刺激性气体,残余物经酸化后得到一个不含氮的物质B ,B 与LiAlH 4反应后得到C ,C 用浓H 2SO 4处理后得到一烯烃D ,该烯烃的相对分子质量为56,经臭氧化并还原水解后得到一个醛和一个酮。
有机化合物的结构和命名

3.有机化合物分子结构表示法
路易斯电子式: 凯库勒式:
结构简式: 键线式:
二、有机化合物的分类
按碳架
化合物类别官能团名称(结构)举例
烯烃碳碳双键C=C
炔烃碳碳三键
卤代烃卤素F, Cl, Br, I
醇及酚羟基-OH
硫醇及硫酚巯基-SH
醚键-O-
硫醚键-S-
2.按官能团
醛基-CHO
酮基(羰基)-CO-
COOH
H
OH
CH3
R/S命名原则
优先次序-OH>-COOH>-CH3
顺时针 R-型
名称 R-(-)-乳酸
投影式
COOH
CH3
OH
H
HOOC
CH3
OH
H
C
构型的表示方法
费歇尔投影式
透视式
COOH
CH3
OH
H
H
COOH
CH3
HO
(-)-乳酸
(+)-乳酸
D-(-)-乳酸 D/L法
顺反异构体的性质
熔点: 130.5 oC pKa1 1.83 pKa2 6.07
熔点: 286.5 oC pKa1 3.03 pKa2 4.44
顺反异构体对化学性质的影响
顺反异构体对生理活性的影响
例如:生物体内的甘油脂肪酸中不饱和羧酸中的碳谈双键一般为Z构型,而维生素A侧链上的碳谈双键都为E构型。若改变它们的构型,生理活性降低甚至完全丧失。
01
02
3、对映异构
光是一种电磁波,光波的振动方向与其前进方向垂直。
01
普通光在所有垂直于其前进方向的平面上振动。
02
平面偏振光
物质的旋光
羧酸、羧酸的衍生物(第4课时 胺、酰胺)高二化学(人教版2019选择性必修3)

酰胺
酰胺是羧酸分子中羟基被氨基所替代得到的化合物。
或取代的氨基(-NRR’) (R和R’可以是氢原子或烃基)
O
酰胺结构一般表示为:R C NH2
O RC
O
酰基
C NH2 酰胺基
酰胺的化学性质
胺类化合物具有碱性可与强酸反应生成有机铵盐,如苯胺与盐酸反应
的化学方程式为
苯胺盐酸盐
用途:胺的用途很广,是重要的化工原料。例如,甲胺和苯胺都是合成 医药、农药和染料等的重要原料。
若干个CH2。 2.酰胺与酯类化学性质有什么相似性?
提示:二者均可以在酸性、碱性条件下发生水解反应。
思考:尿素的水解产物是什么?
O
CO2+H2O
NH2—C—NH2+2H2O
催化剂 △
×H2CO3+2NH3
O NH2—C—NH2+H2O催化△ 剂
CO2+2NH3
【思考与讨论】
洗涤丝绸质衣物,能否选用肥皂或洗衣粉进行清洗? 为什么最好用洗发水进行清洗?
的化学方程式为
苯胺盐酸盐
CH3—NH2+HCl (CH3)2NH+HCl (CH3)3N+HCl
CH3—NH3Cl (CH3)2NH2Cl (CH3)3NHCl
注意: “氨”“铵”“胺” 的区别 氨指氨气(NH3);铵一 般出现在铵盐中;胺 是指一类含氨基(NH2)的有机物。
PART 02
酰胺
…
胺的物理性质
(1)低级胺是气体或易挥发液体,气味与氨相似,高级胺为固体,胺 的沸点比相对分子质量相近的烃高,但比醇和羧酸的沸点低。
(2)胺都能与水分子形成氢键,低级胺易溶于水,碳原子数增加胺的 溶解度迅速降低,6个碳以上的胺难就溶于水。
(3)芳香胺的毒性很大,能致癌。
用系统命名法命名各类化合物或写出化合物的结构式
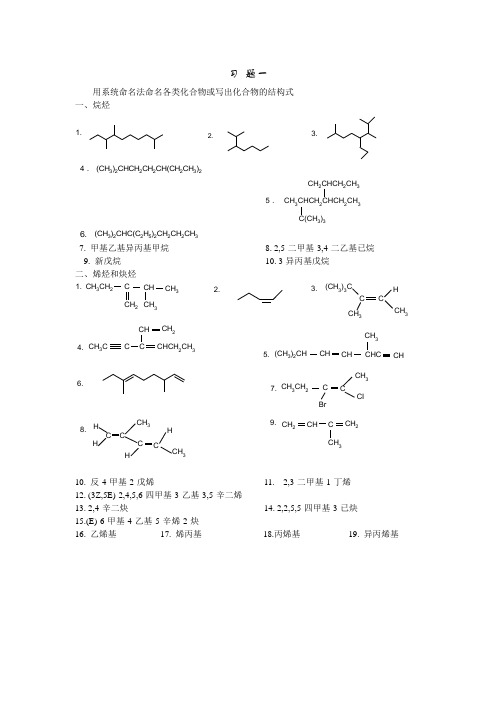
习题一用系统命名法命名各类化合物或写出化合物的结构式一、烷烃(CH3)2CHCH2CH2CH(CH2CH3)2CH2CHCH2CH3CH3CHCH22CH33)35.(CH3)2CHC(C2H5)2CH2CH2CH37. 甲基乙基异丙基甲烷8. 2,5-二甲基-3,4-二乙基已烷9. 新戊烷10. 3-异丙基戊烷二、烯烃和炔烃CH3CH2C CH CH3CH2CH3(CH3)3CC CHCH33CH3C C CCH CH2CHCH2CH3(CH3)2CH CH CH CHCCH3CHCH3CH2C CCH3CIBrHHCCH3HCHCH3CCCH2CH C CH2CH310. 反-4-甲基-2-戊烯11. 2,3-二甲基-1-丁烯12. (3Z,5E)-2,4,5,6-四甲基-3-乙基-3,5-辛二烯13. 2,4-辛二炔14. 2,2,5,5-四甲基-3-已炔15.(E)-6-甲基-4-乙基-5-辛烯-2-炔16. 乙烯基17. 烯丙基18.丙烯基19. 异丙烯基三、脂环烃1.2.C H 3CH 3CH 3CH 3.CH 2CH 3CH 3 4.5.CH 3HCH 3H6.C(CH 3)37.HCH 3H CH315. 顺-1-甲基-3-乙基环丁烷 16. 1,4-二甲基双环[2,2,2]辛烷 17. 螺[2,2]戊烷 18. 双环[4,4,0]庚烷 19. 螺[4,5]-1,6-癸二烯 20. 1-环已烯基环已烯 四、芳烃及其衍生物C 2H 5CH(CH 3)2CH 2CHCHCH(CH 3)2C 2H 5O 2NBrCH 3CHCH 2CH 2CH 2CH 3SO 3HNO 2CH 3ClCH 32CH 3CH 3BrICH3OCHCOOH311. 本苯甲烷 12. 间氯苯基乙炔 13. 异丙苯 14. 1,5-二硝基萘 15. 对氯苄氯 16. 9-溴代菲 17. β-蒽醌磺酸 18. 2-硝基-3′-氯联苯19. 间二乙烯基苯 20. 3-环已基甲苯五、卤代烃的命名CH2ClCH 2CH 2CH 2ClCH(CH 3)2ClBrClBrCH 3BrCH 3ClClC CCH 3H HCH 2BrBrCH 3F 2CCF211. 烯丙基氯 12. 叔丁基溴 13. 4-甲基-5-氯-2-戊炔 14. 偏二氯乙烯 15. 二氟二氯甲烷 16. 1-苯基-2-溴乙烷 17. 苄氯 18. (Z)-3-溴乙基-4-溴-3-戊烯-1-炔 六、醇、酚、醚OHC CH 3CH 3CH 3HOCH 2CH 2CH 2OHOHOHOHCH 2OH(CH 3)2CHCH2CHCH 2OH39.OH CH 3NO 210.OH OH11.OC 2H 512.CH 3OCH(CH 3)213.C 6H 5CH 2OCH 2CHCH 214.CH 33OH15. 异戊醇 16. (E)-4-溴-2,3-二甲基-2-戊烯-1-醇17. 5-硝基-1-萘酚 18. 对硝基苄基丙基醚 19. α,β-二苯基乙醇 20. 季戊四醇 七、醛、酮CH 2CHCCH 2CH 3O (CH 3)2CHC CH 2CH 3OCCH 3O CHOCH 3OCH 3CCH 2CCH 3OOCCH 2Br OCH 3CHCH 2CHO2CH 3CHOO(CH 3)2CCHCHCHO11. 3-甲氧基-4-羟基苯甲醛12. 水杨醛 13. β-羟基丙醛 14. 反-2-氯-4-甲氧基环戊酮 15. 2,4-戊二烯醛 16. 二苯甲酮 17. 1,3-环已二酮 18. 环已基甲醛八、羧酸及其衍生物1.CH 3CH(CH 3)C(CH 3)2COOH2.CH 3CHCOOH3.HOOCCHCH 2COOH4.CH 2CHCH 2COOH5.COOH HOOC 6.COOH7.COOC 2H 5COOH8.COOHCH 39.2H 5O 10.O OOCH 311.COClO 2NO 2N 12.OONH15. 草酸 16. 苯乙酸苯甲酯 17. 3-苯基丙酸 18. ε-已内酰胺 19. 肉桂酸 20. 醋酸苯酯 21. N-苯基苯甲酰胺 22. α,r-二甲基-β-戊酮酸 九、含氮化合物CH 3CH 3CHCH(CH 3)2NO 2CH 2CH 2CHNH 2NCH 3C 2H 5NHC 2H 5CH 3H 2N NHC 6H 5(CH 3)23)3C6H5SO 2NHCH 33)3(CH 3)2NNOCH 2CHCN(CH 3)2NC 12H 25CH 26H 5HSO 4CH 3NHNH CH 3NOHCH 3NNN(CH 3)2CH 3NCH 317. 间硝基乙酰苯胺 18. 甲胺硫酸盐 19. N-甲基-N-乙基苯胺 20. 对甲苄胺 21. 1,6-乙二胺 22. β-奈胺 23. 2-氨基-4-甲氨基已烷 24. N-环已基乙酰胺 25. 偶氮二异丁腈 26. 对二甲氨基偶氮苯磺酸钠 十、杂环化合物1.OCOOH2.NNH 2N NN NH 2CH 3N 3.OCH 3CH 34.BrCOOHCH 3 5.O2CH 36.NCH 2CH 37.8.CH 2CH 3+9.OCH 310.+-11.N12.NN CH 3CH 314. α-噻吩磺酸 15. 糠醇 16. 碘化N,N-二甲基四氢吡咯17. β-吲哚乙酸 18. 4-(对氨基苯磺酰胺基)-6-甲氧基嘧啶 19. 3-乙基异噁唑习题二1.用构造式表示下列各化合物经硝化后可能得到的主要一硝基化合物(一个或几个):C 6H 5Br C 6H 5NHCOCH 3C 6H 5C 2H 5C 6H 5COOH C 6H 4(OH)COOH CH 3C 6H 4COOH C 6H 4(OCH 3)2C 6H 4(NO 2)COOHC 6H 4(OH)BrCH 33CNp-m-(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)(13)对甲苯酚OCH --m-o o2.用化学方法鉴别下列各组化合物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
苯胺结构简式
苯胺是一种有机化合物,化学式为C6H5NH2,也被称为苯基胺或氨基苯。
它是一种无色至黄色的液体,有强烈的氨味,可混溶于水和许多有机溶剂。
苯胺的分子结构可简写为C6H5-NH2。
它属于芳香胺类化合物,是苯环分子中一个氢原子被氨基取代而成的物质。
苯胺的分子结构中,苯环具有6个碳原子,它们处于平面构型,通过共振进行共同稳定。
氨基位于苯环上,和苯环上的一个碳原子相连接,氨基带有一个孤对电子。
这个孤对电子常常与其他电子或化合物发生反应,使得苯胺在化学上具有很大的反应性。
苯胺是一种很重要的化学品,广泛用于染料、药品制造、橡胶和塑料生产等领域。
在染料领域,苯胺是一种重要的中间体,可用于合成各种颜料。
在药品制造领域,苯胺是许多治疗癌症的药物的重要原料。
在橡胶和塑料生产中,苯胺可用来制造聚氨酯、聚酰胺等高分子材料。
另外,苯胺还是化学分析和检测的一种重要试剂。
它可以用于测
定元素硒和铁的含量,也可以用于测定氮的量。
虽然苯胺在许多领域有着广泛的应用,但它也有一些危险性。
苯
胺容易吸收到人体内,对人体健康造成潜在危害。
长期暴露于苯胺会
导致肝脏、肾脏和骨髓等器官受损。
同时苯胺也是致癌物质之一,长
期接触苯胺可以引起白血病和其他肿瘤疾病。
因此,在使用苯胺时,
需要严格遵守安全操作规程,并采取有效的防护措施。
综合来看,苯胺是一种重要的化学品,在许多领域有广泛的应用。
了解苯胺的分子结构和化学性质有助于人们更好地掌握和应用它。
同
时我们也需要注意苯胺带来的潜在危害,保护我们自身和周围环境的
安全。
