第七章 金属氢化 (Hydrometallation) 和金属碳化反应 (Carbometallation)
金属催化剂及相关催化反应过程

2.能带理论
• 能带的形成
N 个金属原子 金属(有 N 个原子) (孤立的) s 4s 4p 3d 1 3 5 s 能带 4s 能带 4p 能带 3d 能带 N 1N 3N 5N 容纳的电子数为两倍的轨道数 受周期电场的影响扩散成为能带
s 带宽 p 带中 d 带窄
dN (密度) dE
小
中
大
铜的电子能带宽度对 原子间距离的关系 (示意图)
Ni C C H 2 C C 吸附 加氢 CH 2 CH 2 CH 2 CH 2 CH 3 CH 3 | | Ni Ni
Ni 催化剂(面心立方):用阴极蒸发方法,使 Ni 气化蒸发到玻璃上,制成Ni膜。 CAT1. 高真空下,100,110和111面上各占1/3无序 CAT2. 在1mmHg N2的气氛中,得(110)面择优取向 加H活性 CAT2比CAT1高五倍。 原因: 在宽双位上的吸附物种受到较大的扭曲,可能成为活泼 的中间物。(110)面的宽双位比(100)和(111)面的多。
N2 本身还能对铁的晶面起重建作用。
即 N2 在铁晶面上进行化学吸附时, Fe 晶格上的其它晶面会逐渐转化为
(111)面。
② 同一反应,不同金属有不同的原子间距,有不同的 活性。
C=C+H2反应。0℃,金属薄膜为催化剂, Fe、Ta、W为体心立方晶格,取(110)面内的原子间距离 Rh、Pt、Pd为面心立方晶格,取晶格常数为晶格距离。 • 3.75A的Rh的活性最好。 • 当距离过宽, C=C 作更大 的变形,能量要求高; • 过窄,反应物得不到活化。
• O2-也会引起深度氧化 这时可以加入一些氯化物来破坏 4Ag( 原子簇 ) 的 结构,防止由于O2-引起的深度氧化。
clemmensen还原反应通式

Clemmensen 还原反应是一种有机化学中常用的反应,通常用于将羰基化合物还原成相应的烷基化合物。
该反应由丹麦化学家埃里克·克莱门森(Eric Christian Clemmensen)于1913年首次报道,因此被命名为Clemmensen 还原反应。
本文将对Clemmensen 还原反应的通式及其反应机理进行详细介绍。
一、Clemmensen 还原反应的通式Clemmensen 还原反应的通式如下:R-C=O + H2 + Zn(Hg) ——> R-CH2 + Zn(OH)2其中,R代表烷基基团,C=O代表羰基化合物,H2代表氢气,Zn(Hg)代表锌银粉。
该反应是通过锌银粉在酸性条件下与羰基化合物反应,发生加成、析氧和脱羧等步骤,最终将羰基化合物还原成相应的烷基化合物。
二、Clemmensen 还原反应的反应机理Clemmensen 还原反应的反应机理主要包括以下几个步骤:1. 锌银粉在酸性条件下与羰基化合物发生加成反应,生成一个亚甲基化合物。
该步骤是反应的关键步骤之一。
2. 生成的亚甲基化合物再与锌银粉和酸继续反应,发生析氧和脱羧等步骤,最终生成烷基化合物。
3. 在反应过程中,锌银粉起到催化剂的作用,加速了反应的进行。
通过上述机理步骤,Clemmensen 还原反应将羰基化合物还原成相应的烷基化合物,是一种重要的化学合成方法。
三、Clemmensen 还原反应的应用Clemmensen 还原反应在有机化学合成中有着广泛的应用。
由于这种反应对含有酮、醛等羰基化合物有较高的还原选择性,并且操作简单、条件温和,因此被广泛用于有机合成中。
Clemmensen 还原反应可以用于合成醇、醚等化合物,对于合成具有特定结构的有机化合物具有重要的应用价值。
在工业上,Clemmensen 还原反应也被用于生产某些有机化合物,如烷基醇的合成等。
由于其反应条件温和、产率高、操作简便等优点,使得Clemmensen 还原反应得到了广泛的应用和推广。
基础化学第7章知识点总结

基础化学第7章知识点总结第七章化合价与化合价化学式本章学习的主要内容有:1、化合价。
2、化合价的应用。
3、离子和离子化学式。
4、共价化学式和价键。
5、离子键。
一、化合价和化合价符号1. 化合价的含义化合价是指原子在化合物中的化合态所带的电荷数。
例如,氢气分子H2中,两个氢原子都是单价,氧气分子O2中,两个氧原子也都是双价,因此H2的量子化学式是H2,O2的量子化学式是O2。
氯气分子Cl2中,两个氯原子都是单价,在氯化钠NaCl中Cl是一价而Na是一价离子。
又如H2O的量子化学式是H2O,氧化氢的量子化学式是H2O,氧气的量子化学式是O2。
又如氢氧化钙Ca(OH)2中,氧是二价离子,高锰酸钾_KMnO4中,氧是二价离子。
2. 化合价的测定和改变化合价有原子内阴外电子数1:1或2:7跟原子化合价能力的规律。
测定它之前,要先分解化合物。
原子内阴外电子数如果满足1:1或2:7则改变不了化合价。
一般一价化合物都分子式是MX,原子间相对距离与中心原子半径之间的比值可以发现离子间离子键的关系。
二价化合物个分子的结构也可以确定化合物M的化合价。
分子间键能和结合能也与化合价有关。
3. 化合价化学式的性质化合价化学式有基本结构、原子分布、原子排列和化合价等等。
它和化合物化学式的相关性也很强。
比如α-铝石榴石结构,β-锡的晶识结构。
还有结构和性质之间的关系,化合价不同的化合物在Ι型结构等等的现象也表明了自己的性质。
4. 具有多种化合价的元素对于具有多种化合价的元素,其化合价在不同情况下可以有多种选择。
如铜,氮,碲等,都是有多种化合价的元素,主要是由于这些元素的内外电子数没满足1:2的要求所以很难只保留一个化合价。
二、化合价的应用1. 确定共价键和离子键通过化合价的计算可以确定共价键和离子键。
化合价差大于等于1.7都一般认为是离子键,小于等于1.7的一般认为是共价键。
碳的化合价结构中化合价原是共价性的。
2. 写化合价式可以根据化合价来写化合价式。
物理化学第七章课后答案完整版

第七章电化学7.1用铂电极电解溶液。
通过的电流为20 A,经过15 min后,问:(1)在阴极上能析出多少质量的?(2) 在的27 ØC,100 kPa下的?解:电极反应为电极反应的反应进度为因此:7.2在电路中串联着两个电量计,一为氢电量计,另一为银电量计。
当电路中通电1 h后,在氢电量计中收集到19 ØC、99.19 kPa的;在银电量计中沉积。
用两个电量计的数据计算电路中通过的电流为多少。
解:两个电量计的阴极反应分别为电量计中电极反应的反应进度为对银电量计对氢电量计7.3用银电极电解溶液。
通电一定时间后,测知在阴极上析出的,并知阴极区溶液中的总量减少了。
求溶液中的和。
解:解该类问题主要依据电极区的物料守恒(溶液是电中性的)。
显然阴极区溶液中的总量的改变等于阴极析出银的量与从阳极迁移来的银的量之差:7.4用银电极电解水溶液。
电解前每溶液中含。
阳极溶解下来的银与溶液中的反应生成,其反应可表示为总反应为通电一定时间后,测得银电量计中沉积了,并测知阳极区溶液重,其中含。
试计算溶液中的和。
解:先计算是方便的。
注意到电解前后阳极区中水的量不变,量的改变为该量由两部分组成(1)与阳极溶解的生成,(2)从阴极迁移到阳极7.5用铜电极电解水溶液。
电解前每溶液中含。
通电一定时间后,测得银电量计中析出,并测知阳极区溶液重,其中含。
试计算溶液中的和。
解:同7.4。
电解前后量的改变从铜电极溶解的的量为从阳极区迁移出去的的量为因此,7.6在一个细管中,于的溶液的上面放入的溶液,使它们之间有一个明显的界面。
令的电流直上而下通过该管,界面不断向下移动,并且一直是很清晰的。
以后,界面在管内向下移动的距离相当于的溶液在管中所占的长度。
计算在实验温度25 ØC下,溶液中的和。
解:此为用界面移动法测量离子迁移数7.7已知25 ØC时溶液的电导率为。
一电导池中充以此溶液,在25 ØC时测得其电阻为。
金属有机化学相关资料

-金属有机化学1.序言2.主族金属有机化学3.过渡金属有机化学4.稀土金属有机化学5.有机合成中的金属有机化学6.金属有机化学催化反应一、序言1. 定义:金属有机化学是研究含有金属-碳键的化合物的化学,包括合成、结构、反应性质及催化性能等。
其中金属包括硼、硅、砷等类金属。
严格区分:有机金属化合物 M -C金属有机化合物 M -O ,M -N ,M -C金属有机化学是无机化学和有机化学的交叉学科,既可以归属于无机化学,也可以归属于有机化学。
2. 发展史1760年 合成第一个金属有机化合物1827年 合成第一个过渡金属有机化合物(第一个含烯烃的金属有机化合物)Zeise’s 盐,Na[Pt(C 2H 4)Cl 3]1849年 E. Frankland 用氢气作保护气体3C 2H 5I + 3Zn → (C 2H 5)2Zn + C 2H 5ZnI + ZnI 21890年 第一个有工业应用价值的金属有机化合物Ni(CO)4,可用于提纯金属镍。
1901年 格氏试剂的发现,V . Grignard (1912年诺贝尔奖)RX + Mg → RMgX1919年 H. Hein, CrCl 3 + PhMgBr → Ph 2Cr1925年 Fischer-Tropsch 反应的发现,其机理的研究目前仍然是金属有机化学的一个重要研究领域,可能是先生成M -C 或者M =C 。
1938年 O.Roelen 发现氢甲酰化反应(Hydroformylation, oxo process)。
PdCl 2催化乙烯水合生成乙醛。
1938~1945年 Reppe 合成的发展CO + H 2 + CH 2=CH 2 → CH 3CH 2CHO1951年 二茂铁的发现 FeCl 2 + C 5H 5- → Fe(C 5H 5)2,导致烯烃-金属π络合物理论的提出。
1953年 Wittig 反应的发现,利用膦叶立德合成烯烃的方法1955年 Ziegler-Natta 催化剂的发现 MCl 3/AlR 3催化烯烃低压聚合 "Cadet's fuming liquid" [(CH 3)2A s]2O A s 2O 3 + 4CH 3COOK1956年H. C. Brown 硼氢化反应的发现,符合反马可夫尼可夫原则,R 2B 接在最少取代的碳原子上。
翻译完成版

金属氢化物冷库模块的分析凯文·亚伯拉罕,M。
普拉卡什麦雅,S.斯里尼瓦沙穆尔蒂*制冷与空调实验室,机械工程学院,马德拉斯印度理工学院学系奈600036,印度摘要金属氢化物的概念在冷藏模块中进行的讨论。
冷量可在被存储在这样的模块,为制取低于环境的温度所应用。
基于合金系统的分析,对多种操作条件和性能特点做了介绍。
在最佳热源的温度条件下能获得最大制冷系数。
鉴于氢气阀成本高,对冷库模块没有氢气阀做了对比研究。
2002年出版由Elsevier科学有限公司代表氢能国际协会。
关键词:金属氢化物;热储能;模块1 介绍金属氢化物为基础的加热和冷却系统可以获得广泛的温度,其中包括速冻、制冰、空调和热泵等舒适性和工艺性的应用。
此外,金属氢化物系统也可以作为热能存储介质。
例如,镁系金属氢化物系统能作为高温蓄热介质具有很大的潜力[1]。
使用镁系氢化物在小规模的太阳能热力电站做储能介质也已证实[2]。
用金属氢化物储存高温热能的传热特性的实验研究已经得出结论[3]。
虽然这些研究的大多数的目的是在高温下对热能的储存,该模块在民用和商业领域有非常好的应用前景。
环境温度下,冷量可被储存在这样的模块中,为之后的制冷所应用。
这种类型的冷库模块不仅用于运输容器,同时也为其他短冷却时间像携带药品冷箱等。
这样是基于金属氢化物冷库模块描述和不同操作条件下的特性进行了讨论。
鉴于氢气阀成本高,还执行一个无阀冷库模块的分析其表现与冷库相比带隔离阀模块。
2 系统的操作2.1 模块与隔离阀冷库模块由两床组成,一个高温合金(A)和一个低温合金(B)。
图1表示出了不同操作的原理。
这发生在冷库模块中,热力循环的性能由V an’t Hoff和PCT 曲线图表示。
图2冷库的操作模块有三个温度水平;即:高温热源Th,中间温度Tm(散热器/环境),和冷负荷的低温度Tc。
蓄冷模块的操作可以被归纳为下面的步骤:充电步骤:首先,床A和B是在室温温度Tm和它们之间的阀是关闭的。
NACE 炼厂腐蚀教材第七章-中文

第七章氢加工装置学习目的完成本章学习后,你将能够做到:∙用常用术语叙述氢加工装臵的目的以及它们是如何工作的∙识别氢加工装臵的主要类型并能够区分它们∙识别和讨论氢加工装臵中导致这些装臵腐蚀的工艺条件∙识别和讨论氢加工装臵中常见的八种腐蚀类型∙识别可以用于减缓和防止氢加工装臵腐蚀的技术∙识别和讨论有些装臵发生的两种不同的材料性能退化机理∙识别可以用于减缓和避免材料性能退化的技术∙识别在氢加工装臵中容易发生腐蚀的十一个部位适宜的结构材料引言当石油在炼厂加工装臵中运转通过系统时,各种各样的杂质会使设备性能减退,甚至使成品油品质下降。
氢加工装臵除去杂质从而改善了烃原料的品质,并把重质进料转化成附加值更高的轻烃产品。
在有催化剂的条件下,在高温高压富氢环境中,这些原料会发生化学反应。
氢加工装臵的类型包括:∙加氢处理装臵(包括加氢脱硫装臵)–除去硫和氮∙加氢裂化装臵–把重质进料裂化成沸点较低的产品∙加氢反应器–把氢加到不饱和烃或贫氢烃中∙加氢精制装臵–除去色素在加氢处理装臵里,硫和氮与氢反应生成硫化氢(H2S)和氨(NH3)。
这些化合物对各种类型的加氢处理装臵的腐蚀和材料选择影响极大。
本章大部分内容就是识别在氢加工装臵中发生的各种类型的腐蚀,并要针对这些腐蚀问题选择适宜的材料。
氢加工最常见的两种氢加工装臵是加氢处理装臵和加氢裂化装臵。
有时候这两种工艺过程合在一起,第一步(加氢处理)除去杂质,第二步作为加氢反应器或加氢裂化装臵发挥作用。
从腐蚀而言,这两个步骤最重要的区别是,加氢处理装臵的进料含有大量硫和氮,而第二步加氢裂化段没有这样的问题。
由于硫、氮、氨一般都会降低第二步中催化剂的活性,所以,在第一步加氢处理阶段要除去这些杂质中的绝大部分。
结果,与第一步加氢处理阶段或一步法氢加工过程相比较,第二步加氢裂化段的腐蚀问题小得多,所以很少考虑选用更高级别的材料。
一步法加氢裂化装臵是个操作高度集中的处理过程,不仅要加氢处理,而且,要把重质烃转化成轻烃产品,并对转化后的烃加氢氢化。
有机化学命名反应概要(修订版)
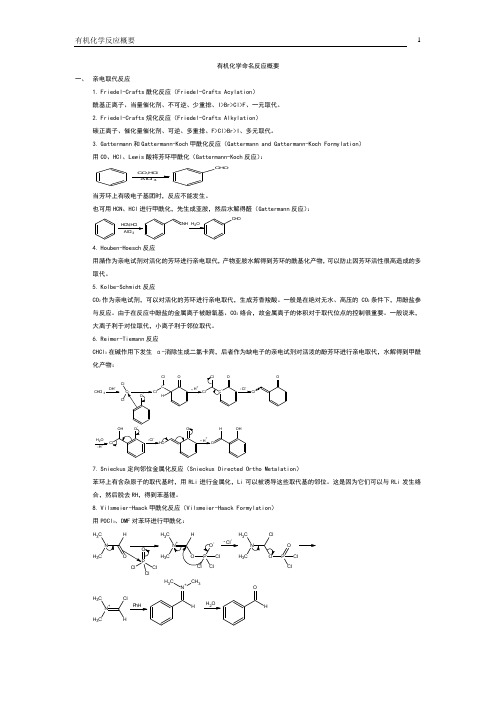
有机化学命名反应概要一、 亲电取代反应1. Friedel-Crafts 酰化反应(Friedel-Crafts Acylation ) 酰基正离子、当量催化剂、不可逆、少重排、I>Br>Cl>F 、一元取代。
2. Friedel-Crafts 烷化反应(Friedel-Crafts Alkylation ) 碳正离子、催化量催化剂、可逆、多重排、F>Cl>Br>I 、多元取代。
3. Gattermann 和Gattermann-Koch 甲酰化反应(Gattermann and Gattermann-Koch Formylation ) 用CO 、HCl 、Lewis 酸将芳环甲酰化(Gattermann-Koch 反应):CO,H Cl AlCl 3C H O当芳环上有吸电子基团时,反应不能发生。
也可用HCN 、HCl 进行甲酰化,先生成亚胺,然后水解得醛(Gattermann 反应):HCN,HCl AlCl 3NH OH 2CHO4. Houben-Hoesch 反应用腈作为亲电试剂对活化的芳环进行亲电取代,产物亚胺水解得到芳环的酰基化产物,可以防止因芳环活性很高造成的多取代。
5. Kolbe-Schmidt 反应CO 2作为亲电试剂,可以对活化的芳环进行亲电取代,生成芳香羧酸。
一般是在绝对无水、高压的CO 2条件下,用酚盐参与反应。
由于在反应中酚盐的金属离子被酚氧基、CO 2络合,故金属离子的体积对于取代位点的控制很重要。
一般说来,大离子利于对位取代,小离子利于邻位取代。
6. Reimer-Tiemann 反应CHCl 3在碱作用下发生α-消除生成二氯卡宾,后者作为缺电子的亲电试剂对活泼的酚芳环进行亲电取代,水解得到甲酰化产物:CHCl 3OH-C ClCl O-OC -ClClHH+~C -OClCl Cl--OClO H 2H+-O-Cl OHCl--OO H H+~OHOH7. Snieckus 定向邻位金属化反应(Snieckus Directed Ortho Metalation )苯环上有含杂原子的取代基时,用RLi 进行金属化,Li 可以被诱导这些取代基的邻位。
金属氢化反应

catalysts which differ by many orders of magnitude in acidity. Examination of Figure 1 shows n o such moderate curvature, but even if such an overall trend could be discerned, its significance would be obscured by the changes in catalyst structure required t o cover the range of this plot. Bronsted relations are available for two other aromatic hydrogen exchange reactions, the detritiations of azulene and guaiazulene.'" Comparison of these with the present correlation should of course be done on the basis of similar catalysts, preferably of a single structural type, and this effectively limits the examination t o relationships based on catalysis by carboxylic acids. The value of a based on all of the carboxylic acid data for trimethoxybenzene is 0.59 f 0.05, and those for azulene and guaiazulene are 0.61 f 0.07 and 0.52 0.10, respectively. It must be borne in mind, however, that these correlations use observed detritiation rate constants, which are functions of protonation rate constants, k l , and intramolecular isotope effects, k H / k T : kobsd = kl,'(l kH/kT).8a These isotope effects are known t o vary in magnitude in a regular way with changes in catalyst acidity and substrate basicity,*l and Bronsted exponents based on kobsdwill therefore be somewhat different from Brpnsted exponents based on kl. The latter, of course are the quantities of significance in comparisons of different substrates and they can be estimatedgb as a = 0.68 f 0.06, 0.67 f 0.07, and 0.56 f 0.10 for the carboxylic
第7章 金属-气相作用3h

吸附 — 分解 — 溶入 (N2)
分解 — 吸附 — 溶入 (H2)
25
第七章 液态金属与气相的相互作用
双原子气体溶入金属液的两种方式
氮在高温下多呈分子状态 吸附 分解 溶入
趋近 表面 原子 溶入 内部 扩散
氢高温时分解度大,电弧 下可完全分解为原子氢 分解
吸附
溶入
温度不够高或气体难以分解时
焊接温度下氢、氧等气体的溶解
温度 气体溶解度与热效应和温度的关系 1-吸热溶解 2-放热溶解
31
直接的影响。
第七章 液态金属与气相的相互作用
氮和氢在金属或合金中的 溶解反应类型及形成化合物倾向
气体 金 属与合金 铁和铁基合金 氮 Al、Ti、V、Zr等金属及合金 Fe、Ni、Al、Cu、Mg、Cr、Co 等金属及合金 氢 Ti、Zr、V、Nb、Ta、Th 等金属及合金 放热反应 吸热反应 不能形成稳定氢化物 溶解反应类型 吸热反应 能形成稳定氮化物 形成化合物倾向
第七章 液态金属与气相的相互作用
第一节 气体的来源与产生 第二节 气体在金属中的溶解
第三节 氧化性气体对金属的氧化 第四节 气体的控制措施
第七章 液态金属与气相的相互作用 3
本 章 要 求
• 了解焊接区和铸型内气体的来源、产生和成分
• 掌握气体的溶解度、影响因素和影响规律,温
度、晶格类型对氮和氢溶解度的影响 • 熟悉焊接条件下氮和氢的存在形式、溶解过程 以及在液态金属中的含量 • 了解氧在液态铁中的溶入形式和室温时在铁基
浇注过程
浇包未烘干,铸型浇注 系统设计不当,铸型透
铸型
•型砂中的水分— 吸附水、结晶水。 •有机物(粘结剂 等)燃烧。
氛中的水分、氮、氧、 气性差,浇注速度控制 氢、CO2、CO、SO2 不当,型腔内的气体不 和有机物燃烧产生的 碳氢化合物等。 能及时排除等,都会使 气体进入液态金属。
金属学与热处理崔忠圻第二版课后答案完整版
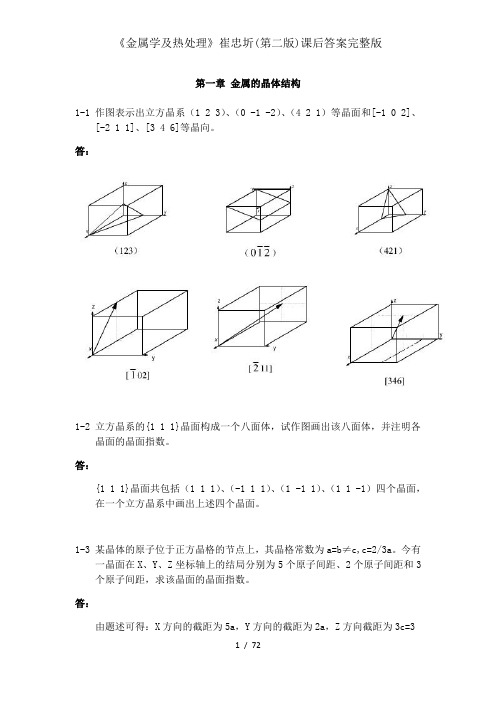
第一章金属的晶体结构1-1 作图表示出立方晶系(1 2 3)、(0 -1 -2)、(4 2 1)等晶面和[-1 0 2]、[-2 1 1]、[3 4 6]等晶向。
答:1-2 立方晶系的{1 1 1}晶面构成一个八面体,试作图画出该八面体,并注明各晶面的晶面指数。
答:{1 1 1}晶面共包括(1 1 1)、(-1 1 1)、(1 -1 1)、(1 1 -1)四个晶面,在一个立方晶系中画出上述四个晶面。
1-3 某晶体的原子位于正方晶格的节点上,其晶格常数为a=b≠c,c=2/3a。
今有一晶面在X、Y、Z坐标轴上的结局分别为5个原子间距、2个原子间距和3个原子间距,求该晶面的晶面指数。
答:由题述可得:X方向的截距为5a,Y方向的截距为2a,Z方向截距为3c=3×2a/3=2a。
取截距的倒数,分别为1/5a,1/2a,1/2a化为最小简单整数分别为2,5,5故该晶面的晶面指数为(2 5 5)1-4 体心立方晶格的晶格常数为a,试求出(1 0 0)、(1 1 0)、(1 1 1)晶面的面间距大小,并指出面间距最大的晶面。
答:==a/2H(1 0 0)==√2a/2H(1 1 0)H==√3a/6(1 1 1)面间距最大的晶面为(1 1 0)1-5 面心立方晶格的晶格常数为a,试求出(1 0 0)、(1 1 0)、(1 1 1)晶面的面间距大小,并指出面间距最大的晶面。
答:==a/2H(1 0 0)==√2a/4H(1 1 0)H==√3a/3(1 1 1)面间距最大的晶面为(1 1 1)注意:体心立方晶格和面心立方晶格晶面间距的计算方法是:1、体心立方晶格晶面间距:当指数和为奇数是H=,当指数和为偶数时H=2、面心立方晶格晶面间距:当指数不全为奇数是H=,当指数全为奇数是H=。
1-6 试从面心立方晶格中绘出体心正方晶胞,并求出它的晶格常数。
答:1-7 证明理想密排六方晶胞中的轴比c/a=1.633。
金属有机化学基础-绪论

1.1.1 研究的内容新、方法新
c. 研究的方法新、手段新
新技术 —— 无水无氧操作技术 新设备 —— 高纯惰性气体处理装置 Schlenk瓶 手套箱(glove-box) 新工艺 —— 电化学,金属蒸汽,低温,压力,高真空,超声,微波 新催化方法 —— 均相、多相催化 水相催化 超临界,CO2作溶剂 离子液体 顺序多步反应(一个反应瓶,“one pot‖) 新测试手段 —— X-ray, 顺磁,核磁共振(变温核磁,动态核磁)
Ziegler催化剂 TiCl4/AlEt2Cl:实现了低温、低压乙烯聚合;
Natta将之改进 TiCl3/AlEt2Cl:应用于丙烯,首次获得等规聚丙烯。
1952年
1955年
1958年
H.Gilman合成出了LiCu(CH3) 2, 开创了铜有机化合物作为有机合成试剂的新领域。 E.O.Fischer报道了第一批h6-芳基过渡金属有机化合物。 同年,他又提出二芳铬也具有夹心面包式分子结构。 G. Wilke发现镍配合物催化丁二烯的环齐聚反应并第一次通 过分离鉴定反应活性物种来确定反应机理。 他还发现了[CpMo(CO)3]2分子中存在Mo-Mo共价键,为过渡 金属原子簇合物奠定了基础。
金属有机化学基础
Back
第1 章
前言
绪 论
金属有机化学发展史
金属有机化合物定义及基本概念
1.1 前言
—— “为什么要学习金属有机化学?”
金属有机化学所具有的特点:“新,广,快” 1.1.1 研究的内容新、方法新
a. 化合物的类型新
金属与烯烃的配合物 金属羰基化合物 金属簇化合物 金属卡宾、卡拜化合物 小分子金属配合物
b. 专业会议
1963年,第一届金属有机化学会议 上世纪80年代,OMCOS (Organometallic Chemistry, directed towards Organic Synthesis)
关于金属中氢扩散的解释

关于金属中氢扩散的解释华中科技大学化学与化工系 董泽华对于氢渗透速率,简单的方法可以采用恒电位方式进行,如果需要在阴极面进行充氢,则必须采用下面的Devanathan-Stachurski 特殊装置。
Devanathan-Stachurski 发明测定金属中原子氢的扩散速率的电化学方法见图1所示[1] ,测量装置是由两个互不相通的电解池组成左端是充氢室(阴极室),电解充氢时试样的C 面是施加的是阴极电流i c ,发生反应H e H ++→,产生原子氢一部分复合成分子氢放出,另一部分扩散进入试样内部;试样A 端是另一电解池的阳极,当加上阳极恒定电位后,从C 面扩散过来的氢原子在试样的A 面被电氧化,即H e H +-→而产生阳极电流i a 。
如果不存在表面反应2H H H +→↑(通过在碳钢表面镀钯或镀镍以及加上足够大的阳极电位就可抑制表面反应的进行),则经过一定的时间后从 C 面产生的原子氢在到达A 面后将全部被氧化, 即试样A 面上的原子氢的浓度c A =0, 这时原子氢的氧化电流I a 达到最大值称为稳态电流密度用I max 表示,故达到稳态时根据Fick 第一定律得 10max I c c FD x-=-∆ (1)式中: F 为法拉第常数; D 为扩散系数;Δx = L 为试样的厚度, cA = c 1 = 0 , 因为A 端H 原子已全部氧化成为H + ; c 0 = cC 是充氢端浓度, 当充氢电流Ic 恒定时,它也是常数,故式(1) 也可写成:I max = FDc 0/L , 或 c 0 = L ⨯ I max / DF (2) 通过测量渗氢电流密度I max ,即可由式(2) 计算出钢中的原子氢的浓度[3]。
图1.氢渗透速率测量装置示意图找到渗氢曲线中I t / I max = 0. 63 所对应的滞后时间L t , 代入公式26LL D t 来计算不同温度下的扩散系数D 值,典型的渗氢电流曲线如图2所示。
铁和氢氧化镍反应

铁和氢氧化镍反应
(实用版)
目录
1.铁和氢氧化镍反应的概述
2.铁和氢氧化镍反应的过程
3.铁和氢氧化镍反应的产物
4.铁和氢氧化镍反应的应用
正文
1.铁和氢氧化镍反应的概述
铁和氢氧化镍反应是一种常见的化学反应,这种反应通常在室温下进行,主要涉及到铁和氢氧化镍两种物质。
在反应过程中,铁和氢氧化镍会发生化学反应,生成新的物质。
这种反应被广泛应用于化学研究和工业生产等领域。
2.铁和氢氧化镍反应的过程
铁和氢氧化镍反应的过程可以分为两个阶段。
第一阶段是铁和氢氧化镍的物理混合,这个阶段主要是通过机械方式将铁和氢氧化镍混合在一起。
第二阶段是铁和氢氧化镍的化学反应,这个阶段中,铁和氢氧化镍会发生化学反应,生成新的物质。
3.铁和氢氧化镍反应的产物
铁和氢氧化镍反应的产物主要是镍和铁的氢氧化物。
镍是一种银白色的金属,具有良好的耐腐蚀性和导电性,常用于制造不锈钢和合金等材料。
铁的氢氧化物是一种红褐色的沉淀物,不溶于水,通常用于水处理和废水处理等领域。
4.铁和氢氧化镍反应的应用
铁和氢氧化镍反应被广泛应用于化学研究和工业生产等领域。
在化学研究中,这种反应常用于研究金属的反应性和化学性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
I OH Et CuLi, Et O, -30 oC 2 2
EtI, 0 oC
OH
1. PBr3, Et2O, 0 oC 2. TMS
CH2Li TMS
1. AgNO3, EtOH; KCN 2. n-BuLi, Et2O; (CH2O)n
1. LAH, NaOMe, THF, Heat 2. I2, -60 oC 3. Me2CuLi, 0 oC
7.1.2 锆氢化反应 (Hydrozirconation)
Wailes 等在 1970 年首次合成了 Cp2Zr(H)Cl 并研究了其与炔烃的加成反应 Schwartz 将它广泛用于与烯烃及炔烃的锆氢化反应(Schwartz 试剂)
Cp2Zr R Cl H R H 27 H Zr E
+
R H 28
LiAlH4 NaOMe THF OH R 7 1.1 eq. n-BuLi, Et2O, -20 oC 3 DIBAL or LiAlH4-AlCl3, THF, heat R H 10 R Al O 8 Al OAl H R I HO 9 R H 11 I OH H
OMe
Li, THF / t-AmOH NH3, -33 oC
7.6.5 镁氢化反应
1. i-BuMgBr cat. Cp2TiCl2 R 2. E+ R' 58 H E (11)
R 57
R'
E+ = H 2O, D 2O, I2, MeI, RCHO R, R' = Me, P h; n-Bu, Me3Si; Me3Si, P h
i-BuMgCl R 59 CH2OH cat. Cp2TiCl2
高尔夫球和啤酒 当你觉得一切似乎都乱了套,一天24小时也不够用时, 你不妨看看这个高尔夫球和啤酒的故事。 哲学课上,老师站在教室前面,讲台上摆着几样东西。 上课铃声一响,他一句话也没说,首先拿起一个空的酱罐子, 开始往里面装高尔夫球。装满后,他问学生们罐子是不是满了。 学生们回答说:“是的。” 接着老师拿起一盒小石子,一边往罐子里装一边搅动, 小石子在高尔夫球之间纷纷滚动着。等到再也装不下时,他 又问学生们罐子是不是已经满了。 学生们回答说:“是的。” 于是老师再拿起一袋细沙往罐子里倒,细沙很快就流入 石子和高尔夫球之间,填满了空隙。他还是问学生们罐子是不 是已经满了。
syn-addition
R 1
R
2DIBAL R H 2
R AlR'2
E+
R H 3
R (2) E
Eisch 等 溶剂效应
DIBAL hexane R 4 DIBAL ether R H 6 SiMe3 Al SiMe3 R H Al SiMe3
5 R = t-Bu, cyclohexyl
Corey et al.
1. Cp2Zr(H)Cl 2.Me2Zn, - 65 0C Ph Ph
Ph OH 37 89%, 67% ee
(8)
3.
OH 4. PhCHO, -20 oC, 8 h
36 N CH3
BDPSO
Cp2Zr(H)Cl CH2Cl2, 21 oC
BDPSO
Zr(Cl)Cp2
1. Et2Zn ( 1.1 equiv. ) - 60 oC 2. 0 oC, 6 h H O
OH
OH
1. MnO2, hexane, 0 oC 2. MnO2, NaCN HOAc, MeOH
1. NBS, DME / H2O, 0 oC 2. i-PrONa, i-PrOH, 0 oC
COOMe
O
COOMe
C18 JH ( JH-I )
Corey JACS 1968, 90, 5618
1. AlMe3 Me3Si 21 OH ( )n 2. DIBAL ether:hexane = 1:1
第七章 金属氢化 (Hydrometallation)
和
金属碳化反应 (Carbometallation)
7.1 金属氢化反应
7.1.1 铝氢化反应 (Hydroalumination)
DIBAL R 1 H neat or hydrocarbon
R H 2
H AlR'2
I2
R H 3
H (1) I
R
(2) 过渡金属催化的硼氢化反应
O B O O O B H O + O cat. RhCl(PPh3)3 O B O O
O + O B H
[Rh(+)-BINAP]BF4
H2O2, NaOH Ph
OH
(10)
86% D 2 mol% Rh(PPh3)3Cl C8H17-n 2 O O B D 14% D OH 2 mol% Rh(PPh3)3Cl O 0.1 equiv. O B D D 100 % [O] HO C8H17-n
学生们又一起大声回答说:“是的。” 老师又从桌子上拿起一瓶啤酒往罐子里倒,直到啤酒把 沙子之间的所有缝隙都充满。 学生们都笑了。 “现在,”老师说,“我想解释一下酱罐子里装的东西在 你们的生活中意味着什么。高尔夫球代表着你们的生命中所有 最重要的东西――家庭、孩子、健康、朋友、感情――即使失 去所有其他的东西,只要还拥有这些,你的人生就还能算是完 整的。而小石子代表的是其他一些比较重要的东西,比如工作、 房子、汽车等等。至于细沙,则代表所有剩下的东西――那些 不太重要的琐碎事物。” “如果你们首先把细纱装进罐子,”他接着说道,“那就 没有多余的地方来装高尔夫球和石子了。生活也一样。如果把 所有的精力都花在次要的事情上,那就会耽误你去做那些真正
R Ph
Ph Al Ph 74 Ph (16)
R = CH3 R = t-C4H9
2 100
: :
98 0
>95% low yield
R 75
OH ( )n
AlMe3 Cp2ZrCl2
R Al AlO 76
CH3 ( )n
R = SiMe3, GeMe3 n = 2, 3, 4
AlMe3 R E HO CH3 ( )n R E+ Al O 77 CH3 ( )n
1960 年:
40 - 60 C H 85 - 95%
o
H R 65 H AlR2 (13)
R3Al + H
R = Et, n-C4H9, i-C4H9, n-C6H1 3, n -C8H1 7
R' ( i-Bu)3Al + R' R' Al(i-Bu)2 + H H Al(i-Bu)2 66 R' i-Bu H + (i-Bu)2Al R' H i-Bu 68
重要的事情。所以一定要认清什么是主要的,什么是你得到 幸福的必要条件,并且对其投入最多的关注和精力。比如陪 孩子们一起玩耍,花一些时间去参加家庭常备药知识考试, 请丈夫或妻子去外边吃顿饭,经常与朋友们见面,尽量多去 看看年迈的父母,抽空再去打一场高尔夫球等等。而且只要 你愿意,总会有时间打扫房子和疏通下水道的。因此,首先 要关注高尔夫球,那些你生命中真正重要的东西。至于其他 的,只不过是一些石子或者沙子罢了。” 一个学生举手问老师:“那么啤酒呢?” 老师笑了:“我很高兴你问了这个问题,啤酒,只是 为了告诉你们,即使你的生活中每一寸空间都已经被完全占 据了,总还是有时间去抽空喝一杯,放松一下的。”
Oct-n (RO)2BH Rh(PPh3)3Cl Oct-n (RO)2B Rh D 45 (RO)2BRh D Oct-n
D (RO)2B Rh H 45
Oct-n D 46 Oct-n Rh-B(OR)2 区域选择性决定步 Oct-R)2 Oct-n H
H
R
+ R'3Al
1. cat. Cp*2ZrCl2 90 2. O2
R * R' 91
OH
(18)
n-Oct
1. Et3Al Cp2ZrCl2, (CH2Cl)2 2. DCl, D2O
BDPSO OH
1. KHMDSA, THF, - 78 oC MnO2 85 oC BDPSO O 2. Tf2NPh, -78 ~ 0 oC, 12 h 3. Bu3SnH, Pd2(dba)3-CHCl3 LiCl, PPh3, THF, 4 h
Cp2Zr(H)Cl, THF BDPSO 40 oC, 12 h
(RO)2BH + Rh(PPh3)3Cl
Ph Ph (RO)2B Rh H 区域选择性决定步 48
H
Ph Rh-B(OR)2 49
H
Ph B(OR)2 50
7.1.4 锡氢化反应
R 51 Br 2.0 Bu3SnH Pd (0) H R Br 52 Pd coupling product H R H 55 SnBu3 E+ R H 56 Stille coupling H E SnBu3 R 53 H SnBu3 PdBr Bu3SnH R H SnBu3 PdH 54
OMe
1. 1 eq. O3, -78 oC; MeOH / Me2S 2. NaBH4, EtOH, -78 oC
COOMe
HO OH
OH
1. TsCl, Py, 0 oC 2. LAH, Et2O
1. TsCl, Py 2. THPOCH2 HMPA, 0 C 3. TsOH, MeOH
o
Li
1. LAH, NaOMe, THF, Heat 2. I2, -60 oC
1. Cp2Zr(H)Cl TBDMSO 31 2. CuBr-SMe2 ( 3 x 5 mol% ) 2 h, 21 oC BF3-etherate
