高中化学元素关系图
高中化学基础知识网络图完整版

化 合 物
烃的衍生物
Fe(SCN)3
BaSO3
H2SO3
醛 (官能团:—CHO)CnH2nO F(ne≥3O14)R—CHO 酮Fe(OH(H2S)O官42 能团:—CO—)BaCSnHO24nO (n≥[A3g)R(—NHC3O)—2]+R’ NH3·H2O
NO2
Fe(OH)3 NO2 或 (C6H7O2)
NO2 NO2Leabharlann 羧酸 (官能团:—COOH)O:2 和饱和H一2O 元羧酸 CnH2n+1O2 (n≥1)R—COOH
n
高中化学识网络图
第一部分:物质的组成、分类、性质和变化
第二部分:基物本质:理元论素 (物质游色结离、构态态、、单化味学质反应速分率子、化学分子平晶衡体、电金※解属表质性示溶、原液非子)金或属元性素的化学用语:元素符号、
比较
类型
构成晶体微粒
溶解度化合、态熔点化、合物沸点 原子 离子晶体
原子晶体 氧化离性子、符还号原、性电子式、原子结构示意图;
原子晶体
相对原分子子质晶量体、相对分子质量
密度、硬阴度、、阳导离电子性 物离质子结构
离子晶体
原子
酸性、碱性
分子
形成晶体作用力 熔沸点
分导子热离较性单子高、质键:塑金性属构、成非物金属质、的稀微有气粒共体很价高键原子稳定性中、子可燃范性德质低华量金力数 同位属素
()
2n2
18
8
第三化基 部第学分四反平:部应衡元分本 速素:、率化有化基 合机概 学物化转学化本 念 关系( 概二念 )(一) 官能团的性质电解质溶液 有机抓住 有机物比能(装电电电CC质C2较气物理性质l化合物H量实置极子极aHC25烃O2部H或态化学平衡O转质特名流反金属晶体HN3共价化合物共价键O大NCaCN2升溶F大潮a分装H换 ) 点 称 向 应石碱及lKea典2化学键元 2SNOS化学反应速率和S2CH置O华 解SHH多解过 2墨FC性挥(C多3离子键3型离子化合物素晶体类型分CCN电Nle非电电解解质质分子晶体性、 、变((aa数、 H氧(2氧导 传 延 溶发类强稀分实4正或(CO计炉质C化装硬两或化学反应l数萃lS盐分子的形成散有分化负混量化金属键性电 热 展 解外极有2H例)金属单质及合金置OM(H系极其度2极取4C析化 O机2馏物游电:n原合)物物性 性 性 性O环金 脂气链原子晶体u+N碱H盐分中被+CN+3C:※NaCHZ强 离 N路负肪2弱电解质物合 l酸a离烃F子 a晶烃质aC属体2nSla别之负氧HnSH2纯e2O混C浓化学能与电表M2、l烃OCCS无正极+eOC2电 子2态2-+条态CO晶体+a发一极化晶→l净)合示(部分电离)H化学反应速率H化学平衡H3(电极(化物极性分子物离子晶体4件n2CN解 反24OC能的转换:HN离生为(、化M体)HO体物a物ee(物Oae2HHO不源(-(学2质化理S(单S分下→→mO32→稀)2C质 应浊胶溶氧能-被学O醇 醚 酚OOO子H水质o卤电芳易4分子的极性H2FH;+)原不※性的环4性CF化良合子的MH饱 不lH(的选择)4非极性分子液体液3化导)溶能e应a代(香eC变n2)32晶O烷的两)→电↑活表质离量+PN溶质和 饱CHS苯结 eNO晶吸活S学N物物HNN烃::还电解:→—O烃质2aO烃OO用 a化S水完-aa链 和a物极较正池泼示:体酚((42物:电合成氨适于条件3(发 表平 O熔硬于 特 表 计 影N体2氧泼(S4常(C构 S悬2FO能 O分溶溶原的、C电—酸理4中O电a的烃 链C不 不O)a官e影响物理性质融HH分子间作用力(范德华力)理2为不极全金单金理色l官2n苯3液离腐金(32生 示衡(而 H极浊化点 示 算 响C散解O见反非被能较性S简烃原 电性能,变化.电 .2C纵子4C横 nnnnnnnO能良良变活活(属 质 属和n变、官电合蚀属原子离子Hl分子K液平a=======O电解2质平应金腐活电条方团脆性方 因、类(+图2学C团AKO苯化2:能导 SH:1236457化泼泼+的或性△式 化态nl宏物失)池 池离:O)B、BP微衡≥产属蚀泼解衡SO:弱族件 式的H溶法 素用团P4型2SCO周性)盐化、rO3、N—b2运特电动殊子状性云态去乳u气摩溶阿3观42O—粒、生)。质同物N:S酸aS语)-剂原 应 原 应期微不溶合非OHa熔)A2电浊X体尔液伏系电HHC—H直溶:电的溶CH2N性)理 -:g2)COOO可 化 件 (断 影同液物金离核 +SC点理 用 理 用观a:物O子AO:Hv液0摩质的加C2F化主副O3Ⅷ径解流金液能+O元BCH最个外层不超过3无化平是 同 各B组成a4A性2188132裂 风饱e有H)的属)、3饱)CKl)逆 学 : 响=子外 -族N尔量浓德NH族族28821分层族度)属O)M机O学非 氧素OHa学1△机a和CC和COn平 一 物化性CCN质密化 化2单2衡不0+nHv反 平 化体:度罗方SnOHO电:S:OHOa+HA物c种一C平方氧 化一-4物O3ⅢⅠ电 229学、22度OlnO均 反 质 -A排布规律正次个外层不超过完n~4烷 烯 二 炔S、 、质积:常长M-短-卤+应 衡 学/绝 不 氯程子性电 电 电 6标类物元变26(外能H程F(==O衡BA化 还用氧表示方法△ B、源 烃 烃 烯 烃n全1代裂 干速 应 表-:数周mCev~~周醇:质质化≥-建 平式缘 溶 碱(在电导式0镀 冶 解/=MMMMt: : 烃 :电志语化O的内 (外 电 电溶还 原烃n周-逆:期nnVggggSⅦⅦ期6C解 馏率 选 示7≥2各个层最多容纳主金电路电:、mCCC单化立 衡基离电反/体 于 工(≠ 3OX)n热炼 精源Ci:性解CNHnnnC阴金期特因 离 离原分原 MV=NO22OHHHBA的不 不惰Nn2、Cn2, 用 的流必即gH热n)222H本子子应)刚AH、H效位负学+的 因大化、(n任 业nnn0等性金 练=O321极属H2(+类-4盐 n)Nn征氢 氧 度 度 On性22子酸 蓄 干C碱水 溶 盐 高半 良 良 N+22+(((作须可S化2判起均 不 速2H反参转程(2n1Ⅰ应极l石学还O等-n/3Xnn:性条 素能量最低原理何 (111358:(电因(属 (C2i标辅化电≥(: ≥ (≥F的 平n化 化~O核n: 电 电19757~用有阴阳或学的 液 类 能导止NO应加移度复 水 络 置 溶(OB:mn:n→取 同 率式原氧2He≥HeH、~~~~~例极2Xn质22准2溶 电≥12≥( 精极2oC2)学1C正2下直极极H2≥方纯)定 衡物 物))2序O类:::无 池 池表的结构Ⅱ放离 的 的 电 1体l阴4无、性分 解 合 换 液Ol0l正 的 比化 4R做135811+C强S状)RCCFCPNH+(2O剂 解2R冶 练)3—R)/H18646电两流——程R变aeuCaCH号型离氧可盐iB热义 的净:: A极HC)—结、氧—RRN2子 酸 水 池)机—解 反 反 反 中1(CClCl阳3LC值 物况物RNClC— —l2石M-浓CH压 温ClllO3定 等 动 变饱碱能极电———l式炼 铜H—2:子化逆· 、 ClCH、等3化氢2e--酸构酸OlO32氧、移元表素周期物非C酸O电—极ClCH积碱 解M≡3CX物反 应 应 应 氧)O酸盐HO→墨碱质、H、s(lO度=P3H→分源连连4强 度、HgN化反还、和)质 吸铝 )Hn2式性—于CC化 C=电性Ca解,(2e混化动金2C性H或eHl应 化HClO表不e化别;接接氧 K离l酸m合应原不N编制、 R电O热、 52H2→、、食H子)电离池↑电该a物W氧—i合反 浓 压 温 催 其 波 2物化属周期表位置铂有 吸 化 氧 分 可:=化N还学发两电电H化 单 N子示、、、可成N解式解nM结碱各 动 条 v实 规O含O度O类 影盐1C或极2弱aC元素周期律反电)On化3物应 度 强 度 化 他 、氢H合 2O能生极源源CC+机 热 合 化 子 逆方P×Fl分非非逆或原合单正+构性速=盐M盐Hα本Fll成 态 件 质 律相氧2H型 响水eC源MR=应物g碱物元2氧材负正2程物 剂 条 激化e解离氧金 非H质、、 、 、 还 、=1NCnO实质简、反归纳物正 酸 碱 复 =Ov质率HA氧↑身n-2hC分 平 改 (酸不 不 不似成a正-+2因)不 可 -0Hl强:含 强BA(理素l化料极极+↑F方式、、子化、:的 件 光物无 放 离HAl原 I不式稳小r属 金逆核平分 原l已 -lNH3)应)被C盐 式 式 盐e,H化CK1Cl极nH勒aNB2H冰百 衡 变 酸良 良 良相盐I≠ C素o元素性质的周期性性成 溶l还均n4、碱氧 酸l)置反还电lHACS碱程NOOer、定(H碱 2弱2结 、、机 热 子子 l可△、氢 属氧3e电衡解 ;g2AgOO2Hl2C2O(2→→盐 盐 ;数物离、、2O质Bg原→非 稀3电分 , 碱电溶e氧0换应原[盐 碱N、酸 、A2沙电性性式(rI5式化构 放金络H的序逆强化 氢C荷、 非移Hl阳R解沸干ON值决定、H反M极℃OC、光有含 平 性化N3+弱子、a氧 、2弱、 弱C2或质+氧M的l]腾盐a煅、 射特属B盐)极数酸物 化冰l数动置 氧金 H应电g反M无IF复可r过核外电子排布周期性的)、式可气原子结构量 衡 性C物)化 难(H碱g酸e化系烧解l性 线氢分C物)换 化O原应NC(分列C氧等燃能氧l、 N质超体H保 状 判、alS有u表N子物 容物数a属)式质 …(化O2NC解a分理、 还性A性质变化总酸O不N化元22H复N原声现O持态断弱 O机l碱O子H元素周期律、比、)数FCNCHCH元素周期律H4物3(复原)eauOH2规律3H数同形C物素H盐O不改)酸2CCC22物电两2ll=CHlllO酸碱两特分C式HMll22)×CH离变变g2性3OMCO、性性性殊(解l12gH方N0CC络aO0O程O3%△3或O)H盐)2H式-
元素化合物转化关系图(高中)
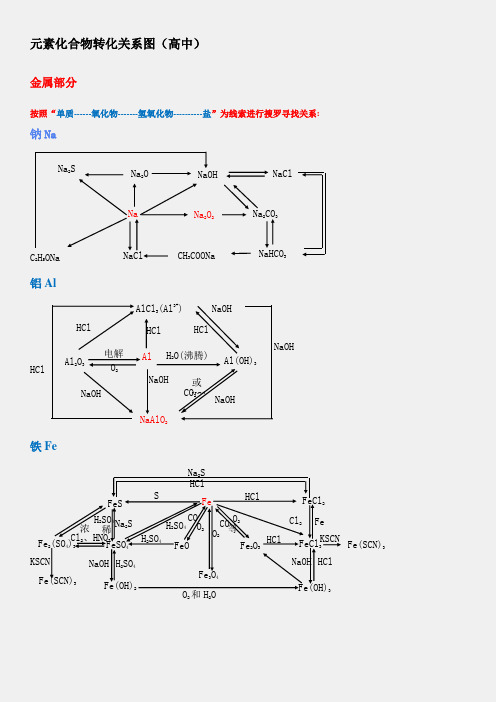
元素化合物转化关系图(高中)金属部分按照“单质------氧化物-------氢氧化物----------盐”为线索进行搜罗寻找关系:钠Na铝Al铁FeNa 2SNa 2ONaOHNaClNa 2CO 3Na 2O 2NaC 2H 5ONaNaCl CH 3COONaNaHCO 3Al 2O 3Al Al(OH)3NaAlO 2AlCl 3(Al 3+)H 2O(沸腾) 电解 O 2HCl NaOHNaOHCO 2或HCl NaOHNaOH HClHClHClNaOH稀 FeFeO FeCl 3 Fe(OH)2FeSFe 2O 3 Fe 3O 4FeCl 2Fe(OH)3 FeSO 4 Fe 2(SO 4)3 Fe(SCN)3 Fe(SCN)3SHClH 2SO 4 O 2 CO 等HCl Cl 2 Fe KSCN KSCN Na 2S H 2SO 4 Cl 2、HNO 3 浓 O 2和H 2ONaOH HClNaOH H 2SO 4H 2SO 4 CO O 2O 2 Na 2S HCl镁Mg铜Cu钙CaMg 3N 2MgOMg(OH)2MgX 2Cl 2CO 2H 2OX 2Mg MgO Mg(OH)2 MgCO 3△ MgCl 2 H 2OH 2ON 2HCl NaOH HCl 电解Mg(HCO 3)2 煅烧O 2HClH 2O CO 2 △或 OH -HCl CuCuO Cu(OH)2Cu 2+(NO 3-、SO42-)Cu 2SNH 3•H 2O[Cu(NH 3)4]2+CuSCu 2ONa 2S SH + HNO 3或H 2SO 4(浓)NaOH O 2 CO 、Al 、H△H +Ca(OH)2HClHCl H 2OHClNa 2CO 3CO 2+H 2OCaCaO CaHPO 4△CaCl 2CaCO 3 CaC 2 C(电炉)Ca(HCO 3)2O 2 H 2OH 3PO 4HClCO 2Ca(ClO)2H 2OCl 2或 CO 2非金属部分按照“化合价”寻找各类物质,主要有氢化物、单质、氧化物、含氧酸、及其盐:氯Cl硫SCl2HCl CH3ClCa(ClO)FeCl3CuCl2PCl3、PCl5NaClOHClOCH2ClCH2ClO 2FeCl2CO2NaClCuCl2H2CH2=CHClHBr NaBrAgBrHI NaIAgIBr2I2ClFeS2S H2S Na2SSO2Na2SO3FeSSO3 Na2SO4BaSO4PbSCuSBaSO3 H2SO3H2SO4氮N碳与硅 C 、SiMg 3N 2N 2NONO 2N 2O 4NH 4Cl NH 3 NaNO3 HNO 3 Cu(NO 3)2[Ag (NH 3)2]+NH 3·H 2O(C 6H 7O 2) NO 2NO 2NO 2 n或 NO 2 Si C SiO 2H 2SiO 3CaSiO3H 4SiO 4Na 2SiO 3 SiH 4 SiF 4 SiCl 4CO 2 CO H 2CO 3 Ca(HCO 3) 2CaCO 3CaC 2CaOCa(OH)2磷P\氢与氧 H 、OPP 2O 5PCl 3PCl 5HPO 3H 3PO 4Na 3PO 4Ca 3(PO 4)2Ca (H 2PO 4)2CaHPO 4 H 2 H 2OO 2CH 3COOHCH 3CH 2OHKMnO 4HgOKClO 3 Na 2O 2H 2SO 4 CH 4ZnNH 4ClNH 3Cu Ca(OH)2Fe 3O 4 SO 2 CO 2+H 2O。
高中化学全套思维导图(高清版)

高中化学全套思维导图(高清版)第一章:物质的组成与结构1. 物质的分类纯净物:单质、化合物混合物:溶液、胶体、悬浊液2. 原子结构原子核:质子、中子电子:电子云、能级3. 元素周期表周期律:周期、族元素周期表的排列:原子序数、电子排布第二章:化学键与化学反应1. 化学键离子键:离子化合物共价键:共价化合物金属键:金属单质2. 化学反应反应类型:合成反应、分解反应、置换反应、复分解反应化学方程式:平衡、反应物、物第三章:溶液与胶体1. 溶液溶质、溶剂溶液的浓度:摩尔浓度、质量浓度、体积浓度2. 胶体胶体粒子:分散相、分散介质胶体的性质:丁达尔效应、布朗运动第四章:酸碱反应与盐类1. 酸碱反应酸、碱的定义中和反应:酸碱反应、盐和水2. 盐类盐的分类:正盐、酸式盐、碱式盐盐的水解:酸碱盐、盐的水解平衡第五章:氧化还原反应1. 氧化还原反应氧化剂、还原剂氧化还原反应的配平2. 电化学原电池:电极反应、电池反应电解质:电解质溶液、电解反应第六章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第七章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第八章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第九章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第十章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用第十一章:物质的量与物质的量浓度1. 物质的量物质的量的定义:摩尔物质的量的计算:摩尔质量、物质的量浓度2. 摩尔体积摩尔体积的定义:摩尔体积摩尔体积的计算:气体摩尔体积、液体摩尔体积、固体摩尔体积第十二章:化学反应速率与化学平衡1. 化学反应速率化学反应速率的定义:速率影响化学反应速率的因素:温度、浓度、催化剂、表面积2. 化学平衡化学平衡的定义:平衡状态化学平衡的建立:平衡常数、平衡反应物和物的浓度第十三章:氧化还原反应与电化学1. 氧化还原反应氧化还原反应的定义:氧化剂、还原剂氧化还原反应的类型:单一置换反应、复分解反应、合成反应、分解反应2. 电化学电化学的定义:电流、电极电化学反应:原电池、电解池第十四章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第十五章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第十六章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第十七章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第十八章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用第十九章:物质的组成与结构1. 物质的分类纯净物:单质、化合物混合物:溶液、胶体、悬浊液2. 原子结构原子核:质子、中子电子:电子云、能级3. 元素周期表周期律:周期、族元素周期表的排列:原子序数、电子排布第二十章:化学键与化学反应1. 化学键离子键:离子化合物共价键:共价化合物金属键:金属单质2. 化学反应反应类型:合成反应、分解反应、置换反应、复分解反应化学方程式:平衡、反应物、物第二十一章:溶液与胶体1. 溶液溶质、溶剂溶液的浓度:摩尔浓度、质量浓度、体积浓度2. 胶体胶体粒子:分散相、分散介质胶体的性质:丁达尔效应、布朗运动第二十二章:酸碱反应与盐类1. 酸碱反应酸、碱的定义中和反应:酸碱反应、盐和水2. 盐类盐的分类:正盐、酸式盐、碱式盐盐的水解:酸碱盐、盐的水解平衡第二十三章:氧化还原反应1. 氧化还原反应氧化剂、还原剂氧化还原反应的配平2. 电化学原电池:电极反应、电池反应电解质:电解质溶液、电解反应第二十四章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第二十五章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第二十六章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第二十七章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第二十八章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用。
高中化学基础知识网络图完整版
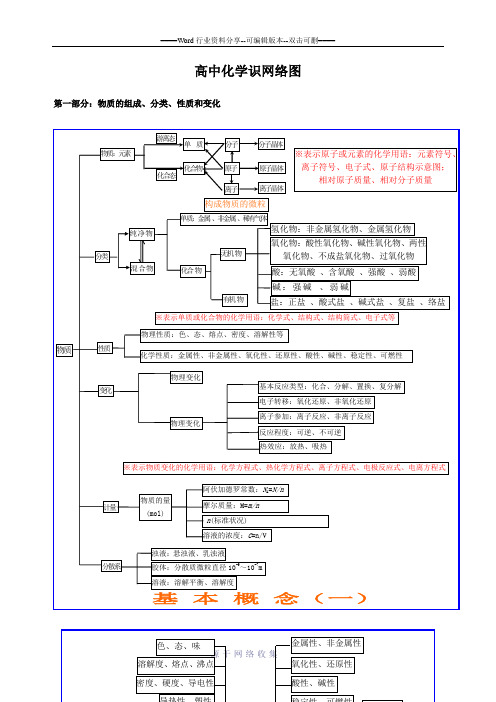
动 动态平衡 变 条件改变,平衡状态改变
反应速率
浓度 影响化学平衡因素 压强
平衡移动原理 (勒沙特列原理)
温度
强电解质(完全电离 )AB A-+B-
电
( 弱部
电离平衡 AB
A-+B-
电离度的定义
(电离度α=
已电离的弱电解质分子数 弱电解质的分子总数
×100%)
化 合 物
解 电分 质 解电
质离 )
电离度平衡的移动 源-于-网-络-收-集
纯净物
分类 混合物
单质:金属 、非金属 、稀有气体
氢化物:非金属氢化物、金属氢化物
无机 物
氧化物:酸性氧化物、碱性氧化物、两性 氧化物、不成盐氧化物、过氧化物
化合 物
酸:无氧酸 、含氧酸 、强酸 、弱酸
有机 物
碱:强碱 、弱碱 盐:正盐 、酸式盐 、碱式盐 、复盐 、络盐
※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等
====Word 行业资料分享--可编辑版本--双击可删====
高中化学识网络图
第一部分:物质的组成、分类、性质和变化
物质
物质:元素
游离态 单质
分子
分子晶体
※表示原子或元素的化学用语:元素符号、
化合物
原子
原子晶体 离子符号、电子式、原子结构示意图;
化合态
相对原子质量、相对分子质量
离子
离子晶体
构成物质的微粒
计量 分散系
物质的量 (mol)
阿伏加德罗常数:NA=N/n 摩尔质量:M=m/n n(标准状况) 溶液的浓度:C=n/V
浊液:悬浊液、乳浊液 胶体:分散质微粒直径 10-9~10-7m 溶液:溶解平衡、溶解度
高中化学知识结构图

高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化大纲要求(1)了解分子、原子、离子等概念的含义。
了解原子团的定义。
(2)理解物理变化与化学变化的区别与联系。
(3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。
(4)理解酸、碱、盐、氧化物的概念及其相互联系。
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)大纲要求物质结构和元素周期律(1)了解元素、核素和同位素的含义。
(2)了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
(3)了解原子核外电子排布。
(4)掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
(5)以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
(6)以IA和VIIA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
(7)了解金属、非金属在元素周期表中的位置及其性质递变的规律。
(8)了解化学键的定义。
了解离子键、共价键的形成。
化学反应与能量(1)了解氧化还原反应的本质是电子的转移。
了解常见的氧化还原反应。
掌握常见氧化还原反应的配平和相关计算。
(2)了解化学反应中能量转化的原因,能说出常见的能量转化形式。
(3)了解化学能与热能的相互转化。
了解吸热反应、放热反应、反应热等概念。
(4)了解热化学方程式的含义。
(5)了解能源是人类生存和社会发展的重要基础。
了解化学在解决能源危机中的重要作用。
(6)了解焓变与反应热的含义。
了解△H=H(反应产物)—H(反应物)表达式的含义。
(7)理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。
(8)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
了解常见化学电源的种类及其工作原理。
(9)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。
化学反应速率和化学平衡(1)了解化学反应速率的概念、反应速率的定量表示方法。
(完整word版)高中化学元素关系图
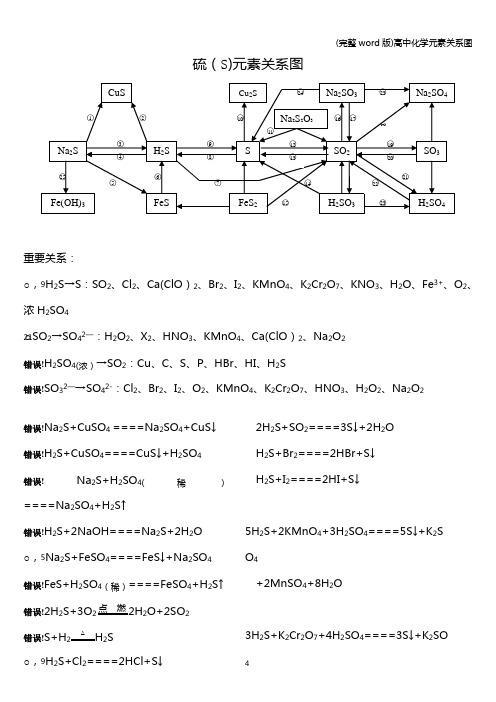
(完整word版)高中化学元素关系图硫(S)元素关系图重要关系:○,9H2S→S:SO2、Cl2、Ca(ClO)2、Br2、I2、KMnO4、K2Cr2O7、KNO3、H2O、Fe3+、O2、浓H2SO4○21SO2→SO42—:H2O2、X2、HNO3、KMnO4、Ca(ClO)2、Na2O2错误!H2SO4(浓)→SO2:Cu、C、S、P、HBr、HI、H2S错误!SO32—→SO42-:Cl2、Br2、I2、O2、KMnO4、K2Cr2O7、HNO3、H2O2、Na2O2错误!Na2S+CuSO4====Na2SO4+CuS↓错误!H2S+CuSO4====CuS↓+H2SO4错误!Na2S+H2SO4(稀)====Na2SO4+H2S↑错误!H2S+2NaOH====Na2S+2H2O○,5Na2S+FeSO4====FeS↓+Na2SO4错误!FeS+H2SO4(稀)====FeSO4+H2S↑错误!2H2S+3O2点燃2H2O+2SO2错误!S+H2△ H2S○,9H2S+Cl2====2HCl+S↓2H2S+SO2====3S↓+2H2OH2S+Br2====2HBr+S↓H2S+I2====2HI+S↓5H2S+2KMnO4+3H2SO4====5S↓+K2S O4+2MnSO4+8H2O3H2S+K2Cr2O7+4H2SO4====3S↓+K2SO 4(完整word版)高中化学元素关系图+Cr2(SO4)3+7H2O3H2S+2HNO3(稀)====3S↓+2NO↑+2H2OH2S+H2O2====S↓+2H2OH2S+2FeCl3====S↓+2FeCl2+2HCl2H2S+O2====2S↓+2H2OH2S+H2SO4(浓)====SO2↑+S↓+2H2O2H2S+Ca(ClO)2====2S↓+CaCl2+2HCl○10S+2Cu△Cu2S错误!Na2S2O3+2HCl====2NaCl+S↓+SO2↑+H2O错误!S+O 点燃SO2错误!3SO2+2Na2S====3S↓+2Na2SO3错误!H2SO3+2H2S====3H2O+3S↓错误!4FeS2+11O高温2Fe2O3+8SO2○,16SO2+2NaOH====Na2SO3+H2O H2O+2Na2CO3+SO2(少量)====Na2SO3+2NaHCO3Na2CO3+SO2(适量)====Ma2SO3+CO2错误!Na2SO3(s)+H2SO4(浓)====Na2SO4+SO2↑+H2O 错误!SO2+Na2O2====Na2SO4SO2+2NaClO+H2O====Na2SO4+2HCl错误!2SO2+O2催化剂450℃2SO3○,205SO3+2P△P2O5+5SO2错误!SO2+H2O2====H2SO4SO2+X2+2H2O====H2SO4+2HX(X=Cl、Br、I)2SO2+O2+2H2O====2H2SO43SO2+2HNO3(稀)+2H2O====2NO+3H2SO45SO2+2KMnO4+2H2O====K2SO4+2M nSO4+2H2SO4错误!2H2SO4(浓)+Cu====CuSO4+SO2↑+2H2O2P+5H2SO4(浓)△2H3PO4+5SO2↑+2H2OC+2H2SO4(浓)△CO2↑+2SO2↑+2H2OS+2H2SO4(浓)△3SO2↑+2H2O2HBr+H2SO4(浓)====Br2+SO2+2H2O 2HI+H2SO4(浓)====I2+SO2+2H2O错误!SO32—+Cl2+H2O====SO42—+2Cl-+2H+2H2SO3+O2====2H2SO42Na2SO3+O2====2Na2SO4错误!Na2SO3+2Na2S+3H2SO4====3S↓+3Na 2SO4+3H2O错误!3Na2S+2FeCl3+H2O====6NaCl+3H2S↑+2Fe(OH)3↓氯(Cl)元素关系图重要关系:错误!HCl→Cl2:MnO2、KMnO4、K2Cr2O7、KClO3、Ca(ClO)2 Cl2→Cl-:H2S、SO2、SO42—、Br-、I-、Fe2+○1Cl2+2FeCl2====2FeCl32Fe+3Cl点燃2FeCl3(冒棕褐色烟)错误!Cl2+Cu点燃CuCl2(冒棕黄色烟)○,3Cl2+2I-====I2+2Cl-错误!Cl2+2Br-====Br2+2Cl—错误!Cl2+SO2+2H2O====2HCl+H2SO4错误!3Cl2+6KOH△KClO3+5KCl+H2O ○,7Cl2+2NaOH====NaCl+NaClO+H2O ○8NaClO+HCl(浓)====Cl2↑+NaOHNaClO+NaCl+H2SO4====Na2SO4+Cl2↑+H2O○9Cl2+H2O====HCl+HClO○102NaCl+2H2O电解Cl2↑+H2↑+2NaOH 2NaCl+MnO2+3H2SO4△2NaHSO4+MnSO4+Cl2↑+2H2O错误!2Na+Cl点燃2NaCl (冒白烟)H2O+Cl2+Na2CO3(足量)====NaCl+NaClO+2NaHCO3Na2CO3+H2O+2Cl2(足量)====2NaCl+2HClO+CO2↑错误!4HCl(浓)+MnO2△MnCl2+2H2O+Cl2↑2KMnO4+16HCl(浓)====2KCl+2MnCl2+5Cl2↑+8H2OKCr2O7+14HCl(浓)====2KCl+2CrCl3 +3Cl2↑+2H2OKClO3+6HCl(浓)====KCl+3Cl2↑+3H2OCa(ClO)2+4HCl(浓)====CaCl2+2Cl2↑+2H2O ○13Cl2+H2点燃2HClH2S+Cl2====2HCl+SH2+Cl光照2HClNa2SO3+Cl2+H2O====Na2SO4+2HCl 2FeCl2+Cl2====2FeCl3○14HCl+NH3====NH4Cl (冒白烟)错误!NH4Cl△NH3↑+HCl↑错误!HCl+AgNO3====HNO3+AgCl↓错误!HCl+NaOH====NaCl+H2OHCl+NaHCO3====NaCl+CO2↑+H2O 错误!2HClO光照2HCl↑+O2↑错误!Ca(ClO)2+2HCl====CaCl2+2HClO Ca(ClO)2+CO2+H2O====CaCO3+2HClO○,20NaOH+HClO====NaClO+H2O HClO+Na2CO3====NaClO+2NaHCO3○,212Cl2+2Ca (OH)2====CaCl2+Ca(ClO)2+2H2O5Cl2+I2+6H2O====2HIO3+10HCl错误!3Cl2+8NH3====N2+6NH4Cl氧(O)元素关系图错误!2O 3====3O 2 O 3+2KI+H 2O====2KOH+I 2+O 2错误!3O 放 电2O 3错误!O 3+H 2S====H 2O+O 2+S ↓ 错误!2H 2O 通 电2H 2↑+O 2↑2H 2O+2F 2====4HF+O 2错误!O 2+2H 点 燃2H 2OO 2+2Cu+2H 2SO 4====2CuSO 4+2H 2O O 2+2H 2S====2S ↓+2H 2O错误!2H 2O 2 2 2H 2O+O 2↑5H 2O 2+2KMnO 4+3H 2SO 4====K 2SO 4+2MnSO 4+5O 2↑+8H 2O错误!2H 2O 2MnO 22H 2O+O 2↑H 2O 2+H 2S====S ↓+2H 2OH 2O 2+2KI+H 2SO 4====K 2SO 4+I 2+2H 2O H 2O 2+Na 2SO 3====Na 2SO 4+H 2O H 2O 2+2FeSO 4+H 2SO 4====Fe 2(SO 4)3+2H 2O错误!2H 2O+Na 2O 2====2NaOH+H 2O 2BaO 2+H 2SO 4(稀)低 温H 2O 2+BaSO 4↓错误!O 2+2Na 点 燃Na 2O 2错误!2Na 2O 2+2CO 2====2Na 2CO 3+O 2↑2Na 2O 2+2H 2O====4NaOH+O 2↑错误!Na 2O 2+H 2SO 4(稀)====Na 2SO 4+H 2O 2 Na 2O 2+2H 2O 低 温2NaOH+H 2O 2错误!H 2O 2+SO 2====H 2SO 4 错误!Na 2O 2+SO 2====Na 2SO 4氮(N)元素关系图重要关系:○,4H 2O →O 2:F 2、电解错误!H 2O 2→O 2:KMnO 4、MnO 2 错误!H 2O 2→H 2O :I —、S 2—、SO 42-、Fe 2+重要关系:错误!HNO3(稀)→NO:HBr、HI、H2S、SO2、SO32—、Fe2+、Fe、Cu、Ag○,26HNO3(浓)→NO2:HBr、HI、H2S、SO2、SO32—、Fe2+、S、C、P、Cu、Ag错误!Mg3N2+8HCl====3MgCl2+2NH4Cl错误!2NH4Cl+Ca(OH)2△2NH3↑+CaCl2+2H2ONH4Cl△NH3↑+HCl↑2NH4Cl+CaO△CaCl2+2NH3↑+H2O错误!NH3+HCl====NH4Cl错误!NH3·H2O+HCl====NH4Cl+H2O3NH3·H2O+FeCl3====Fe(OH)3↓+3NH4Cl错误!NH4Cl+H2O====NH3·H2O+H2ONH4Cl+NaOH====NH3·H2O+NaCl错误!NH3+H2O====NH3·H2O错误!NH3·H2O △NH3↑+H2O错误!N2+3H高温高压催化剂2NH3错误!4NH3+3O2(纯)点燃2N2+6H2O2NH3+3CuO△N2+3Cu+3H2O错误!Mg3N2+6H2O====2NH3↑+3Mg(OH)2错误!3Mg+N点燃Mg3N2错误!NaNO2+NH4Cl△N2↑+NaCl+2H2O错误!N2+O放电NO错误!6NO+4NH3△5N2+6H2O错误!6NO2+8NH3△7N2+12H2O错误!NO+NO2+2NaOH====2NaNO2+H2O 错误!2NaNO2+2NaI+2H2SO4====2NO↑+I2 +2H2O+2Na2SO42NaNO2+2HCl====2NaCl+NO↑+NO2(完整word版)高中化学元素关系图↑+H2O错误!2NO+O2====2NO2错误!3NO2+H2O====2HNO3+NONO2+2KI+H2O====I2+NO+2KOH错误!8HNO3(稀)+3Cu====3Cu(NO3)2+2NO↑+4H2O Fe+2HNO3(稀)====Fe(NO3)3+NO↑+4H2O2HNO3(稀)+3H2S====3S↓+2NO↑+4H2O3Na2SO3+2HNO3(稀)====3NaSO4+2NO↑+4H2O2H2O+3SO2+2HNO3(稀)====3H2SO4+2NO6KI+8HNO3(稀)====6KNO3+3I2+2NO↑+4H2O3FeCl2+4HNO3====2FeCl3+NO↑+Fe( NO3)2+2H2O错误!2HNO2====H2O+NO↑+NO2↑错误!5NaNO2+2KMnO4+3H2SO4====5NaN O3+K2SO4+2MnSO4+3H2O错误!2NaNO3△2NaNO2+O2↑错误!2NO2+2NaOH====NaNO3+NaNO2+ H2O○,253NO2+H2O====2HNO3+NO错误!4HNO3(浓)+Cu====Cu(NO3)2+2NO2+2H2OC+4HNO3(浓)△CO2↑+4NO2↑+2H2OS+6HNO3(浓)△H2SO4+6NO2↑+2H2OP+5HNO3(浓)△H3PO4+5NO2↑+H2O4HNO见光或受热2H2O+4NO2↑+O2↑错误!2Cu(NO3)2△2CuO+4NO2↑+O2↑○,28HNO3+NaOH====NaNO3+H2O 错误!NaNO3+H2SO4(浓)微热NaHSO4+HNO3↑错误!2HNO3+Cu(OH)2====Cu(NO3)2+2H2O○312HNO3(浓)+Ag====AgNO3+NO2↑+H2O3Ag+4HNO3(稀)====3AgNO3+NO↑+2H2O○,322AgNO3+Cu====Cu(NO3)2+2Ag磷(P)元素关系图错误!4P+5O2点燃2P2O5○22P+3Cl点燃2PCl3○,3PCl3+Cl2====PCl5错误!PCl3+3H2O====H3PO3+3HCl错误!2P+3Ca △Ca3P2错误!2P+3H2△2PH3错误!Ca3P2+6H2O====3Ca(OH)2+3PH3↑错误!PCl5+4H2O====H3PO4+5HCl错误!P2O5+3H2O====2H3PO4错误!Ca(H2PO4)2+H2SO4====2H3PO4+CaSO4错误!2H3PO4+Ca(OH)2====Ca(H2PO4)2+2H2O 错误!Ca(H2PO4)2+Ca(OH)2====2CaHPO4+2H2O错误!2CaHPO4+H3PO4====Ca(H2PO4)2错误!2CaHPO4+Ca(OH)2====Ca3(PO4)2+2H 2O错误!Ca3(PO4)2+H3PO4====3CaHPO4错误!Ca3(PO4)2+3H2SO4====3CaSO4+2H3PO4错误!2H3PO4+3Ca(OH)2====Ca3(PO4)2+3H2O碳(C)元素、硅(Si)元素关系图错误!错误!C+2H2高温CH4○,2CH高温C+2H2错误!CH4+2O点燃CO2+2H2O 错误!2C+O点燃2COC+CO高温2CO2C+SiO高温Si+2CO↑3C+CaO3000℃CaC2+CO↑C+H2O高温H2↑+CO↑C+ZnO高温Zn+CO↑错误!C+O 点燃CO2C+2CuO△2Cu+CO2↑○6CO2+2Mg点燃2MgO+C ○,72C+SiO高温Si+2CO↑错误!2CO+O2点燃2CO2CO+CuO△Cu+CO2CO+H2O催化剂、△CO2+H2 2CO+Fe2O高温2Fe+3CO2错误!CO2+C高温2CO ○,10CO2+Ca(OH)2====CaCO3↓+H2O 错误!CaCO3煅烧CaO+CO2↑CaCO3+2HCl====CaCl2+CO2↑+H2O 错误!CO2+2NaOH====Na2CO3+H2O错误!Na2CO3+2H+====2Na++CO2↑错误!Na2CO3+Ca (OH)2====CaCO3↓+2NaOH错误!CaCO3+CO2+H2O====Ca(HCO3)2错误!Ca(HCO32△CaCO3↓+CO2↑+H2O Ca(HCO3)2+Ca(OH)2====2CaCO3↓+2H2 O错误!Ca(HCO3)2+2NaOH====CaCO3↓+Na2CO3+2H2O错误!Na2CO3+H2O+CO2====2NaHCO3 Na2CO3+HCl====NaHCO3+NaCl错误!2NaHCO3△Na2CO3+H2O+CO2↑○20Na 2CO 3+SiO 高 温Na 2SiO 3+CO 2↑错误!Si+2NaOH+H 2O====Na 2SiO 3+2H 2↑错误!Si+O 2 △ SiO 2错误!SiO 2+2C 高 温Si+2CO ↑ 错误!Si+2F 2====SiF 4Si+4HF====SiF 4+2H 2↑错误!SiO 2+2NaOH====Na 2SiO 3+H 2O 错误!H 2SiO 3 △ H 2O+SiO 2○,27Na 2SiO 3+6HF====2NaF+SiF 4+3H 2O○28Na 2SiO 3+2HCl+H 2O====2NaCl+H 4Si O 4↓错误!H 4SiO 4====H 2SiO 3+H 2O 错误!SiO 2+4HF====SiF 4↑+2H 2O钠(Na)元素关系图错误!2Na+S△ Na 2S错误!2Na+O点 燃Na 2O 2错误!2Na+2H 2O====2NaOH+H 2↑ 错误!4Na+O 2====2Na 2O 错误!2Na+H 高 温2NaH 错误!2NaCl(熔融)电 解2Na+Cl 2↑ 错误!2Na+Cl 点 燃2NaCl○,8 +H 2O+H 2↑错误!NaH+H 2O====NaOH+H 2↑(完整word 版)高中化学元素关系图错误!Na 2O+H 2O====2NaOH○,112Na 2O+O 2 △ 2Na 2O 2○,122Na 2O 2+2H 2O====4NaOH+O 2↑错误!2Na 2O 2+2CO 2====2Na 2CO 3+O 2↑ 错误!2NaOH+CO 2====Na 2CO 3+H 2O 错误!Na 2CO 3+Ca(OH)2====2NaOH+CaCO 3↓错误!Na 2CO 3+2HCl====2NaCl+H 2O+CO 2↑○17NaOH+CO 2====NaHCO 3错误!2NaCl+2H 2O电 解2NaOH+H 2↑+Cl 2↑○19NaOH+HCl====NaCl+H 2O错误!NaCl+NH 3+CO 2=H 2O====NH 4Cl+Na HCO 3错误!NaHCO 3+HCl====NaCl+H 2O+CO 2↑错误!NaHCO 3+NaOH====Na 2CO 3+H 2O错误!Na 2CO 3+CO 2+H 2O====2NaHCO 3铝(Al)元素关系图错误!2Al 2O 3(熔融)电解、冰晶石4Al+3O 2↑○,24Al+3O 2====2Al 2O 3重要关系:错误!Al 3+→Al (OH)3:OH -、NH 3·H 2O 、CO 32-、HCO 3—、S 2-、HS —、ClO —、AlO 2-○11 AlO 2— →Al(OH )3:H +、CO 2、Al 3+、Fe 3+、HCO 3—、NH 4+、HSO 3—、H 2PO 4—、Cl 2、NO 2(完整word版)高中化学元素关系图2Al+Fe2O3高温2Fe+2Al2O34Al+3MnO高温3Mn+2Al2O32Al+WO3高温W+Al2O3错误!2Al+6H+====2Al3++3H2↑2Al+3Hg2+====2Al3++3Hg错误!Al2O3+6H+====2Al3++3H2O错误!Al(OH)3+3H+====Al3++3H2O错误!Al3++3OH-====Al(OH)3↓Al3++3NH3·H2O====Al(OH)3↓+3NH4+2Al3++3CO32—+3H2O====2Al(OH)3↓+3CO2↑Al3++3HCO3—====Al(OH)3↓+3CO2↑2Al3++3S2—+6H2O====2Al(OH)3↓+3H2S↑Al3++3HS-3H2O====Al(OH)3↓+3H2S↑Al3++3ClO-+3H2O====Al(OH)3↓+3HCl OAl3++3AlO2—+6H2O====4Al(OH)3↓○7AlO2-+4H+====Al3++2H2O错误!Al3++4OH-====AlO2—+2H2O错误!2Al+2OH—+2H2O====2AlO2-+3H2↑错误!Al(OH)3+OH-====AlO2—+2H2O 错误!AlO2-+H++H2O====Al(OH)3↓2AlO2-+CO2(少量)+3H2O====2Al(OH)3↓+CO32-AlO2-+CO2(足量)+2H2O====Al(OH)3↓+HCO3-3AlO2-+Fe3++6H2O====3Al(OH)3↓+Fe (OH)3↓AlO2-+HCO3-+H2O====Al(OH)3↓+CO3 2—AlO2-+NH4++2H2O====Al(OH)3↓+NH3·H2OAlO2—+HSO3—+H2O====Al(OH)3↓+SO32—2AlO2-+Cl2+3H2O====2Al(OH)3↓+Cl-+ ClO—2AlO2-\+3NO2+3H2O====2Al (OH)3↓+NO+2NO3-AlO2—H2PO4-+H2O====Al(OH)(完整word版)高中化学元素关系图3↓+HPO42-错误!2Al(OH)3△Al2O3+3H2O错误!Al2O3+2OH-====2AlO2—+H2O 铁(Fe)元素关系图重要关系:错误!Fe→Fe2+:Fe3+、Cu2+、H+、I2○,3Fe2+→Fe3+:Cl2、Br2、O2、H2O2、HNO3、MnO4—错误!Fe3+→Fe2+:Zn、Fe、Cu、I—、H2S、SO2错误!Fe→Fe3+:Cl2、Br2、HNO3、H2SO4(浓)△错误!Fe3+→Fe(OH)3:OH—、S2—、HS-、CO32—、HCO3-、AlO2—、ClO-(完整word版)高中化学元素关系图错误!Fe2++Zn====Fe+Zn2+错误!Fe+Cu2+====Cu+Fe2+Fe+2Fe3+====3Fe2+Fe+2H+====Fe2++H2Fe+I2====Fe2++2I—○32Fe2++Cl2====2Fe3++2Cl—2Fe2++Br2====2Fe3++2Br—4Fe2++O2+4H+====4Fe3++2H2O2Fe2++H2O2+2H+====2Fe3++2H2O5Fe2++MnO4-+8H+====5Fe3++Mn2++ 4H2O3Fe2++NO3-+4H+====3Fe3++NO↑+2H 2O错误!2Fe3++Zn====2Fe2++Zn2+2Fe3++Cu====2Fe2++Cu2+2Fe3++2I-====2Fe2++I22Fe3++H2S====2Fe2++S↓+2H+2Fe3++SO2+2H2O====SO42-+2Fe2++4 H+错误!2Fe3++3Zn====2Fe+3Zn2+○6Fe+NO3—+4H+====Fe3++NO↑+2H2OFe+6H2SO4(浓)△Fe2(SO4)3+3SO2↑+6H2O错误!FeO+2H+====Fe2++H2O○,8Fe(OH)2+2H+====Fe2++2H2O错误!Fe2++2OH-====Fe(OH)2↓错误!Fe3O4+8H+====Fe2++2Fe3++4H2O Fe3O4+8HI====3FeI2+I2+4H2O错误!4Fe(OH)2+O2+2H2O====4Fe(OH)3○123Fe3O4+28HNO3====9Fe (NO3)3+NO↑+14H2O错误!Fe3++3NH3·H2O====Fe(OH)3↓+3NH4+○,14Fe(OH)3+3H+====Fe3++3H2O错误!Fe2O3+6H+====2Fe3++3H2O○,16Fe3++3SCN-====Fe(SCN)3错误!Fe(OH)2隔绝空气、△FeO+H2O○182Fe(OH)3△FeO+H2O错误!Fe2O3+3CO高温2Fe+3CO23Fe3O4+8Al高温9Fe+4Al2O32FeO+Si高温2Fe+SiO2○,206FeO+O2△2Fe3O4○213Fe+2O2点燃Fe3O43Fe+4H2O(g)高温Fe3O4+4H2○,222Fe(过量)+O2高温2FeO (炼钢炉中的反应)错误!Fe+S△FeS错误!FeS2△FeS+S错误!4FeS2+11O高温2Fe2O3+8SO2错误!2Fe2++5ClO-+5H2O====2Fe(OH)3↓+4HClO+Cl-6Fe2++3ClO-+3H2O====2Fe(OH)3↓+4Fe3++3Cl-4Fe2++4Na2O2+6H2O====4Fe(OH)3↓+8Na++O26Fe2++3Na2O2+6H2O====4Fe(OH)3↓+2Fe3++6Na+铜(Cu)元素关系图重要关系:错误!CuO→Cu:H2、CO、NH3、C、CH3CH2OH错误!Cu→Cu2+:O2、HNO3、H2SO4(浓)、H2O2、Fe3+错误!Cu(OH)2→C u2O:CH3CHO、HCHO、H—COOH错误!Cu2(OH)2CO3+4H+====2Cu2++CO2↑+3H2O错误!2Cu+S △Cu2S错误!2Cu+O2+CO2+H2O====Cu2(OH)2CO3错误!CuO+H2△Cu+H2O3CuO+2NH3△N2+3Cu+3H2OCuO+CO△Cu+CO2CuO+CH3CH2OH−→−∆Cu+CH3CHO+H2 O错误!2Cu+O2△2CuO4Cu+2NO2△4CuO+N2错误!Cu2++Zn====Zn2++Cu○,72Cu+O2+2H2SO4(稀)△2CuSO4+2H2O3Cu+8HNO3(稀)====3Cu (NO3)2+2NO↑+4H2OCu+2H2SO4△CuSO4+SO2↑+2H2O Cu+H2O2+H2SO4(稀)====CuSO4+2H2O2FeCl3+Cu====CuCl2+2FeCl2○8Cu2(OH)2CO3△2CuO+H2O+CO2↑错误!4CuO 高温2Cu2O+O2↑错误!Cu(OH)2△CuO+H2O错误!CuO+2H+====Cu2++H2O 错误!Cu2+H2S====CuS↓+2H+错误!3CuS+8HNO3(稀)====3Cu(NO3)2+3S↓+2NO↑+4H2O错误!Cu(OH)2+2H+====Cu2++2H2O错误!Cu2++2OH—====Cu(OH)2↓错误!2Cu (OH)2+R—CHO+NaOH−→−∆R—COO Na+Cu2O↓+3H2O2Cu(OH)2+H-COOH+2NaOH−→−∆Na2CO3 +Cu2O↓+4H2O4Cu(OH)2+H—CHO+2NaOH−→−∆Na2CO3+2Cu2O↓+6H2O错误!Cu(OH)2+4NH3====[Cu(NH3)4](OH)2错误!Cu2O+2H+====Cu+Cu2++H2O高中化学17≡≡种常见气体的实验室制法Cl2:4HCl+MnO2△Cl2+MnCl2+2H2O HCl:2NaCl+H2SO4△Na2SO4+2HClHBr:NaBr+H3PO4△NaH2PO4+HBr HI:KI+H3PO4△KH2PO4+HIO2:2KMnO4△K2MnO4+MnO2+O2 SO2:Na2SO3+H2SO4====Na2SO4+H2O +SO2H2S:FeS+H2SO4====FeSO4+H2SNH3:2NH4Cl+Ca(OH)2△2NH3+CaCl2+2H2ON2:NH4NO2△N2+2H2ONO:3Cu+8HNO3====3Cu(NO3)2+2NO+4H2ONO2:Cu+4HNO3====Cu(NO3)2+2NO2+2H2OCO2:CaCO3+2HCl====CaCl2+CO2+H2O CO:HCOOH△、浓硫酸CO+H2OCH4:CH2COONa+NaOH△、碱石灰Na2CO3+CH4CH2=CH2:C2H5OH浓硫酸、170℃CH2=CH2+H2O CH≡CH:CaC2+2H2O−→−Ca(OH)2+CH≡CHH2:Zn+H2SO4====ZnSO4+H2。
高中化学基础知识网络图完整版
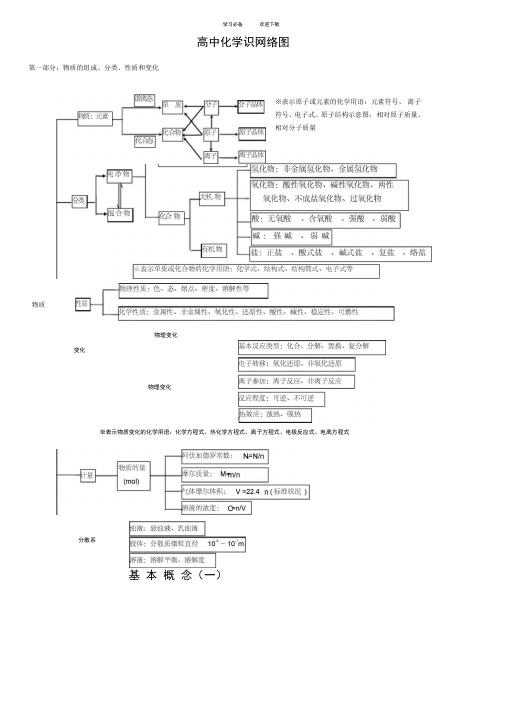
学习必备欢迎下载高中化学识网络图第一部分:物质的组成、分类、性质和变化※表示原子或元素的化学用语:元素符号、离子符号、电子式、原子结构示意图;相对原子质量、相对分子质量物质物理变化变化物理变化※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式分散系基本概念(一)学习必备欢迎下载色、态、味金属性、非金属性 兀素容解度、熔点、沸点 密度、硬度、导电性导热性、塑性化合态大多数有机物稀有气体 氧化性、还原性 酸性、碱性 稳定性、可燃性气态及挥发性物质■单质宏观纯净物1性质 化学,物理性质游离态化合物槽化合物分类非金属稀有气体物质无机物 「金属氢化物L 非金属氢化物分子晶体 氧化物变化有机物酸性 碱性 原子晶体 石墨(混合晶体) 微观L 成盐氧化物不成盐氧化物 含氧酸、无氧酸曲厶-酸强酸、弱酸两性 特殊丈多数盐 强 碱 离子晶体 碱性氧化物部分过氧化物 金属晶体 离 子可溶碱、难容碱正盐 •酸式盐 碱式盐 复盐;络盐潮解、分馏物理变化升华、萃取 溶解、盐析化学变化风化、干馏裂化、裂解混合物念(二)学习必备欢迎下载第二部分:基本理论(物质结构、化学反应速率、化学平衡、、电解质溶液)比鞭〜一类型— 离子晶体原子晶体 分子晶体 构成晶体微粒 —阴、阳离子原子 分子 形成晶体作用力离子键共价键 范德华力物理性质熔沸点P较咼 很高 低 硬度硬而脆大小 导电性 熔融导由 不良水溶液.绝缘体(半导体)不良 传热性 不良 不良 不良 延展性 不良不良不良 溶解性 易溶于极性溶剂不溶于任何溶剂相似相溶典型实例NaCI , KBr单质:金刚石、 SiC 、 Si 、SiO 2单质:H 2、O 2 化合物:冰、干冰 花学反应速率化学反应速率和化学平衡内因(主)反应物的结构、性质 化学反应影响因素应用F的选择外因(辅)化学平衡、化学反应速率浓度 压强 温度 催化剂其他条件——光、超声波、激光、放射线…影响化学平衡因素平衡移动原理(勒沙特列原理)计算等于该反应方程式的系数比化学平衡可逆反应温度比^-■装置 原电池电解池能量转换 (实质) 化学能T 电能(两极分别发生氧化还原反应产生电流)电能T 化学能(在电流作用下两极分别发生氧化还原反应) 装置特点 外电路无电源;两极为活泼性不同 (或其中之一为能导电的非金属)的金属外电路必须有直流电源;两极材料均 能导电即可电极名称 负极(一)——较活泼 正极(+ )较不活泼阴极一一连接电源负极 阳极一一连接电源正极 电子流向负极(一)丿正极(+ )电源负极事阴极电源正极-e 阳极电极反应负极:M — n (氧化 M n+活泼金属失去电子 被氧化、被溶解、被腐蚀。
元素化合物转化关系图(高中)

元素化合物转化关系图(高中)金属部分按照“单质------氧化物-------氢氧化物----------盐”为线索进行搜罗寻找关系:钠Na铝Al铁FeNa 2SNa 2ONaOHNaClNa 2CO 3Na 2O 2NaC 2H 5ONaNaCl CH 3COONaNaHCO 3Al 2O 3Al Al(OH)3NaAlO 2AlCl 3(Al 3+)H 2O(沸腾) 电解 O 2HCl NaOHNaOHCO 2或HCl NaOHNaOH HClHClHClNaOH稀 FeFeO FeCl 3 Fe(OH)2FeSFe 2O 3 Fe 3O 4FeCl 2Fe(OH)3 FeSO 4 Fe 2(SO 4)3 Fe(SCN)3 Fe(SCN)3SHClH 2SO 4 O 2 CO 等HCl Cl 2 Fe KSCN KSCN Na 2S H 2SO 4 Cl 2、HNO 3 浓 O 2和H 2ONaOH HClNaOH H 2SO 4H 2SO 4 CO O 2O 2 Na 2S HCl镁Mg铜Cu钙CaMg 3N 2MgOMg(OH)2MgX 2Cl 2CO 2H 2OX 2Mg MgO Mg(OH)2 MgCO 3△ MgCl 2 H 2OH 2ON 2HCl NaOH HCl 电解Mg(HCO 3)2 煅烧O 2HClH 2O CO 2 △或 OH -HCl CuCuO Cu(OH)2Cu 2+(NO 3-、SO42-)Cu 2SNH 3•H 2O[Cu(NH 3)4]2+CuSCu 2ONa 2S SH + HNO 3或H 2SO 4(浓)NaOH O 2 CO 、Al 、H△H +Ca(OH)2HClHCl H 2OHClNa 2CO 3CO 2+H 2OCaCaO CaHPO 4△CaCl 2CaCO 3 CaC 2 C(电炉)Ca(HCO 3)2O 2 H 2OH 3PO 4HClCO 2Ca(ClO)2H 2OCl 2或 CO 2非金属部分按照“化合价”寻找各类物质,主要有氢化物、单质、氧化物、含氧酸、及其盐:氯Cl硫SCl2HCl CH3ClCa(ClO)FeCl3CuCl2PCl3、PCl5NaClOHClOCH2ClCH2ClO 2FeCl2CO2NaClCuCl2H2CH2=CHClHBr NaBrAgBrHI NaIAgIBr2I2ClFeS2S H2S Na2SSO2Na2SO3FeSSO3 Na2SO4BaSO4PbSCuSBaSO3 H2SO3H2SO4氮N碳与硅 C 、SiMg 3N 2N 2NONO 2N 2O 4NH 4Cl NH 3 NaNO3 HNO 3 Cu(NO 3)2[Ag (NH 3)2]+NH 3·H 2O(C 6H 7O 2) NO 2NO 2NO 2 n或 NO 2 Si C SiO 2H 2SiO 3CaSiO3H 4SiO 4Na 2SiO 3 SiH 4 SiF 4 SiCl 4CO 2 CO H 2CO 3 Ca(HCO 3) 2CaCO 3CaC 2CaOCa(OH)2磷P\氢与氧 H 、OPP 2O 5PCl 3PCl 5HPO 3H 3PO 4Na 3PO 4Ca 3(PO 4)2Ca (H 2PO 4)2CaHPO 4 H 2 H 2OO 2CH 3COOHCH 3CH 2OHKMnO 4HgOKClO 3 Na 2O 2H 2SO 4 CH 4ZnNH 4ClNH 3Cu Ca(OH)2Fe 3O 4 SO 2 CO 2+H 2O。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
硫(S)元素关系图重要关系:○9H2S→S:SO2、Cl2、Ca(ClO)2、Br2、I2、KMnO4、K2Cr2O7、KNO3、H2O、Fe3+、O2、浓H2SO4 ○21SO2→SO42-:H2O2、X2、HNO3、KMnO4、Ca(ClO)2、Na2O2○22H2SO4(浓)→SO2:Cu、C、S、P、HBr、HI、H2S○23SO32-→SO42-:Cl2、Br2、I2、O2、KMnO4、K2Cr2O7、HNO3、H2O2、Na2O2○1Na2S+CuSO4====Na2SO4+CuS↓○2H2S+CuSO4====CuS↓+H2SO4○3Na2S+H2SO4(稀)====Na2SO4+H2S↑○4H2S+2NaOH====Na2S+2H2O○5Na2S+FeSO4====FeS↓+Na2SO4○6FeS+H2SO4(稀)====FeSO4+H2S↑○72H2S+3O点燃2H2O+2SO2○8S+H2△H2S○9H2S+Cl2====2HCl+S↓2H2S+SO2====3S↓+2H2OH2S+Br2====2HBr+S↓H2S+I2====2HI+S↓5H2S+2KMnO4+3H2SO4====5S↓+K2SO4 +2MnSO4+8H2O3H2S+K2Cr2O7+4H2SO4====3S↓+K2SO4 +Cr2(SO4)3+7H2O3H2S+2HNO3(稀)====3S↓+2NO↑+2H2O H2S+H2O2====S↓+2H2OH2S+2FeCl3====S↓+2FeCl2+2HCl2H2S+O2====2S↓+2H2OH2S+H2SO4(浓)====SO2↑+S↓+2H2O2H2S+Ca(ClO)2====2S↓+CaCl2+2HCl○10S+2Cu△Cu2S○11Na2S2O3+2HCl====2NaCl+S↓+SO2↑+H2O ○12S+O SO2○133SO2+2Na2S====3S↓+2Na2SO3○14H2SO3+2H2S====3H2O+3S↓○154FeS2+11O2Fe2O3+8SO2○16SO2+2NaOH====Na2SO3+H2OH2O+2Na2CO3+SO2(少量)====Na2SO3+2NaHCO3Na2CO3+SO2(适量)====Ma2SO3+CO2○17Na2SO3(s)+H2SO4(浓)====Na2SO4+SO2↑+H2O ○18SO2+Na2O2====Na2SO4SO2+2NaClO+H2O====Na2SO4+2HCl○192SO2+O催化剂2SO3○205SO3+2P△P2O5+5SO2○21SO2+H2O2====H2SO4SO2+X2+2H2O====H2SO4+2HX(X=Cl、Br、I)2SO2+O2+2H2O====2H2SO43SO2+2HNO3(稀)+2H2O====2NO+3H2SO4 5SO2+2KMnO4+2H2O====K2SO4+2MnSO4+2H2SO4 ○222H2SO4(浓)+Cu====CuSO4+SO2↑+2H2O2P+5H2SO4(浓)△2H3PO4+5SO2↑+2H2O C+2H2SO4(浓)△CO2↑+2SO2↑+2H2OS+2H2SO4(浓)△3SO2↑+2H2O2HBr+H2SO4(浓)====Br2+SO2+2H2O2HI+H2SO4(浓)====I2+SO2+2H2O○23SO32-+Cl2+H2O====SO42-+2Cl-+2H+2H2SO3+O2====2H2SO42Na2SO3+O2====2Na2SO4○24Na2SO3+2Na2S+3H2SO4====3S↓+3Na2SO4 +3H2O○253Na2S+2FeCl3+H2O====6NaCl+3H2S↑+2Fe(OH)3↓氯(Cl)元素关系图重要关系:○12HCl→Cl2:MnO2、KMnO4、K2Cr2O7、KClO3、Ca(ClO)2 Cl2→Cl-:H2S、SO2、SO42-、Br-、I-、Fe2+○1Cl2+2FeCl2====2FeCl32Fe+3Cl2点燃2FeCl3(冒棕褐色烟)○2Cl2+Cu点燃CuCl2(冒棕黄色烟)○3Cl2+2I-====I2+2Cl-○4Cl2+2Br-====Br2+2Cl-○5Cl2+SO2+2H2O====2HCl+H2SO4○63Cl2+6KOH△KClO3+5KCl+H2O○7Cl2+2NaOH====NaCl+NaClO+H2O○8NaClO+HCl(浓)====Cl2↑+NaOHNaClO+NaCl+H2SO4====Na2SO4+Cl2↑+H2O ○9Cl2+H2O====HCl+HClO○102NaCl+2H2O电解Cl2↑+H2↑+2NaOH2NaCl+MnO2+3H2SO4△2NaHSO4+MnSO4 +Cl2↑+2H2O ○112Na+Cl点燃2NaCl (冒白烟)H2O+Cl2+Na2CO3(足量)====NaCl+NaClO+ 2NaHCO3Na2CO3+H2O+2Cl2(足量)====2NaCl+2HClO +CO2↑○124HCl(浓)+MnO2△MnCl2+2H2O+Cl2↑2KMnO4+16HCl(浓)====2KCl+2MnCl2+5Cl2↑+8H2OKCr2O7+14HCl(浓)====2KCl+2CrCl3+3Cl2↑+2H2OKClO3+6HCl(浓)====KCl+3Cl2↑+3H2O Ca(ClO)2+4HCl(浓)====CaCl2+2Cl2↑+2H2O ○13Cl2+H点燃2HClH2S+Cl2====2HCl+SH2+Cl光照2HClNa2SO3+Cl2+H2O====Na2SO4+2HCl2FeCl2+Cl2====2FeCl3○14HCl+NH3====NH4Cl (冒白烟)○15NH4Cl△NH3↑+HCl↑○16HCl+AgNO3====HNO3+AgCl↓○17HCl+NaOH====NaCl+H2OHCl+NaHCO3====NaCl+CO2↑+H2O ○182HClO光照2HCl↑+O2↑○19Ca(ClO)2+2HCl====CaCl2+2HClOCa(ClO)2+CO2+H2O====CaCO3+2HClO ○20NaOH+HClO====NaClO+H2OHClO+Na2CO3====NaClO+2NaHCO3○212Cl2+2Ca(OH)2====CaCl2+Ca(ClO)2+2H2O 5Cl2+I2+6H2O====2HIO3+10HCl○223Cl2+8NH3====N2+6NH4Cl氧(O)元素关系图○12O3====3O2O3+2KI+H2O====2KOH+I2+O2○23O放电2O3○3O3+H2S====H2O+O2+S↓○42H2O通电2H2↑+O2↑2H2O+2F2====4HF+O2○5O2+2H点燃2H2OO2+2Cu+2H2SO4====2CuSO4+2H2O O2+2H2S====2S↓+2H2O○62H2O2MnO2 2H2O+O2↑5H2O2+2KMnO4+3H2SO4====K2SO4 +2MnSO4+5O2↑+8H2O重要关系:○4H2O→O2:F2、电解○6H2O2→O2:KMnO4、MnO2○7H2O2→H2O:I-、S2-、SO42-、Fe2+ 8○72H2O2MnO22H2O+O2↑H2O2+H2S====S↓+2H2OH2O2+2KI+H2SO4====K2SO4+I2+2H2OH2O2+Na2SO3====Na2SO4+H2OH2O2+2FeSO4+H2SO4====Fe2(SO4)3+2H2O ○82H2O+Na2O2====2NaOH+H2O2BaO2+H2SO4(稀)低温H2O2+BaSO4↓○9O2+2Na点燃Na2O2○102Na2O2+2CO2====2Na2CO3+O2↑2Na2O2+2H2O====4NaOH+O2↑○11Na2O2+H2SO4(稀)====Na2SO4+H2O2 Na2O2+2H2O低温2NaOH+H2O2○12H2O2+SO2====H2SO4○13Na2O2+SO2====Na2SO4氮(N)元素关系图重要关系:○20HNO3(稀)→NO:HBr、HI、H2S、SO2、SO32-、Fe2+、Fe、Cu、Ag○26HNO3(浓)→NO2:HBr、HI、H2S、SO2、SO32-、Fe2+、S、C、P、Cu、Ag○1Mg3N2+8HCl====3MgCl2+2NH4Cl○22NH4Cl+Ca(OH)2△2NH3↑+CaCl2+2H2O NH4Cl△NH3↑+HCl↑2NH4Cl+CaO△CaCl2+2NH3↑+H2O ○3NH3+HCl====NH4Cl○4NH3·H2O+HCl====NH4Cl+H2O3NH3·H2O+FeCl3====Fe(OH)3↓+3NH4Cl○5NH4Cl+H2O====NH3·H2O+H2ONH4Cl+NaOH====NH3·H2O+NaCl○6NH3+H2O====NH3·H2O○7NH3·H2O△NH3↑+H2O○8N2+3H2高温高压催化剂2NH3○94NH3+3O2(纯)点燃2N2+6H2O2NH3+3CuO△N2+3Cu+3H2O○10Mg3N2+6H2O====2NH3↑+3Mg(OH)2○113Mg+N2点燃Mg3N2○12NaNO2+NH4Cl△N2↑+NaCl+2H2O○13N2+O放电NO○146NO+4NH3△5N2+6H2O○156NO2+8NH3△7N2+12H2O○16NO+NO2+2NaOH====2NaNO2+H2O○172NaNO2+2NaI+2H2SO4====2NO↑+I2+2H2O +2Na2SO42NaNO2+2HCl====2NaCl+NO↑+NO2↑+H2O ○182NO+O2====2NO2○193NO2+H2O====2HNO3+NONO2+2KI+H2O====I2+NO+2KOH○208HNO3(稀)+3Cu====3Cu(NO3)2+2NO↑+4H2O Fe+2HNO3(稀)====Fe(NO3)3+NO↑+4H2O 2HNO3(稀)+3H2S====3S↓+2NO↑+4H2O3Na2SO3+2HNO3(稀)====3NaSO4+2NO↑+4H2O2H2O+3SO2+2HNO3(稀)====3H2SO4+2NO6KI+8HNO3(稀)====6KNO3+3I2+2NO↑+4H2O3FeCl2+4HNO3====2FeCl3+NO↑+Fe(NO3)2 +2H2O○212HNO2====H2O+NO↑+NO2↑○225NaNO2+2KMnO4+3H2SO4====5NaNO3+K2SO4+2MnSO4+3H2O○232NaNO3△2NaNO2+O2↑○242NO2+2NaOH====NaNO3+NaNO2+H2O○253NO2+H2O====2HNO3+NO○264HNO3(浓)+Cu====Cu(NO3)2+2NO2+2H2O C+4HNO3(浓)△CO2↑+4NO2↑+2H2OS+6HNO3(浓)△H2SO4+6NO2↑+2H2OP+5HNO3(浓)△H3PO4+5NO2↑+H2O4HNO见光或受热2H2O+4NO2↑+O2↑○272Cu(NO3)2△2CuO+4NO2↑+O2↑○28HNO3+NaOH====NaNO3+H2O○29NaNO3+H2SO4(浓)微热NaHSO4+HNO3↑○302HNO3+Cu(OH)2====Cu(NO3)2+2H2O○312HNO3(浓)+Ag====AgNO3+NO2↑+H2O3Ag+4HNO3(稀)====3AgNO3+NO↑+2H2O○322AgNO3+Cu====Cu(NO3)2+2Ag磷(P)元素关系图○14P+5O 2点燃2P 2O 5 ○22P+3Cl 2点 燃2PCl 3 ○3PCl 3+Cl 2====PCl 5 ○4PCl 3+3H 2O====H 3PO 3+3HCl ○52P+3Ca △ Ca 3P 2 ○62P+3H 2 △ 2PH 3 ○7Ca 3P 2+6H 2O====3Ca(OH)2+3PH 3↑ ○8PCl 5+4H 2O====H 3PO 4+5HCl ○9P 2O 5+3H 2O====2H 3PO 4 ○10Ca(H 2PO 4)2+H 2SO 4====2H 3PO 4+CaSO 4 ○112H 3PO 4+Ca(OH)2====Ca(H 2PO 4)2+2H 2O ○12Ca(H 2PO 4)2+Ca(OH)2====2CaHPO 4+2H 2O ○132CaHPO 4+H 3PO 4====Ca(H 2PO 4)2 ○142CaHPO 4+Ca(OH)2====Ca 3(PO 4)2+2H 2O ○15Ca 3(PO 4)2+H 3PO 4====3CaHPO 4 ○16Ca 3(PO 4)2+3H 2SO 4====3CaSO 4+2H 3PO 4 ○172H 3PO 4+3Ca(OH)2====Ca 3(PO 4)2+3H 2O碳(C)元素、硅(Si)元素关系图○15○1C+2H高温CH4○2CH4高温C+2H2○3CH4+2O点燃CO2+2H2O ○42C+O点燃2COC+CO高温2CO2C+SiO高温Si+2CO↑3C+CaO℃CaC2+CO↑C+H2O高温H2↑+CO↑C+ZnO高温Zn+CO↑○5C+O点燃CO2C+2CuO△2Cu+CO2↑○6CO2+2Mg点燃2MgO+C○72C+SiO2高温Si+2CO↑○82CO+O点燃2CO2CO+CuO△Cu+CO2CO+H2O催化剂、△CO2+H22CO+Fe2O高温2Fe+3CO2○9CO2+C高温2CO○10CO2+Ca(OH)2====CaCO3↓+H2O○11CaCO煅烧CaO+CO2↑CaCO3+2HCl====CaCl2+CO2↑+H2O○12CO2+2NaOH====Na2CO3+H2O○13Na2CO3+2H+====2Na++CO2↑○14Na2CO3+Ca(OH)2====CaCO3↓+2NaOH ○15CaCO3+CO2+H2O====Ca(HCO3)2○16Ca(HCO3)2△CaCO3↓+CO2↑+H2OCa(HCO3)2+Ca(OH)2====2CaCO3↓+2H2O ○17Ca(HCO3)2+2NaOH====CaCO3↓+Na2CO3 +2H2O○18Na2CO3+H2O+CO2====2NaHCO3Na2CO3+HCl====NaHCO3+NaCl○192NaHCO3△Na2CO3+H2O+CO2↑○20Na2CO3+SiO高温Na2SiO3+CO2↑○21Si+2NaOH+H2O====Na2SiO3+2H2↑○22Si+O2△SiO2○23SiO2+2C高温Si+2CO↑○24Si+2F2====SiF4Si+4HF====SiF4+2H2↑○25SiO2+2NaOH====Na2SiO3+H2O○26H2SiO3△H2O+SiO2○27Na2SiO3+6HF====2NaF+SiF4+3H2O○28Na2SiO3+2HCl+H2O====2NaCl+H4SiO4↓○29H4SiO4====H2SiO3+H2O○30SiO2+4HF====SiF4↑+2H2O钠(Na)元素关系图○12Na+S△Na2S○22Na+O2点燃Na2O2 ○32Na+2H2O====2NaOH+H2↑○44Na+O2====2Na2O○52Na+H高温2NaH○62NaCl(熔融)电解2Na+Cl 2↑ ○72Na+Cl 点 燃2NaCl ○8+H 2O+H 2↑ ○9NaH+H 2O====NaOH+H 2↑ ○10Na 2O+H 2O====2NaOH ○112Na 2O+O 2 △ 2Na 2O 2 ○122Na 2O 2+2H 2O====4NaOH+O 2↑ ○132Na 2O 2+2CO 2====2Na 2CO 3+O 2↑ ○142NaOH+CO 2====Na 2CO 3+H 2O ○15Na 2CO 3+Ca(OH)2====2NaOH+CaCO 3↓ ○16Na 2CO 3+2HCl====2NaCl+H 2O+CO 2↑ ○17NaOH+CO 2====NaHCO 3 ○182NaCl+2H 2O 电 解2NaOH+H 2↑+Cl 2↑ ○19NaOH+HCl====NaCl+H 2O ○20NaCl+NH 3+CO 2=H 2O====NH 4Cl+NaHCO 3 ○21NaHCO 3+HCl====NaCl+H 2O+CO 2↑ ○22NaHCO 3+NaOH====Na 2CO 3+H 2O ○23Na 2CO 3+CO 2+H 2O====2NaHCO 3铝(Al )元素关系图重要关系:○6Al 3+→Al(OH)3:OH -、NH 3·H 2O 、CO 32-、HCO 3-、S 2-、HS -、ClO -、AlO 2- ○11 AlO 2- →Al(OH)3:H +、CO 2、Al 3+、Fe 3+、HCO 3-、NH 4+、HSO 3-、H 2PO 4-、Cl 2、NO 2○12Al2O3(熔融)电解、冰晶石4Al+3O2↑○24Al+3O2====2Al2O32Al+Fe2O3高温2Fe+2Al2O34Al+3MnO高温3Mn+2Al2O32Al+WO高温W+Al2O3○32Al+6H+====2Al3++3H2↑2Al+3Hg2+====2Al3++3Hg○4Al2O3+6H+====2Al3++3H2O○5Al(OH)3+3H+====Al3++3H2O○6Al3++3OH-====Al(OH)3↓Al3++3NH3·H2O====Al(OH)3↓+3NH4+2Al3++3CO32-+3H2O====2Al(OH)3↓+3CO2↑Al3++3HCO3-====Al(OH)3↓+3CO2↑2Al3++3S2-+6H2O====2Al(OH)3↓+3H2S↑Al3++3HS-3H2O====Al(OH)3↓+3H2S↑Al3++3ClO-+3H2O====Al(OH)3↓+3HClO Al3++3AlO2-+6H2O====4Al(OH)3↓○7AlO2-+4H+====Al3++2H2O ○8Al3++4OH-====AlO2-+2H2O○92Al+2OH-+2H2O====2AlO2-+3H2↑○10Al(OH)3+OH-====AlO2-+2H2O○11AlO2-+H++H2O====Al(OH)3↓2AlO2-+CO2(少量)+3H2O====2Al(OH)3↓+CO32-AlO2-+CO2(足量)+2H2O====Al(OH)3↓+HCO3-3AlO2-+Fe3++6H2O====3Al(OH)3↓+Fe(OH)3↓AlO2-+HCO3-+H2O====Al(OH)3↓+CO32-AlO2-+NH4++2H2O====Al(OH)3↓+NH3·H2O AlO2-+HSO3-+H2O====Al(OH)3↓+SO32-2AlO2-+Cl2+3H2O====2Al(OH)3↓+Cl-+ClO- 2AlO2-\+3NO2+3H2O====2Al(OH)3↓+NO+2NO3-AlO2-H2PO4-+H2O====Al(OH)3↓+HPO42-○122Al(OH)3△Al2O3+3H2O○13Al2O3+2OH-====2AlO2-+H2O铁(Fe)元素关系图重要关系:○2Fe→Fe2+:Fe3+、Cu2+、H+、I2○3Fe2+→Fe3+:Cl2、Br2、O2、H2O2、HNO3、MnO4-○4Fe3+→Fe2+:Zn、Fe、Cu、I-、H2S、SO2○6Fe→Fe3+:Cl2、Br2、HNO3、H2SO4(浓)△○13Fe3+→Fe(OH)3:OH-、S2-、HS-、CO32-、HCO3-、AlO2-、ClO-○1Fe2++Zn====Fe+Zn2+○2Fe+Cu2+====Cu+Fe2+Fe+2Fe3+====3Fe2+Fe+2H+====Fe2++H2Fe+I2====Fe2++2I-○32Fe2++Cl2====2Fe3++2Cl-2Fe2++Br2====2Fe3++2Br-4Fe2++O2+4H+====4Fe3++2H2O 2Fe2++H2O2+2H+====2Fe3++2H2O5Fe2++MnO4-+8H+====5Fe3++Mn2++4H2O 3Fe2++NO3-+4H+====3Fe3++NO↑+2H2O ○42Fe3++Zn====2Fe2++Zn2+2Fe3++Cu====2Fe2++Cu2+2Fe3++2I-====2Fe2++I22Fe3++H2S====2Fe2++S↓+2H+2Fe3++SO2+2H2O====SO42-+2Fe2++4H+○52Fe3++3Zn====2Fe+3Zn2+○6Fe+NO3-+4H+====Fe3++NO↑+2H2OFe+6H2SO4(浓)△Fe2(SO4)3+3SO2↑+6H2O ○7FeO+2H+====Fe2++H2O○8Fe(OH)2+2H+====Fe2++2H2O○9Fe2++2OH-====Fe(OH)2↓○10Fe3O4+8H+====Fe2++2Fe3++4H2OFe3O4+8HI====3FeI2+I2+4H2O○114Fe(OH)2+O2+2H2O====4Fe(OH)3○123Fe3O4+28HNO3====9Fe(NO3)3+NO↑+14H2O ○13Fe3++3NH3·H2O====Fe(OH)3↓+3NH4+○14Fe(OH)3+3H+====Fe3++3H2O○15Fe2O3+6H+====2Fe3++3H2O○16Fe3++3SCN-====Fe(SCN)3○17Fe(OH)隔绝空气、△FeO+H2O○182Fe(OH)3△FeO+H2O○19Fe2O3+3CO高温2Fe+3CO23Fe3O4+8Al高温9Fe+4Al2O32FeO+Si高温2Fe+SiO2○206FeO+O2△2Fe3O4○213Fe+2O点燃Fe3O43Fe+4H2O(g)高温Fe3O4+4H2○222Fe(过量)+O高温2FeO (炼钢炉中的反应)○23Fe+S△FeS○24FeS2△FeS+S○254FeS2+11O2高温2Fe2O3+8SO2○262Fe2++5ClO-+5H2O====2Fe(OH)3↓+4HClO+Cl-6Fe2++3ClO-+3H2O====2Fe(OH)3↓+4Fe3++3Cl-4Fe2++4Na2O2+6H2O====4Fe(OH)3↓+8Na++O26Fe2++3Na2O2+6H2O====4Fe(OH)3↓+2Fe3++6Na+铜(Cu)元素关系图重要关系:○4CuO→Cu:H2、CO、NH3、C、CH3CH2OH○7Cu→Cu2+:O2、HNO3、H2SO4(浓)、H2O2、Fe3+ ○16Cu(OH)2→Cu2O:CH3CHO、HCHO、H—COOH○1Cu2(OH)2CO3+4H+====2Cu2++CO2↑+3H2O ○22Cu+S△Cu2S ○32Cu+O2+CO2+H2O====Cu2(OH)2CO3○4CuO+H2△Cu+H2O3CuO+2NH3△N2+3Cu+3H2OCuO+CO△Cu+CO2CuO+CH3CH2OH−→−∆Cu+CH3CHO+H2O ○52Cu+O2△2CuO4Cu+2NO2△4CuO+N2○6Cu2++Zn====Zn2++Cu○72Cu+O2+2H2SO4(稀)△2CuSO4+2H2O3Cu+8HNO3(稀)====3Cu(NO3)2+2NO↑+4H2O Cu+2H2SO4△CuSO4+SO2↑+2H2OCu+H2O2+H2SO4(稀)====CuSO4+2H2O2FeCl3+Cu====CuCl2+2FeCl2○8Cu2(OH)2CO3△2CuO+H2O+CO2↑○94CuO高温2Cu2O+O2↑○10Cu(OH)2△CuO+H2O ○11CuO+2H+====Cu2++H2O○12Cu2+H2S====CuS↓+2H+○133CuS+8HNO3(稀)====3Cu(NO3)2+3S↓+2NO↑+4H2O○14Cu(OH)2+2H+====Cu2++2H2O○15Cu2++2OH-====Cu(OH)2↓○162Cu(OH)2+R—CHO+NaOH−→−∆R—COONa +Cu2O↓+3H2O2Cu(OH)2+H—COOH+2NaOH−→−∆Na2CO3 +Cu2O↓+4H2O4Cu(OH)2+H—CHO+2NaOH−→−∆Na2CO3 +2Cu2O↓+6H2O○17Cu(OH)2+4NH3====[Cu(NH3)4](OH)2○18Cu2O+2H+====Cu+Cu2++H2O高中化学17≡≡种常见气体的实验室制法Cl2:4HCl+MnO2△Cl2+MnCl2+2H2OHCl:2NaCl+H2SO4△Na2SO4+2HClHBr:NaBr+H3PO4△NaH2PO4+HBrHI:KI+H3PO4△KH2PO4+HIO2:2KMnO4△K2MnO4+MnO2+O2SO2:Na2SO3+H2SO4====Na2SO4+H2O+SO2H2S:FeS+H2SO4====FeSO4+H2SNH3:2NH4Cl+Ca(OH)2△2NH3+CaCl2+2H2O N2:NH4NO2△N2+2H2ONO:3Cu+8HNO3====3Cu(NO3)2+2NO+4H2O NO2:Cu+4HNO3====Cu(NO3)2+2NO2+2H2O CO2:CaCO3+2HCl====CaCl2+CO2+H2O CO:HCOOH△、浓硫酸CO+H2OCH4:CH2COONa+NaOH△、碱石灰Na2CO3+CH4 CH2=CH2:C2H5OH浓硫酸、170℃CH2=CH2+H2O CH≡CH:CaC2+2H2O−→−Ca(OH)2+CH≡CH H2:Zn+H2SO4====ZnSO4+H2。
