第十六章 硼族元素参考答案
专题1-1:主族非金属-硼及其化合物(解析版)

系列一 主族非金属专题1 硼及其化合物一、硼及其化合物的性质(1)单质硼有晶态硼和无定形硼两种。
晶体硼呈黑灰色,以正二十面体为基本的结构单元,硬度与金刚石的硬度接近,其导电性差,但它的导电率却随着温度的升高而增大,从而示出与金属导体的不同,化学性质较为惰性。
无定型硼为棕色粉末,,化学性质较为活泼。
(2)常温下,硼稳定,仅与F 2反应,2B + 3F 2 2BF 3(3)点燃条件下,硼在空气中燃烧放出大量的热,4B + 3O 2 =====点燃2B 2O 3,该反应体现出硼氧键的键能很大,因此硼可以从许多稳定的氧化物如SiO 2,P 2O 5中取氧。
在炼钢过程中可以作为去氧剂,3SiO 2+4B =====△3Si+2B 2O 3。
(4)高温时,无定形硼可以同水蒸气作用生成硼酸,2B+6H 2O(g)=====△2B(OH)3+3H 2。
(5)高温时,硼也可以与N 2、S 、卤素等反应,2B + N 2=====高温2BN ,2B + 3S =====高温B 2S 3,2B + 3Cl 2=====高温BCl 3。
(6)硼不溶于非氧化性酸,仅被热的氧化性酸,如浓HNO 3、浓H 2SO 4和王水所氧化:B + 3HNO 3(浓)H 3BO 3 + 3NO 2↑;2B + 3H 2SO 4(浓)2H 3BO 3 + 3SO 2↑(7) 无定形硼与NaOH 有类似硅那样的反应:2B + 6NaOH2Na 3BO 3 + 3H 2↑ (8)可利用金属还原法制得单质硼(通常用Mg 或Al ):B 2O 3+3Mg =====△2B+3MgO 。
二、工业制取硼及其化合物的转化关系(1)转化关系(2)相应步骤涉及的反应①硼镁矿与烧碱溶液反应生成可溶于水的偏硼酸钠(NaBO 2)和Mg (OH )2:2MgO·B 2O 3+2NaOH +H 2O===2NaBO 2+2Mg (OH )2↓向偏硼酸钠溶液中通入CO 2使NaBO 2转化成硼砂:4NaBO 2+CO 2+10H 2O===Na 2B 4O 5(OH )4·8H 2O +Na 2CO 3 ②将硼砂与硫酸反应,得到硼酸:Na 2B 4O 5(OH )4·8H 2O +H 2SO 4===4H 3BO 3+Na 2SO 4+5H 2O③硼酸加热分解得到氧化硼:2H 3BO 3=====△B 2O 3+3H 2O④用镁或铝还原B 2O 3制得硼:B 2O 3+3Mg=====△3MgO +2B⑤硼和NaOH 溶液反应生成NaBO 2(或Na[B (OH )4])和H 2:2B +2NaOH +2H 2O===2NaBO 2+3H 2↑或2B+2NaOH +6H 2O===2Na[B (OH )4]+3H 2↑【习题1】硼酸(H 3BO 3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工艺。
第1516章 碳硼族元素习题.doc

D,不水解第15、16章 碳硼族元素习题一、选择题1. 硼的成键特征是()A, 共价性 B,缺电子性 C.多面体性 D,前三者均是 2. 硼成键为SP2杂化,且含三个单键,1个兀46键的化合物是()A. B 2O 3B. BF4-C. BO 33-D. B 2H 63. 硼的独特性质表现在()A. 能形成正氧化态化合物,如BN ,其它非金属则不能B. 能生成大分子C. 能形成负氧化态化合物,其它金属则不能D. 在简单的二元化合物中总是缺电子的4. 在a 菱形硼的Bn 单元中,表现出硼原子是缺电子原子性质的原子个数是()A. 3 个B. 6 个C. 9 个D. 12 个5. 下列分子或晶体,何者的结构表现出硼原子的缺电子性.( )A. B 2O 3B. NaBO 2C. H3BO3D. H3BO3E. B 2H 66, 下列关于单质硼化性的描述,错误的是( )A. 常温下不活泼,但高温下可与许多非金属反应B, 与碳相似,炽热的硼可与水蒸气反应C. 可与盐酸反应 D,可与碱反应7. 硼与浓NaOH 反应,所得的含硼产物是( )A. NaBO 2B. Na 3BO 3C. B 2O 3D. H3BO38. 硼与浓硝酸反应,所得的含硼产物是( )A. B (NO 3)3B. H3BO3C. BND. B 2O 39. 乙硼烷( )A. 是强氧化剂B.是强还原剂C10. 下列对硼酸性质的描述不正确的是( )A, 硼酸是三元酸 B.硼酸是一元路易斯酸C. 硼酸与多元醇反应,生成配合物,使酸性增强D. 硼酸的溶解度小11. 硼酸可缩合成( )A, 链状或环状多硼酸 B,笼状多硼酸C.蛛网状多硼酸D.片层状多硼酸12,在硼酸中加入下列何种物质,可以提高其酸性()A.NaOHB. H3PO4C. C2H5OH D,多羟基醇13.鉴别硼酸根时,可用的物质是()A.CH3OHB. CH3OCH3C. HOCH2CH2OHD. CH3CHO14.H2CO3 H3BO3 H2SiO3的酸性强度顺序是()A.H2CO3<H3BO3<H2SiO3B.H2CO3>H3BO3>H2SiO3C.H2CO3>H2SiO3>H3BO3D.H2CO3<H2SiO3<H3BO315.在H3BO3中加入Na2CO3可制得()A.Na3BC)3B. NaBC)2C. NaqBzOsD. N3.2840716.H3BO3与过量的强碱NaoH作用河得到()A.N^BOsB. NaBC)2C. NaqBzOsD. NazBqO?17.硼砂的水溶液呈()A,碱性B,中性C.酸性D.弱酸性18.用盐酸滴定硼砂水溶液至恰好中和时,溶液呈()A,中性B.弱酸性C.弱碱性D,强碱性19.105BA08 下列关于硼酸结构的叙述错误的是()A.硼酸为白色片状晶体,其结构单元为B(OH)3三角形B.硼原子通过SP3杂化轨道与氧原子成键C.分子间通过氢键形成接近于六角形的对称层状结构D.层与层间以范德华力联系20.在分析化学中,硼砂被用来作标准溶液是因为它,A,易水解B,在干燥空气中易风化C.溶融态时可溶解金属氧化物D,稳定,易提纯21.反应H3BO3+3C2H5OH = B(OC2H5)3+3H2O(案件浓硫酸点燃).用于()A.硼化物的定性分析B.硼酸的定量分析C,两者均是D,两者均否22.CO2泡末灭火器的反应原理是()A.HCCh-离子的水解B,A13+水解C,HCO3- A13+双水解,相互促进D,反应生成A1(HCO3)3,然后水解23.硼族元素最重要的特征是()A.共价性特征B.缺电子性特征)甲酸脱水 水蒸气与炽热的炭反应) C.加合性 D.极性C.共价性和缺电子性特征D.易形成配合物和自身聚合的特征 24.硼的缺电子性表现在( ) A,易形成缺电子多中心键及配合物 B,易形成含桥键的化合物C.易形成不同类型杂化,形成化合物D.易形成共价化合物 25. 硼族元素的原子都属缺电子原子,而硼原子的缺电子性在形成化合物时表现 得尤为突出,其原因是() A, 原子的半径最小,电离能最高 B.原子的半径最小,电负性最大C.原子的非金属性最强D.原子半径小,电负性大,有空2P 轨道 26. 某白色晶体X 微溶于水,其水溶液呈弱酸性.在水溶液中加入甘油酸性增强,将 X强热,得固体Y 和气体C,C 冷却后成无色液体.Y 在熔融时可溶解固体NiO, 在X 的水溶液中加甲醇和浓硫酸,点燃混合物.产生绿色火焰,X,Y 分别是 ( )A. H 2SiO 3B. B 2O 3C. H2C2O4D. H3BO3E. N3.2840727, 从碳到铅,当原子序数增加时,+2氧化态的稳定性()A,增强 B,减弱 C,无变化 D.无法确定28. 碳族元素中,碳和其它元素相比性质差异较大是因为() A,原子量最小B,核电荷最少 C. 原子半径最小,电负性最大,电离能最高,又没d 轨道 D. 原子半径最小29. 实验室里用哪个反应制备CO?( A,分解草酸 B. C.分解蹶基镣D. 30. CO 对人体的毒性,源于它的( A,氧化性 B,还原性31. 1下列气体中容易与过渡金属形成配合物的是( )A. NO,B. SO 2C. COD. CO 232, 最常用实验室制CO 2的反应是( )A. CaCO3+H 2SO4=CaSO 4+CO2+H 2OB. CaCO3+2HCl=CaCl 2+CO 2+H 2OC. 3CaCO 3+2H3PO4=Ca3(PO4)2+3CO 2+3H 2OD. CaCO 3=CaO+CO 233. 气体X 和红热的炭反应,得到一种无色气体Y,Y 和CuO 在加热条件下反应又得到X和Cu,则X和Y依次为()A. CO,CO2B. CO2,COC.田0(气)D. C)2,C034.CO通过PdCb溶液生成黑色沉淀,此法可检出CO,此时CO的作用是()A,氧化剂B,还原剂C.配位剂D.催化剂35.CO分子的偶极矩较小,几乎为零,是因为()A.碳和氧的电负性差值小B.碳原子存在孤对电子C.氧原子是兀配键电子对接受体D.氧原子既吸引o键电子对,又是兀配键电子对的给予体,使氧原子略带正电荷36.干冰不经熔化而升华成气体,此事实说明()A. C02热稳定性差B. C02的键能小C. C02的分子对称D.干冰是分子晶体37.CO能与一些过渡元素的金属原子M形成稳定的蹶合物,原因是()A.CO与M形成了共价参键B.CO与M形成了螯合的两个。
第12-16章 p区元素习题

第12-16章P区元素习题目录一判断题;二选择题;三填空题;四完成方程式;五计算并回答问题一判断题 (返回目录)1 硼在自然界主要以含氧化合物的形式存在。
()2 在硼与氢形成的一系列共价型氢化物中,最简单的是BH3。
()3 硼酸是三元酸。
()4 硼是非金属元素,但它的电负性比氢小。
()5 由于B-O键键能大,所以硼的含氧化合物很稳定。
()6 硼砂的化学式为Na2B2O7。
()7 B2H6为平面形分子。
()8 硼是缺电子原子,在乙硼烷中含有配位键。
()9 三卤化硼熔点的高低次序为BF3<BCl3<BBr3<BI3。
()10 三卤化硼沸点的高低次序为BF3>BCl3>BBr3>BI3。
()11 地壳中丰度最大的金属元素是铝。
()12 Al2O3是两性氧化物,因而各种晶型的Al2O3既可溶于酸,又可溶于碱。
()13 只有在强酸性溶液中才有Al(H2O)63+存在。
()14 在气相中三氯化铝以双聚分子Al2Cl6的形式存在。
()15 AlX3都是共价型化合物。
()16 KAl(SO4)2·12H2O与KCr(SO4)2·12H2O属于同分异构体。
()17 在氯化氢气流中加热金属铝可制得无水AlCl3。
()19 因AlCl3分子中Al为缺电子原子,所以AlCl3中有多中心键。
()20 碳酸盐的溶解度均比酸式碳酸盐的溶解度小。
()21 Na2CO3比NaHCO3的溶解度大,同理,CaCO3比Ca(HCO3)2的溶解度也大。
()22 硅在地壳中的含量仅次于氧。
()23 分子筛是人工合成的硅铝酸盐,具有吸附和催化作用。
()24 活性炭具有吸附作用,它是颗粒状的石墨。
()25 金刚石比石墨更稳定,即使在纯氧气中,金刚石也不能燃烧。
()26 一般情况下,CO2不能助燃,但是镁在二氧化碳气体中能燃烧。
()27 高纯度的硅和锗是良好的半导体。
()28 金刚石与石墨是同素异形体,由金刚石转变为石墨的△r H>0。
第讲硼族元素全解

第讲硼族元素全解硼族元素是周期表中位于第三主族的化学元素。
该族元素的原子结构特点、物理化学性质等方面有很多值得关注的地方。
原子结构特点硼族元素的原子结构特点有以下几点:原子半径硼族元素的原子半径在同一周期中逐渐减小,在同一族中则随着核电荷数增加而逐渐减小。
电子亲和能硼族元素的电子亲和能呈右下方向递减的趋势,其中铍的电子亲和能最小,铟的电子亲和能最大。
电离能硼族元素的电离能值,随着核电荷数增加而逐渐增大,在同一周期中的电离能值逐渐增大。
值得注意的是,三价铍电离能较小,因为可能存在相对稳定的三价氧化物,使得它不容易丧失一个电子。
化合价电子数硼族元素的化合价电子数为3个,因此大多数化合物都为三配位,分子为平面三角形或三棱柱形。
值得注意的是,硼族元素同样也会形成四、五、六价化合物。
物理化学性质硼族元素的物理化学性质主要表现为以下几个方面:电子构型硼族元素的电子构型为ns2np1,其中n依次为2、3、4、5、6,p轨道只有一个未被占据,因此硼族元素属于典型的半金属元素。
化合反应•与非金属的反应:硼族元素可与氧、氮等非金属元素发生化学反应,并有产物生成。
•与金属的反应:大多数硼族元素均能够和金属反应,生成非常具有特异性的异构体。
物理性质•密度:硼族元素的密度随着原子序数的增加而逐渐增大。
•熔点:硼族元素的熔点随着原子序数的增加而先增后降。
•固定化学反应:硼族元素的固定化学反应能力很强,是化学反应中经常用到的一种试剂。
典型代表元素硼族元素中,最典型的代表元素为硼、铝、镓和铟。
硼硼的存在形式有硼酸、硼砂和硼烷等。
其烷基化合物中的双止键和三角形构型具有独特的结构。
硼制品被广泛地应用于一些领域,如玻璃、烟花、橡胶和塑料的生产等。
铝铝是第三大产量金属,铝和铝合金引人瞩目的特性是轻、硬、耐腐蚀、导电和热传导性好。
因此铝及其合金被广泛应用于汽车、航空和建筑等各个领域。
镓镓是一种蓝黑色的金属元素,也称为“未来金属”。
其压电和半导体性质被广泛地运用于电子技术领域,如生物医学、计算和通讯应用等。
硼族元素的通性、化合物及斜线关系

3 硼砂及其它硼酸盐
硼砂 Na2[ B4O(5 OH)4 ] • 8 H2O 是硼的最 主要的含氧酸盐,白色,玻璃光泽。
[B4O5(OH)4]2- B: sp2 杂化 sp3 杂化
硼砂晶体在空气中易失去水而风化。受热到400 ˚C 左右,将失去 8 个结晶水和 2 个羟基水,形成化学式为 Na2B4O7 的无水盐。
自燃
B2H6 + 3 O2 ——— B2O3 + 3 H2O
(2)乙硼烷也能被氯气氧化: B2H6(g)+ 6 Cl2(g)—— 2 BCl3(l)+ 6 HCl(g)
(3)乙硼烷极易水解:
B2H6 + 6 H2O —— 2 B(OH)3 + 6 H2 (4) B2H6 和 NH3 反应,高温下可制得 被称为“无机苯环”的氮硼烷 B3N3H6
2 H3BO3 —— B2O3 + 3 H2O (4)
B2O3 + 3 Mg ——3 MgO + 2 B(5) (2) 工业上也有酸法生成硼单质的工艺,
即用硫酸与硼镁矿反应一步制得硼酸:
Mg2B2O5 • H2O + 2 H2SO4 —— 2 H3BO3 + 2 MgSO4
16 - 2 - 2 铝单质
硼砂属于弱酸强碱盐,其水解反应为:
B4O(5 OH)42- + 5 H2O —— 2 H3BO3 + 2 B(OH)4-
生成等物质的量的弱酸和弱酸盐,形成 缓冲溶液。
0.01 moldm-3 的硼砂溶液 pH = 9.24。
硼砂珠实验:
Na2B4O7 △ B2O3 + 2 NaBO2
一、硼的氢化物(硼烷)
硼氢化合物的物理性质相似于烷烃,故 称之为硼烷。
第十六章-硼族元素PPT课件

-0.34
Tl3+ 1.25 Tl+ -0.336 Tl 1.36 TlCl -0.557
Tl(OH)3 -0.05 TlOH -0.344 Tl
Tl3+的化合物具有强氧化性
Tl+.的化合物特别稳定
8
§16-2 硼及其化合物
2-1 硼在自然界的存在
——以硼酸盐的形式存在
主要矿有:
硼砂—— Na2B4O7·10H2O
27
B2H6的结构由美国化学家—— 利普斯科姆(Lipscomb,W.N.)提出:
1949年后,利普斯科姆开始对硼烷、碳硼烷及其一系列 衍生物进行系统研究。关于硼烷的结构,早在半个世纪前
曾有人做过研究,但都未能真正解释明白硼烷及其衍生物 组分的多样化结构的复杂性。
利普斯科姆利用低温X 射线衍射方法等测定了多种硼烷 结构。根据他测定的结果,硼烷分子具有代表性的结构是
BF3 + F- BF4-
B(OH)3 + OH- [B(OH)4]单质硼和B化合物中还能形成多中心键
3c-2e 键 、 sp2杂化的硼化合物中的大键。
.
11
③ 多面体习性
——晶态B和许多硼的化合物为多面体或多面体的碎片, 形似笼状或巢状等结构。 这种多面体的习性同它能形成多种类型的键有关。
巢图状16硼-3 烷-结菱形构硼的结构
中除外向B—H键以外的其它类型的化学键。
键型
所用轨道数 所用电子数 键数
B—B
2
2
y
B—H—B
3
2
s
开口B—B—B
3
2
闭合B—B—B
3
t 2
B—H
2
2
第十六章氮族元素课后习题参考答案

第十六章氮族元素课后习题参考答案1解:(1)由于N的原子半径太小,其平均负电密度(电子云带负电)大,则N与N原子之间斥力增大使得N-N键键长增长,键能减小而小于P-P键。
形成三键时,因N原子半径小,则两个N原子的P轨道肩并肩重叠比磷原子的更有效,所以N≡N三键键能高于P≡P三键。
(2)由于N原子半径小,且最外层只有四条价轨道,最多只能形成四个共价键,所以无五卤化物存在。
(3)根据分子轨道理论,NO分子最后一个电子填充在反键的π*2py轨道上,其轨道能量相对较高,比较容易失去电子,第一电离能小。
而N原子的结构为1s22s22p3,属于半满状态,失去电子会较困难,所以第一电离能就较高。
2解:(1)把混合气体通过装有P2O5的干燥器(或浓H2SO4),则NH3会被吸收而得到纯氮气;而把混合气体通过装有CaO(或KOH)的干燥器,(但不能使用CaCl2)则可除去水气而得到干燥的氨气。
(2)为除去NO中微量的NO2,可把该气体通过水(或者碱液),则NO2被吸收,然后再通过浓H2SO4,则可获得干燥的NO气体;为除去N2O中少量的NO,可把该气体通过FeSO4溶液,则NO可被吸收除去。
3解:由反应:NH3 + H2O == NH4+ + OH-说明NH3与H+结合的能力强于H2O。
对于反应:HAc + H2O == H3O+ + Ac-(2)HAc + NH3 == NH4+ + Ac-(3)因NH3与H+结合的能力强,所以反应3更易向右进行,使得HAc完全解离成为强酸。
而H2O结合H+的能力弱,所以HAc在水中只部分解离成为弱酸。
4解:碱性大小排序为: NH3 > N2H4 > NH2OH > HN3它们均为路易斯碱,则孤对电子越容易被提供出去,碱性就越强。
二这主要由两个方面产生影响。
一是配位原子的负电性越高,则越易提供孤对电子,另一个是空间位阻因素。
如果孤对电子周围空间阻碍越大,则越难提供电子。
第16章-硼族元素

第16章硼族元素16.1 硼族元素的通性16.1.1 硼族元素的通性包括硼、铝、镓、铟、铊五种元素。
硼在自然界中有硼镁矿、硼砂等;铝在地壳中的含量仅次于氧和硅,占第三位,主要以长石、云母、高岭土等硅酸盐形式存在。
镓、铟、铊比较分散,没有单独矿藏,与其他矿物共生。
硼的原子半径最小,核电荷对外层电子的吸引较强,为非金属,其余四种元素为金属,从硼到铝是由非金属突变到金属,不是逐渐过渡的。
●硼族元素氧化物的酸碱性递变规律:硼的氧化物呈酸性,铝和镓的氧化物为两性,铟和铊的氧化物是碱性的。
●硼族元素的价电子构型为ns2np1,一般氧化态为+III。
“惰性电子对效应”,随着原子序数的递增,生成低氧化态的(+I)的倾向增强。
镓、铟、铊在一定的条件下能显示出+I氧化态,特别是Tl ,其+I氧化态常见,Tl(+I)的化合物具有较强的离子健特征。
●硼、铝两元素亲氧特性表现得突出。
●硼族元素价电子轨道(ns和np)数为4,而价电子仅为3,为缺电子原子,它们所形成的化合物有些为缺电子化合物。
有空的价键轨道,这些化合物有很强的接受电子的趋势,容易形成聚合分子(如:Al2Cl6)和配合物(如:HBF4)。
在此过程中,中心原子价轨道由sp2杂化过渡到sp3杂化,相应分子从平面结构过渡到立体结构。
硼原子最高配位数为4,而其它元素外层d轨道可参与成键,最高配位数可以为6。
16.2 硼族元素的单质及其化合物硼在自然界主要以含氧化合物的形式存在。
硼的重要矿石有硼砂Na2B4O7·10H2O,方硼石2Mg3B8O15•MgCl2,硼镁矿Mg2B2O5•H2O等。
铝在自然界分布很广,主要以铝矾土矿形式存在,它是一种含有杂质的水合氧化铝矿。
镓、铟、铊在自然界单独矿物,以杂质的形式分散在其它矿物中。
16.2.1 硼族元素的单质1. 单质硼(1) 单质硼的结构单质硼有多种同素异形体,包括无定形硼和晶体硼。
无定形硼为棕色粉末,晶体硼呈黑灰色。
大学无机化学第17章 硼族元素习题解答
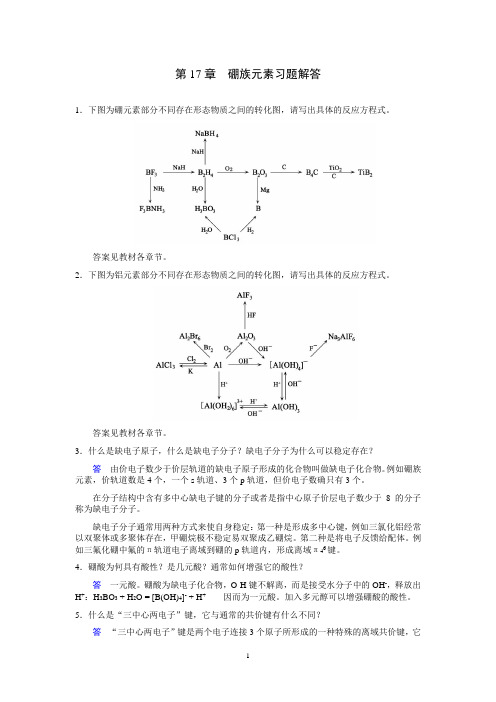
第17章硼族元素习题解答1.下图为硼元素部分不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
2.下图为铝元素部分不同存在形态物质之间的转化图,请写出具体的反应方程式。
答案见教材各章节。
3.什么是缺电子原子,什么是缺电子分子?缺电子分子为什么可以稳定存在?答由价电子数少于价层轨道的缺电子原子形成的化合物叫做缺电子化合物。
例如硼族元素,价轨道数是4个,一个s轨道、3个p轨道,但价电子数确只有3个。
在分子结构中含有多中心缺电子键的分子或者是指中心原子价层电子数少于8的分子称为缺电子分子。
缺电子分子通常用两种方式来使自身稳定:第一种是形成多中心键,例如三氯化铝经常以双聚体或多聚体存在,甲硼烷极不稳定易双聚成乙硼烷。
第二种是将电子反馈给配体。
例如三氟化硼中氟的π轨道电子离域到硼的p轨道内,形成离域π46键。
4.硼酸为何具有酸性?是几元酸?通常如何增强它的酸性?答一元酸。
硼酸为缺电子化合物,O-H键不解离,而是接受水分子中的OH-,释放出H+:H3BO3 + H2O = [B(OH)4]- + H+因而为一元酸。
加入多元醇可以增强硼酸的酸性。
5.什么是“三中心两电子”键,它与通常的共价键有什么不同?答“三中心两电子”键是两个电子连接3个原子所形成的一种特殊的离域共价键,它是缺电子原子的一种成键特征。
它与通常的共价键的区别,在于它是一种缺电子的桥键,而一般的共价键是由两个原子共用两个电子所形成的。
6.铝在什么情况下生成致密的钝化膜,其应用如何?钝化膜又在什么情况下容易被破坏?答铝在空气中由于表面会生成致密的氧化膜而阻止进一步的反应,不易受到腐蚀,常被用来制造化学反应器、医疗器械、冷冻装置、石油精炼装置、石油和天然气管道等。
铝但遇到冷的浓硝酸或浓硫酸时,由于在金属表面生成薄而极其致密的氧化物薄膜,而发生钝化。
食盐可腐蚀铝表面的氧化膜,因此铝制器皿不宜长期存放咸的菜品等。
铝置于水中会生成紧密而很难溶解的氢氧化铝层。
第十三章 p区元素(一)参考答案

第十七章碳、硅、硼一、是非题:1 、钻石所以那么坚硬是因为碳原子间都是共价键结合起来的,但它的稳定性在热力学上石墨要差一些。
2、在B2H6分子中有两类硼氢键,一类是通常的硼氢σ键,另一类是三中心键, 硼与硼之间是不直接成键的。
3、非金属单质不生成金属键的结构,所以熔点比较低,硬度比较小,都是绝缘体。
4、非金属单质与碱作用都是歧化反应。
二、选择题:1、硼的独特性质表现在:A 、能生成正氧化态化合物如BN,其它非金属则不能B 、能生成负氧化态化合物,其它非金属则不能C、能生成大分子D、在简单的二元化合物中总是缺电子的2 、二氧化硅:A 、与NaOH共熔反应生成硅酸钠B、是不溶于水的碱性氧化物C 、单质是分子晶体,与CO2晶体相似D 、属AB2型的化合物,晶体结构属CaF2型3 、下列四种非金属元素中,哪一种不生成象POCl3之类的氯氧分子化合物?A 、B B 、C C 、ND 、S4、C、Si、B都有自相结合成键的能力,但C的自链能力最强,原因是:A 、C原子外层4个电子易得或易失形成C4-或C4+B、C形成的最大共价数为2C、C单质的化学活性较Si,B活泼D、C原子半径小,自链成键不受孤对电子键弱化效应的影响5 、CO与金属形成配合物的能力比N2强的原因是:A、C原子电负性小易给出孤对电子 B 、C原子外层有空d轨道易形成反馈键C、CO的活化能比N2低D 、在CO中由于C-←O+配键的形成,使C原子负电荷偏多,加强了CO 与金属的配位能力6 、下列无机酸中能溶解酸性氧化物SiO2的是:A、HCl B 、H2SO4(浓) C、HF D、HNO3(浓)7 、下列元素性质最相似的是:A、B和Al B 、B和SiB、B和Mg D 、B和C8、关于BF3的下列描述中,说法正确的是:A、BF3水解得到HF(aq)和H3BO3B、BF3接受电子对的倾向比BCl3强C、BF3是离子化合物,分子是极性的D、在室温下B与F2反应得到BF3三、填空题:1、等电子原理是指( )。
16 无机化学 第十六章 硼族元素

2Al+2OH-+6H2O=2Al(OH)4-+3H2↑
二、镓单质
Ga具有熔点与沸点相差甚远这一特点,302.8~2676K,即 液态温度范围很宽(拿到水中就可熔化,像水银),可用 来制高温温度计。 镓的另一特点是“热缩冷胀”,从液 体到固体,体积膨胀3%。 制铅字合金,使字更为清晰。
Ga、In多用于电子工业,作P型半导体的掺杂剂。 也可制 Ⅲ—Ⅴ族半导体化合物,如GaAs等,可用于 光电管中。
实验室: 4HBO2+NaOH=NaBO2 + H2O
(浓) H3BO3 +2NaOH=Na2B4O5(OH)4+5H2O (稀)
滴定H+: Na2B4O5(OH)4+3H2O+2HCl=4H3BO3+2NaCl
3-1 铝族元素单质:
一、铝单质:
用 途
铝已遍及每个家庭,铝及合金广泛地 用于建筑材料、机械化工、食品工业 中,铝是光和热的良好反射体。利用 铝能够很好的反射光,可制造探照灯 的灯罩和反射望远镜的镜子。
γ-Al2O3颗粒小,具有强吸附能力和催化活性,又名活性氧 化铝,可以用作吸附剂和催化剂。
4、氢氧化铝:
在Al3+盐中加入CO32-能得到Al(OH)3 (水解完全)。
Al(OH)3结构较为稳定,加热至373K不脱水。 Al(OH)3是典型的两性化合物,新制备的Al(OH)3既 溶于酸又溶于碱。
二、铝盐和铝酸盐:
制备:灼烧Al(OH)3 或水合氧化铝,可制得α-Al2O3
2、β-Al2O3
主要性能:离子传导能力(允许Na+通过),用作钠-硫蓄 电池的电解质,这种电池的蓄电量为铅蓄电池的3—5倍。
加NH3•H2O或碱于铝盐溶液中,都会得到Al2O3nH2O, 长时间放置(脱水)逐渐转变为AlO(OH)或HAlO2。
无机化学第三版下册答案第二十一章第十六章硼族元素习题解答(1)

第十六章 硼族元素1. 下表中给出第二、三周期元素的第一电离能数据(单位kJ·mol 1 )试说明B,Al 的第一电离能为什么比左右两元素的都低? 答:因为B ,Al 元素基态原子的价电子层结构为:ns 2np 1,最外层np 轨道上的一个电子容易失去而形成np 0空轨道稳定状态。
所以B 和Al 的I 1比左右两元素都低。
2. 在实验室中如何制备乙硼烷,乙硼烷的结构如何? 答:实验室中制备乙硼烷:质子置换法: 2BMn + 6H + = B 2H 6 + 2Mn 3+氢化法: 2BCl 3 + 6H 2 = B 2H 6 + 6HCl氢负离子置换法 3LiAlF 4 + 4BF 3 2B 2H 6 + 3LiF +3AlF 3乙醚或 3NaBH 4 + 4BF 32B 2H 6 + 3NaBF 4乙醚C 2H6的结构:BBHHHHHH分子中的 2个B 原子采取sp 3杂化,C2H 6分子中有4条B-H σ键,2条 氢桥键。
3. 说明三卤化硼和三卤化铝的沸点高低顺序,并指出蒸汽分子的结构。
答:三卤化物的熔沸点顺序见课本P780。
三卤化硼的蒸气分子均为单分子,AlF 3的蒸气为单分子。
而AlCl 3的蒸气为二聚分子,其中Al 采取sp 3杂化。
其结构:4. 画出B 3N 3H 6(无机苯)的结构。
答:NB NB N B HHHHHB 和N 原子都采取sp 2杂化,分子中有3条N -H σ键(sp 2-s ),3条B ―H σ键(sp2-s ),6条B ―N σ键(sp 2-sp 2),一个66π离域键(N 原子提供电子对,B 原子提供空p 轨道)5.B 10H 14的结构中有多少种形式的化学键?各有多少个?答:B 10H 14有5种化学键:有10条B -H σ键(2C -2e 键),2条B -B σ键(2C -2e 键),4条 桥键(3C-2e 键),2条开口硼桥键(3C-2e 键),4条闭合硼桥键(3C-2e 键)。
大学无机化学—硼族元素备课笔记

共熔
高温下下有氧化剂存在时,与碱反应; 2B + 2NaOH + 3KNO3
2NaBO2 + 3KNO2 + H2O
14.2.2.3 镓、铟、铊
镓、铟、铊都是比铅还要软的金属。液态镓的熔沸点差别是所有单质中最大的(m.p=29.78,b.p=2403).将液态镓充填在石英管中做成
的温度计,测量温区大。液态镓中有 Ga2 存在,所以其密度大于固态镓。镓和 As、Sb 作用形成的 GaAs、GaSb 是优良的半导体材料。稀散元素, 不存在独立的矿石,而与其它矿共生。这三种元素都由各自的光谱发现。
硼的熔沸点很高﹙m.p=2300℃﹚,晶体硼的硬度为 9.5,在单质中仅次于金刚石,a-菱形硼的结构单元为 B12, 为正十二面体,每个硼原子与五个硼原子相连,键长为 177pm 常温下,B 和 F2 反应,加热时和反应。除及稀有气体外,B 能与所有的非金属直接反应,也能于许多金属反应形成 硼化物, 如 MB6﹙M 为 Ca、Sr、Ba、Li
可以 看出,硼族元 素的性质大都 是呈现出规律 性的变化,但 也有些异常现 象。电子亲和 能的异常变化 与卤素、氮族 元素以及碳族 元素类似,这
硼族元素原子的价电子层结构为 ns2np1,常见氧化态为+3 和+1,随原子序数的递增,ns2 电子对趋于稳定,特别是 6s 上的 2 个电子稳定性特别 强。使得从硼到铊高氧化数(+Ⅲ)稳定性依次减小,即氧化性依次增强;而低氧化数(+I)稳定性依次增强,其还原性依次减弱。例如:Tl(Ⅲ)是很强的 氧化剂,而 Tl(Ⅰ)很稳定,其化合物具有较强的离子键特性。
(2)硼烷的制备 自然界中没有天然的硼烷,也不能通过硼和氢直接化合制的,而要通过间接途径制备。B2H6 的制备方法有如下几种
2021届高三一轮复习 第16讲元素周期表和元素周期律 教师版有答案

第16讲元素周期律和元素周期表目标要求1.认识元素性质与元素在周期表中位置的关系。
2.结合有关数据和实验事实认识原子结构、元素性质呈周期性变化的规律,构建元素周期律。
3.知道元素周期表的结构,以第3周期的钠、镁、铝、硅、磷、硫、氯以及碱金属和卤族元素为例,了解同周期和同主族元素性质的递变规律。
体会元素周期律(表)在学习元素化合物知识与科学研究中的重要作用。
4.认识元素的原子半径、第一电离能、电负性等元素性质的周期性变化,知道原子核外电子排布呈现周期性变化是导致元素性质周期性变化的原因。
5.知道元素周期表中分区、周期和族的元素原子核外电子排布特征,了解元素周期律(表)的应用价值。
1.元素周期表的结构(1)原子序数按照元素在周期表中的顺序给元素编号,称之为原子序数,原子序数=核电荷数=质子数=核外电子数。
(2)编排原则①周期:把电子层数相同的元素,按原子序数递增的顺序,从左至右排成的横行。
②族:把最外层电子数相同的元素,按电子层数递增的顺序,从上至下排成的纵列。
(3)元素周期表的结构元素周期表⎩⎪⎪⎨⎪⎪⎧ 周期(7个)⎩⎨⎧短周期⎩⎪⎨⎪⎧ 第1、2、3周期元素种数分别为2、8、8种长周期⎩⎪⎨⎪⎧ 第4、5、6、7周期元素种数分别为18、18、32、32种族(16个)⎩⎪⎨⎪⎧主族:由短周期和长周期共同构成,共7个副族:完全由长周期元素构成,共7个Ⅷ族:第8、9、10共3个纵列0族:第18纵列理解应用请在下表中画出元素周期表的轮廓,并在表中按要求完成下列问题: (1)标出族序数。
(2)画出金属与非金属的分界线,写出分界线处金属的元素符号,并用阴影表示出过渡元素的位置。
(3)写出各周期元素的种类。
(4)写出稀有气体元素的原子序数。
答案2.原子结构与元素在周期表中的位置关系(1)原子结构与周期的关系(2)每族元素的价层电子排布特点①主族②0族:He为1s2;其他为n s2n p6。
③过渡元素(副族和Ⅷ族):(n-1)d1~10n s1~2。
简明无机化学第二版答案

简明无机化学第二版答案【篇一:《无机化学》习题解析和答案】》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,2002年8月第4版。
2、参考书《无机化学》北京师范大学、华中师范大学、南京师范大学无机化学教研室编,高等教育出版社,1992年5月第3版。
《无机化学》邵学俊等编,武汉大学出版社,2003年4月第2版。
《无机化学》武汉大学、吉林大学等校编,高等教育出版社,1994年4月第3版。
《无机化学例题与习题》徐家宁等编,高等教育出版社,2000年7月第1版。
《无机化学习题精解》竺际舜主编,科学出版社,2001年9月第1版《无机化学》电子教案绪论(2学时)第一章原子结构和元素周期系(8学时)第二章分子结构(8学时)第三章晶体结构(4学时)第四章配合物(4学时)第五章化学热力学基础(8学时)第六章化学平衡常数(4学时)第七章化学动力学基础(6学时)第八章水溶液(4学时)第九章酸碱平衡(6学时)第十章沉淀溶解平衡(4学时)第十一章电化学基础(8学时)第十二章配位平衡(4学时)第十三章氢和稀有气体(2学时)第十四章卤素(6学时)第十五章氧族元素(5学时)第十六章氮、磷、砷(5学时)第十七章碳、硅、硼(6学时)第十八章非金属元素小结(4学时)第十九章金属通论(2学时)第二十章 s区元素(4学时)第二十一章 p区金属(4学时)第二十二章 ds区元素(6学时)第二十三章 d区元素(一)第四周期d区元素(6学时)第二十四章 d区元素(二)第五、六周期d区金属(4学时)第二十五章核化学(2学时)1 .化学的研究对象什么是化学?● 化学是研究物质的组成、结构、性质与变化的一门自然科学。
(太宽泛)● 化学研究的是化学物质 (chemicals) 。
● 化学研究分子的组成、结构、性质与变化。
● 化学是研究分子层次以及以超分子为代表的分子以上层次的化学物质的组成、结构、性质和变化的科学。
● 化学是一门研究分子和超分子层次的化学物种的组成、结构、性质和变化的自然科学。
第16章-硼族元素习题

第16章硼族元素习题1.选择题16-1硼族元素最重要的特征是…………………………………………………( ) (A) 共价性特征 (B) 缺电子性特征(C) 共价性和缺电子性特征 (D) 易形成配合物和自身聚合的特征16-2 硼成键为sp2杂化,且含三个单键, 1 个π46键的化合物是………….. ( )(A) B2O3(B) BF4-(C) BO33-(D) B2H616-3硼的独特性质表现在………………………………………………………( )(A) 能形成正氧化态化合物,如BN ,其它非金属则不能(B) 能生成大分子(C) 能形成负氧化态化合物,其它金属则不能(D) 在简单的二元化合物中总是缺电子的16-4在 菱形硼的B12单元中,表现硼原子是缺电子原子性质的原子个数是( )(A) 3个(B) 6个(C) 9个(D) 12个16-5 下列关于单质硼性质的描述,错误的是………………………………..( )(A) 常温下不活泼,但高温下可与许多非金属反应(B) 与碳相似,炽热的硼可与水蒸气反应(C) 可与盐酸反应 (D) 可与碱反应16-6 硼与浓NaOH反应,所得的含硼产物是………………………………..( )(A) NaBO2(B) Na3BO3(C) B2O3(D) H3BO316-7 硼与浓硝酸反应,所得的含硼产物是…………………………………( )(A) B(NO3)3(B) H3BO3(C) BN (D) B2O316-8 下列对硼酸性质的描述不正确的是…………………………………( )(A) 硼酸是三元酸(B) 硼酸是一元路易斯酸(C) 硼酸与多元醇反应,生成配合物,使酸性增强(D) 硼酸的溶解度小16-9 硼砂的水溶液呈…………………………………………………….( )(A) 碱性(B) 中性(C) 酸性(D) 弱酸性16-10用盐酸滴定硼砂水溶液至恰好中和时,溶液呈……………………( )(A) 中性(B) 弱酸性(C) 弱碱性(D) 强碱性16-11下列关于硼酸结构的叙述错误的是……………………………….( )(A) 硼酸为白色片状晶体,其结构单元为B(OH)3三角形(B) 硼原子通过sp3杂化轨道与氧原子成键(C) 分子间通过氢键形成接近于六角形的对称层状结构(D) 层与层间以范德华力联系16-12在分析化学中,硼砂被用来作标准溶液是因为它………………………( )(A) 易水解(B) 在干燥空气中易风化(C) 溶融态时可溶解金属氧化物(D) 稳定,易提纯16-13 CO2泡末灭火器的反应原理是…………………………………………..( )(A) HCO3-离子的水解(B ) Al3+水解(C) HCO3-Al3+双水解,相互促进(D) 反应生成Al(HCO3)3,然后水解16-14 下列物质中水解并放出H2的是………………………………………()(A) B2H6(B) N2H4(C) NH3 (D) PH316-15 硼的缺电子性表现在……………………………………………………( )(A) 易形成缺电子多中心键及配合物(B) 易形成含桥键的化合物(C) 易形成不同类型杂化,形成化合物(D) 易形成共价化合物16-16 可形成下面几种类型化合物的X元素是………………………………( ) (XH3)2;X2O3;XCl3;XO2-;XF3·HF(A) P (B) Al (C) B (D) S16-17铝在空气中燃烧时,生成……………………………………………….( )(A)单一化合物Al2O3 (B) Al2O3和Al2N3(C)单一化合物Al2N3 (D) Al2O3和AlN16-18下列含氧酸中属于三元酸的是…………………………………………. ( )(A) H3BO3(B) H3PO2(C) H3PO3(D) H3A s O416-19BF3通入过量的Na2CO3溶液,得到的产物是………………………()(A) HF和H3BO3(B) HBF4和B(OH)3(C) NaBF4和NaB(OH)4(D) HF 和B2O316-20 BF3,B2H6,Al2Cl6都是稳定的化合物,BH3,AlCl3则相对不稳定,其原因是……………………………………………………………………….( )(A) 前者形成大π键,后者缺电子(B) 前者通过大π键、多中心键、配位键补偿了缺电子,后者缺电子(C) 前者缺电子,后者有多中心键(D) 前者有配位键,后者缺电子16-21 铊可以生成氟化铊、氯化铊和碘化铊,Tl在这三种化合物中的氧化态是( )(A) 与F 结合为Tl(+III) (B)与Cl 结合为Tl(+III)(C) 与I 结合为Tl(+I)与F,Cl结合为Tl(+III) (D) 全部为Tl(+III)16-22 InCl2为反磁性化合物,其中In 的氧化数为…………………………….()(A) +1 (B) +2 (C) +3 (D) +1和+316-23三氯化铝经常以(AlCl3)2 形式存在。
第16章-硼族元素习题

第16章硼族元素习题1.选择题16-1硼族元素最重要的特征是…………………………………………………( ) (A) 共价性特征 (B) 缺电子性特征(C) 共价性和缺电子性特征 (D) 易形成配合物和自身聚合的特征16-2 硼成键为sp2杂化,且含三个单键, 1 个π46键的化合物是………….. ( )(A) B2O3(B) BF4-(C) BO33-(D) B2H616-3硼的独特性质表现在………………………………………………………( )(A) 能形成正氧化态化合物,如BN ,其它非金属则不能(B) 能生成大分子(C) 能形成负氧化态化合物,其它金属则不能(D) 在简单的二元化合物中总是缺电子的16-4在 菱形硼的B12单元中,表现硼原子是缺电子原子性质的原子个数是( )(A) 3个(B) 6个(C) 9个(D) 12个16-5 下列关于单质硼性质的描述,错误的是………………………………..( )(A) 常温下不活泼,但高温下可与许多非金属反应(B) 与碳相似,炽热的硼可与水蒸气反应(C) 可与盐酸反应 (D) 可与碱反应16-6 硼与浓NaOH反应,所得的含硼产物是………………………………..( )(A) NaBO2(B) Na3BO3(C) B2O3(D) H3BO316-7 硼与浓硝酸反应,所得的含硼产物是…………………………………( )(A) B(NO3)3(B) H3BO3(C) BN (D) B2O316-8 下列对硼酸性质的描述不正确的是…………………………………( )(A) 硼酸是三元酸(B) 硼酸是一元路易斯酸(C) 硼酸与多元醇反应,生成配合物,使酸性增强(D) 硼酸的溶解度小16-9 硼砂的水溶液呈…………………………………………………….( )(A) 碱性(B) 中性(C) 酸性(D) 弱酸性16-10用盐酸滴定硼砂水溶液至恰好中和时,溶液呈……………………( )(A) 中性(B) 弱酸性(C) 弱碱性(D) 强碱性16-11下列关于硼酸结构的叙述错误的是……………………………….( )(A) 硼酸为白色片状晶体,其结构单元为B(OH)3三角形(B) 硼原子通过sp3杂化轨道与氧原子成键(C) 分子间通过氢键形成接近于六角形的对称层状结构(D) 层与层间以范德华力联系16-12在分析化学中,硼砂被用来作标准溶液是因为它………………………( )(A) 易水解(B) 在干燥空气中易风化(C) 溶融态时可溶解金属氧化物(D) 稳定,易提纯16-13 CO2泡末灭火器的反应原理是…………………………………………..( )(A) HCO3-离子的水解(B ) Al3+水解(C) HCO3-Al3+双水解,相互促进(D) 反应生成Al(HCO3)3,然后水解16-14 下列物质中水解并放出H2的是………………………………………()(A) B2H6(B) N2H4(C) NH3 (D) PH316-15 硼的缺电子性表现在……………………………………………………( )(A) 易形成缺电子多中心键及配合物(B) 易形成含桥键的化合物(C) 易形成不同类型杂化,形成化合物(D) 易形成共价化合物16-16 可形成下面几种类型化合物的X元素是………………………………( ) (XH3)2;X2O3;XCl3;XO2-;XF3·HF(A) P (B) Al (C) B (D) S16-17铝在空气中燃烧时,生成……………………………………………….( )(A)单一化合物Al2O3 (B) Al2O3和Al2N3(C)单一化合物Al2N3 (D) Al2O3和AlN16-18下列含氧酸中属于三元酸的是…………………………………………. ( )(A) H3BO3(B) H3PO2(C) H3PO3(D) H3A s O416-19BF3通入过量的Na2CO3溶液,得到的产物是………………………()(A) HF和H3BO3(B) HBF4和B(OH)3(C) NaBF4和NaB(OH)4(D) HF 和B2O316-20 BF3,B2H6,Al2Cl6都是稳定的化合物,BH3,AlCl3则相对不稳定,其原因是……………………………………………………………………….( )(A) 前者形成大π键,后者缺电子(B) 前者通过大π键、多中心键、配位键补偿了缺电子,后者缺电子(C) 前者缺电子,后者有多中心键(D) 前者有配位键,后者缺电子16-21 铊可以生成氟化铊、氯化铊和碘化铊,Tl在这三种化合物中的氧化态是( )(A) 与F 结合为Tl(+III) (B)与Cl 结合为Tl(+III)(C) 与I 结合为Tl(+I)与F,Cl结合为Tl(+III) (D) 全部为Tl(+III)16-22 InCl2为反磁性化合物,其中In 的氧化数为…………………………….()(A) +1 (B) +2 (C) +3 (D) +1和+316-23三氯化铝经常以(AlCl3)2 形式存在。
【化学】中考必备化学《物质构成的奥秘》技巧全解及练习题(含答案)(2)

【化学】中考必备化学《物质构成的奥秘》技巧全解及练习题(含答案)(2)一、选择题1.硼是作物生长必需的微量营养元素,硼元素的相关信息如图所示。
下列有关硼的说法正确的是A.相对原子质量为10.81g B.属于金属元素C.原子的核电荷数为5D.原子核外有6个电子【答案】C【解析】A、相对原子质量的单位是1,省略不写,不能带g,故错误;B、硼的汉字结构含有石字旁,故是非金属元素,故错误;C、由图可知,硼原子的原子序数是5,原子序数=质子数=核电荷数,故核电荷数是5,故正确;D、原子中核外电子数=质子数,故原子核外有5个电子,故错误。
故选C。
2.2017年5月9日,中国科学院发布了113号、115号、117号及118号四种元素的中文名称,其中一种元素在元囊周期表中的信息如图所示,下列有关该元素的说法正确的是A.元素符号为MC . B.核内有115个质子C.是非金属元素D.相对原子质量为403【答案】B【解析】【详解】A、根据元素周期表中的一格可知,字母表示该元素的元素符号,元素符号为Mc,故选项说法错误。
B、根据元素周期表中的一格可知,左上角的数字为115,表示原子序数为115;根据原子中原子序数=核电荷数=质子数=核外电子数,则核内有115个质子,故选项说法正确。
C、根据元素周期表中的一格可知,中间的汉字表示元素名称,该元素的名称带“钅”字旁,属于金属元素,故选项说法错误。
D、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质量为288,故选项说法错误。
3.下列各图中“○”和“●”分别表示两种质子数不同的原子,其中能表示由一种单质和一种化合物组成的混合物是A.B.C.D.【答案】D【解析】A、图中表示一种化合物,属于纯净物,错误;B、图中表示几种单质组成的混合物,错误;C、图中表示的是一种单质,属于纯净物,错误;D、图中表示的是一种单质和一种化合物组成的混合物,正确。
故选D。
